Method Article
Réactions catalytiques sur des nanoparticules de platine stabilisées aux amines et sans ligands soutenues sur Titania pendant l’hydrogénation d’alcènes et d’aldéhydes
Dans cet article
Résumé
Ce protocole montre une méthode pratique pour comparer les propriétés catalytiques des catalyseurs de platine supportés, synthétisés par dépôt de colloïdes de taille nanométrique ou par imprégnation. L’hydrogénation du cyclohexène sert de réaction modèle pour déterminer l’activité catalytique des catalyseurs.
Résumé
Les ligands comme les amines sont utilisés dans l’approche de synthèse colloïdale pour protéger les nanoparticules de platine (Pt NP) de l’agglomération. Normalement, les ligands comme les amines sont éliminés par diverses procédures de prétraitement avant d’être utilisés en catalyse hétérogène, car les amines sont considérées comme un poison catalyseur. Cependant, une influence bénéfique possible de ces modificateurs de surface sur les réactions d’hydrogénation, qui est connue des espèces spectatrices sur les surfaces métalliques, est souvent négligée.
Par conséquent, des nanoparticules de Pt stabilisées aux amines soutenues par le titane (P25) ont été utilisées sans aucun prétraitement afin d’élucider une influence possible du ligand dans les réactions d’hydrogénation en phase liquide. L’activité catalytique de nanoparticules de Pt stabilisées aux amines de deux tailles différentes a été étudiée dans un réacteur à double paroi à cuve d’agitation à 69 °C à 130 °C et à une pression d’hydrogène de 1 atm. La conversion du cyclohexène en cyclohexane a été déterminée par chromatographie en phase gazeuse (CG) et a été comparée à des particules de Pt sans ligand. Tous les catalyseurs ont été vérifiés avant et après la réaction par spectroscopie électronique à transmission (MET) et spectroscopie photoélectronique à rayons X (XPS) pour détecter d’éventuels changements de taille, de forme et de couche de ligand. L’hydrogénation du cyclohexène en phase liquide a révélé une conversion plus élevée des nanoparticules de Pt stabilisées aux amines sur le titane que des particules sans ligand. L’hydrogénation du 5-méthylfurfural (5-MF) a été choisie pour une réaction d’essai supplémentaire, car l’hydrogénation des aldéhydes α β-insaturés est plus complexe et présente diverses voies de réaction. Cependant, le XPS et la spectroscopie infrarouge (IR) ont prouvé que le 5-MF agit comme poison catalyseur dans les conditions de réaction données.
Introduction
Des catalyseurs de la taille de quelques atomes simples jusqu’à des nanoparticules plus grosses avec des rapports surface/volume élevés et des tailles définies sont des matériaux prometteurs pour un large éventail de réactions catalysées hétérogènes, telles que l’hydrogénation, la déshydrogénation et les réactions photocatalytiques1. Les nanoparticules de platine sont largement utilisées dans les procédés industriels, en raison de leur forte activité d’hydrogénation des oléfines. En outre, les nanoparticules de platine sont des catalyseurs prometteurs pour l’hydrogénation sélective des α,β-cétones insaturées et des aldéhydes 1,2,3,4. Ici, plusieurs paramètres tels que la taille, la forme et le support sont capables d’affecter les propriétés catalytiques 1,5,6.
La taille influence la morphologie des nanoparticules, en particulier dans la gamme de 1 à 5 nm7. Plus précisément, la taille influence les sites d’adsorption disponibles (par exemple: bords, marches ou terrasses) et donc la surface catalytiquement active, ce qui influence davantage l’activité catalytique 7,8,9. De plus, le support est capable d’interagir avec le métal. Ces interactions varient et vont des processus de transfert de charge ou de débordement à une modification de la morphologie ou de l’encapsulation des nanoparticules 6,10. Alors que l’effet de la taille, de la forme et du support sur les propriétés catalytiques est bien connu, un effet possible des adsorbats non directement impliqués dans la réaction, appelés molécules spectatrices ou modificateurs de surface, est moins évolué 1,5,6,11. Dans le cas d’une approche colloïdale pour la préparation du catalyseur, en utilisant des nanoparticules métalliques colloïdales qui sont ensuite déposées sur le support, les ligands stabilisent les nanoparticules et peuvent donc potentiellement influencer la réaction.
Le grand avantage de la synthèse colloïdale est que des nanoparticules d’une certaine taille et forme peuvent être produites de manière ciblée en aidant à contrôler les performances catalytiques via la voie de synthèse12,13,14. La fonction du ligand est de contrôler la taille, la forme et la morphologie des nanoparticules. Cependant, les ligands similaires aux amines sont souvent considérés comme un poison catalyseur, car les ligands bloquent les sites d’adsorption disponibles15,16. Par conséquent, pour augmenter l’activité catalytique des catalyseurs, les ligands sont généralement éliminés par prétraitement, par exemple la calcination ou la décomposition induite par la lumière UV17,18.
Cela contraste avec la catalyse homogène, où les ligands sont essentiels pour stabiliser les complexes de métaux de transition et ajuster leur réactivité15,19. L’interaction entre le ligand et le réactif permet de contrôler la chimiosélectivité, la régiosélectivité et la stéréosélectivité de la réaction catalysée de manière homogène. Comme la séparation des catalyseurs homogènes des produits n’est pas triviale, les catalyseurs hétérogènes sont plus courants bien qu’ils soient moins sélectifs et la question se pose alors de savoir si les ligands ont également un effet positif sur la catalyse hétérogène.
Une approche prometteuse pour les ligands en catalyse hétérogène est l’utilisation de monocouches auto-assemblées contenant des thiols aromatiques et aliphatiques pour améliorer la sélectivité pour l’hydrogénation des aldéhydes α,β-insaturés et des acides gras polyinsaturés sur les nanoparticules Pt et. L’amélioration de la sélectivité repose sur plusieurs effets. Les interactions spécifiques entre le réactif et le modificateur, le blocage sélectif de certains sites actifs indésirables ainsi que les effets stériques et électroniques jouent un rôle dans l’amélioration de la sélectivité20,21,22,23. Une distinction est faite entre les ligands et les spectateurs. Les spectateurs ne participent pas, mais influencent la réaction par des effets stériques, tandis que les ligands sont impliqués dans les réactions24,25. Un spectateur peut se former lors d’une réaction catalytique ou par des procédés chimiques préalables11,26.
Le choix d’un ligand et d’un solvant appropriés pour une hydrogénation en phase liquide réussie est une tâche difficile. Le solvant doit avoir une solubilité élevée pour l’hydrogène ainsi que pour le réactif. En outre, il ne devrait pas y avoir de réactions suivantes ou secondaires avec le solvant, ce qui peut réduire la sélectivité de la réaction. Un ligand approprié doit avoir une forte adsorption sur des sites d’adsorption sélectionnés afin d’empêcher la désorption du ligand dans des conditions de réaction, mais une activité catalytique est toujours présente. Idéalement, le ligand bloque les sites d’adsorption, qui favorisent les réactions secondaires ou orientent la sélectivité de la réaction par les demandes stériques du ligand et par les interactions avec le réactif15,21.
Ce travail explique si les effets stériques et électroniques de la dodécylamine (DDA) influencent ou non l’hydrogénation du cyclohexène et du 5-méthylfurfural (5-MF). Le DDA n’interagit pas directement avec les réactifs, ce qui implique une hydrogénation dirigée par le spectateur. Le 5-MF, un dérivé non toxique du furfural, a été utilisé comme réactif plus complexe et commercialement intéressant, par rapport à l’hydrogénation du cyclohexène. L’hydrogénation sélective du furfural, un produit secondaire de la production de biopétrole, et des dérivés du furfural présentent un intérêt industriel car ces composés peuvent être obtenus à partir de la biomasse et représentent des composants de départ prometteurs pour la production de plusieurs produits chimiques fins27,28.
Cependant, l’hydrogénation sélective est difficile, car l’hydrogénation des doubles liaisons carbonées et du groupe carbonyle sont en concurrence. Thermodynamiquement, l’hydrogénation des doubles liaisons carbonées est favorisée par rapport à l’hydrogénation du groupe carbonyle29.
Protocole
1. Synthèse de nanoparticules Pt/DDA (1,6 nm)
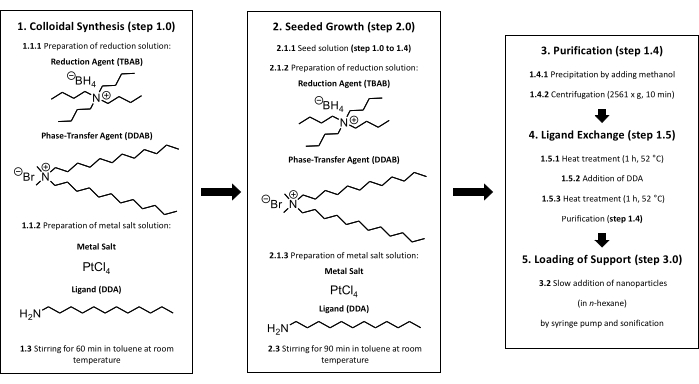
Figure 1 : Synthèse colloïdale de nanoparticules de Pt supportées. Au début, une synthèse colloïdale doit être effectuée (étape 1). Après addition de la solution de réduction à la solution de sel métallique, la solution est agitée à température ambiante pendant 60 min (étape 1.3). À partir de là, deux voies différentes sont possibles. Pour obtenir de plus grosses nanoparticules, une croissance ensemencée est nécessaire (étape 2). Après avoir ajouté le sel métallique et la solution de réduction à la solution de semences, la solution est agitée à température ambiante pendant 90 min (étape 2.3). Après avoir terminé la synthèse (étape 1 ou étape 2), une purification doit être effectuée (étape 1.4). Pour éviter les impuretés telles que les halogénures à la surface, un échange de ligand est nécessaire (étape 1.5). Les nanoparticules de Pt sont chauffées pendant 60 min à 52 °C dans du toluène, une quantité supplémentaire de DDA est ajoutée à la solution et la solution est chauffée pendant 60 minutes supplémentaires à 52 °C (étapes 1.5.1 à 1.5.3). Titania peut être chargé de nanoparticules en effectuant l’étape 3. La taille des particules est vérifiée par TEM après purification, échange de ligand et chargement du support. Veuillez cliquer ici pour voir une version agrandie de cette figure.
REMARQUE : L’approche de synthèse colloïdale est illustrée à la figure 1 et les étapes expérimentales sont décrites dans la section suivante.
- Préparer des solutions pour la synthèse de nanoparticules
- Pour la préparation de la solution de réduction, dissoudre 25,4 mg de l’agent de réduction tétrabutylammonium borohydrure (TBAB) et 46,3 mg du bromure de didodécyldiméthylammonium (DDAB) dans 1 mL de toluène à température ambiante dans un verre à jante laminé de 10 mL.
ATTENTION : Le TBAB peut entraîner une cautérisation au contact de la peau. DDAB conduit à la cautérisation au contact de la peau et est nocif pour l’inhalation. Le toluène est légèrement inflammable et peut nuire au système nerveux central et aux organes. Le DDA peut entraîner une cautérisation au contact de la peau et peut causer des dommages aux organes s’il est avalé ou s’il pénètre dans les voies respiratoires. Par conséquent, effectuez la synthèse sous la hotte et portez des gants et des lunettes de protection. - Pour la préparation de la solution de sel métallique, dissoudre 8,5 mg du chlorure de platine (IV) précurseur (PtCl 4) dans 2,5 mL de toluène à température ambiante dans un verre à bord laminé de 10 ml dans un premier temps et ajouter 185,4 mg du ligand dodécylamine (DDA) après dissolution de PtCl4. Éviter la décomposition des produits chimiques hygroscopiques par le stockage à l’extérieur du récipient de stockage et dissoudre directement les produits chimiques dans un solvant. N’utilisez que des produits chimiques frais.
MISE EN GARDE : Le DDA est très toxique pour la vie aquatique. PtCl4 peut entraîner une cautérisation au contact de la peau et est toxique en cas d’ingestion. Par conséquent, effectuez la synthèse sous la hotte et portez des gants et des lunettes de protection. Tenir à l’écart des sources d’inflammation possibles. Éviter les rejets dans l’environnement. Le TBAB peut entraîner une cautérisation au contact de la peau. DDAB conduit à la cautérisation au contact de la peau et est nocif pour l’inhalation. - Soniquer les deux solutions à température ambiante pendant 1-2 min dans un bain à ultrasons à une fréquence de 35 kHz. PtCl4 est peu soluble dans le toluène. La solution de sel métallique apparaît légèrement jaune après sonification, tandis que la solution de réduction est encore incolore.
- Pour la préparation de la solution de réduction, dissoudre 25,4 mg de l’agent de réduction tétrabutylammonium borohydrure (TBAB) et 46,3 mg du bromure de didodécyldiméthylammonium (DDAB) dans 1 mL de toluène à température ambiante dans un verre à jante laminé de 10 mL.
- Début de la réaction
- Ajouter la solution complète de sel métallique (1 mL) à l’aide d’une pipette à commande plongeante (1 000 μL) munie d’un embout jetable dans une fiole à col rond de 10 mL.
NOTE: Les phénomènes de mélange peuvent influencer la croissance des particules. - Ajouter le volume complet (1 mL) de la solution de réduction à la solution de sel métallique par injection de choc pour obtenir une distribution granulométrique étroite. Utilisez une pipette à commande plongeante (1 000 μL) munie d’un embout jetable tout en remuant la solution pendant l’addition à l’aide d’une barre d’agitation magnétique.
- Ajouter la solution complète de sel métallique (1 mL) à l’aide d’une pipette à commande plongeante (1 000 μL) munie d’un embout jetable dans une fiole à col rond de 10 mL.
- Laisser la solution réactionnelle agiter pendant 60 min dans des conditions ambiantes.
REMARQUE: Le début de la réaction peut être reconnu par des bulles de gaz et un changement de couleur du mélange réactionnel du jaune au gris foncé. La réduction du précurseur Pt et la croissance des nanoparticules Pt sont des processus rapides14. La solution est agitée pendant 60 minutes pour s’assurer que le processus de croissance des nanoparticules Pt est terminé. - Purification de la solution de nanoparticules
- Purifier les nanoparticules de Pt par précipitation et centrifugation à température ambiante. Pour cela, transférer la solution réactionnelle complète avec une pipette à commande plongeante (1 000 μL) avec un embout jetable, dans un tube à centrifuger de 80 ml et ajouter 14 ml de méthanol.
ATTENTION : Le méthanol est hautement inflammable et toxique s’il est avalé ou inhalé et en contact avec la peau. Tenir à l’écart des sources d’inflammation possibles. Ajouter le méthanol à la solution de réaction sous une hotte tout en portant des gants et des lunettes de protection. - Centrifuger à 2 561 x g pendant 10 min à température ambiante. Éliminer la solution après centrifugation.
- Résoudre le résidu de nanoparticules en ajoutant 3 mL de toluène à l’aide d’une pipette à piston plongeant munie d’une pointe jetable (1 000 μL). Les nanoparticules devraient être dans la gamme de taille de 1,3 nm à 2 nm après cette routine de synthèse14.
- Transférer la solution de nanoparticules de l’étape 1.4.3 dans un verre à jante laminé (10 mL) pour une utilisation ultérieure.
- Purifier les nanoparticules de Pt par précipitation et centrifugation à température ambiante. Pour cela, transférer la solution réactionnelle complète avec une pipette à commande plongeante (1 000 μL) avec un embout jetable, dans un tube à centrifuger de 80 ml et ajouter 14 ml de méthanol.
- Effectuer un échange de ligands pour éliminer les résidus de synthèse tels que le chlorure ou le bromure comme décrit ci-dessous.
- Transvaser 3 mL des nanoparticules de Pt purifiées dans le toluène dans une fiole à col rond de 100 mL et remplir de toluène jusqu’à obtenir un volume final de 50 mL. Chauffer la solution à 52 °C et maintenir la température pendant 60 minutes tout en agitant la solution à l’aide d’une barre d’agitation magnétique.
- Résoudre 185,4 mg de DDA dans 2,5 mL de toluène dans un verre à jante laminé de 10 mL à température ambiante et ajouter cette solution à l’aide d’une pipette à moteur plongeant (1 000 μL) avec une pointe jetable à la solution de Pt/DDA (1,5 nm) traitée thermiquement à 52 °C.
- Chauffer et agiter la solution pendant encore 60 minutes à 52 °C. Effectuer une purification comme décrit précédemment à l’étape 1.4, mais dissoudre les nanoparticules de Pt dans 3 mL de n-hexane au lieu de 3 mL de toluène.
ATTENTION : le n-hexane est un liquide et une vapeur hautement inflammables. Le n-hexane provoque une irritation de la peau et peut endommager les organes s’il est inhalé. Le n-hexane est toxique pour la vie aquatique et soupçonné de nuire à la fertilité. Par conséquent, effectuez la synthèse sous la hotte et portez des gants et des lunettes de protection. Tenir à l’écart des sources d’inflammation possibles. Éviter les rejets dans l’environnement.
REMARQUE : Utilisez du n-hexane pour faciliter l’évaporation du solvant (voir l’étape suivante). - Évaporer le solvant dans l’armoire à fumée pendant la nuit à température ambiante et à pression ambiante et peser les nanoparticules de Pt le lendemain.
REMARQUE: Le pesage des nanoparticules Pt est crucial pour déterminer la quantité de titane, qui est nécessaire pour une charge de support définie (voir étape 3).
2. Synthèse de nanoparticules de Pt plus grandes (Pt/DDA (2,4 nm)) par un processus de croissance médié par les graines
- Préparer les solutions pour la synthèse des nanoparticules.
- Dissoudre les nanoparticules de Pt/DDA (1,6 nm) précédemment fabriquées dans 50 mL de toluène dans une fiole à col rond de 100 mL à température ambiante.
- Préparer la solution de réduction en dissolvant séparément 370,5 mg de DDAB et 200,5 mg de TBAB dans 10 mL de toluène à température ambiante dans un verre à jante laminé de 20 mL.
- Dissoudre 68,0 mg de PtCl4 dans 10 mL de toluène dans un verre à jante roulé de 20 mL et ajouter 1438,1 mg de DDA par la suite. Utilisez-le comme solution de sel métallique. Éviter la décomposition des produits chimiques hygroscopiques par le stockage à l’extérieur du récipient de stockage et dissoudre directement les produits chimiques dans un solvant.
- Soniquer les deux solutions réalisées aux étapes 2.1.2 et 2.1.3 à température ambiante pendant 1-2 min dans le bain ultrasonique à une fréquence ultrasonore de 35 kHz.
- Prélever les deux solutions chacune dans une seringue jetable de 20 ml à l’aide d’une aiguille et, si nécessaire, retirer l’air dans la seringue.
- Pour démarrer la réaction, ajouter les solutions supplémentaires de précurseur et de réduction des étapes 2.1.2 et 2.1.3 très lentement et continuellement à l’aide d’une pompe à seringue (0,1 mL/min) à la solution de semence de l’étape 2.1.1 pour éviter la formation de nanofils ou d’une seconde nucléation14. Remuer la solution de semence à température ambiante à l’aide d’une barre d’agitation magnétique tout en ajoutant le précurseur et la solution de réduction.
- Remuer la solution de nanoparticules pendant encore 90 minutes à température ambiante après l’ajout des réactifs. Effectuer une purification comme décrit à l’étape 1.4, mais dissoudre les nanoparticules de Pt dans 3 mL de n-hexane au lieu de 3 mL de toluène. Évaporer le solvant pendant la nuit à température ambiante et à pression ambiante et peser les nanoparticules de Pt le lendemain.
3. Dépôt de nanoparticules de Pt sur le titane (Pt/DDA/P25)
- Disperser P25 dans du n-hexane (2 mg/mL) à température ambiante dans un bécher de taille appropriée en utilisant un bain à ultrasons à une fréquence ultrasonore de 35 kHz.
REMARQUE: La quantité d’oxyde dépend du poids des nanoparticules fabriquées séchées. - Préparer une solution de nanoparticules des particules précédemment fabriquées (1 mg/mL dans le n-hexane) et ajouter cette solution au P25 dispersé à température ambiante à l’aide d’une seringue jetable (20 mL) avec aiguille à un débit de 0,016 mL/min à l’aide d’une pompe à seringue.
REMARQUE: L’adsorption de nanoparticules sur l’oxyde devient visible par un changement de couleur de la solution de gris à incolore. - Sécher la poudre chargée dans des conditions ambiantes pendant une nuit dans l’armoire à fumée, puis pendant 10 min sous vide (0,01 mbar).
4. Synthèse de nanoparticules de Pt supportées par titane sans amine par imprégnation
- Remplir 1 000 mg de titane (P25) dans une boîte de cristallisation (50 mL) et ajouter de l’eau jusqu’à ce que P25 soit recouvert.
- Dissoudre 3 g d’acide chloroplatinique hexahydraté (H2PtCl6 ·6 H2O) dans 20 mL d’eau distillée et ajouter la solution aqueuse au P25 soumis à l’aide d’une pipette jaugée de 20 mL.
ATTENTION : L’hexahydrate d’acide chloroplatinique peut entraîner une cautérisation au contact de la peau et est toxique en cas d’ingestion. Par conséquent, effectuez la synthèse sous la hotte et portez des gants et des lunettes de protection.
REMARQUE: La quantité d’acide chloroplatinique varie en fonction des charges de nanoparticules souhaitées du support oxydique. - Chauffer et maintenir la solution à 75 °C tout en agitant à l’aide d’une barre magnétique pendant 4 h jusqu’à ce que la solution soit visqueuse. Sécher la solution dans la capsule de cristallisation pendant 1 j à 130 °C dans une étuve dans des conditions atmosphériques.
- Effectuer une calcination dans un four à température programmée dans des conditions atmosphériques. Remplissez la poudre de l’étape 4.3 dans un creuset en porcelaine. Chauffer jusqu’à 400 °C en 30 minutes et maintenir la température pendant 4 h. Refroidir l’échantillon à température ambiante sans utiliser de rampe de température.
- Effectuer une réduction du catalyseur dans un four tubulaire. Chauffer à 180 °C avec une rampe de température de 4 °C/min et maintenir la température pendant 1,5 h sous un flux continu d’hydrogène. Vérifiez un flux continu d’hydrogène avec un compteur à bulles.
5. Hydrogénations en phase liquide
- Préparer le réacteur à double paroi pour les mesures catalytiques.
- Remplissez la chemise chauffante avec le moyen chauffant souhaité. Utiliser de l’éther diisopropylique pour une température de fonctionnement de 69 °C dans le réacteur.
REMARQUE : Une liste des autres fluides chauffants usagés se trouve dans les fichiers supplémentaires (voir le tableau supplémentaire S1). - Remplir le réacteur à cuve agitée avec 120 mL de toluène et le catalyseur synthétisé (1 mg/mL). Dégazer le réacteur à cuve d’agitation en appliquant un vide d’environ 360 mbar.
- Éliminer l’oxygène en purgeant. Placez un ballon en caoutchouc, rempli d’hydrogène de 1 atm, sur le condenseur à reflux et rincez le réacteur à cuve agitée avec de l’hydrogène. Répétez le processus de purge cinq fois.
- Commencez à chauffer et à agiter le réservoir du réacteur avec une barre d’agitation magnétique sous atmosphère d’hydrogène.
- Remplissez la chemise chauffante avec le moyen chauffant souhaité. Utiliser de l’éther diisopropylique pour une température de fonctionnement de 69 °C dans le réacteur.
- Démarrer la réaction catalytique
NOTA: Avant qu’un essai catalytique ne soit effectué, l’hydrogénation possible du solvant dans les conditions de réaction a été vérifiée, mais cela n’a pas été le cas (voir figure supplémentaire S1 et tableau supplémentaire S2). Le chromatogramme en phase gazeuse de la figure supplémentaire S1 montre des pics supplémentaires, qui peuvent être attribués aux contaminations dans le toluène, car ils sont également présents dans un échantillon de toluène prélevé dans le récipient de stockage (voir la figure supplémentaire S2 et le tableau supplémentaire S3).- Injecter le réactif, dans ce cas, 1 mL de cyclohexène, avec une seringue jetable avec une aiguille via le septum en caoutchouc avec une stabilité thermique et solvant spécifique après avoir atteint une température constante. Prélever 1 mL d’échantillons à l’aide d’une seringue jetable toutes les 10 minutes.
- Utilisez un filtre à seringue (taille des pores : 0,2 μm) pour séparer le catalyseur de la solution réactionnelle et remplissez le liquide dans un flacon d’échantillonneur automatique qui est scellé correctement par la suite.
REMARQUE: Au lieu d’un filtre à seringue, la centrifugation est également possible pour éliminer le catalyseur.
ATTENTION : Le cyclohexène est un liquide et une vapeur hautement inflammables. Le cyclohexène est nocif s’il est avalé et toxique lorsqu’il entre en contact avec la peau. Par conséquent, effectuez la synthèse sous la hotte et portez des gants et des lunettes de protection. - Testez l’effet d’empoisonnement du 5-méthylfurfural. Préparer le réacteur en cuve d’agitation comme décrit à l’étape 5.1.
REMARQUE : Le 5-MF ne présente aucune conversion sur les catalyseurs Pt pris en charge (voir le tableau supplémentaire S4 et la figure supplémentaire S3). Si un effet d’empoisonnement se produit, peut être vérifié en ajoutant 5-MF à la réaction d’hydrogénation du cyclohexène. - Pour tester l’effet d’empoisonnement du 5-MF sur les nanoparticules de Pt, procédez comme suit: d’abord, injecter 5-MF (5 mmoles) au catalyseur soumis dans le toluène et laisser le mélange agiter pendant 120 min.
- Ajouter le cyclohexène avec une seringue jetable dans un rapport molaire de 1:1 et 1:10 à 5-MF. Pour déterminer le processus de réaction, prélever des échantillons de 1 mL à l’aide d’une seringue jetable munie d’une aiguille toutes les 10 minutes.
- Utilisez un filtre à seringue (taille des pores : 0,2 μm) pour séparer le catalyseur de la solution réactionnelle et remplissez le liquide dans un flacon d’échantillonneur automatique qui est scellé correctement par la suite.
REMARQUE: Au lieu d’un filtre à seringue, une centrifugation pourrait également être effectuée pour éliminer le catalyseur.
- Analyser les produits par GC. Utilisez une colonne avec les spécifications suivantes: longueur = 50 m, film = diméthylpolysiloxane, épaisseur du film = 0,5 μm, diamètre intérieur = 0,2 mm. Appliquer une température d’injecteur de 200 °C avec un rapport de partage de 40:1.
- Commencez avec une température de colonne de 40 °C et maintenez la température pendant 6 min. Chauffer de 40 °C à 180 °C avec une rampe de température de 15 °C/min. Mesure avec un débit d’hydrogène de 0,6 mL/min et une température de 300 °C pour le détecteur FID.
- Injectez les échantillons dans le GC. Attribuer les pics aux différentes substances par comparaison avec les étalons de référence (voir tableau supplémentaire S5 et figure supplémentaire S4).
- Évaluer les chromatogrammes en phase gazeuse en utilisant la méthode à 100%. Calculez le pourcentage de chaque composé en divisant la surface de pic mesurée pour ce composé par la somme de toutes les aires de pic.
6. Préparation aux mesures TEM
- Chargez les échantillons sur une grille de cuivre de 300 mailles recouverte de formvar et de charbon.
- Pour charger la grille avec des nanoparticules de Pt nues, extraire 0,1 mL de la solution purifiée de nanoparticules de Pt dans du n-hexane et diluer la solution extraite en ajoutant 2 mL de n-hexane dans un verre à jante laminé (10 mL). Transfère 8,5 μL de la solution diluée sur la grille à l’aide d’une pipette à commande plongeante (10 μL) munie d’une embout jetable et laissez sécher la grille pendant la nuit à température ambiante à pression ambiante.
- Pour charger la grille avec des poudres, trempez la grille très soigneusement dans la poudre pour éviter tout dommage à la grille et éliminez l’excès de poudre par un flux d’air créé par une pipette Pasteur (longueur: 145 mm, diamètre intérieur: 1,5 mm) avec une bille de pipette (diamètre: 94 mm).
- Placez la grille dans un porte-échantillon de cartouche TEM. Introduisez le porte-échantillon dans la colonne TEM. Suivez la procédure opératoire standard pour manipuler le microscope électronique à transmission.
- Prenez des photos à une tension d’accélération de 80 keV avec un grossissement de 250 000 et importez les images dans un logiciel de retouche d’image.
- Déterminez la silhouette des nanoparticules par le seuil de contraste des images, pour l’analyse des images avec le logiciel de retouche d’image. Le logiciel d’analyse d’images suppose un contour sphérique des particules.
- Éliminez les particules superposées et les particules situées sur les bords de l’image, qui peuvent falsifier la distribution granulométrique, en effaçant ces particules avec les outils de dessin intégrés du logiciel. Pour identifier les particules superposées, comparez l’image traitée (étape 6.4) avec l’image originale.
- Utilisez les outils logiciels intégrés pour l’analyse de la taille des particules. Mesurez manuellement la taille des nanoparticules Pt prises en charge avec les outils logiciels intégrés. Analysez manuellement les nanoparticules Pt prises en charge car la faible différence de contraste entre les nanoparticules et le support ne permet aucune analyse automatique par le logiciel.
7. Mesures XPS d’échantillons synthétisés
- Préparez une plaquette de silicium pour les mesures XPS de nanoparticules nues en immergeant la plaquette dans un verre à jante laminé (10 ml) rempli d’acétone et sonicez la plaquette pendant 1 min à une fréquence de 35 kHz. Répétez la procédure avec le 2-propanol.
- Enduire le fragment de plaquette de silicium nettoyé et séché d’une solution concentrée de nanoparticules de Pt purifiées dans du n-hexane par coulée à goutte avec une micropipette. Sécher la plaquette pendant la nuit à température ambiante et à pression ambiante sous une hotte. Fixez l’échantillon au porte-échantillon à l’aide de ruban de carbone.
REMARQUE : La taille des gouttelettes n’a pas été déterminée et aucune taille de gouttelette spécifique n’a été placée sur les plaquettes. Le volume de la solution aspirée dans la micropipette a été choisi de manière à ce que la goutte ne puisse pas déborder. Le mouillage uniforme des plaquettes ou des pastilles de KBr (voir étape 8.3) est difficile en raison des effets desséchants du solvant. - Préparer un porte-échantillon de fosse pour poudres en immergeant le porte-échantillon dans un verre à jante laminé (10 mL) avec de l’acétone et sonifier le porte-échantillon pendant 1 min à une fréquence ultrasonore de 35 kHz. Répétez la procédure avec le 2-propanol.
- Remplissez l’échantillon dans la fosse du porte-échantillon nettoyé et séché. Placez un film alimentaire propre entre l’estampille et l’échantillon pour éviter les contaminations et appuyez sur l’échantillon à l’aide du tampon.
- Pour identifier un éventuel effet d’intoxication par le 5-MF après hydrogénation, préparer un film Pt recouvert de 5-MF comme échantillon de référence.
- Nettoyez une pièce de plaquette de silicium en immergeant la plaquette dans un verre à jante roulé (10 mL) avec de l’acétone et soniquez la plaquette pendant 1 min (fréquence ultrasonore : 35 kHz). Répétez la procédure avec le 2-propanol. Enduisez la plaquette de silicium nettoyée d’un film Pt de 10 nm à l’aide d’un système de pulvérisation de Pt assisté à l’argon. Pour le fonctionnement, le système de pulvérisation cathodique suit les procédures standard fournies dans le manuel de l’utilisateur.
- Dissoudre 1 mmol de 5-MF dans 2,5 mL de toluène dans un verre à jante laminé (10 mL). Mouiller le film Pt avec 5-MF par coulée goutte avec une micropipette et sécher l’échantillon pendant la nuit à température ambiante et à pression ambiante sous une hotte.
- Introduisez l’échantillon dans la chambre d’analyse XPS. Commencez la mesure en utilisant les paramètres suivants: source de rayonnement: Al E(Kα) = 1486,8 eV (monochromatique), taille du spot: 650 μm, énergie de passe: 40 eV, temps de séjour: 100 ms, taille du pas d’énergie: 0,05 eV, nombre de balayages: 10 pour les spectres détaillés Pt4f et N1s; 5 pour les spectres détaillés C1s et O1s, compensation de charge par canon d’inondation Ar.
- Après avoir terminé les mesures, chargez les spectres dans un logiciel avec des outils intégrés pour appliquer un arrière-plan et ajuster les différents signaux. Ajustez les signaux avec un arrière-plan de Shirley et des courbes gaussiennes-lorentziennes avec un rapport de Gauss Lorentz de 30. Ajouter une queue aux courbes gaussiennes-lorentziennes pour les signaux de platine métallique. Référencer tous les signaux mesurés au signal fortuit C1s mesuré à 284,8 eV pour compenser les effets de charge30.
8. Mesures FT-IR
- Préparer les nanoparticules Pt/DDA (1,6 nm) et Pt/5-MF pour les mesures FT-IR. Pour la synthèse de nanoparticules Pt/5-MF, effectuez une synthèse avec échange de ligand avec 5-MF au lieu de DDA (étapes 1.0 à 1.5.3). Pour la purification des nanoparticules Pt/5-MF après échange de ligands, utilisez du n-hexane au lieu du méthanol pour la précipitation des nanoparticules de Pt. Résoudre les nanoparticules de Pt purifiées dans 1 mL de méthanol.
- Préparer des pastilles de bromure de potassium (KBr) d’environ 1 mm d’épaisseur à l’aide d’une presse hydraulique. Pestle KBr, qui a été stocké dans des conditions sans eau, avant de remplir la presse. Presser les pastilles avec une pression de 10 bar pendant 15 min.
- Enduisez les pastilles de KBr par coulée goutte avec la solution des nanoparticules de Pt purifiées plusieurs fois à l’aide d’une micropipette. Laissez le granulé sécher entre chaque goutte pour éviter que le liquide ne coule sur les bords du granulé. Sécher la pastille KBr à température ambiante et à pression ambiante pendant 2 h sous une hotte.
- Effectuez les mesures FT-IR.
- Pour mesurer un arrière-plan, placez une pastille KBr non couchée dans le porte-échantillon IR. Utilisez une résolution de 1 cm-1 et un temps de mesure de 60 min.
- Placez une pastille KBr chargée dans le porte-échantillon et utilisez les mêmes paramètres que ceux décrits à l’étape 8.4.1.
- Utilisez les outils logiciels intégrés pour soustraire les spectres de fond des spectres d’échantillon et effectuer une correction manuelle de la ligne de base.
- Utiliser un programme ab initio de chimie quantique pour les calculs de fréquence des modes vibratoires. Effectuez les calculs à l’aide de la densité fonctionnelle PBE0 et de l’ensemble de base 6-311G*. Utiliser les calculs théoriques comme guide approximatif pour l’attribution des bandes d’absorption.
Résultats
Les résultats de la synthèse et des tests catalytiques de différentes nanoparticules de Pt sont présentés ici. Tout d’abord, les nanoparticules de Pt synthétisées ainsi que les particules supportées sur P25 ont été caractérisées par TEM pour leur forme et leur taille. En outre, leur composition chimique, par exemple les états d’oxydation des différents éléments et leur environnement chimique, a été étudiée par XPS. Ensuite, les nanoparticules de Pt supportées ont été vérifiées pour leur performance catalytique pour l’hydrogénation des alcènes, le cyclohexène a été utilisé ici et des aldéhydes tels que le 5-MF. Comme l’hydrogénation des aldéhydes ne montre aucune conversion dans les conditions de réaction utilisées, d’autres études systématiques ont été effectuées pour élucider un éventuel empoisonnement de surface des nanoparticules de Pt.
Caractérisation des catalyseurs
La taille et la forme des particules Pt ainsi que les particules supportées sur P25 ont été vérifiées par TEM, car la taille et la forme des particules peuvent influencer l’activité catalytique31. Les images TEM de la figure 2 révèlent que les nanoparticules de Pt présentent une forme quasi sphérique directement après la synthèse colloïdale (figure 2A). La taille et la forme restent les mêmes après échange de ligand avec DDA (Figure 2B). Cependant, les particules plus grosses (Figure 2C), synthétisées par croissance cristalline, sont de forme plus asymétrique et présentent des formes partiellement tripodales et ellipsoïdales. Après dépôt de Pt/DDA (1,6 nm) sur titane (figure 2B), aucun changement de taille et de forme ne s’est produit (figure 2D). La taille et la forme du catalyseur de platine sans amine Pt/P25 (2,1 nm), synthétisé par imprégnation (Figure 2E) sont dans la même gamme par rapport aux nanoparticules de platine, synthétisées par synthèse colloïdale.
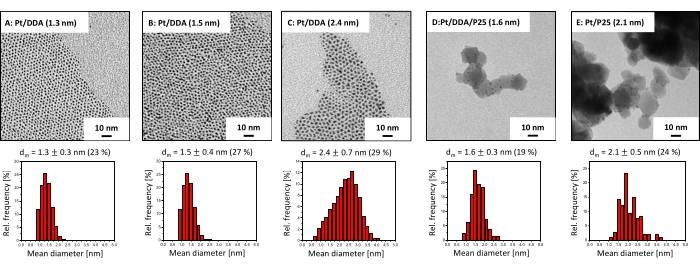
Figure 2 : Images TEM et histogrammes de taille de nanoparticules de platine stabilisées aux amines et de catalyseurs de platine supportés par du titane. Les images TEM (en haut) et les histogrammes de taille (en bas) de (A) tels que synthétisés (Pt/DDA (1,3 nm)), (B) après échange de ligands avec DDA (Pt/DDA (1,5 nm)), (C) après croissance ensemencée (Pt/DDA (2,4 nm)), (D) après dépôt sur titane (Pt/DDA/P25 (1,6 nm)), et (E) nanoparticules de platine sans amine supportées sur titane (Pt/P25 (2,1 nm)). Les images TEM ont été enregistrées en utilisant une tension d’accélération de 80 eV. Veuillez cliquer ici pour voir une version agrandie de cette figure.
XPS a été utilisé pour obtenir des informations chimiques sur les espèces adsorbées de surface. Les nanoparticules de Pt avant et après échange de ligands ont été caractérisées ainsi que les nanoparticules de Pt après dépôt sur titane et les nanoparticules de Pt sans amine. Les spectres XP sont illustrés à la figure 3. Le spectre Pt4f des nanoparticules Pt/DDA (1,3 nm) doit être examiné en premier (figure 3, spectre supérieur). Le spectre Pt4f montre deux signaux à 71,5 eV et 74,8 eV en raison de la division spin-orbite, qui ont un rapport de surface spécifique de 4: 3. Le signal Pt4f7/2 à 71,5 eV peut être attribué aux nanoparticules Pt (1,3 nm) et est décalé vers le haut de 0,4 eV contre 71,1 eV pour le Pt32 en vrac. Cependant, l’énergie de liaison mesurée s’accorde bien avec les nanoparticules Pt/DDA (1,3 nm) sur un film d’or33. La différence d’énergie de liaison entre le Pt en vrac et les petites nanoparticules Pt/DDA peut s’expliquer par un effet de taille.
De légers décalages du signal Pt de 0,2 eV après échange de ligand sans modification de la taille des particules de platine se situent dans la précision de mesure de l’énergie de liaison. Bien qu’aucune différence ne puisse être observée après dépôt sur titane, les spectres XP de Pt/P25 (2,1 nm) synthétisés par la méthode d’imprégnation montrent un décalage vers le bas du pic Pt4f 7/2 de 0,6 eV par rapport à Pt/DDA/P25 (1,6 nm) et un rétrogradage de0,2 eV par rapport au Pt32 en vrac. D’autres espèces sont observées à des énergies de liaison plus élevées, ce qui peut être attribué aux espèces oxydées Pt2+ et Pt4+ 34. Le pic Pt4f 5/2 de Pt 0 et le pic Pt4f7/2 de Pt4+ ont une énergie de liaison similaire avec74,2 eV et 75,0 eV et se chevauchent donc.
Dans la région C1s, trois signaux apparaissent entre 289,0 eV et 284,0 eV dans tous les spectres représentés. Tous les spectres XP sont référencés au carbone adventice à 284,8 eV30. L’attribution des signaux à différentes espèces de carbone est difficile. Le carbone alpha de l’amine devrait apparaître à 285,4 eV et 285,6 eV35,36. Cependant, le signal peut se déplacer en raison des effets de charge, de sorte que le signal peut être superposé avec des atomes de carbone à proximité de l’oxygène. Les signaux compris entre 286,3 eV et 289,0 eV peuvent être attribués au carbone lié à l’oxygène37. Il est possible qu’une contamination par le dioxyde de carbone ou une réaction de surface subissante des ligands conduise à la formation des deux espèces de carbone38.
Le spectre détaillé N1s des petites nanoparticules de Pt telles que préparées (Figure 3, spectre supérieur) présente trois espèces d’azote différentes à 402,6 eV, 399,9 eV et 398,2 eV. Le signal à 402,6 eV peut être attribué à un composé d’ammonium 39, tandis que le signal à399,9 eV correspond au ligand amineadsorbé 33. La présence de bromure (Br3d5/2 à 68,2 eV) dans les spectres Pt4f et les espèces d’ammonium dans les spectres détaillés N1s sont dues à l’utilisation de DDAB comme agent de transfert de phase. Cependant, une formation par humidité ou auto-oxydation de l’amine ne peut être exclue ici35. L’espèce supplémentaire à 398,2 eV est décalée vers des énergies de liaison plus faibles par rapport au signal amine et apparaît éventuellement selon une interaction amine-surface. Plusieurs espèces, par exemple des oligomères et des amides ont été assignées à ce signal35,40. De plus, les amines peuvent subir des réactions de déprotonation sur les surfaces Pt(111), ce qui peut être la raison de l’espèce supplémentaire41,42. En effectuant un échange de ligand, le composé d’ammonium peut être éliminé, tandis que l’espèce de surface amine supplémentaire est toujours présente sur la surface du platine. Fait intéressant, le signal amine montre presque la même énergie de liaison que celle observée pour les nanoparticules Pt avant échange de ligands, tandis que l’espèce supplémentaire est décalée de 0,3 eV vers des énergies de liaison plus faibles après dépôt sur titane. La position des espèces de surface d’amine supplémentaires peut s’expliquer par une interaction plus forte avec la surface qui peut se produire dans deux scénarios. D’une part, l’amine pourrait être encore présente après dépôt sur P25, mais pas en contact direct avec la surface du Pt. D’autre part, le support a déjà révélé un signal à cette position dans le spectre de détail N1s, qui peut être mis en relation avec des impuretés (voir figure supplémentaire S5). Ceux-ci résultent très probablement de la production de P25 ou de la procédure de nettoyage utilisée dans l’industrie43, bien qu’une contamination par des résidus dans la chambre d’analyse du spectromètre ou de l’atmosphère ne puisse pas être totalement exclue ici. Ceci explique également la présence d’amine pour le Pt/P25 sans ligand (2,1 nm).
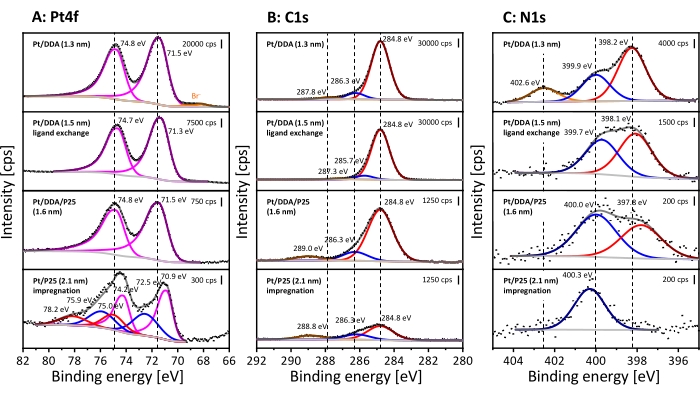
Figure 3 : Analyse XPS de nanoparticules colloïdales Pt/DDA et de catalyseurs supportés par titane. Les spectres détaillés Pt4f (A), les spectres détaillés C1s (B) et les spectres détaillés N1s (C). Les spectres XP empilés représentent Pt/DDA (1,3 nm) avant échange de ligand (en haut), Pt/DDA (1,5 nm) après échange de ligand (ci-dessous), Pt/DDA/P25 (1,6 nm) après dépôt sur titane et Pt/P25 (2,1 nm) synthétisé par imprégnation (en bas). Les lignes pointillées montrent l’intensité mesurée, les lignes gris clair montrent l’arrière-plan soustrait et les lignes gris foncé montrent la somme de toutes les espèces ajustées. Les lignes colorées montrent les espèces ajustées uniques. Les spectres détaillés de Pt4f révèlent des espèces métalliques Pt4f7/2 et Pt4f5/2 (magenta) et Pt2+ oxydées (bleu) et Pt4+ (rouge). Les lignes orange montrent la présence de bromure (Br-3d 5/2 et Br-3d 3/2). Trois espèces de carbone différentes sont présentes dans les spectres détaillés C1s, qui sont colorés en rouge, bleu et orange. Cependant, une affectation à une espèce individuelle est difficile. Les spectres détaillés N1s révèlent de l’ammonium (orange), de l’amine (bleu) et une espèce supplémentaire de surface d’amine (rouge). Les spectres ont été mesurés avec la source de rayonnement Al Kα (monochromatique) (énergie de passe: 40 eV, taille de pas d’énergie: 0,05 eV et nombre de balayages: 10) et ont été référencés sur le signal aliphatique C1s à 284,8 eV30. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Essais catalytiques
Après caractérisation avec TEM et XPS, la performance d’hydrogénation des nanoparticules de Pt supportées par le titane a été testée en considérant l’hydrogénation du cyclohexène comme réaction modèle. La comparaison avec les nanoparticules synthétisées par imprégnation devrait élucider une éventuelle influence des ligands sur l’hydrogénation. Pour cela, la réaction a été réalisée dans un réacteur à double paroi en cuve d’agitation sous atmosphère d’hydrogène. Le toluène, qui a été utilisé comme solvant, n’a pas été hydrogéné dans des conditions de réaction (voir figure supplémentaire S1). La figure 4 montre la conversion du cyclohexène en fonction du temps de réaction pour Pt/DDA/P25 avant (1,3 nm) et après échange de ligands (1,6 nm), pour les particules plus grosses Pt/DDA/P25 (2,4 nm) et Pt/P25 sans amine (2,1 nm).
Le catalyseur Pt/DDA/P25 tel que synthétisé (1,3 nm) sans procédure d’échange de ligand (étape 1.5) présente une conversion du cyclohexène jusqu’à 56% après un temps de réaction de 60 min, tandis que les particules Pt/DDA (1,6 nm) sur lesquelles un échange de ligand a été effectué, convertissent le cyclohexène jusqu’à 72% après le même temps de réaction. Les particules sans ligand présentent une conversion nettement inférieure de 35% par rapport aux particules stabilisées aux amines dans les mêmes conditions. Ce résultat est très prometteur puisque le catalyseur sans amine ne présente aucun ligand, ce qui pourrait bloquer partiellement la surface du platine à l’exception du solvant adsorbé. Les différentes activités des catalyseurs seront discutées ultérieurement. En outre, de plus grandes nanoparticules de Pt/DDA stabilisées aux amines (2,4 nm) sur la ttanie, synthétisées par croissancecristalline 14 , ont également été testées et comparées à des particules Pt/DDA plus petites sur titane (1,6 nm) avec une charge de poids identique (0,1 % en poids). La conversion du cyclohexène sur les plus petites particules Pt/DDA (1,6 nm) de 72 % est légèrement meilleure que la conversion de 67 % sur les plus grosses particules Pt/DDA (2,4 nm). Ici, aucun effet significatif de taille n’a pu être observé pour l’hydrogénation du cyclohexène sur les nanoparticules de Pt stabilisées aux amines (1,6 nm et 2,4 nm). Ce résultat est conforme aux résultats de la littérature pour l’hydrogénation du cyclohexène sur des nanoparticules de Pt sans ligand de différentes tailles, indiquant que l’hydrogénation du cyclohexène n’est pas dépendante de la taille44. Comme les petites particules de Pt sur titane (1,6 nm) ont montré les meilleurs résultats, ces particules ont été prises en compte pour d’autres expériences.
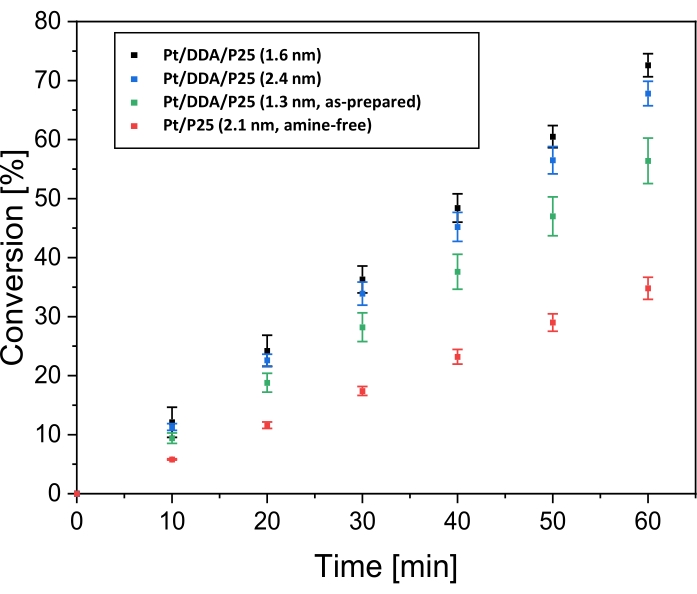
Figure 4 : Conversion dans le temps pour l’hydrogénation du cyclohexène sur des catalyseurs de platine supportés par le titane. Les diagrammes de conversion dans le temps pour l’hydrogénation du cyclohexène à 69 °C et à 1 bar de pression d’hydrogène dans le toluène sur Pt/DDA/P25 (1,6 nm; points noirs), sur Pt/DDA/P25 (2,4 nm; points bleus), sur Pt/DDA/P25 tel que synthétisé (1,3 nm; points verts) et Pt/P25 sans amine (2,1 nm; points rouges). L’hydrogénation a été réalisée dans un réacteur à double paroi à cuve d’agitation. Les barres d’erreur représentent l’erreur type calculée. Chaque série de mesures a été effectuée trois fois. Veuillez cliquer ici pour voir une version agrandie de cette figure.
L’hydrogénation réussie du cyclohexène montre que la solubilité de l’hydrogène dans le toluène est suffisante dans les conditions de réaction pour l’examen des hydrogénations en phase liquide.
Après avoir testé l’activité catalytique des catalyseurs Pt pour l’hydrogénation du cyclohexène, l’hydrogénation du 5-MF a également été étudiée, puisque le 5-MF est un dérivé du furfural, qui peut être obtenu à partir de la biomasse et constitue un matériau de départ prometteur pour la production de plusieurs produits chimiques fins27. Les nanoparticules de Pt stabilisées et sans amine ont été testées à une plage de température de réaction de 70 °C à 130 °C. Outre le toluène, le 2-propanol a également été utilisé comme solvant. De plus, l’hydrogénation a été réalisée dans des conditions sans solvant. Cependant, aucune conversion n’a été observée pour aucun des catalyseurs dans ces conditions.
Vérification de l’inhibition du substrat
Comme aucune conversion du 5-MF en phase liquide n’a pu être observée dans le chromatogramme en phase gazeuse (voir figure supplémentaire S3), d’autres études sur l’influence du 5-MF sur la conversion du cyclohexène ont été effectuées. Ces expériences ont été effectuées pour révéler si le 5-MF ou une espèce de surface de 5-MF ainsi que les produits de réaction possibles agissent comme poison catalyseur dans ces conditions. Auparavant, Pt/DDA/P25 (1,6 nm) présentait la conversion la plus élevée, c’est pourquoi ce catalyseur a été utilisé dans cette réaction. La conversion du cyclohexène avec une quantité croissante de 5-MF en fonction du temps de réaction est présentée à la figure 5.
Comme déjà montré dans le chapitre précédent, la conversion du cyclohexène était de 72% après 60 min de temps de réaction et en l’absence de 5-MF. Après avoir ajouté la même quantité de 5-MF, le taux de conversion du cyclohexène diminue à 30%. Une quantité plus élevée de 5-MF dans le rapport de 10: 1 par rapport au cyclohexène conduit à une nouvelle diminution de la conversion, jusqu’à 21%. En conclusion, un blocage des sites de surface actifs par 5-MF devient plus probable. Cela correspondrait à une inhibition des nanoparticules de Pt supportées par le réactif. Cependant, l’hydrogénation est toujours possible avec un excès de 5-MF.
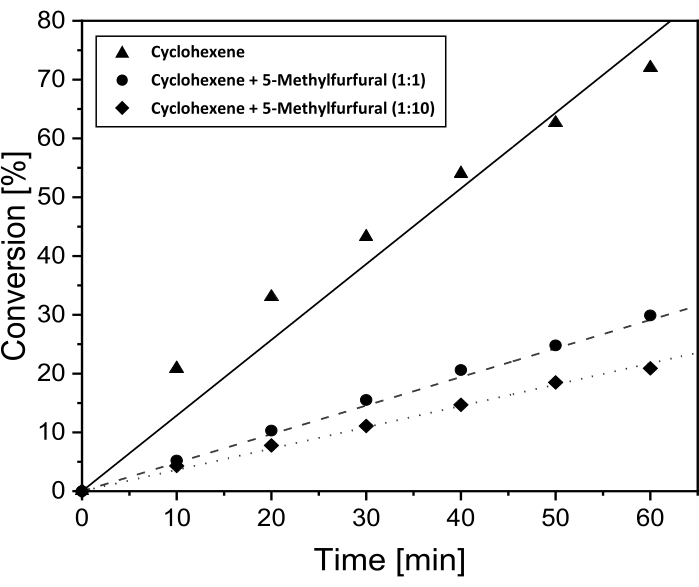
Figure 5 : Conversion dans le temps pour l’hydrogénation du cyclohexène avec ajout de 5-MF pour la preuve des effets d’empoisonnement. Tracés de conversion dans le temps pour l’hydrogénation du cyclohexène sur Pt/DDA/P25 (1,6 nm) sans addition de 5-MF (ligne continue) et avec addition de 5-MF dans le rapport volumique de 1:1 (ligne pointillée) et 1:10 (ligne pointillée) au cyclohexène. L’hydrogénation a été réalisée à 69 °C et à une pression d’hydrogène de 1 bar dans du toluène à l’aide d’un réacteur à double paroi à cuve d’agitation. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Pour le prouver, le catalyseur a été analysé par TEM et XPS avant et après la réaction, comme décrit précédemment. Étant donné que les images TEM ne révèlent aucun changement, seuls les spectres XP doivent être examinés ci-après (pour les images TEM, voir la figure supplémentaire S6). Les spectres XP mesurés sont illustrés à la figure 6. Les spectres seront comparés au 5-MF adsorbé sur un film Pt pour distinguer un empoisonnement par 5-MF ou une espèce réactionnelle.
Ici, seules les choses les plus importantes sont résumées, car les spectres XP du catalyseur avant l’utilisation ont été discutés ci-dessus. Le spectre détaillé Pt4f révèle deux signaux apparaissant à 74,8 eV (Pt4f 5/2) et à 71,5 eV (Pt4f7/2). Les deux peuvent être assignés aux nanoparticules de Pt. Comme mentionné précédemment, l’assignation des espèces dans le spectre C1s peut être difficile en raison des effets de charge, ce qui peut entraîner un chevauchement des signaux du carbone alpha et des atomes de carbone au voisinage de l’oxygène. Cependant, des changements structurels dans la coquille du ligand, par exemple, un remplacement de DDA, devraient entraîner des changements dans les intensités relatives entre les signaux. En outre, la région N1s montre également deux signaux correspondant à l’amine (400,0 eV) et à une autre espèce de surface (397,8 eV).
Après la réaction, de nombreux changements peuvent être observés dans XPS, bien que la TEM ne révèle aucun changement dans la forme et la taille des particules. Les signaux Pt sont décalés de 0,6 eV vers des énergies de liaison plus faibles après hydrogénation. Le spectre détaillé C1s révèle les trois mêmes signaux que ceux déjà discutés. Cependant, le signal à 289,0 eV se déplace de 0,7 eV pour abaisser les énergies de liaison, contrairement au catalyseur inutilisé. Tous les spectres sont référencés au signal à 284,8 eV. Il convient de noter que le rapport entre le carbone adventice et les espèces à énergie de liaison supérieure passe de 1:0,2:0,1 à 1:0,4:0,3 après hydrogénation. Ainsi, la quantité relative d’atomes de carbone à proximité de l’oxygène augmente, ce qui indique que le 5-méthylfurfural peut s’adsorber sur la surface du platine.
Bien qu’aucun décalage ne soit visible dans les spectres détaillés de N1, la quantité d’azote diminue après utilisation. Sur la base des signaux C1, N1 et Pt4f, le rapport azote/carbone et azote/platine a été déterminé. Le rapport carbone/azote augmente de 13:1 à 27:1 tandis que le rapport azote/platine montre une diminution d’un facteur similaire de 1,2:1 à 0,6:1 après hydrogénation. Cela peut être causé par un échange partiel du DDA avec 5-MF et indique en outre un blocage de la surface par 5-MF.
Le rétrogradage des signaux Pt après réaction peut s’expliquer par une densité de charge croissante au niveau des nanoparticules de Pt. Il est possible que des interactions métal-support puissent se produire dans des conditions de réaction, ce qui peut conduire à un décalage vers le bas par un transfert d’électrons du support vers le métal45,46,47. Une autre possibilité est que le 5-MF adsorbé pourrait provoquer un rétrogradage en raison d’un effet donneur. Cependant, le film Pt recouvert de 5-MF montre le comportement inverse dans le signal Pt 4f. Ici, les signaux sont décalés de 0,8 eV vers des énergies de liaison plus élevées par rapport au Pt/DDA/P25 synthétisé (1,6 nm). L’adsorption d’hydrogène sur le platine peut également entraîner des modifications de l’énergie de liaison du signal Pt4f, comme cela a déjà été démontré pour une surface Pt(111) par des mesures XPS à pression ambiante48. Le décalage pour le monocristal est de 0,4 eV. Ici, un rétrogradage de 0,7 eV est observé. Une explication possible est que les particules sont plus sensibles que le matériau en vrac aux changements électroniques et que la particule entière peut être complètement saturée d’hydrogène. Le passage des espèces carbonées de 289,0 eV à 288,3 eV après exposition au 5-MF indique la présence d’une nouvelle espèce carbonée contenant une liaison carbone-oxygène. Puisque le film Pt recouvert de 5-MF montre la même espèce, ce signal peut être attribué au groupe aldéhyde du 5-MF. Cependant, l’espèce à 286,3 eV avant et après l’utilisation du catalyseur est décalée vers le haut de 0,5 eV par rapport aux espèces carbonées à 285,8 eV du 5-MF sur un film Pt. Les effets de charge ainsi que l’épaisseur du film 5-MF peuvent entraîner un changement de l’énergie de liaison, donc, comme déjà mentionné, une discussion sur cette espèce est difficile.
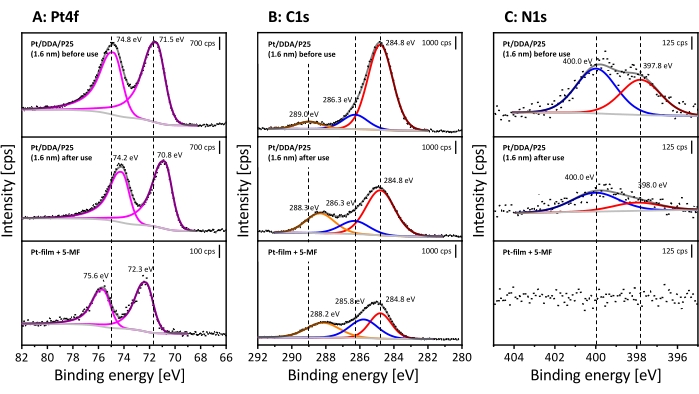
Figure 6 : Preuve d’empoisonnement de surface après hydrogénation du 5-MF en phase liquide à l’aide de XPS. Les spectres détaillés du signal Pt4f (A), du signal C1s (B) et du signal N1s (C) sont montrés. Les spectres XP empilés représentent Pt/DDA/P25 (1,6 nm) avant utilisation (en haut) et après hydrogénation du 5-MF pur (au milieu). À titre de comparaison, un film Pt recouvert de 5-MF est montré en bas. Tous les spectres ont été mesurés avec une source de rayonnement Al Kα (monochromatique) (énergie de passage : 40 eV, taille de pas d’énergie : 0,05 eV et nombre de balayages : 10). Tous les spectres sont référencés sur le signal aliphatique C1s à 284,8 eV30. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Pour mieux comprendre l’effet de l’empoisonnement et distinguer un empoisonnement par 5-MF des espèces de surface possibles, la spectroscopie infrarouge à transformée de Fourier (FT-IR) a été effectuée. Ici, les spectres FT-IR des nanoparticules de Pt avant et après l’ajout de 5-MF au catalyseur ont été comparés avec le DDA pur et le 5-MF comme référence. Pour attribuer les bandes émergentes, une comparaison avec des calculs théoriques et des expériences tirées de la littérature a été effectuée. Les spectres FT-IR mesurés dans la région de 3500 cm-1 à 700 cm-1 sont représentés à la figure 7. Toutes les bandes observées sont en outre énumérées avec une affectation à un mode de vibration dans le tableau supplémentaire S6 et le tableau supplémentaire S7.
La région comprise entre 2 500 cm-1 et 1 300 cm-1 n’a pas été prise en compte, car de nombreuses bandes d’absorption d’eau et de dioxyde de carbone de l’atmosphère qui se chevauchent fortement obstruent cette région. Malheureusement, cette région présente également des bandes d’absorption analytiquement utiles, telles que la bande vibratoire de valence carbonyle d’un aldéhyde aromatique, qui devrait apparaître entre 1715 cm-1 et 1695 cm-1 49,50. Tout d’abord, les bandes spécifiques et leur affectation aux vibrations moléculaires correspondantes de DDA et de 5-MF doivent être discutées. Ensuite, ces spectres seront comparés aux spectres FT-IR mesurés des nanoparticules Pt avant et après avoir pris contact avec le 5-MF. Le ligand DDA montre des bandes fortes dans la gamme de 2 851 cm-1 à 2 954 cm-1 qui peuvent être attribuées aux vibrations d’étirement symétriques et asymétriques des groupes méthyle et méthylène. La bande intense et nette à 3331 cm-1 résulte de la vibration d’étirement N-H du groupe amine49,51. Cette bande peut être prise pour surveiller la situation de liaison de DDA sur la surface du pt. À des nombres d’onde inférieurs, de nombreuses bandes apparaissent. Cependant, une affectation à des vibrations moléculaires spécifiques est compliquée en raison de l’interférence de différentes vibrations pour former des vibrations combinatoires ainsi que des vibrations de cadre. La comparaison avec la littérature 49,50,51 et les calculs théoriques suggèrent que les bandes d’absorption dans la région de 1 158 cm-1 à 1,120 cm-1 résultent de vibrations de la charpente. La bande à 1 063 cm-1 ainsi que la bande à 790 cm-1 peuvent être assignées au groupe amine. À 1 063 cm-1, la vibration d’étirement C-N se produit tandis que les bandes à 790 cm-1 correspondent à une combinaison de modes de remuement et de torsion du groupe amine. De plus, la vibration de bascule deCH2 conduit à une bande d’absorption caractéristique à 720 cm-149. Malheureusement, il n’y a pas d’autre affectation possible pour plusieurs bandes entre 1 090 cm-1 et 837 cm-1. Ces bandes peuvent résulter de vibrations combinatoires du cadre C-C. Cependant, ces vibrations ne sont pas très sensibles aux changements environnementaux, par exemple les vibrations du groupe amine et peuvent donc être négligées.
5-MF montre des bandes à 3 124 cm-1 et 2 994 cm-1, qui sont causées par les vibrations d’étirement C-H de l’anneau. La bande à 2 933 cm-1 correspond à la vibration d’étirement C-H du groupe méthyle52. D’autres bandes apparaissent entre 1 211 cm-1 et 800 cm-1. Les vibrations combinatoires du cycle aromatique avec le groupe méthyle et la vibration plane C-H conduisent à des bandes d’absorption à 1 023 cm-1 et 947 cm-1 tandis que la bande à 800 cm-1 est affectée à la vibration hors plan C-H 52,53. Les bandes à 1 151 cm-1 et 929 cm-1 ont également été observées dans la littérature pour le furfural mais n’ont été assignées à aucun mode vibratoire54.
Les recherches sur les nanoparticules Pt/DDA révèlent que la vibration d’étirement N-H disparaît tandis que les vibrations d’étirement C-H de la chaîne alkyle restent pratiquement inchangées. La disparition de cette bande peut s’expliquer par la règle de sélection de la surface métallique, selon laquelle les vibrations parallèles à la surface ne peuvent pas être observées. Alternativement, cela peut également faire allusion à une rupture de la liaison N-H après adsorption à la surface, ce qui expliquerait la deuxième espèce dans XPS à des énergies de liaison légèrement inférieures à celles de l’amine libre. Une autre possibilité est que la bande devienne potentiellement plus faible en raison des contraintes du site d’adsorption et ne soit donc pas détectée en raison d’un mauvais rapport signal sur bruit. De même, les bandes les plus faibles dans la région des empreintes digitales ne peuvent pas non plus être observées.
Après échange de ligands des nanoparticules Pt/DDA avec 5-MF dans des conditions de réaction, la région du nombre d’onde au-dessus de 2 500 cm-1 peut présenter deux bandes très faibles à 2 924 cm-1 et 2 851 cm-1, ce qui correspondrait aux modes de vibration de DDA. Des bandes supplémentaires correspondant au 5-MF apparaissent à 1 101 cm-1, 1 053 cm-1, 1 022 cm-1, 955 cm-1, 819 cm-1 et 798 cm-1. La différence significative entre les spectres avant et après l’ajout de 5-MF renforce les résultats antérieurs d’un échange de DDA avec 5-MF. Les diminutions d’intensité des bandes d’absorption précédemment fortes de 5-MF, ainsi que les fortes variations des vibrations impliquant la vibration C-H dans le plan de l’anneau (3 124 cm-1, 2 994 cm-1, 1 023 cm-1 et 947 cm-1) peuvent s’expliquer par une géométrie d’adsorption du cycle aromatique presque parallèle à la surface et les règles de sélection de surface métallique associées.
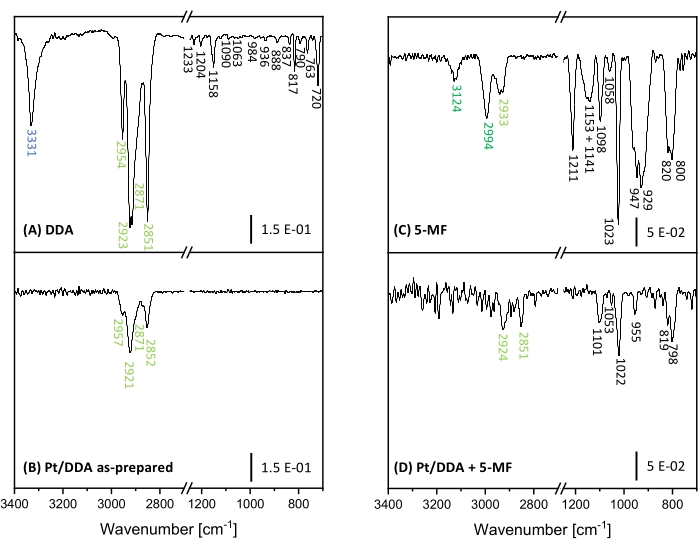
Figure 7 : Spectres FT-IR des nanoparticules Pt et références pour la preuve d’empoisonnement. Les spectres FT-IR des nanoparticules DDA (A) et Pt/DDA (1,3 nm) (B) sur le côté gauche. Les nanoparticules pures de 5-MF (C) et de Pt/DDA, qui ont été manipulées dans des conditions de réaction avec du 5-MF (D) pur, sont montrées sur le côté droit. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Tableau supplémentaire S1: Milieux chauffants pour les réactions d’hydrogénation. Les points d’ébullition des différents milieux chauffants sont énumérés. L’éther diisopropylique a été utilisé pour l’hydrogénation du cyclohexène. Comme le 5-MF n’a montré aucune conversion à 69 °C, des fluides chauffants avec des points d’ébullition plus élevés ont été testés. Veuillez cliquer ici pour télécharger ce tableau.
Figure supplémentaire S1 : chromatogramme en phase gazeuse de l’essai d’hydrogénation du toluène. Le chromatogramme en phase gazeuse montre le toluène, qui a été manipulé dans des conditions de réaction sous 1 atm d’hydrogène à 69 °C avec Pt/DDA/P25 (1,6 nm) comme catalyseur. Cet essai a examiné une possible hydrogénation du toluène. Un échantillon a été prélevé après 60 min. Aucune hydrogénation du solvant n’a pu être observée dans les conditions de réaction. Les contaminations sont marquées d’un * et sont présentes dans le toluène (voir figure supplémentaire S2). Veuillez cliquer ici pour télécharger ce fichier.
Tableau supplémentaire S2: Temps de rétention du toluène et contaminations dans le chromatogramme en phase gazeuse pour l’essai d’hydrogénation. L’échantillon a été prélevé à 69 °C après un temps de réaction de 60 minutes avec Pt/DDA/P25 (1,6 nm) comme catalyseur. Le prélèvement a été effectué avec une seringue de 1 mL à travers un septum. Les contaminations sont marquées d’un * et sont présentes dans le toluène (voir figure supplémentaire S2). Veuillez cliquer ici pour télécharger ce tableau.
Figure supplémentaire S2 : Chromatogramme en phase gazeuse du toluène. Le chromatogramme en phase gazeuse montre le toluène, qui a été vérifié pour d’éventuelles contaminations. Les contaminations sont marquées d’un * et étaient également présentes dans d’autres chromatogrammes en phase gazeuse. Veuillez cliquer ici pour télécharger ce fichier.
Tableau supplémentaire S3 : Temps de rétention du toluène et contaminations dans le chromatogramme en phase gazeuse pour le toluène. Un échantillon de toluène a été prélevé dans le contenant d’entreposage et vérifié pour détecter d’éventuelles contaminations. Les contaminations sont marquées d’un * et sont présentes dans le toluène (voir figure supplémentaire S2). Veuillez cliquer ici pour télécharger ce tableau.
Figure supplémentaire S3 : Chromatogramme en phase gazeuse pour l’hydrogénation du 5-MF après 60 min. L’échantillon a été prélevé à 69 °C après un temps de réaction de 60 minutes avec Pt/DDA/P25 (1,6 nm) comme catalyseur. Le prélèvement a été effectué avec une seringue de 1 mL à travers un septum. Veuillez cliquer ici pour télécharger ce fichier.
Tableau supplémentaire S4: Temps de rétention des substances dans le chromatogramme en phase gazeuse pour l’hydrogénation du 5-MF. L’échantillon a été prélevé à 69 °C après un temps de réaction de 60 minutes avec Pt/DDA/P25 (1,6 nm) comme catalyseur. Veuillez cliquer ici pour télécharger ce tableau.
Figure supplémentaire S4 : Chromatogramme en phase gazeuse des produits possibles. Cet échantillon contient des produits et sous-produits possibles pour l’hydrogénation du 5-méthylfurfural dans le toluène. Les contaminations sont marquées d’un * et sont présentes dans le toluène (voir figure supplémentaire S2). Veuillez cliquer ici pour télécharger ce fichier.
Tableau supplémentaire S5: Temps de conservation des produits possibles. Ce tableau contient les produits et sous-produits possibles pour l’hydrogénation du 5-méthylfurfural dans le toluène. Les contaminations sont marquées d’un * et sont présentes dans le toluène (voir figure supplémentaire S2). Veuillez cliquer ici pour télécharger ce tableau.
Figure supplémentaire S5 : Découpage du spectre de relevé de titane (P25). Seule une partie de l’étude du titane pur (P25) est montrée, dans laquelle se trouvent les pics d’impuretés. Les impuretés résultent de la production de titane ou du processus de nettoyage dans l’industrie44. Le spectre a été mesuré avec une source de rayonnement Al Kα (monochromatique) (énergie de passe: 200 eV, taille de pas d’énergie: 1 eV et nombre de balayages: 2) Ce spectre n’est pas référencé. Veuillez cliquer ici pour télécharger ce fichier.
Figure supplémentaire S6 : Images TEM et histogrammes de taille de nanoparticules de platine stabilisées aux amines avant et après hydrogénation du 5-méthylfurfural. Les images TEM (en haut) et les histogrammes de taille (en bas) sont montrés. L’image TEM de gauche montre des nanoparticules de platine (Pt/DDA/P25 (1,6 nm)) avant hydrogénation. L’image TEM de droite montre les nanoparticules de platine (Pt/DDA/P25 (1,6 nm)) après hydrogénation. Les images TEM ont été enregistrées en utilisant une tension d’accélération de 80 eV. Veuillez cliquer ici pour télécharger ce fichier.
Tableau supplémentaire S6: Modes vibratoires des spectres FT-IR des nanoparticules DDA et Pt/DDA. Sont énumérées toutes les bandes, qui ont été observées dans les deux mesures et montrées à la figure 7. Les bandes d’absorption qui n’ont pu être affectées à aucun mode vibratoire sont marquées d’un signe de tiret (-). Veuillez cliquer ici pour télécharger ce tableau.
Tableau supplémentaire S7 : Modes vibratoires des spectres FT-IR des nanoparticules 5-MF et Pt/5-MF. Sont énumérées toutes les bandes, qui ont été observées dans les deux mesures et montrées à la figure 7. Les bandes d’absorption qui n’ont pu être affectées à aucun mode vibratoire sont marquées d’un signe de tiret (-). Veuillez cliquer ici pour télécharger ce tableau.
Discussion
Les nanoparticules de Pt coiffées de DDA ont été synthétisées avec succès dans deux tailles et formes différentes12,14. Les petites nanoparticules de Pt (1,6 nm) présentent une forme quasi-sphérique tandis que les plus grosses particules (2,4 nm) sont plus asymétriques présentant des structures partiellement tripodales ou ellipsoïdales. Les possibilités sont limitées pour obtenir de plus grosses nanoparticules de platine quasi-sphériques, car une formation de structures allongées se produit en augmentant encore la taille des particules par croissance ensemencée14. La taille et la forme des particules peuvent également être influencées par le ligand, le temps de réaction et la température. Outre le DDA, d’autres ligands peuvent être utilisés dans la synthèse, mais l’agent de coiffage influence la croissance et, par conséquent, la taille et la forme des nanoparticules, comme cela a déjà été démontré pour la synthèse de nanoparticules d’or39. Après avoir ajouté la solution de réduction à la solution de sel métallique, la solution est agitée pendant 60 min (90 min pour la synthèse de particules plus grosses) pour s’assurer que le processus de croissance des nanoparticules Pt est terminé. Le transport des monomères à la surface des particules peut être un facteur limitant. De plus, la température peut influencer le rayon critique, qui décrit la taille minimale requise des particules, à laquelle les graines sont stables en solution. En augmentant la température, le rayon critique diminue, ce qui entraîne une formation plus rapide des graines et par conséquent une diminution plus rapide de la concentration en monomère55. Après synthèse, des impuretés d’ammonium et de bromure peuvent encore être observées dans XPS qui peuvent être éliminées en effectuant un échange de ligand avec DDA. De plus, toutes les nanoparticules synthétisées ont été déposées sur des poudres P25 sans aucun changement de forme, de taille ou de perte du ligand. À titre de comparaison, un catalyseur Pt sans ligand a été généré en utilisant la méthode d’imprégnation, qui présente une taille de nanoparticules Pt de 2,1 nm et une forme quasi-sphérique. XPS révèle en outre que non seulement des espèces métalliques de Pt étaient présentes à la surface, mais aussi des espèces oxydées. Cela indique qu’en l’absence de ligands amine, les nanoparticules de platine interagissent avec le support, ce qui peut entraîner une encapsulation partielle du métal dans le support10. En conséquence, les particules perdent partiellement leur capacité à diviser l’hydrogène56. Cependant, une telle encapsulation est favorisée par une réduction à haute température du précurseur de sel métallique. La température utilisée ici pour la réduction (180 °C) est très inférieure à celles mentionnées dans la littérature pour l’encapsulation (600 °C)57. Une autre explication plus probable serait une réduction incomplète de la source de Pt utilisée. Cependant, les deux explications entraînent une désactivation partielle du catalyseur.
Dans la littérature, les ligands tels que les amines ou l’ammoniac sont souvent considérés comme un poison catalyseur dans la compréhension classique de la catalyse hétérogène15,16. Cependant, les études sur l’hydrogénation en phase liquide du cyclohexène démontrent que Pt/DDA/P25 est toujours actif catalytiquement et a montré une conversion encore plus élevée par rapport au catalyseur sans amine. Les amines sont connues pour bloquer systématiquement les sites d’adsorption en terrasse sur Pt(111)11,58. Les résultats de la littérature ont déjà montré que cet effet prometteur de sélection de sites actifs des ligands peut être utilisé pour améliorer la sélectivité pour l’hydrogénation de l’acétylène dans les flux riches en éthylène en diluant les sites d’adsorption59. Cet effet de sélection active du site a également été observé pour les thiols se liant sur(111)22,23. Pour l’hydrogénation du cyclohexène, ces sites sont donc déjà bloqués par les amines, mais des centres de réaction sous-coordonnés très actifs sont encore disponibles. En plus de l’effet de sélection de site du ligand, une attention particulière doit également être accordée à d’autres propriétés du ligand. Lors de la sélection du ligand, il faut veiller à ce que le ligand stabilise les particules pendant la synthèse et les protège de l’agglomération. De plus, le ligand doit présenter une forte adsorption sur la surface métallique et une stabilité thermique suffisamment élevée pour que le ligand ne soit pas désorbé ou décomposé dans des conditions de réaction. Les résultats montrent que le PDD semble généralement convenir à cette approche catalytique. Aucun effet de taille n’a pu être observé dans la réaction du modèle. Fait intéressant, le catalyseur contenant des nanoparticules de Pt qui n’ont pas subi d’échange de ligand a présenté une conversion plus faible (50%) que les particules Pt déposées sur P25 après échange de ligand (72%). Par conséquent, un blocage des sites actifs par des composés ioniques peut être envisagé dans ces conditions. La réalisation d’un échange de ligand est cruciale pour augmenter l’activité des nanoparticules de platine en éliminant les composés ioniques co-adsorbés tels que le bromure et l’ammonium, comme le montre XPS avant et après l’échange de ligands.
De plus, l’influence des espèces de surface d’amines supplémentaires sur l’activité catalytique des nanoparticules de platine reste ambiguë, car cette espèce peut potentiellement servir de source d’hydrogène supplémentaire et localisée. Les spectres XP et FT-IR semblent indiquer une abstraction d’hydrogène du groupe amine par le platine conduisant à une espèce de surface amine supplémentaire. Cela offre la possibilité de servir de l’hydrogène en plus de l’hydrogène dissous dans le toluène, ce qui peut affecter l’activité catalytique. Un effet donneur d’hydrogène du toluène peut être exclu ici puisque le toluène n’est pas connu pour se déshydrogéner sous une pression d’hydrogène basse et à une température60. Cependant, l’influence de l’extraction d’hydrogène sur l’activité catalytique doit encore être étudiée plus avant. L’hydrogénation de l’acétophénone sur des nanoparticules de platine modifiées par la l-proline a déjà montré que le groupe amine peut accélérer l’hydrogénation par un transfert d’hydrogène de l’amine au réactif15. Par conséquent, une influence possible de l’amine et des espèces de surface sur l’hydrogénation doit être envisagée.
Malgré l’utilisation réussie de nanoparticules Pt/DDA pour l’hydrogénation d’alcènes simples, aucun renouvellement pour le réactif 5-MF plus exigeant n’a pu être observé. Par conséquent, différentes possibilités pour cela peuvent être discutées dans ce qui suit: une explication serait qu’aucune réaction n’a lieu en raison de la faible température de réaction et de la pression d’hydrogène. La température de réaction a été limitée à 160 °C. Comme l’analyse thermogravimétrique a montré que la désorption des ligands et la décomposition des nanoparticules Pt/DDA de tailles comparables ont lieu à ces températures13. En raison du réacteur utilisé, aucune pression supérieure à 1 atm d’hydrogène ne pouvait être utilisée. La pression d’hydrogène plus faible contrairement aux expériences de la littérature pourrait être la raison pour laquelle l’hydrogénation des composés carbonyles, tels que le 5-MF, n’était pas réalisable. Plusieurs études ont en outre montré que les interactions de support métallique fort (SMSI) sont cruciales pour la sélectivité de l’hydrogénation en phase gazeuse du furfural61,62,63. Le SMSI conduit à la formation de vides O, ce qui permet l’adsorption du furfural via le groupe carbonyle à la surface du titane. Un furfuryl-oxy-intermédiaire est formé qui peut être hydrogéné. Cependant, cette hypothèse est contrée par le fait que, contrairement aux expériences en phase gazeuse, aucune preuve d’une influence du SMSI n’a pu être trouvée pour l’hydrogénation en phase liquide du furfural dans le méthanol. Des particules de platine sur différents oxydes (MgO,CeO2 etAl2O3) avaient montré des propriétés catalytiques comparables64. Cela indique que l’hydrogénation pourrait avoir lieu en subissant différents mécanismes dans la phase liquide et la phase gazeuse, ce qui doit être étudié plus avant. L’effet SMSI des particules Pt et du support n’a été observé que pour le catalyseur sans ligand, qui ne montre pas non plus de conversion de 5-MF dans les conditions de réaction utilisées. Par conséquent, un impact de l’effet SMSI semble peu probable. Comme l’empoisonnement du catalyseur par le 5-MF ou un intermédiaire de surface semble plus probable dans les conditions de réaction appliquées, les catalyseurs ont été analysés avant et après l’échange de ligand avec le 5-MF dans des conditions de réaction par XPS et FT-IR. Ces mesures ont confirmé l’hypothèse d’un empoisonnement catalytique par 5-MF car les deux méthodes montrent une diminution des pics correspondant à l’amine à la surface du Pt. La spectroscopie FT-IR suggère en outre que la 5-MF agit comme un poison catalytique puisque des bandes apparaissent dans la région du nombre d’onde en dessous de 1 200 cm-1, ce qui correspond aux bandes attribuées à la 5-MF. Une géométrie d’adsorption presque plate est suggérée en tenant compte des règles de sélection de surface. Un schéma de la restructuration de surface proposée est présenté à la figure 8.
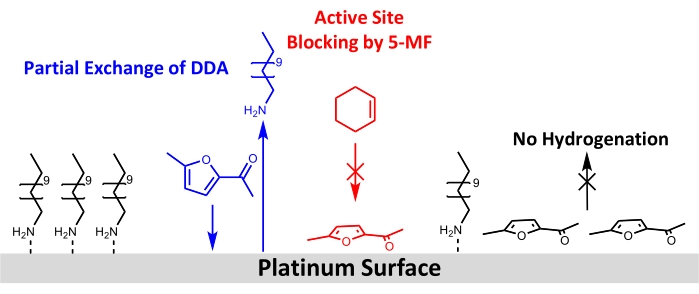
Figure 8 : Schéma des changements structuraux par addition de 5-MF à l’hydrogénation du cyclohexène à la surface des nanoparticules de platine stabilisées aux amines. Les résultats du FT-IR et du XPS montrent un échange partiel de DDA par 5-MF à la surface du platine et un blocage des sites actifs pour l’hydrogénation du cyclohexène. Les résultats des données FT-IR suggèrent une adsorption de l’anneau de 5-MF presque parallèle à la surface. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Pour conclure, les nanoparticules de Pt coiffées d’amine sur P25 sont des candidats prometteurs pour de nouveaux catalyseurs d’hydrogénation, car les nanoparticules de Pt présentent une conversion plus élevée que le catalyseur sans ligand dans la réaction modèle. Cependant, aucune conversion de 5-MF n’a été observée sur l’un ou l’autre catalyseur. Cela résulte d’un empoisonnement du Pt par le réactif et non par le ligand comme souvent considéré dans la littérature dans les conditions de réaction étudiées. Pour les applications futures, une meilleure compréhension de l’influence des ligands sur le comportement d’adsorption des réactifs et leur interaction avec les nanoparticules métalliques est nécessaire. Une synthèse colloïdale est une approche prometteuse en plus des méthodes d’imprégnation et de calcination pour la fabrication de catalyseurs hétérogènes, car elle permet la synthèse de nanoparticules dans une taille et une forme définies. Étant donné que l’approche de synthèse colloïdale permet l’utilisation de différents ligands, par exemple des amines, des amides, des thiols ou des alcools, les nanoparticules de Pt avec d’autres ligands doivent être étudiées et comparées. Cela offre la possibilité d’utiliser des ligands, qui montrent une interaction ligand-réactif spécifique, comme les interactions π-π pour contrôler la géométrie d’adsorption et donc aussi la sélectivité de la réaction. Cette approche pourrait être utilisée pour l’hydrogénation sélective des α,β-cétones insaturées et des aldéhydes, comme cela a déjà été démontré pour l’hydrogénation du cinnamaldéhyde21. En outre, le contrôle de la stéréosélectivité dans les réactions catalysées hétérogènes reste une tâche difficile; Cependant, un ligand chiral approprié pourrait être utilisé pour contrôler la chiralité du produit comme dans les réactions catalysées homogènes. Outre les interactions ligand-réactif, l’effet stabilisateur des ligands pourrait être utilisé pour protéger les nanoparticules métalliques de l’interaction de support métallique fort. L’interaction de support métallique fort réduirait la chimisorption de l’hydrogène par encapsulation des particules avec une couche d’oxyde. Pour une meilleure compréhension de l’influence des ligands, XPS et FT-IR peuvent fournir des informations utiles sur l’effet d’empoisonnement sélectif et les modes de liaison des ligands. En outre, le CO doit être considéré comme une molécule de capteur permettant d’identifier les sites de surface disponibles de la nanoparticule de Pt. De plus, le comportement d’adsorption et les réactions de surface possibles des ligands et des réactifs peuvent être étudiés sur des monocristaux Pt dans des conditions de vide ultra-poussé pour obtenir une compréhension fondamentale des processus de surface. Dans l’ensemble, les ligands en catalyse hétérogène peuvent offrir une nouvelle approche catalytique, qui peut être utilisée pour contrôler l’activité et la sélectivité d’une réaction catalysée en plus de la taille des particules et des effets de soutien. Par conséquent, la façon traditionnelle de penser la catalyse hétérogène des ligands comme poison catalyseur devrait être reconsidérée.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Merci à Edith Kieselhorst et Erhard Rhiel pour leur soutien au TEM et à Carsten Dosche pour le soutien au XPS. Merci à Stefan Petrasz pour son soutien avec le chromatographe en phase gazeuse. Le financement du dispositif XPS par DFG (INST: 184/144-1FUGG) et le financement de DFG-RTG 2226 sont reconnus.
matériels
| Name | Company | Catalog Number | Comments |
| 2-propanol | Sigma Aldrich | 59300-2.5L | puriss. p. a., ACS reagent, >99.8% |
| 4-methyl-2-pentanol | Carl Roth | 4371.2 | purity: >99%, for synthesis |
| 5-methylfurfural | Sigma Aldrich | 137316-100G | ReagentPlus, 99 % |
| acetone | Sigma Aldrich | 32201-2,5L-M | puriss. p. a., ACS reagent, >99.5% |
| cannula | B Braun | 4665643 | diameter: 0.80 mm, length: 120 mm |
| CasaXPS | Casa Software | software, version 2.3.15 | |
| centrifuge | Heraeus | model: Multifuge 1s | |
| centrifuge tube | Schott Duran | 163-9315026 | volume: 80 mL, diameter: 44 mm, length: 100 mm |
| chloroplatinic acid hexahydrate | Merck | 8073400001 | amount of platinum: 40 % |
| column | Agilent Technologies | 19091 S-001 | model: HP-PONA, film: dimethyl polysiloxane, film thickness: 0.2 µm, length: 50 m |
| CRYSTAL 17 | CRYSTAL Theoretical Chemistry Group Torino | software, version: v1.0.2 | |
| crystallizing dish | volume: 50 mL | ||
| cyclohexene | Acros Organics | 154840010 | purity: 99 % |
| desposable syringe | Henke Sass Wolff | Norm-Ject, volume: 1, 2, 5 mL | |
| didodecyldimethylammonium bromide | Acros Organics | 407120250 | purity: 99 % |
| diisopropyl ether | Carl Roth | T899.1 | purity: 98%, for synthesis |
| dodecyl amine | Sigma Aldrich | D222208-500ML | purity: 98 % |
| double walled tank reactor | processed by glass blower | Standard ground glass joint sleeves: 2 x 14/23, 1 x 19/26, 1 x 29/32, reactor volume: 150 mL, material: quartz glas, with outer heating jacket | |
| Fourier-transform infrared spectrometer | Bruker | model: Equinox 55 | |
| rubber balloon | Deutsch & Neumann | 163-7652667 | volume: 4 L, material: latex, |
| gaschromatograph | Agilent Technologies | model: 7820A | |
| HP-PONA-column | Agilent Technologies | 19091S-001 | length: 50 m, film thickness: 0.5 µm, inner diameter: 0.2 mm |
| hydrogen | Air Liquide | P0231L50R2A001 | purity: 5.0 |
| ImageJ | Wayne Rasband | software, version 1.52 | |
| methanol | Sigma Aldrich | 32213-2,5L-M | puriss. p. a., ACS reagent, >99.8% |
| n-hexane | VWR Chemicals | 24577298 | purity: 99 % |
| Opus | Bruker | software, version 5.5 | |
| pasteur pipette | Brand | 747715 | material: glass, length: 145 mm, inside diameter: 1 mm |
| pipette ball | Technikplaza | 89005517 | diameter: 94 mm, material: PVC |
| platinum(IV) chloride | Acros Organics | 195400010 | purity: 99 % |
| plunge operated pipette | LLG Lab Logistics Group | 9.280 005 | volume: 100-1000 µL |
| plunge operated pipette | LLG Lab Logistics Group | 9.280 001 | volume: 0.5-10 µL |
| potassium bromide | Carl Roth | 9252.1 | purity: >98% |
| reflux condenser | neoLab | LZ-1197 | length: 160 mm, NS 14/23 |
| rolled rim glass | VWR Chemicals | 548-0625 | volume: 10 mL |
| round neck flask | Carl Roth | HY50.1 | volume: 10 mL, NS 14/23 |
| rubber septum | Carl Roth | EE04.1 | material: silicone, NS 14/23 |
| syringe filter | Agilent Technologies | 5190-5267 | Captiva Econofilter, pore size 0.2 µm, PTFE menbrane |
| syringe pump | Landgraf Laborsysteme HLL | 106720180 | model: LA180A |
| TEM grid | Plano | diameter: 3.05 mm, 300 mesh, covered with formvar and coal | |
| temperature programmed oven | Nabertherm | model: L5, voltage: 230 V, power: 2.4 kW, controler: C6 | |
| tetrabutylammonium borohydride | Sigma Aldrich | 230170-10G | purity: 98 % |
| three neck round bottom flask | Carl Roth | KY19.1 | volume: 100 mL, NS 14/23, 14/23 |
| Titania P25 | Acros Organics | 384292500 | purity: 99 % |
| toluene | VWR Chemicals | 32249-1L-M | puriss. p. a., ACS reagent, >99.7% |
| transition piece | Carl Roth | with core and stop cock, straight tubing olive, 29/32 | |
| transmission electron microscope | Zeiss | model: 900N | |
| ultrasonic bath | Bandelin | 305 | model: RK 156, volume: 6 L |
| volumetric pipette | Brand | 29718 | volume: 50 mL |
| X-ray photoelectron spectrometer | Thermo Fisher | model: ESCALAB 250 xi |
Références
- Liu, L., Corma, A. Metal catalysts for heterogeneous catalysis: From single atoms to nanoclusters and nanoparticles. Chemical Reviews. 118 (10), 4981-5079 (2018).
- Zakarina, N., Bekturov, E. Platinum nanoparticles stabilized by polyvinylpyrrolidone for hydrogenation. Chinese Journal of Catalysis. 29 (11), 1165-1168 (2008).
- Rioux, R. M., et al. Monodisperse platinum nanoparticles of well-defined shape: synthesis, characterization, catalytic properties and future prospects. Topics in Catalysis. 39 (3-4), 167-174 (2006).
- Ikeda, S., et al. Ligand-free platinum nanoparticles encapsulated in a hollow porous carbon shell as a highly active heterogeneous hydrogenation catalyst. Angewandte Chemie. 118 (42), 7221-7224 (2006).
- Mostafa, S., et al. Shape-dependent catalytic properties of Pt nanoparticles. Journal of the American Chemical Society. 132 (44), 15714-15719 (2010).
- van Deelen, T. W., Hernández Mejía, C., de Jong, K. P. Control of metal-support interactions in heterogeneous catalysts to enhance activity and selectivity. Nature Catalysis. 2 (11), 955-970 (2019).
- Rioux, R. M., Hsu, B. B., Grass, M. E., Song, H., Somorjai, G. A. Influence of particle size on reaction selectivity in cyclohexene hydrogenation and dehydrogenation over silica-supported monodisperse Pt particles. Catalysis Letters. 126 (1-2), 10-19 (2008).
- Somorjai, G. A., Carrazza, J. Structure sensitivity of catalytic reactions. Industrial & Engineering Chemistry Fundamentals. 25 (1), 63-69 (1986).
- Somorjai, G. A. Surface science. Science. 201 (4355), 489-497 (1978).
- Fu, Q., Wagner, T. Interaction of nanostructured metal overlayers with oxide surfaces. Surface Science Reports. 62 (11), 431-498 (2007).
- Siemer, M., Tomaschun, G., Klüner, T., Christopher, P., Al-Shamery, K. Insights into spectator-directed catalysis: CO adsorption on amine-capped platinum nanoparticles on oxide supports. ACS Applied Materials & Interfaces. 12 (24), 27765-27776 (2020).
- Jana, N. R., Peng, X. Single-phase and gram-scale routes toward nearly monodisperse Au and other noble metal nanocrystals. Journal of the American Chemical Society. 125 (47), 14280-14281 (2003).
- Fenske, D., et al. Colloidal synthesis of pt nanoparticles: on the formation and stability of nanowires. Langmuir. 24 (16), 9011-9016 (2008).
- Osmić, M., Kolny-Olesiak, J., Al-Shamery, K. Size control and shape evolution of single-twinned platinum nanocrystals in a room temperature colloidal synthesis. CrystEngComm. 16 (42), 9907-9914 (2014).
- Schrader, I., Warneke, J., Backenköhler, J., Kunz, S. Functionalization of platinum nanoparticles with L-proline: simultaneous enhancements of catalytic activity and selectivity. Journal of the American Chemical Society. 137 (2), 905-912 (2015).
- Maxted, E. B., Biggs, M. S. The catalytic toxicity of nitrogen compounds. Toxicity of ammonia and of amines. Journal of the Chemical Society. , 3844-3847 (1957).
- Aliaga, C., et al. Sum frequency generation and catalytic reaction studies of the removal of organic capping agents from Pt nanoparticles by UV−Ozone treatment. The Journal of Physical Chemistry C. 113 (15), 6150-6155 (2009).
- Comotti, M., Li, W. -. C., Spliethoff, B., Schüth, F. Support effect in high activity gold catalysts for CO oxidation. Journal of the American Chemical Society. 128 (3), 917-924 (2006).
- Gorin, D. J., Sherry, B. D., Toste, F. D. Ligand effects in homogeneous Au catalysis. Chemical Reviews. 108 (8), 3351-3378 (2008).
- Kahsar, K. R., Schwartz, D. K., Medlin, J. W. Selective hydrogenation of polyunsaturated fatty acids using alkanethiol self-assembled monolayer-coated Pd/Al2O3 catalysts. ACS Catalysis. 3 (9), 2041-2044 (2013).
- Kahsar, K. R., Schwartz, D. K., Medlin, J. W. Control of metal catalyst selectivity through specific noncovalent molecular interactions. Journal of the American Chemical Society. 136 (1), 520-526 (2014).
- Pang, S. H., Schoenbaum, C. A., Schwartz, D. K., Medlin, J. W. Directing reaction pathways by catalyst active-site selection using self-assembled monolayers. Nature Communications. 4, 2448 (2013).
- Schoenbaum, C. A., Schwartz, D. K., Medlin, J. W. Controlling the surface environment of heterogeneous catalysts using self-assembled monolayers. Accounts of Chemical Research. 47 (4), 1438-1445 (2014).
- Grimes, R. N. Small carborane ligands as spectators and as players. Journal of Organometallic Chemistry. 581 (1-2), 1-12 (1999).
- Crabtree, R. H. Multifunctional ligands in transition metal catalysis. New Journal of Chemistry. 35 (1), 18-23 (2011).
- Dostert, K. -. H., O'Brien, C. P., Ivars-Barceló, F., Schauermann, S., Freund, H. -. J. Spectators control selectivity in surface chemistry: Acrolein partial hydrogenation over Pd. Journal of the American Chemical Society. 137 (42), 13496-13502 (2015).
- Hu, L., et al. Catalytic conversion of biomass-derived carbohydrates into fuels and chemicals via furanic aldehydes. RSC Advances. 2 (30), 11184 (2012).
- Pushkarev, V. V., Musselwhite, N., An, K., Alayoglu, S., Somorjai, G. A. High structure sensitivity of vapor-phase furfural decarbonylation/hydrogenation reaction network as a function of size and shape of Pt nanoparticles. Nano Letters. 12 (10), 5196-5201 (2012).
- Liao, X. -. M., Pitchon, V., Cuong, P. -. H., Chu, W., Caps, V. Hydrogenation of cinnamaldehyde over bimetallic Au–Cu/CeO2 catalyst under a mild condition. Chinese Chemical Letters. 28 (2), 293-296 (2017).
- Fang, D., He, F., Xie, J., Xue, L. Calibration of binding energy positions with C1s for XPS results. Journal of Wuhan University of Technology-Materials Science Edition. 35 (4), 711-718 (2020).
- Heiz, U., Landman, U. . Nanocatalysis: With 14 tables. , (2008).
- Nyholm, R., Berndtsson, A., Martensson, N. Core level binding energies for the elements Hf to Bi (Z=72-83). Journal of Physics C: Solid State Physics. 13 (36), 1091-1096 (1980).
- Fu, X., Wang, Y., Wu, N., Gui, L., Tang, Y. Surface modification of small platinum nanoclusters with alkylamine and alkylthiol: An XPS study on the influence of organic ligands on the Pt 4f binding energies of small platinum nanoclusters. Journal of Colloid and Interface Science. 243 (2), 326-330 (2001).
- Ono, L. K., Yuan, B., Heinrich, H., Cuenya, B. R. Formation and thermal stability of platinum oxides on size-selected platinum nanoparticles: Support effects. The Journal of Physical Chemistry C. 114 (50), 22119 (2010).
- Bachmann, P., et al. Dehydrogenation of the Liquid Organic Hydrogen Carrier System Indole/Indoline/Octahydroindole on Pt(111). The Journal of Physical Chemistry C. 122 (8), 4470-4479 (2018).
- Mudiyanselage, K., Trenary, M. Adsorption and thermal decomposition of N-methylaniline on Pt(111). Surface Science. 603 (21), 3215-3221 (2009).
- Briggs, D., Beamson, G. Primary and secondary oxygen-induced C1s binding energy shifts in x-ray photoelectron spectroscopy of polymers. Analytical Chemistry. 64 (15), 1729-1736 (1992).
- Huang, M., Adnot, A., Suppiah, S., Kaliaguine, S. XPS observation of surface interaction between H2 and CO2 on platinum foil. Journal of Molecular Catalysis A: Chemical. 104 (2), 131-137 (1995).
- Mohrhusen, L., Osmić, M. Sterical ligand stabilization of nanocrystals versus electrostatic shielding by ionic compounds: a principle model study with TEM and XPS. RSC Advances. 7 (21), 12897-12907 (2017).
- Otero-Irurueta, G., et al. Adsorption and coupling of 4-aminophenol on Pt(111) surfaces. Surface Science. 646, 5-12 (2015).
- Erley, W., Xu, R., Hemminger, J. C. Thermal decomposition of trimethylamine on Pt(111): spectroscopic identification of surface intermediates. Surface Science. 389 (1-3), 272-286 (1997).
- Bridge, M. E., Somers, J. The adsorption of methylamine on Pt(111). Vacuum. 38 (4-5), 317-320 (1988).
- Chen, X., Mao, S. S. Titanium dioxide nanomaterials: synthesis, properties, modifications, and applications. Chemical Reviews. 107 (7), 2891-2959 (2007).
- Madon, R. J., O'Connell, J. P., Boudart, M. Catalytic hydrogenation of cyclohexene: Part II. Liquid phase reaction on supported platinum in a gradientless slurry reactor. American Institute of Chemical Engineers Journal. 24 (5), 904-911 (1978).
- Pan, C. -. J., et al. Tuning/exploiting Strong Metal-Support Interaction (SMSI) in heterogeneous catalysis. Journal of the Taiwan Institute of Chemical Engineers. 74, 154-186 (2017).
- Lewera, A., Timperman, L., Roguska, A., Alonso-Vante, N. Metal–support interactions between nanosized Pt and metal oxides (WO 3 and TiO 2 ) studied using X-ray photoelectron spectroscopy. The Journal of Physical Chemistry C. 115 (41), 20153-20159 (2011).
- Ohyama, J., Yamamoto, A., Teramura, K., Shishido, T., Tanaka, T. Modification of metal nanoparticles with TiO2 and metal−support interaction in photodeposition. ACS Catalysis. 1 (3), 187-192 (2011).
- Zhong, J. -. Q., et al. Synchrotron-based ambient pressure X-ray photoelectron spectroscopy of hydrogen and helium. Applied Physics Letters. 112 (9), 91602 (2018).
- Günzler, H., Gremlich, H. -. U. . IR-Spektroskopie: Eine Einführung. , (2003).
- Hesse, M., Meier, H., Zeeh, B. . Spektroskopische Methoden in der organischen Chemie: 114 Tabellen. , (2012).
- Ripmeester, M., Duford, D. A., Yuan, S. Understanding the behaviour of dodecylamine as a model cationic collector in oil sands tailings dewatering applications using a novel FTIR based method. The Canadian Journal of Chemical Engineering. 98 (7), 1471-1482 (2020).
- Erdogdu, Y., Sertbakan, T. R., Güllüoğlu, M. T., Yurdakul, &. #. 3. 5. 0. ;., Güvenir, A. FT-IR and Raman spectroscopy and computation of 5-Methylfurfural. Journal of Applied Spectroscopy. 85 (3), 517-525 (2018).
- Kiss, &. #. 1. 9. 3. ;. I., Machytka, D., Bánki, J., Gál, M. Spectroscopic study of the conformational isomerism of 2-formylfuran derivatives. Journal of Molecular Structure. 197, 193-202 (1989).
- Allen, G., Bernstein, H. J. Internal rotation: VIII. The infrared and Raman spectra of furfural. Canadian Journal of Chemistry. 33 (6), 1055-1061 (1955).
- Thanh, N. T. K., Maclean, N., Mahiddine, S. Mechanisms of nucleation and growth of nanoparticles in solution. Chemical Reviews. 114 (15), 7610-7630 (2014).
- Tauster, S. J., Fung, S. C., Garten, R. L. Strong metal-support interactions. Group 8 noble metals supported on titanium dioxide. Journal of the American Chemical Society. 100 (1), 170-175 (1978).
- Beck, A., et al. The dynamics of overlayer formation on catalyst nanoparticles and strong metal-support interaction. Nature Communications. 11 (1), 3220 (2020).
- Sobota, M., et al. Ligand effects in SCILL model systems: site-specific interactions with Pt and Pd nanoparticles. Advanced Materials. 23 (2223), 2617-2621 (2011).
- Altmann, L., et al. Impact of organic ligands on the structure and hydrogenation performance of colloidally prepared bimetallic PtSn nanoparticles. ChemCatChem. 5 (7), 1803-1810 (2013).
- Modisha, P. M., Ouma, C. N. M., Garidzirai, R., Wasserscheid, P., Bessarabov, D. The prospect of hydrogen storage using liquid organic hydrogen carriers. Energy & Fuels. 33 (4), 2778-2796 (2019).
- Baker, L. R., et al. Furfuraldehyde hydrogenation on titanium oxide-supported platinum nanoparticles studied by sum frequency generation vibrational spectroscopy: acid-base catalysis explains the molecular origin of strong metal-support interactions. Journal of the American Chemical Society. 134 (34), 14208-14216 (2012).
- Kijeński, J., Winiarek, P., Paryjczak, T., Lewicki, A., Mikołajska, A. Platinum deposited on monolayer supports in selective hydrogenation of furfural to furfuryl alcohol. Applied Catalysis A: General. 233 (1-2), 171-182 (2002).
- Kijeński, J., Winiarek, P. Selective hydrogenation of α,β-unsaturated aldehydes over Pt catalysts deposited on monolayer supports. Applied Catalysis A: General. 193 (1-2), 1-4 (2000).
- Taylor, M. J., et al. Highly selective hydrogenation of furfural over supported Pt nanoparticles under mild conditions. Applied Catalysis B. 180, 580-585 (2016).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon