Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
In vitro Digestion d’émulsions dans une seule gouttelette par échange multi-sous-phase de fluides gastro-intestinaux simulés
Dans cet article
Résumé
Une balance de film de surface de goutte pendante mise en œuvre avec un échange multi-sous-phase, surnommé OCTOPUS, permet d’imiter les conditions digestives par l’échange séquentiel en sous-phase de la solution en vrac originale avec des fluides gastro-intestinaux simulés. La digestion in vitro simulée est surveillée en enregistrant in situ la tension interfaciale de la couche interfaciale digérée.
Résumé
Les émulsions sont actuellement utilisées pour encapsuler et fournir des nutriments et des médicaments pour lutter contre différentes affections gastro-intestinales telles que l’obésité, l’enrichissement en nutriments, les allergies alimentaires et les maladies digestives. La capacité d’une émulsion à fournir la fonctionnalité souhaitée, à savoir atteindre un site spécifique dans le tractus gastro-intestinal, inhiber / retarder la lipolyse ou faciliter la digestibilité, dépend finalement de sa susceptibilité à la dégradation enzymatique dans le tractus gastro-intestinal. Dans les émulsions huile-dans-eau, les gouttelettes lipidiques sont entourées de couches interfaciales, où les émulsifiants stabilisent l’émulsion et protègent le composé encapsulé. La réalisation d’une digestibilité sur mesure des émulsions dépend de leur composition initiale, mais nécessite également de surveiller l’évolution de ces couches interfaciales lorsqu’elles sont soumises à différentes phases de digestion gastro-intestinale. Une balance de film de surface de goutte pendante mise en œuvre avec un échange multi-sous-phase permet de simuler la digestion in vitro d’émulsions dans une seule gouttelette aqueuse immergée dans l’huile en appliquant un modèle de digestion statique personnalisé. Le transit dans le tractus gastro-intestinal est imité par l’échange en sous-phase de la solution originale en vrac de gouttelettes avec des milieux artificiels, imitant les conditions physiologiques de chaque compartiment / étape du tractus gastro-intestinal. L’évolution dynamique de la tension interfaciale est enregistrée in situ tout au long de la digestion gastro-intestinale simulée. Les propriétés mécaniques des interfaces digérées, telles que l’élasticité dilatationnelle interfaciale et la viscosité, sont mesurées après chaque phase de digestion (orale, gastrique, intestin grêle). La composition de chaque milieu digestif peut être ajustée pour tenir compte des particularités des affections digestives, y compris les pathologies gastro-intestinales et les milieux digestifs infantiles. Les mécanismes interfaciaux spécifiques affectant la protéolyse et la lipolyse sont identifiés, fournissant des outils pour moduler la digestion par l’ingénierie interfaciale des émulsions. Les résultats obtenus peuvent être manipulés pour concevoir de nouvelles matrices alimentaires avec des fonctionnalités adaptées telles qu’une faible allergénicité, un apport énergétique contrôlé et une digestibilité réduite.
Introduction
Comprendre comment les graisses sont digérées, ce qui implique la digestion des émulsions, est important pour concevoir rationnellement des produits avec des fonctionnalités sur mesure1. Le substrat pour la digestion des graisses est une émulsion puisque la graisse est émulsionnée lors de la consommation par action mécanique et mélange avec des biosurfactants dans la bouche et l’estomac. En outre, la plupart des graisses consommées par les humains sont déjà émulsionnées (comme les produits laitiers), et dans le cas des nourrissons ou de certaines personnes âgées, c’est la seule forme de consommation. Par conséquent, la conception de produits à base d’émulsion avec des profils de digestion spécifiques est très importante dans la nutrition1. De plus, les émulsions peuvent encapsuler et fournir des nutriments, des médicaments ou des bioactifs lipophiles2 pour lutter contre différentes affections gastro-intestinales telles que l’obésité3, l’enrichissement en nutriments, les allergies alimentaires et les maladies digestives. Dans les émulsions huile-dans-eau, les gouttelettes lipidiques sont entourées de couches interfaciales d’émulsifiants tels que des protéines, des tensioactifs, des polymères, des particules et des mélanges4. Le rôle des émulsifiants est double : stabiliser l’émulsion5 et protéger/transporter le composé encapsulé vers un site spécifique. La réalisation d’une digestibilité adaptée des émulsions dépend de leur composition initiale mais nécessite également de suivre l’évolution continue de cette interface lors du transit dans le tractus gastro-intestinal (Figure 1).
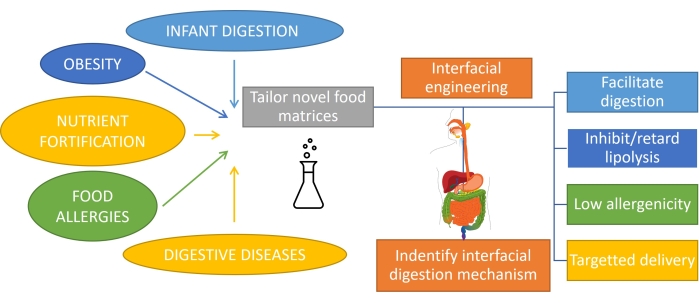
Figure 1: Application de l’ingénierie interfaciale des émulsions pour s’attaquer à certaines des principales affections gastro-intestinales. Veuillez cliquer ici pour voir une version agrandie de cette figure.
La digestion lipidique est finalement un processus interfacial car elle nécessite l’adsorption de lipases (gastriques ou pancréatiques) sur l’interface huile-eau de gouttelettes lipidiques émulsionnées à travers la couche interfaciale pour atteindre et hydrolyser les triglycérides contenus dans l’huile en acides gras libres et monoacylglycérides6. Ceci est schématisé à la figure 2. La lipase gastrique entre en compétition avec la pepsine et les phospholipides dans l’estomac pour l’interface huile-eau (Figure 2, digestion gastrique). Ensuite, la lipase / colipase pancréatique est en concurrence avec la trypsine / chymotrypsine, les phospholipides, les sels biliaires et les produits digestifs dans l’intestin grêle. Les protéases peuvent altérer la couverture interfaciale, empêchant ou favorisant l’adsorption de la lipase, tandis que les sels biliaires sont très actifs en surface et déplacent la majeure partie de l’émulsifiant restant pour favoriser l’adsorption de la lipase (Figure 2, digestion intestinale). Finalement, le taux et l’étendue de la lipolyse dépendent des propriétés interfaciales de l’émulsion digérée initiale / gastrique, telles que l’épaisseur, les connexions inter/ intramoléculaires et les interactions électrostatiques et stériques. En conséquence, le suivi de l’évolution de la couche interfaciale au fur et à mesure de sa digestion offre une plate-forme expérimentale pour identifier les mécanismes et événements interfaciaux affectant l’adsorption de la lipase et, par conséquent, la digestion des lipides.
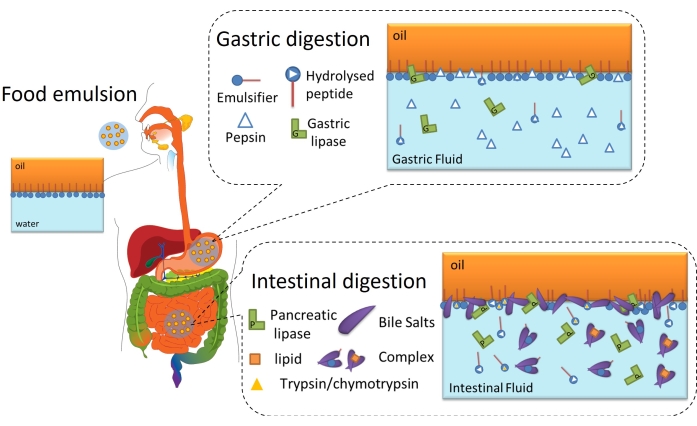
Figure 2 : Schéma illustrant le rôle des interfaces dans la digestion des lipides gastro-intestinaux. L’hydrolyse de la pepsine modifie la composition interfaciale au niveau de la phase gastrique, tandis que la lipase gastrique hydrolyse les triglycérides. Dans l’intestin grêle, la trypsine/chymotrypsine hydrolyse davantage le film interfacial, tandis que la lipolyse procède par l’adsorption des BS/lipases, l’hydrolyse des triglycérides et la désorption des produits lipolytiques par solubilisation dans les micelles/complexes BS. Veuillez cliquer ici pour voir une version agrandie de cette figure.
L’équipement de chute suspendue de l’Université de Grenade (UGR) est mis en œuvre avec une technologie brevetée, le double capillaire coaxial, qui permet l’échange en sous-phase de la solution en vrac7. Le capillaire, qui retient la goutte pendante, consiste en un arrangement de deux capillaires coaxiaux qui sont connectés indépendamment à chaque canal d’un double microinjecteur. Chaque micro-injecteur peut fonctionner indépendamment, ce qui permet l’échange du contenu perdu par fluxtraversant 7. En conséquence, l’échange en sous-phase consiste en l’injection simultanée de la nouvelle solution avec le capillaire interne et l’extraction de la solution globale avec le capillaire externe en utilisant le même débit. Ce processus permet le remplacement de la solution en vrac sans perturbation de la zone interfaciale ou du volume de la gouttelette. Cette procédure a ensuite été mise à niveau vers un échange multi-sous-phase, qui permet jusqu’à huit échanges séquentiels en sous-phase de la solution de masse de gouttelettes8. Cela permet de simuler le processus digestif dans une seule gouttelette aqueuse en suspension dans un milieu lipidique en échangeant séquentiellement la solution en vrac avec des milieux artificiels imitant les différents compartiments (bouche, estomac, intestin grêle). L’ensemble de la configuration est représenté à la figure 3, y compris les détails des composants. Les seringues du micro-injecteur sont reliées aux huit valves vias, chacune étant reliée à un tube microcentrifuge contenant le liquide digestif artificiel avec les composants décrits à la figure 2.

Figure 3 : Vue générale de l’OCTOPUS avec tous les composants. La caméra CCD, le microscope, le micropositionneur, la cellule thermostabilisée et le double capillaire sont connectés indépendamment à un double micro-injecteur avec deux seringues reliées à huit valves vias. Chaque seringue se connecte avec un capillaire, quatre tubes microcentrifugés avec échantillon et une décharge. Veuillez cliquer ici pour voir une version agrandie de cette figure.
La figure 4A montre comment chacun des fluides digestifs artificiels est injecté dans le pendentif goutte à goutte par échange de sous-phase à travers le double capillaire. Chaque composé digestif détaillé à la figure 2 peut être appliqué simultanément/séquentiellement, simulant le passage dans le tractus gastro-intestinal. Les fluides digestifs artificiels contiennent différentes enzymes et biosurfactants, qui modifient la tension interfaciale de l’émulsifiant initial, comme le montre la figure 4B. Le logiciel DINATEN (voir Tableau des matériaux), également développé à l’UGR, enregistre l’évolution de la tension interfaciale en temps réel au fur et à mesure que la couche interfaciale initiale est digérée in vitro. De plus, après chaque phase digestive, l’élasticité dilatationnelle de la couche interfaciale est calculée en imposant des oscillations périodiques de volume / zone interfaciale sur la couche interfaciale stabilisée et en enregistrant la réponse de la tension interfaciale. La période/fréquence et l’amplitude de l’oscillation peuvent être variées, et le traitement d’image avec le logiciel CONTACTO fournit les paramètres rhéologiques dilatationnels8.
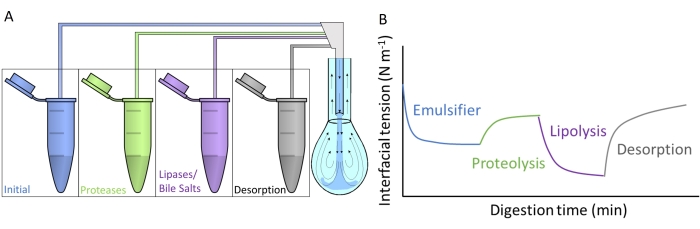
Figure 4 : Exemples de profils de digestion. (A) La couche émulsifiante initiale est soumise à des milieux digestifs artificiels placés dans la microcentrifugeuse par échange séquentiel en sous-phase des différentes solutions dans la goutte pendante. (B) L’évolution générale de la tension interfaciale (axe y) de l’émulsifiant initial en fonction du temps (axe des abscisses) tel qu’il est digéré in vitro par les différentes enzymes/biosurfactants dans les milieux artificiels. Un échange final en sous-phase avec le liquide intestinal ordinaire mesure la désorption des lipides digérés par solubilisation en micelles mixtes. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Cette étude présente le protocole général conçu pour mesurer la digestion in vitro des couches interfaciales avec un équipement de goutte pendentif9. La couche interfaciale initiale est soumise séquentiellement à des conditions imitant le passage dans le tractus gastro-intestinal, comme illustré à la figure 2. Ces différents milieux digestifs sont injectés dans le pendentif goutte à goutte par échange sous-phase des différentes solutions contenues dans les tubes microcentrifugeuses (Figure 4A). La composition de ces milieux peut être personnalisée en fonction des conditions gastro-intestinales qui seront évaluées, à savoir, protéolyse gastrique/intestinale/lipolyse, permettant de mesurer les effets cumulatifs et les sinergies10. Les conditions expérimentales utilisées pour imiter le processus de digestion dans chaque compartiment suivent le protocole de consensus international publié par INFOGEST détaillant le pH et les quantités d’électrolytes et d’enzymes11. Le dispositif expérimental basé sur la goutte pendante permet d’enregistrer la tension interfaciale in situ tout au long du processus de digestion simulé. La rhéologie dilatationnelle de la couche interfaciale est calculée à la fin de chaque étape digestive. De cette façon, chaque émulsifiant offre un profil de digestion illustrant les propriétés des interfaces digérées, comme illustré à la figure 4B. Cela permet d’extraire des conclusions concernant sa susceptibilité ou sa résistance aux différentes étapes du processus digestif. En général, les milieux digestifs artificiels contiennent du pH acide/basique, des électrolytes, des protéases (gastriques et intestinales), des lipases (gastriques et intestinales), des sels biliaires et des phospholipides, qui sont dissous dans leurs liquides digestifs respectifs (gastrique ou intestinal). La figure 4B montre un profil générique de l’évolution de la tension interfaciale d’un émulsifiant, d’abord soumise à une action protéase, puis à des lipases. En général, la protéolyse de la couche interfaciale favorise une augmentation de la tension interfaciale due à la désorption des peptides hydrolysés9,12, tandis que la lipolyse entraîne une réduction très forte de la tension interfaciale due à l’adsorption des sels biliaires et des lipases 13. Un échange final en sous-phase avec le liquide intestinal épuise la solution en vrac de matière non adsorbée/digérée et favorise la désorption des composés solubles et la solubilisation des lipides digérés dans des micelles mixtes. Ceci est quantifié par l’augmentation de la tension interfaciale enregistrée (Figure 4B).
En résumé, la conception expérimentale mise en œuvre dans la goutte pendante pour simuler la digestion in vitro dans une seule gouttelette permet de mesurer les effets cumulatifs et les synergies lorsque le processus de digestion est appliqué séquentiellement à la couche interfaciale initiale10. La composition de chaque milieu digestif peut être facilement ajustée pour tenir compte des particularités des affections digestives, y compris les pathologies gastro-intestinales ou les milieux digestifs infantiles14. Ensuite, l’identification des mécanismes interfaciaux affectant la protéolyse et la lipolyse peut être utilisée pour moduler la digestion par l’ingénierie interfaciale des émulsions. Les résultats obtenus peuvent être appliqués à la conception de nouvelles matrices alimentaires avec des fonctionnalités adaptées telles qu’une faible allergénicité, un apport énergétique contrôlé et une digestibilité réduite 15,16,17,18,19.
Access restricted. Please log in or start a trial to view this content.
Protocole
1. Séquence de nettoyage de toute la verrerie utilisée dans l’expérimentation scientifique des surfaces
- Frottez la verrerie avec une solution de nettoyage concentrée (voir le tableau des matériaux) diluée dans de l’eau (10%).
- Rincer abondamment avec une séquence d’eau du robinet, de propanol, d’eau distillée et d’eau ultrapure. Sécher dans une cabine et conserver dans une armoire fermée jusqu’à utilisation.
2. Préparation des échantillons
- Préparer les milieux digestifs artificiels selon les protocoles normalisés INFOGEST11,20 (voir le tableau des matériaux). Pour plus de détails, voir le tableau 1 et inclure de petites adaptations aux exigences du travail interfacial pour prévenir la contamination tensio-active et la dilution des échantillons (1:10)10.
- Préparez la solution émulsifiante en suivant les étapes ci-dessous.
- Préparer 0,01 L d’une solution concentrée de (1 kg) L−1) émulsifiant ou mélange d’émulsifiants (voir le tableau des matières) dans un tampon initial (tableau 1) et conserver sous agitation légère pendant la nuit.
- Diluer à 0,1 kg· L−1 (ou selon les besoins) pour saturer l’interface; atteindre un pseudo plateau dans la tension interfaciale après 1 h d’adsorption à une zone interfaciale constante suivant le rapport publié précédemment21.
- Conserver sous agitation légère pendant 15 minutes avant utilisation.
- Purifier la phase huileuse.
- Préparez un mélange d’huile végétale (tournesol, olive, trioléine, etc.) et les résines métasilicates de magnésium (voir le tableau des matériaux) dans une proportion de 2:1 p/p dans un grand bécher. Conserver sous agitation mécanique légère pendant au moins 3 h.
- Centrifuger le mélange à 8 000 x g pendant 30 minutes à température ambiante dans une centrifugeuse commerciale (voir le tableau des matières).
- Filtrer le mélange d’huile sous vide à l’aide d’un filtre à seringue (taille des pores de 0,2 μm) (voir le tableau des matières). Conserver dans des bouteilles d’ambre propres scellées et barbotées d’azote jusqu’à utilisation.
3. Calibrage et nettoyage de l’OCTOPUS
- Rincer tous les tubes à l’eau ultrapure en réglant une séquence de nettoyage des seringues et de toutes les valves à travers un capillaire (valves 6/4) et à la sortie externe (valve 8-couleur bleue). Pour ce faire, appuyez sur le bouton Nettoyer dans la boîte de dialogue de gauche (Figure supplémentaire 1A).
- Vérifier la tension superficielle7 de l’eau à température ambiante en formant une gouttelette d’eau et en mesurant en temps réel pendant 5 min (Figure supplémentaire 1B, C).
- Régler la densité différentielle air-eau (0,9982 kg· L−1) dans la boîte de dialogue de gauche, Figure supplémentaire 1B.
- Remplissez la cuvette propre (verre optique) avec 0,002 L d’huile végétale propre et placez-la dans le porte-cuvette de la cellule thermostatique (Figure 3).
- Réglez le thermostat et laissez l’équilibre de la température à 37 °C.
- Vérifiez la tension interfaciale de l’eau-huile à température ambiante7.
- Régler la densité différentielle par rapport à l’huile végétale-eau (huile d’olive: 0,800 kg· L−1) (figure supplémentaire 1C).
- Injecter 40 μL à un débit de 0,5 μL·s−1 et mesurer en temps réel toutes les secondes jusqu’à la fin de l’injection. Il s’agit d’un processus dynamique simple (Figure supplémentaire 1B, D).
- Tracer la tension interfaciale en fonction du volume des gouttelettes dans une fiche technique.
- Vérifiez que la plage de volume des gouttelettes fournit une valeur pour la tension interfaciale indépendante du volume des gouttelettes. Tracer la zone interfaciale en fonction du volume des gouttelettes.
- Programmez un processus comportant deux étapes (figure supplémentaire 1B et figure supplémentaire 2A) en suivant les étapes ci-dessous.
- Avec une seringue interne, injectez un volume contenu dans cette plage de tension interfaciale constante.
- Maintenir la surface interfaciale constante à la valeur sélectionnée à l’étape 3.5.4 et enregistrer la tension interfaciale pendant 5 min7.
4. Programmation d’un processus expérimental dans DINATEN pour chaque étape digestive
REMARQUE : Pour les paramètres de processus, voir la figure supplémentaire 1B.
- Effectuez le contrôle initial.
- Pour la formation de gouttes, injecter 10 μL (±5 μL) de solution émulsifiante dans le capillaire (valve 6) (Figure supplémentaire 2A).
- Enregistrer l’adsorption à une surface interfaciale constante 21 de 20 mm 2 (±10 mm2) pendant 1 h (figure supplémentaire 2B).
- Enregistrer la rhéologie dilatationnelle8 (figure supplémentaire 2C).
- Régler l’amplitude d’oscillation à 1,25 μL, période 10 s.
- Enregistrer l’adsorption à la zone interfaciale sélectionnée (étape 4.1.2) pendant 10 s.
- Répétez l’étape 4.1.3 à différentes périodes : 5 s, 20 s, 50 s et 100 s.
- Enregistrer la digestion gastrique.
- Enregistrer l’adsorption21 à la zone interfaciale sélectionnée pendant 10 s.
- Échange de sous-phase7 avec le liquide dans la valve 2 (sSGF) et les enzymes gastriques (tableau 1) (figure supplémentaire 2D).
- Remplissez la seringue gauche de la valve 2. Injecter 125 μL dans la valve 6-capillaire avec la seringue gauche à 5 μL·s−1.
- Extraire 125 μL du capillaire avec la seringue droite à 5 μL·s−1. Déchargez la seringue droite pour sortir de la valve 8. Répétez les étapes 4.2.2.1-4.2.2.2 10 fois pour assurer un échange complet.
- Enregistrer l’adsorption21 à la zone interfaciale sélectionnée à l’étape 4.1.2 pendant 1 h (figure supplémentaire 2B).
- Enregistrer la rhéologie dilatationnelle8 (figure supplémentaire 2C).
- Régler l’amplitude d’oscillation à 1,25 μL, période 10 s.
- Enregistrer l’adsorption de la zone interfaciale sélectionnée à l’étape 4.1.2 pendant 10 s. Répétez à différentes périodes: 5 s, 20 s, 50 s, 100 s.
- Enregistrer la digestion intestinale.
- Enregistrer l’adsorption21 à la zone interfaciale sélectionnée à l’étape 4.1.2 pendant 10 s (figure supplémentaire 2B).
- Échange de sous-phase7 avec du liquide dans la valve 3 (SIF) et des enzymes intestinales/sels biliaires/phospholipides (tableau 1) (figure supplémentaire 2D).
- Remplissez la seringue gauche de la valve 2. Injecter 125 μL dans la valve 6-capillaire avec la seringue gauche à 5 μL·s−1. Extraire 125 μL du capillaire avec la seringue droite à 5 μL·s−1.
- Déchargez la seringue droite pour sortir de la valve 8. Répétez les étapes 4.3.2.1-4.3.2.2 10 fois pour assurer un échange complet.
- Enregistrer l’adsorption21 à la zone interfaciale sélectionnée à l’étape 4.1.2 pendant 1 h.
- Enregistrer la rhéologie dilatationnelle8 (figure supplémentaire 2C).
- Régler l’amplitude d’oscillation à 1,25 μL, période 10 s.
- Enregistrer l’adsorption à la zone interfaciale sélectionnée à l’étape 4.1.2 pendant 10 s.
- Répétez à différentes périodes: 5 s, 20 s, 50 s, 100 s.
- Notez la désorption en suivant les étapes ci-dessous.
- Enregistrer l’adsorption21 à la zone interfaciale sélectionnée à l’étape 4.1.2 pendant 10 s (figure supplémentaire 2B).
- Échange de sous-phase7 avec liquide dans la vanne 5 (sSIF) (tableau 1, figure supplémentaire 2D).
- Remplissez la seringue gauche de la valve 5. Injecter 125 μL dans la valve 5-capillaire avec la seringue gauche à 5 μL·s−1.
- Extraire 125 μL du capillaire avec la seringue droite à 5 μL·s−1. Déchargez la seringue droite pour sortir de la valve 8. Répétez les étapes 4.4.2.1-4.4.2.2 10 fois pour assurer un échange complet.
- Enregistrer l’adsorption21 à la zone interfaciale sélectionnée à l’étape 4.1.2 pendant 1 h (figure supplémentaire 2B).
- Enregistrer la rhéologie dilatationnelle8 (figure supplémentaire 2C).
- Maintenir l’amplitude de 1,25 μL, période 10 s.
- Enregistrer l’adsorption à la zone interfaciale sélectionnée à l’étape 4.1.2 pendant 10 s.
- Répétez l’étape 4.4.4 à différentes périodes : 5 s, 20 s, 50 s, 100 s.
5. Mise en place de l’expérience
- Remplissez les tubes de microcentrifugation avec le milieu de digestion artificiel et connectez chacun d’eux à la vanne respective par le tube correspondant.
- Remplir le tube dans les vannes 2 à 5 en nettoyant de la vanne 2, de la vanne 3, de la vanne 4 et de la vanne 5 jusqu’à la sortie externe (vanne 8) (figure supplémentaire 1A).
- Remplissez le tuyau dans la vanne 1 en nettoyant de la vanne 1 à la valve 6-capillaire 5 fois.
- Placez le capillaire dans la phase huileuse. Charger la seringue gauche avec la valve 1 (solution initiale, tableau 1).
- Commencez le traitement séquentiel de l’étape 4.1-initiale, de l’étape 4.2-gastrique, de l’étape 4.3-intestins et de l’étape 4.4-désorption, en enregistrant les données à la fin de chaque processus.
6. Calcul des paramètres rhéologiques dilatationnels avec le logiciel de traitement d’image CONTACTO8
REMARQUE : Pour plus de détails, voir Maldonado-Valderrama et coll.8.
- Charger les images correspondant à l’oscillation de surface à une fréquence et une amplitude données (Figure supplémentaire 3A).
- Appuyez sur Rhéologie (Figure supplémentaire 3B) et obtenez les paramètres de dilatation (Figure supplémentaire 3C).
- Copiez-collez les résultats dans la feuille de calcul des données.
7. Tracer les résultats expérimentaux
- Recalculez la colonne de temps dans chacune des étapes du processus de digestion en ajoutant les dernières données de l’heure de l’étape précédente.
- Tracez la tension interfaciale en fonction du temps additif pour chacune des étapes du processus de digestion utilisé.
- Tracer l’élasticité et la viscosité finales de tension interfaciale/dilatation obtenues à la fin de chaque étape par rapport à la phase de digestion : digestion initiale, digestion gastrique, digestion duodénale et désorption.
Access restricted. Please log in or start a trial to view this content.
Résultats
Cette section présente différents exemples de profils de digestion mesurés avec l’OCTOPUS. L’aspect général des correspondances de profils de digestion simulées est illustré à la figure 4B. La tension interfaciale est généralement représentée contre le temps dans le profil de digestion. Les différentes phases/étapes de digestion considérées sont représentées en différentes couleurs. La première phase forme la couche initiale et correspond à la phase d’adsorption de...
Access restricted. Please log in or start a trial to view this content.
Discussion
Cet article décrit un protocole généralisé pour mesurer la digestion in vitro des couches interfaciales à l’aide d’un équipement de chute pendant. Le protocole peut être adapté aux exigences spécifiques de l’expérience en ajustant la composition des tampons digestifs, qui sont basés sur le protocole harmonisé INFOGEST11,20 pour faciliter la comparaison avec la littérature. Les enzymes digestives et les biosurfactants peuvent être ajou...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Les auteurs déclarent qu’ils n’ont pas d’intérêts financiers concurrents connus ou de relations personnelles qui auraient pu influencer le travail rapporté dans cet article.
Remerciements
Cette recherche a été financée par les projets RTI2018-101309-B-C21 et PID2020-631-116615RAI00, financés par MCIN/AEI/10.13039/501100011033 et par « FEDER A way of Making Europe ». Ce travail a été (partiellement) soutenu par le Groupe de Physique des Biocolloïdes et des Fluides (réf. PAI-FQM115) de l’Université de Grenade (Espagne).
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| Alpha-chymotrypsin from bovine pancreas | Sigma-Aldrich | C4129 | Enzyme |
| Beta-lactoglobulin | Sigma-Aldrich | L0130 | Emulsfier |
| Bovine Serum Albumin | Sigma-Aldrich | 9048-46-8 | Emulsfier |
| CaCl2 | Sigma-Aldrich | 10043-52-4 | Electrolyte |
| Centrifuge | Kronton instruments | Centrikon T-124 | For separating oil and resins |
| Citrus pectin | Sigma-Aldrich | P9135 | Emulsfier |
| co-lipase FROM PORCINE PANCREAS | Sigma | C3028 | Enzyme |
| CONTACTO | University of Granada (UGR) | https://core.ugr.es/dinaten/, last access: 07/18/2022 | |
| DINATEN | University of Granada (UGR) | https://core.ugr.es/dinaten/, last access: 07/18/2022 | |
| Gastric lipase | Lipolytech | RGE15-1G | Enzyme |
| Human Serum Albumin | Sigma-Aldrich | 70024-90-7 | Emulsifier |
| INFOGEST | http://www.proteomics.ch/IVD/ | ||
| Lipase from porcine pancreas, type II | Sigma-Aldrich | L33126 | Enzyme |
| Magnesium metasilicate resins | Fluka | 1343-88-0 | Resins to purify oil |
| Micro 90 | International products | M-9051-04 | Cleaner |
| NaCl | Sigma | 7647-14-5 | Electrolyte |
| NaH2PO4 | Scharlau | 10049-21-5 | To prepare buffer |
| OCTOPUS | Producciones Científicas y Técnicas S.L. (Gójar, Spain) | Pendandt Drop Equipment implemented with multi subphase exchange | |
| Olive oil | Sigma-Aldrich | 1514 | oil |
| Pancreatic from porcine pancreas | Sigma | P7545-25 g | Enzyme |
| Pepsin | Sigma-Aldrich | P6887 | Enzyme |
| Pluronic F127 | Sigma | P2443 | Emulsifier |
| Pluronic F68 | Sigma | P1300 | Emulsfier |
| Sodium deoxycholate | Sigma | Bile salts | |
| Sodium glycodeoxycholate | Sigma | C9910 | Bile salts |
| Sodium taurocholate | Sigma | 86339 | Bile salts |
| Syringe Filter | Millex-DP | SLGP033R | Syringe Filter 0.22 µm pore size polyethersulfone |
| Trypsin | Sigma-Aldrich | T1426 | Enzyme |
Références
- McClements, D. J. The biophysics of digestion: Lipids. Current Opinion in Food Science. 21, 1-6 (2018).
- McClements, D. J., Li, Y. Structured emulsion-based delivery systems: Controlling the digestion and release of lipophilic food components. Advances in Colloid and Interface Science. 159 (2), 213-228 (2010).
- Corstens, M. N., et al. Food-grade micro-encapsulation systems that may induce satiety via delayed lipolysis: A review. Critical Reviews in Food Science and Nutrition. 57 (10), 2218-2244 (2017).
- Aguilera-Garrido, A., del Castillo-Santaella, T., Galisteo-González, F., Gálvez-Ruiz, M. J., Maldonado-Valderrama, J. Investigating the role of hyaluronic acid in improving curcumin bioaccessibility from nanoemulsions. Food Chemistry. 351, 129301(2021).
- Rodríguez Patino, J. M., Carrera Sánchez, C., Rodríguez Niño, M. R. Implications of interfacial characteristics of food foaming agents in foam formulations. Advances in Colloid and Interface Science. 140 (2), 95-113 (2008).
- Wilde, P. J., Chu, B. S. Interfacial & colloidal aspects of lipid digestion. Advances in Colloid and Interface Science. 165 (1), 14-22 (2011).
- Cabrerizo-Vílchez, M. A., Wege, H. A., Holgado-Terriza, J. A., Neumann, A. W. Axisymmetric drop shape analysis as penetration Langmuir balance. Review of Scientific Instruments. 70 (5), 2438-2444 (1999).
- Maldonado-Valderrama, J., Muros-Cobos, J. L., Holgado-Terriza, J. A., Cabrerizo-Vílchez, M. A. Bile salts at the air-water interface: Adsorption and desorption. Colloids and surfaces B: Biointerfaces. 120, 176-183 (2014).
- Maldonado-Valderrama, J., Terriza, J. A. H., Torcello-Gómez, A., Cabrerizo-Vílchez, M. A. In vitro digestion of interfacial protein structures. Soft Matter. 9, 1043-1053 (2013).
- Maldonado-Valderrama, J. Probing in vitro digestion at oil-water interfaces. Current Opinion in Colloid and Interface Science. 39, 51-60 (2019).
- Brodkorb, A., et al. INFOGEST static in vitro simulation of gastrointestinal food digestion. Nature Protocols. 14 (4), 991-1014 (2019).
- del Castillo-Santaella, T., Maldonado-Valderrama, J., Molina-Bolivar, J. A., Galisteo-Gonzalez, F. Effect of cross-linker glutaraldehyde on gastric digestion of emulsified albumin. Colloids and Surfaces B: Biointerfaces. 145, 899-905 (2016).
- Macierzanka, A., Torcello-Gómez, A., Jungnickel, C., Maldonado-Valderrama, J. Bile salts in digestion and transport of lipids. Advances in Colloid and Interface Science. 274, 102045(2019).
- Maldonado-Valderrama, J., Torcello-Gómez, A., del Castillo-Santaella, T., Holgado-Terriza, J. A., Cabrerizo-Vílchez, M. A. Subphase exchange experiments with the pendant drop technique. Advances in Colloid and Interface Science. 222, 488-501 (2015).
- Bellesi, F. A., Ruiz-Henestrosa, V. M. P., Maldonado-Valderrama, J., Del Castillo Santaella, T., Pilosof, A. M. R. Comparative interfacial in vitro digestion of protein and polysaccharide oil/water films. Colloids and Surfaces B: Biointerfaces. 161, 547-554 (2018).
- Del Castillo-Santaella, T., Sanmartín, E., Cabrerizo-Vílchez, M. A., Arboleya, J. C., Maldonado-Valderrama, J. Improved digestibility of β-lactoglobulin by pulsed light processing: A dilatational and shear study. Soft Matter. 10 (48), 9702-9714 (2014).
- Infantes-Garcia, M. R., et al. In vitro gastric lipid digestion of emulsions with mixed emulsifiers: Correlation between lipolysis kinetics and interfacial characteristics. Food Hydrocolloids. 128, 107576(2022).
- del Castillo-Santaella, T., Cebrián, R., Maqueda, M., Gálvez-Ruiz, M. J., Maldonado-Valderrama, J. Assessing in vitro digestibility of food biopreservative AS-48. Food Chemistry. 246, 249-257 (2018).
- Torcello-Gómez, A., Maldonado-Valderrama, J., Jódar-Reyes, A. B., Cabrerizo-Vílchez, M. A., Martín-Rodríguez, A. Pluronic-covered oil-water interfaces under simulated duodenal conditions. Food Hydrocolloids. 34, 54-61 (2014).
- Minekus, M., et al. A standardised static in vitro digestion method suitable for food - an international consensus. Food & Function. 5 (6), 1113-1124 (2014).
- Wege, H. A., Holgado-Terriza, J. A., Cabrerizo-Vílchez, M. A. Development of a constant surface pressure penetration langmuir balance based on axisymmetric drop shape analysis. Journal of Colloid and Interface Science. 249 (2), 263-273 (2002).
- del Castillo-Santaella, T., et al. Hyaluronic acid and human/bovine serum albumin shelled nanocapsules: Interaction with mucins and in vitro digestibility of interfacial films. Food Chemistry. 383, 132330(2022).
- Aguilera-Garrido, A., et al. Applications of serum albumins in delivery systems: Differences in interfacial behaviour and interacting abilities with polysaccharides. Advances in Colloid and Interface Science. 290 (5), 102365(2021).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon