Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Quantification expérimentale des interactions entre les systèmes d’administration de médicaments et les cellules in vitro : Guide d’évaluation préclinique de la nanomédecine
Dans cet article
Résumé
Un flux de travail est démontré pour la quantification absolue des interactions médicamenteuses-cellules porteuses à l’aide de la cytométrie en flux afin de permettre une meilleure évaluation rationnelle des nouveaux systèmes d’administration de médicaments. Ce flux de travail s’applique aux transporteurs de médicaments de tout type.
Résumé
Un élément majeur de la conception de systèmes d’administration de médicaments concerne la façon d’amplifier ou d’atténuer les interactions avec des types de cellules spécifiques. Par exemple, une chimiothérapie peut être fonctionnalisée avec un anticorps pour améliorer la liaison aux cellules cancéreuses (« ciblage ») ou fonctionnalisée avec du polyéthylèneglycol pour aider à échapper à la reconnaissance des cellules immunitaires (« furtivité »). Même au niveau cellulaire, l’optimisation de la liaison et de l’absorption d’un vecteur de médicament est un problème de conception biologique complexe. Ainsi, il est utile de séparer la force avec laquelle un nouveau transporteur interagit avec une cellule de l’efficacité fonctionnelle de la cargaison d’un transporteur une fois livrée à cette cellule.
Pour poursuivre l’exemple chimiothérapeutique, « comment il se lie à une cellule cancéreuse » est un problème distinct de « dans quelle mesure il tue une cellule cancéreuse ». Les essais quantitatifs in vitro pour ces derniers sont bien établis et reposent généralement sur la mesure de la viabilité. Cependant, la plupart des recherches publiées sur les interactions cellule-transporteur sont qualitatives ou semi-quantitatives. Généralement, ces mesures reposent sur le marquage fluorescent du support et, par conséquent, rapportent des interactions avec les cellules en unités relatives ou arbitraires. Cependant, ce travail peut être standardisé et rendu absolument quantitatif avec un petit nombre d’expériences de caractérisation. Une telle quantification absolue est précieuse, car elle facilite les comparaisons rationnelles, interclasses et intra-classes de divers systèmes d’administration de médicaments - nanoparticules, microparticules, virus, conjugués anticorps-médicament, cellules thérapeutiques modifiées ou vésicules extracellulaires.
De plus, la quantification est une condition préalable aux méta-analyses ultérieures ou aux approches de modélisation in silico . Dans cet article, des guides vidéo, ainsi qu’un arbre de décision sur la façon de réaliser une quantification in vitro pour les systèmes d’administration de médicaments porteurs, sont présentés, qui prennent en compte les différences de taille de support et de modalité d’étiquetage. En outre, d’autres considérations pour l’évaluation quantitative des systèmes avancés d’administration de médicaments sont discutées. Ceci est destiné à servir de ressource précieuse pour améliorer l’évaluation rationnelle et la conception de la prochaine génération de médecine.
Introduction
La conception de constructions d’administration de médicaments qui présentent un comportement spécifique et conçu en fonction du type de cellule qu’elles rencontrent a suscité un intérêt considérable de la recherche. Les constructions potentielles d’administration de médicaments ou « porteurs » comprennent les formulations lipidiques, les inorganiques nanocultivés, les assemblages polymères, les vésicules extracellulaires, les cellules bactériennes fonctionnalisées ou les virus modifiés. Tous ces éléments peuvent présenter une spécificité d’organe, de tissu ou de cellule en raison de propriétés physiques, de propriétés de surface ou de fonctionnalisations chimiques modifiées telles que la fixation d’anticorps 1,2.
Une étape presque omniprésente dans l’évaluation in vitro des porteurs consiste à incuber des cellules avec une suspension contenant ledit porteur chargé de médicament. Après l’incubation, la performance du transporteur est mesurée par une lecture fonctionnelle de la performance de la cargaison de drogue, par exemple, l’efficacité de la transfection ou la toxicité. Les lectures fonctionnelles sont utiles, car elles constituent une mesure en aval de l’efficacité des porteurs. Cependant, pour les constructions d’administration de médicaments plus complexes, il est de plus en plus important d’aller au-delà des lectures fonctionnelles et de quantifier séparément le degré d’interaction du porteur avec la cellule d’intérêt. Il y a plusieurs raisons à cela.
Tout d’abord, il y a un intérêt croissant pour la découverte (et l’amélioration itérative) des technologies de porte-avions « plates-formes », qui peuvent transporter une variété de marchandises. Par exemple, les nanoparticules lipidiques (LNP) conçues pour encapsuler l’ARN peuvent échanger une séquence d’ARN contre une autre avec quelques mises en garde3. Ainsi, pour améliorer de manière itérative la technologie du transporteur, il est essentiel de quantifier ses performances indépendamment de la fonctionnalité de fret. Deuxièmement, les lectures fonctionnelles peuvent ne pas être simples pour la cargaison d’intérêt, ce qui compromet la capacité d’itérer et d’évaluer rapidement les formulations des transporteurs. Alors que l’on pourrait effectuer une optimisation in vitro en utilisant un modèle de cargaison avec une lecture fonctionnelle simple (par exemple, la fluorescence), le changement de la cargaison peut modifier la réponse biologique à un transporteur4 et peut donc ne pas donner de résultats représentatifs. Troisièmement, de nombreux porteurs sont conçus pour interagir avec un type de cellule spécifique et être absorbés par celui-ci. Cette capacité de ciblage d’un transporteur peut et doit être différenciée de l’exécution de son ciblage thérapeutique de poste de chargement. Pour continuer l’exemple de la LNP, une cargaison d’ARN peut être extrêmement puissante, mais si la LNP est incapable de se lier à la cellule, d’être internalisée et de libérer l’ARN, aucun effet fonctionnel en aval ne sera observé. Cela peut être un problème en particulier pour les porteurs destinés à cibler les types de cellules difficiles à transfecter, tels que les cellules T5. Inversement, une LNP pourrait cibler extrêmement efficacement, mais la cargaison d’ARN pourrait ne pas fonctionner. Un test en aval qui ne mesure que la fonctionnalité du fret ne sera pas en mesure de différencier ces deux situations, ce qui compliquera le développement et l’optimisation des systèmes d’administration de médicaments des transporteurs.
Dans ce travail, comment quantifier absolument l’association de transporteurs est discuté. L’association est un terme qui fait référence au degré d’interaction mesuré expérimentalement entre un porteur et une cellule. L’association ne fait pas la différence entre la liaison membranaire et l’internalisation - un transporteur peut être associé parce qu’il est lié à la surface de la cellule ou parce que la cellule l’a internalisée. L’association est généralement mesurée dans le cadre d’expériences d’incubation de porteurs cellulaires. Historiquement, l’association a été rapportée soit dans des unités fluorescentes arbitraires (généralement « intensité de fluorescence médiane » ou MFI), soit sous forme de « pourcentage d’association », des mesures dont les limites ont été discutéesprécédemment 6. En bref, ces mesures ne sont pas comparables entre les expériences, les laboratoires et les transporteurs de médicaments en raison des différences dans les protocoles expérimentaux, les paramètres du cytomètre en flux et les intensités de marquage des différents supports. Des efforts ont été faits pour surmonter le premier en calibrant le cytomètre, convertissant ainsi la mesure relative de l’IMF en une mesure absolument quantitative de la fluorescence7. Cependant, cette méthode ne tient pas compte de la variabilité de l’intensité de marquage des différents porteurs et, par conséquent, ne permet pas la comparaison rationnelle des performances de divers porteurs dans une cellule cible de choix8.
Ici, la façon de convertir pratiquement des unités fluorescentes relatives et arbitraires à la métrique quantitative absolue du « nombre de porteurs par cellule » est démontrée en effectuant un petit nombre d’expériences de caractérisation supplémentaires. Si une autre mesure de la concentration de la porteuse est souhaitée (p. ex., masse porteuse par pile ou volume porteur par cellule), il est facile de convertir à partir de porteuses par cellule, à condition que la caractérisation de la porteuse ait été effectuée. Par souci de concision et pour éviter le jargon, le mot « porteur » est utilisé dans ce travail pour désigner le vaste assortiment de constructions d’administration de médicaments. Ces techniques de quantification sont également applicables, qu’elles soient appliquées à une particule d’or nano-modifiée ou à une bactérie bio-modifiée.
Quelques faits permettent la conversion d’unités fluorescentes arbitraires en porteurs par cellule. Premièrement, l’intensité de fluorescence mesurée est proportionnelle à la concentration d’un fluorophore9 (ou d’un support marqué par fluorescence), en supposant que la fluorescence est dans les limites de détection de l’instrument et que les réglages de l’instrumentation sont les mêmes. Ainsi, si la fluorescence d’un porteur et la fluorescence d’un échantillon sont connues, on peut déterminer combien de porteurs sont présents dans cet échantillon si toutes les mesures ont été effectuées dans les mêmes paramètres et conditions. Cependant, en particulier pour les petits porteurs, il peut ne pas être possible de mesurer la fluorescence des porteuses, l’autofluorescence cellulaire et la fluorescence des cellules associées aux porteuses sur le même instrument avec les mêmes réglages. Dans ce cas, il existe une deuxième exigence pour permettre la conversion entre la fluorescence mesurée sur un instrument et la fluorescence mesurée sur un autre. Pour ce faire, une courbe standard de concentration en fluorophore peut être établie pour mesurer l’intensité de fluorescence sur les deux instruments, en tirant parti de la norme MESF (Molecules of Equivalent Soluble Fluorochrome)9. Cela permet ensuite de mesurer la fluorescence des porteurs en vrac sur un non-cytomètre, une mesure qui peut être effectuée sur des porteurs de toute taille ou caractéristique. Lorsqu’une telle quantification globale est effectuée sur une suspension de support de concentration connue, le nombre de porteurs par cellule d’un échantillon peut, encore une fois, être calculé.
Bien que ce travail démontre le processus de mesure de l’association des porteurs (telle que déterminée par l’intensité de fluorescence mesurée), un protocole analogue pourrait être effectué pour d’autres mesures de l’interaction cellule-porteur (par exemple, un protocole expérimental qui différencie les porteurs internalisés et liés à la membrane). De plus, ce protocole serait en grande partie le même si l’association était mesurée par un test non fluorescent (par exemple, par cytométrie de masse).
Protocole
1. Choisir le flux approprié
- Suivez l’arbre de décision décrit à la figure 1 pour déterminer le meilleur flux de travail (flux) (Figure 2) pour la configuration expérimentale utilisée. Reportez-vous à la discussion pour d’autres commentaires sur ce choix de filière.
- Si vous suivez le flux du cytomètre, passez aux étapes 2.1.1-2.2.7. Si vous suivez le flux en bloc, passez aux étapes 3.1.1.1-3.1.5.7.
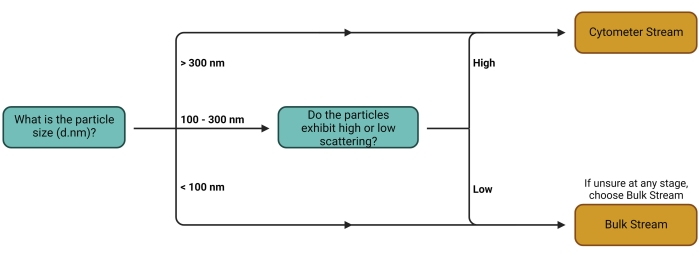
Figure 1 : Arbre de décision Workstream. La décision quant au flux à utiliser dépend principalement du type d’intérêt du transporteur. Les porteurs plus grands et les porteurs ayant des propriétés de diffusion élevées peuvent plus facilement être détectés individuellement sur les cytomètres, ce qui les rend aptes à la quantification à l’aide du flux de cytomètres. Le Bulk Stream convient à tous les autres types de transporteurs. Veuillez cliquer ici pour voir une version agrandie de cette figure.
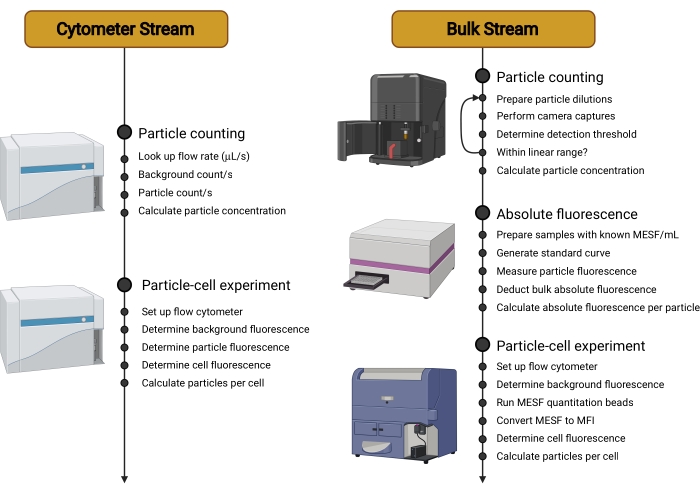
Figure 2 : Vue d’ensemble des axes de travail. Ce protocole est divisé en deux flux différents. Le flux de cytomètres utilise un cytomètre sensible pour compter les porteurs en suspension, mesurer leur fluorescence individuelle, puis déterminer la fluorescence des cellules incubées avec des porteurs. Le flux en vrac utilise des techniques non basées sur la cytométrie, telles que l’analyse de suivi des nanoparticules, pour compter les porteurs en suspension. La fluorescence de la porteuse individuelle est ensuite quantifiée à l’aide d’un lecteur de microplaques ou d’un spectrofluoromètre. L’utilisation du cytomètre en flux est donc limitée à la mesure de la fluorescence finale des cellules incubées avec des supports, une mesure qui peut être effectuée sur une gamme plus large de cytomètres et qui est indépendante du type de porteur utilisé. Abréviations : MESF = molécules de fluorochrome soluble équivalent; MFI = intensité médiane de fluorescence. Veuillez cliquer ici pour voir une version agrandie de cette figure.
2. Le flux de cytomètres
- Comptage des porteurs
NOTE: N’importe quel cytomètre de flux peut être utilisé pour cette mesure, à condition que le débit (μL / s) soit connu. Si le débit est inconnu et ne peut être déterminé, ne poursuivez pas cette étape. Au lieu de cela, passez à l’étape 3.1. Le comptage des porteurs en suspension permet une détermination précise et reproductible du nombre de porteurs incubés dans chaque expérience cellulaire.- Configurez le cytomètre pour détecter les porteurs, à la fois par un canal de diffusion optique (généralement la diffusion latérale [SSC]) et par fluorescence. Assurez-vous d’ajuster le seuil pour permettre la détection des porteurs.
REMARQUE : Une itération à travers différents canaux de diffusion optique peut être nécessaire si SSC ne fournit pas un signal clair (p. ex., diffusion vers l’avant [FSC]). - Effectuer un échantillon contenant uniquement des diluants pour quantifier le nombre d’événements de fond dans les canaux SSC et fluorescents.
REMARQUE: Le nombre idéal d’événements en arrière-plan est de < 100 événements / s. - Préparer les porteurs à la cytométrie en flux.
- Assurez-vous que les supports sont bien suspendus par vortex ou sonication, selon le système de support impliqué.
- Si possible, assurez-vous que la concentration de vecteurs se situe entre 1 000 porteurs/μL et 10 000 porteurs/μL. Un nombre d’événements d’un à deux ordres de grandeur supérieur à l’arrière-plan est un bon début. Si l’ordre de grandeur de la concentration du porteur est inconnu, un bon début consiste à préparer une dilution de 1:1 000 à partir du stock. Utiliser les résultats initiaux comme rétroaction pour éclairer les futures dilutions d’échantillons.
NOTE: Une suspension trouble est généralement trop concentrée.
- Chargez le premier échantillon porteur sur le cytomètre et commencez l’enregistrement.
- Comparer le nombre d’événements résultant à la fois des canaux de SSC et de fluorescence; Ceux-ci devraient être approximativement égaux (différence de <10%). Si ce n’est pas le cas, vérifiez les paramètres du cytomètre, par exemple les réglages du tube photomultiplicateur (PMT) et l’intensité du laser pour le canal fluorescent. Sinon, utilisez d’autres méthodes telles que la microscopie confocale pour valider que le marquage fluorescent des supports est présent et uniforme.
- Répéter les étapes 2.1.3 à 2.1.5 deux fois ou plus avec des dilutions différentes de celles du stock. Assurez-vous que le nombre d’événements dans chaque échantillon est supérieur d’au moins un ordre de grandeur au nombre d’événements de fond.
- Vérifier que trois échantillons ou plus présentent une tendance linéaire, c’est-à-dire qu’une dilution de l’échantillon à deux reprises devrait entraîner une réduction correspondante de la concentration du support mesurée.
- Utiliser les échantillons dans la plage linéaire, les facteurs de dilution correspondants et le débit connu du cytomètre pour calculer la concentration du porteur de stock selon l’équation (1):
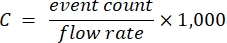 (1)
(1)
où C est la concentration du porteur de stock dans les supports/mL. Il est recommandé d’utiliser le nombre d’événements dérivé de la détection de diffusion optique plutôt que la fluorescence.
- Configurez le cytomètre pour détecter les porteurs, à la fois par un canal de diffusion optique (généralement la diffusion latérale [SSC]) et par fluorescence. Assurez-vous d’ajuster le seuil pour permettre la détection des porteurs.
- Lecture par cytométrie en flux de l’expérience sur les cellules porteuses, y compris la détermination de l’intensité de fluorescence par porteur
NOTE: Idéalement, l’intensité fluorescente par porteur sera déterminée aussi près que possible de l’expérience de cellule porteuse. Il s’agit de s’assurer que les IMF obtenues pour les porteurs individuels peuvent être directement comparées aux IFM des cellules associées aux porteurs. En pratique, un cytomètre génère généralement des résultats similaires lorsqu’il est utilisé pendant des jours consécutifs en utilisant les mêmes tensions PMT, mais cela ne peut être garanti.- Concevoir l’expérience de cellule porteuse. Utiliser la concentration de porteur déterminée à l’étape 2.1 pour administrer la dose désirée de porteurs.
- Configurez le cytomètre en flux pour l’expérience finale de cellule porteuse en déterminant les réglages optimaux de tension PMT dans les canaux appropriés. Définissez les seuils pour permettre la détection des opérateurs.
- Exécutez les porteuses en suspension pour déterminer l’intensité de fluorescence par porteuse dans les réglages PMT actuels.
- Si nécessaire, modifiez les seuils du cytomètre pour détecter les cellules et non les porteurs.
- Exécuter un échantillon témoin négatif - cellules non incubées avec des porteurs - pour déterminer la fluorescence de fond (autofluorescence) des cellules.
- Exécutez les échantillons de cellules porteuses pour déterminer l’intensité de fluorescence par cellule. Cette fluorescence est une combinaison linéaire de l’autofluorescence cellulaire et de la présence de porteurs fluorescents.
- Calculez le nombre de porteurs par cellule à l’aide de l’équation suivante (2) :
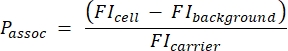 (2)
(2)
où Passoc est le nombre de porteurs associés par cellule, cellule FI est l’IMF des cellules incubées avec des porteurs, FI fond est l’IMF des cellules non incubées avec des porteurs, et FItransporteur est l’IMF des porteurs en suspension.
3. Le flux en vrac
- Comptage des porteurs : analyse de suivi des nanoparticules
NOTA: Dans le flux en vrac, le comptage des porteurs est une étape nécessaire pour quantifier l’intensité absolue de fluorescence par transporteur (voir l’étape 3.1.4). De plus, le comptage des porteurs en suspension permet de déterminer avec précision et reproductibilité le nombre de porteurs incubés dans chaque expérience cellulaire.- Préparation
- Montez la cellule d’écoulement sur le module laser et verrouillez l’ensemble du module laser en place à l’intérieur de l’instrument.
- Rincer lentement (pas plus vite que 0,1 mL/s) la cellule d’écoulement avec ~1 mL d’eau distillée. Si des bulles se forment à l’intérieur de la cellule d’écoulement, rétractez partiellement la suspension pour fusionner la bulle avec l’interface air-liquide avant de continuer.
- Démarrez la caméra à peu près à mi-chemin du rinçage; Assurez-vous de confirmer que les débris du support sont emportés. Sélectionnez Capture pour ouvrir l’onglet Paramètres de capture et cliquez sur Démarrer la caméra.
- Sécher le système avec 1 mL d’air. Si des supports statiques sont visibles à l’écran, nettoyez la cellule d’écoulement conformément aux instructions du fabricant.
- Préparez les supports à l’analyse de suivi des nanoparticules en vous assurant que les porteurs sont bien suspendus par vortex ou sonication, selon le système de support impliqué. Si l’ordre de grandeur de la concentration du stock est inconnu, préparer une dilution de 1:100 à partir du stock et utiliser les résultats initiaux comme rétroaction pour éclairer les futures dilutions de l’échantillon. Diluer les supports dans de l’eau et non dans une solution saline tamponnée au phosphate (PBS) pour préparer au moins ~0,6-1 mL de chaque échantillon avec une concentration de support comprise entre 1 × 107 supports/mL et 1 × 109 supports/mL.
NOTE: Une suspension trouble est généralement trop concentrée. Les tampons et les sels peuvent générer un bruit de fond élevé.
- Mesure
- Retirez le module laser et placez-le à la verticale.
- Prélever le premier échantillon porteur dans une seringue de 1 mL. Fixez la seringue à l’entrée du tube et chargez soigneusement l’échantillon dans la cellule d’écoulement. Si des bulles se forment à l’intérieur de la cellule d’écoulement, rétractez partiellement la suspension pour fusionner la bulle avec l’interface air-liquide avant de continuer. Assurez-vous que toute la cellule d’écoulement est remplie de liquide, puis faites une pause.
- Ajustez la mise au point de la caméra si nécessaire pour visualiser les supports individuels. Effectuez des réglages de mise au point grossiers avec le bouton rotatif situé sur le côté droit de l’instrument. Effectuez des réglages plus fins en sélectionnant l’onglet Matériel | Pompes/Stage. Modifiez la mise au point en ajustant le curseur Focus .
- Ajustez le niveau de la caméra pour vous assurer qu’il n’y a pas de sursaturation. Dans l’onglet Capture , sélectionnez le niveau optimal de la caméra en ajustant le curseur.
- Si l’instrument est équipé de cet accessoire, chargez la seringue contenant l’échantillon porteur dans la pompe à seringue pour assurer un débit continu de l’échantillon pendant les mesures.
- Sous l’onglet SOP , sélectionnez Mesure standard pour effectuer cinq captures de 30 s chacune. Entrez le nom du fichier de base et, si vous le souhaitez, ajoutez des informations d’exemple supplémentaires en cliquant sur le bouton Avancé (ce qui ouvre une boîte de dialogue modale avec une variété de choix).
NOTA: Si un facteur de dilution est saisi, la mesure finale de la concentration du porteur sera ajustée automatiquement par le logiciel. Il est déconseillé d’entrer ce facteur. Au lieu de cela, effectuer le réglage manuellement, ce qui facilite l’analyse et permet d’évaluer si chaque dilution se situe dans la plage dynamique de l’instrument (étape 3.1.3.4). - Appuyez sur Créer et exécuter le script et attendez qu’une fenêtre contextuelle apparaisse vous demandant d’obtenir un échantillon s’il vous plaît avancer.
- Si vous utilisez la pompe à seringues, sélectionnez l’onglet Matériel | Onglet Pompe à seringue | régler le débit de perfusion à 30-80 et appuyer sur Infuser. Si vous n’utilisez pas la pompe à seringues, avancez manuellement l’échantillon.
- Dans la fenêtre contextuelle, sélectionnez OK pour lancer la capture. Après chacune des cinq captures, lorsque la fenêtre contextuelle Please advance sample réapparaît, vérifiez que l’échantillon se déplace toujours dans la cellule d’écoulement, manuellement ou via la pompe à seringue. Ensuite, sélectionnez OK pour procéder à la capture suivante.
REMARQUE: Après cinq captures, le logiciel ouvre automatiquement l’onglet Processus et ouvre une fenêtre contextuelle vous demandant d’ajuster les paramètres du processus.
- Analyse
- Dans l’onglet Processus , réglez le curseur Seuil de détection (entre 4 et 8) pour identifier correctement les transporteurs distincts visibles à l’écran. Ajustez également le gain d’écran pour faciliter la visualisation; Cela n’affectera pas l’analyse en aval. Utilisez le curseur sous l’écran de capture pour faire défiler plusieurs images de la vidéo afin de faciliter le réglage du seuil de détection.
NOTA : Le seuil de détection doit être fixé une fois et, par la suite, ne doit pas être modifié entre les mesures ou les échantillons. - Dans la fenêtre contextuelle (remarque après l’étape 3.1.2.9), appuyez sur OK pour lancer l’analyse de suivi. Suivez l’avancement de l’analyse en cliquant sur l’onglet Analyse | Onglet Analyse unique .
- Une fois l’analyse terminée, recherchez une invite Paramètres d’exportation qui s’affiche, dans laquelle Inclure PDF et Inclure le résumé de l’expérience doivent être sélectionnés par défaut. Sélectionnez les autres formats d’exportation souhaités.
- Dans la section Résultats de l’exportation des données PDF, pour vous assurer que la concentration mesurée est fiable, vérifiez que la concentration mesurée dans le support est comprise entre 1 × 107 porteuses/ml et 1 × 109 porteuses/ml - la plage dynamique de l’instrument - et vérifiez s’il y a des messages d’erreur ou des messages de mise en garde sous le résultat de la mesure de la concentration.
- Répéter les étapes 3.1.2.1 à 3.1.3.4 deux fois ou plus avec des dilutions différentes de celles du stock. Assurez-vous que la concentration de chaque échantillon se situe dans la plage linéaire de l’instrument.
- Sélectionner trois échantillons ou plus qui montrent une tendance linéaire, c’est-à-dire qu’une dilution de l’échantillon à deux fois devrait entraîner une réduction correspondante de deux fois de la concentration mesurée dans le support. Utiliser les échantillons sélectionnés et les facteurs de dilution correspondants pour calculer la concentration du porte-stock.
- Dans l’onglet Processus , réglez le curseur Seuil de détection (entre 4 et 8) pour identifier correctement les transporteurs distincts visibles à l’écran. Ajustez également le gain d’écran pour faciliter la visualisation; Cela n’affectera pas l’analyse en aval. Utilisez le curseur sous l’écran de capture pour faire défiler plusieurs images de la vidéo afin de faciliter le réglage du seuil de détection.
- Détermination de l’intensité absolue de fluorescence par porteur
NOTE: Étant donné que la fluorescence des porteurs individuels dans ce flux ne peut pas être caractérisée directement, l’intensité de fluorescence est quantifiée en vrac. Cette méthode repose sur le fait que l’intensité de fluorescence est linéairement liée à la concentration en fluorochrome selon la loi Lambert-Beer. Lorsqu’une telle quantification en vrac des supports en suspension est effectuée sur une suspension dont la concentration de support est connue (voir étape 3.1), la fluorescence par support peut être dérivée. Cette étape peut être effectuée sur un lecteur de plaque de fluorescence ou un spectrofluoromètre. L’intensité de fluorescence est comparée à une courbe standard d’échantillons avec fluorescence absolue connue, donnée en nombre de MESF.- Utiliser une solution de fluorochrome libre pour marquer le support: remettre le colorant en suspension dans le tampon approprié (par exemple, DMSO) et effectuer d’autres dilutions dans le même tampon que le diluant porteur. Alternativement, utiliser une solution d’anticorps conjugué au fluorochrome. Calculer la concentration de la solution mère (MESF/mL) à partir de la concentration en mg/mL, du poids moléculaire en mg/mole et du nombre d’Avogadro à l’aide de l’équation (3). Effectuer une dilution en série dans le diluant porteur pour générer des échantillons de courbe standard.
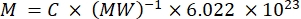 (3)
(3)
REMARQUE : N’utilisez un anticorps conjugué au fluorochrome que si le degré de marquage, c’est-à-dire le rapport molaire entre le fluorochrome et l’anticorps dans la solution, est connu. Dans un premier temps, générez une courbe standard avec une large plage, car l’intensité de fluorescence de l’échantillon porteur est encore inconnue. À partir de là, réduisez-le pour inclure la plage requise. - Préparez les échantillons de support.
NOTA: La meilleure pratique consiste à tester deux dilutions porteuses ou plus pour valider que les mesures sont linéaires et se situent dans l’intervalle de la courbe étalon. - Mesurer la fluorescence de volumes égaux de chaque échantillon, c’est-à-dire les courbes porteuse et standard.
- Générer une courbe standard et déduire l’intensité absolue de fluorescence en MESF/mL pour les échantillons porteurs mesurés.
- Calculer l’intensité absolue de fluorescence par support (MESF/porteur) en divisant la fluorescence globale (MESF/mL) par la concentration du porteur (supports/mL) comme dans l’équation (4) :
 (4)
(4)
- Utiliser une solution de fluorochrome libre pour marquer le support: remettre le colorant en suspension dans le tampon approprié (par exemple, DMSO) et effectuer d’autres dilutions dans le même tampon que le diluant porteur. Alternativement, utiliser une solution d’anticorps conjugué au fluorochrome. Calculer la concentration de la solution mère (MESF/mL) à partir de la concentration en mg/mL, du poids moléculaire en mg/mole et du nombre d’Avogadro à l’aide de l’équation (3). Effectuer une dilution en série dans le diluant porteur pour générer des échantillons de courbe standard.
- Expérience cellulaire (y compris la détermination de l’intensité de fluorescence équivalente par porteur)
NOTE: Dans cette étape, les billes de quantification de cytométrie en flux sont utilisées pour générer une courbe standard de la relation entre MESF et MFI. Ces billes de quantification sont constituées de plusieurs populations de billes avec un nombre connu de MESF par bille, et ces billes individuelles peuvent être détectées par n’importe quel cytomètre. Idéalement, la courbe standard MESF est déterminée en même temps que la lecture des expériences sur les cellules porteuses. Il s’agit de s’assurer que les valeurs d’IMF calculées pour les porteurs individuels peuvent être directement comparées à l’IMF des cellules associées aux porteurs. En pratique, un cytomètre génère généralement des résultats similaires lorsqu’il est utilisé pendant des jours consécutifs en utilisant les mêmes tensions PMT, mais cela ne peut être garanti.- Concevoir l’expérience de cellule porteuse. Utiliser la concentration de porteur déterminée à la section 3.1.3 pour administrer la dose désirée de porteurs.
- Configurez le cytomètre en flux pour l’expérience finale de cellule porteuse en déterminant les réglages optimaux de tension PMT dans les canaux appropriés.
- Exécuter un échantillon témoin négatif, c’est-à-dire des cellules non incubées avec des supports, pour déterminer la fluorescence de fond.
- Préparer et remettre en suspension les billes de quantification de cytométrie en flux. Utilisez le même tampon que celui utilisé pour les échantillons de cellules (p. ex., PBS). Si les populations de perles sont fournies séparément, regroupez-les.
- Exécutez l’échantillon de bille de quantification de cytométrie en flux.
- Exécutez les échantillons de cellules porteuses pour déterminer l’intensité de fluorescence par cellule.
- Utilisez l’échantillon de billes de quantification pour générer une courbe standard convertissant l’intensité de fluorescence absolue (MESF) en MFI. Utilisez cette courbe standard et les résultats de l’étape 3.1.4 pour calculer l’IMF théorique des transporteurs. Calculer le nombre de porteurs par cellule à l’aide de l’équation (5) :
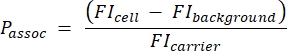 (5)
(5)
Où Passoc est le nombre de porteurs associés par cellule, cellule FI est l’IMF des cellules incubées avec des porteurs, FI fond est l’IMF des cellules non incubées avec des porteurs, et FItransporteur est l’IMF calculée des porteurs en suspension (étape 3.1.4).
- Préparation
Résultats
Comme discuté précédemment, différents types de transporteurs de médicaments nécessitent l’utilisation de différentes techniques pour la quantification absolue de l’association cellule-porteur. Par exemple, les particules de noyau stabilisé en poly(acide méthacrylique) (PMASH) stabilisé au disulfure de 633 nm sont suffisamment grandes et denses pour être détectées à l’aide d’un cytomètre en flux sensible. Ainsi, ces particules ont été marquées par fluorescence, puis fermées et compt?...
Discussion
La caractérisation des interactions entre les transporteurs de médicaments et les cellules devient de plus en plus importante dans le développement de nouveaux systèmes d’administration de médicaments. Plus précisément, pour permettre l’évaluation rationnelle et la comparaison de diverses constructions de porteurs, il est essentiel de quantifier la performance de ce transporteur pour interagir avec les cellules cibles et hors cible. Ce protocole décrit une méthodologie à deux volets qui permet à tout cher...
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à divulguer.
Remerciements
Ce travail a été soutenu par l’Australian National Health and Medical Research Council (NHMRC; Subvention de programme no GNT1149990), l’Australian Centre for HIV and Hepatitis Virology Research (ACH2), ainsi qu’un don de la succession de Réjane Louise Langlois. F.C. reconnaît l’attribution d’une bourse de recherche principale principale du National Health and Medical Research Council (NHMRC) (GNT1135806). Les figures 1 et 2 ont été créées avec BioRender.com.
matériels
| Name | Company | Catalog Number | Comments |
| Alexa Fluor 647 C2 Maleimide | Invitrogen | A20347 | pH-stable dye used to label 150 nm, 235 nm, or 633 nm PMASH carriers; example of good dye to use in cell-carrier association studies |
| Apogee A50 Microflow | Apogee | Sensitive flow cytometer capable of detecting small carriers for counting | |
| CytoFLEX S Flow Cytometer | Beckman Coulter | Sensitive flow cytometer capable of detecting small carriers for counting and read out for final cell-barrier experiments | |
| FCS Express | De Novo Software | Software used to analyze flow cytometry data, i.e., perform gating and derive median fluorescence intensity values of populations of choice. Alternatives include FlowJo, OMIQ, Python | |
| Infinite 200 PRO | Tecan Lifesciences | Standard microplate reader instrument used for bulk fluorescence measurements of carriers in solution | |
| LSRFortessa Cell Analyzer | BD Biosciences | Less sensitive flow cytometer, but one more generally available to researchers. Can be used to read out final cell-carrier experiment | |
| NanoSight NS300 | Malvern Panalytical | Instrument used for Nanoparticle Tracking Analysis | |
| Prism 8 | GraphPad | Software used to graph and calculate standard curves. Alternatives include Microsoft Excel, Origin, Minitab, Python amongst many others | |
| Quantum MESF kits Alexa Fluor 647 | Bangs Laboratories | 647 | Absolute quantitation beads for flow cytometery. Used to convert fluorescence intensities measured in bulk on a microplate reader to fluorescence intensities measured on a flow cytometer using the MESF standard |
Références
- Conde, J., et al. Revisiting 30 years of biofunctionalization and surface chemistry of inorganic nanoparticles for nanomedicine. Frontiers in Chemistry. 2, 48 (2014).
- Cheng, Q., et al. Selective ORgan Targeting (SORT) nanoparticles for tissue specific mRNA delivery and CRISPR/Cas gene editing. Nature Nanotechnology. 15 (4), 313-320 (2020).
- Jackson, N. A. C., Kester, K. E., Casimiro, D., Gurunathan, S., DeRosa, F. The promise of mRNA vaccines: A biotech and industrial perspective. npj Vaccines. 5 (1), 1-6 (2020).
- Press, A. T., et al. Cargo-carrier interactions significantly contribute to micellar conformation and biodistribution. NPG Asia Materials. 9 (10), 444 (2017).
- Cevaal, P. M., et al. In vivo T cell-targeting nanoparticle drug delivery systems: Considerations for rational design. ACS Nano. 15 (3), 3736-3753 (2021).
- Faria, M., Johnston, S. T., Mitchell, A. J., Crampin, E., Caruso, F. Bio-nano science: Better metrics would accelerate progress. Chemistry of Materials. 33 (19), 7613-7619 (2021).
- Shin, H., Kwak, M., Geol Lee, T., Youn Lee, J. Quantifying the level of nanoparticle uptake in mammalian cells using flow cytometry. Nanoscale. 12 (29), 15743-15751 (2020).
- Lozano-Andrés, E., et al. Considerations for MESF-bead based assignment of absolute fluorescence values to nanoparticles and extracellular vesicles by flow cytometry. bioRxiv. , (2021).
- Schwartz, A., et al. Formalization of the MESF unit of fluorescence intensity. Cytometry. Part B, Clinical Cytometry. 57 (1), 1-6 (2004).
- Faria, M., et al. Revisiting cell-particle association in vitro: A quantitative method to compare particle performance. Journal of Controlled Release. 307, 355-367 (2019).
- Chen, A. K., Cheng, Z., Behlke, M. A., Tsourkas, A. Assessing the sensitivity of commercially available fluorophores to the intracellular environment. Analytical Chemistry. 80 (19), 7437-7444 (2008).
- Comfort, N., et al. Nanoparticle tracking analysis for the quantification and size determination of extracellular vesicles. Journal of Visualized Experiments. (169), e62447 (2021).
- Cui, J., et al. Immobilized particle imaging for quantification of nano- and microparticles. Langmuir. 32 (14), 3532-3540 (2016).
- Shang, J., Gao, X. Nanoparticle counting: Towards accurate determination of the molar concentration. Chemical Society Reviews. 43 (21), 7267-7278 (2014).
- Thomas, D. G., et al. ISD3: A particokinetic model for predicting the combined effects of particle sedimentation, diffusion and dissolution on cellular dosimetry for in vitro systems. Particle and Fibre Toxicology. 15 (1), 6 (2018).
- Johnston, S. T., Faria, M., Crampin, E. J. Isolating the sources of heterogeneity in nano-engineered particle-cell interactions. The Journal of the Royal Society Interface. 17 (166), 20200221 (2020).
- Ahmed-Cox, A., et al. Spatio-temporal analysis of nanoparticles in live tumor spheroids impacted by cell origin and density. Journal of Controlled Release. 341, 661-675 (2022).
- Faria, M., et al. Minimum information reporting in bio-nano experimental literature. Nature Nanotechnology. 13 (9), 777-785 (2018).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon