Method Article
Évaluation de l’intégrité de la barrière intestinale chez la souris à l’aide de dextrane marqué à la fluorescéine-isothiocyanate
Dans cet article
Résumé
Dans la présente étude, le dextrane marqué à la fluorescéine-isothiocyanate (FITC) est administré à des souris par gavage oral pour évaluer la perméabilité intestinale à la fois in vivo et dans des échantillons plasmatiques et fécaux. Comme la fonction de barrière intestinale est affectée dans de nombreux processus pathologiques, ce test direct et quantitatif peut être utilisé dans divers domaines de recherche.
Résumé
L’intégrité de la barrière intestinale est une caractéristique de la santé intestinale. Alors que l’intégrité de la barrière intestinale peut être évaluée à l’aide de marqueurs indirects tels que la mesure des marqueurs inflammatoires plasmatiques et la translocation bactérienne vers la rate et les ganglions lymphatiques, l’étalon-or quantifie directement la capacité des molécules sélectionnées à traverser la couche muqueuse intestinale vers la circulation systémique. Cet article utilise une technique non invasive, rentable et peu lourde pour quantifier et suivre en temps réel la perméabilité intestinale chez la souris utilisant du dextrane marqué à l’isothiocyanate de fluorescéine (FITC-dextran). Avant la supplémentation orale avec FITC-dextran, les souris sont à jeun. Ils sont ensuite gavés avec du FITC-dextran dilué dans une solution saline tamponnée au phosphate (PBS). Une heure après le gavage, les souris sont soumises à une anesthésie générale à l’isoflurane et la fluorescence in vivo est visualisée dans une chambre d’imagerie. Cette technique vise à évaluer la fluorescence résiduelle dans la cavité abdominale et l’absorption hépatique, ce qui suggère une migration porte de la sonde fluorescente. Des échantillons de sang et de selles sont prélevés 4 h après le gavage oral et les souris sont sacrifiées. Les échantillons de plasma et de matières fécales dilués dans du PBS sont ensuite plaqués et la fluorescence est enregistrée. La concentration de FITC-dextran est ensuite calculée à l’aide d’une courbe standard. Dans des recherches antérieures, l’imagerie in vivo a montré que la fluorescence se propage rapidement au foie chez les souris dont la barrière intestinale est plus faible induite par un régime pauvre en fibres, tandis que chez les souris supplémentées en fibres pour renforcer la barrière intestinale, le signal fluorescent est conservé principalement dans le tractus gastro-intestinal. En outre, dans cette étude, les souris témoins avaient une fluorescence plasmatique élevée et une fluorescence réduite dans les selles, tandis qu’inversement, les souris supplémentées en inuline avaient des niveaux plus élevés de signaux de fluorescence dans l’intestin et de faibles niveaux dans le plasma. En résumé, ce protocole fournit des mesures qualitatives et quantitatives de la perméabilité intestinale en tant que marqueur de la santé intestinale.
Introduction
La barrière intestinale joue un rôle important à la fois dans la santé et la maladie. Il nécessite un équilibre complexe entre permettre aux nutriments nécessaires de pénétrer dans la circulation à partir de la lumière intestinale tout en empêchant simultanément la pénétration de molécules pro-inflammatoires, telles que les agents pathogènes ou les antigènes1. L’augmentation de la perméabilité peut être causée par de nombreux troubles gastro-intestinaux, tels que les maladies du foie ou les maladies inflammatoires de l’intestin (MII)2,3. Par exemple, dans la colite ulcéreuse (CU), une MII, l’inflammation chronique entraîne la rupture des jonctions serrées, la perturbation subséquente de la barrière intestinale et la translocation de bactéries, perpétuant potentiellement l’inflammation muqueuse et systémique4.
L’intégrité de la barrière intestinale est donc un marqueur important de la santé intestinale. Cependant, les méthodes actuelles de mesure de la perméabilité intestinale présentent de nombreuses limites. Par exemple, les méthodes mesurant les marqueurs inflammatoires plasmatiques ou la translocation bactérienne vers la rate et les ganglions lymphatiques sont indirectes 5,6. D’autres méthodes peuvent être invasives et prendre beaucoup de temps. Cet article décrit un test non invasif et rentable qui mesure directement et quantitativement la perméabilité intestinale. Ce test utilise du dextrane marqué à la fluorescéine-isothiocyanate (FITC-dextran) pour suivre la perméabilité intestinale en temps réel en mesurant la fluorescence in vivo. De plus, la mesure des taux de FITC-dextran dans le plasma et les fèces quantifie la perméabilité intestinale (Figure 1).
Le test de perméabilité FITC-dextran a déjà été utilisé dans de nombreux contextes différents, y compris dans des modèles animaux de la maladie de Parkinson7, de la septicémie8, de l’AVC ischémique9 et des brûlures10. De plus, ce test a été utilisé récemment pour aider à comprendre comment le microbiome intestinal peut être impliqué dans différents processus pathologiques et comment il peut être ciblé ou manipulé en tant que thérapeutique potentiel. Par exemple, il a été utilisé pour étudier le microbiome et les thérapies basées sur le microbiome dans le vieillissement 11, les MII12, le cancer colorectal 13 et le trouble du spectre autistique11. Comme la fonction de barrière intestinale est impliquée dans de nombreux aspects de la santé et de la maladie, ce test a été largement utilisé. Sa simplicité relative et sa faible charge temporelle le rendent idéal pour tester les conditions in vivo soupçonnées d’altérer l’intégrité de la barrière intestinale. Ses résultats quantitatifs sont utiles pour déterminer l’efficacité d’un traitement potentiel.
Dans cette étude, l’effet de l’alimentation sur la fonction de barrière intestinale a été évalué à l’aide du test FITC-dextran. La perméabilité intestinale des souris recevant un régime témoin et la perméabilité intestinale des souris recevant un régime supplémenté en inuline ont été comparées. L’inuline est un oligosaccharide bénéfique qui a été montré pour améliorer la fonction de barrière intestinale12,13. Pour les mesures de fluorescence in vivo (arrière-plan), une souris non traitée supplémentaire a été utilisée comme témoin négatif et a reçu du PBS au lieu de FITC-dextran. Cette expérience démontre que le test FITC-dextran est un outil précieux pour évaluer la perméabilité intestinale.
Protocole
Toutes les procédures ont été effectuées conformément aux lignes directrices du Conseil canadien de protection des animaux après approbation par le Comité institutionnel de protection des animaux du CRCHUM. Des souris BALB/c femelles âgées de huit semaines, obtenues d’une source commerciale (voir le tableau des matériaux), ont été utilisées pour la présente étude. Les animaux ont reçu une supplémentation alimentaire avec 10% d’inuline poids / poids pendant 2 semaines. Un groupe témoin a reçu un régime similaire sans supplément d’inuline. Les souris avaient un accès ad libitum au régime. Un aperçu du test est présenté à la figure 1.
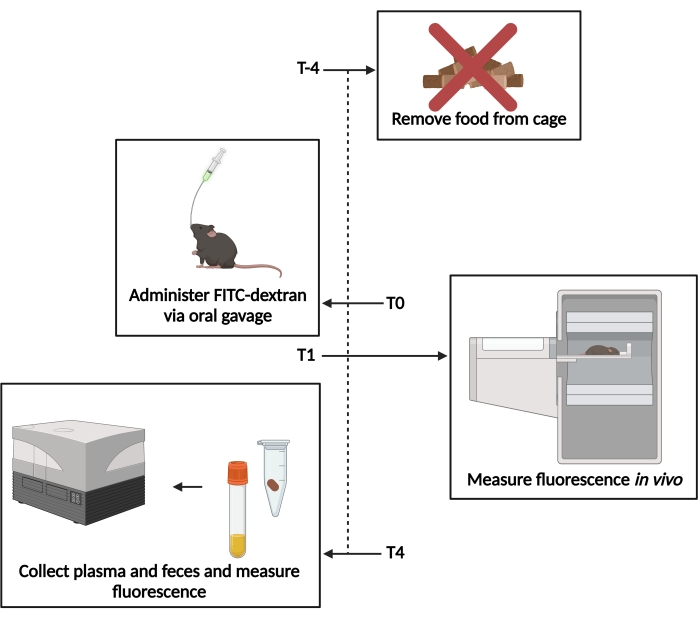
Figure 1 : Schéma du test FITC-dextran. T−4- 4 h avant le gavage, l’accès à la nourriture a été supprimé. T0- FITC-dextran a été administré par gavage oral. T1 - 1 h après le gavage, la fluorescence in vivo a été évaluée. T4- 4 h après le gavage, les échantillons de matières fécales et de plasma ont été prélevés et la fluorescence a été mesurée. Veuillez cliquer ici pour voir une version agrandie de cette figure.
1. Administration de FITC-dextran
- Avant d’administrer FITC-dextran, jeûnez les souris pendant 4 heures tout en maintenant un accès ad libitum à l’eau.
NOTE: Le jeûne doit de préférence être initié au début du cycle de lumière (le matin). Les souris peuvent être transférées dans une nouvelle cage sans litière pendant le jeûne pour limiter la coprophagie. - Préparer 200 μL de 80 mg·mL−1 4 kDa FITC-dextran (voir le tableau des matières) dilué dans une solution saline tamponnée au phosphate (PBS) 1x stérile (par souris). Préparez fraîchement les échantillons immédiatement avant l’administration et conservez-les à l’abri de la lumière.
- Administrer 200 μL de la suspension FITC-dextran par gavage oral à chaque souris à l’aide d’une aiguille de gavage incurvée stérilisée de 38 mm et 22 G munie d’une pointe en forme de boule ou de poire (voir le tableau des matériaux). Démarrez une minuterie après le premier gavage et attendez 5 à 10 minutes avant de gavage de la souris suivante pour permettre des mesures in vivo (étape 2), en maintenant toujours 1 h après le gavage. Conserver la suspension FITC-dextran restante pour la courbe standard.
REMARQUE : Immédiatement après le gavage, les aliments peuvent être remplacés pour assurer la formation de matières fécales.
2. Mesure de fluorescence in vivo
- Anesthésier les souris 1 h après le gavage en utilisant de l’isoflurane à 2,5% ou un autre anesthésique. Confirmer que l’animal est anesthésié de façon appropriée en pinçant l’orteil ou la queue et en s’assurant qu’il ne réagit pas.
- Retirez la fourrure de la région abdominale à l’aide d’un rasoir électrique et appliquez généreusement une pommade lubrifiante ophtalmique sur les yeux pour éviter le dessèchement. Ensuite, placez les souris individuellement dans la chambre d’imagerie couchée dorsalement.
REMARQUE : Une souris témoin doit être incluse qui reçoit du PBS ou une solution saline au lieu de FITC-dextran pour tenir compte de l’arrière-plan pendant l’imagerie in vivo .
- Retirez la fourrure de la région abdominale à l’aide d’un rasoir électrique et appliquez généreusement une pommade lubrifiante ophtalmique sur les yeux pour éviter le dessèchement. Ensuite, placez les souris individuellement dans la chambre d’imagerie couchée dorsalement.
- Imagez les souris à l’aide d’une chambre d’imagerie à fluorescence (voir le tableau des matériaux). Acquérir des images de la région abdominale, en réglant la longueur du laser à 470 nm et la résolution à 2,0 mm.
- Démarrez la machine et le logiciel en cliquant sur le bouton de démarrage et en le maintenant enfoncé. Laissez le système se réchauffer.
REMARQUE: Le système peut avoir besoin de 20 minutes ou plus pour se réchauffer, de sorte que la machine doit être démarrée tôt afin de ne pas interférer avec l’imagerie des souris 1 h après le gavage. - Cliquez sur État de l’appareil et assurez-vous que tous les appareils configurés affichent « OK » avant de continuer.
- Si nécessaire, réchauffez le laser approprié en cliquant sur Contrôle laser, puis en cliquant sur le bouton Nom du laser du laser souhaité.
- Commencez une nouvelle étude en cliquant sur Nouvelle étude. Enregistrez sous le fichier approprié avec le nom souhaité.
- Cliquez sur Options d’étude, puis entrez l’ID du spécimen et choisissez le bon laser et expérimentez.
- Ouvrez la chambre d’imagerie et placez l’animal dorsalement sur la plaque de balayage. Fixez les membres et la queue avec du ruban adhésif et assurez-vous que le nez et la bouche sont bien ajustés dans le tube d’anesthésie, en maintenant 2,5% d’isoflurane.
- Ajustez la hauteur de la plaque de balayage de sorte que la région de balayage soit légèrement ventrale à partir de la ligne médiane de l’animal. Ajustez la plaque en tournant le bouton de réglage à l’intérieur de la chambre d’imagerie. Fermez et verrouillez la porte de la chambre d’imagerie.
- Sélectionnez la zone à analyser à l’aide de l’outil Dessin . Inclure toute la largeur de l’abdomen juste au-dessus du foie jusqu’au rectum. Cliquez sur l’outil Modifier pour ajuster la zone une fois dessinée.
- Réglez la résolution de numérisation sur 2,0 mm, puis cliquez sur Suivant. Une fois l’automatisation de l’alimentation terminée, assurez-vous que les paramètres sont corrects et effectuez les ajustements nécessaires. Cliquez sur Démarrer pour commencer l’analyse.
- Une fois l’analyse terminée, retirez l’animal de la chambre d’imagerie et placez-le dans un incubateur pour maintenir la température corporelle tout en récupérant de l’anesthésie.
- Cliquez sur Continuer l’étude pour conserver les paramètres, puis répétez les étapes 2.2.5-2.2.10 jusqu’à ce que toutes les souris aient été analysées.
- Cliquez sur le bouton d’alimentation et maintenez-le enfoncé pendant 3 s pour éteindre la chambre d’imagerie.
- Démarrez la machine et le logiciel en cliquant sur le bouton de démarrage et en le maintenant enfoncé. Laissez le système se réchauffer.
- Évaluer la fluorescence en comparant la fluorescence abdominale de chaque animal et de la souris témoin sur des images uniformément mises à l’échelle à l’aide d’un logiciel associé au système d’imagerie utilisé (voir le tableau des matériaux).
- Ouvrez les fichiers image en les recherchant sous le nom de fichier choisi. Ouvrez tous les fichiers qui ont des paramètres synchronisés en même temps.
- À l’aide de la barre d’outils des paramètres d’image, utilisez les boutons Synchroniser l’image et Synchroniser l’échelle pour synchroniser les paramètres des images, ce qui permet une comparaison précise.
- Enregistrez les images avec leurs échelles ajustées.
3. Mesure de la fluorescence dans les échantillons fécaux et le plasma
- Prélever une pastille fécale de chaque souris dans un tube stérile 4 h après le gavage. Gardez les tubes dans l’obscurité sur la glace.
- Anesthésier les souris par injection intrapéritonéale de 240 mg/mL de pentobarbital sodique (dilution, 1:100; voir le tableau des matières). Administrer à une dose de 0,03 mL/g de poids corporel.
- Prélever des échantillons de sang d’au moins 700 μL dans un tube destiné à la collecte de plasma contenant de l’héparine ou de l’EDTA pour prévenir la coagulation (voir le tableau des matériaux) en insérant un tube capillaire en verre dans le plexus rétro-orbitaire14.
REMARQUE: Les méthodes alternatives de prélèvement sanguin comprennent la ponction cardiaque ou le retrait de la veine de la queue. Comme il s’agit d’une procédure terminale, les souris doivent être euthanasiées par luxation cervicale ou par une méthode alternative humaine. Suivez les recommandations du comité local d’éthique animale pour l’euthanasie.
- Prélever des échantillons de sang d’au moins 700 μL dans un tube destiné à la collecte de plasma contenant de l’héparine ou de l’EDTA pour prévenir la coagulation (voir le tableau des matériaux) en insérant un tube capillaire en verre dans le plexus rétro-orbitaire14.
- Centrifuger les échantillons de sang à 9 390 x g pendant 10 min à température ambiante. Transférez le plasma dans un nouveau tube stérile et conservez-le dans l’obscurité sur de la glace.
- Diluer 50 mg d’échantillons fécaux dans 200 μL de 1x PBS et diluer le plasma 1:2 avec 1x PBS. Le taux de dilution peut être modifié en fonction de l’intensité du signal de fluorescence.
- Générer une courbe standard en utilisant des dilutions en série de FITC-dextran dans 1x PBS. En commençant par la concentration la plus élevée de 20 mg·mL−1 FITC dextran, diluer diluer d’un facteur 1:1 en série 7-10 fois.
NOTE: Les concentrations doivent donc indiquer 20 mg·mL−1, 10 mg·mL−1, 5 mg·mL−1, 2,5 mg·mL−1, 1,25 mg·mL−1, 0,625 mg·mL−1, 0,3125 mg·mL−1, etc. - Plaque 100 μL d’échantillons et étalons dans une plaque noire opaque de 96 puits. Inclure un PBS vide. Lire la fluorescence sur un lecteur de plaques fluorescentes (voir Tableau des matériaux) avec l’absorption à 530 nm et l’excitation à 485 nm.
REMARQUE : Les échantillons et les étalons peuvent être plaqués en double ou en triple, puis leurs valeurs de fluorescence sont moyennées. - Déterminer la concentration de FITC-dextran par échantillon en comparant la fluorescence aux concentrations connues de la courbe étalon. Dans les échantillons, multiplier la concentration par le facteur de dilution (étape 3.5).
Résultats
L’analyse de la fluorescence in vivo a montré que les souris qui n’ont reçu que le régime témoin avaient un apport hépatique plus élevé de FITC-dextran et des niveaux plus élevés de fluorescence résiduelle dans la cavité abdominale par rapport aux souris qui ont reçu le régime supplémenté en inuline (Figure 2A). Une certaine fluorescence était visible dans le cæcum des souris qui ont reçu le régime d’inuline, mais il y avait peu ou pas d’apport hépatique, indiquant que ces régimes protégeaient contre une perméabilité intestinale accrue.
Les niveaux de fluorescence dans les échantillons plasmatiques et fécaux renforcent et quantifient leurs homologues in vivo . Les souris qui ont reçu le régime supplémenté en inuline avaient des niveaux significativement plus faibles de FITC-dextran dans leur plasma par rapport aux souris qui n’ont reçu que le régime témoin (Figure 2B). Cela indique qu’ils avaient amélioré la fonction de barrière intestinale parce que moins de FITC-dextran pouvait pénétrer la barrière intestinale dans la circulation. De manière concordante, les souris qui ont reçu le régime d’inuline avaient des niveaux significativement plus élevés de FITC-dextran dans leurs fèces que les souris qui n’ont reçu que le régime témoin (Figure 2C). Cela renforce le fait qu’ils avaient une fonction de barrière intestinale intacte car le FITC-dextran est resté dans le côlon jusqu’à l’excrétion, ce qui est considéré comme normal. Les niveaux plus faibles de FITC-dextran dans les fèces des souris témoins indiquent qu’il a pénétré à travers la barrière intestinale dans la circulation plutôt que d’être excrété de manière appropriée. Les niveaux élevés de FITC-dextran dans le plasma renforcent cette découverte.
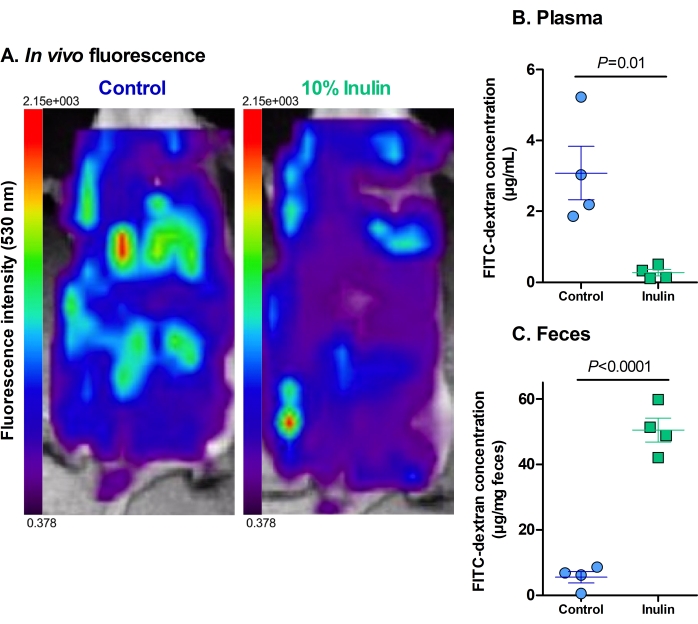
Figure 2 : La supplémentation alimentaire en inuline diminue la translocation de FITC-dextran à travers la barrière intestinale. (A) La fluorescence résiduelle et l’absorption hépatique de FITC-dextran. Rouge = intensité la plus élevée; violet foncé = intensité la plus faible. Fluorescence maximale de 2,15 x 103, fluorescence minimale de 0,378. (B) La concentration plasmatique de FITC-dextran. P = 0,010. (C) La concentration fécale de FITC-dextran. P = 0,00003. N = 4 par groupe. Les données sont représentées sous forme de moyenne ± SEM. Chaque point représente une souris. Test t de l’étudiant non apparié. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
La fonction de barrière intestinale fait partie intégrante de nombreux processus pathologiques différents. Ainsi, l’évaluation de la perméabilité intestinale de manière non invasive, rentable et quantifiable est essentielle pour représenter avec précision ces maladies dans des modèles animaux. Le test FITC-dextran offre la possibilité de cette représentation. Cependant, ce protocole implique plusieurs étapes critiques qui doivent être complétées avec précision pour obtenir des résultats fiables. Tout d’abord, il est essentiel de garantir l’utilisation de FITC-dextran de taille appropriée. Pour l’examen de la perméabilité in vivo , 4 kDa FITC-dextran est le poids moléculaire optimal, et à mesure que le poids moléculaire augmente, la perméabilité diminue15. Ainsi, l’utilisation de FITC-dextran d’un poids moléculaire différent peut fournir des résultats confus ou peu fiables. De plus, il est important de noter l’heure de chaque gavage et d’ajuster les points temporels pour la collecte de données in vivo et la collecte de plasma et de matières fécales en conséquence. Par exemple, si deux souris sont gavées à 10 minutes d’intervalle, les lectures de fluorescence in vivo et la collecte des matières fécales et du plasma doivent également avoir lieu à 10 minutes d’intervalle. La comparaison de la fluorescence aux mêmes points temporels permet une représentation plus précise des différences de perméabilité. En outre, l’ordre dans lequel les animaux des différents groupes sont testés devrait être alterné afin d’éviter un effet de regroupement dû au calendrier. Au lieu de tester tous les animaux du groupe A en premier, puis tous les animaux du groupe B en second (AAABBB), il est recommandé de changer le groupe après chaque animal (ABABAB).
Ce test peut être modifié pour inclure uniquement l’évaluation des échantillons de plasma et de matières fécales s’il n’y a pas d’accès à un appareil d’imagerie. Bien que l’imagerie directe par fluorescence in vivo permette de visualiser l’apport hépatique et la fluorescence abdominale résiduelle, l’évaluation de la fluorescence dans les échantillons plasmatiques et fécaux fournit toujours une mesure quantitative de la perméabilité intestinale. De plus, comme l’a démontré l’expérience décrite, les niveaux de fluorescence dans le plasma et les fèces sont bien corrélés avec l’imagerie in vivo . De plus, ce test peut être modifié pour inclure uniquement l’imagerie in vivo . Cela permet aux animaux d’être maintenus en vie pour continuer à tester d’autres paramètres ou surveiller l’évolution de la perméabilité intestinale au fil du temps. La possibilité de modifier ce test le rend donc accessible, mais toujours quantitatif. Enfin, la dose de 200 μL de 80 mg·mL−1 FITC-dextran administrée à chaque souris a été utilisée précédemment et s’est révélée efficace chez les souris présentant de petites différences de poids corporel16. De plus, il est important de noter que toutes les souris utilisées dans la section des résultats représentatifs pesaient environ 20 g, ce qui permet d’utiliser le même dosage pour chaque souris. Pour tenir compte des différences de poids corporel, cependant, FITC-dextran peut être administré à une dose de 0,6-0,8 mg / g de poids corporel, par exemple17. Surtout, quelle que soit la dose utilisée, il est important de limiter la quantité gavée à chaque souris à moins de 10 mL·kg−1 pour prévenir les complications ou l’inconfort18.
Bien que le test FITC-dextran fournisse une méthode efficace pour évaluer la fonction de barrière intestinale, il présente encore certaines limites. L’une des limites de ce modèle est qu’il nécessite de jeûner les souris pendant plusieurs heures, ce qui signifie qu’il n’est pas fiable de comparer ces résultats à ceux de souris qui n’ont pas été à jeun. De plus, le jeûne peut affecter les résultats dans certains modèles qui nécessitent des horaires d’alimentation stricts, comme lors de la mesure de la glycémie dans des modèles animaux pour le diabète.
Malgré ces limites, le test FITC-dextran reste une méthode efficace pour analyser la perméabilité intestinale car il est quantitatif, polyvalent, rentable et moins invasif que de nombreuses méthodes classiques. Par exemple, les sondes couramment utilisées pour mesurer la perméabilité intestinale sont les petites sondes saccharidiques ou Cr-EDTA, qui présentent certains avantages19. Cependant, certaines sondes saccharidiques n’ont qu’une perméabilité spécifique à la région. Comme ils sont hydrolysés dans la partie distale de l’intestin grêle, ils ne donnent aucun aperçu de la perméabilité du côlon19. D’autre part, le Cr-EDTA peut fournir des informations sur la perméabilité du côlon mais nécessite des mesures pendant 24 heures, ce qui rend la charge temporelle de cette méthode beaucoup plus élevée que celle du test FITC-dextran20. De plus, aucune de ces méthodes ne fournit l’imagerie in vivo directe de ce test. Par conséquent, le test FITC-dextran offre une option relativement simple, directe et efficace par rapport aux méthodes alternatives de mesure de la perméabilité intestinale.
Enfin, dans les processus pathologiques tels que les MII4, la maladie d’Alzheimer21 et la maladie hépatique2, la perméabilité intestinale est un paramètre important qui pourrait être mesuré à l’aide du test FITC-dextran pour améliorer les études. Par exemple, dans le développement de nouveaux traitements, tels que les immunothérapies pour les MII, ce test peut être utilisé pour tester l’efficacité de la thérapie pour maintenir l’intégrité de la barrière intestinale. Étant donné que l’altération de la fonction de barrière intestinale peut être impliquée dans la perpétuation de l’inflammation chronique dans la colite ulcéreuse, par exemple, il est importantd’examiner dans quelle mesure une thérapie protège contre une perméabilité accrue 4. Ce n’est qu’un exemple, mais le test FITC-dextran est un moyen accessible et quantifiable de mesurer la perméabilité intestinale dans de nombreux domaines et aspects de la recherche.
Déclarations de divulgation
Les auteurs déclarent qu’ils n’ont aucune divulgation.
Remerciements
Ces travaux ont été financés par une subvention du Conseil de recherches en sciences naturelles et en génie du Canada (subvention RGPIN-2018-06442 au SMM). Nous remercions l’animalerie du CRCHUM et le Dr Junzheng Peng de la Plateforme de phénotypage cardiovasculaire.
matériels
| Name | Company | Catalog Number | Comments |
| 50 ppm Fe Diet (10% Inulin) | Envigo Teklad | TD.190651 | Representative Results |
| 50 ppm Fe Diet (FeSO4) | Envigo Teklad | TD.190723 | Representative Results |
| BALB/c Mice 49-55 Days, Female | Charles River | 028BALB/C | Representative Results |
| BD 1 mL Syringe Tuberculin Slip Tip | Becton, Dickinson and Company | 309659 | For gavage |
| BD Microtainer Tubes - With LH (Lithium Heparin) | Becton, Dickinson and Company | 365965 | For plasma collection |
| Centrifuge 5420 | Eppendorf | S420KN605698 | |
| Curved Gavage Needle (Gavage Cannula) 7.7.0 38 mm x 22 G | Harvard Apparatus Canada | 34-024 | No longer available - A potential alternative is available at Instech Labs (FTP-22-38) |
| Euthanyl (Pentobarbital Sodium) 240 mg/mL | Bimeda-MTC Animal Health Inc. | 141704 | 1/100 dilution; Administered via intraperitoneal injection at 0.03 mL/g body weight |
| FITC-dextran 4 | TdB Labs | 20550 | |
| Heparinized Capillary Tubes | Kimble Chase Life Science and Research | 2501 | For retro-orbital blood collection |
| Microplate, PS, 96-well, Flat-bottom (Chimney Well), Black, Flutrac, Med. Binding | Greiner Bio-one | 655076 | |
| MiniARCO Clipper Kit | Kent Scientific | CL8787-KIT | For hair removal |
| Optix MX2 and Optix Optiview | Advanced Research Technologies | 2.02.00.6 | Fluorescence imaging machine and software |
| Phosphate Buffered Saline 1x (PBS) | Wisent Inc | 311-010-LL | |
| Puralube Vet Ointment | Dechra | 12920060 | Ophthalmic ointement to prevent eye damage during anesthesia |
| Spark Multiplate Reader | Tecan | 30086376 |
Références
- König, J., et al. Human intestinal barrier function in health and disease. Clinical and Translational Gastroenterology. 7 (10), 196 (2016).
- Lorenzo-Zuniga, V., et al. Insulin-like growth factor I improves intestinal barrier function in cirrhotic rats. Gut. 55 (9), 1306-1312 (2006).
- Schwarz, B. T., et al. LIGHT signals directly to intestinal epithelia to cause barrier dysfunction via cytoskeletal and endocytic mechanisms. Gastroenterology. 132 (7), 2383-2394 (2007).
- Schmitz, H., et al. Altered tight junction structure contributes to the impaired epithelial barrier function in ulcerative colitis. Gastroenterology. 116 (2), 301-309 (1999).
- Fouts, D. E., Torralba, M., Nelson, K. E., Brenner, D. A., Schnabl, B. Bacterial translocation and changes in the intestinal microbiome in mouse models of liver disease. Journal of Hepatology. 56 (6), 1283-1292 (2012).
- Galipeau, H. J., Verdu, E. F. The complex task of measuring intestinal permeability in basic and clinical science. Neurogastroenterology and Motility. 28 (7), 957-965 (2016).
- Bordoni, L., et al. Positive effect of an electrolyzed reduced water on gut permeability, fecal microbiota and liver in an animal model of Parkinson's disease. PLoS One. 14 (10), 0223238 (2019).
- Wang, Q., Fang, C. H., Hasselgren, P. -. O. Intestinal permeability is reduced and IL-10 levels are increased in septic IL-6 knockout mice. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology. 281 (3), 1013-1023 (2001).
- Crapser, J., et al. Ischemic stroke induces gut permeability and enhances bacterial translocation leading to sepsis in aged mice. Aging. 8 (5), 1049-1063 (2016).
- Mal Earley, Z., et al. Burn injury alters the intestinal microbiome and increases gut permeability and bacterial translocation. PLoS One. 10 (7), 0129996 (2015).
- Sharon, G., et al. Human gut microbiota from autism spectrum disorder promote behavioral symptoms in mice. Cell. 177 (6), 1600-1618 (2019).
- Schroeder, B. O., et al. Bifidobacteria or fiber protects against diet-induced microbiota-mediated colonic mucus deterioration. Cell Host & Microbe. 23 (1), 27-40 (2018).
- Hajjar, R., et al. Improvement of colonic healing and surgical recovery with perioperative supplementation of inulin and galacto-oligosaccharides. Clinical Nutrition. 40 (6), 3842-3851 (2021).
- JoVE. Lab Animal Research. Blood Withdrawal I. JoVE Science Education Database. , (2022).
- Costantini, T. W., et al. Quantitative assessment of intestinal injury using a novel in vivo, near-infrared imaging technique. Molecular Imaging. 9 (1), 30-39 (2010).
- Thevaranjan, N., et al. Age-associated microbial dysbiosis promotes intestinal permeability, systemic inflammation, and macrophage dysfunction. Cell Host & Microbe. 21 (4), 455-466 (2017).
- Chassaing, B., Aitken, J. D., Malleshappa, M., Vijay-Kumar, M. Dextran sulfate sodium (DSS)-induced colitis in mice. Current Protocols in Immunology. 104, 1-14 (2014).
- Turner, P. V., Brabb, T., Pekow, C., Vasbinder, M. A. Administration of substances to laboratory animals: Routes of administration and factors to consider. Journal of the American Association for Laboratory Animal Science. 50 (5), 600-613 (2011).
- Arrieta, M. C., Bistritz, L., Meddings, J. B. Alterations in intestinal permeability. Gut. 55 (10), 1512-1520 (2006).
- von Martels, J. Z. H., Bourgonje, A. R., Harmsen, H. J. M., Faber, K. N., Dijkstra, G. Assessing intestinal permeability in Crohn's disease patients using orally administered 52Cr-EDTA. PLoS One. 14 (2), 0211973 (2019).
- Gonzalez-Escamilla, G., Atienza, M., Garcia-Solis, D., Cantero, J. L. Cerebral and blood correlates of reduced functional connectivity in mild cognitive impairment. Brain Structure and Function. 221 (1), 631-645 (2016).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon