Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Microdissection et microscopie électronique à balayage à monture entière Visualisation du plexus choroïde de souris
Dans cet article
Résumé
Le plexus choroïde (CP), un tissu peu étudié en neurosciences, joue un rôle clé dans la santé et la maladie du système nerveux central. Ce protocole décrit une technique de microdissection pour isoler le CP et l’utilisation de la microscopie électronique à balayage pour obtenir une vue d’ensemble de sa structure cellulaire.
Résumé
Le plexus choroïde (CP), une structure hautement vascularisée faisant saillie dans les ventricules du cerveau, est l’un des tissus les moins étudiés en neurosciences. Comme il devient de plus en plus clair que cette minuscule structure joue un rôle crucial dans la santé et la maladie du système nerveux central (SNC), il est de la plus haute importance de disséquer correctement la PC hors des ventricules cérébraux d’une manière qui permet un traitement en aval, allant de l’analyse fonctionnelle à l’analyse structurelle. Ici, l’isolement de la PC de souris ventricule latéral et quatrième cerveau sans avoir besoin d’outils ou d’équipement spécialisés est décrit. Cette technique d’isolement préserve la viabilité, la fonction et la structure des cellules au sein du CP. En raison de sa vascularisation élevée, le CP peut être visualisé flottant à l’intérieur des cavités ventriculaires du cerveau à l’aide d’un microscope binoculaire. Cependant, la perfusion transcardique requise pour l’analyse en aval peut compliquer l’identification du tissu CP. En fonction des étapes de traitement ultérieures (par exemple, analyse de l’ARN et des protéines), cela peut être résolu en visualisant le PC par perfusion transcardique avec du bleu de bromophénol. Après isolement, la PC peut être traitée à l’aide de plusieurs techniques, y compris l’analyse de l’ARN, des protéines ou d’une seule cellule, pour mieux comprendre la fonction de cette structure cérébrale spéciale. Ici, la microscopie électronique à balayage (MEB) sur l’ensemble de la monture CP est utilisée pour obtenir une vue d’ensemble de la structure.
Introduction
Des barrières serrées séparent le système nerveux central (SNC) de la périphérie, y compris la barrière hémato-encéphalique (BHE) et la barrière hémato-céphalo-rachidien (LCR). Ces barrières protègent le SNC contre les agressions extérieures et assurent un microenvironnement équilibré et contrôlé 1,2,3. Alors que la BHE a été largement étudiée au fil du temps, la barrière hémato-LCR située au plexus choroïde (PC) n’a fait que susciter un intérêt croissant de la recherche au cours de la dernière décennie. Cette dernière barrière se trouve dans les quatre ventricules du cerveau (Figure 1A, B) et se caractérise par une seule couche de cellules épithéliales du plexus choroïde (CPE) entourant un stroma central, des capillaires qui fuient, des fibroblastes et une population de cellules lymphoïdes et myéloïdes (Figure 1C)4,5,6. Les cellules CPE sont fermement interconnectées par des jonctions serrées, empêchant ainsi les fuites des capillaires sanguins fenêtrés sous-jacents dans le LCR et le cerveau. De plus, le transport à travers les cellules CPE est régulé par un certain nombre de systèmes de transport vers l’intérieur et vers l’extérieur qui gèrent l’afflux de composés bénéfiques (p. ex. nutriments et hormones) du sang vers le LCR et l’efflux de molécules nocives (p. ex. déchets métaboliques, neurotransmetteurs en excès) dans l’autre sens 1,6. Pour pouvoir exercer leur fonction de transport actif, les cellules CPE contiennent de nombreuses mitochondries dans leur cytoplasme7. De plus, le CP est la principale source de LCR et agit comme le gardien du cerveau par la présence de cellules inflammatoires résidentes1. En raison de son emplacement unique entre le sang et le cerveau, le PC est également parfaitement positionné pour effectuer une surveillance immunitaire8.
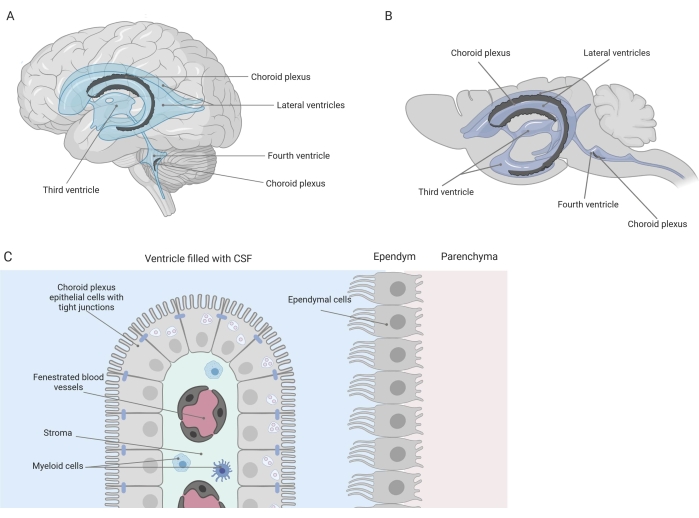
Figure 1 : Vue d’ensemble schématique de l’emplacement et de la composition du plexus choroïde (CP). (A,B) Le tissu CP se trouve dans les deux ventricules latéraux, le troisième et le quatrième ventricules (A) du cerveau humain et (B) du cerveau de la souris. (C) Le tissu CP est constitué d’une seule couche de cellules cuboïdes de l’épithélium CP (CPE) étroitement connectées entourant les capillaires fenêtrés, le tissu conjonctif lâche et les cellules lymphoïdes et myéloïdes, et forme la barrière hémato-céphalorachidienne (adaptée et modifiée à partir de la référence23). Figure créée avec Biorender.com. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Au cours de la dernière décennie, de plus en plus de preuves, y compris plusieurs rapports de notre groupe de recherche, ont révélé que la PC joue un rôle central dans la santé et la maladie 9,10,11,12,13,14,15,16,17,18 . Par exemple, on sait que la barrière hémato-LCR vieillissante présente des altérations morphologiques dans, entre autres, les noyaux, les microvillosités et la membrane basale 1,19. De plus, dans le contexte de la maladie d’Alzheimer, l’intégrité globale de la barrière est compromise et tous ces changements liés à l’âge semblent être encore plus prononcés 1,8,20. En plus des changements morphologiques, le transcriptome, le protéome et le sécrétome de la PC sont modifiés au cours de la maladie 12,21,22,23. Ainsi, une connaissance avancée de la PC est essentielle pour mieux comprendre son rôle dans les maladies neurologiques et potentiellement développer de nouvelles stratégies thérapeutiques.
Une méthode efficace de microdissection précise de la PC hors des ventricules cérébraux est la première étape inestimable pour permettre une étude appropriée de cette minuscule structure cérébrale. En raison de sa nature hautement vascularisée (Figure 2B), la PC flottant à l’intérieur des cavités ventriculaires du cerveau peut être identifiée à l’aide d’un microscope binoculaire. Cependant, la perfusion transcardique est souvent nécessaire pour l’analyse en aval, ce qui complique l’identification et l’isolement corrects du tissu CP (Figure 2C). Si les étapes de traitement ultérieures le permettent (par exemple, dans le cas de l’analyse de l’ARN et des protéines), la PC peut être visualisée par perfusion transcardique avec du bleu de bromophénol (Figure 2A). Plusieurs publications décrivent déjà l’isolement du PC à partir de cerveaux de rats24 et de petits souris25. Ici, une technique d’isolement par microdissection est décrite pour isoler la PC des souris adultes. Il est important de noter que cette technique d’isolement préserve la viabilité, la fonction et la structure des cellules au sein du CP. L’isolement de la PC flottant dans le quatrième ventricule et les ventricules latéraux est décrit ici. En bref, les souris sont anesthésiées en phase terminale et, si nécessaire, perfusées par voie transcardale. Cependant, il convient de noter que la perfusion peut endommager la structure des cellules au sein du CP. Par conséquent, si l’échantillon doit être analysé par microscopie électronique à transmission (MET), microscopie électronique à balayage de face de bloc série (SBF-SEM) ou MEB à faisceau d’ions focalisés (FIB-MEB), la perfusion ne doit pas être effectuée. Ensuite, tout le cerveau est isolé et des forceps sont utilisés pour hémisecter le cerveau de manière sagittique. De là, les PC flottant dans les ventricules latéraux peuvent être identifiés et disséqués, tandis que les PC du quatrième ventricule peuvent être isolés du côté cérébelleux du cerveau.

Figure 2 : Visualisation du (A-C) quatrième et (D-F) ventricule latéral du plexus choroïde (CP) après perfusion au bleu de bromophénol (A,D), (B,E) pas de perfusion et (C,F) perfusion avec PBS/héparine. Les images sont prises au stéréomicroscope (grossissement 8x-32x). Veuillez cliquer ici pour voir une version agrandie de cette figure.
Une fois que la PC est correctement disséquée hors des ventricules cérébraux, tout un répertoire de techniques peut être appliqué pour mieux comprendre la fonction de cette structure. Par exemple, la cytométrie en flux ou le séquençage de l’ARN unicellulaire peuvent être effectués pour quantifier et analyser phénotypiquement les cellules inflammatoires infiltrantes dans certaines conditions pathologiques26,27. En plus de la composition cellulaire, la composition moléculaire du PC peut être analysée pour évaluer la présence de cytokines et de chimiokines via un test immuno-enzymatique (ELISA), immunoblot, ou par analyse simultanée de plusieurs cytokines à l’aide du réseau de billes de cytokines28. De plus, des analyses du transcriptome, vasculaire, histologie des cellules immunitaires et sécrétome peuvent être effectuées sur les explants CP microdisséqués29. Ici, la microscopie électronique à balayage (MEB) sur l’ensemble de la monture CP est utilisée pour obtenir une vue d’ensemble de la structure de la CP. Le MEB utilise un faisceau d’électrons focalisés pour balayer la surface et créer une image de la topographie et de la composition de la surface. Comme la longueur d’onde des électrons est beaucoup plus petite que celle de la lumière, la résolution du MEB est de l’ordre du nanomètre et supérieure à celle d’un microscope optique. Par conséquent, les études morphologiques au niveau subcellulaire peuvent être effectuées via SEM. En bref, le CP disséqué est immédiatement transféré dans un fixateur contenant du glutaraldéhyde pour une fixation nocturne, suivie d’une osmication et d’une coloration à l’acétate d’uranyle. Les échantillons sont ensuite traités avec une coloration à l’aspartate de plomb, déshydratés et finalement intégrés pour l’imagerie.
Ainsi, ce protocole facilite l’isolement efficace de la PC des ventricules cérébraux de la souris, qui peut être analysée plus en détail à l’aide d’une variété de techniques en aval pour étudier sa structure et sa fonction.
Protocole
Toutes les expérimentations animales décrites dans cette étude ont été menées conformément à la législation nationale (loi belge 14/08/1986 et 22/12/2003, arrêté royal belge 06/04/2010) et européenne (directives européennes 2010/63/UE, 86/609/CEE). Toutes les expériences sur des souris et des protocoles animaux ont été approuvées par le comité d’éthique de l’Université de Gand (numéros de permis LA1400091 et CE 2017-026).
1. Préparation
- Anesthésiques : Préparez un anesthésique terminal. Par exemple, une solution de pentobarbital sodique (≥100 mg/kg) dans une solution saline tamponnée au phosphate (PBS) peut être préparée.
- Solution de perfusion transcardique : Préparer 10 mL (par souris) de solution de PBS/héparine (contenant 0,2 % d’héparine) additionnée de bleu de bromophénol à 0,5 %.
REMARQUE: Si les étapes de traitement en aval le permettent (par exemple, dans le cas de l’analyse de l’ARN et des protéines), le plexus choroïde (CP) peut être visualisé par perfusion transcardique avec du bleu de bromophénol. Si le bleu de bromophénol n’est pas compatible avec les étapes de traitement ultérieures (p. ex. pour l’imagerie), utilisez du PBS/héparine pour perfuser. - Préparer les solutions requises pour l’analyse SEM.
- Préparer un tampon Na-cacodylate 0,1 M (pH 7,4). Préparer une solution de 2% de paraformaldéhyde et 2,5% de glutaraldéhyde dans un tampon Na-cacodylate 0,1 M. Faire 20 mL de cette solution par échantillon.
- Préparer le tétroxyde d’osmium à 2 % dans un tampon Na-cacodylate de 0,1 M (5 mL par échantillon).
- Préparez des solutions 50 %, 70 %, 85 % et 100 % EtOH. Préparer 5 mL de chaque solution d’EtOH par échantillon.
2. Microdissection du plexus choroïde hors du ventricule latéral et du quatrième ventricule
REMARQUE : Des souris C57BL/6 femelles âgées de 9 semaines ont été utilisées dans cette étude. Cependant, la technique d’isolement décrite est indépendante de la souche, du sexe et de l’âge de la souris adulte.
- Isolez le cerveau de la souris.
- Injecter par voie intrapéritonéale une dose létale d’un barbiturique à courte durée d’action (>100 mg/kg, préparé à l’étape 1.1) à l’aide d’une aiguille de 26 G pour anesthésier la souris en phase terminale. Vérifiez le réflexe du pied de la souris en pinçant sa patte arrière avec une pince.
- Lorsqu’il n’y a pas de réflexe plantaire, placez l’animal anesthésié en phase terminale dans la position du décubitus dorsal et fixez la souris en épinglant les membres sur une assiette.
REMARQUE : Si la perfusion transcardique des souris n’est pas nécessaire, selon la méthode d’analyse en aval (p. ex., pour l’imagerie SEM), passez à l’étape 2.1.7. Cependant, si la perfusion est nécessaire pour éliminer les cellules sanguines ou d’autres composants dans le sang, la PC peut être visualisée comme une structure bleue flottant dans les ventricules cérébraux par perfusion avec du bleu de bromophénol. - Désinfectez la poitrine en pulvérisant de l’éthanol à 70%. Placez un champ stérile autour de la zone chirurgicale. Faites une incision de ~4 cm juste sous le diaphragme à l’aide d’une lame chirurgicale en acier au carbone (voir le tableau des matériaux).
- Ouvrez la peau et exposez la poitrine à l’aide de ciseaux chirurgicaux. Coupez complètement le diaphragme.
- Séparez le thorax pour exposer les poumons et le cœur qui bat.
- Perfuser transcardiellement les souris avec 10 mL de solution de perfusion à un débit de 4,5 mL/min, à l’aide d’une pompe à perfusion (voir le tableau des matériaux). La perfusion prendra ~2 min. Insérez une aiguille 26G dans le ventricule gauche pour pomper la solution dans le circuit systémique. En outre, faites une coupe avec des ciseaux chirurgicaux dans l’oreillette droite afin que le sang puisse sortir de la circulation.
REMARQUE: Une pompe de perfusion est préférable à l’administration manuelle du fluide, car elle fournira les fluides à une vitesse programmée avec précision et garantira que les forces de cisaillement causées par la perfusion ne sont pas trop fortes. Des forces de cisaillement excessives compromettront la viabilité et la structure des cellules dans la CP. De plus, le débit de perfusion recommandé ici est optimal pour perfuser les souris adultes à partir de 7 semaines. Si des souris plus jeunes sont utilisées, un débit plus faible doit être utilisé. Il est également important de tamponner le sang qui sort de l’oreillette droite afin de préserver un site chirurgical propre. - Décapita la souris.
REMARQUE: Faites attention de couper la tête aussi bas que possible à l’épaule pour préserver la structure du cerveau. Si la coupure est trop haute, le cervelet peut être endommagé. - Après la décapitation, coupez le cuir chevelu en faisant une incision entre les oreilles jusqu’à la supériorité des yeux. Tirez la peau latéralement pour exposer le crâne. Ensuite, ouvrez le crâne en suivant les sutures squamosales, vers la partie nasale.
REMARQUE: Il est important de retirer doucement le crâne pour maintenir l’intégrité du cerveau. - Placez le cerveau dans une boîte de Petri glacée et ajoutez 1 ml de 1x PBS glacé sur le tissu cérébral.
REMARQUE: L’enrobage de la capsule n’est pas nécessaire.
- Isoler la PC flottant dans le quatrième ventricule.
- Coupez doucement le cervelet du cerveau avec un scalpel. Le cerveau est la plus grande partie du cerveau, tandis que le cervelet est une partie beaucoup plus petite à l’arrière du cerveau. Si nécessaire, retirez les parties restantes du tissu du tronc cérébral du cervelet.
- Faites pivoter le cerveau de manière à ce que la ligne de coupe soit tournée vers le haut. Assurez-vous que la quatrième cavité ventriculaire est maintenant visible au milieu de la section, avec le CP flottant sur le site dorsal. Si nécessaire, ouvrez un peu le ventricule en ouvrant le tissu conjonctif avec une pince tranchante. De cette façon, le PC sera plus visible et plus facile à atteindre.
- Arrachez doucement le CP de la paroi du ventricule à l’aide de minuscules pinces tranchantes.
NOTE Il est important de ne toucher et de retirer le CP qu’à cette étape afin de ne pas contaminer l’échantillon avec les tissus environnants. L’ouverture des ventricules telle que décrite à l’étape 2.2.2 facilitera l’étape 2.2.3.
- Isoler la PC qui dépasse du ventricule latéral.
- Utilisez de minuscules pinces tranchantes pour couper le cerveau en deux hémisphères.
- Faites pivoter le cerveau de manière à ce que la ligne de coupe soit tournée vers le haut. Pour révéler le ventricule latéral, retirez doucement le cortex du thalamus.
- Rétractez l’hippocampe sur la ligne de coupe médiosagittale. Le ventricule latéral est maintenant visible avec le CP situé au fond du ventricule. Si nécessaire, ouvrez un peu le ventricule en ouvrant le tissu conjonctif avec une pince tranchante. De cette façon, le PC sera plus visible et plus facile à atteindre.
- Utilisez de minuscules pinces tranchantes pour arracher doucement le CP de la paroi du ventricule.
REMARQUE: Il est important de ne toucher et de retirer le CP que dans cette étape afin de ne pas contaminer l’échantillon avec les tissus environnants. L’ouverture des ventricules telle que décrite à l’étape 2.3.4 facilitera l’étape 2.3.5. Faites preuve de prudence à cette étape pour préserver autant que possible la structure du PC. Il est plus facile de commencer à tirer le CP dans la direction rostrale vers la caudale.
3. Analyse morphologique du tissu CP par microscopie électronique à balayage (MEB)
ATTENTION : Des solutions toxiques sont utilisées dans les étapes de traitement suivantes. Il est recommandé d’effectuer la préparation de l’échantillon dans une hotte.
- Effectuez la préparation des échantillons pour le SEM comme décrit ci-dessous.
- Transférer le CP isolé frais dans une solution de fixation fraîchement préparée contenant 2 % de paraformaldéhyde et 2,5 % de glutaraldéhyde dans un tampon Na-cacodylate 0,1 M (pH 7,4). Incuber pendant une nuit à 4 °C.
REMARQUE : Comme le tissu CP est très fragile et mince, il faut le placer dans de petits paniers d’échantillons (voir le tableau des matériaux) pour le transférer entre les tampons. De cette façon, la structure du tissu sera mieux préservée. Un fixateur à base de cacodylate est utilisé par rapport à un fixateur à base de PBS, car le tampon cacodylate puissant peut contrer le faible pH du glutaraldéhyde dans le fixateur EM. - Laver l’échantillon 3x pendant 5 min chacun avec 3-5 mL de tampon Na-cacodylate 0,1 M (pH 7,4).
- Postfixer les échantillons dans 3-5 mL de tétroxyde d’osmium à 2% dans un tampon Na-cacodylate 0,1 M pendant 30 min. Lavez les échantillons 3x pendant 5 min chacun avec 3-5 mL d’eau ultrapure.
- Déshydrater les échantillons dans une série de solutions glacées à des concentrations croissantes d’EtOH (50%, 70%, 85%, 100%), pendant 15 min par solution d’EtOH. Utilisez un sécheur à point critique pour sécher correctement l’échantillon.
NOTE Le passage de la phase liquide à la phase gazeuse affecte la tension superficielle, causant des dommages à la structure de surface. L’étape de séchage du point critique permet de préserver la structure de surface. - Placez soigneusement l’échantillon sur un support d’échantillon muni d’un autocollant carbone (voir le tableau des matériaux).
- Enduire les échantillons d’une fine couche (2-5 nm) de platine. Pour ce faire, montez une source de platine dans un système de vide entre deux bornes électriques à courant élevé et chauffez le platine à sa température d’évaporation. Un jet fin de platine est déposé sur l’échantillon.
REMARQUE : Un protocole plus détaillé pour cette étape est fourni dans la référence30. Outre le platine, l’or ou l’or/palladium peuvent également être utilisés.
- Transférer le CP isolé frais dans une solution de fixation fraîchement préparée contenant 2 % de paraformaldéhyde et 2,5 % de glutaraldéhyde dans un tampon Na-cacodylate 0,1 M (pH 7,4). Incuber pendant une nuit à 4 °C.
- Visualisez les échantillons de PC avec SEM (voir le tableau des matériaux). La procédure de visualisation du tissu CP via SEM est similaire à celle d’autres types de tissus et dépend des logiciels et instruments utilisés. Un protocole SEM étape par étape accompagné d’une vidéo est disponible en référence31 ou en référence30.
Résultats
Le protocole décrit facilite l’isolement efficace de la PC à partir des ventricules latéraux (Figure 2A-C) et quatrième (Figure 2D-F) du cerveau de la souris. Après avoir isolé tout le cerveau, les forceps sont utilisés pour hémisecter le cerveau de manière sagittale et identifier les PC flottant dans les ventricules latéraux. La PC du quatrième ventricule peut être isolée du côt...
Discussion
Ici, une méthode pour isoler le plexus choroïde (CP) hors du ventricule latéral et du quatrième ventricule d’un cerveau de souris est décrite. Toute cette méthode de montage du CP facilite une analyse plus approfondie en utilisant un répertoire de techniques pour obtenir une vue complète de la morphologie du CP, de la composition cellulaire, du transcriptome, du protéome et du sécrétome. De telles analyses sont cruciales pour mieux comprendre cette structure remarquable qui dépasse des ventricules du cervea...
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été soutenu par la Fondation belge pour la recherche sur la maladie d’Alzheimer (SAO; numéro de projet: 20200032), la Fondation pour la recherche Flandre (FWO Vlaanderen; numéros de projet: 1268823N, 11D0520N, 1195021N) et le Fonds Baillet Latour. Nous remercions le VIB BioImaging Core pour la formation, le soutien et l’accès au parc d’instruments.
matériels
| Name | Company | Catalog Number | Comments |
| 26G x 1/2 needle | Henke Sass Wolf | 4710004512 | |
| Aluminium specimen mounts | EM Sciences | 75220 | |
| Cacodylate buffer | EM Sciences | 11652 | |
| Carbon steel surgial blades | Swann-Morton | 0210 | size: 0.45 mm x 12 mm |
| Carbon adhesive tabs -12 mm | EM Sciences | 77825-12 | |
| Critical point dryer | Bal-Tec | CPD030 | |
| Crossbeam 540 | Zeiss | SEM system | |
| Forceps | Fine Science Tools GmbH | 91197-00 | |
| Glutaraldehyde | EM Sciences | 16220 | |
| Heparin | Sigma-Aldrich | H-3125 | |
| Ismatec Reglo ICC Digital Peristaltic pump 2-channel | Metrohm Belgium N.V | CPA-7800160 | |
| Osmium Tetroxide | EM Sciences | 19170 | |
| Paraformaldehyde | Sigma-Aldrich | P6148 | |
| Phosphate buffered saline (PBS) | Lonza | BE17-516F | |
| Platinum | Quorum | Q150T ES | PBS without Ca++ Mg++ or phenol red; sterile filtered |
| Sodium pentobarbital | Kela NV | 514 | |
| Specimen Basket Stainless Steel | EM Sciences | 70190-01 | |
| Stemi DV4 Stereo microscope | Zeiss | ||
| Surgical scissors | Fine Science Tools GmbH | 91460-11 |
Références
- Vandenbroucke, R. E. A hidden epithelial barrier in the brain with a central role in regulating brain homeostasis. Implications for aging. Annals of the American Thoracic Society. 13, 407-410 (2016).
- Engelhardt, B., Sorokin, L. The blood-brain and the blood-cerebrospinal fluid barriers: function and dysfunction. Seminars in Immunopathology. 31 (4), 497-511 (2009).
- Engelhardt, B., Wolburg-Buchholz, K., Wolburg, H. Involvement of the choroid plexus in central nervous system inflammation. Microscopy Research and Technique. 52 (1), 112-129 (2001).
- Engelhardt, B., Vajkoczy, P., Weller, R. O. The movers and shapers in immune privilege of the CNS. Nature Immunology. 18 (2), 123-131 (2017).
- De Bock, M., et al. A new angle on blood-CNS interfaces: a role for connexins. FEBS Letters. 588 (8), 1259-1270 (2014).
- Strazielle, N., Ghersi-Egea, J. F. Physiology of blood-brain interfaces in relation to brain disposition of small compounds and macromolecules. Molecular Pharmaceutics. 10 (5), 1473-1491 (2013).
- Redzic, Z. B., Segal, M. B. The structure of the choroid plexus and the physiology of the choroid plexus epithelium. Advanced Drug Delivery Reviews. 56 (12), 1695-1716 (2004).
- Kratzer, I., Ek, J., Stolp, H. The molecular anatomy and functions of the choroid plexus in healthy and diseased brain. Biochimica et Biophysica Acta-Biomembranes. 1862 (11), 183430 (2020).
- Demeestere, D., Libert, C., Vandenbroucke, R. E. Clinical implications of leukocyte infiltration at the choroid plexus in (neuro)inflammatory disorders. Drug Discovery Today. 20 (8), 928-941 (2015).
- Brkic, M., et al. Amyloid βoligomers disrupt blood-CSF barrier integrity by activating matrix metalloproteinases. Journal of Neuroscience. 35 (37), 12766-12778 (2015).
- Vandenbroucke, R. E., et al. Matrix metalloprotease 8-dependent extracellular matrix cleavage at the blood-CSF barrier contributes to lethality during systemic inflammatory diseases. Journal of Neuroscience. 32 (29), 9805-9816 (2012).
- Marques, F., et al. The choroid plexus response to a repeated peripheral inflammatory stimulus. BMC Neuroscience. 10, 135 (2009).
- Marques, F., et al. The choroid plexus in health and in disease: dialogues into and out of the brain. Neurobiology of Disease. 107, 32-40 (2017).
- Lun, M. P., Monuki, E. S., Lehtinen, M. K. Development and functions of the choroid plexus-cerebrospinal fluid system. Nature Reviews Neuroscience. 16 (8), 445-457 (2015).
- Spector, R., Keep, R. F., Snodgrass, S. R., Smith, Q. R., Johanson, C. E. A balanced view of choroid plexus structure and function: Focus on adult humans. Experimental Neurology. 267, 78-86 (2015).
- Lehtinen, M. K., et al. The choroid plexus and cerebrospinal fluid: emerging roles in development, disease, and therapy. Journal of Neuroscience. 33 (45), 17553-17559 (2013).
- Balusu, S., Brkic, M., Libert, C., Vandenbroucke, R. E. The choroid plexus-cerebrospinal fluid interface in Alzheimer's disease: more than just a barrier. Neural Regeneration Research. 11 (4), 534-537 (2016).
- Demeestere, D., Libert, C., Vandenbroucke, R. E. Therapeutic implications of the choroid plexus-cerebrospinal fluid interface in neuropsychiatric disorders. Brain, Behavior, and Immunity. 50, 1-13 (2015).
- Simon, M. J., Iliff, J. J. Regulation of cerebrospinal fluid (CSF) flow in neurodegenerative, neurovascular and neuroinflammatory disease. Biochimica et Biophysica Acta-Molecular Basis of Disease. 1862 (3), 442-451 (2016).
- Serot, J. M., Zmudka, J., Jouanny, P. A possible role for CSF turnover and choroid plexus in the pathogenesis of late onset Alzheimer's disease. Journal of Alzheimer's Disease. 30 (1), 17-26 (2012).
- Marques, F., et al. Altered iron metabolism is part of the choroid plexus response to peripheral inflammation. Endocrinology. 150 (6), 2822-2828 (2009).
- Thouvenot, E., et al. The proteomic analysis of mouse choroid plexus secretome reveals a high protein secretion capacity of choroidal epithelial cells. Proteomics. 6 (22), 5941-5952 (2006).
- Vandendriessche, C., et al. Importance of extracellular vesicle secretion at the blood-cerebrospinal fluid interface in the pathogenesis of Alzheimer's disease. Acta Neuropathologica Communications. 9 (1), 143 (2021).
- Bowyer, J. F., et al. A visual description of the dissection of the cerebral surface vasculature and associated meninges and the choroid plexus from rat brain. Journal of Visualized Experiments. (69), e4285 (2012).
- Inoue, T., Narita, K., Nonami, Y., Nakamura, H., Takeda, S. Observation of the ciliary movement of choroid plexus epithelial cells ex vivo. Journal of Visualized Experiments. (101), e52991 (2015).
- Dani, N., et al. A cellular and spatial map of the choroid plexus across brain ventricles and ages. Cell. 184 (11), 3056-3074 (2021).
- Carloni, S., et al. Identification of a choroid plexus vascular barrier closing during intestinal inflammation. Science. 374 (6566), 439-448 (2021).
- Van Hoecke, L., et al. Involvement of the choroid plexus in the pathogenesis of Niemann-Pick disease type. C. Frontiers in Cell Neuroscience. 15, 757482 (2021).
- Shipley, F. B., et al. Tracking calcium dynamics and immune surveillance at the choroid plexus blood-cerebrospinal fluid interface. Neuron. 108 (4), 623-639 (2020).
- Guerin, C. J., Kremer, A., Borghgraef, P., Lippens, S. Targeted studies using serial block face and focused ion beam scan electron microscopy. Journal of Visualized Experiments. (150), e59480 (2019).
- JoVE. Scanning Electron Microscopy (SEM). JoVE Science Education Database. , (2022).
- Pauwels, M., et al. Choroid plexus derived extracelular vesicles exhibit brain targeting characteristics). Biomaterials. 290, 121830 (2022).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon