Method Article
Édition génique de cellules primaires de macaque rhésus B
Dans cet article
Résumé
Nous présentons une méthode de culture et d’édition de gènes de cellules B de macaque rhésus primaire utilisant CRISPR / Cas9 et le virus adéno-associé recombinant sérotype 6 pour l’étude des thérapies cellulaires B.
Résumé
Les lymphocytes B et leur descendance sont les sources d’anticorps fortement exprimés. Leurs capacités élevées d’expression protéique ainsi que leur abondance, leur accessibilité facile via le sang périphérique et leur facilité pour les transferts adoptifs simples en ont fait une cible attrayante pour les approches d’édition de gènes pour exprimer des anticorps recombinants ou d’autres protéines thérapeutiques. L’édition de gènes de cellules B primaires de souris et humaines est efficace, et les modèles murins pour les études in vivo se sont révélés prometteurs, mais la faisabilité et l’évolutivité pour des modèles animaux plus grands n’ont pas encore été démontrées. Nous avons donc développé un protocole pour éditer les cellules B primaires du macaque rhésus in vitro afin de permettre de telles études. Nous rapportons les conditions de culture in vitro et d’édition de gènes de cellules B de macaque rhésus primaire à partir de cellules mononucléées du sang périphérique ou de splénocytes à l’aide de CRISPR / Cas9. Pour réaliser l’intégration ciblée de grandes cassettes (<4,5 kb), un protocole rapide et efficace a été inclus pour la préparation du virus adéno-associé recombinant de sérotype 6 en tant que modèle de réparation dirigé par homologie à l’aide d’un vecteur auxiliaire adénoviral auto-silencieux activé par la tétracycline. Ces protocoles permettent l’étude de thérapies prospectives à base de cellules B chez les macaques rhésus.
Introduction
Les cellules B sont le fondement de l’immunité humorale. Lors de l’activation par l’antigène apparenté et les signaux secondaires, les cellules B naïves donnent naissance à des cellules B du centre germinal, des cellules B mémoire et des plasmocytes1. Ce dernier est la source des anticorps sécrétés qui interviennent dans les fonctions protectrices de la plupart des vaccins actuellement disponibles2. Les plasmocytes ont été décrits comme des usines d’anticorps car ils sécrètent de grandes quantités d’anticorps dans le sérum - environ 2 ng / jour / cellule3, soit 7-16 g / L de sérum, faisant des anticorps l’une des trois protéines les plus abondantes dans le sérum4. Les cellules B sont abondantes dans le sang et peuvent donc être facilement obtenues et réinjectées à un individu.
Ces caractéristiques ont fait des cellules B une cible des efforts de thérapie cellulaire pour modifier le récepteur des cellules B (BCR) et exprimer des anticorps largement neutralisants (bNAbs) dirigés contre le virus de l’immunodéficience humaine (VIH)5,6,7,8,9,10,11,12,13,14,15 et d’autres protéines 16, 17,18,19,20,21. De telles approches ont montré un potentiel dans de nombreuses études sur la souris in vivo 7,8,10,11,16,22. Cependant, plusieurs obstacles doivent encore être surmontés pour la traduction clinique 9,15,23, parmi lesquels l’innocuité, la durée et l’ampleur de l’efficacité thérapeutique, ainsi que la mise à l’échelle à des animaux plus gros tels que les primates non humains (PNH). En effet, les PSN, et en particulier les macaques rhésus, qui ont une longue histoire dans la recherche sur les anticorps et le VIH24,25, sont le modèle le plus approprié pour tester ces paramètres.
Ici, nous avons développé des protocoles qui permettent de résoudre ces problèmes. À ce jour, peu d’études ont tenté de cultiver des cellules B de macaque rhésus ex vivo, et seule une sélection positive utilisant CD20 a été rapportée pour la purification des cellules B de macaque rhésus26,27,28. Nous avons établi un protocole pour l’isolement des cellules B du macaque rhésus intactes par l’épuisement négatif d’autres types de cellules. De plus, les conditions de culture sont définies pour l’édition génique ciblée des cellules B de macaque rhésus. Ce protocole décrit l’utilisation des ribonucléoprotéines CRISPR/Cas9 (RNP) et du virus adéno-associé recombinant sérotype 6 (rAAV6) comme modèle de réparation dirigée par homologie (HDRT) pour modifier des gènes de cellules de macaque rhésus B en culture. Grâce à ce protocole, des gains d’édition allant jusqu’à 40 % avec de grands inserts (~1,5 ko) ont été atteints. Nous présentons également une méthode rapide et rentable pour produire du rAAV6 en utilisant un assistant adénoviral auto-silencieux activé par la tétracycline29 pour permettre le test rapide des HDRT dans ce format. Ensemble, ces protocoles décrivent un flux de travail efficace pour l’édition de gènes de cellules B de macaque rhésus (Figure 1), permettant l’évaluation des thérapies à base de cellules B dans un modèle de PSN.
Pour commencer les expériences, le matériel du donneur peut être commandé auprès de sources commerciales ou obtenu par phlébotomie ou splénectomie. Dans cette étude, les phlébotomies et les prélèvements sanguins ont été effectués comme décrit précédemment30 en utilisant l’anticoagulant EDTA. Pour obtenir des cellules B de macaque rhésus primaire splénique, des splénectomies partielles (25% à 50%) ou totales ont été réalisées à l’aide de techniques rapportées précédemment31. Les animaux ont été à jeun pendant la nuit avant l’opération. Brièvement, pendant la chirurgie, l’abdomen a été coupé et préparé avec des gommages alternés de chlorhexidine et d’alcool isopropylique à 70% trois fois. Une incision (5-10 cm) a été faite dans l’abdomen pour identifier et isoler la rate. Le système vasculaire de la rate était ligaturé avec des sutures ou des pinces vasculaires. L’incision a été fermée en deux couches avec des sutures de polydioxanone 4-0 PDS. La splénectomie a été réalisée une seule fois pour un animal individuel. Des suspensions unicellulaires ont été préparées à partir de rate de macaque par macération à l’aide de crépines cellulaires. Les cellules mononucléaires provenant de suspensions de sang et de cellules spléniques ont été préparées par centrifugation à gradient de densité et stockées dans de l’azote liquide.
Protocole
Toutes les procédures et expériences sur les animaux ont été effectuées conformément aux protocoles approuvés par le Comité institutionnel de soin et d’utilisation des animaux de l’Institut national des allergies et des maladies infectieuses, National Institutes of Health. Un résumé des protocoles suivants est présenté à la figure 1. Les macaques rhésus mâles et femelles (Macaca mulatta) d’origine génétique indienne âgés de 2 à 8 ans ont été hébergés et soignés conformément aux directives du Comité sur le soin et l’utilisation des animaux de laboratoire dans une installation de niveau de biosécurité 2.
ATTENTION : Toutes les expériences ont été réalisées conformément aux précautions universelles pour les agents pathogènes transmissibles par le sang, avec des techniques stériles/aseptiques et un équipement de niveau de biosécurité 2 approprié dans des hottes à flux laminaire.
1. Production de rAAV6
- Préparer les réactifs pour la production de rAAV6.
- Concevoir et cloner le modèle de réparation dirigé par homologie entre les répétitions terminales inversées (ITR) d’AAV2 dans le pAAV vectoriel à l’aide de techniques standard. Assurez-vous que les bras d’homologie sont d’au moins ~250 pb de chaque côté, mais aussi peu que 60 pb peuvent suffire, bien que des bras d’homologie plus longs soient préférés si la conception de la construction le permet. Si des séquences cibles de l’un des ARNg utilisés sont présentes dans le HDRT, retirez-les en utilisant des mutations silencieuses, qui sont plus efficaces dans le motif adjacent protospacer ou la région semencière du site cible.
REMARQUE: La synthèse de gènes combinée à l’assemblage Gibson pour un clonage efficace32 peut être effectuée. Préparez un Maxiprep d’un clone correct pour la transfection. Pour la conception de sgRNA, CHOPCHOP33 est recommandé, et une liste d’autres outils peut être trouvée à https://zlab.bio/guide-design-resources. La capacité maximale d’emballage de l’AAV, y compris le RTI, est de ~4,7 kb. AAV6 est le sérotype le plus couramment utilisé pour modifier les cellules hématopoïétiques, en particulier les cellules B9. D’autres sérotypes d’AAV pour l’édition de gènes de cellules B de macaque rhésus n’ont pas été testés, mais AAV28 et AAV-DJ10,11 ont été utilisés dans des études sur la souris. - Préparer le milieu de culture 293AAV et le milieu de production conformément aux tableaux 1 et 2. Filtre stérile à travers une unité de filtration à membrane en polyéthersulfone (PES) de 0,2 μm. Conserver à 4 °C.
- Préparer 1x solution de polyéthylènemine (PEI) (1 mg/mL, 100 mL).
- Dans un bécher en verre de 250 mL, chauffer ~ 70 mL deH2Oau micro-ondes pendant ~30 s, puis ajouter 100 mg d’IPE. Ajouter un agitateur magnétique et remuer jusqu’à ce que le PEI soit en grande partie dissous.
- Ajuster le pH à 7 avec 1 M HCl, puis compléter à 100 mL avec H2O, attendre 10 min, vérifier à nouveau le pH et ajuster si nécessaire.
- Filtrer stérile la solution PEI à travers une unité de filtration à membrane PES de 0,2 μm, aliquote, et stocker −20 °C. Après décongélation, la solution peut être conservée à 4 °C jusqu’à 2 mois.
- Préparer 5x solution de polyéthylèneglycol (PEG)/NaCl.
- Peser 400 g de PEG 8 000 et 24 g de NaCl.
- Ajouter un agitateur magnétique à un bécher en verre de 2 L, ajouter le PEG 8 000 pesé et le NaCl, et rincer avec ~ 550 mL d’eau désionisée.
- Remuer avec le chauffage et porter à ébullition ou à 80-90 °C jusqu’à dissolution complète.
- Ajustez le pH à ~7,4 avec 1 M NaOH, puis réglez le volume à 1 L à l’aide d’un cylindre de mesure et transférez-le dans une bouteille en verre de 2 L avec l’agitateur magnétique.
- Autoclaver le flacon, l’agitateur magnétique et la solution au bain-marie pendant 30 min à 121 °C.
- Après l’autoclavage, refroidir la solution dans une chambre froide tout en agitant à l’aide de l’agitateur magnétique pour éviter la séparation en différentes phases. Aliquote si nécessaire et conserver à 4 °C.
- Préparer le tampon de formulation.
- Mélanger 500 mL de DPBS avec 50 μL de 10% de Pluronic F-68. Filtre stérile à travers une unité de filtration à membrane PES de 0,2 μm et stockage à température ambiante (RT).
- Concevoir et cloner le modèle de réparation dirigé par homologie entre les répétitions terminales inversées (ITR) d’AAV2 dans le pAAV vectoriel à l’aide de techniques standard. Assurez-vous que les bras d’homologie sont d’au moins ~250 pb de chaque côté, mais aussi peu que 60 pb peuvent suffire, bien que des bras d’homologie plus longs soient préférés si la conception de la construction le permet. Si des séquences cibles de l’un des ARNg utilisés sont présentes dans le HDRT, retirez-les en utilisant des mutations silencieuses, qui sont plus efficaces dans le motif adjacent protospacer ou la région semencière du site cible.
- Culture cellulaire, transfection et transduction pour la production de rAAV6
- Décongeler, mettre en culture et congeler les cellules 293AAV comme décrit par le fabricant en utilisant le milieu de culture 293AAV ci-dessus et la trypsine-EDTA pour le fractionnement. Il est recommandé de congeler certains passages précoces et d’utiliser les cellules pour la production d’AAV avant qu’elles n’atteignent le passage 40.
- Pour la production de rAAV6, ensemencez quatre boîtes de culture cellulaire de 15 cm contenant 5 x 106 cellules dans 30 ml chacune. Les cellules sont prêtes pour la transfection généralement 1-2 jours après l’ensemencement quand elles atteignent 80%-90% de confluence.
- Décongeler un Maxiprep de plasmide pAAV contenant le HDRT à emballer dans AAV6. Resuspendre 85,6 μg du plasmide pAAV dans 3 mL de milieu DMEM pur.
- Dissoudre 342 μL de solution de PEI à 1 mg/mL dans 3 mL de milieu DMEM pur. Incuber les deux solutions pendant 10 min à TA.
- Mélanger les deux tubes de 3 mL dans un tube de ~6,4 mL de mélange de transfection et incuber pendant 20 minutes à TA.
- Pendant ce temps, décongeler le vecteur auxiliaire auto-silencieux activé par la tétracycline RepCap6 du congélateur à -80 °C dans un bain-marie à 37 °C. Pour transduire les cellules 293AAV, ajouter le vecteur auxiliaire à une multiplicité d’infection (MOI) de 25 en utilisant la dose infectieuse médiane de culture tissulaire (TCID 50) et en supposant 1,15 x10 7 cellules/boîte; typiquement, 2-10 μL est utilisé par boîte de 15 cm. Bercer et faire tourner doucement les plats pour les distribuer.
- Après l’incubation du mélange de transfection, ajoutez-en 1,6 ml goutte à goutte sur chacune des quatre boîtes de 15 cm. Incuber à 37 °C et 5% de CO2 pendant une nuit.
NOTE: Alternativement, si les vecteurs rAAV6 d’intérêt sont déjà disponibles, ces vecteurs peuvent être utilisés pour fournir le génome viral à emballer, ce qui élimine le besoin de plasmides avec ce système et donne des titres rAAV6 comparables. Pour cette approche, les cellules 293AAV sont co-transduites avec le rAAV6 souhaité à un MOI de 50 (basé sur les copies du génome rAAV6 [GC]/mL) avec le vecteur auxiliaire. - Le lendemain, aspirer et jeter soigneusement le milieu de culture, et le remplacer par 30 ml de milieu de production préchauffé. Incuber pendant encore 96 h avant la récolte. Aucun autre changement moyen n’est recommandé pour maximiser les rendements.
- Récolte et purification de l’AAV6 recombinant à partir du milieu
- Sans déloger les cellules de la boîte, rassembler tout le surnageant cellulaire dans une unité filtrante avec une membrane PES de 0,2 μm au moins 50% plus grande que le volume de milieu à filtrer. Ensuite, filtrez le surnageant.
NOTE: Si des rendements plus élevés de rAAV6 sont souhaités, les cellules peuvent être récoltées et le rAAV extrait de la pastille cellulaire à l’aide de kits commerciaux ou de protocoles établis34,35. Étant donné que l’AAV6 est principalement sécrété dans le milieu36, seul le surnageant a été utilisé, ce qui a réduit la main-d’œuvre, les coûts et le temps. - Ajouter 5x solution de PEG/NaCl au surnageant filtré à 25% du volume collecté; il s’agit généralement de 30 ml si quatre boîtes de 15 cm de 30 ml sont utilisées.
- Bien mélanger en inversant, puis incuber pendant une nuit à 4 °C pour précipiter les particules virales.
REMARQUE: Les particules AAV sont stables jusqu’à 2 jours dans cette solution. - Prérefroidir une centrifugeuse à godet pivotant avec 250 ml d’inserts de tube à 4 °C. Préparer une unité de filtration centrifuge de 4 mL avec une coupure de 100 kDa et une seringue en PES hydrophile de 0,22 μm en prétraitant chaque membrane avec 2 mL de F-68 pluronique à 10 % pendant au moins 1 h à TA.
- Transférer le mélange AAV-PEG/NaCl dans un tube de 250 mL, centrifuger à 2 500 x g pendant 1 h à 4 °C, puis retirer délicatement le surnageant entier par aspiration.
- Resuspendre la pastille virale beige à blanche en tourbillonnant dans 4 mL de HEPES 1 M jusqu’à ce qu’elle soit complètement remise en suspension. Si nécessaire, laissez-le reposer pendant 5 minutes et vortex à nouveau. Remettez en suspension à l’aide d’une pipette sérologique de 5 ml et transférez le volume total dans un tube de 15 ml.
- Dans une hotte, ajouter un volume égal de chloroforme à la suspension virale, généralement 4 mL.
- Tourbillonner vigoureusement pendant 2 min, puis centrifuger à 1 000 x g pendant 5 min à TA.
- Recueillir la couche supérieure (surnageant contenant de l’AAV) dans un nouveau tube de 50 mL et jeter la couche inférieure (chloroforme).
ATTENTION : Les solutions contenant du chloroforme sont des déchets dangereux. Suivre les lignes directrices de l’établissement pour son élimination. - Placer le surnageant contenant de l’AAV sous une hotte et laisser le chloroforme restant s’évaporer pendant 30 min.
- Pendant ce temps, lavez l’unité de filtration centrifuge prétraitée et le filtre à seringue.
- Ajouter 1,5 mL de tampon de formulation à l’unité de filtration centrifuge prétraitée. Centrifuger à 3 500 x g pendant 10 min à 15 °C dans un rotor à godet oscillant. Répétez cette étape avec 4 mL de tampon de formulation pour laver la membrane.
- Rincer le filtre de la seringue deux fois avec 5 mL de tampon de formulation à l’aide d’une seringue de 5 mL.
- Charger le surnageant contenant du virus AAV ~4 mL provenant de l’extraction du chloroforme dans une seringue de 5 mL, fixer le filtre de la seringue lavée et filtrer directement dans l’unité de filtration centrifuge.
- Centrifuger à 3 500 x g pendant 25 min à 15 °C, puis confirmer que la solution AAV dans le filtre est comprise entre 50 et 100 μL. Si le volume de la solution est de > 100 μL, poursuivre la centrifugation.
- Après avoir retiré le filtrat, ajouter 4 mL de tampon de formulation à l’intérieur de la tasse de l’unité de filtration centrifuge et mélanger la solution uniformément par pipetage. Centrifuger à 3 500 x g pendant 25 min à 15 °C, puis confirmer que la solution AAV dans le filtre est comprise entre 50 et 100 μL. Si le volume de la solution est de > 100 μL, poursuivre la centrifugation. Répétez cette étape pour un autre lavage.
- Après la centrifugation finale, confirmer que le volume de la solution est de 50-70 μL; Si ce n’est pas le cas, continuez à centrifuger. Transférer la préparation dans un tube de 1,5 mL. Aliquote si désiré et conserver à −80 °C.
- Sans déloger les cellules de la boîte, rassembler tout le surnageant cellulaire dans une unité filtrante avec une membrane PES de 0,2 μm au moins 50% plus grande que le volume de milieu à filtrer. Ensuite, filtrez le surnageant.
- Détermination du titre AAV6 recombinant par qPCR
NOTE: Les amorces qPCR sont recuites dans la région ITR et devraient donc convenir à toutes les constructions clonées en pAAV.- Décongeler une partie aliquote du rAAV6 à titrer et une partie aliquote du matériau de référence AAV6. Le matériau de référence AAV6 doit être proche de 4 x 1011 GC/mL; sinon, ajuster les dilutions en conséquence.
- Effectuer une digère de DNase I pour éliminer tout ADN plasmidique libre restant dans la préparation rAAV6 en combinant 2,0 μL de l’échantillon ou du matériau de référence AAV6 avec 15,6 μL deH2Osans nucléase, 2,0 μL de tampon 10x DNase I et 0,4 μL de DNase I.
- Mélanger et incuber doucement pendant 30 min à 37 °C, puis transférer sur la glace. Il s’agit de la dilution 1 (voir tableau 3).
- Préparer avec de l’eau des dilutions en série quintuples de tous les échantillons et du matériau de référence AAV6 comme indiqué dans le tableau 3 ci-dessous.
- Préparez un mélange maître qPCR vert SYBR. Par puits, mélanger 4,7 μL d’eau exempte de nucléases avec 10 μL de mélange maître SYBR Green, 0,15 μL d’amorce ITR vers l’avant à 100 μM et 0,15 μL d’amorce ITR inverse à 100 μM.
REMARQUE : Chaque échantillon est mesuré en double, avec 16 puits pour l’étalon de référence, 8 puits par échantillon et 2 puits pour un contrôle sans gabarit. Préparez 10 % de mélange principal supplémentaire pour tenir compte des erreurs de pipetage. - Dans une plaque de réaction optique à 96 puits ou 384 puits, charger 15 μL/puits du mélange maître qPCR vert SYBR.
- Ensuite, chargez 5 μL d’échantillons et de matériau de référence AAV6 ou d’eau sans nucléase pour le contrôle sans gabarit. Pour l’étalon de référence AAV6, dilution de charge 2 à dilution 9. Pour les échantillons, dilution de charge 5 à dilution 8. Mesurer chaque dilution en double. Évitez les bulles.
- Scellez la plaque chargée avec un film transparent optique, centrifugez à 800 x g pendant 1 min à RT et chargez la plaque dans l’instrument qPCR avec la configuration appropriée à 96 puits ou 384 puits.
- Configurez et exécutez l’instrument qPCR à l’aide de la détection SYBR dans les conditions de cyclage suivantes : 98 °C pendant 3 min, puis 40 cycles de 98 °C pendant 15 s et 58 °C pendant 30 s, suivis d’une courbe de fusion.
- Analyser les données à l’aide du logiciel de l’instrument en utilisant la concentration du matériau de référence AAV6 en copies génomiques par millimètre (GC/mL) comme courbe standard (voir le tableau 3). Calculer la concentration finale de l’échantillon en multipliant par le facteur de dilution.
- S’assurer que la courbe standard R2 est proche de 1,0, que l’efficacité de la PCR est de 90 % à 110 %, que la ligne de base a été supprimée, que la courbe de fusion montre un seul pic, que les valeurs C t changent en fonction des dilutions et que les doublons sont à moins de 0,5 Ct; sinon, excluez les valeurs aberrantes. Attendez-vous à des rendements comme dans la figure 2.
2. Préparation des milieux et des stimuli des cellules B
- Préparer le milieu de décongélation : Combiner le RPMI-1640 avec 20 % de FCS. Filtre stérile à travers une unité de filtration à membrane PES de 0,2 μm. Conserver à 4 °C.
- Préparer le milieu de culture de cellules B : Combiner les réactifs du tableau 4, puis filtrer stérile à travers une unité filtrante à membrane PES de 0,2 μm. Conserver à 4 °C.
- Remettre en suspension chacun des stimulants des lymphocytes B du tableau 5 à des concentrations mères dans le milieu de culture de cellules B, à l’exception de l’ODN CpG qui doit être remis en suspension dans de l’eau exempte de nucléase. Conserver à −80 °C.
- Si vous effectuez une déplétion négative des cellules non B (étape 4 facultative), préparez DPBS (sans calcium, sans magnésium) avec 2% FCS (DPBS 2% FCS). Filtre stérile à travers une unité de filtration à membrane PES de 0,2 μm. Conserver à 4 °C.
3. Préparation et culture de cellules B de macaque rhésus
NOTE: Des PBMC ou des splénocytes de macaque rhésus cryoconservés sont utilisés pour mettre en place la culture cellulaire30,31.
- Préchauffer le milieu de décongélation et les milieux de culture de cellules B au bain-marie à 37 °C. Décongeler les stimulants des cellules B du tableau 5 sur la glace.
- Préparer un tube de taille appropriée contenant un milieu de décongélation préchauffé. Cela devrait idéalement être plus de 10 fois le volume des cellules décongelées.
- Décongeler un à deux cryoflacons de PBMC ou de splénocytes à la fois dans un bain-marie à 37 °C et décanter dans le tube préparé avec un milieu préchauffé. Rincez les cryotubes pour recueillir toutes les cellules.
- Centrifuger les cellules à 200 x g pendant 10 min à TA.
REMARQUE: Ces paramètres de centrifugation réduisent la contamination plaquettaire tout en préservant les rendements PBMC. Des vitesses plus élevées telles que 350 x g pendant 5 minutes peuvent être utilisées. - Remettez les cellules en suspension dans un milieu de décongélation de 10 ml pour le lavage.
- Répétez les étapes 3.4 et 3.5 pour un total de trois centrifugations afin d’éliminer le milieu de congélation. Après la dernière centrifugation, remettre les cellules en suspension à une température estimée de ~5 x 106 cellules/ml dans un milieu de culture de cellules B.
REMARQUE: Le protocole ci-dessus cultive des préparations entières de PBMC ou de splénocytes contaminées par d’autres cellules. Si des cultures de cellules B plus pures sont nécessaires, bien qu’à des rendements totaux de cellules B significativement réduits, passez à l’étape 4. Aucune différence n’a été observée dans l’efficacité de la révision entre les deux méthodes. - Diluer une partie aliquote de 10 μL de cellules au besoin avec un milieu de culture de cellules B pour le comptage. Compter à l’aide d’un hémocytomètre et d’une coloration au bleu de trypan, en combinant des volumes égaux de cellules remises en suspension et une solution de bleu de trypan à 0,4%.
- Ajuster la concentration cellulaire à 3 x 106 cellules/ml avec le milieu de culture de cellules B en fonction du nombre de cellules. Ensuite, ajoutez les stimulants des cellules B à leurs concentrations finales conformément au tableau 5 et mélangez.
- Transférer les cellules dans une boîte de culture cellulaire appropriée. Dans l’ensemble, 0,6 x 10 6-0,7 x 106 cellules/cm2 est recommandé. Incuber les cellules à 37 °C avec 5% de CO 2 pendant 48 h ±2 h.
4. Déplétion négative facultative des cellules non-B
NOTE: Le rendement et la pureté dépendent du pourcentage d’entrée de cellules B parmi les PBMC, qui peut différer considérablement d’un macaque rhésusindividuel 27. Attendez-vous à une pureté de 80% à 95%, à une efficacité de 60% et à 1 x 10 6-1,5 x 106 cellules à partir de 1 x 107 PBMC.
- Après le dernier lavage (étape 3.6), remettre les cellules en suspension à 1 x 108 cellules/ml dans du bloc FCS à 2 % de DPBS et du bloc Fc humain dilué 1:200. Le nombre de cellules est basé sur le nombre de cellules décongelées.
- Incuber pendant 15 minutes sur de la glace pour bloquer les récepteurs Fc, puis ajouter les anticorps biotinylés dans le tableau 6. Incuber pendant encore 20 minutes sur la glace.
- Remplir le tube avec du DPBS 2% FCS et faire tourner à 200 x g pendant 10 min à 4 °C.
- Remettez en suspension les cellules dans DPBS 2% FCS à 80% du volume de l’étape 4.1 (c.-à-d. 80 μL par 1 x 107 cellules).
- Ajouter des billes magnétiques de streptavidine à la suspension cellulaire à 20 % du volume de l’étape 4.1 (c.-à-d. 20 μL de billes par 1 x 107 cellules).
- Incuber les cellules pendant 15 minutes sur de la glace et agiter de temps en temps.
- Pendant ce temps, par 1 x 108 cellules, préparez un séparateur magnétique avec une grande colonne d’épuisement magnétique et un filtre de pré-séparation. Rincer le filtre et la colonne de préséparation avec 2 ml de DPBS 2 % FCS par gravité et jeter l’écoulement continu. Installez un tube de prélèvement de 15 mL.
REMARQUE: L’utilisation d’autres colonnes telles que des colonnes de sélection positive ou d’autres systèmes de purification de billes magnétiques peut réduire considérablement la pureté. - Après l’incubation, compléter les cellules à 0,5 mL avec DPBS 2% FCS si le volume est de <0,5 mL. Si le volume est de ≥0,5 mL, continuez simplement.
- Chargez la suspension cellulaire dans le filtre de préséparation de la colonne préparée et recueillez le débit dans le tube de 15 mL.
- Éluer deux fois les cellules B enrichies non liées en ajoutant 1 mL de DPBS 2% FCS dans le filtre de pré-séparation. Recueillir les cellules non liées dans le même tube par écoulement gravitaire.
NOTE: Une élution supplémentaire peut augmenter légèrement le rendement. La pureté et l’efficacité peuvent être évaluées par la cytométrie en flux des cellules d’entrée, des cellules enrichies et des cellules retenues sur la colonne. Pour obtenir les cellules retenues sur la colonne, retirez la colonne de l’aimant et rincez avec 3 ml de DPBS 2% FCS à l’aide du piston fourni. Si vous le souhaitez, évaluer la pureté par cytométrie en flux comme dans la figure 3 en utilisant les réactifs du tableau 7. - Centrifuger les lymphocytes B enrichis à 200 x g pendant 10 min à 4 °C.
- Remettez les cellules en suspension à une température estimée ~5 x 106 cellules/mL dans un milieu de culture de cellules B et continuez à l’étape 3.7.
5. Édition du gène primaire des cellules B du macaque rhésus
- Après avoir activé les cellules B du macaque rhésus pendant 48 h ± 2 h, préparer les réactifs pour l’électroporation et la transduction.
- Préchauffer le DMSO, le tampon duplex sans nucléase, le tampon T et le tampon E (kit d’électroporation de 10 μL) ou E2 (kit d’électroporation de 100 μL) du kit d’électroporation à RT.
- Décongeler les stimulants rAAV6 HDRT et B du tableau 5 sur la glace.
- Resuspendre les sgRNAs CRISPR-Cas9 à 100 μM dans un tampon duplex. Reconstituer pendant 10 min à TA, et mélanger en tourbillonnant et en effleurant. Gardez les sgRNA reconstitués sur la glace jusqu’à utilisation. Conserver à −80 °C.
REMARQUE: Les sgRNA CRISPR-Cas9 peuvent être conçus avec divers outils en ligne (voir 1.1.1) et peuvent varier considérablement dans leur efficacité de coupe. Des tests empiriques de l’efficacité de coupe sont recommandés à l’aide de tests tels que TIDE37 ou ICE38. - Par électroporation de 10 μL, préparer 550 μL de milieu de culture de cellules B avec tous les stimulants du tableau 5 et ajouter 1 % de DMSO. Multipliez les volumes par 10 pour des électroporations de 100 μL. En option, 10% de ce milieu peut être préparé sans antibiotique-antimycotique, ce qui augmente légèrement la viabilité cellulaire après la transfection.
- Par électroporation de 10 μL, préparer un puits d’une plaque de culture cellulaire de 48 puits avec 50 μL de milieu de culture de cellules B avec des stimulants et sans antibiotique-antimycotique, si vous l’utilisez. Pour les électroporations de 100 μL, pipeter 500 μL dans les puits d’une plaque de 6 puits.
- Ajouter rAAV6 HDRT au milieu dans les puits, jusqu’à 20% du volume dans le puits. Visez des MOI allant de 1 x 10 5-1 x 10 6 en fonction du nombre de cellules par transfection (électroporation de 10 μL : 5 x 10 5 cellules ; électroporation de 100 μL :5 x 106 cellules) et de la GC dans la préparation rAAV6. Des concentrations élevées de stock de rAAV6 de 5 x 1013 GC/mL à 5 x 1014 GC/mL sont recommandées pour obtenir des MOI élevés avec de faibles volumes.
REMARQUE: Des MOI plus faibles peuvent entraîner une réduction de l’efficacité de l’édition, et des MOI de 5 x 105 sont généralement proches de l’efficacité maximale de l’édition que nous avons observée. Aucune influence de la variation des MOI sur la viabilité des lymphocytes B n’a été observée. Il est recommandé d’inclure des témoins sans rAAV6 HDRT, sans transfection RNP et sans les deux. - Préchauffer les plats préparés et le milieu restant en les transférant dans un incubateur à 37 °C avec 5% de CO2.
- Par électroporation de 10 μL, préparer 1,15 μL de ribonucléoprotéine (RNP) : Mélanger 0,4 μL de Cas9 61 μM avec 0,75 μL d’ARNg 100 μM dans un tampon duplex. Préparez un supplément (30% de plus pour une seule électroporation est recommandé) en raison d’une erreur de pipetage et pour éviter les bulles lors du chargement des pointes d’électroporation. Échelle 10 fois pour des pointes de 100 μL.
- Incuber le RNP pendant au moins 15 min à TA avant de le mélanger avec les cellules. Après l’incubation, plusieurs RNP peuvent être combinés si plus d’un locus doit être ciblé simultanément. Aucune différence significative d’efficacité n’a été observée avec jusqu’à trois loci en même temps.
- Pendant ce temps, préparez les cellules pour l’électroporation. Gardez les cellules à TA en tout temps pour éviter les chocs de température. Récolter les cellules après 48 h ± 2 h de culture dans un récipient approprié. Rincez la vaisselle avec du DPBS pour recueillir le maximum de cellules.
- Centrifuger les cellules à 200 x g pendant 10 min à TA. Jeter le surnageant et remettre les cellules en suspension dans DPBS à ~2 x 106 cellules/mL.
- Combiner 10 μL de solution de bleu de trypan à 0,4% avec 10 μL de suspension cellulaire et compter à l’aide d’un hémocytomètre.
REMARQUE: À ce stade, en raison de la perte pendant la récolte et le lavage, attendez-vous à environ 60% des cellules qui ont été mises en culture 48 h ± 2 heures plus tôt. - Pendant ce temps, centrifuger les cellules à 200 x g pendant 10 min à TA. Jetez le surnageant, en veillant à minimiser les DPBS restants. Resuspendre les cellules dans un tampon T préchauffé (RT) à 5,55 x 107 cellules/mL en fonction du nombre de cellules ci-dessus.
- Configurez le système de transfection en allumant la machine et en la réglant sur 1 350 V, 15 ms et 1 impulsion. Placez la station de pipette à l’intérieur de la hotte à flux laminaire
- Pour chaque série de 10 électroporations, préparer un tube de transfection avec 3 mL de tampon E (pour 10 μL de transfections) ou E2 (pour 100 μL de transfections). Insérez le tube dans la station de pipette.
- Par électroporation de 10 μL, combiner 1,15 μL de RNP avec 9 μL de cellules. Assurez-vous d’avoir un volume suffisant (+ 30%) pour éviter d’aspirer de l’air dans l’embout d’électroporation. Incuber à TA pendant 1-2 min avant l’électroporation.
- Aspirer 10 μL ou 100 μL de RNP et de mélange cellulaire dans l’embout d’électroporation de taille appropriée sur une pipette d’électroporation, insérer la pipette chargée dans la station de pipette et démarrer l’électroporation. Assurez-vous que les embouts sont complètement exempts de bulles d’air pour éviter les arcs électriques. Surveillez pendant l’électroporation pour vérifier qu’il n’y a pas d’arc électrique.
- Éjecter immédiatement les cellules électroporées dans le petit volume de milieu préparé et préchauffé avec ou sans rAAV6 à l’intérieur de la plaque de 48 puits (transfections de 10 μL) ou de 6 puits (transfections de 100 μL). Répétez les étapes 5.15 à 5.17 avec les échantillons restants. Ajouter des échantillons témoins sans transfection dans les puits de culture.
- Incuber les cellules à 37 °C avec 5 % de CO 2 pendant 4 h ±2 h, puis ajouter le milieu de culture de cellules B préparé et préchauffé contenant des stimulants, du DMSO et des antibiotiques/antimycotiques : 450 μL pour les transfections de 10 μL ou 4,5 mL pour les transfections de 100 μL.
- Poursuivre l’incubation à 37 °C avec 5% de CO2 pendant 12-24 h. Ensuite, changez le milieu en milieu de culture de cellules B contenant des stimulants et des antibiotiques / antimycotiques sans DMSO si une culture prolongée est souhaitée. L’analyse de l’ADN génomique peut être effectuée après 24 heures. La PCR numérique par gouttelettes utilisant une amorce à l’extérieur du bras d’homologie et une amorce à l’intérieur de l’insert peut être utilisée pour quantifier l’efficacité d’édition39. Effectuez des PCR pour amplifier le site d’insertion et le séquençage de Sanger pour vérifier l’édition correcte.
- Pour l’analyse des niveaux de protéines, cultiver les cellules pendant 40 à 48 heures après l’électroporation pour permettre des changements d’expression protéique, et effectuer une analyse par cytométrie en flux à l’aide des réactifs du tableau 7.
Résultats
La production de rAAV6 avec l’utilisation de l’adénoviral auxiliaire auto-silencieux activé par la tétracycline a entraîné la production de 4 x 10 10 GC/mL de milieu de culture cellulaire en moyenne, surpassant ainsi la production en utilisant une triple transfection standard sans aide de 30 à40 fois (Figure 2).
La purification facultative des cellules B du macaque rhésus a entraîné l’élimination de la grande majorité des lymphocytes T CD3+ et des cellules myéloïdes CD14+ et/ou CD16+, avec des puretés de 80 % à 95 % de cellules B CD20+ obtenues systématiquement (Figure 3). Sur la base de nos conceptions précédentes dans les cellules B murines7, nous avons développé une méthode pour modifier la spécificité du récepteur des cellules B des cellules B du macaque rhésus tout en maintenant simultanément l’exclusion allélique dans la grande majorité des cellules B en supprimant les chaînes légères d’anticorps endogènes par la perturbation de leur région constante. Nous avons construit un HDRT sans promoteur à insérer dans le locus IGH entre le dernier gène IGHJ et l’amplificateur Eμ des cellules rhésus macaque B (Figure 4). Cette construction utilise le promoteur endogène VH de la région VDJ en amont naturellement réarrangée dans les cellules B matures et n’est donc pas exprimée par les génomes épisomiques AAV. De plus, cette construction nécessite l’épissage dans les régions constantes à chaîne lourde d’anticorps en aval pour être exprimées à la surface de la cellule. Par conséquent, la liaison à l’antigène spécifique à la surface cellulaire montrée par cytométrie en flux indique une intégration correcte du locus cible et que la séquence insérée est fonctionnelle.
Nous avons emballé une telle construction codant pour l’anticorps Ab1485, un anti-VIH bNAb40 dérivé du macaque rhésus, dans rAAV6 et l’avons utilisée pour modifier les cultures activées de splénocytes ou de PBMC de macaques rhésus, comme décrit ci-dessus (Figure 5A). Le protocole a maintenu une viabilité cellulaire élevée (~90%) tout en supprimant simultanément l’expression de la chaîne légère dans ~80% des cellules B. La majorité des lymphocytes B exprimaient encore l’isotype IgM (Figure 5B). L’ajout du rAAV6 codant pour le HDRT Ab1485 a entraîné l’édition de gènes et l’expression de surface Ab1485 dans 16% à 21% des cellules B (Figure 5A), bien qu’à une intensité de fluorescence plus faible pour les chaînes d’anticorps que sur les cellules B non éditées (Figure 5A panneau droit, Figure 5C). Cela peut être le résultat de la compétition des épitopes entre la coloration de l’antigène et les monoclonaux utilisés pour détecter le BCR de surface en cytométrie en flux, ainsi que de l’expression réduite réelle des protéines en raison de la nature polycistronique du HDRT et de l’épissage moins efficace. L’ajout de 1 % de DMSO et d’incubations prolongées et concentrées avec le rAAV6 HDRT a généralement augmenté l’efficacité de l’édition (Figure 6A-C). En utilisant cette méthode spécifique, généralement de 5% à 20% et jusqu’à 40%, l’efficacité d’édition est obtenue en fonction du macaque rhésus individuel (Figure 5A, Figure 6A-E) et de la qualité du lot rAAV6 HDRT (Figure 6E). Dans l’ensemble, nous présentons des protocoles pour une production efficace de rAAV6 ainsi que pour la culture, la purification et la génération des cellules B du macaque rhésus.
| Réactifs | Volume | Stock | Concentration finale |
| DMEM, Haute teneur en glucose | 500 mL | 1 x | ~ 88,5 % |
| FCS, inactivé par la chaleur | 50 mL | 1 x | ~ 8,85 % |
| Antibiotique/Antimycotique | 5 mL | 100 x | 1 x |
| Glutamine | 5 mL | 200 mM | 2 mM |
| Sodium Pyruvate | 5 mL | 100 mM | 1 mM |
Tableau 1 : Le milieu de culture cellulaire 293AAV.
| Réactifs | Volume | Stock | Concentration finale |
| DMEM, Haute teneur en glucose | 500 mL | 1 x | ~ 95,2 % |
| FCS, inactivé par la chaleur | 10 mL | 1 x | ~ 1,9 % |
| Antibiotique/Antimycotique | 5 mL | 100 x | 1 x |
| Glutamine | 5 mL | 200 mM | 2 mM |
| Sodium Pyruvate | 5 mL | 100 mM | 1 mM |
Tableau 2 : Le milieu de production de cellules 293AAV.
| Série de dilutions | Volume de l’échantillon (μL) | Diluant et volume | Facteur de dilution | Dilution totale | Référence AAV6 |
| GC/ml | |||||
| Dilution 1 | Échantillon de 2 μL ou norme de référence AAV à 4,1 x 1011 GC/mL | 18 μL de tampon DNAseI et enzyme | 10 x | 10 x | 4,1 x 1010 |
| Dilution 2 | 15 μL Dil. 1 | 60 μL H2O | 5 x | 50 x | 8,2 x 109 |
| Dilution 3 | 20 μL Dil. 2 | 80 μL H2O | 5 x | 250 x | 1,6 x 109 |
| Dilution 4 | 20 μL Dil. 3 | 80 μL H2O | 5 x | 1250 x | 3,3 x 108 |
| Dilution 5 | 20 μL Dil. 4 | 80 μL H2O | 5 x | 6250x | 6,6 x 107 |
| Dilution 6 | 20 μL Dil. 5 | 80 μL H2O | 5 x | 31250 x | 1,3 x 107 |
| Dilution 7 | 20 μL Dil. 6 | 80 μL H2O | 5 x | 156250 x | 2,6 x 106 |
| Dilution 8 | 20 μL Dil. 6 | 80 μL H2O | 5 x | 781250 x | 5,24 x 105 |
| Dilution 9 | 20 μL Dil. 7 | 80 μL H2O | 5 x | 3906250 x | 1,05 x 105 |
Tableau 3 : table de dilution qPCR.
| Réactif | Volume | Stock | Concentration finale |
| RPMI-1640 | 420 mL | 1 x | 84% |
| FCS, inactivé par la chaleur | 50 mL | 1 x | 10% |
| Antibiotique/Antimycotique | 5 mL | 100 x | 1 x |
| Glutamine | 5 mL | 200 mM | 2 mM |
| Sodium Pyruvate | 5 mL | 100 mM | 1 mM |
| HEPES | 5 mL | 1 M | 10 mM |
| 2-B-mercapto-éthanol | 550 μL | 55 mM | 55 μM |
| Acides aminés non essentiels | 5 mL | 100 x | 1 x |
| Insuline-Transfert-Sélénium | 5 mL | 100 x | 1 x |
Tableau 4 : milieu de culture de cellules B.
| Réactif | Dilution | Stock | Concentration finale |
| MegaCD40L | 1:1000 | 100 μg/mL | 100 ng/mL |
| CpG ODN | 1:300 | 1 mg/mL | 3,33 μg/mL |
| BAFF humain | 1:1000 | 40 μg/mL | 40 ng/mL |
| IL-2 humaine | 1:1000 | 50 μg/mL | 50 ng/mL |
| IL-10 humaine | 1:1000 | 50 μg/mL | 50 ng/mL |
Tableau 5 : Stimulants des lymphocytes B.
| Anticorps | Clone | Dilution | Conc. finale |
| CD3 anti-humain | FN-18 | 1:40 | 2,5 μg/mL |
| CD8a anti-humain | RPA-T8 | 1:200 | 2,5 μg/mL |
| CD14 anti-humain | M5E2 | 1:200 | 2,5 μg/mL |
| CD16 anti-humain | 3G8 | 1:200 | 2,5 μg/mL |
| CD33 anti-humain | AC104.3E3 | 1:50 | 1 essai |
| CD64 anti-humain | 10.1 | 1:800 | 0,625 μg/mL |
| CD66 anti-humain | TET2 | 1:11 | 1 essai |
| CD89 anti-humain | R59 | 1:800 | 0,625 μg/mL |
Tableau 6 : Anticorps pour la déplétion facultative des cellules non-B.
| Réactif | Type/clone | Dilution/concentration de travail |
| CD14 anti-humain AlexaFluor647 | M5E2 | 1:50 |
| CD16 anti-humain AlexaFluor700 | 3G8 | 1:50 |
| CD20 anti-humain PECy7 | 2H7 | 1:50 |
| CD3 PE anti-humain | DS34-2 | 1:50 |
| Zombie-NIR | - | 1:500 |
| HLA-DR BV605 anti-humain | L243 | 1:200 |
| Ig lambda à chaîne légère anti-humaine APC | MHL-38 | 1:50 |
| anti-humain Kappa Light Chain FITC | polyclonal | 1:500 |
| IgM anti-humain BV421 | MHM-88 | 1:50 |
| Antigène RC1, biotinylé aléatoirement | - | 5 μg/mL |
| Streptaviridine-PE | - | 1:500 |
Tableau 7 : Réactifs cytométriques en flux pour analyse.
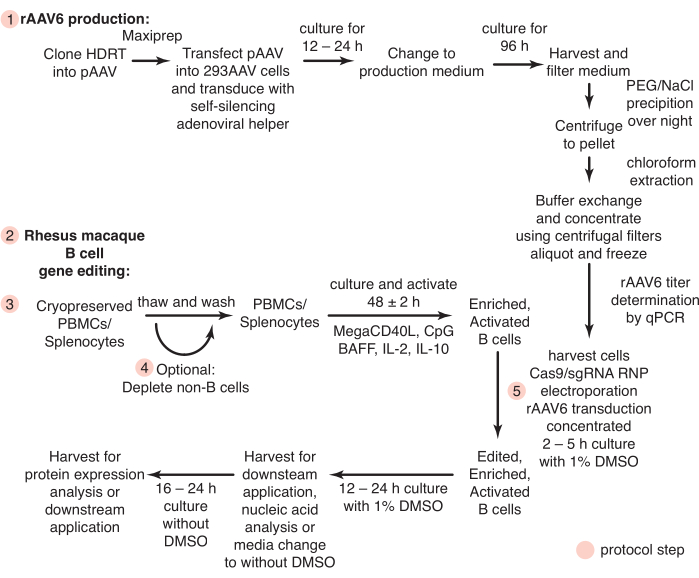
Figure 1 : Vue d’ensemble schématique de la production de rAAV6 et de l’édition génique des cellules primaires du macaque rhésus B. Les protocoles sont divisés en production de rAAV6 (étape 1) et édition de gènes de cellules B de macaque rhésus (étapes 2-5), y compris une étape facultative pour la déplétion des cellules non-B (étape 4). Les étapes des protocoles sont indiquées par des cercles rouges. Veuillez cliquer ici pour voir une version agrandie de cette figure.
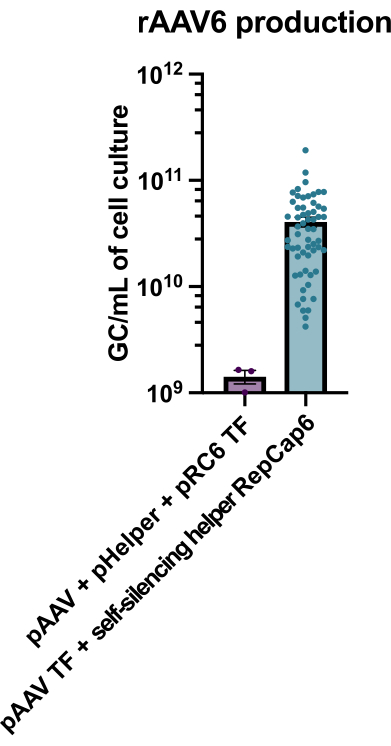
Figure 2 : Rendements élevés de rAAV6 à l’aide d’un assistant adénoviral auto-silencieux. rAAV6 a été produit en utilisant les méthodes décrites ici (transfection pAAV [TF] + aide auto-silencieuse RepCap6, aide adénovirale auto-silencieuse) ou triple transfection typique sans aide de pAAV, pHelper et pRepCap6 (pRC6). rAAV6 a été purifié à partir du surnageant cellulaire seulement. Les méthodes utilisant les vecteurs auxiliaires adénoviraux auto-silencieux ont produit 30 à 40 fois plus de rAAV titré par qPCR, comme décrit ci-dessus. Chaque point représente une production individuelle de rAAV utilisant diverses constructions pAAV de 2 à 20 expériences indépendantes. Moyenne ± SEM est tracée. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Figure 3 : Enrichissement des lymphocytes B par l’épuisement négatif des lymphocytes non B. Les cellules B de macaque rhésus ont été enrichies à partir de PBMC selon le protocole décrit et enrichies à 90% de pureté. Les entrées et sorties de pré-enrichissement après enrichissement sont affichées. Fermé sur des PBMC singulet en direct. Représentant de cinq expériences indépendantes. Veuillez cliquer ici pour voir une version agrandie de cette figure.
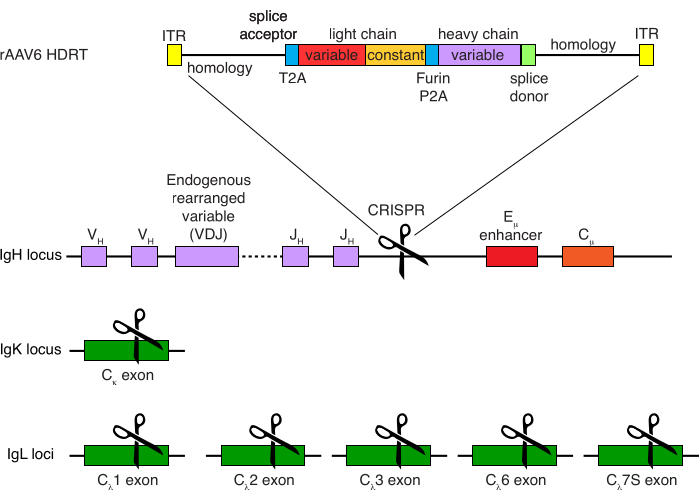
Figure 4 : Stratégie de ciblage utilisée pour modifier la spécificité du récepteur des cellules B du macaque rhésus. rAAV6 a été produit avec le HDRT représenté. Le HDRT se compose d’un bras d’homologie de 266 bp 5', suivi de 111 pb de l’accepteur d’épissage de l’exon 1 du macaque rhésus, puis d’un linker GSG avec une séquence peptidique 2A autoclivant (T2A) du virus Thosea asigna, suivie d’une séquence leader et de la chaîne légère complète de l’anticorps anti-macaque rhésus Ab1485 en tant que macaque rhésus IGLC1. Ceci est suivi d’un site de clivage de la furine, d’un agent de liaison GSG et d’une séquence peptidique 2A autoclivant du teschovirus porcin (Furin-P2A), suivie d’une autre séquence leader et de la variable à chaîne lourde Ab1485, suivie de 52 pb de la séquence donneuse d’épissage IGHJ4 du macaque rhésus, pour permettre l’épissage dans les régions constantes à chaîne lourde d’anticorps en aval, et d’un bras d’homologie de 514 pb. Cette construction a été ciblée dans le locus IGH entre le dernier gène IGHJ et l’amplificateur Eμ en utilisant la séquence cible de sgRNA GAGATGCCAGAGCAAACCAG. Les deux bras d’homologie ont été conçus pour se terminer au site de coupe de ce sgRNA, supprimant ainsi la séquence cible et permettant une efficacité d’intégration optimale. Simultanément, pour maintenir l’exclusion allélique et l’expression d’un seul récepteur de cellules B, nous avons supprimé les chaînes légères endogènes en utilisant des ARNg ciblant le macaque rhésus IGKC avec la séquence cible GGCGGGAAGATGAAGACAGA et IGLC1, IGLC2, IGLC3, IGLC6 et IGLC7S en utilisant la séquence cible CTGATCAGTGACTTCTACCC. Le HDRT comprenait des mutations silencieuses empêchant le clivage de la séquence IGLC1 par ce sgRNA. Veuillez cliquer ici pour voir une version agrandie de cette figure.
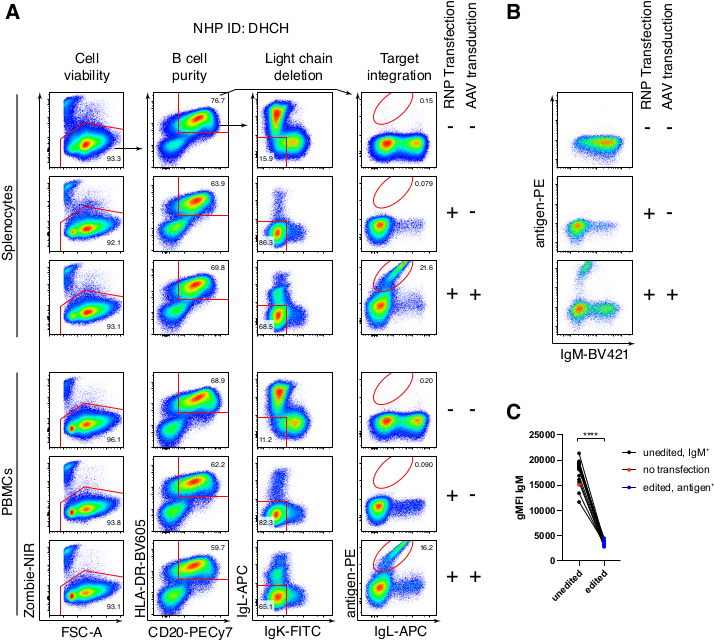
Figure 5 : Édition génique de cellules primaires de macaque rhésus B. (A) Les splénocytes primaires (panneau supérieur) ou PBMC (panneau inférieur) du même macaque rhésus ont été cultivés sans déplétion de cellules non B et édités comme décrit ci-dessus. La stratégie de ciblage était illustrée à la figure 4. Deux jours après l’électroporation, les cellules ont été récoltées et colorées en surface pour l’analyse cytométrique en flux. La colonne de gauche a été fermée sur des cellules singulet, et les autres colonnes ont ensuite été fermées, comme indiqué dans la rangée supérieure. La viabilité des cellules, la pureté des cellules B, l’efficacité de délétion des chaînes légères et l’efficacité de knock-in d’Ab1485 par coloration avec l’antigène spécifique RC141 sont indiquées dans des échantillons non traités, RNP transfectés, ou RNP transfectés + rAAV6 transduits (MOI = 5 x 105). Représentant de six expériences indépendantes avec des cellules de différents macaques rhésus. (B) expression d’IgM sur des témoins de cellules B de macaque rhésus en culture ou après édition et (C) intensité de fluorescence moyenne géométrique (gMFI) d’IgM sur des cellules B qui n’ont pas perdu l’expression d’Ig en raison du ciblage IgLC et IgKC (non édité) ou des cellules B qui se lient à l’antigène attendu (édité). Le point rouge indique l’IGg des cellules B témoins non transfectées en culture. indique p < 0,0001 dans un test t apparié. Veuillez cliquer ici pour voir une version agrandie de cette figure.
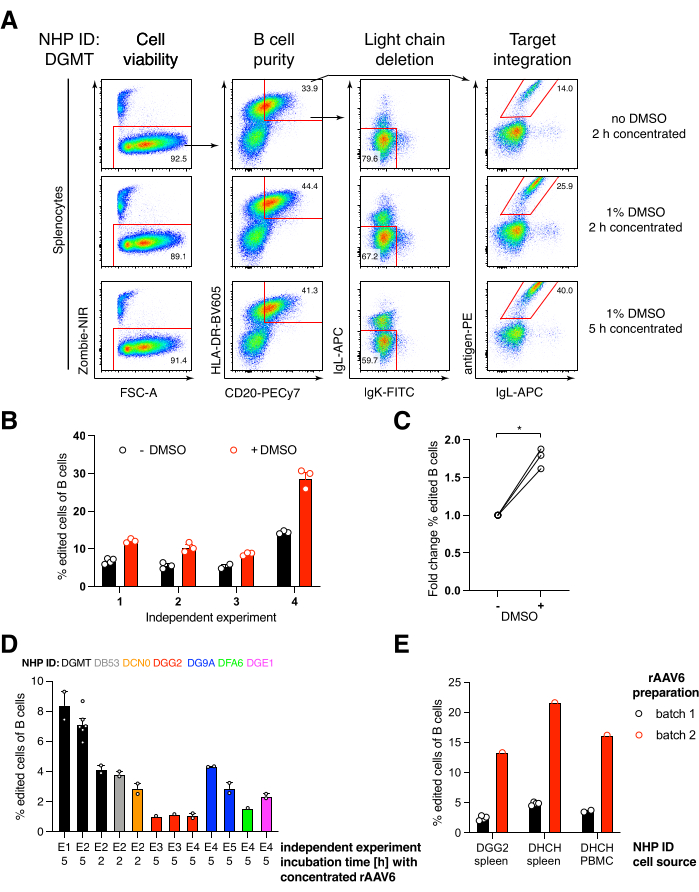
Figure 6 : Effets du DMSO, de l’incubation concentrée prolongée avec le RDHD rAAV6, de la qualité des lots de rAAV et de la reproductibilité parmi différents PSN de donneurs sur l’efficacité de l’édition génique dans les cellules primaires du macaque rhésus B. (A) Les splénocytes ont été cultivés et édités comme décrit. Après électroporation, 5 x 10 5 cellules ont été cultivées dans un milieu avec ou sans 1% de DMSO et incubées dans 50 μL de milieu contenant rAAV6 HDRT à un MOI de 5 x 10 5 pendant 2 h ou5 h avant l’ajout de 450 μL supplémentaires de milieu. Les cellules ont été analysées 2 jours après électroporation par cytométrie en flux, comme sur la figure 5. Représentant de quatre expériences indépendantes. (B) Quantification de (A) sur quatre expériences indépendantes. Les points indiquent des répétitions techniques avec des réglages de transfection de 1 350 V, 10-20 ms et une durée d’électroporation par impulsion et des concentrations de DMSO allant de 0,75% à 1,25%. (C) Changement moyen de l’efficacité de l’édition par rapport à (B). * p > 0,05 dans le test U de Mann-Whitney. (D) Efficacité de l’édition par rapport aux expériences indépendantes avec différents macaques utilisant un lot de rAAV6 commercial à faible efficacité. (E) Efficacité de l’édition à l’aide de deux lots commerciaux différents de rAAV6 dans lesquels la même construction a été emballée dans les cellules B de deux PSN différents dans la même expérience. Les points indiquent des réplications techniques avec des réglages de transfection de 1 350 V, 10-20 ms et 1 électroporation par impulsions. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Les protocoles présentés ici fournissent une méthode rapide et efficace pour générer des rendements et des titres élevés de rAAV6 en tant que HDRT et de nouvelles méthodes pour modifier efficacement les cellules primaires du macaque rhésus B in vitro.
Le protocole de production rAAV6 est relativement simple et rapide, permettant la production et le test de nombreuses constructions différentes simultanément sans travail excessif. Si vous le souhaitez, le rAAV6 peut être purifié davantage à l’aide de protocoles établis tels que l’ultracentrifugation à gradient d’iodixanol34 ou la séparation aqueuse à deux phases35 avant échange tampon et concentration.
Bien que cela ait réduit le rendement global, nous avons choisi d’utiliser uniquement un milieu de culture cellulaire réduit au sérum pour la purification du rAAV6 au lieu de la purification à partir de la pastille cellulaire, car la majorité du rAAV6 est libérée dans le milieu36 et la purification à partir de la pastille cellulaire ajoute plus de coûts et de main-d’œuvre. L’utilisation de l’assistant adénoviral auto-inactivant a augmenté les rendements de 30 à 40 fois en moyenne, ce qui a permis de tester les constructions emballées dans AAV6 dans une seule boîte de 15 cm. Bien que notre méthode de purification soit basique, en utilisant cette méthode, nous obtenons relativement peu de variation d’un lot à l’autre dans l’efficacité de l’édition de gènes ou la viabilité cellulaire après la transduction en utilisant diverses lignées cellulaires ou d’autres cellules primaires (données non présentées).
Nous avons développé un protocole de purification des cellules B du macaque rhésus pour obtenir des cellules B primaires intactes en utilisant l’épuisement négatif des populations indésirables. Bien qu’il ne soit pas nécessaire pour l’édition de gènes de ces cellules, il fournit un moyen d’obtenir une population relativement pure de cellules primaires de macaque rhésus B pour cette application ou d’autres si d’autres types de cellules interfèrent avec les objectifs expérimentaux. Cependant, la pureté se fait au prix d’une réduction des rendements globaux des cellules B. Notamment, pour les cultures de cellules B enrichies et non enrichies, la fraction de cellules B dans les préparations initiales de PBMC ou de splénocytes est cruciale. Pour les PBMC en particulier, nous recommandons de dépister différents macaques chez les individus ayant un pourcentage élevé de lymphocytes B dans le sang périphérique afin d’obtenir un nombre élevé de lymphocytes B pour les expériences, car cette valeur peut varier considérablement d’un individu à l’autre27. Les PBMC peuvent être obtenues par saignement régulier ou leucaphérèse42.
Le protocole d’édition de gènes conduit à une édition de gènes efficace, généralement entre 60% et 80% des cellules B knock-out et 5% à 20% des cellules B knock-in, bien que nous ayons atteint jusqu’à 90% de BCR knock-out et 40% BCR knock-in B (Figure 5 et Figure 6).
Les principaux paramètres pour l’édition efficace des cellules B de macaque rhésus sont l’efficacité de coupe de l’ARNg, les paramètres d’électroporation, le MOI et la qualité de la préparation rAAV6. L’efficacité de coupe des ARNg candidats doit être déterminée empiriquement pour permettre une édition et une conception optimales du HDRT. Les paramètres d’électroporation présentés ici équilibrent l’efficacité et la viabilité pour obtenir le nombre total maximal de cellules B éditées plutôt que le pourcentage le plus élevé de cellules B éditées. Si un pourcentage plus élevé de cellules éditées est nécessaire, des tensions accrues (jusqu’à 1 750 V) ou des longueurs d’impulsion modifiées (10-30 ms) sont recommandées, bien que plus de mort cellulaire puisse être observée. Nous avons également noté des efficacités d’édition légèrement plus élevées dans les cellules B spléniques par rapport aux cellules B des PBMC du même individu (Figure 5) ; Cependant, la raison sous-jacente de cette situation est actuellement inconnue.
Nous avons constaté que l’ajout de 1% de DMSO après électroporation augmentait significativement l’efficacité de l’édition de gènes de ~40% dans les cellules B de macaque rhésus sans affecter la viabilité cellulaire (Figure 6A-C), conformément aux rapports dans d’autres cellules43. Cependant, une culture prolongée dans du DMSO à 1% doit être évitée et peut affecter la viabilité cellulaire. Le DMSO peut être complètement omis si vous le souhaitez.
La culture des cellules dans un petit volume après électroporation pendant plusieurs heures avec le rAAV6 conduit à des rendements d’édition plus élevés, probablement en raison de la meilleure transduction du HDRT par le rAAV6 et, par conséquent, de la concentration intracellulaire plus élevée de HDRT au moment pertinent où Cas9 est actif. Nous avons constaté que la culture des cellules de cette façon jusqu’à 8 heures n’affectait pas la viabilité cellulaire, mais que l’efficacité de l’édition n’augmentait pas de façon spectaculaire au-delà de 5 heures (Figure 6). Si seule l’élimination au lieu de la frappe est requise, cette étape peut être omise.
En conclusion, nous présentons des protocoles complets pour l’édition génique des cellules B du macaque rhésus in vitro et la production de rAAV6 HDRT nécessaires à l’impact efficace des constructions souhaitées. Ces protocoles permettent de tester rapidement et à moindre coût de nombreuses constructions présentées sous forme de rAAV6 et de tester précliniquement la faisabilité et l’évolutivité des thérapies à base de cellules B dans un modèle de primates non humains plus pertinent.
Déclarations de divulgation
Aucun intérêt concurrent n’est déclaré.
Remerciements
Nous tenons à remercier Harry B. Gristick et Pamela Bjorkman d’avoir fourni l’antigène RC1 et l’ensemble des laboratoires Nussenzweig et Martin pour une discussion critique. Ce travail a été soutenu par la subvention INV-002777 de la Fondation Bill et Melinda Gates (au M.C.N.) et le programme de recherche intra-muros de l’Institut national des allergies et des maladies infectieuses, National Institutes of Health. (R.G. et M.A.M). M.C.N. est un enquêteur HHMI.
matériels
| Name | Company | Catalog Number | Comments |
| 1.5 mL tube sterile, Dnase, Rnase and purogen free | Stellar Scientific | T17-125 | or similar |
| 10 mL serological pipette, polystyrene, sterile, nonpyrogenic, DNase-/RNase-free, and Human DNA-free | Corning | 4488 | or similar |
| 15 cm tissue culture dish | Falcon | 353025 | or similar |
| 15 mL polypropylene conical tybe | Falcon | 352097 | or similar |
| 25 mL serological pipette, polystyrene, sterile, nonpyrogenic, DNase-/RNase-free, and Human DNA-free | Corning | 4489 | or similar |
| 250 mL polypropylene conical tybe | Corning | 430776 | or similar |
| 293AAV cell line | Cell Biolabs | AAV-100 | |
| 2-B-mercapto-ethanol, 55mM (1000x) | Gibco | 21985-023 | |
| 48-well tissue culture plate | Corning | 3548 | or similar |
| 5 mL serological pipette, polystyrene, sterile, nonpyrogenic, DNase-/RNase-free, and Human DNA-free | Corning | 4487 | or similar |
| 5 mL syringes with Luer-Lok Tip | BD | 309646 | or similar |
| 50 mL polypropylene conical tybe | Falcon | 352070 | or similar |
| 50 mL serological pipette, polystyrene, sterile, nonpyrogenic, DNase-/RNase-free, and Human DNA-free | Corning | 4490 | or similar |
| 6-well tissue culture plate | Falcon | 353046 | or similar |
| AAV-6 Packaging System (plasmids) | Cell Biolabs | VPK-406 | |
| AAV6 Reference Materials (full capsids) | Charles River | RS-AAV6-FL | |
| Accu-jet S Pipette Controller | Brand | 26350 | or similar pipette controller |
| Antibiotic/Antimycotic 100x | Gibco | 15260-062 | |
| anti-human CD14 AlexaFluor647 | Biolegend | 301812 | |
| anti-human CD14 biotin | BioLegend | 301826 | |
| anti-human CD16 AlexaFluor700 | BD Biosciences | 557920 | |
| anti-human CD16 biotin | BioLegend | 302004 | |
| anti-human CD20 PECy7 | Biolegend | 302312 | |
| anti-human CD3 biotin | Thermo Fisher | APS0309 | |
| anti-human CD3 PE | BD Biosciences | 552127 | |
| anti-human CD33 biotin | Miltenyi | 130-113-347 | |
| anti-human CD64 biotin | BioLegend | 305004 | |
| anti-human CD66 biotin | Miltenyi | 130-100-143 | |
| anti-human CD89 biotin | BioLegend | 354112 | |
| anti-human CD8a biotin | BioLegend | 301004 | |
| anti-human HLA-DR BV605 | Biolegend | 307640 | |
| anti-human Ig light chain lambda APC | Biolegend | 316610 | |
| anti-human IgM BV421 | Biolegend | 314516 | |
| anti-Human Kappa Light Chain FITC | Fisher Scientific | A18854 | |
| Autoclave | Steris | Amsco Lab 250 | or similar |
| Cell culture CO2 incubator | Fisher Scientific | 51026331 | or similar |
| Centrifugal Filter Unit (Amicon Ultra - 4, 100 kDa) | Millipore | UFC810024 | |
| Centrifuge 5920 R | Eppendorf | EP022628188 | or any other, coolable swinging bucket centrifuge with inserts for 96-well plates, 15, 50 and 250 mL size tubes |
| Chloroform | Fisher Scientific | C298SK-4 | |
| Cpg ODN | Invivogen | tlrl-2395 | |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | 34869-500ML | |
| DMEM, High Glucose | Gibco | 11965092 | |
| DNaseI (RNase-free) | New England Biolabs | M0303L | |
| DPBS, no calcium, no magnesium | Gibco | 14190144 | |
| Electroporation kit (Neon Transfection System 10 µL) | Fisher Scientific | MPK1096 | or other sizes or 100 uL transfection kit MPK 10096 |
| Electroporation system (Neon Transfection System) | Fisher Scientific | MPK5000 | |
| FCS | Hyclone | SH30910.03* | |
| Ficoll-PM400 (Ficoll-Paque PLUS) | Cytiva | 17144002 | or similar |
| Fume Hood | Fisher Scientific | FH3943810244 | or similar |
| Glutamine 200 mM | Gibco | 25030-081 | |
| Graduated Cylinder 1L | Corning | 3022-1L | or similar |
| Hemocytometer | Sigma-Aldrich | Z375357-1EA | or similar |
| HEPES 1M | Gibco | 15630-080 | |
| HEPES 1M | Gibco | 15630-080 | |
| Hot Plate Magnetic Stirrer | Fisher Scientific | SP88857200 | or similar |
| Human BAFF | Peprotech | 310-13 | |
| Human BD Fc Block | BD | 564220 | |
| Human IL-10 | Peprotech | 200-10 | |
| Human IL-2 | Peprotech | 200-02 | |
| Hydrochloric acid | Fisher Scientific | A144S-500 | |
| Hydrophilic Polyethersulfone Syringe Filters, (Supor membrane), Sterile - 0.2 µm, 25 mm | Pall | 4612 | |
| Insulin-Transferin-Selenium, 100x | Gibco | 41400-045 | |
| ITR primer forward: GGAACCCCTAGTGATGGAGTT | Integrated DNA Technologies | custom | |
| ITR primer reverse: CGGCCTCAGTGAGCGA | Integrated DNA Technologies | custom | |
| Laminar flow biosafety cabinet | The Baker Company | SG403A | or similar |
| Large magnetic depletion (LD) Column | Miltenyi Biotec | 130-042-901 | |
| Magentic seperator (MidiMACS separator and multistand) | Miltenyi Biotec | 130-090-329 | |
| Magnetic stir bar | Fisher Scientific | 14-512-127 | or similar |
| Magnetic streptavidin beads (Streptavidin MicroBeads) | Miltenyi Biotec | 130-048-101 | |
| Maxiprep kit | Machery-Nagel | 740414.5 | or similar |
| Media Bottles 2L with cap | Cole-Parmer | UX-34514-26 | or similar |
| MegaCD40L | Enzo | ALX-522-110-C010 | |
| MicroAmp Optical 384-well Reaction Plate | Fisher Scientific | 4309849 | |
| MicroAmp Optical Adhesive Film | Fisher Scientific | 4311971 | |
| Microcentrifuge 5424 R | Eppendorf | 5404000014 | or any other table top centrifuge for 1.5 mL tubes |
| Microwave oven | Panasonic | NN-SD987SA | or similar |
| Nikon TMS Inverted Phase Contrast Microscope | Nikon | TMS | or any other Inverted phase-contrast microscope for cell culture |
| Non-essential amino acids, 100x | Gibco | 11140-050 | |
| Nuclease-free Duplex buffer | Integrated DNA Technologies | 11-01-03-01 | |
| Nuclease-free Water | Qiagen | 129115 | |
| pH meter | Mettler Toledo | 30019028 | or similar |
| Pipetman Classic Starter Kit, 4 Pipette Kit, P2, P20, P200, P1000 and tips | Gilson | F167380 | or similar set of pipettes and tips |
| Pluronic F-68 10 % | Gibco | 24040-032 | |
| Polyethylene Glycol 8000 | Fisher Scientific | BP233-1 | |
| Polyethylenimine, Linear, MW 25000, Transfection Grade (PEI 25K | Polysciences | 23966-100 | |
| Precision Balance | Mettler Toledo | ME4001TE | or similar |
| Pre-Separation Filters (30 µm) | Miltenyi Biotec | 130-041-407 | |
| Pyrex glass beaker 2 L | Cole-Parmer | UX-34502-13 | or similar |
| Pyrex glass beaker 250 mL | Millipore Sigma | CLS1000250 | or similar |
| qPCR Instrument | Fisher Scientific | 4485691 | or similar |
| RC1 antigen randomly biotinylated | Bjorkman lab, CalTech | in house | |
| RPMI-1640 | Gibco | 11875-093 | |
| S.p. Cas9 Nuclease | Integrated DNA Technologies | 1081059 | |
| Scientific 1203 Water Bath | VWR | 24118 | or any water bath set to 37 °C |
| Sodium chloride | Sigma-Aldrich | S7653-5KG | |
| Sodium hydroxide | Sigma-Aldrich | S8045-500G | |
| Sodium Pyruvate 100 mM | Gibco | 11360-070 | |
| Sterile Disposable Filter Units with PES Membranes | Thermo Scientific Nalgene | 567-0020 | |
| Streptavidin-PE | BD Biosciences | 554061 | |
| SYBR Green Master Mix | Fisher Scientific | A25742 | |
| Tetracycline-enabled, self-silencing adenoviral vector RepCap6 | Oxgene | TESSA-RepCap6 | |
| Trypan Blue Solution, 0.4% | Gibco | 15250061 | |
| Trypsin-EDTA (0.05%), phenol red | Gibco | 25300054 | |
| Water Purification System | Millipore Sigma | ZEQ7000TR | or similar |
| Zombie-NIR | Biolegend | 423106 |
Références
- Victora, G. D., Nussenzweig, M. C. Germinal centers. Annual Review of Immunology. 40, 413-442 (2022).
- Plotkin, S. A. Correlates of protection induced by vaccination. Clinical and Vaccine Immunology. 17 (7), 1055-1065 (2010).
- Brinkmann, V., Heusser, C. H. T cell-dependent differentiation of human B cells into IgM, IgG, IgA, or IgE plasma cells: High rate of antibody production by IgE plasma cells, but limited clonal expansion of IgE precursors. Cellular Immunology. 152 (2), 323-332 (1993).
- Chernecky, C. C., Berger, B. J. . Protein Electrophoresis - Serum., 6th edition. , 917-920 (2013).
- Balazs, A. B., et al. Antibody-based protection against HIV infection by vectored immunoprophylaxis. Nature. 481 (7379), 81-84 (2011).
- Greiner, V., et al. CRISPR-mediated editing of the B cell receptor in primary human B cells. iScience. 12, 369-378 (2019).
- Hartweger, H., et al. HIV-specific humoral immune responses by CRISPR/Cas9-edited B cells. Journal of Experimental Medicine. 216 (6), 1301-1310 (2019).
- Huang, D., et al. Vaccine elicitation of HIV broadly neutralizing antibodies from engineered B cells. Nature Communications. 11, 5850 (2020).
- Jeske, A. M., Boucher, P., Curiel, D. T., Voss, J. E. Vector strategies to actualize B cell-based gene therapies. Journal of Immunology. 207 (3), 755-764 (2021).
- Nahmad, A. D., et al. In vivo engineered B cells secrete high titers of broadly neutralizing anti-HIV antibodies in mice. Nature Biotechnology. 40 (8), 1241-1249 (2022).
- Nahmad, A. D., et al. Engineered B cells expressing an anti-HIV antibody enable memory retention, isotype switching and clonal expansion. Nature Communications. 11, 5851 (2020).
- Voss, J. E., et al. Reprogramming the antigen specificity of B cells using genome-editing technologies. eLife. 8, 42995 (2019).
- Pesch, T., et al. Molecular design, optimization, and genomic integration of chimeric B cell receptors in murine B cells. Frontiers in Immunology. 10, 2630 (2019).
- Cheong, T. C., Compagno, M., Chiarle, R. Editing of mouse and human immunoglobulin genes by CRISPR-Cas9 system. Nature Communications. 7, 10934 (2016).
- Rogers, G. L., Cannon, P. M. Genome edited B cells: A new frontier in immune cell therapies. Molecular Therapy. 29 (11), 3192-3204 (2021).
- Hung, K. L., et al. Engineering protein-secreting plasma cells by homology-directed repair in primary human B cells. Molecular Therapy. 26 (2), 456-467 (2018).
- Johnson, M. J., Laoharawee, K., Lahr, W. S., Webber, B. R., Moriarity, B. S. Engineering of primary human B cells with CRISPR/Cas9 targeted nuclease. Scientific Reports. 8, 12144 (2018).
- Wu, C. M., et al. Genetic engineering in primary human B cells with CRISPR-Cas9 ribonucleoproteins. Journal of Immunological Methods. 457, 33-40 (2018).
- Luo, B., et al. Engineering of alpha-PD-1 antibody-expressing long-lived plasma cells by CRISPR/Cas9-mediated targeted gene integration. Cell Death and Disease. 11 (11), 973 (2020).
- Laoharawee, K., et al. Genome engineering of primary human B cells using CRISPR/Cas9. Journal of Visualized Experiments. (165), e61855 (2020).
- Laoharawee, K., Johnson, M. J., Moriarity, B. S. CRISPR/Cas9-mediated genome engineering of primary human B cells. Methods in Molecular Biology. 2115, 435-444 (2020).
- Moffett, H. F., et al. B cells engineered to express pathogen-specific antibodies protect against infection. Science Immunology. 4 (35), (2019).
- Hartweger, H., Nussenzweig, M. C. CRISPR comes a-knock-in to reprogram antibodies in vivo. Nature Biotechnology. 40 (8), 1183-1184 (2022).
- Nishimura, Y., Martin, M. A. Of mice, macaques, and men: Broadly neutralizing antibody immunotherapy for HIV-1. Cell Host & Microbe. 22 (2), 207-216 (2017).
- Shedlock, D. J., Silvestri, G., Weiner, D. B. Monkeying around with HIV vaccines: Using rhesus macaques to define 'gatekeepers' for clinical trials. Nature Reviews Immunology. 9 (10), 717-728 (2009).
- Kreuser, S., et al. Efficient methods for generation and expansion of, and gene delivery to rhesus macaque plasma B cells. bioRxiv. , (2021).
- Gujer, C., Sundling, C., Seder, R. A., Karlsson Hedestam, G. B., Lore, K. Human and rhesus plasmacytoid dendritic cell and B-cell responses to Toll-like receptor stimulation. Immunology. 134 (3), 257-269 (2011).
- Kim, J. S., et al. Cell enrichment-free massive ex-vivo expansion of peripheral CD20(+) B cells via CD40-CD40L signals in non-human primates. Biochemical and Biophysical Research Communications. 473 (1), 92-98 (2016).
- Su, W., et al. Self-attenuating adenovirus enables production of recombinant adeno-associated virus for high manufacturing yield without contamination. Nature Communications. 13, 1182 (2022).
- Endo, Y., et al. Short- and long-term clinical outcomes in rhesus monkeys inoculated with a highly pathogenic chimeric simian/human immunodeficiency virus. Journal of Virology. 74 (15), 6935-6945 (2000).
- Balaphas, A., Buchs, N. C., Meyer, J., Hagen, M. E., Morel, P. Partial splenectomy in the era of minimally invasive surgery: The current laparoscopic and robotic experiences. Surgical Endoscopy. 29 (12), 3618-3627 (2015).
- Gibson, D. G., et al. Enzymatic assembly of DNA molecules up to several hundred kilobases. Nature Methods. 6 (5), 343-345 (2009).
- Labun, K., et al. CHOPCHOP v3: Expanding the CRISPR web toolbox beyond genome editing. Nucleic Acids Research. 47, 171-174 (2019).
- Strobel, B., Miller, F. D., Rist, W., Lamla, T. Comparative analysis of cesium chloride- and iodixanol-based purification of recombinant adeno-associated viral vectors for preclinical applications. Human Gene Therapy Methods. 26 (4), 147-157 (2015).
- Guo, P., et al. Rapid and simplified purification of recombinant adeno-associated virus. Journal of Virological Methods. 183 (2), 139-146 (2012).
- Vandenberghe, L. H., et al. Efficient serotype-dependent release of functional vector into the culture medium during adeno-associated virus manufacturing. Human Gene Therapy. 21 (10), 1251-1257 (2010).
- Brinkman, E. K., Chen, T., Amendola, M., van Steensel, B. Easy quantitative assessment of genome editing by sequence trace decomposition. Nucleic Acids Research. 42 (22), 168 (2014).
- Conant, D., et al. Inference of CRISPR edits from Sanger trace data. The CRISPR Journal. 5 (1), 123-130 (2022).
- Wilkinson, A. C., et al. Cas9-AAV6 gene correction of beta-globin in autologous HSCs improves sickle cell disease erythropoiesis in mice. Nature Communications. 12, 686 (2021).
- Wang, Z., et al. A broadly neutralizing macaque monoclonal antibody against the HIV-1 V3-Glycan patch. eLife. 9, 61991 (2020).
- Escolano, A., et al. Immunization expands B cells specific to HIV-1 V3 glycan in mice and macaques. Nature. 570 (7762), 468-473 (2019).
- Pathiraja, V., Matar, A. J., Gusha, A., Huang, C. A., Duran-Struuck, R. Leukapheresis protocol for nonhuman primates weighing less than 10 kg. Journal of the American Association for Laboratory Animal Science. 52 (1), 70-77 (2013).
- Stratigopoulos, G., De Rosa, M. C., LeDuc, C. A., Leibel, R. L., Doege, C. A. DMSO increases efficiency of genome editing at two non-coding loci. PLoS One. 13 (6), 0198637 (2018).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon