Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Optimisation de la technologie de traitement pour Tiebangchui avec Zanba basée sur CRITIC combinée à la méthode de surface de réponse de Box-Behnken
Dans cet article
Résumé
Le présent protocole décrit une méthode de traitement de désintoxication efficace et standard pour le Tiebangchui sauté Zanba utilisant CRITIC combiné à la méthode de surface de réponse Box-Behnken.
Résumé
La racine séchée d’Aconitum pendulum Busch., appelée Tiebangchui (TBC) en chinois, est l’un des médicaments tibétains les plus célèbres. C’est une herbe largement utilisée dans le nord-ouest de la Chine. Cependant, de nombreux cas d’empoisonnement se sont produits en raison de la toxicité intense du TBC et parce que ses doses thérapeutiques et toxiques sont similaires. Par conséquent, trouver une méthode sûre et efficace pour réduire sa toxicité est une tâche urgente. Une recherche dans les classiques de la médecine tibétaine montre que la méthode de traitement du TBC sauté avec du Zanba a été enregistrée dans la « Spécification de traitement de la médecine tibétaine de la province du Qinghai (2010) ». Cependant, les paramètres de traitement spécifiques ne sont pas encore clairs. Ainsi, cette étude vise à optimiser et à normaliser la technologie de traitement du TBC sauté Zanba.
Tout d’abord, une expérience à facteur unique a été menée sur quatre facteurs: l’épaisseur de la tranche de TBC, la quantité de Zanba, la température de traitement et le temps. Avec les teneurs en monoester et en alcaloïdes diester dans le TBC sauté Zanba comme indices, CRITIC combiné à la méthode de surface de réponse Box-Behnken a été utilisé pour optimiser la technologie de traitement du TBC sauté Zanba. Les conditions de traitement optimisées du TBC sauté Zanba étaient une épaisseur de tranche TBC de 2 cm, trois fois plus de Zanba que de TBC, une température de traitement de 125 °C et 60 min de sauté. Cette étude a déterminé les conditions de traitement optimisées et standard pour l’utilisation du TBC sauté Zanba, fournissant ainsi une base expérimentale pour l’utilisation clinique sûre et la production industrielle de Zanba-sauté TBC.
Introduction
La racine séchée d’Aconitum pendulum Busch et A. flavum Hand.-Mazz., l’un des médicaments tibétains les plus célèbres, est appelée Tiebangchui (TBC) en chinois 1,2. Les racines séchées de TBC sont utiles pour dissiper le froid et le vent, réduire la douleur et calmer le choc. Il a été enregistré dans le premier volume de « Drug Standards (Tibetan Medicine) of the Ministry of Health of the People’s Republic of China », qui indique que les racines séchées de TBC sont couramment utilisées pour traiter la polyarthrite rhumatoïde, les ecchymoses et autres maladies du rhume3. Cependant, la dose thérapeutique clinique de TBC est similaire à sa dose toxique, et des incidents d’empoisonnement ou de décès ont été fréquemment signalés en raison d’une mauvaise utilisation4. Par conséquent, la réduction de la toxicité et la préservation de l’efficacité du TBC sont devenues un point chaud de la recherche au fil des ans.
En médecine tibétaine, le traitement est l’une des méthodes les plus efficaces pour atténuer la toxicité du TBC. Selon « Spécification de traitement de la médecine tibétaine de la province du Qinghai (2010) », les herbes originales (à confirmer) doivent être placées dans un pot en fer et sautées avec du Zanba jusqu’à ce que le Zanba jaunisse, après quoi le Zanba est enlevé et les herbes sont séchées à l’air 5,6. Cependant, aucun paramètre de procédé spécifique n’a été documenté, ce qui rend difficile le contrôle de la technologie de traitement et de la qualité du TBC sauté Zanba. La méthode CRITIC est une méthode de pondération objective qui permet d’éviter la fuzzification et la subjectivité, et d’améliorer l’objectivité de la pondération7. La méthode de la surface de réponse de Box-Behnken peut refléter directement l’interaction entre chaque facteur par l’ajustement polynomial8. La combinaison de la surface de réponse de Box-Behnken et de la méthode CRITIC est couramment utilisée pour optimiser la technologie de traitement afin d’acquérir le protocole de traitement optimisé 9,10. Dans cet article, un alcaloïde monoester-diterpénoïde (MDA) (benzoylaconitine) et deux alcaloïdes diester-diterpénoïdes (ADD) (aconitine, 3-désoxyaconitine) ont été utilisés comme indices d’évaluation. CRITIC combiné à la méthode de surface de réponse Box-Behnken a été appliqué pour optimiser la technologie de traitement du TBC sauté Zanba et établir une méthode de traitement standard pour une utilisation cliniquement sûre.
Protocole
La méthode de traitement du TBC sauté Zanba a été optimisée et normalisée par CRITIC combinée à la méthode de surface de réponse Box-Behnken. La benzoylaconitine, l’acontitine et la 3-désoxyaconitine ont été utilisées comme indices d’évaluation au cours de cette procédure.
1. Préparation de la solution d’échantillon
- Préparer la solution mère de la substance de référence. Peser précisément 9,94 mg de benzoylaconitine, 8,49 mg d’acontitine et 6,25 mg de 3-désoxyaconitine (table des matières) sur une balance analytique électronique et les placer dans une fiole jaugée de 10 ml. Ensuite, ajoutez une solution de méthanol d’acide chlorhydrique à 0,05% pour dissoudre les solides et compléter le volume à 10 mL. Enfin, bien agiter le mélange pour obtenir la solution mère de la substance de référence avec des concentrations massiques de 0,9940 mg/mL de benzoylaconitine, 0,8490 mg/mL d’aconitine, et 0,6250 mg/mL de 3-désoxyaconitine.
ATTENTION : L’acide chlorhydrique est un matériau très corrosif11. Utilisez une protection adéquate, comme des gants, une blouse de laboratoire, des lunettes de protection et une hotte. - Préparer la solution de l’échantillon d’essai.
- Peser 2 g de poudre de TBC sautée Zanba dans une fiole conique.
- Préparez du TBC sauté Zanba en pesant 30 g de TBC (2 cm) et 90 g de Zanba et en les ajoutant dans le sauté préchauffé. Réglez l’heure et la température du sauté à 40 min et 140 °C, respectivement. Configurez la machine pour terminer le traitement.
- Utilisez une machine à écraser à grande vitesse pour broyer le TBC sauté Zanba séparément en échantillons de poudre pouvant passer à travers un tamis de 50 mailles (0,355 mm).
- Ajouter 3 mL de solution d’ammoniaque et 50 mL d’une solution mélangée d’alcool isopropylique et d’acétate d’éthyle (un rapport de 1:1 v/v) dans la fiole conique ci-dessus, d’après des études antérieures12,13.
REMARQUE : Pour préparer la solution d’ammoniac, ajouter 40 mL de solution concentrée d’ammoniac dans une fiole jaugée de 100 mL et remplir d’eau purifiée dans la ligne de mesure. Prenez les mesures de protection appropriées lorsque vous utilisez une solution d’ammoniaque concentrée car elle a une forte odeur. - Peser l’échantillon et la fiole conique ci-dessus et noter le poids. Ultrasons pendant 30 min (tension : 220 V, fréquence : 40 kHz).
REMARQUE: Les alcaloïdes de l’aconitine sont facilement décomposés par la chaleur. Ainsi, la température d’extraction par ultrasons doit être inférieure à 25 °C. - Peser l’échantillon et la fiole conique après extraction par ultrasons.
- Compenser le poids perdu en ajoutant un mélange d’alcool isopropylique et d’acétate d’éthyle (rapport de 1:1 v/v).
- Filtrez l’échantillon de solution. Évaporer 25 mL du filtrat jusqu’à séchage à l’aide d’un évaporateur rotatif à 40 °C.
- Dissoudre le résidu en ajoutant 5 mL de solution de méthanol d’acide chlorhydrique à 0,05 %, filtrer la solution à travers un filtre à seringue de 0,2 μm et l’analyser en effectuant une chromatographie liquide à haute performance (CLHP).
- Peser 2 g de poudre de TBC sautée Zanba dans une fiole conique.
- Préparer une solution de référence mélangée contenant 0,1988 mg/mL de benzoylaconitine, 0,0509 mg/mL d’aconitine et 0,0938 mg/mL de 3-désoxyaconitine.
NOTA : Chaque étalon (0,9940 mg de benzoylaconitine, 0,2545 mg d’aconitine, et 0,4690 mg de 3-désoxyaconitine) est dissous dans une fiole jaugée de 5 mL dans du méthanol d’acide chlorhydrique à 0,05 % comme milieu de dissolution. - Préparer un tampon d’acétate d’ammonium 0,04 M en dissolvant 6,16 g d’acétate d’ammonium (Table des matières) dans 2 L d’eau ultrapure (phase mobile A). Ajustez le pH à 8,50 avec de l’ammoniac.
ATTENTION : L’ammoniac est une matière dangereuse. Utilisez une protection adéquate, comme des gants, une blouse de laboratoire, des lunettes de protection et une hotte. - Filtrer 2 L d’acétonitrile ultrapur à 100% (phase mobile B) et le dégazer.
ATTENTION : L’acétonitrile est une matière dangereuse13. Utilisez une protection adéquate, comme des gants, une blouse de laboratoire, des lunettes de protection et une hotte.
2. Condition chromatographique
- Injecter 10 μL des solutions d’échantillons prétraitées dans un système HPLC avec des pompes binaires. Utiliser un système CLHP utilisant une colonne ODS-3 (5 μm x 4,6 mm x 250 mm; fonctionnant à 30 °C) avec phases mobiles A et B pour la séparation MDA et DDA. Injectez chaque échantillon trois fois pour la réplication technique.
- Programmer la méthode comme indiqué dans le tableau 1 pour la colonne ODS-3. Définissez un débit de 1,0 mL/min et la longueur d’onde de détection à 235 nm.
- Enregistrez les zones de pointe de chaque composé cible.
NOTE: Les détails des instruments se trouvent dans le tableau des matériaux.
3. Test d’adaptabilité du système
REMARQUE : Reportez-vous à la section 2 pour connaître les conditions chromatographiques permettant d’effectuer les étapes 3.1 à 3.5.
- Étudier la relation linéaire entre la concentration et la surface du pic.
- Préparer diverses concentrations - 19,88, 39,76, 59,64, 159,04, 198,80 et 497,00 μg/mL - de la solution de benzoylaconitine.
- Préparer diverses concentrations - 8,49, 16,98, 25,47, 33,96, 50,94 et 169,80 μg/mL - de solution d’aconitine.
- Préparer diverses concentrations - 1,875, 12,50, 37,50, 62,50, 93,75 et 125,00 μg/mL - de solution de 3-désoxyaconitine.
- Injecter les solutions de référence ci-dessus de faible concentration massique à concentration massique élevée et enregistrer les zones de pic.
- Obtenir trois équations de régression linéaire à partir du graphique de la concentration de la solution de référence (μg/L) par rapport à la surface du pic.
REMARQUE : S’assurer que les concentrations de benzoylaconitine, d’acontine et de 3-désoxyaconitine se situent dans la plage linéaire de cette courbe étalon.
- Effectuer des essais de précision en injectant en continu six répétitions de 10 μL de la solution échantillon dans le système CLHP et exécuter les échantillons dans les mêmes conditions CLHP décrites à la section 2. Enregistrez les zones de pointe de benzoylaconitine, d’acontine et de 3-désoxyaconitine.
- Effectuer des expériences d’essai de stabilité en injectant 10 μL de la solution échantillon préparée et déterminer les zones de pic après 0 h, 2 h, 4 h, 8 h, 12 h et 24 h.
REMARQUE: Les zones de pic sont enregistrées automatiquement par le système HPLC référencé. Ces points temporels étaient basés sur la littérature pertinente15,16,17. - Effectuer l’essai de reproductibilité en prenant le même lot de TBC sauté Zanba pour préparer six solutions d’échantillons d’essai en parallèle selon la méthode décrite à l’étape 1.2. Injecter 10 μL de chaque échantillon dans le système CLHP et exécuter les échantillons comme décrit à la section 2.
REMARQUE : La reproductibilité a été évaluée en comparant les différences de concentration entre les six échantillons. - Effectuer l’expérience de récupération en préparant six portions du même lot de TBC sauté Zanba pour la solution d’essai. Ensuite, ajouter ~100% de la substance de référence de chaque composant de l’indice dans six portions de la solution d’essai pour calculer le taux de récupération. Injecter ces échantillons (10 μL) dans le système CLHP dans les mêmes conditions que celles décrites au point 2 et calculer le taux de récupération à l’aide de l’équation (1):
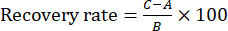 (1)
(1)
NOTA: Dans l’équation (1), A est la quantité du composant à mesurer dans la solution d’essai, B est la quantité de substance de référence ajoutée et C est la valeur mesurée de la solution contenant la substance de référence et l’échantillon de TBC sauté Zanba.
4. Expériences monofactorielles
- Comparaison de l’épaisseur des tranches
- Préparer cinq groupes pour les essais, chacun avec 30 g de TBC, où l’épaisseur du TBC est de 0,5, 1, 2, 3 et 4 cm, respectivement. Pesez une quantité de Zanba trois fois supérieure à celle de TBC (90 g).
REMARQUE : Le TBC est toxique. Utilisez une protection appropriée, comme des gants, une blouse de laboratoire, des lunettes de protection et une hotte aspirante, et soyez prudent pendant le processus de coupe. Grâce à la pré-expérience, il a été constaté que trois fois la quantité de Zanba était nécessaire pour un contact complet entre TBC et Zanba. Par conséquent, dans la conception expérimentale formelle, l’étude a sélectionné trois fois la quantité de Zanba lors de l’examen de l’épaisseur de la tranche. - Réglez la température et l’heure de la sauteuse automatique à 140 °C et 40 min, respectivement.
- Ajouter ~30 g de TBC et 90 g de Zanba dans la machine après que la machine à sauter automatique ait chauffé à la température réglée.
- Préparez les exemples de solutions en suivant l’étape 1.2. Calculer le contenu de la MDA et des DDA dans différents produits de transformation selon la courbe standard (tableau 2). Calculer le score global sur la base des résultats via la méthode CRITIC de la section 6.
- De cette façon, comparez les quantités de Zanba, ainsi que les températures et les temps de traitement pour optimiser les conditions.
- Préparer cinq groupes pour les essais, chacun avec 30 g de TBC, où l’épaisseur du TBC est de 0,5, 1, 2, 3 et 4 cm, respectivement. Pesez une quantité de Zanba trois fois supérieure à celle de TBC (90 g).
- Comparaison du montant de Zanba
- Effectuez cinq groupes de tests, chacun avec 30 g de TBC (2 cm), où la quantité de Zanba est une, deux, trois, quatre et cinq fois plus que TBC, respectivement.
- Allumez la machine à sauter pour le traitement. Réglez l’heure et la température du sauté à 40 min et 140 °C.
- Préparez les exemples de solutions en suivant l’étape 1.2. Calculer la teneur en MDA et DDA dans différents produits de transformation selon la courbe standard (tableau 2). Calculer le score global sur la base des résultats via la méthode CRITIC de la section 6.
- Comparaison de la température de traitement
- Effectuer cinq groupes de tests, chacun avec 30 g de TBC (2 cm) et 90 g de Zanba.
- Allumez la machine à sauter pour le traitement. Réglez la température de traitement sur 100 °C, 120 °C, 140 °C, 160 °C et 180 °C. Définissez le temps de traitement sur 40 min.
NOTE: Grâce à des expériences préalables, il a été constaté que la vitesse de jaunissement de Zanba est très faible lorsque la température de traitement est inférieure à 100 ° C, et Zanba est facile à brûler et à noircir si la température est trop élevée (supérieure à 180 ° C). Par conséquent, 100 °C et 180 °C ont été fixés pour être les valeurs minimales et maximales de température pendant le traitement, respectivement. - Préparez les exemples de solutions en suivant l’étape 1.2. Enregistrez les zones de pointe des MDA et des DDA. Calculer la teneur en MDA et DDA dans différents produits de transformation selon la courbe standard (tableau 2). Calculer le score global sur la base des résultats via la méthode CRITIC de la section 6.
NOTE: L’expérience implique des températures élevées de 160 ° C et 180 ° C. Faites attention à la sécurité pendant l’expérience, selon le code de sécurité du laboratoire.
- Comparaison des délais de traitement
- Effectuer cinq groupes de tests, chacun avec 30 g de TBC (2 cm) et 90 g de Zanba.
- Allumez la machine à sauter pour le traitement. Définissez le temps de traitement sur 20, 40, 60, 80 et 100 min. Réglez la température à 140 °C.
- Préparez les exemples de solutions en suivant la description de l’étape 1.2. Enregistrez les zones de pointe des MDA et des DDA. Calculer la qualité de la MDA et des DDA dans différents produits de transformation selon la courbe standard (tableau 2). Calculer le score global sur la base des résultats via la méthode CRITIC de la section 6.
5. Optimisation de la technologie de traitement du TBC sauté Zanba à l’aide de la méthodologie de surface de réponse (RSM)
- Conception de la surface de réponse Box-Behnken
- Déterminer la plage d’épaisseur de la tranche (A, 1-3 cm), la quantité de Zanba (B, 2-4x), la température de traitement (C, 100-140 °C) et le temps de traitement (D, 40-80 min) par des expériences préliminaires utilisant des tests à facteur unique (étapes 4.1-4.4).
REMARQUE : Les valeurs codées de quatre variables et leurs niveaux sont indiqués dans le tableau 3. Trois niveaux de chaque variable ont été codés comme -1, 0 et 1.
- Déterminer la plage d’épaisseur de la tranche (A, 1-3 cm), la quantité de Zanba (B, 2-4x), la température de traitement (C, 100-140 °C) et le temps de traitement (D, 40-80 min) par des expériences préliminaires utilisant des tests à facteur unique (étapes 4.1-4.4).
- Utilisez un logiciel pour générer la matrice et analyser les modèles de surface de réponse.
REMARQUE: Les captures d’écran pour l’utilisation du logiciel sont affichées dans le fichier supplémentaire 1.- Utilisez un plan de Box-Behnken à trois niveaux et quatre facteurs composé de 24 expériences (comme dans cette étude) et mesurez cinq répétitions (ordre d’exécution 1, 9, 14, 16 et 25) pour calculer la somme d’erreur pure des carrés (tableau 4). Définissez le score complet (Y) comme réponse (étapes 1 à 4, dossier supplémentaire 1).
- Sur la page d’accueil, cliquez sur Nouvelle conception (étape 1, Fichier supplémentaire 1), et dans le panneau de gauche de la page Conception , cliquez sur Surface de réponse | Box-Behnken et définissez les paramètres des quatre facteurs du tableau (étape 2, fichier supplémentaire 1).
- Cliquez sur Suivant (étape 2, Fichier supplémentaire 1), définissez les noms des réponses, puis cliquez sur Terminer (étape 3, Fichier supplémentaire 1).
- Générez la conception de la surface de réponse via l’opération ci-dessus (étape 4, fichier supplémentaire 1).
- Utilisez un plan de Box-Behnken à trois niveaux et quatre facteurs composé de 24 expériences (comme dans cette étude) et mesurez cinq répétitions (ordre d’exécution 1, 9, 14, 16 et 25) pour calculer la somme d’erreur pure des carrés (tableau 4). Définissez le score complet (Y) comme réponse (étapes 1 à 4, dossier supplémentaire 1).
- Terminez l’expérience en fonction des 29 scénarios conçus pour la surface de réponse.
- Préparez les exemples de solutions en suivant l’étape 1.2.
- Enregistrez les zones de pointe des MDA et des DDA.
REMARQUE: Les zones de pic sont enregistrées automatiquement par le système HPLC référencé. - Calculer la qualité du MDA et des DDA dans les différents produits de transformation.
- Calculez le score complet en fonction des résultats via la méthode CRITIC à l’étape 6.
Remarque : La méthode spécifique est illustrée à l’étape 6. - Entrez le score complet obtenu de 29 essais dans l’ordinateur et analysez-le à l’aide du logiciel référencé (étape 5, dossier supplémentaire 1).
- Effectuer la validation statistique des équations polynomiales et des analyses de surface de réponse tracées dans des graphiques de modèles 3D via le logiciel (étapes 6 à 8, fichier supplémentaire 1).
- Dans le volet de navigation de gauche, sous Analyse (+), cliquez sur Y, puis sur Démarrer l’analyse dans la fenêtre Configurer (étape 6, Fichier supplémentaire 1).
- Cliquez sur ANOVA dans le menu supérieur et observez le tableau des résultats affichant l’analyse de la variance (étape 7, Fichier supplémentaire 1).
- Dans le menu supérieur, cliquez sur Graphes du modèle , puis sur Surface 3D pour obtenir les tracés de surface de réponse reflétant les effets des paramètres de traitement sur les scores synthétiques (étape 8, Fichier supplémentaire 1).
- Effectuer la validation du modèle de surface de réponse en triple exemplaire dans les conditions optimales prévues (étape 9, dossier supplémentaire 1) pour vérifier la stabilité de la technologie de traitement. Dans le volet de navigation de gauche, sous Optimisation, cliquez sur Numérique Puis, dans le menu supérieur, cliquez sur Solutions. Observez les conditions optimales prévues.
6. Évaluation du modèle
REMARQUE : Cette étape doit être effectuée après la fin de chaque expérience à facteur unique ou expérience de surface de réponse. Une fois chaque expérience (p. ex., comparaison de l’épaisseur des tranches) terminée, le contenu de la MDA et des DDA dans les différents échantillons est mesuré pour obtenir cinq ensembles de données, conformément à l’étape 1.2 et à la section 2. Les données sont présentées dans le tableau supplémentaire S1.
- Traitement sans dimension de l’index
Remarque : Cette étape transforme la valeur mesurée (Xij) en une valeur relative sans dimension, de sorte que la valeur de chaque indice est au même niveau de quantité. Cette opération peut faciliter l’analyse complète et la comparaison d’indicateurs dans différentes unités ou ordres de grandeur18. À des fins d’illustration, les valeurs d’épaisseur de tranche ont été utilisées pour les calculs indiqués ci-dessous (tableau supplémentaire S1).- Normaliser le contenu de la MDA (obtenir yMDA; MDA fait référence à benzoylaconitine) en utilisant la formule dans Eq. (2).
REMARQUE : L’indice « i » représente l’un des quatre facteurs, et l’épaisseur de la tranche est le premier facteur étudié. Par conséquent, la valeur de i est égale à 1. L’indice « j » représente chaque niveau de facteurs; Ainsi, lorsque l’épaisseur de la tranche est le premier niveau (0,5 cm), j est égal à 1; Lorsque l’épaisseur de la tranche est le cinquième niveau (4 cm), j est égal à 5. Les teneurs en MDA (Xij) dans le TBC traité avec des épaisseurs de 0,5, 1, 2, 3 et 4 cm étaient de 0,9693, 1,0876, 1,3940, 1,4185 et 1,3614 mg/g, respectivement. Ainsi, x j, max est 1,4185 et xj, min est 0,9693.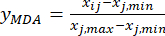 (2)
(2)
Ainsi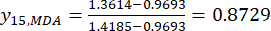
Ici, Xij est le contenu mesuré de la MDA de l’expérience dans le i-ème facteur et au j-ième niveau; xj, min est la teneur minimale de la MDA dans ce groupe d’expériences; et xj, max est la teneur maximale en MDA dans ce groupe d’expériences. Ainsi, i = 1, 2, ..., m et j = 1, 2, ..., n.
REMARQUE : Ainsi, les valeurs normalisées de la MDA sont 0,0000, 0,2634, 0,9455, 1,0000 et 0,8729 en utilisant Eq. (2). - Normaliser le contenu total des ADD (obtenir yADD; Les DDA font référence à l’aconitine et à la 3-désoxyaconitine) en utilisant la formule de l’équation (3).
NOTE: i est l’un des quatre facteurs, et j est chaque niveau des facteurs; Xij est la teneur mesurée des DDA de l’expérience au i-ème facteur et au j-ième niveau; xj, min est le contenu minimal des DDA dans cette expérience de groupe de données; et xj, max est le contenu maximal des DDA dans cette expérience de groupe de données. De cette façon, i = 1, 2, ..., m et j = 1, 2, ..., n. La teneur en ADD (Xij) dans le TBC traité avec des épaisseurs de 0,5, 1, 2, 3 et 4 cm était de 0,3492, 0,2692, 0,2962, 0,5354, 0,5124 mg/g, respectivement. Ainsi, x j, max est 0,5354 et xj, min est 0,2692.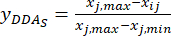 (3)
(3)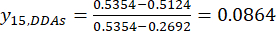
REMARQUE : Les valeurs normalisées sont 0,6995, 1,0000, 0,8986, 0,0000 et 0,0864 en utilisant Eq. (3).
- Normaliser le contenu de la MDA (obtenir yMDA; MDA fait référence à benzoylaconitine) en utilisant la formule dans Eq. (2).
- Calculez l’intensité de contraste correspondante (S i), le conflit (δ i), les informations (C i) et le poids de l’indice (W i) en fonction des nqe. (4) à (7), respectivement19,20.
NOTE: i = 1, 2, ..., m. yij est la donnée normalisée de la teneur MDA ou DDA de l’expérience dans le i-ème facteur et au niveau j-ième.- Pour estimer l’intensité du contraste, calculez d’abord la valeur moyenne de MDA.
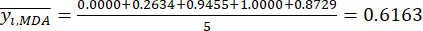
Où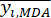 est la valeur moyenne de la MDA.
est la valeur moyenne de la MDA.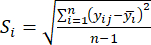 (4)
(4)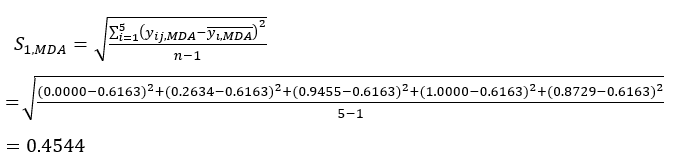
- Pour calculer la valeur de conflit, estimez d’abord le coefficient de corrélation γij à l’aide de la fonction CORREL dans Excel21.
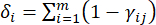 (5)
(5)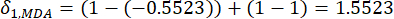
- Calculez les valeurs d’information comme suit.
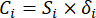 (6)
(6)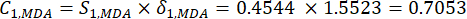
REMARQUE: De même, C1, DDAS = 0,7210 - Calculez la pondération de l’indice comme suit.
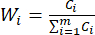 (7)
(7)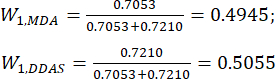
NOTA : Par conséquent, les coefficients pondéraux de la MDA et des ADD par rapport à l’épaisseur de la tranche ont été établis à 0,4945 et 0,5055, respectivement.
- Pour estimer l’intensité du contraste, calculez d’abord la valeur moyenne de MDA.
- Calculez les scores complets des épaisseurs de tranches.
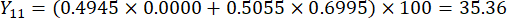
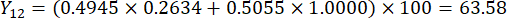
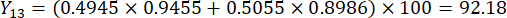
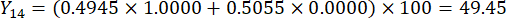
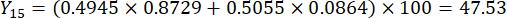
Remarque : Y13 est la valeur maximale. Par conséquent, le meilleur paramètre des épaisseurs de tranchage est le troisième niveau - 2 cm.
Résultats
Dans cette étude, le gradient d’élution utilisé avait une bonne résolution (Figure 1) pour les trois composantes de l’indice dans le TBC sauté Zanba, tel que déterminé après un débogage répété. Les trois composantes de l’indice dans le TBC sauté Zanba avaient une bonne relation linéaire à l’intérieur d’une plage de concentration spécifique (tableau 2). La précision (tableau 5), la stabilité (tableau 6), la répé...
Discussion
Le TBC est un médicament tibétain important qui a pour effet de dissiper le froid et de soulager la douleur. Il a été principalement utilisé pour traiter les blessures traumatiques et l’arthralgie rhumatismale en Chine pendant des milliers d’années24,25,26. Les alcaloïdes diterpénoïdes sont à la fois des ingrédients actifs et toxiques du TBC27,28,29
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à divulguer.
Remerciements
Ce travail a été soutenu financièrement par la Fondation nationale des sciences naturelles de Chine (n ° 82130113), la Fondation chinoise des sciences postdoctorales (n ° 2021MD703800), la Fondation scientifique pour les jeunes du Département des sciences et de la technologie de la province du Sichuan (n ° 2022NSFSC1449) et le programme de promotion de la recherche « Xinglin Scholars » de l’Université de médecine traditionnelle chinoise de Chengdu (No. BSH2021009).
matériels
| Name | Company | Catalog Number | Comments |
| 3-Deoxyaconitine | Chengdu Desite Biotechnology Co., Ltd. | DST221109-033 | |
| Aconitine | Chengdu Desite Biotechnology Co., Ltd. | DSTDW000602 | |
| Ammonium acetate | Tianjin Kermel Chemical Reagent Co., Ltd | Chromatographic grade | |
| Benzoylaconitine | Chengdu Desite Biotechnology Co., Ltd. | DSTDB005502 | |
| Design-Expert software | Stat-Ease, Inc., Minneapolis, MN, USA | version 13.0 | |
| Electronic analytical balance | Shanghai Liangping Instruments Co., Ltd. | FA1004 | |
| High performance liquid chromatography | SHIMADZU Co., Ltd. | LC-20A | |
| High-speed smashing machine | Beijing Zhongxing Weiye Instrument Co., Ltd. | FW-100 | |
| Millipore filter | Tianjin Jinteng Experimental Equipment Co., Ltd | φ13 0.22 Nylon66 | |
| stir-Fry machine | Changzhou Maisi Machinery Co., Ltd | Type 5 | |
| Tiebangchui | Gannan Baicao Biotechnology Development Co., Ltd | 20211012 | |
| Ultra pure water systemic | RephiLe Bioscience, Ltd. | Genie G | |
| Ultrasonic cleansing machine | Ningbo Xinyi Ultrasonic Equipment Co., Ltd | SB2200 | |
| Zanba | 27 Chuanzang Road, Ganzi County | - |
Références
- Li, C. Y., et al. Aconitum pendulum and Aconitum flavum: A narrative review on traditional uses, phytochemistry, bioactivities and processing methods. Journal of Ethnopharmacology. 292, 115216 (2022).
- Wang, J., Meng, X. H., Chai, T., Yang, J. L., Shi, Y. P. Diterpenoid alkaloids and one lignan from the roots of Aconitum pendulum Busch. Natural Products and Bioprospecting. 9 (6), 419-423 (2019).
- Yu, L., et al. Traditional Tibetan medicine: therapeutic potential in rheumatoid arthritis. Frontiers In Pharmacology. 13, 938915 (2022).
- Zhao, R., et al. One case of ventricular arrhythmia caused by poisoning of traditional Chinese medicine Aconitum pendulum Busch. Journal of People's Military Medical. 61 (4), 346-348 (2018).
- Qinghai Medical Products Administration. Processing specification of Tibetan medicine of Qinghai province. Qinghai Nationalities Publishing House. , 96-97 (2010).
- Li, J., et al. Comparison of three objective weighting methods to optimize the extraction process of Jianwei Chupi granules. Journal of Guangdong Pharmaceutical University. 38 (6), 91-97 (2022).
- Feng, Z. G., et al. Processing methods and the underlying detoxification mechanisms for toxic medicinal materials used by ethnic minorities in China: A review. Journal of Ethnopharmacology. 305, 116126 (2023).
- Hsu, Y. T., Su, C. S. Application of Box-Behnken design to investigate the effect of process parameters on the microparticle production of ethenzamide through the rapid expansion of the supercritical solutions process. Pharmaceutics. 12 (1), 42 (2020).
- Cheng, F., et al. Optimization of the baked drying technology of Cinnamomi Ramulus based on CRITIC combined with box-behnken response surface method. Journal of Chinese Medicinal Materials. 2022 (8), 1838-1842 (2022).
- Huang, X., et al. Optimization of microwave processing technology for carbonized Gardenia jasminoides by Box-Behnken response surface methodology based on CRITIC weighted evaluation. Chinese Herbal Medicines. 48 (6), 1133-1138 (2017).
- Elling, U., et al. Derivation and maintenance of mouse haploid embryonic stem cells. Nature Protocols. 14 (7), 1991-2014 (2019).
- Gu, J., Wang, Y. P., Ma, X. Simultaneous determinnation of three diester diterpenoid alkaloids in the toots of Aconiti flavi et penduli by HPLC method. Chinese Pharmaceutical Affairs. 28 (6), 618-621 (2014).
- Zhang, Y., Fu, X. UPLC simultaneous determination of six esteric alkaloids components in Aconitum Flaram Hand.Mazz. Asia-Pacific Traditional Medicine. 16 (5), 62-65 (2020).
- Rumachik, N. G., Malaker, S. A., Paulk, N. K. VectorMOD: Method for bottom-up proteomic characterization of rAAV capsid post-translational modifications and vector impurities. Frontiers In Immunology. 12, 657795 (2021).
- Wang, Y. J., Tao, P., Wang, Y. Attenuated structural transformation of aconitine during sand frying process and antiarrhythmic effect of its converted products. Evidence-Based Complementary and Alternative Medicine. 2021, 7243052 (2021).
- Wang, H. P., Zhang, Y. B., Yang, X. W., Zhao, D. Q., Wang, Y. P. Rapid characterization of ginsenosides in the roots and rhizomes of Panax ginseng by UPLC-DAD-QTOF-MS/MS and simultaneous determination of 19 ginsenosides by HPLC-ESI-MS. Journal of Ginseng Research. 40 (4), 382-394 (2016).
- vander Leeuw, G., et al. Pain and cognitive function among older adults living in the community. Journals of Gerontology Series A. Biological Sciences and Medical Sciences. 71 (3), 398-405 (2016).
- Lao, D., Liu, R., Liang, J. Study on plasma metabolomics for HIV/AIDS patients treated by HAART based on LC/MS-MS. Frontiers in Pharmacology. 13, 885386 (2022).
- Li, Y., et al. Evaluation of the effectiveness of VOC-contaminated soil preparation based on AHP-CRITIC-TOPSIS model. Chemosphere. 271, 129571 (2021).
- Zhong, S., Chen, Y., Miao, Y. Using improved CRITIC method to evaluate thermal coal suppliers. Scientific Reports. 13 (1), 195 (2023).
- Lewis, N. S., et al. Magnetically levitated mesenchymal stem cell spheroids cultured with a collagen gel maintain phenotype and quiescence. Journal of Tissue Engineering. 8, (2017).
- Chinese Pharmacopoeia Committee. . Pharmacopoeia of the People's Republic of China. 4, (2020).
- Li, G., et al. Effect of response surface methodology-optimized ultrasound-assisted pretreatment extraction on the composition of essential oil released from tribute citrus peels. Frontiers in Nutrition. 9, 840780 (2022).
- Liu, X. F., et al. Hezi inhibits Tiebangchui-induced cardiotoxicity and preserves its anti-rheumatoid arthritis effects by regulating the pharmacokinetics of aconitine and deoxyaconitine. Journal of Ethnopharmacology. 302, 115915 (2023).
- Smolen, J. S., et al. Rheumatoid arthritis. Nature Reviews.Disease Primers. 4, 18001 (2018).
- Wang, F., et al. C19-norditerpenoid alkaloids from Aconitum szechenyianum and their effects on LPS-activated NO production. Molecules. 21 (9), 1175 (2016).
- Wang, B., et al. Study on the alkaloids in Tibetan medicine Aconitum pendulum Busch by HPLC-MSn combined with column chromatography. Journal of Chromatographic Science. 54 (5), 752-758 (2016).
- Liu, S., et al. A review of traditional and current methods used to potentially reduce toxicity of Aconitum roots in Traditional Chinese Medicine. Journal of Ethnopharmacology. 207, 237-250 (2017).
- Qiu, Z. D., et al. Online discovery of the molecular mechanism for directionally detoxification of Fuzi using real-time extractive electrospray ionization mass spectrometry. Journal of Ethnopharmacology. 277, 114216 (2021).
- El-Shazly, M., et al. Use, history, and liquid chromatography/mass spectrometry chemical analysis of Aconitum. Journal of Food and Drug Analysis. 24 (1), 29-45 (2016).
- Chan, T. Y. K. Aconitum alkaloid poisoning because of contamination of herbs by aconite roots. Phytotherapy Research. 30 (1), 3-8 (2016).
- Guo, L., et al. Exploring microbial dynamics associated with flavours production during highland barley wine fermentation. Food Research International. 130, 108971 (2020).
- Guo, T. L., Horvath, C., Chen, L., Chen, J., Zheng, B. Understanding the nutrient composition and nutritional functions of highland barley (Qingke): A review. Trends in Food Science & Technology. 103, 109-117 (2020).
- Wu, H., et al. Anti-myocardial infarction effects of Radix Aconiti Lateralis Preparata extracts and their influence on small molecules in the heart using matrix-assisted laser desorption/ionization-mass spectrometry imaging. International Journal of Molecular Sciences. 20 (19), 4837 (2019).
- Huang, G., et al. Study on cardiotoxicity and mechanism of "Fuzi" extracts based on metabonomics. International Journal of Molecular Sciences. 19 (11), 3506 (2018).
- Li, S. L., et al. An insight into current advances on pharmacology, pharmacokinetics, toxicity and detoxification of aconitine. Biomedicine & Pharmacotherapy. 151, 113115 (2022).
- Xie, Y., et al. Optimization of processing technology of braised Rehmanniae Raidx based on multiple indexes and response surface technology and correlation between components and color. Journal of Chinese Traditional Medicine. 47 (18), 4927-4937 (2022).
- Yang, X. Q., Xu, W., Xiao, C. P., Sun, J., Feng, Y. Z. Study on processing technology of Atractylodes chinensis with rice water and its pharmacodynamics of anti-diarrhea. Chinese Herbal Medicines. 53 (1), 78-86 (2022).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon