Tests indépendants de l’oxygène pour mesurer la fonction mitochondriale chez les mammifères
Dans cet article
Résumé
Ici, nous présentons une compilation de tests pour mesurer directement la fonction mitochondriale dans les cellules de mammifères indépendamment de leur capacité à consommer de l’oxygène moléculaire.
Résumé
Le flux d’électrons dans la chaîne de transport d’électrons mitochondriales (ETC) soutient des fonctions biosynthétiques, bioénergétiques et de signalisation à multiples facettes dans les cellules de mammifères. Comme l’oxygène (O2) est l’accepteur terminal d’électrons le plus omniprésent pour l’ETC chez les mammifères, le taux de consommation d’O2 est fréquemment utilisé comme indicateur de la fonction mitochondriale. Cependant, des recherches émergentes démontrent que ce paramètre n’est pas toujours indicatif de la fonction mitochondriale, car le fumarate peut être utilisé comme accepteur d’électrons alternatif pour maintenir les fonctions mitochondriales dans l’hypoxie. Cet article compile une série de protocoles qui permettent aux chercheurs de mesurer la fonction mitochondriale indépendamment du taux de consommation d’O2. Ces tests sont particulièrement utiles lors de l’étude de la fonction mitochondriale dans des environnements hypoxiques. Plus précisément, nous décrivons des méthodes pour mesurer la production d’ATP mitochondriale, la biosynthèse de novo de la pyrimidine, l’oxydation du NADH par le complexe I et la production de superoxyde. En combinaison avec les expériences classiques de respirométrie, ces tests orthogonaux et économiques fourniront aux chercheurs une évaluation plus complète de la fonction mitochondriale dans leur système d’intérêt.
Introduction
La fonction mitochondriale est une mesure essentielle de la santé cellulaire, car elle soutient les fonctions biosynthétiques, bioénergétiques et de signalisation clés dans les cellules de mammifères1. La grande majorité des fonctions mitochondriales nécessitent un flux d’électrons à travers la chaîne de transport d’électrons (ETC), et les perturbations du flux d’électrons dans l’ETC provoquent une maladie mitochondriale grave2. L’ETC est composé d’une série de réactions de réduction et d’oxydation (redox) qui sont intégrées dans la membrane mitochondriale interne, et ces réactions de transfert d’électrons libèrent de l’énergie libre qui peut être exploitée pour soutenir la synthèse de l’ATP, les processus physiologiques tels que la thermogenèse, les voies de biosynthèse telles que la biosynthèse de novo de la pyrimidine et l’équilibre du statut redox des cofacteurs tels que le NADH. Les complexes ETC I et III produisent des espèces réactives de l’oxygène (ROS)3,4,5, qui, à leur tour, régulent les voies clés de signalisation telles que HIF, PI3K, NRF2, NFκB et MAPK 6. Par conséquent, les métriques du flux d’électrons dans l’ETC sont classiquement utilisées comme proxy de la fonction mitochondriale dans les cellules de mammifères.
Les expériences de respirométrie sont fréquemment utilisées pour mesurer la fonction mitochondriale dans les cellules de mammifères. Puisque O2 est l’accepteur terminal d’électrons le plus omniprésent pour l’ETC chez les mammifères, sa réduction est utilisée comme proxy pour la fonction mitochondriale. Cependant, de nouvelles preuves démontrent que les mitochondries de mammifères peuvent utiliser le fumarate comme accepteur d’électrons pour maintenir les fonctions mitochondriales qui dépendent de l’ETC, y compris la biosynthèse de novo de la pyrimidine 7, l’oxydation du NADH7 et la désintoxication du sulfure d’hydrogène8. Ainsi, dans certains contextes, notamment en milieu hypoxique, les mesures du taux de consommation d’O2 (OCR) ne fournissent pas une indication précise ou précise de la fonction mitochondriale.
Ici, nous décrivons une série de tests qui peuvent être utilisés pour mesurer la fonction mitochondriale indépendamment de l’OCR. Nous fournissons des tests pour mesurer directement l’oxydation NADH médiée par le complexe I, la biosynthèse de novo pyrimidine médiée par la dihydroorotate déshydrogénase, la synthèse complexe V-dépendante de l’ATP, la directionnalité nette du complexe succinate déshydrogénase (SDH) et les ROS dérivés des mitochondries. Ces tests sont destinés à être effectués sur des cellules de mammifères en culture, bien que beaucoup puissent être adaptés pour étudier les fonctions mitochondriales in vivo. Notamment, les tests décrits dans ce protocole sont des mesures plus directes des fonctions mitochondriales que l’OCR. De plus, ils permettent de mesurer la fonction mitochondriale en hypoxie, un contexte dans lequel l’OCR n’est pas une mesure indicative. Pris ensemble, ces essais, combinés à des expériences classiques de respirométrie, fourniront aux chercheurs une évaluation plus complète de la fonction mitochondriale dans les cellules de mammifères.
Protocole
1. Essais de prolifération pour mesurer l’activité du complexe I, de la dihydroorotate déshydrogénase (DHODH) et du complexe V
- Cellules d’ensemencement pour les essais de prolifération
REMARQUE : Ce protocole utilise la lignée cellulaire d’ostéosarcome humain 143B achetée dans le commerce auprès de l’ATCC. Cette lignée cellulaire a été utilisée conformément aux lignes directrices de notre protocole approuvé par le Comité de biosécurité (CIB) de l’établissement.- Retirez les plaques de l’incubateur de culture tissulaire. Aspirer le milieu des assiettes et laver avec 1x solution saline tamponnée au phosphate (PBS) pour éliminer tout milieu restant. Aspirer le PBS et couvrir le plat avec 0,05% -0,25% de trypsine pour soulever les cellules du fond de la plaque.
- Attendez 3 à 5 minutes que la trypsine libère les cellules de la plaque, puis éteignez la trypsine avec 10 ml du milieu de croissance désiré contenant 10% de sérum bovin fœtal (FBS).
- Recueillir les cellules dans un tube conique et centrifuger à 1 000 × g pendant 5 min pour granuler les cellules.
- Aspirer le milieu du tube sans déranger la pastille. Remettez la pastille en suspension avec un milieu complet.
- Comptez les cellules et quantifiez le volume nécessaire pour ensemencer entre 10 000 et 25 000 cellules dans une plaque à 6 puits.
REMARQUE: Chaque lignée cellulaire devra être optimisée pour le nombre de cellules à ensemencer. La confluence idéale atteinte est ~10% au début de l’expérience et ~80% à la fin de l’expérience. - Pipeter les cellules dans une plaque de 6 puits, et ajouter 2 mL de milieu complet dans les puits. Laisser reposer pendant 24 h avant de passer aux conditions du milieu expérimental.
REMARQUE : Ensemencer au moins trois répétitions par affection et suffisamment de puits pour tester la condition témoin non traitée, la condition témoin traitée par inhibiteur, la condition expérimentale non traitée et la condition expérimentale traitée par inhibiteur.
- Changement moyen pour évaluer l’activité complexe V par prolifération
NOTE: Les cellules proliférant dans un milieu avec du galactose dépendent de l’activité du complexe V pour la synthèse de l’ATP 9,10. Contrairement au glucose, qui produit deux ATP nets de glycolyse, le galactose n’en produit aucun, forçant les cellules à dépendre du complexe V pour la synthèse de l’ATP (Figure 1). L’inhibiteur complexe V oligomycine est utilisé comme témoin.- Fabriquer un milieu contenant du glucose de 10 mM (voir tableau 1).
- Fabriquer un milieu contenant du galactose à 10 mM (voir tableau 1).
- Changez le milieu dans chaque puits pour du DMEM contenant du glucose ou du DMEM contenant du galactose. Ajouter 5 μM d’oligomycine (l’inhibiteur complexe V) aux puits concernés et le même volume de DMSO aux puits non traités. Le stock d’oligomycine est de 10 mM remis en suspension dans du DMSO. Remettez la plaque dans l’incubateur de culture tissulaire pendant 2 jours.
- Changement moyen pour évaluer l’activité complexe I par prolifération
NOTE: Les cellules proliférant dans un milieu exempt de pyruvate dépendent davantage de l’activité du complexe I11,12. Sans pyruvate, les cellules cultivées nécessitent le complexe I pour faciliter la majeure partie de la réoxydation du NADH en NAD+ (Figure 2). L’inhibiteur du complexe I roténone est utilisé comme témoin.- Faire un milieu DMEM sans pyruvate complété avec 10% FBS et 1% pénicilline-streptomycine.
- Préparer une solution 1 M de pyruvate (voir tableau 1).
- Changer le milieu dans chaque puits pour un milieu exempt de pyruvate ou un milieu contenant du pyruvate. Ajouter 2 μM de roténone (l’inhibiteur du complexe I) aux puits traités et le même volume de DMSO aux puits non traités. Le stock de roténone est de 25 mM remis en suspension dans du DMSO. Remettez la plaque dans l’incubateur de culture tissulaire pendant 2 jours.
- Changement moyen pour évaluer l’activité de la DHDH par prolifération
NOTE: Les cellules proliférant dans un milieu sans uridine nécessitent une activité dihydroorotate déshydrogénase (DHODH)11,12,13. En l’absence d’uridine exogène, les cellules cultivées synthétisent les pyrimidines par la voie de novo. L’inhibiteur de DHODH brequinar est utilisé comme témoin.- Faire du DMEM sans uridine complété par 10% FBS et 1% de pénicilline-streptomycine.
- Préparer une solution mère d’uridine à 10 mg/mL, puis préparer un milieu uridine à 100 μg/mL (voir le tableau 1).
- Changer le milieu dans chaque puits pour un milieu exempt d’uridine ou un milieu contenant de l’uridine. Ajouter 5 μM de brequinar (l’inhibiteur de DHODH) aux puits traités et le même volume de DMSO aux puits non traités. Le stock de brequinar est de 10 mM remis en suspension dans le DMSO. Remettez la plaque dans l’incubateur de culture tissulaire pendant 2 jours.
- Compter les cellules pour les essais de prolifération
- Pour toutes les expériences, reconstituez le milieu tous les 2 jours. Si le milieu devient de couleur jaune, augmentez la fréquence des changements de milieu. Laissez les cellules proliférer jusqu’à 7 jours et arrêtez l’expérience si l’un des puits commence à sembler envahi par la végétation. Les puits sont considérés comme envahis lorsque la confluence dépasse 80%.
- Aspirer le milieu, laver avec 1x PBS et couvrir le fond du puits avec 0,25% de trypsine (500 μL pour un plat à 6 puits).
- Attendez 5 minutes jusqu’à ce que les cellules aient décollé du plat. Vérifiez cela au microscope.
- Tremper la trypsine avec 1 mL de DMEM complet contenant 10% de FBS.
- Pipette de haut en bas pour briser les amas de cellules.
- Préparer les gobelets Coulter en remplissant chacun avec 10 ml de tampon isotone (une tasse par puits). Comptez les cellules d’un compteur de cellules et enregistrez les données. Si la lecture est le nombre de cellules par millilitre (cellules/mL), multipliez la valeur enregistrée par 1,5 pour obtenir le nombre total de cellules par puits.
REMARQUE: D’autres méthodes de comptage cellulaire telles qu’un hémocytomètre suffiront si le laboratoire ne dispose pas d’un compteur Coulter.
2. Tracédes isotopes stables en C 4-aspartate et analyse LC-MS pour mesurer l’activité DHODH
- 13Tracé des isotopes stables en C 4-aspartate dans les cellules adhérentes
NOTE: L’activité DHODH peut être directement surveillée en mesurant l’incorporation de 13 C 4-aspartate dans 13C3-UMP. Brequinar est utilisé comme témoin de l’activité DHODH (figure 3). Les niveaux résultants de 13C3-UMP sont une mesure de l’activité DHODH.- Ensemencez entre 250 000 et 500 000 cellules dans un plat à 6 puits pour atteindre 75% de confluence le lendemain.
- Préparer une solution mère de milieu 250 mM 13 C 4-aspartate et 10 mM 13C4-aspartate (voir tableau 1).
- Changer le milieu dans chaque puits en milieu contenant 10 mM 13C 4-aspartate. Incuber pendant le nombre d’heures approprié pour obtenir un état stable pour marquer les cellules d’intérêt.
NOTE: L’état d’équilibre est défini comme la période dans laquelle le pourcentage de métabolite marqué plafonne au fil du temps14. Pour les cellules d’ostéosarcome 143B, le 13C 4-aspartate atteint un état d’équilibre à 8 heures. Il est préférable de déterminer ce délai avant l’expérimentation en effectuant une expérience sur le parcours temporel avec l’isotope stable d’intérêt.
- Isolement du métabolite des cellules adhérentes
- Avant de commencer, préparez un seau de glace sèche et préparez 80% de MeOH de qualité CLHP dans de l’eau de qualité CLHP. Refroidissez ce tampon dans un congélateur à -80 °C pendant une nuit ou placez-le directement sur de la glace sèche.
- Sortir une assiette à la fois de l’incubateur, aspirer le milieu des puits et laver 2x avec 1x PBS. Retirez tout le PBS résiduel des puits avant de passer à l’étape suivante.
REMARQUE: Assurez-vous d’incliner la plaque pendant l’aspiration et la pipette contre la paroi de la capsule pour éviter la perturbation des cellules adhérentes. - Placez la plaque sur de la glace sèche et ajoutez immédiatement 800 μL de MeOH de qualité LCMS à 80 % dans de l’eau de qualité LCMS à 20 % dans chaque puits.
- Incuber la plaque pendant au moins 15 minutes dans un congélateur à −80 °C pour faciliter la lyse cellulaire.
REMARQUE: À ce stade, la plaque suivante peut être retirée de l’incubateur et les étapes 2.2.1-2.2.4 répétées. Continuez jusqu’à ce que toutes les plaques soient en incubation dans le congélateur à −80 °C. - Sortir une assiette à la fois du congélateur, gratter chaque puits sur de la glace sèche à l’aide d’un élévateur de cellule et transférer le lysat dans un tube microcentrifuge de 1,5 mL. Gardez le tube sur de la glace sèche jusqu’à l’étape suivante.
- Vortex de tous les tubes pendant 10 min à 4 °C, puis centrifugation à 4 °C pendant 10 min à la vitesse maximale (au moins 17 000 × g).
- Transférer le surnageant dans un tube à microcentrifugation de 1,5 mL et sécher dans un concentrateur sous vide à 4 °C équipé d’un piège à froid à −105 °C sous vide poussé pendant environ 6 h ou jusqu’à ce que les échantillons se soient évaporés. Une fois le lysat séché, conservez les pastilles de métabolite à -80 °C jusqu’à ce qu’elles soient prêtes à être préparées pour la chromatographie liquide associée à la spectrométrie de masse (LCMS).
- Mesure par chromatographie liquide-spectrométrie de masse (LC-MS) des métabolites polaires
NOTE: Tout flux de travail chromatographique et spectrométrie de masse permettant la détection de l’aspartate, des intermédiaires dans la biosynthèse de novo de la pyrimidine et de l’UMP suffira14.- Préparer les échantillons pour le LCMS sur glace en ajoutant 100 μL d’eau de qualité CLHP aux granulés séchés et au vortex pendant 10 minutes à 4 °C.
- Centrifuger les échantillons à 4 °C pendant 10 min à la vitesse maximale (au moins 17 000 × g) et déplacer 25 μL dans chaque flacon de LC-MS.
- Injecter 2 μL de lysat dans le système LC-MS. Une méthodologie couramment utilisée est donnée ci-dessous:
- Préparer la phase A mobile comprenant 20 mM de carbonate d’ammonium (qualité LC-MS) et 0,1 % d’hydroxyde d’ammonium (qualité LC-MS) dissous dans de l’eau de qualité LC-MS.
- Choisissez 100% acétonitrile (LC-MS Grade) comme phase mobile B.
- Pour la chromatographie, choisissez une colonne analytique de 5 μm, 150 mm x 2,1 mm équipée d’une colonne protectrice de 2,1 mm x 20 mm pour les composés hydrophiles (voir le tableau des matériaux). Régler le four à colonne à 25 °C.
- Utilisez les paramètres de chromatographie liquide suivants : un débit constant de 0,15 mL/min; un gradient linéaire de 80 % à 20 % de la phase B mobile pendant 20 min, suivi d’un gradient linéaire de 20 % à 80 % de la phase B mobile pendant 0,5 min, suivi d’un maintien à 80 % de la phase B mobile pendant 7,5 min.
- Choisissez les réglages suivants du spectromètre de masse : un balayage complet entre m/z 70 Da et 1 000 Da ; une résolution de 70 000 personnes; un objectif AGC de 1 × 106; et un temps d’injection maximal de 20 ms. Faites fonctionner la source en mode de commutation de polarité. Réglez la tension de pulvérisation à 3,0 kV, le capillaire chauffé à 275 °C, la sonde HESI à 350 °C, le débit de gaz de gaine à 40 unités, le débit de gaz auxiliaire à 15 unités et le débit de gaz de balayage à 1 unité.
- Effectuez l’analyse des données à l’aide de n’importe quel logiciel qui s’interface avec le flux de travail LCMS.
REMARQUE: Les logiciels utilisés avec le flux de travail ci-dessus sont XCalibur (Thermo) et TraceFinder (Thermo). Les principales considérations relatives à l’analyse des données sont décrites ci-dessous :- Temps de rétention prévus : Déterminer le temps de rétention de chaque métabolite en exécutant les étalons pour chaque métabolite d’intérêt en utilisant la méthode chromatographique avant l’expérience.
Remarque : Les temps de rétention de l’UMP et de ses isotopologues, y compris 13C3-UMP, sont exactement les mêmes. - M/Z attendu pour les métabolites : Si un métabolite s’ionise en mode ion négatif (tel que UMP), calculer la masse exacte attendue en utilisant la formule moléculaire de UMP moins un proton [C 9 H14N2O9P]. Pour les métabolites qui s’ionisent en mode ion positif, calculez la masse exacte en utilisant la formule moléculaire plus un proton.
- Précision de masse: Lors de l’utilisation d’un spectromètre de masse orbitrap, le métabolite d’intérêt et ses isotopologues devraient avoir une précision de masse de ±5 mmu. Utilisez un logiciel pour calculer cela, en tenant compte du M/Z attendu et du M/Z réel détecté.
- Correction de l’abondance naturelle : Toutes les données de traçage devraient subir une correction de l’abondance naturelle pour tenir compte des isotopes ~1 % 13C et ~0,5 % 15 N-isotopes dans la nature 15.
- Temps de rétention prévus : Déterminer le temps de rétention de chaque métabolite en exécutant les étalons pour chaque métabolite d’intérêt en utilisant la méthode chromatographique avant l’expérience.
3. Tracédes isotopes stables de la5-glutamine en C pour mesurer l’activité de la SDH
- 13Tracé des isotopes stables en C 5-glutamine dans les cellules adhérentes
NOTE: L’activité SDH peut être directement surveillée en mesurant l’interconversion de certains isotopologues du fumarate et du succinate sur 13C5-glutamine traçant 7,16,17. L’inhibiteur du complexe III, l’antimycine, est utilisé comme témoin pour modifier la directionnalité nette du complexe SDH (Figure 4).- Ensemencez entre 250 000 et 500 000 cellules dans un plat à 6 puits pour atteindre 75% de confluence le lendemain.
- Préparer un stock de 50 mM 13C5-glutamine (voir tableau 1).
- Préparer un milieu calque contenant 2 mM 13C5-glutamine (voir tableau 1).
- Changer le milieu dans chaque puits en milieu contenant 2 mM 13C5-glutamine. Incuber pendant le nombre d’heures approprié pour obtenir un état stable de marquage des cellules d’intérêt (voir la note à l’étape 2.1.3).
- Isoler les métabolites en suivant le protocole de l’étape 2.2.
- Analysez les échantillons sur LC-MS en suivant le flux de travail décrit à l’étape 2.3.
- Analyse de l’activité SDH basée sur les modèles d’étiquetage
NOTE: L’activité d’oxydation du succinate du complexe SDH peut être surveillée en évaluant le rapport de 13 C 4-fumarate à 13C4-succinate sur 13 C5-glutamine traçage. L’activité de réduction du fumarate du complexe SDH peut être surveillée en évaluant le rapport de 13 C 3-succinate à 13 C3-fumarate sur 13C 5-glutamine traçage.- Calculez le pourcentage d’étiquetage de 13 C 3-fumarate, 13 C 4-fumarate, 13 C3-succinate et 13C 4-succinate. Par exemple, pour déterminer le pourcentage de fumarate de 13 C3, additionnez toutes les aires de pics intégrées pour les isotopologues du fumarate (fumarate non marqué, fumarate 13 C1, fumarate 13C 2, fumarate 13 C 3 et fumarate 13 C4), et divisez l’aire de pic pour 13C 3-fumaratepar la surface isotopologique totale. Multipliez par 100.
- Pour calculer l’oxydation du succinate de succinate divisez le pourcentage de fumarate de 13C 4 par le pourcentage de 13C4-succinate.
- Pour calculer la réduction du fumarate, diviser le pourcentage de 13 C 3-succinate par le pourcentage de fumarate de 13C 3.
4. Essai direct de l’activité complexe I
NOTE: DCPIP est un accepteur d’électrons artificiel; Il change de forme réduite lorsqu’il accepte les électrons de l’ubiquinol. Dans ce test, l’ubiquinone est réduite en ubiquinol via l’oxydation complexe médiée par l’I du NADH en NAD+. Ainsi, la mesure du renouvellement du DCPIP oxydé dans ce test acellulaire est une approximation de l’activité du complexe I 7,18.
- Purifier et quantifier les mitochondries des cellules
REMARQUE: Tout protocole de purification mitochondriale peut être utilisé pour ce test19.- Développez les cellules jusqu’à ce que 25 à 100 millions de cellules soient obtenues. Aspirer le milieu de la vaisselle, laver avec 1x PBS, aspirer le PBS et essayer de faire tourner les cellules avec 0,25% de trypsine. Tremper la trypsine avec un milieu de culture et granuler les cellules à 1 000 × g pendant 5 min.
- Laver les granulés de la cellule 2x dans 5 ml de 1x PBS, et répéter la centrifugation à 1 000 × g pendant 5 min pour granuler les cellules. Conservez les granulés lavés dans un congélateur à −20 °C jusqu’à purification mitochondriale.
REMARQUE : Ne pas congeler-décongeler les granulés de la cellule plus d’une fois. - Préparer le tampon d’isolement des mitochondries (voir Tableau 1).
NOTE: Les réactifs contenant du sodium tels que NaOH ne doivent pas être utilisés pour préparer des tampons d’isolement mitochondrial, car le sodium ternit le potentiel de la membrane mitochondriale20 et perturbe l’homéostasie mitochondrialedu calcium 21. - Remettez en suspension les granules cellulaires à 10 millions de cellules par 1 mL de tampon d’isolement mitochondrial. Par exemple, remettre en suspension 100 millions de cellules granulées dans 10 ml de tampon d’isolement mitochondrial.
REMARQUE: Assurez-vous de perturber les amas de cellules sans introduire de bulles dans le tampon. - Déplacez 2 mL de suspension cellulaire dans un homogénéisateur en verre prérefroidi d’un volume de travail de 3 à 8 mL compatible avec un pilon PTFE Potter-Elvehjem. Homogénéiser les cellules avec 10-20 coups, en surveillant les cellules au microscope pour confirmer la lyse cellulaire tout au long du processus d’homogénéisation. Augmentez le nombre d’AVC si nécessaire pour assurer une lyse cellulaire efficace.
REMARQUE: Si l’homogénéisation des cellules avec la méthode ci-dessus n’est pas efficace pour lyser les cellules, passez à une méthode de lyse à la seringue22. - Transférer 2 mL du lysat cellulaire dans un tube microcentrifuge sur de la glace et répéter les étapes ci-dessus jusqu’à ce que la suspension cellulaire entière soit homogénéisée.
- Enduire les noyaux et les débris cellulaires à 650 × g pendant 10 min dans une centrifugeuse à 4 °C.
- Déplacer le surnageant dans un nouveau tube de 2,0 ml et répéter la centrifugation ci-dessus à 650 × g pendant 10 min à 4 °C.
- Déplacer le surnageant dans un nouveau tube de 2,0 ml et enduire les mitochondries brutes à 7 000 × g pendant 10 minutes dans une centrifugeuse à 4 °C.
- Jeter le surnageant et remettre la pastille en suspension dans 1 mL de tampon d’isolement mitochondrial. Déplacez 50 μL dans un nouveau tube pour la quantification des protéines. Répétez l’étape de centrifugation ci-dessus sur les deux aliquotes de l’échantillon (l’échantillon de 50 μL et les ~950 μL restants).
- Jeter le surnageant et conserver les granulés dans un congélateur à −80 °C jusqu’à ce qu’ils soient prêts à être utilisés.
- Ajouter 200 μL de tampon RIPA aux pastilles de l’aliquote de 50 μL pour extraire la protéine, vortex pendant 10 minutes et centrifuger à 21 000 × g pour isoler la protéine. Quantifier la quantité de protéines dans l’aliquote de 50 μL et utiliser ce nombre pour quantifier la protéine restante dans l’échantillon de 950 μL. Par exemple, si la quantification de la protéine pour la partie aliquote de 50 μL est de 1 μg/μL, la protéine totale dans la pastille mitochondriale restante est de 950 μg (1 μg/μL × 950 μL).
- Réalisation du test d’activité complexe I
REMARQUE: La lignée cellulaire d’ostéosarcome 143B a été utilisée pour ce test, mais le protocole peut être adapté à toutes les cellules en culture.- Resuspendre les mitochondries purifiées dans le tampon de remise en suspension des mitochondries (voir tableau 1) à une concentration finale de 5 mg de protéines/mL.
- Effectuer cinq cycles de congélation/décongélation dans un congélateur à −20 °C pour perméabiliser les mitochondries.
- Faire tampon pour l’essai d’activité complexe I (voir tableau 1).
- Mélanger 50 ug du stock de mitochondries de 5 mg/mL avec 90 μL de tampon d’activité complexe I. Préparer cinq répétitions non traitées et cinq répétitions traitées à la roténone (5 μM) pour contrôler l’activité complexe I.
- Lire l’absorbance de base à 600 nm dans un lecteur de plaques réglé à 37 °C.
- Initier la réaction en ajoutant du NADH à une concentration finale de 2 mM et suivre l’absorbance (600 nm) sur une période de 1 h, en mesurant au moins toutes les 2 minutes tout au long. La diminution de l’absorbance est révélatrice d’une réduction du DCPIP via l’activité du complexe I.
REMARQUE: Le NADH doit être ajouté à l’aide d’une pipette multicanal pour s’assurer que tous les échantillons sont initiés en même temps.
5. Dosage à base de LC-MS pour mesurer les niveaux de superoxyde
REMARQUE: Les propriétés de fluorescence de MitoSox Red peuvent changer indépendamment de sa réaction avec le superoxyde23. Ce test basé sur LC-MS mesure directement le produit à partir du superoxyde réagissant avec MitoSox Red. Le test suivant est légèrement modifié par rapport à Xiao et al.24. Le 2-hydroxy-mitoethidium (2-OH MitoE2+) est le produit de la réaction superoxyde (Figure 5). La lignée cellulaire Caki1 a été utilisée pour ce test, mais le protocole peut être adapté à toutes les cellules en culture.
- Traitement des cellules adhérentes avec MitoSox Red
- Ensemencez entre 250 000 et 500 000 cellules dans un plat à 6 puits pour atteindre 75% de confluence le lendemain. Assurez-vous d’ensemencer un ensemble de plaques pour le test LC-MS et un jeu de plaques en double pour la normalisation du nombre de cellules.
- Préparer du DMEM complet contenant 10 % de FBS inactivé par la chaleur et 1 % de pénicilline-streptomycine dans le milieu Eagle modifié de Dulbecco.
- Rafraîchir le milieu dans tous les puits pour toutes les conditions avec 2 mL de DMEM complet. Assurez-vous d’ajouter des médicaments ou des traitements d’intérêt à ce stade.
- Incuber les cellules dans un incubateur de culture tissulaire pendant 1 h.
- Préparez des contrôles positifs et négatifs. Préparer un stock de 50 mM d’hydroperoxyde de tert-butyle dilué dans du PBS et un stock de 250 mM de N-acétylcystéine (NAC) dilué dans du DMSO (voir le tableau 1).
REMARQUE: L’hydroperoxyde de tertbutyle (tBuOOH) est une espèce réactive puissante de l’oxygène qui agira comme un contrôle positif et augmentera la quantité de 2-OH MitoE2+. La NAC est un puissant antioxydant qui agira comme un contrôle négatif et neutralisera la production de superoxyde causée par tBuOOH. - Ajouter 1 μL de tBuOOH aux puits témoins positifs et 1 μL de tBuOOH + 100 μL de NAC aux puits témoins négatifs.
REMARQUE: L’utilisation d’une pipette P2 (plage de 0,1 à 2 μL) est la meilleure façon de transférer 1 μL. - Incuber pendant 1 h dans un incubateur de culture tissulaire.
- Préparer 1 mM de MitoSox Red (voir Tableau 1) et ajouter 2 μL de MitoSox Red 1 mM à chaque puits pour obtenir une concentration finale de 1 μM. Incuber pendant 30 min dans un incubateur de culture tissulaire.
- Au cours de cette incubation finale, compter l’une des plaques dupliquées pour acquérir le nombre de cellules afin de normaliser les données finales de LC-MS.
- Isolement du produit Mitosox Red oxydé des cellules adhérentes
- Procurez-vous un seau de glace sèche et placez de l’isopropanol frais de qualité CLHP sur la glace sèche avant de commencer l’isolement.
- En sortant une assiette à la fois, aspirez le milieu des puits et lavez 2x avec 1 mL de 1x PBS. Aspirez tout le PBS résiduel des puits avant de passer à l’étape suivante.
REMARQUE: Assurez-vous d’incliner la plaque pendant l’aspiration et la pipette contre la paroi de la capsule pour éviter toute perturbation des cellules adhérentes. - Placez la plaque sur de la glace sèche et ajoutez 800 μL d’isopropanol de qualité CLHP à chaque puits.
- Incuber la plaque pendant au moins 15 minutes dans un congélateur à −80 °C pour faciliter la lyse cellulaire.
REMARQUE: À ce stade, la plaque suivante peut être retirée de l’incubateur et les étapes 5.2.1-5.2.4 répétées. Continuez jusqu’à ce que toutes les plaques soient en incubation dans le congélateur à −80 °C. - Sortir une assiette à la fois du congélateur, gratter chaque puits sur de la glace sèche à l’aide d’un élévateur de cellule et transférer le lysat dans un tube microcentrifuge de 1,5 mL. Gardez le tube sur de la glace sèche jusqu’à l’étape suivante.
- Vortex de tous les tubes pendant 10 min à 4 °C, puis centrifugation à 4 °C pendant 10 min à la vitesse maximale (au moins 17 000 × g).
- Transférer le surnageant dans un tube microcentrifuge de 1,5 mL et sécher dans un concentrateur sous vide. Une fois le lysat séché, conservez les granulés de métabolite à -80 °C jusqu’à ce qu’ils soient prêts pour la LC-MS.
- Mesure LC-MS du MitoSox Red et du 2-hydroxy-mitoethidium (2-OH MitoE2+)
- Préparer les échantillons pour le LCMS sur glace en ajoutant 100 μL d’un mélange 3:3:1 de MeOH:chloroforme:eau de qualité CLHP. Vortex pendant 10 min à 4 °C.
- Déplacez 25 μL dans chaque flacon de LC-MS. Conservez le reste de l’échantillon dans le congélateur à −80 °C.
- Préparer les tampons de chromatographie liquide suivants : i) tampon A : eau de qualité CLHP contenant 0,1 % d’acide formique ; ii) tampon B : acétonitrile de qualité CLHP contenant 0,1 % d’acide formique.
- Ouvrez l’application Thermo XCalibur Instrument Setup pour commencer à développer la méthode.
- Recherchez deux cases dans la barre latérale gauche de cette fenêtre - la première boîte permet le développement de la méthode de chromatographie, et la deuxième boîte permet le développement de la méthode de spectrométrie de masse.
- Développement de méthodes de chromatographie liquide :
- Régler un débit de 0,25 mL/min et commencer la méthode à 20 % B, en augmentant à 95 % B sur une période de 12 minutes. Au cours de la minute suivante, abaissez le tampon B à 20 % B et maintenez ce niveau pendant les 2 minutes suivantes.
NOTE: Les 2 dernières minutes d’écoulement à 20% B sont critiques pour que la pression de la colonne redescende à la pression initiale et équilibre la colonne avec les rapports tampons appropriés. Si cette étape d’équilibrage n’est pas incluse, les temps de rétention seront décalés pour tous les échantillons exécutés ultérieurement.
- Régler un débit de 0,25 mL/min et commencer la méthode à 20 % B, en augmentant à 95 % B sur une période de 12 minutes. Au cours de la minute suivante, abaissez le tampon B à 20 % B et maintenez ce niveau pendant les 2 minutes suivantes.
- Créez un fichier de mélodie avec les paramètres suivants :
- Ouvrez l’application Tune et créez un nouveau fichier tune.
- Appliquez également tous les paramètres chevauchés du module Configuration de la méthode (voir étape 5.3.9.3) à ce fichier de réglage, notamment la plage de numérisation, la résolution, la polarité, la cible AGC et l’IT maximal.
- Réglez le gaz Sheath sur 30, le gaz auxiliaire sur 3 et le gaz Sweep sur 3 également. Réglez la tension de pulvérisation sur 3 kV, la température capillaire sur 300 et le niveau RF de la lentille S sur 60.
- Développement de méthodes de spectrométrie de masse :
- Dans la liste en bas à gauche des analyses potentielles, faites glisser et déposez Full MS au centre de la fenêtre. Assurez-vous de cliquer sur le carré Full MS après la chute pour ajuster les paramètres. La durée totale de la méthode MS est de 13 min.
NOTE: La méthode LC est plus longue que la méthode MS parce que les 2 dernières minutes sont consacrées au reconditionnement de la colonne et non à la quantification des métabolites. - Sur le côté droit du module, sous Propriétés de la méthode, assurez-vous que la durée et la durée d’exécution de la méthode sont définies sur 13h00 min.
- Exécutez cette analyse complète en mode positif à une résolution de 70 000 et une cible AGC de 1 × 106. Définissez l’IT maximum sur 100 ms et la plage de balayage de 300 m/z à 700 m/z.
- Sous Tune Files vers le haut du module, observez que le fichier de réglage qui vient d’être créé est lié à cette méthode.
- Dans la liste en bas à gauche des analyses potentielles, faites glisser et déposez Full MS au centre de la fenêtre. Assurez-vous de cliquer sur le carré Full MS après la chute pour ajuster les paramètres. La durée totale de la méthode MS est de 13 min.
- Exécutez la méthode de détection MitoSox Red avec des injections d’échantillons de 2 μL.
Résultats Représentatifs
Les activités du DHODH, du complexe I et du complexe V peuvent toutes être évaluées à l’aide d’essais de prolifération. Lors de la privation d’uridine du milieu de culture, les cellules deviennent plus dépendantes de la voie de novo pour la biosynthèse de la pyrimidine. Ainsi, lorsque les cellules ont été mises au défi de proliférer dans un milieu exempt d’uridine, elles étaient plus sensibles à l’inhibition de l’activité DHODH par brequinar que les cellules cultivées dans un milieu contenant de l’uridine (Figure 6A). De même, la privation de pyruvate du milieu de culture rend les cellules plus dépendantes de l’activité du complexe I pour la prolifération. Ainsi, lorsque les cellules ont été mises au défi de proliférer dans un milieu exempt de pyruvate, elles étaient plus sensibles à l’inhibition de l’activité du complexe I par la roténone que les cellules cultivées dans un milieu contenant du pyruvate (Figure 6B). L’activité du complexe V peut être évaluée en mettant les cellules au défi de proliférer dans un milieu contenant du galactose au lieu du glucose. Comme le galactose produit zéro ATP net dans la glycolyse, les cellules qui se développent dans ce carburant dépendent davantage de la synthèse mitochondriale de l’ATP via l’activité complexe V. Ainsi, les cellules proliférant dans un milieu contenant du galactose étaient plus sensibles à l’inhibition du complexe V par l’oligomycine que les cellules proliférant dans un milieu contenant du glucose (Figure 6C).
L’activité de la SDH peut être mesurée à l’aide du traçage dela 5-glutamine 13C et en surveillant son incorporation dans les isotopologues du fumarate et du succinate . Dans les conditions traitées par véhicule, le complexe SDH a favorisé l’activité en avant, et l’incorporation du 13 C 4-succinate dans le 13 C4-fumarate était supérieure à l’incorporation du 13 C 3-fumarate dans le 13C 3-succinate (Figure 7). Dans les conditions traitées à l’antimycine, le complexe SDH favorisait l’activité inverse, et l’incorporation du fumarate de 13 C 3 dans le 13 C3-succinate était supérieure à l’incorporation du 13 C 4-succinate dans le 13 C4-fumarate (Figure 7).
La production de superoxyde à l’intérieur des mitochondries peut être mesurée à l’aide du rapporteur fluorescent MitoSox, qui génère du 2-hydroxy-mitoethidium lors de la réaction avec le superoxyde. Dans cette étude, les cellules traitées avec MitoSox en présence de peroxyde d’hydrogène tertbutyle présentaient des niveaux plus élevés de 2-hydroxy-mitoethidium d’une manière qui a été supprimée par l’ajout de NAC, un antioxydant qui éteint les ROS cellulaires (Figure 8).
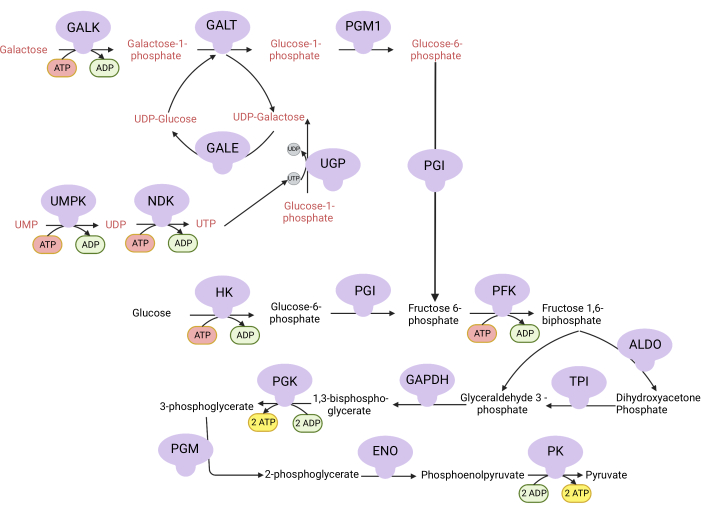
Figure 1 : Base mécaniste de l’essai complexe de prolifération V. Oxydation du glucose et du galactose par glycolyse. Le glucose produit deux ATP nets de la glycolyse, tandis que le galactose produit un ATP net nul parce que la synthèse UTP est nécessaire pour l’UDP-galactose. Ainsi, les cellules cultivées dans le galactose sont plus dépendantes de la synthèse mitochondriale de l’ATP en raison d’un manque d’ATP produit par glycolyse. Abréviations : GALK = galactokinase; GALT = galactose-1-phosphate uridylyltransférase; PGM1 = phosphoglucomutase 1; GPI = glucose-6-phosphate isomérase, UGP = UDP-glucose pyrophosphorylase; GALE = UDP-galactose-4-épimérase; NDK = nucléotide diphosphate kinase; UMPK = uridine monophosphate kinase; HK = hexokinase; PFK = phosphofructokinase; ALDO = aldolase; TPI = triosephosphate isomérase; GAPDH = glycéraldéhyde-3-phosphate déshydrogénase; PGK = phosphoglycérate kinase; PGM = phosphoglucomutase; ENO = énolase; PK = pyruvate kinase. Veuillez cliquer ici pour voir une version agrandie de cette figure.
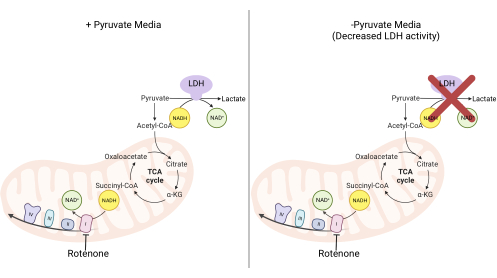
Figure 2 : Base mécaniste de l’essai complexe de prolifération I. Schéma des voies métaboliques qui sont altérées lors de l’inhibition de l’activité complexe I. Dans les milieux à haute teneur en pyruvate, l’inhibition du complexe I est contournée par oxydation du NADH médiée par la LDH. Dans les milieux à faible teneur en pyruvate, cette adaptation est moins réalisable, ce qui rend les cellules plus dépendantes de l’activité du complexe I pour réoxyder le NADH. Abréviations : LDH = lactate déshydrogénase; Cycle TCA = cycle de l’acide tricarboxylique. Veuillez cliquer ici pour voir une version agrandie de cette figure.
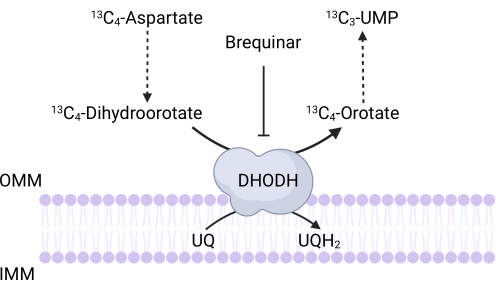
Figure 3 : Schéma de la réaction DHODH lors du traçage 13C 4-aspartate. Brequinar inhibe l’oxydation du dihydroorotate en orotate, empêchant ainsi la synthèse en aval de l’UMP. 13LeC4-aspartate est incorporé dans le 13C3-UMPvia l’activité DHODH. Abréviations : OMM = membrane mitochondriale externe; IMM = membrane mitochondriale interne; DHODH = dihydroorotate déshydrogénase. Veuillez cliquer ici pour voir une version agrandie de cette figure.
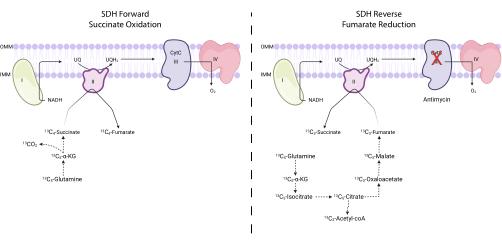
Figure 4 : Mesure de l’activité du complexe II avant et inverse via le traçage dela 5-glutamine 13C. Pour mesurer l’activité du complexe II direct (à gauche), l’incorporation de 13 C 5-glutamine dans le 13 C 4-succinate et le 13 C4-fumarate est surveillée. Pour mesurer l’activité du complexe inverse II (à droite), l’incorporation de 13 C 5-glutamine dans le 13 C 3-succinate et le 13 C3-fumarate est surveillée. Abréviations : SDH = succinate déshydrogénase; CytC = cytochrome C. Veuillez cliquer ici pour voir une version agrandie de cette figure.
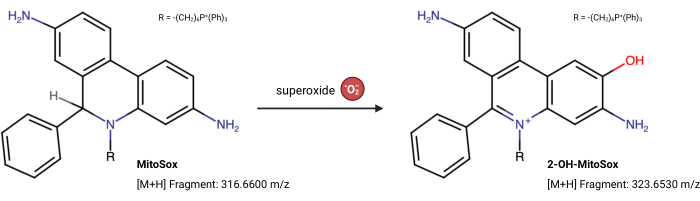
Figure 5 : Réaction MitoSox Red avec superoxyde. La réaction de MitoSox avec les superoxydes mitochondriaux pour former 2-OH-MitoE2+. Veuillez cliquer ici pour voir une version agrandie de cette figure.
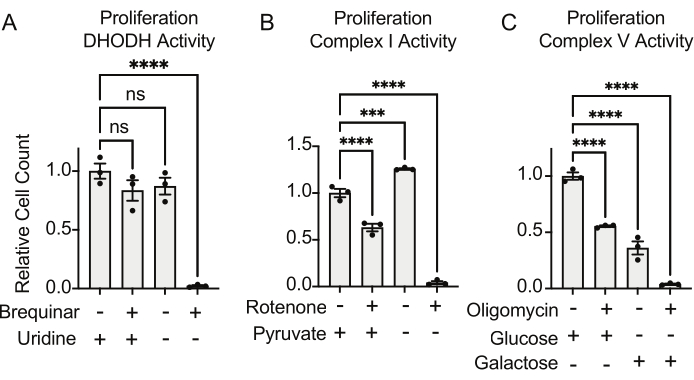
Figure 6 : Tests basés sur la prolifération pour mesurer la fonction mitochondriale (A) Prolifération de cellules d’ostéosarcome 143B traitées avec 5 uM brequinar, un inhibiteur de DHODH, en milieu avec ±100 ug/mL d’uridine. Les données sont moyennes ± SEM; N = 3 par condition. (B) Prolifération de cellules d’ostéosarcome 143B traitées avec la roténone 2 uM, un inhibiteur du complexe I, en milieu avec ±5 mM de pyruvate. Les données sont moyennes ± SEM; N = 3 par condition. (C) Prolifération de cellules d’ostéosarcome 143B traitées avec l’oligomycine 5 uM, un inhibiteur complexe V, en milieu avec 10 mM de glucose ou 10 mM de galactose comme seule source centrale de carbone. Les données sont moyennes ± SEM; N = 3 par condition. * indique p < 0,05 en utilisant un test ANOVA unidirectionnel dans Graphpad Prism. Veuillez cliquer ici pour voir une version agrandie de cette figure.
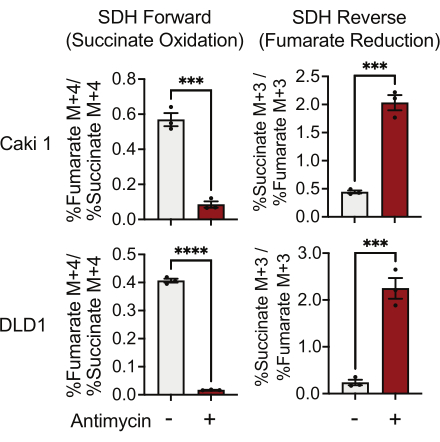
Figure 7 : Traçage de la5-glutamine en C 13C pour mesurer l’activité du complexe II. Oxydation du succinate et réduction du fumarate (SDH inverse) dans les cellules Caki1 et DLD1 traitées à l’antimycine A 500 nM. Les données représentent la moyenne ± SEM; N = 3 par condition. indique p < 0,05 à l’aide d’un test t non apparié dans GraphPad Prism. Abréviations : SDH = oxydation du succinate ; SDH inverse = réduction du fumarate. Veuillez cliquer ici pour voir une version agrandie de cette figure.
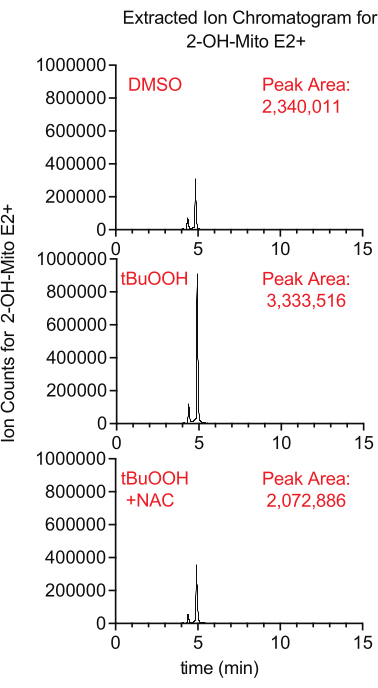
Figure 8 : Essai MitoSox basé sur LCMS pour détecter le superoxyde. Extrait du chromatogramme ionique de 2-OH-Mito E2+ isolé à partir de cellules Caki1 traitées avec MitoSox pendant 30 min en présence de tBuOOH ± de NAC. Abréviations : LCMS = chromatographie liquide-spectrométrie de masse; NAC = N-acétyl cystéine. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Tableau 1 : Composition des réactifs, des tampons et des milieux utilisés dans ce protocole. Veuillez cliquer ici pour télécharger ce tableau.
Discussion
Comme les recherches émergentes démontrent que les mitochondries des mammifères peuvent fonctionner sans consommer d’oxygène moléculaire, il est de la plus haute importance pour les chercheurs d’utiliser des tests orthogonaux, au-delà des mesures OCR, pour quantifier avec précision la fonction mitochondriale. Ici, nous avons compilé une série de tests qui peuvent être utilisés pour évaluer directement les activités des complexes I, II, V et DHODH en mesurant l’équilibre mitochondrial NAD + / NADH, l’utilisation d’accepteurs d’électrons terminaux adaptatifs, la production d’ATP, la biosynthèse de novo de la pyrimidine et les ROS dérivés des mitochondries. Notamment, ces tests mesurent plus directement la fonction mitochondriale que les mesures OCR. En outre, ces tests fournissent aux chercheurs des moyens traitables de quantifier la fonction mitochondriale pendant l’hypoxie, pour laquelle les mesures OCR sont en grande partie hors de propos en raison de l’utilisation du fumarate comme accepteur d’électrons terminal privilégié. Enfin, les méthodes basées sur la prolifération décrites ici sont plus rentables que les expériences classiques de respirométrie, fournissant ainsi un moyen largement accessible d’étudier la fonction mitochondriale dans les systèmes mammifères.
Il y a des considérations clés lors de l’utilisation de ces tests pour mesurer la fonction mitochondriale dans les cellules en culture. En ce qui concerne les essais de prolifération, il est important d’ajuster le nombre de cellules ensemencées pour le taux de doublement de chaque lignée cellulaire. Les cellules doivent être ensemencées à au moins 10% de confluence et avec suffisamment d’espace pour permettre trois à quatre doublages afin que les différences de prolifération puissent être quantifiées. Une autre considération pour chaque essai est la concentration des petites molécules utilisées comme témoins pour les activités de chaque complexe ETC. Comme différentes lignées cellulaires peuvent présenter des sensibilités différentes à ces inhibiteurs, il est essentiel de tester la dose de ces petites molécules pour identifier la concentration optimale.
Une limitation universelle des essais étudiant la fonction mitochondriale in vitro, y compris les mesures OCR et tous les tests décrits ici, est la composition métabolique du milieu de culture. Le milieu de culture cellulaire standard tend à biaiser les systèmes en niveaux superficiellement élevés de fonction mitochondriale. Par exemple, les niveaux supraphysiologiques de glutamine augmentent son anaplérose du cycle25 du TCA, ce qui alimente la synthèse mitochondriale du NADH et, par conséquent, augmente la phosphorylation oxydative. De même, la pression partielle de l’oxygène varie entre 3 mmHg et 100 mmHg (environ 0,1%-13%O2) dans les tissus de mammifères mais est atmosphérique (140 mmHg, environ 21%) in vitro26,27. Cet excèsO2 maximise la capacité respiratoire mitochondriale et la production de superoxyde28. Récemment, des efforts ont été déployés pour concevoir des milieux de culture plus physiologiques29,30. Notamment, la culture de cellules dans des milieux semblables au plasma humain diminue la respiration mitochondriale dans certaines lignées cellulaires cancéreuses30, les ROS mitochondriaux dans les cellules T 31 et les adaptations mitochondriales aux thérapies anticancéreuses32. Ainsi, il est essentiel d’être conscient de la composition des milieux de culture utilisés et de comprendre comment elle peut avoir un impact sur la fonction mitochondriale.
Une autre limitation importante et universelle dans l’interprétation de la fonction mitochondriale est le potentiel de différences dans le nombre de mitochondries. Il est donc essentiel de mesurer le contenu mitochondrial soit par la quantification de l’ADNmt33, soit par la mesure de la masse mitochondriale avec des colorants insensibles au potentiel membranaire34, soit par transfert Western des marqueurs mitochondriaux. Il s’agit d’un contrôle critique afin qu’une diminution du nombre de mitochondries ne soit pas confondue avec une diminution de la fonction mitochondriale.
Il existe également des limitations et des dépannages spécifiques qui s’appliquent aux tests décrits ici. Premièrement, étant donné que les cellules différenciées ne prolifèrent pas, les tests basés sur la prolifération ne seront pas utiles pour évaluer la fonction mitochondriale dans ce contexte. L’une des principales limites du protocole de traçage 13C 4-aspartate pour mesurer l’activité DHODH est que l’absorption d’aspartate dans les cellules peut être extrêmement inefficace35. Pour surmonter cette limitation potentielle, les chercheurs peuvent surexprimer le transporteur d’aspartate, SLC1A3, pour faciliter l’absorption du 13C 4-aspartate35.
Une limitation du protocole utilisant le traçage de la 5-glutamine 13C pour mesurer l’activité SDH est que ce test nécessite que les cellules utilisent la voie de carboxylation réductrice pour enrichir les isotopologues M + 3 afin de mesurer l’activité inverse. Certaines lignées cellulaires sont incapables de flux de carboxylation réductrice en raison d’une faible expression de la citrate lyaseATP 36, d’une stabilisation insuffisante de l’HIF37 ou d’un rapport α-KG:citrate trop faible38. Pour surmonter cette limitation, on pourrait utiliser le traçage 13C 4-aspartate pour mesurer les activités SDH en avant et en arrière7. Dans ce test, l’activité directe de la SDH peut être mesurée par le rapport du fumarate M+2:succinate M+2 et de la réaction inverse par le succinate M+4:fumarate M+4. Notamment, ce traçage contourne la plupart des enzymes dans la voie de carboxylation réductrice.
Une limitation de l’essai d’activité complexe I utilisant la réduction DCPIP comme lecture est que les mitochondries ne sont pas structurellement intactes. Le processus de congélation-décongélation des mitochondries pour permettre leur absorption de NADH pour le test peut certainement ternir l’intégrité structurelle de la membrane mitochondriale39. Ce test doit être effectué parallèlement à des tests tels que le test de prolifération complexe I pour s’assurer que les changements observés dans l’activité du complexe I sont également vrais avec des cellules intactes.
Dans des études futures, certaines de ces techniques pourront être adaptées pour mesurer les fonctions mitochondriales in vivo en utilisant des organismes modèles tels que des souris et Caenorhabditis elegans. Les méthodes actuelles utilisées pour mesurer la fonction mitochondriale in vivo sont centrées sur l’OCR au niveau de l’organisme, en particulier le taux d’échange respiratoire lors de l’utilisation de modèles murins. Une limitation claire de cette méthode est que l’oxygène remplit de nombreuses fonctions biochimiques et de signalisation au-delà de son rôle d’accepteur terminal d’électrons omniprésent dans l’ETC mitochondrial. Par exemple, l’oxygène est « consommé » par l’activité catalytique des enzymes de la famille des dioxygénases. Bien que ces enzymes contribuent au taux de consommation d’oxygène cellulaire, elles ne participent pas, ne régulent pas ou ne reflètent pas la fonction mitochondriale. Les expériences classiques de pneumométrie in vitro contrôlent généralement la « ROC non mitochondriale », tandis que les expériences sur le rapport d’échange respiratoire (RER) de l’organisme ne peuvent pas contrôler cela, ce qui limite l’interprétation du RER en tant que métrique de la fonction mitochondriale in vivo. Cependant, il est possible d’adapter les protocoles pour mesurer l’activité DHODH via le traçage 4-aspartate 13C, l’activité du complexe II via le traçage 13C5-glutamine, l’activité du complexe I sur les mitochondries purifiées à partir de tissus et les ROS mitochondriaux en utilisant des composés favorables à laLC-MS tels que MitoB afin de mesurer la fonction mitochondriale in vivo.. Ces tests directs pour interroger les fonctions mitochondriales, en combinaison avec les expériences classiques de respirométrie, fournissent aux chercheurs une évaluation plus complète et plus précise de la fonction mitochondriale dans les cellules et les tissus de mammifères.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à signaler.
Remerciements
Les figures produites dans ce manuscrit ont été créées avec BioRender.com. Nous sommes reconnaissants à Amy Walker de nous avoir fait part de ses commentaires sur cet article. J.B.S. a été soutenu par la Worcester Foundation for Biomedical Research Grant.
matériels
| Name | Company | Catalog Number | Comments |
| 1.5 mL tube | Cell Treat | 667443 | |
| 2.0 mL tube | Cell Treat | 229446 | |
| 6-well plate | Cell Treat | 229106 | |
| 12-well plate | Cell Treat | 229112 | |
| 13C4-aspartate | Sigma-Aldrich | 604852 | |
| 13C5-Glutamine | Cambridge Isotope Laboratories | 285978-14-5 | |
| 15 mL centrifuge tube | Cell Treat | 667411 | |
| 50 mL centrifuge tube | Cell Treat | 667421 | |
| 150 mm tissue culture dish | Cell Treat | 229651 | |
| 1x Phosphate-buffered saline | Gibco | 10010049 | |
| 2,6-dichlorophenolindophenol | Honeywell | 33125 | |
| Ammonium Carbonate | Sigma-Aldrich | 37999 | |
| Antimycin | Sigma-Aldrich | A8674 | |
| Ascentis Express C18 | Sigma-Aldrich | 53825-U | |
| Bottle top filter 500 mL, 0.22 µm, PES 9 9 mm membrane diameter | Cell Treat | 229717 | |
| Bovine Serum Albumin | Sigma-Aldrich | A3294 | |
| Brequinar | Sigma-Aldrich | SML0113 | |
| Cell Lifter, Double End Flat and Narrow Blade | Cell Treat | 229305 | |
| CentriVap -105 Cold Trap | Labconco | 7385020 | |
| Complete Protease Inhibitor Tablets | Sigma-Aldrich | 4693116001 | |
| Coulter Counter Cups | Fisher Scientific | 07-000-694 | |
| Decylubiquinone | Sigma-Aldrich | D7911 | |
| DMSO | Invitrogen | D12345 | |
| Dulbecco’s Modified Eagle Medium (DMEM) | Gibco | 11995-065 | |
| EDTA | Sigma-Aldrich | E6758 | |
| EGTA | Sigma-Aldrich | E3889 | |
| Eppendorf Centrifuge 5425R | Eppendorf | 2231000908 | |
| Eppendorf Centrifuge 5910 Ri | Eppendorf | 5943000343 | |
| Galactose | Sigma-Aldrich | G5388 | |
| Glucose | Sigma-Aldrich | G7021 | |
| Glucose-free DMEM | Gibco | 11966025 | |
| Glutamine-free DMEM | Thermo Fisher | 11960044 | |
| Heat-Inactivated Fetal Bovine Serum | Sigma-Aldrich | F4135 | |
| Hepes | Sigma-Aldrich | H3375 | |
| HPLC-grade 35% Ammonium hydroxide | Thermo Scientific | 460801000 | |
| HPLC-grade Acetonitrile | Sigma-Aldrich | 900667 | |
| HPLC-grade Chloroform | Sigma-Aldrich | 366927 | |
| HPLC-grade formic acid | Thermo Scientific | 28905 | |
| HPLC-grade Isopropanol | Sigma-Aldrich | 563935 | |
| HPLC-grade MeOH | Sigma-Aldrich | 900688 | |
| HPLC-grade Water | Sigma-Aldrich | 270733 | |
| Human Osteosarcome Cell Line 143B | ATCC | CRL-8303 | |
| Hydrochloric Acid | Sigma-Aldrich | 320331-500ML | |
| Isotone buffer | Beckman Coulter | 8546719 | |
| K2HPO4 | Sigma-Aldrich | P2222 | |
| Mannitol | Sigma-Aldrich | M4125 | |
| MitoSox Red | Invitrogen | M36008 | |
| N-acetyl-L-cysteine | Sigma-Aldrich | A9165 | |
| Oligomycin | Sigma-Aldrich | 75351-5MG | |
| Pencillin Streptomycin | Gibco | 15140-122 | |
| Potter-Elvehjem Tissue Grinder, Size 21 | Kimble | 885502-0021 | |
| Pyruvate | Sigma-Aldrich | P5280 | |
| Pyruvate-free DMEM media | Gibco | 11965175 | |
| Q Exactive Plus Mass Spectrometer | Thermo Scientific | 726030 | |
| ReCO2ver Incubator | Baker | ||
| Refrigerated Centrivap Benchtop Vacuum Concentrator | Labconco | 7310020 | |
| RIPA Buffer | Millipore Sigma | 20188 | |
| Rotenone | Sigma-Aldrich | R8875 | |
| SeQuant ZIC-pHILIC 5μm 150 x 2.1 mm analytical column | Sigma-Aldrich | 1.50460.0001 | |
| SeQuant ZIC-pHILIC guard kit | Millipore Sigma | 1.50438.0001 | |
| Sodium Hydroxide, Pellets | Millipore Sigma | 567530-250GM | |
| Sucrose | Sigma-Aldrich | S0389 | |
| SW, TRACEFINDER 5.1 SP3 | Thermo Scientific | OPTON-31001 | |
| Tert-butyl hydroperoxide solution | Sigma-Aldrich | 458139 | |
| Tris | Sigma-Aldrich | 93352 | |
| Trypsin-EDTA (0.25%), phenol red | Gibco | 25-200-114 | |
| Uridine | Sigma-Aldrich | U3003 | |
| VANQUISH HORIZON / FLEX HPLC | Thermo Scientific | VF-S01-A-02 | |
| Z2 Coulter Particle count and size analyzer | Beckman Coulter | BZ10131270 |
Références
- Spinelli, J. B., Haigis, M. C. The multifaceted contributions of mitochondria to cellular metabolism. Nature Cell Biology. 20 (7), 745-754 (2018).
- Gorman, G. S., et al. Mitochondrial diseases. Nature Reviews Disease Primers. 2, 16080 (2016).
- Chandel, N. S., et al. Reactive oxygen species generated at mitochondrial complex III stabilize hypoxia-inducible factor-1alpha during hypoxia: A mechanism of O2 sensing. Journal of Biological Chemistry. 275 (33), 25130-25138 (2000).
- Cadenas, E., Boveris, A., Ragan, C. I., Stoppani, A. O. M. Production of superoxide radicals and hydrogen peroxide by NADH-ubiquinone reductase and ubiquinol-cytochrome C reductase from beef-heart mitochondria. Archives of Biochemistry and Biophysics. 180 (2), 248-257 (1977).
- Murphy, M. P. How mitochondria produce reactive oxygen species. Biochemical Journal. 417 (1), 1-13 (2009).
- Schieber, M., Chandel, N. S. ROS function in redox signaling and oxidative stress. Current Biology. 24 (10), 453-462 (2014).
- Spinelli, J. B., et al. Fumarate is a terminal electron acceptor in the mammalian electron transport chain. Science. 374 (6572), 1227-1237 (2021).
- Kumar, R., et al. A redox cycle with complex II prioritizes sulfide quinone oxidoreductase-dependent H(2)S oxidation. Journal of Biological Chemistry. 298 (1), 101435 (2022).
- Warburg, O., Geissler, A. W., Lorenz, S. On growth of cancer cells in media in which glucose is replaced by galactose. Hoppe-Seyler's Zeitschrift für Physiologische Chemie. 348 (12), 1686-1687 (1967).
- Marroquin, L. D., Hynes, J., Dykens, J. A., Jamieson, J. D., Will, Y. Circumventing the Crabtree effect: replacing media glucose with galactose increases susceptibility of HepG2 cells to mitochondrial toxicants. Toxicological Sciences. 97 (2), 539-547 (2007).
- Attardi, G., King, M. P. Human cells lacking mtDNA: Repopulation with exogenous mitochondria by complementation. Science. 246 (4929), 500-503 (1989).
- Bodnar, A. G., Cooper, M., Leonard, J. V., Schapira, A. H. Respiratory-deficient human fibroblasts exhibiting defective mitochondrial DNA replication. Biochemical Journal. 305, 817-822 (1995).
- Gregoire, M., Morais, R., Quilliam, M. A., Gravel, D. On auxotrophy for pyrimidines of respiration-deficient chick embryo cells. European Journal of Biochemistry. 142 (1), 49-55 (1984).
- Mackay, G. M., Zheng, L., vanden Broek, N. J., Gottlieb, E. Analysis of cell metabolism using LC-MS and isotope tracers. Methods in Enzymology. 561, 171-196 (2015).
- Heinrich, P., et al. Correcting for natural isotope abundance and tracer impurity in MS-, MS/MS- and high-resolution-multiple-tracer-data from stable isotope labeling experiments with IsoCorrectoR. Scientific Reports. 8 (1), 17910 (2018).
- Lee, P., Chandel, N. S., Simon, M. C. Cellular adaptation to hypoxia through hypoxia inducible factors and beyond. Nature Reviews Molecular Cell Biology. 21 (5), 268-283 (2020).
- Bisbach, C. M., et al. Succinate can shuttle reducing power from the hypoxic retina to the O(2)-rich pigment epithelium. Cell Reports. 31 (2), 107606 (2020).
- Angebault, C., et al. Idebenone increases mitochondrial complex I activity in fibroblasts from LHON patients while producing contradictory effects on respiration. BMC Research Notes. 4, 557 (2011).
- Liao, P. C., Bergamini, C., Fato, R., Pon, L. A., Pallotti, F. Isolation of mitochondria from cells and tissues. Methods in Cell Biology. 155, 3-31 (2020).
- Iwai, T., et al. Sodium accumulation during ischemia induces mitochondrial damage in perfused rat hearts. Cardiovascular Research. 55 (1), 141-149 (2002).
- Murphy, E., Eisner, D. A. Regulation of intracellular and mitochondrial sodium in health and disease. Circulation Research. 104 (3), 292-303 (2009).
- Lampl, T., Crum, J. A., Davis, T. A., Milligan, C., Del Gaizo Moore, V. Isolation and functional analysis of mitochondria from cultured cells and mouse tissue. Journal of Visualized Experiments. (97), e52076 (2015).
- Murphy, M. P., et al. Guidelines for measuring reactive oxygen species and oxidative damage in cells and in vivo. Nature Metabolism. 4 (6), 651-662 (2022).
- Xiao, Y., Meierhofer, D. Are hydroethidine-based probes reliable for reactive oxygen species detection. Antioxidants and Redox Signaling. 31 (4), 359-367 (2019).
- DeBerardinis, R. J., et al. Beyond aerobic glycolysis: Transformed cells can engage in glutamine metabolism that exceeds the requirement for protein and nucleotide synthesis. Proceedings of the National Academy of Sciences of the United States of America. 104 (49), 19345-19350 (2007).
- Keeley, T. P., Mann, G. E. Defining physiological normoxia for improved translation of cell physiology to animal models and humans. Physiological Reviews. 99 (1), 161-234 (2019).
- Ast, T., Mootha, V. K. Oxygen and mammalian cell culture: Are we repeating the experiment of Dr. Ox. Nature Metabolism. 1 (9), 858-860 (2019).
- Gu, C., Jun, J. C. Does hypoxia decrease the metabolic rate. Frontiers in Endocrinology. 9, 668 (2018).
- Voorde, J., et al. Improving the metabolic fidelity of cancer models with a physiological cell culture medium. Scientific Advances. 5 (1), 7314 (2019).
- Cantor, J. R., et al. Physiologic medium rewires cellular metabolism and reveals uric acid as an endogenous inhibitor of UMP synthase. Cell. 169 (2), 258-272 (2017).
- MacPherson, S., et al. Clinically relevant T cell expansion media activate distinct metabolic programs uncoupled from cellular function. Molecular Therapy. Methods and Clinical Development. 24, 380-393 (2022).
- Torres-Quesada, O., Doerrier, C., Strich, S., Gnaiger, E., Stefan, E. Physiological cell culture media tune mitochondrial bioenergetics and drug sensitivity in cancer cell models. Cancers. 14 (16), 3917 (2022).
- Chan, S. W., Chen, J. Z. Measuring mtDNA damage using a supercoiling-sensitive qPCR approach. Methods in Molecular Biology. 554, 183-197 (2009).
- Doherty, E., Perl, A. Measurement of mitochondrial mass by flow cytometry during oxidative stress. Reactive Oxygen Species. 4 (10), 275-283 (2017).
- Birsoy, K., et al. An essential role of the mitochondrial electron transport chain in cell proliferation is to enable aspartate synthesis. Cell. 162 (3), 540-551 (2015).
- Beigneux, A. P., et al. ATP-citrate lyase deficiency in the mouse. Journal of Biological Chemistry. 279 (10), 9557-9564 (2004).
- Gameiro, P. A., et al. In vivo HIF-mediated reductive carboxylation is regulated by citrate levels and sensitizes VHL-deficient cells to glutamine deprivation. Cell Metabolism. 17 (3), 372-385 (2013).
- Fendt, S. M., et al. Reductive glutamine metabolism is a function of the alpha-ketoglutarate to citrate ratio in cells. Nature Communications. 4, 2236 (2013).
- Lee, C. P. Biochemical studies of isolated mitochondria from normal and diseased tissues. Biochimica et Biophysica Acta. 1271 (1), 21-28 (1995).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon