Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Gastrectomie totale robotisée épargnant le vague pour le traitement de la mutation du gène CDH1
Dans cet article
Résumé
Cet article se concentre sur la gastrectomie totale robotisée épargnant le vague. Les techniques et les pièges de la préservation vague, de l’œsophagojéjunostomie suturée, de la formation de la poche jéjunale et de la reconstruction Roux-en-Y avec une jéjunojéjunostomie agrafée sont discutés.
Résumé
Le cancer gastrique diffus héréditaire (HDGC) causé par la mutation du gène CDH1 est un syndrome cancéreux héréditaire qui augmente le risque de cancer gastrique diffus et est presque impossible à détecter par gastroscopie de dépistage. Le traitement préventif recommandé est une gastrectomie totale. La chirurgie robotique facilite l’utilisation de techniques chirurgicales mini-invasives (MIS) pour les anastomoses et la préservation du vague postérieur afin de réduire potentiellement les résultats fonctionnels indésirables. Un homme asymptomatique de 24 ans présentant la mutation du gène CDH1 prouvée par des tests génétiques et des antécédents familiaux d’un frère ayant subi une gastrectomie totale pour HDGC a été traité avec cette technique. Ce rapport de cas vidéo démontre les techniques et les pièges de la chirurgie robotique en termes de positionnement du patient et de placement du port, de dissection postérieure préservant le vague, d’œsophagojéjunostomie suturée, de formation de la poche jéjunale et de reconstruction Roux-en-Y avec une jéjunojéjunostomie agrafée. Bien que ces techniques soient démontrées dans le cas de la gastrectomie prophylactique, beaucoup d’entre elles peuvent être appliquées à d’autres types de chirurgie bénigne et bariatrique de l’intestin antérieur et générale. La chirurgie robotique peut faciliter la technique du MIS de l’intestin antérieur, comme décrit dans ce cas d’une gastrectomie totale épargnant le vague.
Introduction
Le cancer gastrique diffus héréditaire (HDGC) est caractérisé par une mutation génétique dans le gène suppresseur de tumeur E-cadhérine (CDH1), qui a un mode de transmissionautosomique dominant 1. Ce syndrome cancéreux héréditaire augmente le risque de cancer gastrique diffus et de cancer du sein lobulaire. Les directives actuelles recommandent de tester les mutations CDH1 chez les patients présentant des grappes familiales de HDGC et de LBC, en particulier chez ceux dont l’apparition est précoce (avant l’âge de 40 ans)2. Selon la plus grande série rapportée de porteurs de la mutation CDH1, l’incidence cumulée au cours de la vie du cancer gastrique est de 70 % (IC à 95 %, 59 % à 80 %) chez les hommes et de 56 % (IC à 95 %, 44 % à 69 %) chez les femmes porteuses de cette mutation3. Cependant, des études récentes ont estimé que la pénétrance du cancer gastrique avec cette mutation était de l’ordre de 37 % à 42 % pour les hommes et de 25 % à 33 % pour les femmes1.
La surveillance endoscopique avec biopsie est le type de surveillance recommandé pour ceux qui choisissent de retarder la gastrectomie prophylactique ; Cependant, il est presque impossible de détecter un cancer gastrique précoce dans cette cohorte à l’aide de la gastroscopiede dépistage 2. Un examen endoscopique approfondi en lumière blanche est suivi d’un minimum de 30 biopsies gastriques non ciblées dans cinq zones distinctes de l’estomac. Cependant, cette méthode de surveillance a un taux élevé de faux négatifs et ne détecte que 20 % à 63 % des foyers de cellules occultes 4,5.
La gastrectomie totale prophylactique (PTG) est le traitement préventif recommandé pour tout porteur pathogène ou probablement pathogène du variant CDH1 à partir de l’âge de 20 ans, mais elle n’est pas recommandée au-delà de 70ans 1,2. La métastase ganglionnaire périgastrique est une découverte rare chez les patients asymptomatiques, qui ont généralement des cellules T1a ou des cellules en anneau de chevalière in situ. La morbidité périopératoire est généralement faible et la satisfaction des patients est élevée6. Bien que la qualité de vie globale après la chirurgie soit élevée, une vagotomie tronculaire est généralement réalisée dans une gastrectomie totale 7,8. La résection du nerf vague au-dessus du niveau des branches cœliaque et hépatique entraîne une dénervation parasympathique de l’arbre hépatobiliaire et de l’intestin grêle et de l’intestin grêle. La diarrhée post-vagotomie et le syndrome de chasse sont des complications à long terme bien connues après le PTG8.
La chirurgie robotique offre au chirurgien une vue en 3 dimensions, agrandie 10x, du champ opératoire et offre un haut degré de liberté avec des instruments chirurgicaux articulés9. L’objectif de la mise en œuvre de cette technique est de réduire potentiellement les résultats fonctionnels indésirables grâce à la préservation du vague postérieur, qui est facilitée par les techniques chirurgicales mini-invasives (MIS).
Protocole
Le patient a donné son consentement éclairé à la publication d’informations anonymisées, d’images et de documentation vidéo. Le Dr Michael Talbot, professeur agrégé (co-auteur), est un chirurgien gastro-intestinal supérieur accrédité pour pratiquer la gastrectomie dans son établissement. En raison du risque négligeable de ce rapport de cas et de ce protocole, il a été exempté d’un examen éthique conformément aux lignes directrices du comité d’examen institutionnel local. L’application de l’éthique pour les rapports de cas est exemptée conformément aux directives du comité d’examen institutionnel local.
1. Positionnement du patient
- Placez le patient en position de Trendelenburg inversée après l’anesthésie générale.
- Fixez le patient en position à l’aide d’un repose-pieds, d’une sangle corporelle placée au-dessus des genoux et de sangles de cheville. Enlever (<90°) les bras, et les bander en crêpe sur les planches de bras. Placez un support d’écarteur de foie Nathanson sur la table d’opération, crânien à la planche du bras gauche.
2. Emplacement du port (Figure 1)
- Faites une incision cutanée de 12 mm selon l’approche préférée du chirurgien dans la position médio-claviculaire droite au niveau ou en dessous du niveau de l’ombilic. Effectuez une entrée optique à l’aide d’un laparoscope de 8 mm, 0° et d’un port de 12 mm à travers cette incision. Notez que le port de l’appareil photo doit être à 10-20 cm de l’anatomie cible.
- Remplacez le port par un port robotique (agrafage) de 12 mm avec un réducteur de 12-8 mm, et remplacez le laparoscope par un laparoscope de 8 mm à 30°. Établir un pneumopéritoine de 15 mmHg de CO2 avec un débit de 45 mmHg.
- Faites trois incisions cutanées supplémentaires de 8 mm dans le plan transombilical et placez trois ports robotiques de 8 mm. Placez l’un des ports robotiques au niveau de l’ombilic et les deux autres ports robotiques latéraux sur le côté gauche. Assurez-vous qu’il y a une distance de >8 cm entre les ports et une distance de 10 à 20 cm entre les ports et l’anatomie cible.
- Placez un autre port d’assistant de 12 mm (port A) dans le quadrant supérieur droit. Insérez un écarteur Nathanson dans l’épigastre par une incision de 5 mm et rétractez le lobe gauche du foie.
- Placez le chariot patient robotisé sur le patient depuis le côté droit du patient, en prenant soin d’éviter toute collision avec l’écarteur hépatique. Ancrez d’abord le bras de la caméra à l’aide du placement du port guidé par laser. Effectuez un incisura ciblant l’estomac avec une lunette robotique de 8 mm, 30° à l’aide du port 3.
- Amarrez et faites roter les ports robotiques restants aux bras de l’instrument, puis insérez un instrument bipolaire de 8 mm (orifice 1), une extension de scelleuse de récipient (orifice 2) et une pince fenêtrée basculée (pot 4). Réglez la coupure automatique monopolaire et bipolaire et la coagulation forcée sur l’effet 3, et vérifiez la configuration du système.
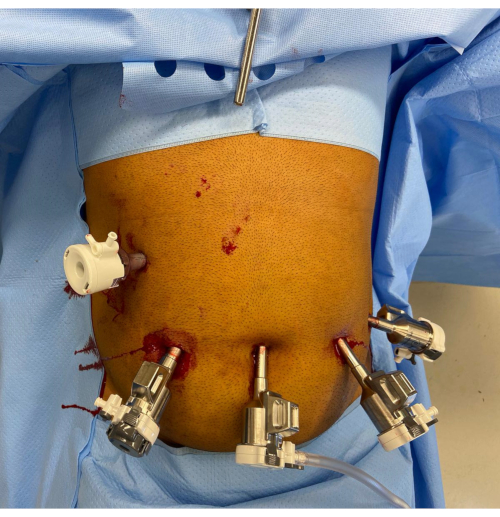
Figure 1 : Placement du port robotisé. La poignée de l’écarteur Nathanson est visible dans l’épigastre. Il y a un port d’assistant de 12 mm dans le quadrant supérieur droit. Les ports restants de gauche à droite de l’image sont le port robotique de 12 mm avec réducteur, le port de caméra de 8 mm et deux ports robotiques supplémentaires de 8 mm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
3. Dissection préservant le vague
- Mobilisez la grande courbe de l’estomac à travers le ligament gastrocolique de l’antre au cardia et divisez-le en cinq à sept vaisseaux gastriques courts latéraux à l’arcade scelleuse de vaisseaux, étendez-vous pour inclure les nœuds N1. Ensuite, mobilisez le côté gauche du hiatus œsophagien.
- Entrez dans le ligament phréno-œsophagien et mobilisez le côté gauche de l’œsophage distal. Effectuez une dissection distale avec le scellant de vaisseau et continuez jusqu’à la mobilisation de la première partie du duodénum. Suivez la fenêtre sus-duodénale à travers la pars flaccida pour terminer la mobilisation œsophagienne du côté droit, avec le plan de dissection attenant à l’œsophage.
- Transectez la première partie du duodénum avec l’agrafeuse robotisée à l’aide d’une recharge verte de 60 mm x 4,3 mm avec un renfort de contrefort. Divisez les vaisseaux gastriques gauches près de la paroi de l’estomac à l’aide du scelleur de vaisseaux. Il s’agit de s’assurer que le vague postérieur est laissé non divisé dans le mésentère autour du pédicule gastrique gauche.
- Rétractez l’œsophage et l’estomac dans le sens supérolatéral et identifiez le nerf vague postérieur. Balayez le nerf vers l’arrière et préservez-le.
4. Suture de l’œsophagojéjunostomie avec une poche jéjunale
- Reconstruction du ligament phréno-œsophagien
- Effectuez la reconstruction du ligament phréno-œsophagien dans le sens inverse des aiguilles d’une montre, de 5 heures à 9 heures, à l’aide d’une suture barbelée non résorbable 2-0 sur une aiguille à pointe conique de 26 mm de 1/2 cercle. Transectez l’œsophage intraabdominal à l’aide de l’agrafeuse robotisée à l’aide d’une recharge verte de 60 mm x 4,3 mm. Déplacez le ventre détaché vers le quadrant supérieur droit.
- Anastomose œsophago-jéjunale
- Soulevez le grand épiploon crânien pour identifier la flexion duodéno-jéjunale et amenez une anse jéjunale de 50 cm (créant un membre biliopancréatique de 40 à 60 cm après la formation de la poche jéjunale) à l’œsophage.
- Suture : une suture barbelée résorbable 3-0 de 23 cm de long sur une aiguille à pointe conique de 1/2 cercle de 26 mm en tant que pexie œsophagojéjunale latérale à 3 heures. Rétractez la suture non coupée latéralement. Créez une œsophagostomie antérieure à la ligne d’agrafe à l’aide d’un crochet de diathermie monopolaire avec un guide de sonde nasogastrique 18Fr. Créez une jéjunostomie d’une taille égale ou légèrement plus petite comme pour l’œsophagostomie.
- Suturez la paroi postérieure de l’œsophagojéjunostomie avec la suture barbelée de manière continue, dans le sens des aiguilles d’une montre, de 3 heures à 9 heures, en incorporant la ligne d’agrafe. Suturez la partie antérieure à l’aide d’une autre de la même suture pour compléter la suture monocouche de pleine épaisseur pour l’anastomose œsophagojéjunale. Placez quelques sutures médiales au-delà de l’anastomose comme une pexie médiale.
- Poche jéjunale
- Transectez l’anse jéjunale proximale à 10 cm de l’anastomose à l’aide d’une agrafeuse robotisée à l’aide d’une recharge blanche de 60 mm x 2,5 mm. Créez des entérostomies anti-timerontiennes de 10 cm proximales et distales à l’anastomose œsophago-jéjunale.
- Effectuez deux tirs de l’agrafeuse robotisée à l’aide de recharges blanches de 60 mm x 2,5 mm pour créer la poche jéjunale. Assurez-vous que la deuxième décharge ne va pas jusqu’au bout de l’anastomose œsophago-jéjunale afin de préserver l’apport sanguin aux anastomoses. Fermez l’entérotomie jéjunale de manière continue avec une suture barbelée résorbable 3-0.
5. Jéjunojéjunostomie agrafée
- Mesurez un membre alimentaire de 70 cm et placez une suture interrompue en soie 2-0 à cet endroit et le membre biliopancréatique distal pour le marquage et la rétraction.
- Former la jéjunojéjunostomie à l’aide d’une technique d’agrafage uniquement, comme décrit dans la technique de triple agrafage pour le pontage gastrique laparoscopique10,11. Utilisez une recharge blanche de 60 mm x 2,5 mm pour former l’anastomose et fermer l’entérotomie.
- Fermez les défauts mésentériques jéjunaux et rétro-Roux à l’aide de sutures barbelées non résorbables 2-0 pour réduire le risque de complications dues à une hernie interne.
6. Extraction et fermeture de l’échantillon
- Retirez les instruments, l’écarteur Nathanson et les ports sous vision robotique. Détachez le chariot patient robotisé du patient.
- Créez une mini-laparotomie de 5 cm par le prolongement du port ombilical. Injectez l’échantillon à travers un petit écarteur de protection de plaie à joint torique. Fermez la laparotomie de la manière habituelle à l’aide de sutures épargnant les muscles avec une fermeture fasciale continue et avec un rapport suture/longueur de la plaie de 1:4.
Résultats
La durée totale de l’opération a été de 2 h 50 min, et le patient a eu une évolution postopératoire banale. Le patient a été soumis à un régime alimentaire gratuit le jour 1 après l’opération et est sorti de l’hôpital le jour 4. Lors du suivi de 1 mois et de 3 mois, le patient se portait bien et n’a signalé aucun symptôme de diarrhée ou de chasse.
L’échantillon a été envoyé pour un examen pathologique et a mis en évidence cinq zo...
Discussion
Un homme asymptomatique de 24 ans présentant la mutation du gène CDH1 prouvée par des tests génétiques et des antécédents familiaux d’un frère ayant subi une gastrectomie totale pour HDGC a été sélectionné. L’endoscopie préopératoire n’a rien révélé de particulier. Le cas sert de plate-forme pour discuter des techniques et des pièges de ses aspects clés. Cela comprend le positionnement du patient et la mise en place du port, la dissection postérieure préservant...
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Les auteurs remercient la Fondation de recherche sur le métabolisme et le gastro-intestin supérieurs d’avoir financé les frais de publication de la revue. Les auteurs remercient également le patient dans ce cas pour son consentement à la publication de ses informations et images anonymisées.
matériels
| Name | Company | Catalog Number | Comments |
| Laparoscopic instruments | |||
| 5 mm optical entry port | Applied Medical | CFF03 | Kii Fios First entry access system. |
| Laparoscopic 5mm 0° camera | Olympus | ENDOEYE HD II | 5 mm, 0° |
| Laparoscopic needle holder | KARL STORZ | Laparoscopic needle holder | |
| Nasogastric tube | Cardinal Health | 8888264960E | 16Fr |
| Nathanson liver retractor | COOK Medical | NLRS-1001/ NLRS-1002 | Large/ Extra-large |
| Robotic instruments | |||
| 12 mm port | Intuitive Surgical | 470375 | |
| 8 mm port | Intuitive Surgical | 470380 | |
| 8 mm reducer | Intuitive Surgical | 470381 | |
| Da Vinci Xi/X Endoscope with Camera, 8 mm, 0° | Intuitive Surgical | 470026 | |
| Da Vinci Xi/X Endoscope with Camera, 8 mm, 30° | Intuitive Surgical | 470027 | |
| Force Bipolar 8 mm | Intuitive Surgical | 470405 | |
| Mega SutureCut Needle Driver | Intuitive Surgical | 470309 | |
| Monopolar hook diathermy | Intuitive Surgical | 470183 | |
| SureForm 60mm stapler | Intuitive Surgical | 480460 | |
| Tip-up fenetrated grasper 8 mm | Intuitive Surgical | 470347 | |
| Vessel Sealer Extend 8 mm | Intuitive Surgical | 480422 | |
| Stapler reloads | |||
| Seamguard buttress 60 mm | GORE | 1BSGXI60GB/12BSGXI60GB | |
| SureForm 60 mm green reload | Intuitive Surgical | 48360G | |
| SureForm 60 mm white reload | Intuitive Surgical | 48360W | |
| Sutures | |||
| 2-0 nonabsorbable barbed suture | Medtronic | VLOCN0644 | 23 cm V-Loc on a 26 mm ½ circle taper point needle |
| 3-0 absorbable barbed suture | Medtronic/ Ethicon (J&J) | VLOCM0644 | 23 cm V-Loc on a 26 mm ½ circle taper point needle (preferred), STRATAFIX (alternate). Catalogue number |
| 2-0 monocryl suture | Ethicon (J&J) | JJW3463 | Cut to 15 cm, taper point needle |
| 2-0 silk suture | Ethicon (J&J) | JJ423H | Cut to 15 cm, taper point needle |
| 1 PDS suture | Ethicon (J&J) | JJ75414 | Fascial closure |
| 3-0 monocryl suture | Ethicon (J&J) | JJY227H | Skin closure |
| Topical Skin Adhesive | Ethicon (J&J) | JJ79025 | Skin closure/ wound dressing |
| Specimen extraction | |||
| Alexis O-ring wound retractor | Applied Medical | C8402 | Medium. For specimen extraction |
| Handheld diathermy | Covidien/ Valleylab | VLE2515 | For specimen extraction |
Références
- Gamble, L. A., Heller, T., Davis, J. L. Hereditary diffuse gastric cancer syndrome and the role of CDH1: A review. JAMA Surgery. 156 (4), 387-392 (2021).
- Shenoy, S. CDH1 (E-cadherin) mutation and gastric cancer: Genetics, molecular mechanisms and guidelines for management. Cancer Management and Research. 11, 10477-10486 (2019).
- Hansford, S., et al. Hereditary diffuse gastric cancer syndrome: CDH1 mutations and beyond. JAMA Oncology. 1 (1), 23-32 (2015).
- Friedman, M., et al. Surveillance endoscopy in the management of hereditary diffuse gastric cancer syndrome. Clincal Gastroenterology and Hepatology. 19 (1), 189-191 (2021).
- van der Post, R. S., et al. Hereditary diffuse gastric cancer: updated clinical guidelines with an emphasis on germline CDH1 mutation carriers. Journal of Medical Genetics. 52 (6), 361-374 (2015).
- Kaurah, P., et al. Hereditary diffuse gastric cancer: Cancer risk and the personal cost of preventive surgery. Familal Cancer. 18 (4), 429-438 (2019).
- Hejazi, R. A., Patil, H., McCallum, R. W. Dumping syndrome: Establishing criteria for diagnosis and identifying new etiolo gies. Digestive Diseases and Sciences. 55 (1), 117-123 (2010).
- Johnston, D. Operative mortality and postoperative morbidity of highly selective vagotomy. British Medical Journal. 4 (5996), 545-547 (1975).
- Nakauchi, M., et al. Robotic surgery for the upper gastrointestinal tract: Current status and future perspectives. Asian Journal of Endoscopic Surgery. 10 (4), 354-363 (2017).
- Frantzides, C. T., et al. Laparoscopic Roux-en-Y gastric bypass utilizing the triple stapling technique. Journal of the Society of Laparoendoscopic Surgeons. 10 (2), 176-179 (2006).
- Madan, A. K., Frantzides, C. T. Triple-stapling technique for jejunojejunostomy in laparoscopic gastric bypass. Archives of Surgery. 138 (9), 1029-1032 (2003).
- Forrester, J. D., et al. Surgery for hereditary diffuse gastric cancer: Long-term outcomes. Cancers. 14 (3), 728 (2022).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon