Détection simultanée de différentes classes d’anticorps dans un test sérologique multiplexé
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Un système d’analyse de flux de fluorescence à double rapporteur à trois canaux a été utilisé pour développer un test immunologique multiplex à base de billes qui évalue simultanément les échantillons de sérum pour les IgG et les IgM provoquées par plusieurs antigènes de différentes espèces de Borrelia qui causent la borréliose de Lyme en Europe et en Amérique du Nord.
Résumé
Pour suivre la progression des maladies infectieuses, il est utile d’évaluer l’immunoréactivité vis-à-vis de divers déterminants antigéniques et de mesurer différents isotypes d’anticorps car ils apparaissent à différents stades de la réponse immunitaire de l’hôte. Dans le cas de la borréliose de Lyme, l’agent pathogène peut être l’un des multiples membres de l’espèce Borrelia . Par conséquent, une classification correcte des échantillons nécessite d’évaluer l’immunoréactivité contre différents antigènes de différentes espèces de Borrelia . De plus, les réponses IgG et IgM antipathogènes peuvent avoir des durées d’élicitation différentes au cours de la progression de la maladie. Nous démontrons ici le développement d’un test immunologique multiplex à deux rapporteurs qui a une utilité pour identifier la réponse immunitaire spécifique de Borrelia dans des échantillons de sérum humain en évaluant simultanément l’immunoréactivité des IgG et des IgM contre différents antigènes bactériens dans le même puits de réaction. Cette approche à double rapporteur conserve les performances analytiques des méthodes à rapporteur unique tout en économisant du temps et des ressources et en réduisant les exigences en matière de taille d’échantillon. Ce test permet essentiellement de doubler l’information sérologique à partir d’un échantillon de sang en deux fois moins de temps.
Introduction
La borréliose de Lyme est la maladie infectieuse transmise par les tiques la plus courante dans les climats tempérés de l’hémisphère nord1. Elle est causée par des bactéries spirochètes du genre Borrelia, avec cinq agents pathogènes humains connusdont la répartition géographique varie 2. Les principales espèces pathogènes de Borrelia en Europe sont B. afzelii et B. garinii, B. burgdorferi s.s., B. spielmanii et B. bavariensis étant moins fréquemment impliqués. En Amérique du Nord, B. burgdorferi s.s. est le seul agent causal de la borréliose de Lyme 2,3. Les agents pathogènes de Borrelia sont transmis par les membres du genre de tiques Ixodes, la transmission pouvant se produire dans les 24 heures suivant la piqûre de tique4.
Le diagnostic de borréliose de Lyme est généralement posé par les symptômes cliniques, puis confirmé par la sérologie. En Europe et en Amérique du Nord, les lignes directrices diagnostiques recommandent une série de tests en deux étapes consistant en un test immuno-enzymatique (ELISA) avec un immunotransfert réflexe pour évaluer la réponse des anticorps contre les antigènes spécifiques de Borrelia 1,5,6,7,8,9 . Cependant, cette approche manque de sensibilité et n’est pas optimale, en particulier dans la phase précoce de l’infection lorsque la séroconversion peut être incomplète et que les titres d’IgG et d’IgM anti-Borrelia sont tropfaibles6.
Les immunoessais multiplex améliorent les immunoessais traditionnels qui ne mesurent qu’une seule cible à la fois et peuvent évaluer simultanément plusieurs réponses isotypes d’anticorps contre un ou plusieurs antigènes 10,11,12. Les tests tels que les tests ELISA se limitent à l’identification et à la quantification d’un seul analyte par réaction, dans le cas présent, soit des IgG circulantes, soit des IgM induites contre un seul antigène bactérien après une infection par Borrelia. Ce rapport illustre l’utilisation de la technologie de profilage d’analyte à base de billes pour le développement d’un test immunologique multiplex qui détecte simultanément les anticorps IgG et IgM contre l’un des antigènes Borrelia choisis ici dans des échantillons de sérum humain. Nous avons sélectionné quatre antigènes qui, ensemble, couvrent l’espèce pathogène Borrelia la plus commune originaire d’Europe (B. garinii, B. afzelii, B. burgdorferi s.s.) et l’Amérique du Nord (B. burgdorferi s.s.) (Tableau 1) 2,3. Cela permet une identification décisive des agents pathogènes et la capacité de discerner l’immunoréactivité précoce des IgM et des IgG plus tardives et plus durables dans les échantillons de patients.
| Isotype cible | Chaîne Reporter | Antigène | Espèces de Borrelia | Filtrer | Concentration de couplage antigénique |
| Igm | PE | OspC | B. garinii | 20047 | 5,0 μg/106 perles |
| IgG | BV421 | VlsE | B. burgdorferi s.s | Réf. B31 | 1,25 μg/106 perles |
| IgG | BV421 | DbpA | B. burgdorferi s.s. | ZS7 | 10,0 μg/106 billes |
| IgG | BV421 | DbpA | B. afzelii | PKo | 5,0 μg/106 perles |
Tableau 1 : Antigènes représentatifs de Borrelia utilisés pour le développement de tests multiplex.
Nous avons d’abord développé un test immunologique à rapporteur unique qui détectait soit les anticorps IgG ou IgM anti-antigène Borrelia , soit les anticorps IgM dans deux réactions distinctes, puis nous avons fusionné ces tests dans un test multiplex à double rapporteur qui mesure les deux isotypes d’anticorps dans le même mélange réactionnel. Les billes magnétiques sont couplées à un antigène cible pathogène d’intérêt, puis incubées avec des échantillons de sérum de patients. L’antigène couplé aux billes est reconnu par les IgG et les IgM circulantes dans le sérum qui est généré dans une réponse immunitaire contre cet antigène pathogène. La spécificité des IgG par rapport aux IgM est déterminée par la sélection d’un anticorps secondaire qui se lie aux IgG ou aux IgM, chacun avec un signal fluorophore distinct associé aux deux anticorps secondaires. Chaque signal fluorescent est détecté dans l’un des deux canaux rapporteurs de l’instrument (c’est-à-dire à double rapporteur) qui a un laser d’excitation et une capture d’émission différents spécifiques pour le fluorophore unique utilisé pour détecter les IgG ou les IgM (ici Brilliant Violet 421 ou phycoerythrine, respectivement). Le canal de classification de l’instrument identifie le colorant à code couleur qui est inhérent aux différents jeux de billes. Ainsi, plusieurs antigènes cibles peuvent être couplés à des billes colorées différemment, et les ensembles de billes mélangés ensemble et utilisés pour évaluer de manière exhaustive diverses immunoréactivités anti-pathogènes dans des échantillons de sérum. Le canal de classification identifie chaque ensemble de billes individuel (c’est-à-dire l’antigène spécifique) et mesure la fluorescence associée aux IgG ou aux IgM par rapport à cet antigène. Le test multiplex qui en résulte permet d’économiser du temps et des ressources par rapport aux tests classiques moins complets et de cataloguer avec précision l’immunoréactivité de la maladie de Lyme dans des volumes d’échantillons limités. Alors qu’une approche similaire à double rapporteur a déjà été utilisée pour catégoriser les réponses immunitaires dans d’autres pathologies telles que l’infection par le SRAS-CoV-213, ce rapport détaille l’application de la technologie de dosage fluorescent multiplex pour caractériser l’immunoréactivité dans la borréliose de Lyme.
Protocole
L’approbation appropriée du comité d’examen institutionnel et du comité d’éthique a été reçue pour l’utilisation d’échantillons de sérum humain dans cette série expérimentale. Les échantillons étaient des matières résiduelles anonymisées provenant d’une étude nationale allemande sur la séroprévalence du SRAS-CoV-214. L’autorisation d’utilisation d’échantillons humains a été accordée par le comité d’éthique de la faculté de médecine de Hanovre, en Allemagne (9086_BO_S_2020). Au total, 21 échantillons de sérum humain ont été utilisés dans la présente étude.
1. Approbation éthique pour l’utilisation d’échantillons humains
- Obtenir les approbations éthiques appropriées pour l’utilisation d’échantillons humains.
2. Réactifs et équipements
- Échantillons de sérum humain : Effectuer la validation des essais techniques et le contrôle de la qualité à l’aide d’échantillons de sérum provenant de personnes ayant déjà reçu un diagnostic de borréliose de Lyme ou d’un statut immunitaire négatif à Borrelia 12,14.
- Instrumentation à rapporteur unique. Utiliser un instrument à rapporteur unique à deux canaux (Table des matériaux) pour le développement initial de l’essai et la validation technique.
REMARQUE : Le système à rapporteur unique comporte deux lasers : 1) identifie et quantifie la fluorescence spécifique à l’ensemble de billes pour discriminer différents ensembles de billes, s’il est utilisé (canal de classification), et 2) détecte et quantifie la fluorescence de phycoérythrine (PE) spécifique à la cible liée aux billes (canal rapporteur ; excitation de 532 nm, émission « orange » de 565 à 585 nm). Ainsi, une seule classe d’isotypes d’anticorps (par exemple, IgG ou IgM) peut être analysée à la fois à l’aide du canal rapporteur unique.- Effectuer des études de validation initiales pour évaluer séparément les IgG et les IgM anti-Borrelia , dans un format à rapporteur unique à 96 puits qui utilise des réactifs de détection marqués au PE pour les deux classes d’anticorps.
NOTE : Le test actuel évalue les IgG circulantes spécifiques de l’antigène Borrelia VlsE et deux variantes de DbpA, ainsi que les IgM circulantes spécifiques de l’antigène OspC, à titre d’exemples représentatifs. Le test peut être étendu pour évaluer l’immunoréactivité sérique par rapport à d’autres antigènes anti-Borrelia , selon les besoins12.
- Effectuer des études de validation initiales pour évaluer séparément les IgG et les IgM anti-Borrelia , dans un format à rapporteur unique à 96 puits qui utilise des réactifs de détection marqués au PE pour les deux classes d’anticorps.
- Instrumentation à double rapporteur. Utiliser un instrument à double rapporteur à trois canaux (Table of Materials) qui permet une analyse simultanée des IgG/IgM dans la même réaction, pour le développement et la validation technique du double dosage IgM/IgG (détaillé ci-dessous). Cet instrument dispose de 3 canaux de détection de fluorescence au total, dont 2 sont des canaux rapporteurs qui évaluent les signaux ciblés associés aux Ig.
REMARQUE : Le système à double rapporteur comporte trois lasers : 1) identifie et quantifie la fluorescence spécifique à l’ensemble de billes (canal de classification) ; 2) détecte et quantifie la fluorescence de la phycoérythrine (PE) spécifique à la cible (Reporter Channel 1 ; excitation de 532 nm, émission « orange » de 565 à 585 nm), et 3) évalue la fluorescence de Brilliant Violet 421 (BV421) spécifique à la cible d’un deuxième analyte cible (Reporter Channel 2 ; excitation de 405 nm, émission « bleue » de 421-441 nm). Le système à double rapporteur est compatible avec les formats de test à plaque de microtitration à 96 puits et à 384 puits (manipulation semi-automatisée). Le schéma d’essai général est illustré à la figure 1. Les étapes du protocole sont détaillées ci-dessous.
3. Couplage antigénique
- Coupler les antigènes de Borrelia à des microsphères magnétiques, carboxylées et fluorescentes de 6,5 μm codées par couleur (billes ; Table des matériaux) en utilisant la chimie du 1-éthyl-3-(3-diméthylaminopropyl)carbodiimide (EDC)/sulfo-N-hydroxysuccinimide (sNHS).
NOTE : Une description détaillée se trouve aux références11et12. Trouvez la concentration de couplage de chaque antigène dans le tableau 1. Les billes couplées doivent être conservées à l’obscurité à 4 °C jusqu’à leur utilisation. Tous les tampons utilisés dans les réactions de couplage et de détection sont détaillés dans les documents supplémentaires.
4. Procédure d’analyse : Analyse sérologique IgG ou IgM à rapporteur unique : format à 96 puits
- Diluer l’échantillon en 2 étapes (2 étapes, toutes deux dans des plaques à 96 puits ; dilution de l’échantillon de sérum 200 fois dans le tampon de dosage).
REMARQUE : La composition du tampon d’essai est un mélange 1 :4 de tampon croisé faible : PBS contenant 1 % (p/v) d’albumine sérique bovine. Du Tween-20 est ajouté au mélange jusqu’à une concentration finale de 0,05 % (v/v).- Étape 1 de dilution de l’échantillon : Mélanger 5 μL de l’échantillon de sérum avec 120 μL du tampon de dosage (dilution 25 fois).
- Étape 2 de la dilution de l’échantillon : Diluer la dilution de l’échantillon 25 fois plus 8 fois en mélangeant 10 μL de la dilution avec 70 μL du tampon de dosage pour que la dilution finale de l’échantillon soit 200 fois.
- Dilution magnétique du mélange de billes
- Préparer un mélange de billes contenant 1,0 × 106 perles/mL par population de billes (c.-à-d. par antigène cible unique).
- Diluer le mélange de billes préparé 25 fois dans un tampon d’analyse pour obtenir la concentration finale de billes dans cette suspension diluée est maintenant de 4 × 104 billes/mL par population de billes (c’est-à-dire par antigène cible unique).
- Incubation d’échantillons de sérum à l’aide de billes
- Pipeter 25 μL de suspension de billes multiplex couplées diluées (contenant 4,0 × 104 billes/ensemble/mL) dans les puits assignés d’une plaque de microtitration à demi-surface de 96 puits (tableau des matériaux).
- Ajouter 25 μL d’échantillon de sérum dilué 200 fois (à partir de l’étape 4.1 ci-dessus) dans des puits appropriés contenant 25 μL de suspension de billes couplées.
REMARQUE : Cela produit une dilution supplémentaire de 2 fois, de sorte que la dilution finale de l’échantillon de sérum dans le puits est de 400 fois et le nombre final de billes est de 1000 perles / ensemble de billes / réaction de 50 μL. - Recouvrez la plaque de réaction à 96 puits d’un joint de microplaque (feuille adhésive ou couvercles de plaque en plastique).
- Incuber la plaque pendant 2 h à 20 °C, à 750 tr/min sur un agitateur de plaques.
- Lavage des perles
- Retirez la plaque de réaction à 96 puits de l’agitateur de plaques et retirez soigneusement le joint de la plaque adhésive.
- Placez la plaque de réaction à 96 puits dans une laveuse de plaques.
- Lavez les billes trois fois avec un tampon de lavage de 100 μL (1× PBS + 0,05 % v/v Tween 20) à l’aide du laveur de plaques magnétique automatisé.
- Remettre en suspension les billes lavées dans 100 μL de tampon de lavage, recouvrir la plaque d’un film adhésif ou d’un couvercle de plaque en plastique et agiter la plaque sur un agitateur de plaque pendant 1 min à 20 °C à 1000 tr/min.
- Fendre les perles lavées
- Retirez la plaque de réaction à 96 puits de l’agitateur de plaques et retirez soigneusement le joint de la plaque adhésive.
- Mélangez les réactions en pipetant cinq fois vers le haut et vers le bas et transférez 50 μL de chaque volume de réaction de 100 μL à chacune des deux nouvelles plaques de réaction à 96 puits, une plaque pour la détection des IgG et une pour la détection des IgM.
- Incubation d’anticorps/réactifs de détection
REMARQUE : À ce stade, des billes couplées à l’antigène cible ont été incubées avec des échantillons de sérum pour extraire les anticorps circulants dans le sérum (le cas échéant) qui réagissent avec l’antigène ou les antigènes. Les billes ayant réagi avec des immunoglobulines liées ont été divisées en deux plaques, et les IgG et les IgM sont maintenant détectées et quantifiées dans leurs plaques séparées à l’aide d’anticorps secondaires spécifiques à l’isotype avec un marquage PE. Décaler la manipulation des plaques de 20 min.- Aspirer le surnageant des puits contenant des billes magnétiques à l’aide de la laveuse magnétique.
- Pour chaque plaque, préparer le mélange approprié de réactifs de détection d’Ig (anti-IgG ou anti-IgM), contenant des IgG anti-humaines conjuguées au PE de chèvre (3 μg/mL) ou des IgM anti-humaines conjuguées à l’âne au PE (5 μg/mL) dans le tampon d’essai. Pour chaque puits contenant des billes, 30 μL de réactif de détection sont utilisés. Préparez des volumes suffisants de réactifs de détection d’IgG et d’IgM pour les puits de réaction, avec suffisamment d’excédents pour compenser les pertes de pipetage.
- Pipeter 30 μL de réactif de détection d’IgG dans chaque puits contenant des billes de réaction sur la plaque d’IgG et recouvrir la plaque de réaction à 96 puits d’un joint de microplaque.
- Pipeter 30 μL de réactif de détection d’IgM dans chaque puits contenant des billes de réaction sur la plaque d’IgM et recouvrir la plaque de réaction à 96 puits d’un joint de microplaque.
- Incuber pendant 45 min à 20 °C en agitant à 750 tr/min sur un agitateur à plaques.
- Lavage des perles
- Retirez la plaque de réaction à 96 puits de l’agitateur de plaques et retirez soigneusement le joint de la plaque adhésive.
- Placez la plaque de réaction à 96 puits dans une laveuse magnétique.
- Lavez les billes trois fois avec un tampon de lavage de 100 μL à l’aide de la laveuse magnétique.
- Remettre les billes en suspension dans 100 μL de tampon de lavage.
- Analysez les résultats sur l’instrument rapporteur unique.
- Recouvrez la plaque de réaction à 96 puits d’un joint de microplaque.
- Agiter la plaque de réaction à 96 puits pendant 3 min à 20 °C, à 1000 tr/min sur une plaque agitatrice.
- Transférez la plaque de réaction à 96 puits de l’agitateur à plaques et placez-la dans un analyseur de débit à rapporteur unique (tableau des matériaux).
- Pour chaque échantillon, analysez l’intensité fluorescente médiane (MFI) à l’aide des paramètres suivants de l’instrument : Volume d’absorption = 80 μL, Nombre = 50/population de billes, Délai d’attente = 60 s, Déclenchement = 7 500-15 000)12,13.
5. Procédure d’essai : Dosage sérologique IgG et IgM à double rapporteur : format à 96 puits
- Dilution de l’échantillon (2 étapes, toutes deux dans des plaques de 96 puits ; dilution de l’échantillon de sérum 200 fois dans un tampon d’essai)
- Étape 1 de dilution de l’échantillon : Mélanger un échantillon de sérum de 5 μL avec un tampon de dosage de 120 μL (dilution 25 fois).
- Étape 2 de la dilution de l’échantillon : Diluer les dilutions de l’échantillon 25 fois 8 fois supplémentaires en mélangeant 10 μL de la première dilution (échantillon dilué 25 fois de la section 5.1.1) avec un tampon d’essai de 70 μL (dilution 8 fois), pour obtenir une dilution finale de l’échantillon à 200 fois.
- Dilution magnétique du mélange de billes
- Préparez un mélange de billes contenant 1,0 × 106 billes couplées à l’antigène cible/mL par population de billes (c.-à-d. par antigène cible unique).
REMARQUE : Dans cette série expérimentale, nous avons évalué l’immunoréactivité des IgG et des IgM contre quatre antigènes uniques de Borrelia dans chaque réaction. - Diluer le mélange de billes préparé 50 fois dans le tampon d’essai. La concentration de billes dans cette suspension diluée est maintenant de 2,0 × 104 perles/mL par population de billes.
NOTE : Le nombre de billes dans la réaction d’essai duplex est réduit de moitié par rapport à celui utilisé dans la réaction à rapporteur unique afin de permettre une comparabilité directe entre les deux essais et de préserver les ressources, après que des études préliminaires ont confirmé que le signal de fluorescence était maintenu dans la plage linéaire de quantification lors de l’utilisation de la moitié du nombre de billes.
- Préparez un mélange de billes contenant 1,0 × 106 billes couplées à l’antigène cible/mL par population de billes (c.-à-d. par antigène cible unique).
- Incubation d’échantillons de sérum à l’aide de billes
- Pipeter 25 μL de suspension de billes couplées à l’antigène cible dilué (contenant 2,0 × 104 billes/ensemble/mL) dans des puits pré-assignés d’une plaque de microtitration demi-surface à 96 puits. Le nombre exact de puits de réaction et leur emplacement sur la plaque dépendent du nombre total d’échantillons analysés déterminé par l’opérateur et du fait que des puits uniques ou répétés seront exploités par échantillon.
REMARQUE : Les billes magnétiques couplées à l’antigène cible réagiront avec des échantillons de sérum humain. Les IgG et les IgM immunoréactives de l’antigène de Borrelia , si elles sont présentes dans les échantillons, se lient et s’immobilisent sur les mêmes billes couplées à l’antigène. La quantification secondaire des anticorps des IgG et des IgM liées sera ensuite réalisée sur les mêmes billes dans les mêmes réactions, en utilisant différents fluorophores pour l’identification des IgG et des IgM qui permet leur différenciation. - Ajouter 25 μL de sérum dilué 200 fois (à partir de l’étape 5.1 ci-dessus) dans chaque puits contenant 25 μL de suspension à billes couplées à l’antigène cible mixte (étape 5.2).
REMARQUE : Cela produit une dilution supplémentaire de 2 fois, de sorte que la dilution finale de l’échantillon de sérum dans le puits est de 400 fois et le nombre final de billes est de 500 perles / ensemble de billes / réaction de 50 μL. - Recouvrez la plaque de réaction à 96 puits d’un joint de microplaque (feuille adhésive ou couvercle de plaque en plastique).
- Incuber la plaque avec des billes pendant 2 h à 20 °C, à 750 tr/min sur un agitateur de plaques.
- Pipeter 25 μL de suspension de billes couplées à l’antigène cible dilué (contenant 2,0 × 104 billes/ensemble/mL) dans des puits pré-assignés d’une plaque de microtitration demi-surface à 96 puits. Le nombre exact de puits de réaction et leur emplacement sur la plaque dépendent du nombre total d’échantillons analysés déterminé par l’opérateur et du fait que des puits uniques ou répétés seront exploités par échantillon.
- Lavage des billes (pour éliminer l’excès d’échantillon de sérum)
- Retirez la plaque de réaction à 96 puits de l’agitateur de plaques et retirez le joint de la plaque adhésive.
- Placez la plaque de réaction à 96 puits dans une laveuse magnétique.
- Lavez les billes trois fois avec un tampon de lavage de 100 μL à l’aide de la laveuse magnétique.
- Aspirer le volume de lavage final des billes après la dernière étape de lavage.
- Anticorps de détection (Incubation - Partie I)
- Fabriquer un réactif à double détection d’IgG et d’IgM fraîches contenant des IgG anti-humaines de chèvre biotinylées (1 μg/mL) avec des IgM anti-humaines conjuguées à l’âne PE (5 μg/mL) dans un tampon d’essai. Pour chaque puits contenant des billes, 30 μL de réactif à double détection sont utilisés. Préparez des volumes suffisants de réactifs à double détection d’IgG et d’IgM pour les puits de réaction, avec suffisamment d’excédents pour compenser les pertes de pipetage.
- Pipeter 30 μL de réactif à double détection d’IgG et d’IgM dans chaque puits assigné et recouvrir la plaque de réaction à 96 puits d’un joint de microplaque.
- Incuber la plaque pendant 45 min à 20 °C en agitant à 750 tr/min sur un agitateur de plaques.
- Lavage des billes (pour éliminer l’excès d’anticorps de détection)
- Retirez la plaque de réaction à 96 puits de l’agitateur de plaques et retirez soigneusement le joint de la plaque adhésive.
- Placez la plaque de réaction à 96 puits dans un laveur de plaques magnétique automatisé.
- Lavez les billes trois fois avec un tampon de lavage de 100 μL à l’aide du laveur de plaques magnétique automatisé.
- Aspirer le volume de lavage final des billes après la dernière étape de lavage.
- Rapporteur conjugué à la streptavidine (Incubation - Partie II)
- Diluer la streptavidine fraîche marquée BV421 dans un tampon d’essai à une concentration de 0,2 μg/mL. Pour chaque puits contenant des billes, 30 μL de streptavidine marquée BV421 sont utilisées. Préparez un volume suffisant de streptavidine marquée BV421 pour les puits de réaction, avec suffisamment d’excédent pour compenser les pertes de pipetage.
- Pipeter 30 μL de BV421-streptavidine diluée dans chaque puits de réaction et couvrir la plaque de réaction à 96 puits avec le joint de la microplaque.
- Incuber la plaque pendant 30 min à 20 °C en agitant à 750 tr/min sur un agitateur de plaques.
- Laver les billes (pour enlever l’excès de BV421-streptavidine)
- Retirez la plaque de réaction à 96 puits de l’agitateur de plaques et retirez soigneusement le joint de la plaque adhésive.
- Placez la plaque de réaction à 96 puits dans le laveur de plaques magnétique.
- Lavez les billes trois fois avec un tampon de lavage de 100 μL à l’aide du laveur de plaques magnétique automatisé.
- Remettre les billes en suspension dans les puits jusqu’à un volume final de 100 μL dans le tampon de lavage.
- Analyser les résultats sur l’instrument à double rapporteur
- Recouvrez la plaque de réaction à 96 puits d’un joint de microplaque.
- Incuber la plaque de réaction à 96 puits pendant 3 min à 20 °C, à 1000 tr/min sur un agitateur à plaques.
- Transférez la plaque de réaction à 96 puits de l’agitateur à plaques vers l’analyseur de débit à double rapporteur (tableau des matériaux).
- Évaluez l’intensité fluorescente médiane (MFI) de l’échantillon conformément aux instructions du fabricant (paramètres de l’instrument : mode double rapporteur, volume d’absorption = 80 μL, nombre = 50/population de billes, délai d’attente = 60 s, déclenchement = 7 500-15 000).
6. Dosage sérologique IgG et IgM à double rapporteur : format semi-automatisé à 384 puits
- Effectuer l’essai à double rapporteur dans un format de plaque à 384 puits en utilisant les étapes d’analyse détaillées à la section 5, mais traiter les échantillons à l’aide d’un robot de pipetage et d’un laveur de plaques magnétique automatisé (Table des matériaux). En format 384 puits, agiter les plaques pendant les incubations et les lavages à 1450 tr/min, et avant de mesurer la fluorescence, agiter la plaque pendant 5 min à 21 °C et 1800 tr/min.
Résultats Représentatifs
Vue d’ensemble expérimentale
Les schémas généraux pour les dosages Borrelia à billes à rapporteur unique et double rapporteur sont présentés à la figure 1. Pour les cibles d’anticorps uniques (c’est-à-dire les IgG ou les IgM) générées contre un antigène Borrelia donné, les deux classes d’anticorps ont été évaluées indépendamment dans des échantillons de sérum humain à l’aide d’un anticorps anti-isotype conjugué PE pour la déclaration. Pour le test à double rapporteur avec analyse simultanée de l’immunoréactivité des IgG et des IgM, la détection des IgG spécifiques de l’antigène Borrelia a utilisé un système de rapporteur de Streptavidine (fluorescence bleue) marqué à la streptavidine (fluorescence bleue) anti-humain biotinylé, tout en conservant le rapporteur conjugué PE (fluorescence orange) pour la détection des IgM. Le flux de travail du test à double rapporteur est similaire à celui du test à rapporteur unique, à l’exception d’une incubation supplémentaire de 30 minutes du système de détection avec le réactif de détection de fluorescence à deuxième canal BV421-Streptavidine.
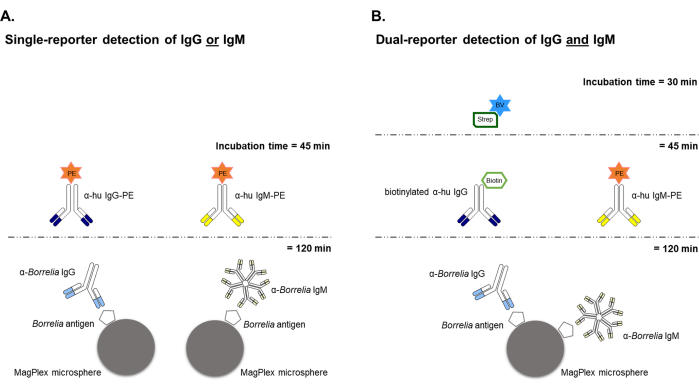
Figure 1 : Schéma des dosages Borrelia à billes à rapporteur unique et à double rapporteur. (A) L’instrument à rapporteur unique a été utilisé pour développer et valider initialement le test à base de billes qui caractérisait individuellement les IgG ou les IgM anti-Borrelia, les deux utilisant un marqueur rapporteur fluorescent de phycoérythritine (PE) qui émet un signal dans les spectres « orange ». N’importe quel antigène Borrelia souhaité peut être couplé aux billes et utilisé pour capturer et quantifier les IgG ou les IgM présentes dans les échantillons de sérum. Deux immunoessais distincts sont nécessaires pour évaluer la réactivité des IgG et des IgM contre un antigène donné. (B) Le système à double rapporteur a permis l’analyse simultanée d’échantillons de sérum pour les anticorps IgG et IgM contre n’importe quel antigène individuel de Borrelia dans le même puits. Cette approche utilise le même anticorps de détection conjugué au PE pour cibler les IgM anti-Borrelia, mais remplace la détection des IgG d’un système à base de PE par l’utilisation d’un anticorps de détection primaire biotinylé et de la streptavidine marquée au BV421 (un émetteur « bleu ») qui nécessite une étape d’incubation supplémentaire du système de détection de 30 minutes. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Précision intra-essai
L’analyse de corrélation de Spearman pour trois antigènes représentatifs de Borrelia (Figure 2) a démontré une reproductibilité uniforme des valeurs MFI lors de la détection d’anticorps anti-Borrelia présents dans les sérums humains.
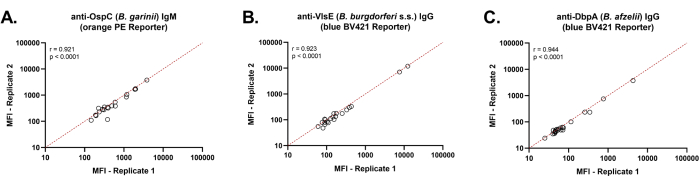
Figure 2 : Précision intra-test de l’essai Borrelia à double rapporteur. L’analyse de corrélation de Spearman a montré une grande précision intra-test du test à double rapporteur lorsqu’un système de détection PE a été utilisé pour détecter les anticorps IgM spécifiques de Borrelia (A) et qu’un système de détection BV421 a été utilisé pour détecter les anticorps IgG spécifiques de Borrelia (B, C). Au total, 21 échantillons de sérum ont été analysés en double à l’aide d’une procédure semi-automatisée. Dans chaque graphique, les signaux MFI ont été tracés les uns par rapport aux autres et analysés par régression linéaire. Une courbe linéaire (x=y) représentée par une ligne pointillée rouge indique des signaux MFI identiques pour les systèmes de détection. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Précision inter-essais
Une bonne reproductibilité d’un essai à l’autre a été observée avec le test à double rapporteur. Les diagrammes de Levey-Jennings (Figure 3) avec les valeurs de l’IMF d’un échantillon de contrôle de la qualité mesuré sur sept essais indépendants ont démontré la grande précision entre les essais pour tous les antigènes représentatifs. Le pourcentage moyen de coefficient de variation (CV% = écart-type/moyenne × 100) des quatre antigènes représentatifs de Borrelia était de 5,3 %.
Linéarité de dilution
Étant donné que le test original à rapporteur unique et le nouveau test à double rapporteur utilisent des plates-formes de cytométrie en flux différentes, nous avons comparé les sorties de fluorescence médianes du même test immunologique antigénique entre les deux instruments de cytométrie en flux (Figure 4). Les séries de dilution des échantillons ont fourni des courbes de dilution linéaires pour l’évaluation des IgM et des IgG, avec un bon parallélisme dose-réponse entre les instruments sur toute la plage de dilution évaluée (1 :100-1 :12 800).
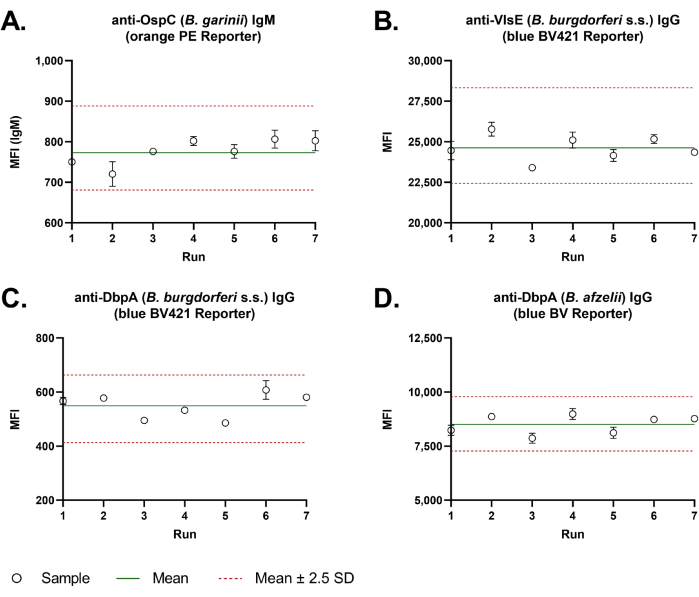
Figure 3 : Précision inter-essais de l’essai Borrelia à base de billes à double rapporteur. Pour l’évaluation de la précision inter-essais, la réponse en anticorps IgM (A) et IgG (B-D) spécifiques de Borrelia d’un échantillon de contrôle de la qualité a été analysée sur sept essais indépendants, dans des puits dupliqués à chaque fois. Les dosages ont été effectués manuellement. Les valeurs de l’IMF ont été tracées dans un graphique de Levey-Jennings. Une ligne verte donne la moyenne de toutes les valeurs. Deux lignes pointillées rouges indiquent la plage de tolérance de la précision inter-essais. Celle-ci a été calculée à partir de la valeur moyenne ± 2,5 fois l’écart-type (2,5 S.D.). Veuillez cliquer ici pour voir une version agrandie de cette figure.
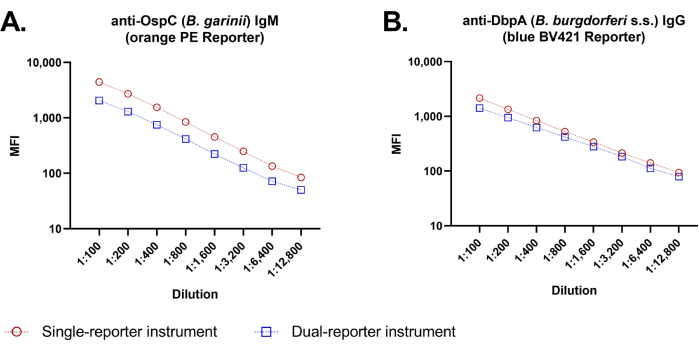
Figure 4 : Linéarité de dilution de l’essai Borrelia à base de billes à double rapporteur. À des dilutions d’échantillon de 100 à 12 800 fois, les courbes de dilution pour la détection des IgM (A) et des IgG (B) étaient similaires lorsqu’elles étaient effectuées manuellement avec l’instrument à rapporteur unique et l’instrument à double rapporteur. À toutes les dilutions testées, les valeurs de l’IMF étaient légèrement plus élevées avec l’instrument à rapporteur unique (symboles rouges) qu’avec l’instrument à double rapporteur (symboles bleus). Les courbes de dilution pour 2 antigènes représentatifs sont représentées, chaque point de dilution représentant la mesure moyenne des puits triples avec un écart-type (écart-type *) indiqué par des barres d’erreur. Remarque : Les petites cartes SD ne sont pas visibles à cette échelle. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Matériel supplémentaire. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
Ce rapport met en évidence le développement d’un test immunologique à base de billes de Borrelia à deux rapporteurs qui détermine de manière reproductible et sensible l’immunoréactivité anti-Borrelia dans des échantillons de sérum12. Les différentes espèces pathogènes de Borrelia qui causent la borréliose de Lyme peuvent être différenciées par l’hétérogénéité de l’antigène spécifique au variant 6,7,8,9. Le test multiplexé évalue simultanément l’immunoréactivité anti-Borrelia médiée par les IgG et les IgM dans le même puits de réaction, conservant ainsi les réactifs, la main-d’œuvre et le matériel d’échantillon autrement nécessaires pour effectuer deux tests singleplex séparément. La comparaison des réponses IgM et IgG au fil du temps peut permettre un meilleur suivi de la progression de la maladie, car la séroconversion IgM en IgG se produit après l’infection6.
Le système à double rapporteur utilise deux systèmes d’anticorps de détection différents13,15. Des expériences connexes n’ont montré aucune réactivité croisée détectable significative entre les systèmes de détection des anti-IgM et des anti-IgG de Borrelia lorsque les deux classes d’anticorps ont été analysées ensemble dans le même puits de réaction12. Compte tenu de l’affinité de liaison plus faible des anticorps IgM par rapport aux anticorps IgG16,17, nous avons choisi un anticorps de détection conjugué PE pour la détection des IgM (le premier canal rapporteur de l’instrument à double rapporteur) car le PE est l’un des fluorophores les plus fortement émetteurs couramment utilisés dans les immunoessais18. Pour l’évaluation des IgG, nous avons utilisé un anticorps de détection biotinylé qui a ensuite été éclairé avec de la streptavidine conjuguée BV421 (le deuxième canal rapporteur de l’instrument)19. Malgré l’étape d’incubation supplémentaire de 30 minutes par rapport au système à rapporteur unique, le système à double rapporteur produit deux fois plus d’informations par réaction. Dans l’ensemble, le test multiplexé à double rapporteur nécessite moins de temps cumulé et d’entrées de matériaux que l’exécution de deux tests à rapporteur unique.
Les performances et la stabilité élevées du test Borrelia multiplexé ont été illustrées par une reproductibilité élevée dans les études de précision intra et inter-essais, et par la démonstration de la linéarité de dilution et du parallélisme de dilution sur une large gamme de concentrations d’échantillons pour l’évaluation des IgG et des IgM. Nous avons observé des niveaux d’émission de fluorescence absolus plus élevés pour les mêmes fluorophores en utilisant l’instrument à canal unique par rapport au système à deux canaux (≈1,7 × plus élevés avec le PE), attribuables à des différences dans les paramètres optiques et d’étalonnage entre les deux instruments (Figure 4). Néanmoins, les courbes d’émission de fluorescence avec les deux fluorophores sont restées dans la plage linéaire des deux instruments aux extrêmes de dilution de l’échantillon élevé et faible, et tout écart dans la fluorescence absolue mesurée n’a pas affecté la classification de l’état d’exposition à Borrelia . 12
L’un des principaux avantages de ce test multiplex Borrelia à base de billes est la facilité avec laquelle le test peut être modifié ou étendu pour évaluer des analytes différents ou supplémentaires, par exemple pour détecter des anticorps dirigés contre des antigènes d’autres espèces de Borrelia . Les ensembles de billes magnétiques xMAP contiennent différentes combinaisons de colorants qui peuvent être distinguées dans le canal de classification de l’instrument et peuvent théoriquement être mises en œuvre dans des tests multiplex qui peuvent évaluer simultanément jusqu’à 500 analytes uniques dans le même échantillon. Alors que la présente étude met en évidence quatre antigènes représentatifs de Borrelia pour démontrer la fonctionnalité et la stabilité du test et pour comparer le système à rapporteur unique et double, le test final interroge huit antigènes qui, ensemble, peuvent identifier les cinq agents pathogènes Borrelia cliniquement pertinents circulant en Europe et en Amérique du Nord12.
Des performances à haut débit sont possibles en utilisant des plaques de microtitration standard à 384 puits dans un format de test semi-automatisé. La compatibilité des dosages et des instruments avec les plaques à 96 et 384 puits permet d’utiliser le test multiplex Borrelia comme un outil de criblage efficace pour l’analyse rapide de grands ensembles d’échantillons, tels que les études nationales20. L’exécution manuelle du test reste possible pour les petits ensembles d’échantillons utilisant des plaques plus petites à 96 puits.
Les limites de l’étude comprennent l’évaluation comparative de seulement quelques cibles d’immunoréactivité de Borrelia dans un petit nombre d’échantillons de sérum humain. Cependant, l’étude originale a confirmé que la performance du test pour les IgG et les IgM a été maintenue lors de l’analyse de huit antigènes des cinq espèces connues de Borrelia dans un ensemble d’échantillons plus large12. De plus, l’instrument à double rapporteur ne peut évaluer que deux isotypes d’anticorps simultanément dans chaque réaction, de sorte qu’un profilage complet des isotypes nécessiterait d’effectuer des réactions de test supplémentaires13.
En conclusion, ce rapport détaille la fusion et la conversion réussies d’immunoessais à rapporteur unique à billes en tests à double rapporteur qui peuvent évaluer simultanément les anticorps IgG et IgM pathogènes spécifiques de Borrelia dans des échantillons de sérum humain. Cette approche combinée permet d’économiser du temps, des matériaux et de la main-d’œuvre pour générer le même volume de données que deux tests indépendants à rapporteur unique. Le test multiplex peut être mis à l’échelle d’un format de plaque de microtitration de 96 puits à 384 puits et peut être semi-automatisé par l’utilisation d’instruments robotisés de manipulation des plaques et des liquides, ce qui le rend adapté aux applications à haut débit telles que les enquêtes de population à grande échelle. Les systèmes de dosage à double rapporteur à base de billes ont déjà démontré leur utilité dans l’évaluation, par exemple, des réponses immunitaires à d’autres agents pathogènes viraux et bactériens13,21, l’évaluation des réponses allogéniques des anticorps contre les épitopes HLA dans la transplantation d’organes22 et l’exploration des mécanismes des maladies auto-immunes23. Le présent rapport détaille l’utilisation de la technologie multiplex pour identifier l’exposition aux agents pathogènes Borrelia qui causent la maladie de Lyme, comme un exemple de la façon dont les laboratoires peuvent adapter cette approche pour explorer des mécanismes immunitaires complexes dans diverses pathologies.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce rapport a été financé par Luminex (Austin, TX). Les auteurs remercient Matthew Silverman, Ph.D. (Biomedical Publishing Solutions, Panama City, FL ; mattsilver@yahoo.com) pour son aide à l’analyse et à la révision scientifique. Les auteurs remercient également Harald Klein et Christoph von Eichel-Streiber de tgcBIOMICS GmbH (Bingen, Allemagne) pour avoir fourni les antigènes de Borrelia utilisés dans l’étude. Des échantillons de sérum humain pour la validation des essais techniques et le contrôle de la qualité ont été obtenus à partir de : 1) l’étude de prévalence multilocale et en série sur les anticorps contre le SRAS-CoV-2 en Allemagne par l’intermédiaire du département d’épidémiologie du Centre Helmholtz de recherche sur les infections, à Braunschweig, en Allemagne ; et 2)le département de neurologie, Sächsisches Krankenhaus Rodewisch (Rodewisch, Allemagne). L’autorisation d’utilisation d’échantillons humains a été accordée par le comité d’éthique de la faculté de médecine de Hanovre, en Allemagne (9086_BO_S_2020).
matériels
| Name | Company | Catalog Number | Comments |
| Antibodies and Detection Reagents | Source | Catalog Number | |
| Biotinylated Goat Anti-Human IgG | Jackson ImmunoResearch (Dianova) | 109-066-098 | |
| Brilliant Violet 421-Streptavidin | BD Biosciences | 563259 | |
| Donkey Anti-Human IgM | Jackson ImmunoResearch (Dianova) | 709-116-073 | |
| Borrelia Antigens | tgcBIOMICS (Bingen, Germany) | ||
| Coupling Reagents | |||
| 1-Ethyl-3-[3-dimethylaminopropyl]carbodiimide hydrochloride (EDC) | Thermo Scientific Pierce | 77149 ProteoChem (100 mg) | |
| 10x PBS | Fisher Scientific | BP399-4 | |
| BSA | Carl Roth | T844.3 | |
| MES (2-ethanesulfonic acid; zwitterionic buffer) | Carl Roth | 4256.2 | |
| Na2HPO4 | Carl Roth | 4984.1 | |
| ProClin300 | Sigma | 48914-U | |
| Sulfo-NHS (N-hydroxysulfosuccinimide) | Thermo Scientific Pierce | 24510 (500 mg) | |
| Triton X-100 | Thermo Scientific | 85111 | |
| Instrumentation and Ancillary Lab Supplies | Source | ||
| 384-well plate | Corning, Cat# 3570 | ||
| 96-well deep-well plates | ThermoFisher Scientific, Cat# 95040450 | ||
| 96-well half-area plates | Corning, Cat# 3690 | ||
| BioTek 405 TS Plate Washer | BioTek Instruments/Agilent Technologies, Santa Clara, CA | ||
| BioTek MultiFlo FX Plate Washer | BioTek Instruments/Agilent Technologies, Santa Clara, CA | ||
| DynaMag Spin Magnet (for isolating beads in microcentrifuge tubes) | ThermoFisher, Cat# 12320D | ||
| Flexmap 3D (two-channel, single-reporter instrument) | Luminex Corp., Austin, TX | ||
| KingFisher Magnetic Particle Processor (for isolating beads in 96-well plates) | ThermoFisher, Cat# A31508 | ||
| MagPlex Microspheres (magnetic, fluorescent, 6.5-µm-diameter beads) | Luminex Corp., Austin, TX | ||
| SmartBlock Plates | Eppendorf, Cat# 5363000039 | ||
| ThermoMixer C | Eppendorf, Cat# 5382000015 | ||
| ThermoTop | Eppendorf, Cat# 5308000003 | ||
| xMAP Intelliflex (three-channel, dual-reporter instrument) | Luminex Corp., Austin, TX |
Références
- Stanek, G., Strle, F. Lyme borreliosis-from tick bite to diagnosis and treatment. FEMS Microbiology Reviews. 42 (3), 233-258 (2018).
- Stanek, G., Wormser, G. P., Gray, J., Strle, F. Lyme borreliosis. The Lancet. 379 (9814), 461-473 (2012).
- Rizzoli, A., et al. Lyme borreliosis in Europe. Eurosurveillance. 16 (27), 19906 (2011).
- Cook, M. J. Lyme borreliosis: a review of data on transmission time after tick attachment. International Journal of General Medicine. 8, 1-8 (2015).
- Strle, F., Stanek, G., Lipsker, D., Jaulhac, B. Clinical Manifestations and Diagnosis of Lyme Borreliosis. Lyme Borreliosis: Biological and Clinical Aspects. , 51-110 (2009).
- Wilske, B., Fingerle, V., Schulte-Spechtel, U. Microbiological and serological diagnosis of Lyme borreliosis. FEMS Immunology and Medical Microbiology. 49 (1), 13-21 (2007).
- Dessau, R. B., et al. To test or not to test? Laboratory support for the diagnosis of Lyme borreliosis: a position paper of ESGBOR, the ESCMID study group for Lyme borreliosis. Clinical Microbiology and Infection. 24 (2), 118-124 (2018).
- Eldin, C., et al. Review of European and American guidelines for the diagnosis of Lyme borreliosis. Médecine et Maladies Infectieuses. 49 (2), 121-132 (2019).
- Lantos, P. M., et al. Clinical Practice Guidelines by the Infectious Diseases Society of America (IDSA), American Academy of Neurology (AAN), and American College of Rheumatology (ACR): 2020 Guidelines for the Prevention, Diagnosis and Treatment of Lyme Disease. Clinical Infectious Diseases. 72 (1), e1-e48 (2021).
- Gerritzen, A., Brandt, S. Serodiagnosis of Lyme borreliosis with bead based immunoassays using multiplex technology. Methods. 56 (4), 477-483 (2012).
- Embers, M. E., et al. Five-antigen fluorescent bead-based assay for diagnosis of Lyme disease. Clinical Vaccine Immunology. 23 (4), 294-303 (2016).
- Häring, J., et al. Borrelia multiplex: a bead-based multiplex assay for the simultaneous detection of Borrelia specific IgG/IgM class antibodies. BMC Infectious Diseases. 22 (1), 859 (2022).
- Angeloni, S., Cameron, A., Pecora, N. D., Dunbar, S. A rapid, multiplex dual reporter IgG and IgM SARS-CoV-2 neutralization assay for a multiplexed bead-based flow analysis system. Journal of Visualized Experiments. 170, (2021).
- Gornyk, D., et al. SARS-CoV-2 Seroprevalence in Germany. Deutsches Ärzteblatt International. 118 (48), 824-831 (2021).
- Angeloni, S., Das, S., De Jager, W., Dunbar, S. . xMAP Cookbook. , (2022).
- Racine, R., Winslow, G. M. IgM in microbial infections: Taken for granted. Immunology Letters. 125 (2), 79-85 (2009).
- Ehrenstein, M. R., Notley, C. A. The importance of natural IgM: scavenger, protector and regulator. Nature Reviews Immunology. 10 (11), 778-786 (2010).
- Kovaleski, G., et al. Extraction and purification of phycobiliproteins from algae and their applications. Frontiers in Chemistry. 10, 1065355 (2022).
- Chattopadhyay, P. K., et al. Brilliant violet fluorophores: A new class of ultrabright fluorescent compounds for immunofluorescence experiments. Cytometry Part A. 81 (6), 456-466 (2012).
- Coors, A., et al. Regional seropositivity for Borrelia burgdorferi and associated risk factors: findings from the Rhineland Study, Germany. Parasites & Vectors. 15 (1), 241 (2022).
- Gürsoy, M., et al. Salivary IgA and IgG antibody responses against periodontitis-associated bacteria in Crohn's Disease. International Journal of Molecular Science. 24 (3), 2385 (2023).
- Argani, H. Anti-HLA Antibody: The role of epitopes in organ transplantation. Experimental and Clinical Transplantation. 17 (Suppl 1), 38-42 (2019).
- Laman, J. D., Huizinga, R., Boons, G. J., Jacobs, B. C. Guillain-Barré syndrome: expanding the concept of molecular mimicry. Trends in Immunology. 43 (4), 296-308 (2022).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon