Imagerie ATG9A, une protéine membranaire à plusieurs étendues
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Ce protocole décrit diverses méthodes qui peuvent aider à l’étude de la biologie de l’ATG9A, y compris l’immunofluorescence suivie d’une analyse d’imagerie, les considérations de surexpression transitoire et l’étude de l’état de glycosylation de l’ATG9A à l’aide du transfert Western.
Résumé
L’autophagie est une voie hautement conservée que la cellule utilise pour maintenir l’homéostasie, dégrader les organites endommagés, combattre les agents pathogènes envahisseurs et survivre à des conditions pathologiques. Un ensemble de protéines, appelées protéines ATG, constituent la machinerie centrale de l’autophagie et travaillent ensemble dans une hiérarchie définie. Les études de ces dernières années ont amélioré nos connaissances sur la voie de l’autophagie. Plus récemment, il a été proposé que les vésicules ATG9A sont au cœur de l’autophagie, car elles contrôlent la synthèse rapide de novo d’un organite appelé phagophore. L’étude de l’ATG9A s’est avérée difficile, car l’ATG9A est une protéine transmembranaire et elle est présente dans différents compartiments membranaires. À ce titre, la compréhension de son trafic est un élément important pour comprendre l’autophagie. Nous y présentons des méthodes détaillées qui peuvent être utilisées pour étudier l’ATG9A et, en particulier, sa localisation à l’aide de techniques d’immunofluorescence, qui peuvent être évaluées et quantifiées. Les pièges de la surexpression transitoire sont également abordés. La caractérisation correcte de la fonction d’ATG9A et la standardisation des techniques d’analyse de son trafic sont cruciales pour caractériser davantage les événements régissant l’initiation de l’autophagie.
Introduction
L’ATG9A est la seule protéine transmembranaire de la machinerie centrale de l’autophagie et est trafiquée entre le Golgi et un compartiment de la vésicule cytosolique ATG9A, transitant par le compartiment endosomal1. Après avoir longtemps été énigmatique, l’ATG9A a récemment été décrite comme fonctionnant comme un scramblase lipidique, car elle équilibre les lipides à travers les bicouches membranaires 2,3. Il est maintenant clair qu’ATG9A se situe au sommet de la hiérarchie dans la formation des autophagosomes, et son étude est donc vitale pour comprendre l’autophagie 4,5. En tant que telles, les vésicules ATG9A ont récemment été proposées comme « graine » de l’autophagosome 6,7. Cependant, des études antérieures ont démontré que l’ATG9A n’interagit que transitoirement avec l’autophagosome en formation à différents stades de sa maturation et ne s’intègre pas dans la membrane autophagique 6,8,9,10,11. Ainsi, d’autres recherches sont nécessaires pour démêler complètement le rôle et les multiples fonctions potentielles de l’ATG9A dans la formation des autophagosomes. Cependant, l’écart entre les modèles actuels et les données précédentes ne peut être résolu que par des expériences ciblées portant sur le trafic d’ATG9A à l’aide d’approches quantitatives validées et de marqueurs intracellulaires.
Il existe différents outils utilisés pour étudier l’ATG9A, chacun ayant des avantages et des inconvénients, et l’utilisation de ces outils est compliquée par la structure de l’ATG9A, sa fonction moléculaire et le trafic cellulaire 2,8,12. L’ATG9A forme un homotrimère, est glycosylé et est transporté dans toute la cellule vers des compartiments tels que le Golgi, les endosomes et la membrane plasmique13,14. Compte tenu de son itinéraire complexe, il y a plusieurs défis dans l’interprétation des lectures telles que la dispersion de l’ATG9A à partir du Golgi lors de traitements ou de stimuli spécifiques (tels que la privation de nutriments et de sérum). L’ATG9A est extrêmement dynamique en termes de trafic vésiculaire ; en effet, les vésicules contenant de l’ATG9A ont été définies comme le compartiment de l’ATG9A dans le contexte de l’autophagie induite par la famine. Le compartiment ATG9A, formé par ces vésicules dynamiques, interagit transitoirement avec plusieurs organites intracellulaires 8,15,16,17. Les techniques décrites ici, y compris l’immunofluorescence, l’imagerie en direct et les tests de glycosylation, devraient aider à la détection et à la compréhension de la biologie de l’ATG9A. En particulier, les approches décrites dans cet article aideront à répondre aux questions relatives à la localisation dans des compartiments cellulaires spécifiques et aux interactions avec des partenaires protéiques spécifiques et/ou des compartiments membranaires. Étant donné que le domaine central conservé hydrophobe de l’ATG9A (domaine PFAM PF04109) a une topologie unique et que l’ATG9A circule entre plusieurs compartiments membranaires, les chercheurs doivent être conscients de certains pièges et artefacts lors de la surexpression transitoire d’ATG9A, y compris, mais sans s’y limiter, la rétention du réticulum endoplasmique (RE). D’autres problèmes possibles peuvent survenir en raison d’un mauvais repliement de la protéine, d’une agrégation artificielle dans des conditions de croissance normales ou d’une détection insuffisante du compartiment vésiculaire en raison de protocoles de perméabilisation sous-optimaux pour l’immunofluorescence.
Lors de l’imagerie endogène ATG9A, il faut veiller à la préparation de l’échantillon et à l’acquisition de l’image pour garantir la qualité de l’analyse quantitative ultérieure et l’interprétation correcte des données. La combinaison des techniques décrites dans cet article avec des approches biochimiques standard (telles que l’immunoprécipitation ou les expériences de pull-down non décrites ici) devrait améliorer notre compréhension de la fonction de l’ATG9A. Cette boîte à outils expérimentale est destinée à aider les nouveaux chercheurs à naviguer dans certains des tests nécessaires pour déterminer la fonction de l’ATG9A dans leur système biologique.
Protocole
Tous les réactifs utilisés dans cette étude sont disponibles dans le commerce, à l’exception des constructions d’ADN ATG9A et de l’anticorps STO-215 maison (voir le tableau des matériaux), qui sont disponibles sur demande. Les outils d’analyse décrits ici sont basés sur des logiciels libres (FIJI/ImageJ)18.
1. Culture cellulaire
- Maintenir HEK293A cellules dans un flacon traité par culture tissulaire T150 jusqu’à une confluence de 80 % à 90 % dans du DMEM (milieu d’aigle modifié de Dulbecco) à haute teneur en glucose, complété par 10 % de FBS (sérum de veau fœtal) et 4 mM de L-glutamine (voir le tableau des matériaux). Incuber les cellules à 37 °C dans un incubateur de culture tissulaire humidifié à 10 % de CO2.
NOTE : Les cellules HEK293A sont utilisées dans la présente étude, car elles ont une réponse d’autophagie canonique robuste en cas de privation d’acides aminés, qui est notamment détectée par une augmentation de la CL3 lipidée associée à la membrane 1,9,19, et conviennent à l’imagerie. - Passage des cellules en aspirant le milieu de la fiole à l’aide d’une pipette sérologique. Lavez les cellules une fois avec 15 mL de PBS (solution saline tamponnée au phosphate) ou une solution similaire avant d’ajouter 2 mL de solution de trypsine-EDTA (acide éthylènediaminetétraacétique) pour détacher les cellules. Recueillir les cellules détachées avec 8 mL de DMEM et réensemencer un certain nombre de cellules de manière à ce que la confluence soit de 80 % à 90 % après 2 jours pour les expériences décrites ici.
2. Coloration endogène de l’ATG9A
- Semez HEK293A cellules (ou cellules de votre choix) sur des lamelles de verre stériles n° 1,5 placées dans une plaque à 24 puits afin qu’elles soient confluentes à ~80 % le lendemain. Cela donne généralement 7 x 104 cellules/puits dans 500 μL de DMEM.
REMARQUE : Pour les cellules HEK293A ou d’autres lignées cellulaires faiblement adhérentes, les lamelles doivent être enduites de poly-D-lysine à 0,1 mg / mL dans de l’eau déminéralisée. Ajouter 500 μL de poly-D-lysine (voir tableau des matériaux) sur le dessus des lamelles placées dans les puits pendant 10 min à température ambiante (RT), suivi de trois lavages à l’eau déminéralisée et d’un dernier lavage au DMEM. Procédez à l’ensemencement des cellules après l’enrobage et veillez à ce qu’elles soient uniformément réparties dans la boîte de culture. - Traiter les cellules en fonction des conditions expérimentales spécifiques (c’est-à-dire la famine pendant 2 h dans l’EBSS [Earle’s Balanced Salt Solution]).
REMARQUE : La composition de l’EBSS est de 1 g/L de D-glucose, 6,8 g/L de NaCl, 0,4 g/L de KCl, 0,151 g/L de CaCl 2,2H 2 O, 0,2 g/L de mM de MgSO, 4,7H 2 O, 0,124 g/L de NaH 2,4,2H 2 O et 2,2 g/L de NaHCO3 (voir le tableau des matériaux) dissous dans de l’eau distillée. - Aspirer le milieu et le remplacer soigneusement par 500 μL de solution de formaldéhyde à 4 % dans du PBS complété par 0,1 mM de CaCl 2 et 0,1 mM de MgCl2 pendant 20 min à RT pour fixer les cellules.
- Aspirer la solution de formaldéhyde à 4 % de chaque puits, en la remplaçant par 500 μL de PBS. Répétez cette étape de lavage trois fois. Ne laissez pas les lamelles sécher ou rester sans liquide.
- Tremper les groupes aldéhydes libres en utilisant 500 μL de solution de NH4Cl à 50 mM dans du PBS pendant 10 min à RT.
- Aspirer le PBS et le remplacer par 500 μL d’une solution de digitonine à 50 μg/mL dans du PBS (solution mère à 1 mg/mL dans de l’eau déminéralisée, voir Tableau des matériaux) pendant 5 min à RT pour perméabiliser les cellules.
- Aspirer la solution de digitonine de chaque puits et la remplacer par 500 μL de PBS. Répétez cette étape de lavage trois fois.
- Aspirer le PBS de chaque puits, et le remplacer par 500 μL de solution bloquante (5 % de BSA [albumine sérique bovine] diluée dans du PBS) pendant 30 min à RT.
- Aspirez la solution de blocage et remplacez-la par 500 μL de PBS.
- À l’aide d’une pince à épiler, prélever les lamelles dans le puits, retirer délicatement l’excédent de solution de PBS à l’aide de lingettes minces ou de papier filtre en cellulose et déposer délicatement chaque lamelle, côté cellule vers le bas, sur une goutte de 50 μL de solution primaire d’anticorps (p. ex., hamster arménien 14F2 dilué à 0,9 μg/mL dans une solution BSA/PBS à 1 %, voir le tableau des matériaux). Incuber dans une chambre humidifiée pendant 1 h à RT.
REMARQUE : Pour faciliter la manipulation, les gouttes de solution d’anticorps peuvent être placées sur une feuille de film thermoplastique auto-obturant (voir le tableau des matériaux) à l’intérieur d’un autre récipient plutôt que directement sur une surface solide. - Récupérez les lamelles à l’aide d’une pince à épiler et, après avoir égoutté doucement l’excès de solution d’anticorps primaires à l’aide de lingettes en tissu mince, replacez les lamelles (côté cellule vers le haut) dans la plaque à 24 puits et lavez-les trois fois avec du PBS.
- Répétez l’étape 2.10. À l’aide d’une pince à épiler, prélever les lamelles de chaque puits, en égouttant soigneusement l’excès de PBS à l’aide de lingettes en tissu minces, et déposer délicatement chaque lamelle (côté cellule vers le bas) sur une goutte de 50 μL de solution d’anticorps secondaires diluée 1 :1 000 dans une solution BSA/PBS à 1 % (p. ex., Cy3 Goat Anti-Armenian Hamster IgG, qui a une réactivité croisée minimale avec les bovins, les humains, protéines sériques de souris, de lapins et de rats, voir le tableau des matériaux). Incuber dans une chambre humidifiée pendant 1 h à RT.
REMARQUE : Facultatif : Un marqueur de cytosquelette peut être utilisé en plus de l’anticorps secondaire pour l’analyse d’image subséquente (c.-à-d. Alexa Fluor 647 Phalloïdine diluée 1 :1 000, voir le tableau des matériaux). Pour faciliter la manipulation, les gouttes de solution d’anticorps peuvent être placées sur une feuille de film d’étanchéité à l’intérieur d’un autre récipient plutôt que directement sur une surface solide. - Prélever les lamelles à l’aide d’une pince à épiler et, après avoir égoutté l’excès de solution d’anticorps secondaires, placer les lamelles dans la plaque à 24 puits (côté cellule vers le haut) et les laver trois fois avec 500 μL de PBS.
- À l’aide d’une pince à épiler, prélever les lamelles, égoutter soigneusement l’excès de PBS à l’aide de lingettes en papier minces, et déposer délicatement chaque lamelle (côté cellule vers le bas) sur une goutte de 50 μL de solution Hoechst 1 :4 000 (Hoechst 33342) dans PBS. Incuber dans une chambre humide pendant 5 min à RT.
REMARQUE : Pour une manipulation facile, les gouttes de solution d’anticorps peuvent être placées sur une feuille de film d’étanchéité à l’intérieur d’un autre récipient plutôt que directement sur une surface solide. - Récupérez les lamelles à l’aide d’une pince à épiler et, après avoir égoutté doucement l’excès de solution Hoechst à l’aide de lingettes en papier minces, replacez les lamelles dans la plaque à 24 puits et lavez-les trois fois avec du PBS et une fois avec de l’eau déminéralisée (500 μL par lavage).
- Égouttez soigneusement l’excès d’eau déminéralisée à l’aide de lingettes minces et déposez délicatement chaque lamelle (côté cellule vers le bas) sur une goutte de 10 à 20 μL de solution de montage (voir le tableau des matériaux) repérée sur une lame de microscope pour l’immunofluorescence, en évitant la formation de bulles d’air.
REMARQUE : Le fluide de montage utilisé ici a le même indice de réfraction que l’huile d’immersion et durcit après quelques heures à RT ou pendant la nuit à 4 °C. Des solutions de montage non durcissantes peuvent être utilisées, mais il faut veiller à sceller la lamelle avec du vernis à ongles. - Retirez l’excès de solution d’enrobage par aspiration et laissez sécher les échantillons tout en les laissant reposer à plat à RT pendant la nuit dans l’obscurité, soit dans un porte-lames, soit recouverts d’une feuille d’aluminium.
3. Acquisition d’images
- Allumez le microscope confocal. Ouvrez le logiciel d’imagerie (voir Table des matériaux) pour démarrer la configuration de l’acquisition d’images.
- Dans l’onglet Fonction , sélectionnez l’objectif Plan-Apochromat 63x/1.4 Oil DIC M27 pour capturer les images à des fins d’analyse.
- Dans l’onglet Fonction d’acquisition , allumez les lasers appropriés dans la zone Laser du Panneau de configuration (Argon, Diode-405-30, DPSS 561-10 et HeNe633).
- Dans la zone Configuration de l’imagerie du Panneau de configuration, créez quatre pistes, chaque piste correspondant à un canal, pour effectuer une acquisition séquentielle.
- Définissez la résolution appropriée des images dans la fenêtre Mode d’acquisition . Définissez la résolution sur 1 024 x 1 024 (taille d’image) et sélectionnez une profondeur de bits de 16 bits.
- Pour chaque canal, ajustez la puissance et le gain du laser afin d’obtenir un bon signal sans pixels saturés, ce qui entraverait l’analyse de l’intensité de l’image. À l’aide du bouton Live, réglez le niveau de sortie laser et le gain (Master).
REMARQUE : L’utilisation de l’option d’indicateur de portée est recommandée pour la détection des pixels saturés. Maintenez la puissance du laser entre 1 % et 10 % et le gain (maître) en dessous de 850 pour éviter les bruits de fond. - Dans la zone Canaux du Panneau de configuration, réglez la même ouverture de sténopé pour chaque canal, en considérant 1 unité d’Airy (UA) pour le canal ayant la longueur d’onde la plus élevée.
- Acquérez 10 champs aléatoires contenant des quantités similaires de cellules (20 à 30 cellules par champ). L’acquisition de 100 à 200 cellules par condition fournira une bonne puissance pour l’analyse ultérieure de l’image.
4. Analyse d’images de la dispersion de l’ATG9A
- Téléchargez le logiciel FIJI à partir d’Internet (voir le tableau des matériaux). Ouvrez l’image avec FIJI en cliquant sur Plugins > Bio-Formats > BioFormats Importer.
- Cliquez sur Analyser > Définir les mesures, puis sélectionnez la valeur de gris moyenne dans la fenêtre des mesures pour l’analyse de l’intensité.
- Cliquez sur Image > Color > Split Channels, et séparez les canaux en trois images (marqueur Golgi, cytosquelette, signal ATG9A).
- Accédez à Image > Ajuster > seuil, puis définissez un seuil dans le canal correspondant au marqueur Golgi.
- Cliquez sur Modifier > sélection > Créer une sélection, puis créez une sélection à partir de l’image binaire.
- Accédez à Modifier > sélection > Ajouter au gestionnaire > Renommer (Golgi), enregistrez la sélection dans le gestionnaire de retour sur investissement et renommez-la Golgi.
- Cliquez sur Image > Ajuster > seuil, et définissez un seuil dans le canal correspondant au marqueur du cytosquelette pour définir le contour cellulaire.
- Accédez à Modifier > sélection > Créer une sélection, puis créez une sélection à partir de l’image binaire.
- Cliquez sur Modifier > sélection > Ajouter au gestionnaire > Renommer (Total), enregistrez la sélection dans le gestionnaire de retour sur investissement et renommez-la Total.
- Sélectionnez l’image correspondant à la coloration ATG9A.
- Dans Analyser > mesurer, appliquez le ROI Golgi en cliquant dessus, et mesurez l’intensité de la région de Golgi .
- Cliquez sur Analyser > mesurer, appliquez le ROI Total en cliquant dessus, et mesurez l’intensité de la région Total .
- Répétez la procédure dans toutes les images, enregistrez les résultats sous forme de fichiers .csv et traitez les données à l’aide de la formule suivante :
Taux de dispersion de l’ATG9A = Intensité de Golgi/Intensité totale
5. Imagerie de cellules vivantes de constructions ATG9A
- Semez HEK293A cellules (ou cellules de votre choix) dans 2 mL de milieu dans une boîte de culture tissulaire de 60 mm afin qu’elles atteignent ~65 %-70 % de confluence le lendemain ; Cela donne généralement 1 x 10 6-2 x 106 cellules.
- Le lendemain, préparez des mélanges lipofectamine :ADN (ou un autre réactif de transfection d’ADN approprié, voir le tableau des matériaux) comme suit :
- En fonction de l’efficacité de l’expression de la construction, diluer 0,5 à 2 μg d’ADN plasmidique dans 100 μL d’un milieu approprié sans sérum et mélanger doucement la solution en pipetant de haut en bas. Incuber le mélange pendant 5 min à RT.
REMARQUE : La construction de l’ADN plasmidique est spécifique à l’expérience. Les chercheurs peuvent soit cloner eux-mêmes, soit obtenir des auteurs sur demande. - Diluer le réactif de transfection Lipofectamine 2000 dans un rapport de 3 :1 Lipofectamine :ADN dans 100 μL d’un milieu sans sérum approprié et mélanger délicatement la solution en pipetant de haut en bas. Incubez ce mélange pendant 5 min à RT.
- Mélangez les deux solutions en pipetant doucement de haut en bas et en incubant pendant 20 minutes à RT.
- En fonction de l’efficacité de l’expression de la construction, diluer 0,5 à 2 μg d’ADN plasmidique dans 100 μL d’un milieu approprié sans sérum et mélanger doucement la solution en pipetant de haut en bas. Incuber le mélange pendant 5 min à RT.
- Ajoutez le mélange Lipofectamine :ADN à chaque plaque de culture cellulaire contenant 4 mL de milieu de culture, et balancez doucement la plaque d’avant en arrière pour répartir uniformément le mélange. Incuber les cellules à 37 °C dans un incubateur de culture cellulaire humidifié à 10 % de CO2.
- Remplacer le milieu par un milieu de culture frais 4 h après la transfection et incuber les cellules à 37 °C dans un incubateur de culture cellulaire humidifié à 10 % de CO2 pendant la nuit.
- Le lendemain, trypsiniser, compter et réensemencer les cellules sur des boîtes de culture adaptées à la microscopie de cellules vivantes (boîtes de culture avec une lamelle de verre n° 1,5, voir le tableau des matériaux). Semez 0,4 x 10 6-0,7 x 106 cellules sur les boîtes pour atteindre ~60%-75% de confluence sur la lamelle au moment de l’imagerie.
REMARQUE : Le revêtement avec de la poly-D-lysine, comme expliqué à l’étape 2.1, est recommandé pour les cellules HEK293A. - Le lendemain (48 h après la transfection), imagez les cellules.
6. Étude de l’état de glycosylation de l’ATG9A
- Semez HEK293A cellules (ou cellules de votre choix) dans une boîte de culture tissulaire de 10 cm afin qu’elles atteignent ~80 % de confluence le lendemain si vous prévoyez d’étudier l’ATG9A endogène, qui donne généralement 1,5 x 10 6-2,5 x 106 cellules dans 10 mL. Alternativement, ensemencez les cellules de manière à ce qu’elles atteignent ~65%-70% de confluence si la transfection des constructions ATG9A, ce qui donne généralement 1 x 10 6-1,5 x 106 cellules dans 10 mL.
- Traiter les cellules avec 100 μg/mL de cyclohexamide (CHX, voir le tableau des matériaux) ou le véhicule le lendemain. Incuber pendant 24 h (ou jusqu’à ce qu’il soit désiré).
- Retirez les cellules de l’incubateur, aspirez le milieu et placez-les sur de la glace. Remplacez-le par 5 mL de 1x PBS glacé. Détachez physiquement les cellules de la boîte à l’aide d’un racleur à cellules et pipetez la solution de cellules PBS dans un tube à fond conique de 15 mL. Centrifuger à 800 x g pendant 5 min à 4 °C pour granuler les cellules.
- Aspirer le surnageant et remettre les cellules en suspension dans ~100 μL (selon la taille de la pastille cellulaire) de tampon de lyse de TNTE glacé (1 % de Triton, 150 mM de NaCl, 20 mM de Tris-HCl, pH 7,4, 0,5 mM d’EDTA) complété par un cocktail d’inhibiteurs de protéase (voir le tableau des matériaux), et transférer dans un tube de microcentrifugation de 1,5 mL.
- Incuber le lysat sur de la glace pendant 15 min. Après cela, centrifugez le lysat à 20 000 x g pendant 10 min à 4 °C pour sédimenter les noyaux et les débris insolubles, puis transférez le surnageant dans un tube de microcentrifugation frais.
- Quantifier la concentration protéique du lysat à l’aide de la méthode Bradford20 et d’un spectrophotomètre capable de mesurer à une longueur d’onde de 595 nm.
- Normaliser les quantités de protéines et combiner 16 μL de lysat (ne contenant pas plus de 100 μg de protéines au total) avec 5 tampons PNGase F (peptide :N-glycosidase F) selon les instructions du fabricant avant d’ajouter 1 μL d’enzyme PNGase F (voir le tableau des matériaux). Incuber selon les instructions du fabricant de la PNGase F.
- Ajouter un volume de tampon d’échantillon 3x Laemmli pour obtenir une concentration 1x, et incuber à 65 °C pendant 5 min avant de charger pour l’électrophorèse à l’aide d’un gel de tris-acétate pour maximiser la séparation des protéines. Transférer les protéines du gel à une membrane appropriée (c.-à-d. PVDF [difluorure de polyvinylidène]) à l’aide des protocoles standard de transfert Western21 (voir le tableau des matériaux).
REMARQUE : L’ébullition des échantillons à 95 °C entraînera l’agrégation de l’ATG9A, réduisant ainsi la détection de l’ATG9A. - Réaliser le western blot à l’aide d’anticorps spécifiques pour l’ATG9A (anticorps STO-215, produit en interne1) (voir le tableau des matériaux). Laissez la section de poids moléculaire plus élevé de la membrane non coupée pour visualiser les espèces de poids moléculaire ATG9A plus élevé.
Résultats Représentatifs
L’ATG9A est une protéine transmembranaire associée à plusieurs compartiments membranaires intracellulaires 8,17,22,23,24. Dans les conditions basales, l’ATG9A est principalement localisé au niveau du réseau trans-Golgi (TGN), comme l’indiquent l’immunofluorescence de la protéine endogène et les chevauchements avec GM130, un marqueur cis-Golgi (Figure 1A), ainsi que dans les petites vésicules qui chevauchent partiellement le compartiment de recyclage endocytaire (ERC)23. La localisation d’ATG9A au niveau du Golgi peut être détectée à l’aide de différents protocoles d’immunofluorescence. Cependant, la fraction vésiculaire d’ATG9A, ainsi que son changement de localisation, en particulier l’augmentation du pool vésiculaire, en réponse à des stimuli spécifiques tels que la privation de nutriments et de sérum, peuvent être d’intensité très variable et difficiles à visualiser avec les approches d’imagerie conventionnelles. Le rapport entre l’ATG9A localisé au niveau du Golgi et l’ATG9A localisé à une fraction vésiculaire est appelé le taux de dispersion de l’ATG9A. Pour détecter les changements dans le taux de dispersion de l’ATG9A, par exemple lors d’un traitement EBSS, qui est utilisé pour épuiser à la fois le sérum et les acides aminés, un marqueur de Golgi tel que GM130 ou TGN46 et un marqueur du cytosquelette tel que la phalloïdine, qui colore le contour cellulaire25, sont utiles pour quantifier facilement la dispersion de l’ATG9A (Figure 1B). Il est important de noter que l’analyse du rapport de fluorescence moyen ne peut être interprétée que comme une mesure comparative entre les conditions plutôt que comme un taux fixe de dispersion. Le rapport entre les compartiments dépend fortement de facteurs biologiques et non biologiques tels que la lignée cellulaire utilisée, la qualité de la coloration ou les méthodes de seuillage appliquées (Figure 1B). Pour cette raison, le chercheur doit mettre en place un pipeline capable de détecter l’enrichissement de Golgi ATG9A dans leurs conditions expérimentales spécifiques, puis d’étendre l’analyse avec les mêmes paramètres à toutes les images de l’ensemble à analyser. Les images binaires représentatives et les zones sélectionnées pour l’analyse de la fluorescence moyenne de l’ATG9A sont présentées à titre indicatif à la figure 1B.
ATG9A abrite plusieurs domaines transmembranaires flanqués de deux domaines N- et C-terminaux relativement flexibles et non structurés, dont la séquence C-terminale englobe près de la moitié de la protéine12. Il est important de noter que le modèle de localisation de l’ATG9A surexprimé peut être influencé par l’extrémité de la protéine qui est marquée (Figure 2A). En particulier, lors de l’utilisation de systèmes d’expression transitoire et du marquage d’ATG9A directement sur son extrémité N-terminale avec un marqueur fluorescent (par exemple, eGFP, mRFP ou dérivés), sa localisation de Golgi peut être partiellement compromise, avec moins d’enrichissement observé dans des conditions basales (c’est-à-dire nourries), tandis que les vésicules ATG9A sont toujours facilement visibles (Figure 2A). Le marquage d’ATG9A sur son terminus C semble induire légèrement des clusters positifs GFP plus importants qui pourraient être agrégés. Enfin, une version monomère de mRFP-ATG9A montre également des amas fluorescents similaires de vésicules et une faible coloration de Golgi dans les cellules surexprimant (Figure 2A).
L’ATG9A se replie dans la membrane ER avant d’être acheminé vers les vésicules de Golgi et d’ATG9A. Au cours de son séjour dans le RE, l’ATG9A est modifié par des glycanes liés à l’azote sur l’asparagine 99, puis en atteignant le Golgi, il acquiert des glycanes complexes et matures liés à l’azote 1,14. Cette modification par glycosylation peut être détectée par western blot par l’apparition d’une double bande14. Conformément à sa localisation intracellulaire, la plupart des ATG9A endogènes abritent des glycanes complexes liés à l’azote et, par conséquent, la bande de poids moléculaire plus élevé est prédominante, avec une faible bande de poids moléculaire inférieur également visible (Figure 2B). La présence d’une double bande est plus facilement visible lors de l’utilisation de gels d’acétate de tris pour améliorer la résolution des protéines de poids moléculaire plus élevé (Figure 2B, témoin, t = 0). Lorsque la protéine endogène est soumise à un traitement par PNGase F (peptide :N-glycosidase F), qui élimine la plupart des glycanes complexes liés à l’azote, la protéine se présente sous la forme d’une seule bande (Figure 2B, PNGase F, t = 0). Par conséquent, l’état de glycosylation lié à l’azote de l’ATG9A peut être utilisé comme proxy pour surveiller la sortie de l’ATG9A du RE vers le Golgi, ce qui est reflété par le rapport relatif entre les deux bandes.
Lors de la construction transitoire de mRFP-ATG9A, la protéine surexprimée s’accumule d’abord dans le RE, potentiellement parce que la machinerie de trafic est incapable de se replier et de trafiquer tout l’ATG9A, et que la bande de poids moléculaire inférieure est prédominante (Figure 2C, témoin t = 0). Notamment, après 24 h d’expression de mRFP-ATG9A, il y a une distribution à peu près égale entre les bandes supérieure et inférieure, ce qui suggère que le pool mRFP-ATG9A se déplace dans le Golgi (Figure 2C, Contrôle, t = 24). Si les cellules sont traitées avec du cycloheximide (CHX), qui bloque la synthèse protéique de novo 26, le repliement et la sortie de l’ATG9A du RE peuvent être clarifiés. Comme la protéine endogène est repliée, glycosylée et résidente dans le Golgi, le traitement par CHX ne modifie pas de manière significative le rapport entre les bandes de poids moléculaire inférieur et supérieur (Figure 2B, Contrôle). Cependant, en utilisant l’expression transitoire de mRFP-ATG9A, le traitement CHX favorise l’accumulation de la bande de poids moléculaire plus élevé (Figure 2C, Contrôle, CHX t = 24). La bande mRFP-ATG9A surexprimée de poids moléculaire plus élevé s’effondre dans la bande inférieure après traitement par la PNGase F (Figure 2C, PNGase F, t = 24). Ces données montrent que la protéine endogène acquiert rapidement des glycanes matures, comme en témoigne la prédominance de la bande de poids moléculaire plus élevé, et que la poursuite de CHX n’affecte pas le rapport des bandes doubles (Figure 2B). Dans le cas d’une surexpression transitoire de mRFP-ATG9A, le traitement CHX induit l’accumulation de la bande supérieure, ce qui indique que des glycanes plus matures sont acquis lorsque le pool RE se replie et sort du RE vers le Golgi (Figure 2C).
L’ajout d’un linker entre la séquence ATG9A et les marqueurs fluorescents peut être utile pour favoriser une localisation et un trafic plus physiologiques de la protéine. La fusion d’une séquence 3x-FLAG (24 acides aminés) entre un fluorophore N-terminal et ATG9A aide la protéine surexprimée à se comporter de manière similaire à la protéine endogène (Figure 3). En effet, la surexpression de mCherry-3xFLAG-ATG9A colocalise avec le marqueur de Golgi GM130 dans des conditions d’alimentation (Figure 3A). Il est important de noter que cette localisation et le compartiment vésiculaire de l’ATG9A sont préservés dans le temps, ce qui permet l’étude spatio-temporelle du trafic de l’ATG9A (Figure 3B).
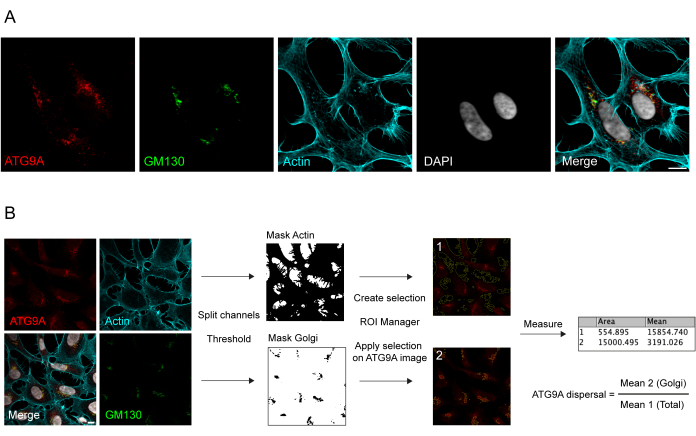
Figure 1 : Analyse d’images de la localisation endogène de l’ATG9A. (A) Image d’immunofluorescence représentative de l’ATG9A endogène (rouge), du GM130 comme marqueur de Golgi (vert) et de la phalloïdine pour visualiser le cytosquelette d’actine (cyan). Barre d’échelle = 10 μm. (B) Flux de travail de l’analyse de l’image pour déterminer la fraction d’ATG9A endogène qui se localise dans la zone de Golgi. Barre d’échelle = 10 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
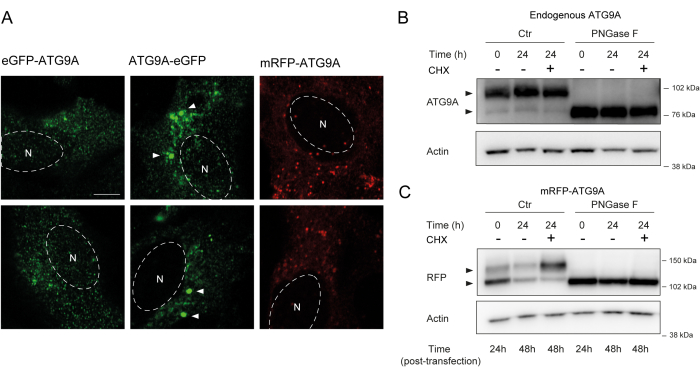
Figure 2 : Analyse des constructions d’ATG9A marquées par fluorescence par localisation et glycosylation. (A) L’ATG9A marqué par N-terminal eGFP est moins localisé au niveau du Golgi et réside principalement dans les vésicules. L’ATG9A marqué par l’eGFP C-terminal présente des agrégats à l’intérieur de la cellule (certains exemples sont marqués par des pointes de flèche blanches ; l’eGFP-ATG9A et l’ATG9A-eGFP sont en vert). L’ATG9A marqué par le point N mRFP est moins localisé au niveau du Golgi et réside principalement dans les vésicules. N indique l’emplacement approximatif du noyau de la cellule, et le mRFP-ATG9A est en rouge. Barre d’échelle = 5 μm. (B) L’ATG9A endogène se présente sous la forme de deux bandes lorsqu’il est analysé par western blot (pointes de flèche) : une bande supérieure (glycanes complexes liés à l’azote) et une bande inférieure (pas de glycanes matures liés à l’azote). Le traitement par cyclohexamide (CHX) n’affecte pas le rapport entre les bandes supérieure et inférieure. Le traitement par la PNGase F entraîne la disparition de la bande supérieure. (C) Après la transfection transitoire d’ATG9A marqué par mRFP dans HEK293A cellules, deux bandes proéminentes sont visibles sur le western blot (pointes de flèche). Le traitement par la PNGase F entraîne la disparition de la bande supérieure. Le traitement par CHX après la transfection entraîne une augmentation de la glycosylation car le pool d’ATG9A transfecté est acheminé du RE vers le Golgi. Veuillez cliquer ici pour voir une version agrandie de cette figure.
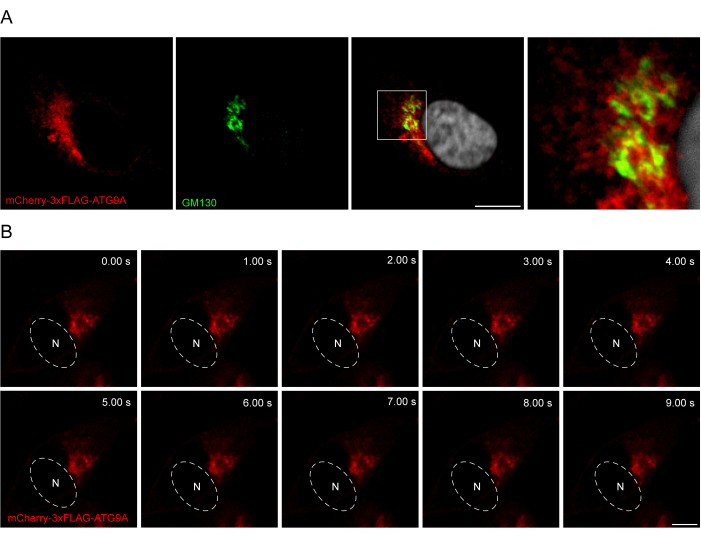
Figure 3 : Analyse de la localisation de mCherry-3xFLAG-ATG9A par immunofluorescence et imagerie en direct. (A) Expériences d’immunofluorescence de cellules HEK293A surexprimant transitoirement mCherry-3xFLAG-ATG9A et colorées avec le marqueur de Golgi GM130. Barre d’échelle = 10 μm. Le mCherry-3xFLAG-ATG9A est en rouge et le marqueur GM130 Golgi est en vert. (B) Montage d’expériences d’imagerie en direct dans des cellules HEK293A surexprimant transitoirement mCherry-3xFLAG-ATG9A. N indique l’emplacement approximatif du noyau. Délai = 1 ips. Barre d’échelle = 10 μm. Le mCherry-3xFLAG-ATG9A est en rouge. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Cette étude illustre les différents outils qui peuvent être utilisés pour étudier la localisation de l’ATG9A. Tout d’abord, cette étude décrit comment l’ATG9A peut être visualisé par immunofluorescence et comment cela peut être quantifié. Deuxièmement, les stratégies qui peuvent être utilisées pour marquer ATG9A avec un marqueur fluorescent pour la visualisation dans des cellules fixes ou vivantes sont comparées. Enfin, ce travail décrit comment étudier et utiliser l’état de glycosylation de l’ATG9A pour déterminer si l’ATG9A est sorti de l’urgence et a traversé le Golgi.
En ce qui concerne la caractérisation de la localisation endogène de l’ATG9A par immunofluorescence, il faut être attentif aux méthodes de fixation et de perméabilisation employées pour l’expérience. Selon les procédures standard décrites ici, la fixation du paraformaldéhyde couplée à la perméabilisation de la digitonine sont de bonnes conditions pour visualiser à la fois les vésicules ATG9A et ATG9A positives associées à Golgi7. En plus de la fixation et de la perméabilisation, le moment de l’incubation avec la solution d’anticorps primaire est également critique. Nous avons observé, mais non documenté, que des concentrations plus élevées de solution d’anticorps primaires et des temps d’incubation plus longs peuvent conduire à une augmentation faussement représentative de la coloration de Golgi de l’ATG9A, ce qui finit par compromettre la détection de la redistribution de l’ATG9A à d’autres compartiments membranaires. De plus, étant donné que l’ATG9A est présent dans de nombreux compartiments intracellulaires 1,13,17,22,23,24,27,28, il est important d’utiliser des marqueurs membranaires spécifiques, ainsi que l’ATG9A, pour identifier où se trouve l’ATG9A. Plusieurs approches ont été utilisées dans le passé pour quantifier la localisation de l’ATG9A, y compris le coefficient de corrélation de Pearson pour la colocalisation29. Cependant, le chevauchement partiel de l’ATG9A avec le Golgi et le compartiment vésiculaire distinct conduit à un nombre élevé de valeurs aberrantes de pixels, ce qui peut biaiser l’interprétation du coefficient de corrélation. Pour cette raison, une approche plus simpliste basée sur le rapport de la fluorescence moyenne dans les deux compartiments à analyser est préférable, et cette approche est moins sensible à la variabilité cellule par cellule. Pour plus d’informations sur l’analyse d’images par microscopie, les lecteurs sont invités à consulter le chapitre30 de ce livre.
Lors de l’étude de l’état de glycosylation de l’ATG9A, le choix des gels pour l’exécution des Western blots est important. Pour ce protocole, les gels d’acétate de tris à 3 % à 8 % sont préférés car ils offrent la résolution la plus élevée pour les protéines plus grosses, mais des compositions de gel alternatives ou des tampons de fonctionnement qui offrent une bonne séparation des protéines de haut poids moléculaire peuvent également être utilisés. L’expérimentateur peut assurer la séparation maximale des protéines en augmentant le temps d’électrophorèse.
Lors de la préparation des échantillons pour visualiser l’ATG9A sur le western blot, il faut veiller à ne pas faire bouillir les échantillons après l’ajout du tampon de Laemmli ; L’ébullition à 95 °C induit la formation d’agrégats d’ATG9A et, par conséquent, l’ATG9A ne migre pas efficacement dans le gel1. Il est recommandé de chauffer les échantillons à 65 °C pendant 5 min27.
Des niveaux élevés de transfection conduisent généralement à une accumulation plus élevée d’ATG9A dans le RE, tandis que des niveaux d’expression modérés aident à la localisation physiologique de la protéine. De manière anecdotique, les temps d’incubation de 72 h au lieu de 48 h aident souvent à réduire les artefacts de localisation des urgences. Notamment, mRFP-ATG9A peut rendre compte avec précision du trafic et de la fonction d’ATG9A si les niveaux sont contrôlés par des niveaux d’expression ou en utilisant des lignées cellulaires stables 8,9,22,27.
L’échec d’une population d’ATG9A surexprimée à acquérir des glycanes matures liés à l’azote peut être utilisé comme une lecture du trafic perturbé d’ATG9A. Lors de la mutation ou de la suppression de certaines régions d’ATG9A, il existe un risque d’augmentation de la rétention du RE, ce qui peut entraîner l’échec de l’acquisition de glycanes matures liés à l’azote et, par conséquent, une bande ATG9A à migration plus rapide sur le transfert Western. Les chercheurs travaillant avec des constructions ATG9A tronquées doivent vérifier la rétention du RE, les états de glycosylation et la localisation de Golgi.
Pour l’imagerie des cellules vivantes de l’ATG9A, un microscope Airyscan, s’appuyant sur la fonction rapide Airyscan, fournit une résolution optimale d’environ 120 nm. Pour la précision de la localisation, des fréquences d’images d’environ 1 à 2 images par seconde (ips) en mode super-résolution sont optimales en fonction du nombre de canaux imagés. Des microscopes confocaux similaires qui peuvent imager à grande vitesse peuvent également être utilisés pour l’imagerie des vésicules ATG9A ; Cependant, il convient de noter que la vitesse d’imagerie peut affecter directement la détection des événements et, par conséquent, affecter l’interprétation des données.
En résumé, les protocoles présentés décrivent des moyens de quantifier et de caractériser la localisation de l’ATG9A par immunofluorescence, microscopie sur cellules vivantes et son statut de glycosylation. Ces protocoles peuvent aider les chercheurs qui travaillent avec l’ATG9A et aider à éviter certains pièges.
Déclarations de divulgation
S.A.T. siège au conseil consultatif scientifique de Casma Therapeutics.
Remerciements
Les auteurs remercient Rocco D’Antuono pour la relecture de certains aspects du manuscrit, ainsi que tous les membres actuels et passés du laboratoire de biologie cellulaire moléculaire de l’autophagie (MCBA) pour les discussions qui ont conduit à l’affinement de ces protocoles. A. v.V., S.D.T., E.A., S.A.T, ont été soutenus par l’Institut Francis Crick qui reçoit son financement de base de Cancer Research UK (CC2134), du Conseil de la recherche médicale du Royaume-Uni (CC2134). Cette recherche a été financée en tout ou en partie par le Wellcome Trust (CC2134). Aux fins du libre accès, l’auteur a appliqué une licence de droit d’auteur public CC BY à toute version de manuscrit acceptée par l’auteur découlant de cette soumission.
matériels
| Name | Company | Catalog Number | Comments |
| 24 multiwell plates | Falcon | 353047 | For tissue culture |
| 35 mm Dish | No. 1.5 Coverslip | 14 mm Glass Diameter | Uncoated | MATTEK | P35G-1.5-14-C | Cell culture dish for live-cell microscopy |
| 4x Laemmli Sample Buffer | Bio-Rad | 1610747 | |
| 60 mm tissue culture dish | Thermofischer Scientific | 10099170 | For tissue culture |
| Alexa Fluor 647 Phalloidin | Thermofischer Scientific | A22287 | Actin stain |
| anti-ATG9A antibody | home made | STO-215 | Rabbit anti N-terminal peptide ATG9A |
| anti-Rabbit IgG, peroxidase-linked | Invitrogen | 10794347/NA934-1ml | Secondary antibody for rabbit polyclonal STO-215 |
| anti-RFP antibody | Evrogen | AB233 | for Western Blot |
| ATG9A Monoclonal Antibody (14F2 8B1), Invitrogen | Invitrogen | 15232826 | Antibody for immunofluorescence |
| ATG9A-eGFP | home made | Construct which expresses tagged ATG9A | |
| Bemis Parafilm | Thermofischer Scientific | 11747487 | self-sealing thermoplastic film |
| Bio-Rad Protein Assay Dye Reagent Concentrate | Bio-Rad | 5000006 | For determining protein concentration |
| Bovine serum albumin (BSA) | Merck | 10735086001 | For blocking non-specific labelling |
| CaCl2.2H2O | / | For PBS and EBSS | |
| cOmplete Protease Inhibitor Cocktail | Roche | 11697498001 | Supplement in lysis buffer to prevent protein degradation |
| Cy3 AffiniPure Goat Anti-Armenian Hamster IgG | Jackson ImmunoResearch | 127-165-099 | Secondary antibody for i14F2 8B1 antibody for mmunofluorescence |
| Cyclohexamide | Sigma Aldrich | 66-81-9 | To stop protein translation |
| D-Glucose | / | For EBSS | |
| Digitonin | Merck | 300410 | For permeabilizing cells |
| DMEM | Merck | D6546-6x500ml | For tissue culture |
| eGFP-ATG9A | home made | Construct which expresses tagged ATG9A | |
| Fetal Bovine Serum | Gibco | 10270-106 | Supplement for DMEM for cell culture |
| FIJI (ImageJ) | / | https:/fiji.sc/ | Open source image analysis software |
| Hoechst | Thermofischer Scientific | H3570 | Stains the nucleus |
| KCl | / | For EBSS | |
| L-glutamine | Sigma | 67513 | For tissue culture |
| Lipofectamine 2000 | Invitrogen | 11668-019 | For Cell Transfection |
| LSM880 Airyscan microscope | Zeiss | / | Confocal microscopy |
| MgCl2 | / | For PBS | |
| MgSO4.7H2O | / | For EBSS | |
| Mowiol mounting solution | Millipore | 475904 | for permanent mounting glass coverslips |
| NaCl | / | For EBSS | |
| NaH2PO4.2H2O | / | For EBSS | |
| NaHCO3 | / | For EBSS | |
| NuPAGE 3 to 8%, Tris-Acetate, 1.5 mm, Mini Protein Gels | Thermofischer Scientific | EA0378BOX | for Western Blotting |
| NuPAGE MES SDS Running Buffer (20x) | Life Tech | NP0002 | for Western Blotting |
| Opti-MEM I Reduced Serum Medium | Thermo | 31985062 | For Cell Transfection |
| Paraformaldehyde | Agar Scientific | R1026 | For fixing cells |
| pcDNA3.1-mCherry-3xFlag-ATG9A | home made | Construct which expresses tagged ATG9A | |
| Phosphate Buffered Saline (PBS) | / | For tissue culture | |
| PNGaseF | NEB | P0710S | To remove N-linked glycans |
| Poly-D-lysine hydrobromide mol wt 70,000-150,000 | Merck | P0899 | For coating coverslips |
| Rapid PNGase F enzyme | NEB | P07105 | To remove N-linked glycans |
| RFP-ATG9A | home made | Construct which expresses tagged ATG9A | |
| Triton X-100 | Thermofischer Scientific | 13454259 | Detergent for Cell lysis |
| Trypsin-EDTA solution | Sigma | T4049 | For tissue culture |
| Whatman Filter Paper | Merck | WHA1001325 | For Western Blot and IF |
| XCell SureLock Mini-Cell Electrophoresis System | Invitrogen | EI0001 | For Western Blotting |
| Zen Black edition | Zeiss | / | Used to operate the LSM 880 |
Références
- Young, A. R., et al. Starvation and ULK1-dependent cycling of mammalian Atg9 between the TGN and endosomes. Journal of Cell Science. 119, 3888-3900 (2006).
- Maeda, S., et al. lipid scrambling activity and role in autophagosome formation of ATG9A. Nature Structural & Molecular Biology. 27 (12), 1194-1201 (2020).
- Matoba, K., et al. Atg9 is a lipid scramblase that mediates autophagosomal membrane expansion. Nature Structural & Molecular Biology. 27 (12), 1185-1193 (2020).
- Mercer, T. J., Gubas, A., Tooze, S. A. A molecular perspective of mammalian autophagosome biogenesis. Journal of Biological Chemistry. 293 (15), 5386-5395 (2018).
- Yamamoto, H., Zhang, S., Mizushima, N. Autophagy genes in biology and disease. Nature Reviews: Genetics. , (2023).
- Sawa-Makarska, J., et al. Reconstitution of autophagosome nucleation defines Atg9 vesicles as seeds for membrane formation. Science. 369 (6508), (2020).
- Melia, T. J., Lystad, A. H., Simonsen, A. Autophagosome biogenesis: From membrane growth to closure. Journal of Cell Biology. 219 (6), 202002085 (2020).
- Orsi, A., et al. Dynamic and transient interactions of Atg9 with autophagosomes, but not membrane integration, are required for autophagy. Molecular Biology of the Cell. 23 (10), 1860-1873 (2012).
- Judith, D., et al. ATG9A shapes the forming autophagosome through Arfaptin 2 and phosphatidylinositol 4-kinase IIIbeta. Journal of Cell Biology. 218 (5), 1634-1652 (2019).
- Karanasios, E., et al. Autophagy initiation by ULK complex assembly on ER tubulovesicular regions marked by ATG9 vesicles. Nature Communications. 7, 12420 (2016).
- Koyama-Honda, I., Itakura, E., Fujiwara, T. K., Mizushima, N. Temporal analysis of recruitment of mammalian ATG proteins to the autophagosome formation site. Autophagy. 9 (10), 1491-1499 (2013).
- Guardia, C. M., et al. Structure of human ATG9A, the only transmembrane protein of the core autophagy machinery. Cell Reports. 31 (13), 107837 (2020).
- Soreng, K., et al. SNX18 regulates ATG9A trafficking from recycling endosomes by recruiting Dynamin-2. EMBO Reports. 19 (4), e44837 (2018).
- Staudt, C., Gilis, F., Boonen, M., Jadot, M. Molecular determinants that mediate the sorting of human ATG9A from the endoplasmic reticulum. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 1863 (9), 2299-2310 (2016).
- Knaevelsrud, H., Carlsson, S. R., Simonsen, A. SNX18 tubulates recycling endosomes for autophagosome biogenesis. Autophagy. 9 (10), 1639-1641 (2013).
- Takahashi, Y., et al. The Bif-1-Dynamin 2 membrane fission machinery regulates Atg9-containing vesicle generation at the Rab11-positive reservoirs. Oncotarget. 7 (15), 20855-20868 (2016).
- Imai, K., et al. Atg9A trafficking through the recycling endosomes is required for autophagosome formation. Journal of Cell Science. 129 (20), 3781-3791 (2016).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- van Vliet, A. R., et al. ATG9A and ATG2A form a heteromeric complex essential for autophagosome formation. Molecular Cell. 82 (22), 4324-4339 (2022).
- Kielkopf, C. L., Bauer, W., Urbatsch, I. L. Bradford assay for determining protein concentration. Cold Spring Harbor Protocols. 2020 (4), 102269 (2020).
- Kurien, B. T., Scofield, R. H. Validating antibody specificities for immunohistochemistry by protein blotting. Methods in Molecular Biology. 2593, 21-33 (2023).
- Lamb, C. A., et al. TBC1D14 regulates autophagy via the TRAPP complex and ATG9 traffic. EMBO Journal. 35 (3), 281-301 (2016).
- Longatti, A., et al. TBC1D14 regulates autophagosome formation via Rab11- and ULK1-positive recycling endosomes. Journal of Cell Biology. 197 (5), 659-675 (2012).
- Ravussin, A., Brech, A., Tooze, S. A., Stenmark, H. The phosphatidylinositol 3-phosphate-binding protein SNX4 controls ATG9A recycling and autophagy. Journal of Cell Science. 134 (3), (2021).
- DesMarais, V., Eddy, R. J., Sharma, V. P., Stone, O., Condeelis, J. S. Optimizing leading edge F-actin labeling using multiple actin probes, fixation methods and imaging modalities. BioTechniques. 66 (3), 113-119 (2019).
- Ennis, H. L., Lubin, M. Cycloheximide: Aspects of inhibition of protein synthesis in mammalian cells. Science. 146 (3650), 1474-1476 (1964).
- Webber, J. L., Tooze, S. A. Coordinated regulation of autophagy by p38alpha MAPK through mAtg9 and p38IP. EMBO Journal. 29 (1), 27-40 (2010).
- Claude-Taupin, A., et al. ATG9A protects the plasma membrane from programmed and incidental permeabilization. Nature Cell Biology. 23 (8), 846-858 (2021).
- Aaron, J. S., Taylor, A. B., Chew, T. L. Image co-localization - Co-occurrence versus correlation. Journal of Cell Science. 131 (3), 211847 (2018).
- D'Antuono, R., Nechyporuk-Zloy, V. Basic digital image acquisition, design, processing, analysis, management, and presentation. Principles of Light Microscopy: From Basic to Advanced. , 77-104 (2022).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon