Examen histologique de la morphologie mitochondriale dans un modèle de maladie de Parkinson
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Cette étude présente une méthode d’analyse de la morphologie des mitochondries basée sur l’immunomarquage et l’analyse d’images dans le tissu cérébral de souris in situ. Il décrit également comment cela permet de détecter les changements dans la morphologie mitochondriale induits par l’agrégation des protéines dans les modèles de la maladie de Parkinson.
Résumé
Les mitochondries jouent un rôle central dans le métabolisme énergétique des cellules, et leur fonction est particulièrement importante pour les neurones en raison de leur forte demande énergétique. Par conséquent, le dysfonctionnement mitochondrial est une caractéristique pathologique de divers troubles neurologiques, y compris la maladie de Parkinson. La forme et l’organisation du réseau mitochondrial sont très plastiques, ce qui permet à la cellule de répondre aux signaux et aux besoins environnementaux, et la structure des mitochondries est également étroitement liée à leur santé. Ici, nous présentons un protocole pour étudier la morphologie mitochondriale in situ basé sur l’immunomarquage de la protéine mitochondriale VDAC1 et l’analyse d’images ultérieure. Cet outil pourrait être particulièrement utile pour l’étude des maladies neurodégénératives car il peut détecter des différences subtiles dans le nombre et la forme des mitochondries induites par des agrégats de α-synucléine, une protéine sujette à l’agrégation fortement impliquée dans la pathologie de la maladie de Parkinson. Cette méthode permet de rapporter que les neurones dopaminergiques de la substantia nigra pars compacta hébergeant des lésions pS129 présentent une fragmentation mitochondriale (comme le suggère leur rapport d’aspect réduit, AR) par rapport à leurs neurones voisins sains dans un modèle de Parkinson à injection intracrânienne fibrillaire préformé.
Introduction
Le système nerveux central a une demande intense d’ATP : les neurones utilisent l’ATP pour soutenir les gradients ioniques, la synthèse des neurotransmetteurs, la mobilisation, la libération et le recyclage des vésicules synaptiques, et pour permettre la traduction et la dégradation locales des protéines. Plus de 95 % de l’ATP utilisé par le cerveau est produit par les mitochondries1. Il n’est donc pas surprenant que le dysfonctionnement mitochondrial soit particulièrement nocif pour les neurones. En fait, les déficiences de la fonction mitochondriale jouent un rôle important dans plusieurs maladies neurologiques, y compris les maladies neurodégénératives, telles que la maladie de Parkinson (MP) et la maladie d’Alzheimer (MA)2,3.
De multiples gènes sont sans équivoque liés à des protéines codant pour la qui sont pertinentes pour la fonction mitochondriale et l’homéostasie, telles que Parkin 4,5,6, PTEN-induced kinase 1 (PINK1)7,8 et DJ-19. D’autres preuves d’un rôle du dysfonctionnement mitochondrial dans la MP sont que les traitements avec des inhibiteurs du complexe I de la chaîne de transport d’électrons mitochondriale (tels que la roténone et le MPTP) récapitulent plusieurs aspects de la MP in vitro et in vivo10. Cependant, il est important de préciser que de nombreux processus pathologiques peuvent entraîner une perte neuronale dans la MP, ainsi que des déficits mitochondriaux : le stress oxydatif, l’altération de l’homéostasie calcique, l’échec de l’ubiquitine-protéasome et des systèmes autophagie-lysosomal, et l’agrégation des protéines sont parmi les plus étudiés (examinés en 11,12,13 et).
Les mitochondries sont de forme hétérogène : en plus des unités individuelles, on les trouve généralement sous forme de réseaux réticulaires et tubulaires étendus. La structure et l’emplacement cellulaire des mitochondries sont essentiels à leur fonction14 ; En fait, les réseaux mitochondriaux sont extrêmement dynamiques, subissant de fréquents processus de fission, de fusion et de mitophagie afin de répondre aux besoins des cellules et de répondre aux signaux environnementaux15,16. De plus, la morphologie des mitochondries est intimement liée à leur état de santé. Par exemple, dans l’atrophie optique humaine, les mutations génétiques qui réduisent l’activité mitochondriale conduisent à des mitochondries anormales, minces et hyperfusionnées17. D’autre part, une variété de maladies humaines présentent une morphologie mitochondriale aberrante, y compris la fragmentation mitochondriale ou la fusion mitochondriale excessive, qui ont des effets néfastes sur la fonction mitochondriale (examiné dans18). Dans le contexte de la MP, nous avons déjà montré avec d’autres que la forme anormale des mitochondries est corrélée à un dysfonctionnement en réponse aux agrégats de α-synucléine19. Bien que la morphologie mitochondriale ait été largement étudiée in vitro dans le contexte de la MP et d’autres maladies 20,21,22, il n’existe pas de protocoles pour l’évaluation de la morphologie mitochondriale à partir de coupes in vivo. Cela rend l’étude in vivo des mitochondries dans le contexte de maladies telles que la MP fortement dépendante des animaux transgéniques23 ou de l’évaluation d’extraits de mésencéphale qui ne peuvent pas fournir de résolution cellulaire.
Ici, un protocole est présenté pour étudier la morphologie mitochondriale in situ comme indicateur de leur état fonctionnel et de leur santé, basé sur l’immunomarquage de la protéine mitochondriale VDAC124 suivi d’une analyse d’images dans des coupes de tissus enrobés de paraffine. Nous montrons également les résultats de ce protocole dans des modèles de MP in vitro et in vivo : cellules de neuroblastome surexprimant la SNCA (Synucléine Alpha) et tissu cérébral de souris soumises à une injection intracrânienne de fibrilles préformées de α-synucléine (PFF). La co-immunocoloration avec un anticorps contre la α-synucléine (dans les cellules) ou la phosphoSer129-α-synucléine pS129 (dans le cerveau de souris) nous a permis d’identifier des cellules présentant une pathologie protéique agrégée (fibrilles de α-synucléine et de α-synucléine surexprimées, respectivement) dans les échantillons, tandis que les cellules négatives servaient de contrôle non pathologique dans les mêmes échantillons. Grâce à cette analyse et aux données décrites ici, un rapport d’aspect réduit a été observé, indiquant la fragmentation des mitochondries dans les cellules surexprimant le SNCA ou présentant des lésions pS129.
Protocole
Toutes les procédures décrites dans cette section ont été effectuées conformément au cadre éthique fourni par l’Université du Pays Basque Référence M20/2022/212, le Gouvernement du Pays Basque, le Gouvernement espagnol et l’Union européenne.
1. Analyse de la morphologie mitochondriale dans les cellules SH-SY5Y surexprimant le SNCA
NOTE : Ici, une brève description de la génération du matériel in vitro pour l’étude, qui servira de comparaison pour les résultats obtenus in situ , est fournie. Il est recommandé d’effectuer ce type d’analyse avant de lancer une expérience in vivo pour la morphologie mitochondriale, car cela permettra de s’assurer que toutes les installations d’imagerie et d’analyse appropriées sont en place.
- Pour augmenter la fixation cellulaire et faciliter l’adhésion cellulaire sur des plaques optiques plates à 96 puits, ajouter 25 μL/puits de matrice de revêtement 1:1000 dans le DMEM F12 par pipetage (voir le tableau des matériaux). Incuber les plaques pendant 1 h à 37 °C et 5% de CO2.
- Compartissez SH-SY5Y en utilisant la chambre Neubauer. Retirez la matrice d’enrobage par pipetage et ensemencez 10 000 cellules/puits sur la plaque revêtue à 96 puits dans 50 μL/puits de DMEM F-12 complété par 10 % de FBS, 2 mM de glutamine et de la pénicilline/streptomycine (voir le tableau des matériaux).
- Incuber les cellules à 37 °C et 5 % de CO2pendant 24 h.
- Préparez un mélange de 250 ng d’ADNpc3.1 transportant du SNCA de type sauvage humain, 0,250 μL de réactif de transfection, 0,250 L d’adjuvant de transfection et un milieu de transfection jusqu’à 50 μL pour chaque puits (voir le tableau des matériaux). Préparez une solution maîtresse en tenant compte du nombre total de puits dans l’expérience.
- Retirer le milieu de culture par pipetage manuel et ajouter 50 μL/puits de la solution préparée à l’étape 1.4 par pipetage. Incuber à 37 °C, 5% CO2.
- h après la transfection, prélever le milieu de transfection par pipetage et ajouter 25 μL/puits de paraformaldéhyde (PFA) à 4 % dans du PBS.
ATTENTION : Le paraformaldéhyde est un fixateur toxique ; utiliser l’EPI approprié. - Incuber 5 min à température ambiante (R.T). Retirer la solution de fixation par pipetage et laver une fois en ajoutant 50 μL/puits de PBS. Éliminer le PBS par pipetage.
- Pipeter 25 μL/puits de TBS avec 0,05 % de Tween (TBS-T) et 10 % de sérum d’âne normal (NDS, voir le tableau des matériaux). Incuber pendant 1 h à R.T. pour bloquer tout signal non spécifique.
- Préparer une solution d’anticorps anti-α-synucléine de lapin MJFR1 1:1000 avec l’anticorps anti-TOMM20 de souris 1:100 dans TBS-T (voir Tableau des matériaux) en fonction du nombre de puits à analyser.
- Retirer la solution bloquante de l’étape 1.8 par pipetage et ajouter 25 μL/puits du mélange d’anticorps primaires préparé à l’étape 1.9. Incuber toute la nuit à 4 °C.
- Retirer la solution d’anticorps primaire et laver trois fois en ajoutant et en retirant 50 μL/puits de TBS-T par pipetage.
- Préparer une solution d’anticorps secondaire vert anti-souris 1:1000 avec anticorps secondaire rouge anti-lapin 1:1000 dans TBS-T (voir tableau des matériaux) en fonction du nombre de puits à analyser.
- Après avoir aspiré le PBS du dernier lavage décrit à l’étape 1.11, ajouter 25 μL/puits du mélange d’anticorps secondaires à l’aide d’une pipette et incuber la plaque pendant 1 h à R.T.
- Retirer la solution secondaire d’anticorps par pipetage et ajouter 25 μL/puits de 2 g/mL de DAPI dans le TBS-T. Incuber la plaque pendant 5 min à R.T.
- Retirer la solution de DAPI à l’aide d’une pipette et laver trois fois en ajoutant et en retirant 50 μL/puits de TBS-T à l’aide d’une pipette.
- Pipeter 80 μL/puits de PBS avec 0,02 % d’azoture de sodium et stocker la plaque à 4 °C.
ATTENTION : L’azoture de sodium est toxique ; utiliser l’EPI approprié. - Capturez des images à l’aide d’un microscope à fluorescence automatisé à haut contenu ou d’un système d’imagerie confocal équivalent équipé d’un objectif 60x (voir Tableau des matériaux).
- Effectuez une analyse du signal TOMM20 de cellules individuelles à l’aide de Fidji en suivant les étapes 3.15-3.21. Évitez toute cellule subissant l’apoptose, la nécrose ou la mitose.
NOTE : Pour ce faire, nous excluons de l’analyse les cellules présentant les caractéristiques morphologiques de l’apoptose, de la nécrose ou de la mitose qui sont visibles au microscope, telles que le rétrécissement cellulaire, la bulle membranaire, le détachement cellulaire, la condensation nucléaire, la fragmentation de l’ADN et la chromatine nucléaire condensée organisée en brins épais alignés dans un seul plan.
2. La génération de PFF et d’injections intracrâniennes PFF chez la souris
NOTE : La génération du matériel d’injection et le processus d’injection intracrânienne sont présentés ici. Ce protocole est adapté de Luk et al.25.
- Pour obtenir des PFF, placer un tube/flacon contenant 0,5 mL de α-Syn (5 mg/mL ; Peptide, voir tableau des matières) sur un agitateur à 37 °C et 250 tr/min pendant 7 jours pour induire l’agrégation de α-synucléine.
- Sonicer la α-synucléine agrégée à 20 % d’amplitude et 0,25 cycle jusqu’à ce qu’une fragmentation optimale soit atteinte et observée par coloration négative des échantillons par microscopie électronique à transmission.
- Pour préparer les souris C57Bl/6 mâles et femelles de type sauvage (âgées de 3 mois) à recevoir des injections de PFF striatale, administrer Meloxicam/Metacam (5 mg/kg) dans une solution saline par voie sous-cutanée. Administrer également 1 mL de solution saline stérile par deux injections sous-cutanées de 0,5 mL par animal. Ces traitements préviennent la déshydratation, l’inflammation et la douleur.
- Induire une anesthésie avec 4 % d’isoflurane et 0,7 L/min d’O2 dans une chambre d’induction. Vérifiez la profondeur de l’anesthésie par l’absence de réponse de la pédale.
- Rasez la partie supérieure de la tête de la souris et insérez doucement l’animal dans le cadre de l’appareil stéréotaxique sur un tapis chauffant.
- Maintenir le plan anesthésique en administrant une anesthésie par inhalation animale (1 % à 2 % d’isoflurane dans 0,7 L/minO2) à travers un masque facial pendant tout le processus d’injection.
- Placez l’animal sur le cadre stéréotaxique. Désinfectez la zone opératoire avec trois cycles alternés de gommage à la chlorhexidine et d’éthanol à 70 %. Appliquer la marcaïne/bupivacaïne localement (environ 100 μL) en infiltration sous-cutanée de 0,25 %.
- Effectuez une incision de 0,5 cm de la peau pour exposer le crâne et percez un trou de 1 mm de diamètre dans le crâne pour exposer la surface du cerveau, aux coordonnées suivantes de Bregma : - 0,5 mm antéropostérieur, +/- 2,5 mm médiolatéral.
- Injecter 1,5 L de PFF obtenus à l’étape 2.2 par administration stéréotaxique aux coordonnées indiquées à l’étape 2.8 à partir de Bregma et -2,7 mm dorso-ventral (à partir du cerveau supérieur) à un débit de 100 nl/min avec une seringue Hamilton de 32 G. Retirez la seringue 5 minutes après l’injection.
- Suturez (taille : 4-0, 45 cm, voir tableau des matériaux) la plaie avec trois à cinq points de suture selon les besoins, et collez chacun d’eux avec 2 nœuds doubles puis un nœud simple. Arrêtez l’inhalation d’anesthésique et retirez la souris du cadre.
- Laissez la souris récupérer dans une cage de récupération appropriée avant de la remettre dans sa cage d’origine.
- Au cours de la semaine suivante, effectuez des contrôles postopératoires quotidiens. La douleur, la détresse ou l’inconfort de tout animal doit être administré avec Meloxicam/Metacam comme indiqué à l’étape 2.3 toutes les 24 heures.
- Trois mois plus tard, injecter 300 μL de pentobarbital sodique à 200 mg/mL dans une solution saline par injection intrapéritonéale. Une fois le réflexe de douleur perdu, faites une incision (2-3 cm) sur la poitrine et soulevez les côtes pour exposer le cœur.
- Perfuser par voie transcardique avec 10 mL de PBS et 35 mL de paraformaldéhyde à 4 % dans du PBS l’un après l’autre à 5 mL/min à l’aide d’une seringue de 50 mL reliée à une aiguille papillon de 23 G.
- Retirer la cervelle et postfixer dans 4 % de PFA pendant 24 h supplémentaires à 4 °C. Conservez-le dans de l’éthanol à 70 % à 4 °C après un traitement PFA.
- Mettez le cerveau dans des boîtes d’enrobage en plastique appropriées (voir le tableau des matériaux) et incubez dans de l’éthanol à 95 % pendant 1 h à l’autorégie.
- Transférez les cerveaux à 100 % d’éthanol pendant 1 h à R.T. Répétez l’étape dans de l’éthanol frais à 100 % et incubez à nouveau pendant 1 h.
- Transférer la cervelle dans du xylène ou un substitut de xylène pendant 1 h à R.T. Répéter dans une solution fraîche et incuber à nouveau pendant 1 h.
- Retirez le xylène ou le substitut de xylène et incubez l’échantillon dans de la paraffine tiède pendant 1 h. Remplacez la paraffine et laissez incuber pendant une heure supplémentaire.
- Montez le cerveau sur les boîtes d’enrobage avec de la paraffine chaude et laissez-le sécher pendant la nuit. Préparez des coupes de 5 μm à l’aide d’un microtome (voir tableau des matériaux) et montez-les sur des lames de verre.
3. Analyse de la morphologie mitochondriale par immunohistochimie sur des coupes de cerveau incluses en paraffine de souris injectées de PFF
- Déparaffiné les lames en les trempant dix fois dans le substitut de xylène. Incuber les lames pendant 2 min dans un substitut de xylène. Tremper à nouveau dix fois dans le substitut de xylène.
REMARQUE : Cette étape est nécessaire pour éliminer la paraffine et permettre la réhydratation des échantillons. - Réhydratation : répétez la procédure décrite à l’étape 3.1 avec les solutions suivantes : 100 % d’EtOH, 95 % d’EtOH, 70 % d’EtOH et deux fois avec ddH2O dans l’ordre.
- Effectuez le prélèvement d’antigènes et l’immunocoloration en suivant les étapes ci-dessous.
- Commencez par transférer les échantillons dans un récipient allant au micro-ondes avec du ddH2O.
- Réchauffer un tampon de citrate 100x pH 6 (voir le tableau des matières) stocké à 4 °C (les détergents peuvent avoir précipité) et préparer 350 mL de tampon de citrate 1x frais 1x. Versez ensuite le tampon de citrate dans un récipient en plastique pratique avec un couvercle.
- Placez les lames dans le récipient tampon de citrate (CRITIQUE : vérifiez que les lames sont sous le niveau du tampon) et mettez le couvercle.
ATTENTION : Assurez-vous que le couvercle n’est PAS complètement fermé, sinon le récipient pourrait éclater au micro-ondes. - Micro-ondes à 700 W : 4 min + 5 min de repos, 1,5 min + 5 min de repos. Compléter le tampon de citrate et cuire à nouveau au micro-ondes 1,5 min + 5 min de repos, 1,5 min + 5 min de repos, 1,5 min + 5 min de repos.
- Refroidir les échantillons dans un tampon de citrate sur de la glace pendant 20 min. Laver l’échantillon avec du ddH2O.
REMARQUE : Le prélèvement d’antigènes peut varier en fonction des besoins spécifiques en anticorps.
- Séchez les lames d’échantillon avec une serviette en papier sans toucher le tissu. Dessinez des rectangles avec un stylo Pap (voir Tableau des matériaux) autour des morceaux de tissu.
- Transférez toutes les lames dans une boîte anti-coloration des lames et lavez-les plusieurs fois doucement avec TBS + 0,05 % TWEEN (TBS-T). Vérifiez que les gouttes TBS-T restent à l’intérieur des rectangles du stylo pap.
- Retirez le TBS-T des échantillons en tapotant sur une serviette en papier. Ajouter 50 μL d’une solution bloquante (10 % de PDN dans le TBS-T) dans chaque rectangle (sans toucher le tissu) et incuber pendant 1 h à RT.
REMARQUE : Les volumes peuvent varier en fonction de la taille du tissu ; Essayez de vous assurer que : (1) la zone de l’enclos PAP est similaire d’un échantillon à l’autre, et (2) la zone est entièrement couverte par le volume tampon choisi. - Retirez la solution de blocage des échantillons en tapotant une serviette en papier. Pipeter doucement 50 μL/rectangle du mélange d’anticorps primaires suivant dans le TBS-T : anti-tyrosine hydroxylase 1:250 avec anti-VDAC1 1:100 et anti-pSer129 α-synucléine EP1536Y 1:2000 (voir le tableau des matériaux).
- Incuber toute la nuit à 4 °C.
- Lavez en pipetant TBS-T sur les lames et retirez-le en tapotant sur du papier absorbant. Répétez trois fois.
- Ajouter par pipetage 50 μL/rectangle d’un mélange d’anticorps secondaires : anti-Poulet secondaire, anti-souris secondaire rouge et anti-Lapin secondaire rouge lointain 1:1000 dans TBS-T (voir le tableau des matières). Incuber à 37 °C pendant 1 h dans l’obscurité.
- Lavez trois fois avec du TBS-T comme décrit à l’étape 3.13.
- Incuber avec du DAPI 2 μg/mL dans du TBS-T pendant 1 min. Retirez la solution DAPI en tapotant sur une serviette en papier. Lavez trois fois avec du TBS-T comme décrit à l’étape 3.13.
- Monter une lamelle en verre sur les échantillons à l’aide de 2 gouttes/lame de réactif de montage (voir tableau des matériaux). Appuyez doucement sur la lamelle pour éliminer les bulles et laissez sécher les échantillons pendant 1 h à R.T. Ensuite, conservez-les à 4 °C dans l’obscurité.
- Imagez au moins 50 cellules dans différents domaines à l’aide d’un système d’imagerie par fluorescence à éclairage structuré équipé d’un objectif à huile 60x ou d’une technologie confocale.
- Effectuez une analyse du signal VDAC1 des cellules individuelles à l’aide de Fidji comme indiqué dans les étapes suivantes.
- Tout d’abord, sélectionnez et isolez la région d’intérêt (ROI) en dessinant un contour autour de la cellule positive ou négative (selon le cas) et en utilisant la fonction « Recadrer ». Afin d’éviter tout biais dans la sélection du retour sur investissement, choisissez-le en tenant compte du signal de fluorescence d’un marqueur non lié à l’analyse (c’est-à-dire pas un marqueur mitochondrial).
- Facultatif : si l’image est excessivement pixélisée, utilisez la fonction « lisse » pour obtenir une définition de bord plus élevée.
REMARQUE : Si la fonction de lissage est appliquée à une image, veuillez l’appliquer à toutes les images suivantes. - Facultatif : utilisez la fonction « Convolve » (mode Noyau, dans Process > Filters) pour réduire l’arrière-plan.
REMARQUE : Ceci est facultatif et généralement pas nécessaire lors de l’utilisation de sections de 5 m en raison de la nature plus fine des sections. - Activez les descripteurs de forme et limitez les options de seuil sur la fonction « Définir la mesure » (assurez-vous qu’elles sont activées lors de l’analyse).
- Dans le menu « Ajuster », sélectionnez la fonction de seuil et ajustez le niveau de seuil. Les paramètres de seuil doivent être conservés pour toutes les cellules d’un même échantillon.
- Essayez d’assurer une visualisation adéquate du réseau mitochondrial, comme le montrent les images représentatives de cet article, tout en éliminant les pixels d’arrière-plan.
- Utilisez l’outil Analyser les particules dans l’onglet Analyser. Définissez une taille appropriée pour capturer les mitochondries. Dans cet exemple, les commandes size : 25-Infinity, activate : Pixel units et select : Show : Masks ont été utilisées pour visualiser le résultat. Fidji calculera et affichera les comptes, le format d’image (AR) et d’autres paramètres de forme dans un nouveau panneau.
- Effectuer une analyse statistique des données au besoin. Dans cette expérience, le test t a été utilisé pour analyser la différence entre le rapport d’aspect (AR) et le nombre moyens calculés par Fidji entre les groupes expérimentaux après les tests de normalité avec les tests de normalité D’Agostino et Pearson.
Résultats Représentatifs
Afin de s’assurer que les conditions d’imagerie et d’analyse appropriées sont en place pour l’évaluation in situ de la morphologie mitochondriale dans les tissus, une exploration in vitro de la morphologie mitochondriale en réponse à un modulateur connu de la morphologie mitochondriale est recommandée (Section 1). Par exemple, le SNCA a été génétiquement surexprimé dans les cellules SH-SY5Y pour induire des changements dans la morphologie mitochondriale comme décrit précédemment26. D’autres agressions qui pourraient être utilisées comme contrôle pour aggraver la morphologie mitochondriale seraient la famine ou l’utilisation d’inhibiteurs de l’activité mitochondriale tels que MPP+. Les cellules ont été transfectées et colorées pour la α-synucléine (AS) afin de séparer les cellules SNCA+ (AS+) et SNCA- (AS-). Ils ont également été colorés avec TOMM2027 pour visualiser le réseau mitochondrial des cellules. Pour rendre cette analyse aussi similaire que possible à celle d’une coupe de tissu de 5 μm, un plan confocal a été analysé par opposition à une projection maximale de plusieurs plans. L’analyse morphologique d’un plan confocal de TOMM20 a révélé que le nombre total de mitochondries et leur rapport d’aspect ou AR (qui est en corrélation avec l’allongement de l’organite) étaient réduits en réponse à la surexpression de SNCA (Figure 1).
L’immunocoloration a été réalisée pour la protéine mitochondriale VDAC1 dans des coupes de cerveau de souris de 5 μm incluses dans de la paraffine provenant d’animaux injectés avec des PFF comme décrit dans la section protocole ci-dessus. Les neurones dopaminergiques de la substance noire pars compacte (SNc), qui subissent une dégénérescence dans la MP, ont été révélés par co-immunomarquage avec l’anti-tyrosine hydroxylase (TH) et ont été séparés régionalement de l’aire tegmentale ventrale et de la substance noire pars lateralis. D’autre part, la coloration anti-phosphoSer129-α-synucléine (pS129) nous a permis de distinguer les cellules qui hébergeaient des lésions pS129 des cellules saines (pS129+ par rapport à pS129-). Des images SNc de trois animaux différents ont été prises, et l’analyse ultérieure de la coloration VDAC1 des neurones TH-positifs a révélé une réduction du nombre de mitochondries et du rapport d’aspect entre les neurones porteurs de lésions pS129 et les neurones dépourvus de celles-ci (Figure 2). Ces résultats indiquent que la morphologie mitochondriale des neurones hébergeant des lésions pS129 est altérée par rapport à celle des cellules dépourvues de lésions pS129.
Bien que cette expérience particulière montre une réduction de l’AR, mettant ainsi en évidence une réduction de l’allongement des mitochondries ainsi qu’une réduction du nombre global, ce qui indique une aggravation de la morphologie mitochondriale, l’interprétation des données devrait dépendre de l’expérience. Par exemple, une réduction de l’AR et du nombre peut indiquer une réduction globale du contenu mitochondrial ainsi qu’une fragmentation, tandis qu’une réduction de l’AR mais une augmentation du nombre global indiquerait un phénotype de fragmentation mitochondriale. Il est donc important d’interpréter les données dans le contexte des deux mesures.
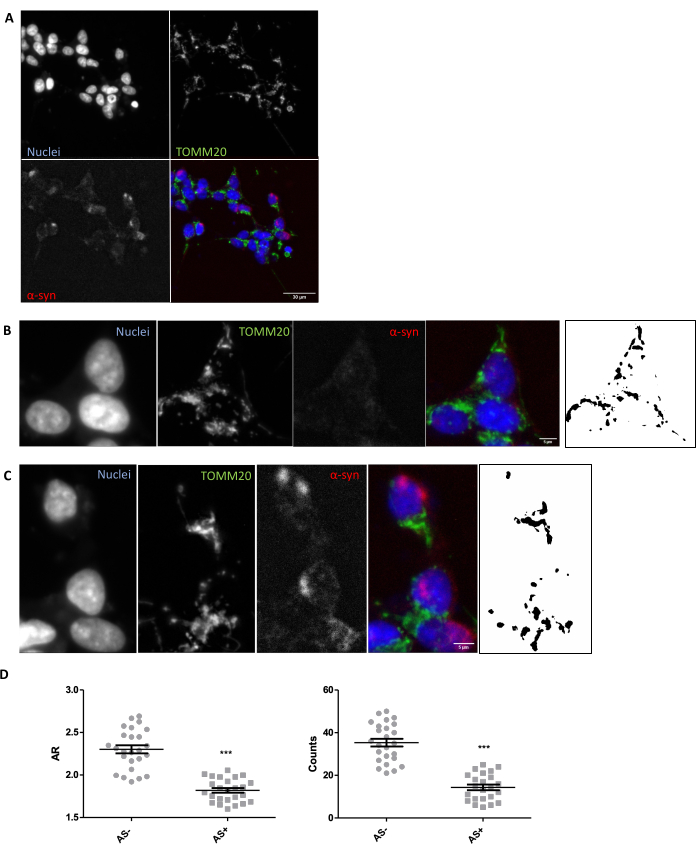
Figure 1 : Morphologie mitochondriale dans un modèle in vitro surexprimant le SNCA. Co-immunomarquage pour TOMM20 (vert), α-synucléine (AS, rouge) et DAPI (bleu) sur les cellules SNCA surexprimant et non surexprimant (AS+ et AS-, respectivement) (A). Détail d’une cellule AS- (B) et d’une cellule AS+ (C). Les images en noir et blanc dans les panneaux (B) et (C) représentent les masques du signal TOMM20 après application de la fonction Fidji décrite dans la section Protocole. Ce masque permet de quantifier la forme des structures résultantes. Le nombre de mitochondries et les valeurs du rapport d’aspect (AR) des cellules AS- et AS+ (N = 25 cellules par condition) ont été quantifiés et représentés sous forme de valeurs individuelles ainsi que de ± SEM moyennes ; **valeur p < 0,05 test t (D). La normalité a été évaluée par les tests de normalité D’Agostino et Pearson. Barres d’échelle : A, 30 μm ; B,C, 5 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
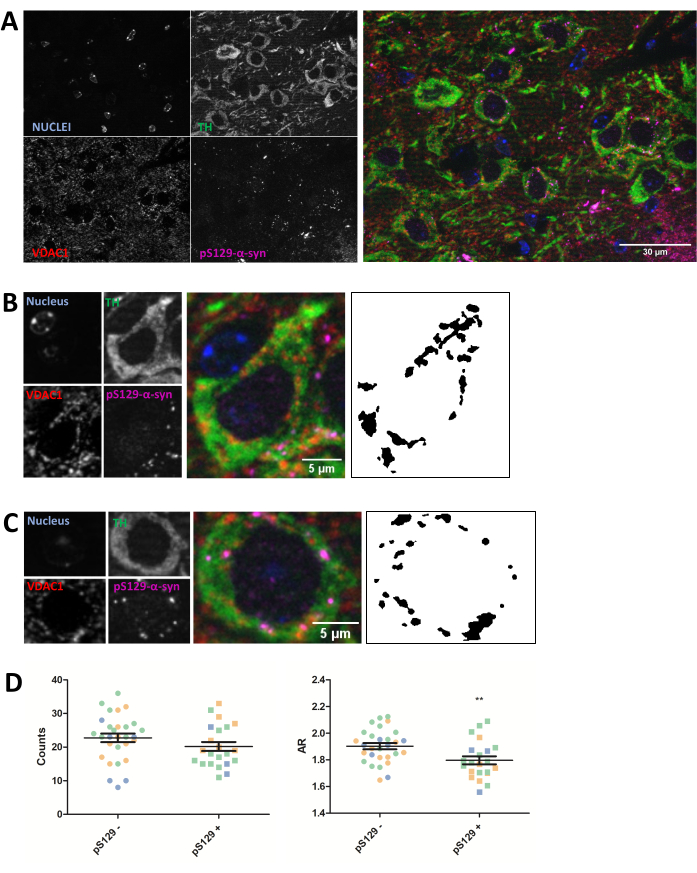
Figure 2 : La morphologie mitochondriale est affectée dans les neurones hébergeant des lésions pS129. Co-immunomarquage pour TH (vert), VDAC1 (rouge), phosphoS129-α-synucléine (magenta) et DAPI (bleu) du SNc de souris injectées de PFF (A). Le détail d’un neurone dopaminergique phosphoS129-α-synucléine négative (pS129-) (B) et d’un neurone dopaminergique phosphoS129-α-synucléine positif (pS129+) (C). Les images en noir et blanc dans les panneaux (B) et (C) représentent les masques du signal TOMM20 après application de la fonction Fidji décrite dans la section Protocole. Ce masque permet de quantifier la forme des structures résultantes. Les cellules négatives et positives ont été comptées dans des échantillons provenant de trois animaux différents, comme l’illustrent les différentes couleurs des valeurs graphiques individuelles (bleu, vert et orange). Le nombre de mitochondries et la quantification de l’AR de pS129- (N = 29) par rapport à pS129+ (N = 22) dans les neurones dopaminergiques ont été représentés sous forme de valeurs moyennes ± SEM ainsi que de valeurs cellulaires individuelles ; **valeur p < 0,05 test t (D). La normalité a été évaluée par les tests de normalité D’Agostino et Pearson. Barres d’échelle : A, 30 μm ; B,C, 5 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Dans l’ensemble, cette étude montre que l’immunomarquage combiné à l’analyse d’images est une méthode fiable pour analyser la morphologie mitochondriale. En effet, il permet de quantifier le nombre de mitochondries ainsi que certains paramètres morphologiques tels que l’aspect ratio en culture cellulaire et en tissu. Le nombre de mitochondries est directement lié à l’état fonctionnel des mécanismes de fission et de fusion des échantillons, tandis que la valeur AR repose sur l’allongement de l’organite. Cette méthode peut être particulièrement utile pour l’évaluation rapide des anomalies mitochondriales dans des modèles de MP dans lesquels l’altération de la morphologie, de la dynamique et des fonctions mitochondriales est un mécanisme pathologique bien connu28,29. α-synucléine joue également un rôle important dans la MP : en effet, la α-synucléine est l’un des composants des corps de Lewy, les agrégats fibrillaires cytoplasmiques utilisés pour le diagnostic post-mortem des patients atteints de la MP30. De plus, des mutations du gène SNCA ont été trouvées chez des patients atteints de MP familière et sporadique (examiné dans31). Il a été largement démontré que la phosphorylation de la α-synucléine au niveau de Ser129 marque une pathologie de type Lewy-Body, qui émerge après une agression par PFF et provoque divers effets toxiques32,26.
En utilisant l’outil présenté ici, nous avons pu détecter une réduction du nombre mitochondrial et des valeurs AR en présence de α-synucléine surexprimée et agrégée (cellules présentant une coloration à la α-synucléine et neurones portant des lésions positives à la phosphoSer129α-synucléine, respectivement) par rapport aux cellules dépourvues de telles lésions (cellules α-synucléine et phosphoS129α-synucléine négative). Ces résultats concordent avec les rapports précédents montrant comment les interactions directes α-synucléine-mitochondries produisent des effets toxiques sur la fonction mitochondriale et l’homéostasie dans26,33 34. En effet, il a été rapporté que les souris présentant des mutations de la α-synucléine présentent une augmentation des dommages à l’ADN mitochondrial35 et de la mitophagie 36,37. De plus, il a été décrit que l’augmentation des niveaux de α-synucléine favorise la fission/fragmentation mitochondriale, induit des espèces réactives de l’oxygène dans les mitochondries et dérègle l’expression des protéines mitochondriales dans les lignées cellulaires et les modèles murins surexprimant la α-synucléine 26,38,39.
Il est important de souligner que cet outil dépend fortement des anticorps utilisés pour l’étude ; Une évaluation morphologique minutieuse de la coloration des anticorps utilisée est impérative pour détecter le compartiment subcellulaire approprié. Comme cette technique est basée sur des coupes de 5 μm et nécessite donc des plans focaux uniques pour l’analyse des structures mitochondriales, l’absence d’un phénotype n’exclut pas l’existence d’un phénotype, car il est possible que des différences subtiles dans la morphologie mitochondriale ne soient pas détectées par cette méthode.
Bien que ce travail et d’autres aient déjà utilisé des approches similaires pour évaluer la morphologie mitochondriale in vivo40, il est nécessaire de mettre un protocole détaillé à la disposition de la communauté des chercheurs pour cette évaluation. L’importance de cette étude est qu’il est possible d’appliquer cette méthode à divers modèles de maladies in vivo pour évaluer les anomalies morphologiques mitochondriales et identifier les pathologies potentielles, ce qui pourrait éventuellement faciliter le criblage de composés phares pour le traitement de ces troubles. Bien que cette analyse soit actuellement limitée aux tissus inclus dans la paraffine, l’avantage de la méthode est qu’elle peut être appliquée à n’importe quel modèle de maladie après le prélèvement de tissus en phase terminale, ce qui en fait un outil très polyvalent.
Déclarations de divulgation
Nous ne souhaitons signaler aucun conflit d’intérêts.
Remerciements
Nous tenons à remercier les bailleurs de fonds de cette étude, en particulier Ikerbasque, le ministère espagnol de la Science et de l’Innovation, la Fondation Michael J Fox, IBRO et le Centre basque Achucarro pour les neurosciences.
matériels
| Name | Company | Catalog Number | Comments |
| 32 G Hamilton syringe | Hamilton | 7632-01 | |
| 4',6-diamidino-2-fenilindol, dihidrocloruro (DAPI) | Invitrogen | D1306 | |
| 4/0 USP 45 cm suture | SSa90 pga | 32345n-36u | |
| Alexa fluor 488/594-Donkey anti-Mouse | Invitrogen | A21202; A21203 | green/red dye-Donkey anti-Mouse |
| Alexa fluor 594/647-Donkey anti-Rabbit | Invitrogen | A21207 A31573 | red/far red dye-Donkey anti-Rabbit |
| AlexaFluor 488-Donkey anti-Chicken | Jackson ImmunoResearch | 703-545-155 | green dye-Donkey anti-Chicken |
| Anti-PSer129 α-synuclein EP1536Y (Rabbit) antibody | Abcam | ab51253 | |
| Anti-TOM 20 (Mouse) antibody | Santa Cruz | sc-17764 | |
| Anti-Tyrosine Hydroxylase (Chicken) antibody | Abcam | ab76442 | |
| Anti-VDAC1 (Mouse) antibody | Santa Cruz | sc-390996 | |
| Anti-α-synuclein antibody MJFR1 (Rabbit) | Abcam | ab138501 | |
| Citrate buffer 100X stock: 120mM citrate buffer, 5% Tween in water (pH 6) | Home-made | ||
| Disposable base mold for tissue embedding | Fisher | 22-363-553 | Plastic embedding boxes |
| D-MEM F12 | Gibco | A321331020 | |
| EVOS M7000 Imaging System | ThermoFisher Scientific | High-content automated fluorescence microscope | |
| Fetal Bovine Serum | Gibco | 10270106 | |
| Flat optical bottom 96 well plates | Greiner | 675090 | |
| FluorSave Reagent | Millipore | 345789-20ML | Mounting reagent |
| Glutamine 200 mM | Gibco | 25030-024 | |
| ImmEdge Hydrophobic Barrier Pen | Vector Laboratories | H-4000 | PAP-pen |
| Lipofectamine and Plus Reagent | Invitrogen | 11668-019; 11514-015 | Transfection reagent and transfection adjuvant |
| Matrigel | Corning | 354230 | Coating matrix |
| Microtome | ThermoFisher Scientific | ||
| Normal Donkey Serum | Gibco | PCN5000 | |
| Opti-MEM | Gibco | 31985070 | Transfection medium |
| PCDNA4 plasmid (backbone) | Addgene | 41036 | |
| Penicillin/Streptomycin solution | Gibco | 15140-122 | |
| SH-SY5Y cells/well | ATCC | HTB-11 | |
| Xylene substitute | Labbox | 22L36504 | |
| Zeiss Axio Imager Apotome 2 | Carl Zeiss | Structured illumination fluorescence imaging system | |
| α-synuclein peptide | rpeptide | S-1010-2 |
Références
- Yang, Y., Lu, B. Mitochondrial morphogenesis, distribution, and parkinson disease. Journal of Neuropathology and Experimental Neurology. 68 (9), 953-963 (2009).
- Schapira, A. H. Mitochondria in the aetiology and pathogenesis of Parkinson's disease. The Lancet Neurology. 7 (1), 97-109 (2008).
- Swerdlow, R. H. Mitochondria and mitochondrial cascades in alzheimer's disease. Journal of Alzheimer's Disease. 62 (3), 1403-1416 (2018).
- Hedrich, K., et al. type, and origin of Parkin mutations: Review and case studies. Movement Disorders. 19 (10), 1146-1157 (2004).
- Kahle, P. J., Haass, C. How does parkin ligate ubiquitin to Parkinson's disease. EMBO reports. 5 (7), 681-685 (2004).
- Dawson, T. M., Dawson, V. L. The role of parkin in familial and sporadic Parkinson's disease. Movement Disorders. 25, S32-S39 (2010).
- Pickrell, A. M., Youle, R. J. The Roles of PINK1, Parkin, and Mitochondrial Fidelity in Parkinson's Disease. Neuron. 85 (2), 257-273 (2015).
- Zhi, L., et al. Loss of PINK1 causes age-dependent decrease of dopamine release and mitochondrial dysfunction. Neurobiology of Aging. 75, 1-10 (2019).
- Bonifati, V., et al. DJ-1(PARK7), a novel gene for autosomal recessive, early onset parkinsonism. Neurological Sciences. 24 (3), 159-160 (2003).
- Chia, S. J., Tan, E. -. K., Chao, Y. -. X. Historical Perspective: Models of Parkinson's Disease. International Journal of Molecular Sciences. 21 (7), 2464 (2020).
- Wilson, D. M., Cookson, M. R., Den Bosch, L. V. a. n., Zetterberg, H., Holtzman, D. M., Dewachter, I. Hallmarks of neurodegenerative diseases. Cell. 186 (4), 693-714 (2023).
- Moore, D. J., West, A. B., Dawson, V. L., Dawson, T. M. Molecular pathophysiology of Parkinson's disease. Annual Review of Neuroscience. 28 (1), 57-87 (2005).
- Olanow, C. W., Tatton, W. G. Etiology and pathogenesis of Parkinson's disease. Annual Review of Neuroscience. 22 (1), 123-144 (1999).
- Nunnari, J., Suomalainen, A. Mitochondria: In sickness and in health. Cell. 148 (6), 1145-1159 (2012).
- Okamoto, K., Shaw, J. M. Mitochondrial Morphology and Dynamics in Yeast and Multicellular Eukaryotes. Annual Review of Genetics. 39 (1), 503-536 (2005).
- Malpartida, A. B., Williamson, M., Narendra, D. P., Wade-Martins, R., Ryan, B. J. Mitochondrial Dysfunction and Mitophagy in Parkinson's Disease: From Mechanism to Therapy. Trends in Biochemical Sciences. 46 (4), 329-343 (2021).
- Zou, W., et al. Nanoscopic quantification of sub-mitochondrial morphology, mitophagy and mitochondrial dynamics in living cells derived from patients with mitochondrial diseases. Journal of Nanobiotechnology. 19 (1), 136 (2021).
- Navaratnarajah, T., Anand, R., Reichert, A. S., Distelmaier, F. The relevance of mitochondrial morphology for human disease. The International Journal of Biochemistry & Cell Biology. 134, 105951 (2021).
- Zambon, F., et al. Cellular α-synuclein pathology is associated with bioenergetic dysfunction in Parkinson's iPSC-derived dopamine neurons. Human Molecular Genetics. 28 (12), 2001-2013 (2019).
- Cherubini, M., Lopez-Molina, L., Gines, S. Mitochondrial fission in Huntington's disease mouse striatum disrupts ER-mitochondria contacts leading to disturbances in Ca2+ efflux and Reactive Oxygen Species (ROS) homeostasis. Neurobiology of Disease. 136, 104741 (2020).
- Parihar, M. S., Parihar, A., Fujita, M., Hashimoto, M., Ghafourifar, P. Alpha-synuclein overexpression and aggregation exacerbates impairment of mitochondrial functions by augmenting oxidative stress in human neuroblastoma cells. The International Journal of Biochemistry & Cell Biology. 41 (10), 2015-2024 (2009).
- Wiemerslage, L., Lee, D. Quantification of mitochondrial morphology in neurites of dopaminergic neurons using multiple parameters. Journal of Neuroscience Methods. 262, 56-65 (2016).
- Liu, Y. -. T., et al. Mt-Keima detects PINK1-PRKN mitophagy in vivo with greater sensitivity than mito-QC. Autophagy. 17 (11), 3753-3762 (2021).
- Shoshan-Barmatz, V., Shteinfer-Kuzmine, A., Verma, A. VDAC1 at the intersection of cell metabolism, apoptosis, and diseases. Biomolecules. 10 (11), 1485 (2020).
- Luk, K. C., et al. Pathological α-Synuclein transmission initiates parkinson-like neurodegeneration in nontransgenic mice. Science. 338 (6109), 949-953 (2012).
- Ryan, B. J., et al. REST protects dopaminergic neurons from mitochondrial and α-synuclein oligomer pathology in an alpha synuclein overexpressing BAC-transgenic mouse model. The Journal of Neuroscience. 41 (16), 3731-3746 (2021).
- Yamamoto, H., et al. Dual role of the receptor Tom20 in specificity and efficiency of protein import into mitochondria. Proceedings of the National Academy of Sciences. 108 (1), 91-96 (2011).
- Exner, N., Lutz, A. K., Haass, C., Winklhofer, K. F. Mitochondrial dysfunction in Parkinson's disease: molecular mechanisms and pathophysiological consequences. The EMBO Journal. 31 (14), 3038-3062 (2012).
- Grünewald, A., Kumar, K. R., Sue, C. M. New insights into the complex role of mitochondria in Parkinson's disease. Progress in Neurobiology. 177, 73-93 (2019).
- Baba, M., et al. Aggregation of alpha-synuclein in Lewy bodies of sporadic Parkinson's disease and dementia with Lewy bodies. The American journal of pathology. 152 (4), 879-884 (1998).
- Vázquez-Vélez, G. E., Zoghbi, H. Y. Parkinson's disease genetics and pathophysiology. Annual Review of Neuroscience. 44 (1), 87-108 (2021).
- Mahul-Mellier, A. -. L., et al. The process of Lewy body formation, rather than simply α-synuclein fibrillization, is one of the major drivers of neurodegeneration. Proceedings of the National Academy of Sciences. 117 (9), 4971-4982 (2020).
- Ganguly, U., et al. Interaction of α-synuclein and Parkin in iron toxicity on SH-SY5Y cells: implications in the pathogenesis of Parkinson's disease. Biochemical Journal. 477 (6), 1109-1122 (2020).
- Ganjam, G. K., et al. Mitochondrial damage by α-synuclein causes cell death in human dopaminergic neurons. Cell Death & Disease. 10 (11), 865 (2019).
- Martin, L. J., et al. Parkinson's Disease α-synuclein transgenic mice develop neuronal mitochondrial degeneration and cell death. The Journal of Neuroscience. 26 (1), 41-50 (2006).
- Choubey, V., et al. Mutant A53T α-Synuclein induces neuronal death by increasing mitochondrial autophagy. Journal of Biological Chemistry. 286 (12), 10814-10824 (2011).
- Chen, L., Xie, Z., Turkson, S., Zhuang, X. A53T Human α-synuclein overexpression in transgenic mice induces pervasive mitochondria macroautophagy defects preceding dopamine neuron degeneration. The Journal of Neuroscience. 35 (3), 890-905 (2015).
- Kamp, F., et al. Inhibition of mitochondrial fusion by α-synuclein is rescued by PINK1, Parkin and DJ-1. The EMBO Journal. 29 (20), 3571-3589 (2010).
- Nakamura, K., et al. Direct membrane association drives mitochondrial fission by the parkinson disease-associated protein α-synuclein. Journal of Biological Chemistry. 286 (23), 20710-20726 (2011).
- Park, J., et al. Abnormal mitochondria in a non-human primate model of MPTP-induced Parkinson's disease: Drp1 and CDK5/p25 signaling. Experimental Neurobiology. 28 (3), 414-424 (2019).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon