Analyse de flux à double rapporteur à base de billes fluorescentes magnétiques du blocage de l’interaction-1/-L1 par les anticorps induits par le vaccin PDL1-VAXX
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Les inhibiteurs de point de contrôle sont des cibles importantes dans le développement de thérapies pour la lutte contre le cancer. Ce rapport présente un nouveau vaccin anticancéreux à base de peptides PDL1, PDL1-Vaxx, qui induit la production d’anticorps polyclonaux neutralisants qui bloquent la formation du complexe-1/PDL1. Ce travail détaille également le développement et la mise à l’essai d’un test à base de billes fluorescentes pour l’analyse de cette activité.
Résumé
L’inhibition des récepteurs de point de contrôle (-1,-L1 et CTLA-4) avec des anticorps monoclonaux s’est avérée très bénéfique dans les essais cliniques pour le traitement des patients atteints de cancer et est devenue une approche de base dans l’immunothérapie moderne du cancer. Cependant, seul un sous-ensemble de patients répond à l’immunothérapie par anticorps monoclonaux de point de contrôle. Il est donc urgent de développer de nouvelles stratégies thérapeutiques contre le cancer. Un nouveau vaccin contre le cancer à épitope peptidique des cellules B PDL1 (ligand de mort programmée 1) a été développé, avec les acides aminés 130-147 liés au peptide MVF (protéine de fusion du virus de la rougeole à cellules T de promiscuité) via un linker GPSL. Des tests précliniques ont indiqué que ce vaccin PDL1 (PDL1-Vaxx) stimule efficacement les anticorps hautement immunogènes chez les animaux. Les animaux immunisés avec PDL1-Vaxx présentent une charge tumorale réduite et des taux de survie prolongés dans divers modèles de cancer animal. Les mécanismes d’action indiquent que les anticorps induits par le vaccin inhibent la prolifération des cellules tumorales, induisent l’apoptose et bloquent l’interaction-1/-L1. Ce manuscrit présente un test à base de billes magnétiques qui utilise un système d’analyse de flux à double rapporteur pour évaluer l’interaction-1/-L1 et son blocage par les anticorps anti-PDL1 élevés contre le PDL1-Vaxx.
Introduction
Dans les lymphocytes T, les lymphocytes B et les points de contrôle intracellulaires du système immunitaire, des voies de signalisation régulent les activités immunitaires. Certaines cellules cancéreuses se protègent des attaques immunitaires en stimulant des cibles de points de contrôle, ce qui inhibe la fonction immunitaire et favorise la survie et la prolifération néoplasiques. L’immunothérapie oncologique par inhibition des points de contrôle utilise des anticorps pour cibler et bloquer les points de contrôle de signalisation et, ainsi, restaurer les fonctions antinéoplasiques du système immunitaire 1,2,3. Les traitements anticancéreux les plus efficaces comprennent actuellement les anticorps monoclonaux nivolumab, qui cible la protéine de mort programmée 1 (-1)4, et l’atezolizumab, qui cible le ligand de mort programmée 1 (-L1)5. Cette approche s’est avérée très efficace dans le traitement des patients atteints de cancer. Cependant, l’utilité clinique des stratégies actuelles d’inhibition des points de contrôle est atténuée par les effets indésirables et la résistance au traitement, en particulier dans le traitement monogénique6. Une combinaison d’immunothérapie et de stratégies thérapeutiques plus efficaces avec une toxicité plus faible est nécessaire de toute urgence dans le traitement du cancer 1,3,6.
Au cours des 30 dernières années, le laboratoire du Dr Kaumaya a mis au point des vaccins contre le cancer peptidiques et des agents similaires aux peptides pour le traitement du cancer, dont certains font l’objet d’essais cliniques en cours 1,2,7,8,9,10,11,12,13,14 . Par exemple, B-Vaxx avec l’immunothérapie combinée HER-2 a montré des avantages pour les patients contre les tumeurs solides métastatiques et/ou récurrentes dans les essais cliniques12. Les derniers vaccins anticancéreux du laboratoire sont PD1-Vaxx 2,13 et PDL1-Vaxx14, qui ont montré de grands avantages dans les études précliniques, en particulier dans le traitement combiné. Le PD1-Vaxx a terminé des essais cliniques d’escalade de dose aux États-Unis et en Australie. Le PD1-Vaxx sera associé à l’atezolizumab dans le cadre de l’essai de phase 1b qui débutera en mai 2023. Ce rapport se concentre sur l’évaluation de la capacité des anticorps induits par PDL1-Vaxx à bloquer l’interaction-1/-L1.
Le vaccin contre le cancer PDL1-Vaxx est un nouveau vaccin à épitopes peptidiques à cellules B avec les acides aminés-L1 130-147 liés au peptide de fusion du virus de la rougeole (MVF) à cellules T de promiscuité via un liant peptidique GPSL. Des études précliniques ont montré que PDL1-Vaxx est hautement immunogène pour stimuler la production d’anticorps anticancéreux dans divers modèles animaux, prolonger la survie et réduire la charge tumorale14. Ces anticorps générés contre le peptide-L1 peuvent bloquer avec succès l’interaction PD1/-L1, entraînant ainsi une activité anti-néoplasique. Ce rapport présente un test qui analyse le blocage de la formation du complexe PD1/-L1 par les anticorps induits par PDL1-Vaxx à l’aide d’un format à base de billes magnétiques avec une lecture à double rapporteur sur un instrument de cytométrie en flux.
Protocole
1. Préparation expérimentale
REMARQUE : Les détails de tous les réactifs/équipements mentionnés à cette étape sont répertoriés dans le tableau des matériaux.
- Obtenir de la-1 humaine recombinante (rhPD-1 ; marquée à la polyhistidine). Reconstituer le rhPD1 lyophilisé avec une solution saline tamponnée au phosphate (PBS) filtrée stérile, pH 7,4, avant utilisation.
- Obtenir de la-L1 humaine recombinante biotinylée (rhPD-L1). Reconstituer le rhPD-L1 lyophilisé avec de l’eau stérile déminéralisée avant utilisation.
- Procurez-vous le réactif de détection de la R-phycoérythrine conjugué à la streptavidine (SAPE). Conservez toutes les solutions SAPE à l’abri de la lumière à la température du réfrigérateur (c’est-à-dire entre 2 et 8 °C).
- Procurez-vous des microsphères magnétiques teintées par fluorescence (6,5 μm de diamètre, polystyrène avec magnétite intégrée) et le kit de couplage de billes15 (le cas échéant, voir le tableau des matériaux). Le couplage covalent aux microsphères nécessite du sulfo-NHS (sulfo-N-hydrosuccinimide) et de l’EDC (chlorhydrate de N-[3-diméthylaminopropyl]-N′-éthylcarbodiimide).
REMARQUE : Les ensembles de billes magnétiques sont disponibles avec l’une des 500 étiquettes fluorescentes uniques, ce qui permet l’identification et la différenciation des différents ensembles de billes16. Les billes sont offertes à des concentrations de stock de 2,5 × 106 perles/mL et de 12,5 × 106 perles/mL. Conservez les billes à l’abri de la lumière à la température du réfrigérateur (c’est-à-dire entre 2 et 8 °C). Ne pas congeler les suspensions de billes. - Obtenez des anticorps témoins positifs et négatifs et des anticorps de détection secondaire marqués au violet brillant 421 (BV421). Conservez toutes les molécules conjuguées fluorescentes à l’abri de la lumière.
- Effectuez toutes les réactions de couplage dans des tubes de liaison à faible teneur en protéines et toutes les réactions de dosage dans des plaques de microtitration à faible teneur en protéines, à fond rond et à 96 puits. Scellez les plaques avec une feuille adhésive jetable ou des couvercles de microplaques en plastique à 96 puits pour les étapes d’incubation du test. Utilisez un séparateur à plaques magnétiques pour immobiliser les billes pendant les étapes de lavage du dosage.
REMARQUE : Le système d’analyse de flux à double rapporteur comporte trois lasers : (1) un qui identifie et quantifie la fluorescence spécifique à l’ensemble des billes (canal de classification) ; (2) celui qui détecte et quantifie la fluorescence de la phycoérythrine (PE) spécifique à la cible (Reporter Channel 1 ; excitation à 532 nm, émission « orange » à 565-585 nm) ; et (3) celui qui détecte et quantifie la fluorescence BV421 spécifique à la cible d’un deuxième analyte cible (Reporter Channel 2 ; excitation de 405 nm, émission « bleue » de 421-441 nm).
2. Couplage rhPD-1 aux billes magnétiques
REMARQUE : La protéine à coupler doit être exempte d’albumine sérique bovine (BSA), d’azoture de sodium, de glycine, de glycérol, de tris(hydroxy-méthyl)aminométhane (Tris) ou d’additifs contenant des amines et doit être en suspension dans du PBS à un pH de 7,4. Il existe un kit de couplage commercial qui comprend tous les réactifs et tampons nécessaires décrits dans le présent document (voir le tableau des matériaux).
- Retirez tous les réactifs de couplage du réfrigérateur et laissez-les s’équilibrer à température ambiante (RT, 18-22 °C) pendant 20 à 30 min.
- Remettre les microsphères d’origine en suspension en les mettant brièvement en vortex, en les sonisant ou en les faisant tourner (15 min à 15-30 tr/min), selon la fiche d’information du produit.
- Transférer 1 × 106 billes magnétiques dans un tube de microcentrifugation à faible teneur en protéines de 1,5 ml (voir le tableau des matériaux).
- Billes de lavage avec 100 μL de tampon d’activation15 : 0,1 M NaH2PO4 (monobasique), pH 6,2.
REMARQUE : Le couplage peut également être effectué à l’aide d’un kit de couplage préconfiguré, qui comprend 0,1 M d’acide 2-morpholinoéthanesulfonique (MES), pH 6,0, comme tampon d’activation et de couplage alternatif (voir le tableau des matériaux).- Placez le tube contenant les billes dans un séparateur magnétique pendant 1 à 2 min.
REMARQUE : Alternativement, les billes peuvent être séparées par microcentrifugation à ≥8 000 × g pendant 1 à 2 minutes. - Aspirer le surnageant à l’aide d’une pipette à partir des billes immobilisées par aimant ou en granulés avec le tube toujours positionné dans le séparateur magnétique.
- Retirez le tube de la microcentrifugeuse de l’aimant et ajoutez 80 μL de tampon de couplage (voir le tableau des matériaux).
- Faire tourner doucement le tube de réaction et soniser pendant 20 s pour disperser les billes.
- Placez le tube contenant les billes dans un séparateur magnétique pendant 1 à 2 min.
- Activez les billes avec du sulfo-NHS et de l’EDC.
REMARQUE : La solution mère de sulfo-NHS est de 50 mg/mL dissous dans le tampon d’activation. La solution mère d’EDC est également dissoute à 50 mg/mL dans le tampon d’activation. Le tampon d’activation et l’humidité dans l’atmosphère provoquent la dégradation de l’EDC. Il n’est pas conseillé d’utiliser une solution EDC stockée. Préparez juste assez de solution EDC fraîche avant l’étape et utilisez-la immédiatement lorsque la solution est prête. Jetez l’excédent de solution EDC.
MISE EN GARDE : L’EDC provoque une grave irritation des yeux et est un irritant des voies respiratoires et de la peau.- Ajouter 10 μL de sulfo-NHS dans le tube microfuge contenant les billes lavées et activées.
- Ajouter 10 μL de solution mère d’EDC dans le tube de microfuge contenant les billes et le sulfo-NHS.
- Protégez les microsphères photosensibles de la lumière et faites tourner le rotateur pendant 20 min à 15-30 tr/min, à RT (18-22 °C). Alternativement, le tube peut rester immobile pendant l’étape d’activation s’il est doucement vortex pour redistribuer les billes à des intervalles de 10 minutes.
- Lavez l’excès de réactifs de couplage des billes.
- Placez le tube contenant les billes activées dans un séparateur magnétique pendant 1 à 2 min.
- Aspirer le surnageant à l’aide d’une pipette à partir de billes immobilisées ou granulées avec le tube toujours positionné dans le séparateur magnétique.
- Retirez le tube de la microcentrifugeuse de l’aimant et ajoutez 100 μL de tampon d’activation.
- Faites vortex le tube de réaction doucement pour disperser les billes.
- Répétez les étapes 2.6.1 à 2.6.4 deux fois de plus pour un total de trois lavages. À la fin du lavage, les billes seront suspendues dans 100 μL de tampon d’activation à une concentration approximative de 10 × 106 billes/mL.
- Couplez le peptide rhPD-1 aux billes activées.
- Ajoutez 390 μL de tampon d’activation dans le tube contenant les billes activées pour porter le volume total de la suspension des billes à 490 μL.
- Ajouter 1 μg de peptide-1 à la suspension de billes activées en ajoutant 10 μL de solution peptidique-1 (1 mg/mL dissous dans du PBS) dans le tube contenant les billes activées.
- Faites un bref vortex dans le tube de la microcentrifugeuse pour répartir uniformément le-1 et les billes activées.
- Incuber les billes avec-1 pendant 2 h dans l’obscurité à RT (18-22 °C) avec rotation (15-30 tr/min).
- Lavez les billes deux fois (2x) à l’aide d’un tampon d’essai/lavage (PBS-TBN : 1x PBS, pH 7,4 + 0,1 % BSA + 0,05 % Tween-20 + 0,05 % NaN315).
- Placez le tube contenant les billes activées dans un séparateur magnétique pendant 1 à 2 min.
- Aspirer le surnageant à l’aide d’une pipette à partir des billes immobilisées par aimant ou en granulés avec le tube toujours positionné dans le séparateur magnétique.
- Retirez le tube de la microcentrifugeuse de l’aimant et ajoutez 100 μL de tampon d’activation.
- Faites vortex le tube de réaction doucement pour disperser les billes.
- Répétez les étapes 2.8.1 à 2.8.4 une fois de plus pour un total de deux lavages. À la fin du lavage, les billes seront mises en suspension dans 100 μL de tampon d’activation à une concentration de 10 × 106 billes/mL.
REMARQUE : Le tampon d’analyse/lavage peut être fabriqué sans azoture de sodium (conservateur) si le tampon n’est pas également utilisé comme milieu de stockage. - Conservez les billes couplées à rhPD-1 dans l’obscurité au réfrigérateur à une température de 2 à 8 °C si elles ne sont pas utilisées immédiatement. Les billes couplées aux protéines sont stables jusqu’à 18 mois.
3. Évaluation du couplage réussi de rhPD-1 aux billes
NOTE : Les microsphères couplées à rhPD-1 réagissent avec la rhPD-L1 biotinylée, cette dernière étant détectée par incubation avec SAPE suivie d’une évaluation sur le cytomètre en flux. Cela permet de vérifier à la fois le couplage réussi de-1 aux billes magnétiques et l’interaction fonctionnelle entre les protéines rhPD-1 et rhPD-L1.
- Créer une série de dilution en deux fois de rhPD-L1 biotinylée dans le PBS-TBN (la solution mère de rhPD-L1 est de 1 mg/mL). La plage de concentration finale de rhPD-L1 à tester est d’une solution de 8 μg/mL à une solution de 313 pg/mL. Créer des volumes de 150 μL de chaque dilution rhPD-L1 : 50 μL pour chaque réaction et deux réactions par condition, plus un excès suffisant pour tenir compte des pertes de pipetage.
- Étiqueter les tubes de microfuge de dilution rhPD-L1 comme suit : 8 μg/mL, 4 μg/mL, 2 μg/mL, 1 μg/mL, 0,5 μg/mL, 0,25 μg/mL, 0,125 μg/mL, 0,063 μg/mL et 0,031 μg/mL. Un tube de 0 μg/mL (PBS-TBN uniquement) sert de témoin sans-L1.
- Précharger 150 μL de PBS-TBN dans tous les tubes de dilution rhPD-L1 marqués.
REMARQUE : La concentration finale la plus élevée de rhPD-L1 à tester est de 8 μg/mL, et la rhPD-L1 sera diluée 1 :1 lors de l’ajout au mélange réactionnel, de sorte que le tube de dilution étiqueté « 8 μg/mL » fait référence à la concentration finale et contient en fait 16 μg/mL de rhPD-L1. Les étiquettes sur tous les tubes de dilution indiquent la concentration finale de rhPD-L1 après addition à la réaction. - Créer la dilution rhPD-L1 la plus élevée (16 μg/mL réel). Il s’agit d’une dilution en deux étapes de 62,5 fois de la solution mère de rhPD-L1 à 1 mg/mL (1 000 μg/16 μg = 62,5).
- Combiner 84 μL de PBS-TBN avec 16 μL de solution mère de rhPD-L1 (1 mg/mL, c’est-à-dire 1 000 μL) dans un tube de microcentrifugation. Il s’agit d’une dilution de 6,25 fois et la concentration résultante est de 160 μg/mL rhPD-L1.
- Dans le tube étiqueté « 8 μg/mL », mélanger 270 μL de PBS-TBN avec 30 μL de la dilution rhPD-L1 créée à l’étape précédente (160 μg/mL). Il s’agit d’une dilution 10 fois plus élevée, et la concentration résultante est en fait de 16 μg/mL. L’étiquette du tube « 8 μg/mL » fait référence à sa concentration finale après addition à la réaction.
- Transférez 150 μL de la dilution rhPD-L1 créée à l’étape 3.1.3 (« 8 μg/mL ») dans le tube « 4 μg/mL », fermez le bouchon du tube de la microcentrifugeuse et tourbillonnez brièvement pour mélanger la solution.
- Répétez l’étape 3.1.4 séquentiellement jusqu’à ce que la série de dilution rhPD-L1 soit terminée. Après création, tous les tubes entre « 8 μg/mL » et « 0,063 μg/mL », ainsi que le témoin de 0 μg/mL, doivent contenir 150 μL de solution, et le dernier tube, « 0,031 μg/mL », doit contenir 300 μL de solution. Cela crée un volume suffisant de chaque dilution pour tester 50 μL de chaque dilution de rhPD-L1 biotinylée dans des réactions dupliquées, avec un excédent suffisant pour compenser les pertes de pipetage.
- Comptez les billes couplées à rhPD-1 à l’aide d’un hémocytomètre17.
- Diluer les billes de base couplées à rhPD-1 à 5 × 104 billes/mL, avec un volume suffisant pour 2 500 billes/50 μL/réaction.
- Faire vortex la suspension de billes couplées à rhPD-1 de 5 × 104 billes/mL et pipeter 50 μL de la suspension dans chaque puits marqué/cartographié d’une plaque de microtitration à fond rond de 96 puits afin qu’il y ait des puits dupliqués créés pour chaque dilution rhPD-L1 testée.
- Ajouter 50 μL de chaque tube de dilution rhPD-L1 biotinylé créé à l’étape 3.1 dans les puits appropriés sur la plaque de microtitration.
- Couvrir la plaque de microtitration d’une feuille jetable ou d’une scelleuse de plaque adhésive en plastique, et incuber la plaque pendant 1 h dans l’obscurité à RT (18-22 °C) sur un agitateur orbital (600 tr/min).
- Laver l’excès de rhPD-L1 biotinylé des billes.
- Transférez la plaque scellée de l’agitateur orbital vers le séparateur à plaque magnétique pendant 2 min pour immobiliser les billes.
- Retirez avec précaution le scellant de la plaque adhésive, vérifiez que l’aimant et la plaque de microtitration sont bien ensemble, puis retournez la plaque et jetez les surnageants dans un évier ou un conteneur à déchets liquides à risque biologique, selon le cas. Tapotez doucement mais vivement la plaque inversée sur un coussin de papier absorbant pour retirer le surnageant restant.
- Retirez la plaque de microtitration du séparateur à plaques magnétiques et pipetez 150 μL de PBS-TBN dans chaque puits.
- Placez la plaque non scellée sur le séparateur magnétique pendant 2 min pour immobiliser les billes.
- S’assurer que l’aimant et la plaque de microtitration sont bien ensemble, puis retournez la plaque et déversez les surnageants dans un évier ou un récipient à déchets liquides à risque biologique, selon le cas. Tapotez doucement mais vivement la plaque inversée sur un coussin de papier absorbant pour retirer le surnageant restant.
- Répétez les étapes de lavage des plaques 3.7.3 à 3.7.5 deux fois pour un total de trois lavages avec 150 μL de PBS-TBN chacun. Assurez-vous qu’il ne reste aucun surnageant dans les puits à la fin de la dernière étape de lavage. Travaillez régulièrement pour éviter que les billes immobilisées ne sèchent au fond du puits.
- Ajoutez le réactif de détection SAPE.
- Diluer la solution mère SAPE dans du PBS-TBN à une concentration utile de 6 μg/mL. Préparer un volume suffisant de solution de travail SAPE pour que tous les puits de réaction puissent recevoir 100 μL/puits, avec suffisamment de surplus pour supporter les pertes de pipetage.
- Retirez la plaque de microtitration du séparateur à plaques magnétiques.
- Ajouter 100 μL de solution de travail SAPE dans chaque puits de réaction et remettre en suspension les billes lavées par pipetage.
- Sceller la plaque de microtitration à 96 puits à l’aide d’une feuille d’aluminium ou d’une plaque adhésive en plastique et incuber pendant 1 h dans l’obscurité à RT (18-22 °C) sur un agitateur orbital à 600 tr/min.
- Retirez la plaque de microtitration de l’incubateur, transférez-la dans le séparateur à plaques magnétiques pour immobiliser les billes, retirez le scellant adhésif de la plaque et lavez les billes trois fois avec 150 μL PBS-TBN, comme décrit aux étapes 3.7.3 à 3.7.5.
- Après avoir retiré le lavage final, retirez la plaque du séparateur à plaques magnétiques et remettez les billes en suspension dans 100 μL de PBS-TBN par puits.
- Analysez les résultats.
- Lisez la plaque de l’instrument d’analyse de l’écoulement (voir le tableau des matériaux) pour déterminer l’intensité de fluorescence médiane (MFI) de chaque réaction à l’aide des paramètres suivants de l’instrument : volume d’aspiration = 50 μL ; nombre minimum de perles = 100 perles ; réglage du délai d’attente = 40 s ; déclenchement = 7 000 à 17 000 ; mode de fonctionnement = Rapporteur unique. Des puits dupliqués sont exécutés pour chaque condition, et les deux valeurs MFI de sortie pour chaque condition sont moyennées avant d’effectuer d’autres calculs de données et de représenter graphiquement.
NOTA : La valeur MFI de chaque dilution doit montrer une liaison dépendante de la concentration, ce qui indique une efficacité de couplage acceptable de rhPD-1 aux billes et confirme une bonne interaction des protéines recombinantes PD-1/PD-L1.
- Lisez la plaque de l’instrument d’analyse de l’écoulement (voir le tableau des matériaux) pour déterminer l’intensité de fluorescence médiane (MFI) de chaque réaction à l’aide des paramètres suivants de l’instrument : volume d’aspiration = 50 μL ; nombre minimum de perles = 100 perles ; réglage du délai d’attente = 40 s ; déclenchement = 7 000 à 17 000 ; mode de fonctionnement = Rapporteur unique. Des puits dupliqués sont exécutés pour chaque condition, et les deux valeurs MFI de sortie pour chaque condition sont moyennées avant d’effectuer d’autres calculs de données et de représenter graphiquement.
4. Test de blocage-1 /-L1 à billes magnétiques-L1
NOTE : Ce test évalue l’activité bloquante des médiateurs solubles (par exemple, les anticorps anti-PDL1-peptide) sur les interactions PD1/-L1 recombinantes. En bref, le rhPD-L1 biotinylé est préincubé avec des anticorps générés chez le lapin après différentes inoculations de peptides PDL1-Vaxx. Le mélange d’anticorps rhPD-L1 + anti-PDL1 est ensuite capturé à l’aide de billes magnétiques couplées à rhPD-1, et la liaison de rhPD-L1 aux billes couplées à rhPD-1 est quantifiée par l’ajout de streptavidine-PE. Le signal de fluorescence PE est inversement corrélé à l’activité bloquante des anticorps/inhibiteurs anti-PDL1 testés. La liaison à l’anticorps anti-PDL1-peptide est évaluée simultanément par la liaison d’un anticorps secondaire anti-lapin couplé à BV421 (pour les anticorps anti-PDL1-peptide) ou anti-humain (pour les anticorps témoins) et par l’évaluation de la fluorescence BV421 dans le deuxième canal de l’instrument. Les étapes de l’essai sont illustrées à la figure 1.
- Préparer une série de dilution en deux parties des anticorps testés, y compris des candidats anticorps polyclonaux induits par PDL1-Vaxx, un anticorps témoin négatif (trastuzumab, Herceptin, anticorps monoclonal anti-HER2 humanisé) et un anticorps témoin positif (atezolizumab ; anticorps monoclonal IgG1 anti-PDL1 humanisé). Chaque réaction utilisera 25 μL de la dilution d’anticorps assignée, de sorte que les volumes indiqués sont suffisants pour effectuer chaque réaction dans des puits en double par condition (c.-à-d. 50 μL par condition), avec un certain excédent restant pour tenir compte des pertes de pipetage.
- Pour chaque anticorps anti-PDL1-peptide induit par le vaccin et chaque anticorps témoin, assurez-vous que la plage des concentrations finales d’anticorps testées est comprise entre 1 000 μg/mL et 8 μg/mL. Préparer des solutions mères de tous les anticorps à 2 000 μg/mL.
- Pour chaque anticorps, étiquetez les tubes de dilution comme suit : 1 000 μg/mL, 500 μg/mL, 250 μg/mL, 125 μg/mL, 63 μg/mL, 31 μg/mL, 16 μg/mL et 8 μg/mL, et indiquez le nom de l’anticorps. Pour chaque anticorps, ajoutez également un tube « 0 μg/mL », qui sera le témoin du véhicule seul (PBS-TBN).
REMARQUE : Lorsqu’il est ajouté au mélange réactionnel, la concentration d’anticorps sera diluée 1 :1. Les tubes de dilution d’anticorps sont marqués comme la concentration finale d’anticorps après addition à la réaction et contiennent en fait deux fois plus d’anticorps que ce qui est marqué. - Ajouter 75 μL de PBS-TBN à tous les tubes de dilution d’anticorps étiquetés « 500 μg/mL » et moins, y compris les tubes témoins « 0 μg/mL » pour véhicules seulement.
- Pour chaque anticorps, pipeter 150 μL de la solution mère à 2 000 μg/mL dans le tube correspondant étiqueté « 1 000 μg/mL ». Cela sera utilisé pour effectuer toutes les dilutions ultérieures pour chaque anticorps.
- Pour chaque anticorps, créez une série de dilution complète en transférant à la pipette 75 μL du tube « 1 000 μg/mL » vers le tube avec la dilution la plus basse suivante dans la série (c.-à-d. « 500 μg/mL »). Fermez le tube de dilution nouvellement terminé, faites-le tourbillonner brièvement et poursuivez la construction de la série de dilution en transférant 75 μL du tube « 500 μg/mL » au tube « 250 μg/mL ». Répétez ce schéma jusqu’à ce que la dernière dilution, « 8 μg/mL », ait été effectuée pour tous les anticorps.
REMARQUE : Dans la série de dilution terminée pour chaque anticorps, il doit y avoir un volume de 75 μL pour tous les tubes, à l’exception de la dilution la plus faible, 8 μg/mL, qui doit contenir un volume de 150 μL. Chaque réaction utilisera 25 μL de dilution d’anticorps, de sorte que ces volumes sont suffisants pour effectuer chaque réaction dans des puits dupliqués par condition (c.-à-d. 50 μL par condition), avec un supplément pour tenir compte des pertes de pipetage.
- Placer 25 μL d’anticorps dilués dans les puits désignés d’une plaque de microtitration à 96 puits.
- Diluer le rhPD-L1 biotinylé à une concentration utile de 4 μg/mL dans du PBS-TBN à un volume suffisant pour inclure 25 μL dans des puits en double par condition (c.-à-d. 50 μL par condition), avec un supplément pour tenir compte des pertes de pipetage.
NOTE : Dans ce travail, la rhPD-L1 biotinylée à 4 μg/mL a donné lieu à environ 50 % du signal MFI maximal mesuré dans l’évaluation antérieure du couplage et a été utilisée pour l’analyse du blocage-1/-L1. - Ajouter 25 μL de rhPD-L1 biotinylé (4 μg/mL) dans chaque puits de réaction, recouvrir la plaque de microtitration d’une feuille ou d’un joint adhésif en plastique et incuber à RT (18-22 °C) pendant 1 h en agitant sur un agitateur à plaque orbitale à 600 tr/min.
- Diluer les billes couplées à rhPD-1 à 50 000 billes/mL, avec un volume suffisant pour 50 μL/puits (2 500 billes/puits) plus un supplément pour tenir compte des pertes de pipetage.
- Retirez la plaque de réaction de microtitration à 96 puits de l’agitateur et retirez le joint de la plaque adhésive.
- Ajouter 50 μL du mélange de billes couplées à rhPD-1 dans chaque puits.
- Sceller la plaque et incuber pendant 1 h dans l’obscurité à RT (18-22 °C) sur un agitateur orbital à 600 tr/min.
- Transférez la plaque scellée de l’agitateur orbital vers le séparateur à plaque magnétique pendant 2 min pour immobiliser les billes.
- Retirez soigneusement le scellant de la plaque adhésive, vérifiez que l’aimant et la plaque de microtitration sont bien ensemble, puis retournez la plaque et videz les surnageants. Tapotez doucement la plaque inversée sur un coussin de papier absorbant pour éliminer l’excès de surnageant.
- Lavez l’excès de réactifs de réaction des billes.
- Retirez la plaque de microtitration du séparateur à plaques magnétiques et ajoutez 150 μL de PBS-TBN dans chaque puits.
- Placez la plaque de microtitration sur le séparateur à plaques magnétiques pendant 2 min pour immobiliser les billes.
- Vérifiez que l’aimant et la plaque de microtitration sont bien ensemble, puis retournez la plaque et videz les surnageants. Tapotez doucement la plaque inversée sur un coussin de papier absorbant pour éliminer l’excès de surnageant.
- Répétez les étapes de lavage des plaques 4.11.1 à 4.11.3 deux fois, pour un total de trois lavages avec PBS-TBN. Assurez-vous que le réactif SAPE est préparé (ci-dessous) avant de retirer la dernière (troisième) solution de lavage.
- Ajoutez le réactif de détection SAPE.
- Diluer la solution mère SAPE à une concentration de travail de 6 μg/mL dans du PBS-TBN ; faire un volume suffisant pour 100 μL/puits, plus un supplément pour tenir compte des pertes de pipetage.
- Ajouter 100 μL/puits de solution de travail SAPE dans chaque puits de réaction et remettre les billes en suspension par pipetage.
- Sceller la plaque et incuber pendant 1 h dans l’obscurité à RT (18-22 °C) sur un agitateur orbital à 600 tr/min.
- Décanter l’excès de SAPE de la réaction.
- Transférez la plaque scellée de l’agitateur orbital vers le séparateur à plaque magnétique pendant 2 min pour immobiliser les billes.
- Retirez avec précaution le scellant de la plaque adhésive, vérifiez que l’aimant et la plaque de microtitration sont bien ensemble, puis retournez la plaque et videz le surnageant. Tapotez doucement la plaque inversée sur un coussin de papier absorbant pour retirer le surnageant contenant l’excès de SAPE.
- Laver l’excédent de SAPE sur les perles.
- Retirez la plaque de microtitration du support de plaque magnétique.
- Ajouter 150 μL de PBS-TBN dans chaque puits pour remettre les billes en suspension.
- Placez la plaque de microtitration sur le séparateur à plaques magnétiques pendant 2 min pour immobiliser les billes.
- Vérifiez que l’aimant et la plaque de microtitration sont bien ensemble, puis retournez la plaque et videz le surnageant. Tapotez doucement la plaque inversée sur un coussin de papier absorbant pour éliminer l’excès de surnageant.
- Effectuez deux étapes de lavage supplémentaires avec PBS-TBN pour un total de trois lavages en répétant les étapes 4.15.1 à 4.15.4. Préparez les anticorps de détection secondaire BV421 (étape suivante) avant de retirer la solution de lavage finale (troisième).
- Ajoutez les anticorps secondaires configurés par BV421.
- Diluer les IgG anti-humaines congugées BV421 (pour détecter les anticorps témoins humanisés) et les IgG anti-lapin congugées par BV421 (pour détecter les anticorps polyclonaux induits par PDL1-Vaxx) (voir le tableau des matériaux) 1 :400 dans un tampon de lavage/dosage à des volumes suffisants pour utiliser 100 μL/puits de chaque, avec un supplément pour compenser les pertes de pipetage.
- Ajouter 100 μL d’IgG anti-humain conjugué BV421 dilué ou d’IgG anti-lapin conjugué BV421 dans les puits appropriés.
- Sceller la plaque et incuber pendant 1 h dans l’obscurité à RT (18-22 °C) sur un agitateur orbital à 600 tr/min.
- Décanter l’excès d’anticorps secondaires conjugués BV421 des billes.
- Transférez la plaque scellée de l’agitateur orbital vers le séparateur à plaque magnétique pendant 2 min pour immobiliser les billes.
- Retirez avec précaution le scellant de la plaque adhésive, vérifiez que l’aimant et la plaque de microtitration sont bien ensemble, puis retournez la plaque et videz le surnageant. Tapotez doucement la plaque inversée sur un coussin de papier absorbant pour retirer le surnageant contenant l’excès d’anticorps secondaires conjugués BV421.
- Lavez l’excès d’anticorps secondaires conjugués BV421 des billes.
- Ajouter 150 μL de PBS-TBN dans chaque puits pour remettre les billes en suspension.
- Placez la plaque de microtitration sur le séparateur à plaques magnétiques pendant 2 min pour immobiliser les billes.
- Vérifiez que l’aimant et la plaque de microtitration sont bien ensemble, puis retournez la plaque et videz le surnageant. Tapotez doucement la plaque inversée sur un coussin de papier absorbant pour éliminer l’excès de surnageant.
- Effectuez trois étapes de lavage supplémentaires avec PBS-TBN pour un total de quatre lavages en répétant les étapes 4.19.1 à 4.19.3.
- Après avoir retiré le dernier (quatrième) tampon de lavage, retirez la plaque de microtitration du séparateur à plaques magnétiques et remettez les billes en suspension dans un puits de 100 μL PBS-TBN/à l’aide d’une pipette.
- Analysez les résultats.
- Lire la plaque sur le système d’analyse de débit à double rapporteur pour déterminer l’IMF de chaque réaction à l’aide des paramètres suivants de l’instrument : volume d’aspiration = 50 μL ; nombre minimum de perles = 100 perles ; réglage du délai d’attente = 40 s ; contrôle : 7 000 à 17 000 ; mode de fonctionnement = Dual Reporter.
- Avec le système à double rapporteur, assurez-vous que le Reporter Channel 1 mesure la fluorescence orange PE (quantité de rhPD-L1 attachée aux billes conjuguées rhPD-1) et que le Reporter Channel 2 mesure la fluorescence bleue BV421 (quantité d’anticorps bloquant attaché lié à rhPD-L1).
- Exécutez des puits en double pour chaque condition et faites la moyenne des deux valeurs MFI en sortie pour chaque condition avant d’effectuer d’autres calculs de données et d’effectuer des graphiques.
- Standardisez la valeur MFI de chaque échantillon au témoin négatif et calculez le pourcentage d’inhibition pour chaque échantillon :
% d’inhibition = (100 × [IMF témoin négatif − IMF échantillon])/IMF témoin négatif
REMARQUE : Les valeurs négatives de l’IMF de contrôle (pas d’inhibition) sont les valeurs les plus élevées ; l’IMF du signal-L1 lié est de 100 % et l’inhibition de la liaison de rhPD-L1 à rhPD-1 est définie comme étant de 0 %.
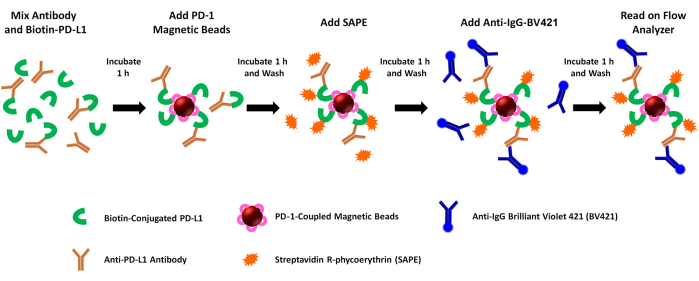
Figure 1 : Schéma de l’essai de blocage-1/-L1 à double rapporteur. Le-L1 humain recombinant biotinylé (rhPD-L1) est pré-incubé avec des anticorps anti-PDL1 induits par PDL1-Vaxx avant de se combiner avec des billes magnétiques couplées à rhPD-1 pour permettre la formation de complexes de points de contrôle-1/-L1. La rhPD-L1 complexée est ensuite détectée et marquée par l’ajout de phycoérythrine couplée à la streptavidine (SAPE, fluorophore orange). Les anticorps dirigés contre les épitopes de PDL1-Vaxx ciblent rhPD-L1 qui s’est complexé en rhPD-1 pré-couplé aux billes magnétiques, et ils sont éclairés à l’aide d’un anticorps secondaire conjugué au violet brillant 421 (BV421, fluorophore bleu). Les anticorps rhPD-L1 biotinylés qui sont complexés à-1 (signal PE) et les anticorps anti-PDL1 qui reconnaissent et se lient au rhPD-L1 (signal BV421) sont analysés simultanément à l’aide d’un instrument de cytométrie en flux à double rapporteur qui interroge les échantillons pour les deux fluorophores dans deux canaux rapporteurs distincts. Les valeurs de sortie pour chaque échantillon sont l’intensité de fluorescence médiane de chaque fluorophore. L’inhibition de la formation du complexe PD1/-L1 par différents anticorps induits par PDL1-Vaxx est ensuite extrapolée en comparant les signaux expérimentaux à ceux générés à l’aide d’un anticorps monoclonal témoin négatif qui ne se lie pas à rhPD-L1 (inhibition de 0%). Veuillez cliquer ici pour voir une version agrandie de cette figure.
Résultats Représentatifs
Le test a permis de quantifier avec précision l’inhibition de l’interaction-1/-L1 par quatre anticorps polyclonaux uniques, générés contre les peptides vaccinaux rhPD-L1, qui sont explorés en tant qu’agents thérapeutiques potentiels contre le cancer. Le schéma de ce test est fourni à la figure 1. La quantité de rhPD-L1 biotinylée qui s’est liée aux billes conjuguées de rhPD-1 et l’inhibition de cette liaison par les quatre candidats anticorps induits par PLD1-Vaxx ont été mesurées dans le canal Reporter 1 à l’aide d’un réactif de détection de streptavidine-PE qui se lie directement à rhPD-L1 (Figure 2).
Les quatre anticorps polyclonaux anti-PDL1-peptide ont bloqué l’interaction rhPD-L1 avec-1 qui avait été immobilisée sur des microsphères à des degrés variables. Le pourcentage d’inhibition des différents anticorps peptidiques anti-PDL1 variait de 48 % à 74 % à la concentration maximale testée de 1 000 μg/mL. L’anticorps monoclonal témoin positif, l’atezolizumab, a permis d’obtenir un blocage de 92 % de l’interaction-1/-L1 à la concentration maximale testéede 14 μg/mL (Figure 2). Tous les anticorps expérimentaux PDL1-Vaxx ont montré une inhibition dépendante de la concentration de la liaison de rhPD-L1 aux billes conjuguées rhPD-1 par rapport au trastuzumab, l’anticorps témoin négatif qui ne devrait pas interagir avec le système-1/-L1.
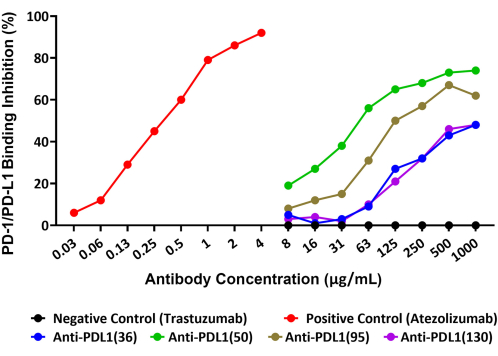
Figure 2 : Blocage de l’interaction de rhPD-L1 avec rhPD-1 couplé à des billes magnétiques par des anticorps anti-PDL1-peptide, comme le montre un nouveau test immunologique à base de billes fluorescentes. La-1 humaine recombinante a été couplée à des microsphères magnétiques, et les billes ont ensuite été incubées avec du rhPD-L1 biotinylé qui avait été pré-incubé avec différents anticorps anti-PDL1-peptide. Un réactif de détection de la streptavidine-phycoérythrine a été utilisé pour se lier à la biotine et, ainsi, évaluer la quantité relative de rhPD-L1 disponible pour se lier à-1. Les anticorps polyclonaux élevés chez le lapin contre les vaccins peptidiques PDL1 (anti-PDL1[36], anti-PDL1[50], anti-PDL1[95] et anti-PDL1[130]) ont été testés pour leur activité inhibitrice et ont montré un blocage de 48%-74% des interactions-1/-L1 recombinantes à la concentration la plus élevée testée. L’atezolizumab (un anticorps monoclonal anti-PDL1 différent) a été utilisé comme témoin positif. L’anticorps monoclonal commercial non apparenté trastuzumab (anti-HER2) a été utilisé comme témoin négatif. Cette figure est adaptée de Guo et al.14. Veuillez cliquer ici pour voir une version agrandie de cette figure.
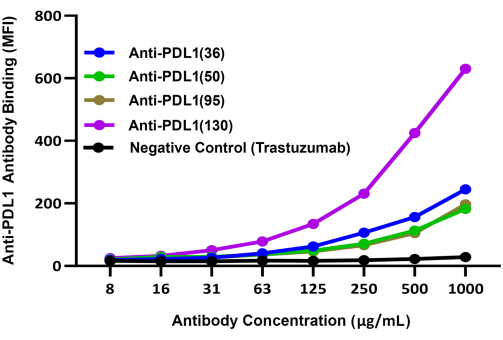
Figure 3 : Liaison comparative de différents anticorps induits par PDL1-Vaxx à rhPD-L1 complexés à des billes magnétiques enrobées de rhPD1. Un anticorps de détection secondaire conjugué violet brillant 421 a été utilisé pour comparer la liaison de différents anticorps polyclonaux anti-PDL1-peptide de lapin à rhPD-L1 via des billes enrobées de rhPD-1. Le signal de fluorescence bleue BV421 a été enregistré dans le canal 2 du Reporter de l’instrument à double rapporteur ; ce signal est corrélé à l’efficacité relative de liaison des anticorps expérimentaux anti-PDL1-peptide. Le trastezumab (anti-HER2), un anticorps monoclonal qui cible un point de contrôle différent de celui de-1/-L1, a été utilisé comme témoin négatif. L’IMF représente l’intensité de fluorescence médiane moyenne des billes, qui a été mesurée dans des puits de réaction dupliqués par condition. Cette figure est adaptée de Guo et al.14. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Les capacités relatives des quatre anticorps candidats expérimentaux induits par PDL1-Vaxx à se lier à rhPD-L1 ont été comparées à l’aide d’un système de détection séparé (IgG anti-lapin conjuguées BV421) qui a été évalué sur le deuxième canal rapporteur de l’instrument. Ces résultats indiquent que les quatre anticorps polyclonaux anti-PDL1-peptide se lient à rhPD-L1 d’une manière dépendante de la concentration14 (Figure 3). L’anticorps anti-PDL1(130) a montré le signal de liaison rhPDL1 le plus élevé des quatre candidats anticorps induits par PDL1-Vaxx.
Discussion
L’objectif de l’immunothérapie anticancéreuse liée aux points de contrôle est de perturber l’interaction entre les protéines des points de contrôle et leurs ligands importants dans la survie et la progression des tumeurs2. Ce groupe de recherche développe activement de nouveaux vaccins-1 et-L1 qui suscitent une réponse anticorps qui cible et interrompt le point de contrôle-1/-L1 3,8,13,14. Auparavant, deux variantes de tests immuno-enzymatiques (ELISA) ont été réalisées pour évaluer les effets des anticorps anti-PDL1-peptide sur l’inhibition de l’interaction recombinante PD1/-L114. (1) Dans le premier variant, rhPD-L1 a été enrobé sur une plaque de microtitration, puis la plaque a été incubée avec des anticorps dilués induits par le candidat vaccin anti-PDL1. L’inhibition de l’interaction-1/-L1 recombinante par les anticorps a ensuite été évaluée en ajoutant du rhPD-1 biotinylé et en quantifiant la liaison au rhPD-L1 immobilisé à l’aide d’un conjugué streptavidine-peroxydase de raifort et d’un substrat colorimétrique. C’est ce que nous avons défini comme le test de blocus direct. (2) Dans la deuxième variante, le-1 a été recouvert sur la plaque de microtitration. La rhPD-L1 biotinylée a été pré-incubée avec chacun des anticorps polyclonaux induits par le candidat anti-PLD1 dans des tubes de réaction séparés. Les mélanges rhPDL1/anti-PDL1 ont ensuite été ajoutés aux puits de plaques contenant du rhPD-1 immobilisé et laissés réagir. Tout rhPDL1 qui a réagi avec le rhPD-1 immobilisé en présence d’anticorps potentiellement bloquants induits par PDL1-Vaxx a été détecté lors de l’incubation ultérieure de la streptavidine-HRP et du substrat colorimétrique. C’est ce que nous avons défini comme le test de blocage inverse.
Le blocage inverse de l’interaction-1/-L1 recombinante par des anticorps anti-PDL1-peptide a montré une inhibition du signal (c’est-à-dire un blocage-1/-L1) d’une manière dépendante de la concentration d’anticorps14, tandis que l’approche de blocage direct n’a pas fourni de résultats cohérents (non illustré). Le test de blocage à double rapporteur à base de billes a été développé pour vérifier les résultats ELISA et pour étudier le blocage de l’interaction-1/-L1 dans une phase fluide, ce qui élimine les problèmes potentiels d’entrave stérique / disponibilité des épitopes de liaison associés à l’immobilisation des protéines recombinantes au fond des puits. L’analyse de la microsphère a été directement corrélée aux résultats du blocage ELISA à l’aide du test de blocage inverse (Figure 2). De plus, les immunoessais basés sur la fluorescence peuvent fournir une meilleure sensibilité du test et une plage dynamique élargie par rapport aux tests ELISA colorimétriques18, et de plus, le test à base de billes multiplexées permet la performance simultanée de deux immunoessais indépendants au sein d’une seule réaction. Le sulfo-NHS et l’EDC utilisés pour le couplage covalent des microsphères à rhPD-1 pourraient avoir conduit aux différences de performance observées entre les tests de blocage direct et de blocage inversé et aux différences de sensibilité observées entre les tests ELISA et les tests d’interaction-1/-L1 recombinants à base de billes Luminex. D’autres recherches aux niveaux chimique et moléculaire sont nécessaires pour étudier les mécanismes possibles responsables de ces différences.
Les tests ELISA14 et les tests à base de billes démontrent que les anticorps anti-PDL1 induits par PDL1-Vaxx peuvent inhiber la formation de complexes de points de contrôle PD1/-L1. Le PDL1-Vaxx à base de peptides induit avec succès des anticorps anti-PDL1 qui peuvent bloquer l’interaction-1/-L1. Cette approche pourrait constituer une nouvelle stratégie thérapeutique pour le traitement du cancer, comme le soutiennent les études précliniques chez l’animal 3,13,14. Les essais cliniques prévus détermineront l’efficacité du PDL1-Vaxx pour l’immunothérapie par point de contrôle et le contrôle de la maladie chez les patients atteints de cancer.
Déclarations de divulgation
Pravin T.P. Kaumaya est consultant auprès d’Imugene, Ltd.
Remerciements
Les auteurs remercient Sherry Dunbar, Ph.D., MBA de Luminex Corporation (Austin, TX) pour son soutien à la recherche, et Matthew Silverman, Ph.D., Biomedical Publishing Solutions (Panama City, FL ; mattsilver@yahoo.com) pour son aide scientifique et rédactionnelle. Ce travail a été soutenu par des prix décernés à Pravin T. P. Kaumaya par les National Institutes of Health (R21 CA13508 et R01 CA84356) et à Imugene Ltd, Sydney, Australie (OSU 900600, GR110567 et GR124326).
matériels
| Name | Company | Catalog Number | Comments |
| Buffers | |||
| Activation Buffer: 0.1 M NaH2PO4, pH 6.2 | Millipore/Sigma | S3139 | |
| Assay/Wash Buffer: PBS-TBN (1x PBS, pH 7.4 + 0.1% BSA + 0.05 % (v/v) Tween-20; 0.05% NaN3) | Millipore/Sigma | P3563 (PBS+Tween20), A7888 (Bovine serum albumin), S8032 (sodium azide) | |
| Coupling Buffer: 50 mM 2-morpholinoethanesulfonic acid (MES), pH 5.0 | MilliporeSigma | M2933 | |
| Coupling Reagents | |||
| 1-Ethyl-3-[3-dimethylaminopropyl]carbodiimide hydrochloride (EDC) | ThermoFisher Scientific (Waltham, MA) | 77149 | |
| xMAP Antibody Coupling Kit (if desired), includes: | Luminex Corp. (Austin, TX) | 40-50016 | |
| EDC, 10 mg | |||
| sNHS solution, 250 µL | |||
| Activation/Coupling Buffer: 0.1 M 2-morpholinoethanesulfonic acid (MES), pH 6.0 | |||
| Wash Buffer: 1x PBS, pH 7.4 + 0.1% BSA + 0.05 % (v/v) Tween-20; 0.05% NaN3 (PBS-TBN) | |||
| Sulfo-NHS (N-hydroxysulfosuccinimide) | ThermoFisher Scientific (Waltham, MA) | 24510 | |
| Instrumentation and Ancillary Lab Supplies | |||
| xMAP INTELLIFLEX (dual-reporter instrument) | Luminex Corp. (Austin, TX) | INTELLIFLEX-DRSE-RUO | |
| Low protein-binding round bottom 96-well plate | ThermoFisher Scientific (Waltham, MA) | 07-200-761 | |
| Luminex Magnetic Plate Separator (or comparable) | Luminex Corp. (Austin, TX) | CN-0269-01 | |
| Luminex Magnetic Tube Separator (or comparable) | Luminex Corp. (Austin, TX) | CN-0288-01 | |
| MagPlex Microspheres (magnetic, fluorescent, 6.5-µm-diameter beads) | Luminex Corp. (Austin, TX) | MC-1**** (varies by bead label) | |
| Protein LoBind microcentrifuge tubes | ThermoFisher Scientific (Waltham, MA) | 022431081 | |
| Peptides, Antibodies, & Detection Reagents | |||
| Atezolizumab (humanized anti-PDL1 IgG1 monoclonal antibody), positive control | Genentech/Roche (San Francisco, CA) | n/a (prescription medications) | |
| Biotinylated recombinant human PDL1 | Sino Biological (Wayne, PA) | 10084-H49H-B | |
| Brilliant Violet 421-congugated donkey anti-human IgG | Jackson Immunoresearch Laboratories Inc. (Westgrove, PA) | 709-675-149 | |
| Brilliant Violet 421-congugated donkey anti-rabbit IgG | Jackson Immunoresearch Laboratories Inc. (Westgrove, PA) | 711-675-152 | |
| Recombinant human PD-1 (poly-histidine tagged) | Acro Biosystems (Newark, DE) | PD1-H5256 | |
| Streptavidin-conjugated R-phycoerythrin (SAPE) | Agilent (Santa Clara, CA) | PJRS34-1 | |
| Trastuzumab (Herceptin, humanized anti-HER2 monoclonal antibody), negative control | Genentech/Roche (San Francisco, CA) | n/a (prescription medications) |
Références
- Kaumaya, P. T. B-cell epitope peptide cancer vaccines: a new paradigm for combination immunotherapies with novel checkpoint peptide vaccine. Future Oncology. 16 (23), 1767-1791 (2020).
- Pandey, P., et al. Revolutionization in cancer therapeutics via targeting major immune checkpoints PD-1, PD-L1 and CTLA-4. Pharmaceuticals. 15 (3), 335 (2022).
- Guo, L., Overholser, J., Good, A. J., Ede, N. J., Kaumaya, P. T. P. Preclinical studies of a novel human PD-1 B-cell peptide cancer vaccine PD1-Vaxx from BALB/c mice to beagle dogs and to non-human primates (cynomolgus monkeys). Frontiers in Oncology. 12, 826566 (2022).
- Brahmer, J. R., Hammers, H., Lipson, E. J. Nivolumab: Targeting PD-1 to bolster antitumor immunity. Future Oncology. 11 (9), 1307-1326 (2015).
- Shah, N. J., Kelly, W. J., Liu, S. V., Choquette, K., Spira, A. Product review on the Anti-PD-L1 antibody atezolizumab. Human Vaccines & Immunotherapeutics. 14 (2), 269-276 (2018).
- Postow, M. A., Sidlow, R., Hellmann, M. D. Immune-related adverse events associated with immune checkpoint blockade. The New England Journal of Medicine. 378 (2), 158-168 (2018).
- Kaumaya, P. T. A paradigm shift: Cancer therapy with peptide-based B-cell epitopes and peptide immunotherapeutics targeting multiple solid tumor types: Emerging concepts and validation of combination immunotherapy. Human Vaccines & Immunotherapeutics. 11 (6), 1368-1386 (2015).
- Guo, L., Kaumaya, P. T. P. First prototype checkpoint inhibitor B-cell epitope vaccine (PD1-Vaxx) en route to human Phase 1 clinical trial in Australia and USA: Exploiting future novel synergistic vaccine combinations. British Journal of Cancer. 125 (2), 152-154 (2021).
- Dakappagari, N. K., Douglas, D. B., Triozzi, P. L., Stevens, V. C., Kaumaya, P. T. Prevention of mammary tumors with a chimeric HER-2 B-cell epitope peptide vaccine. Cancer Research. 60 (14), 3782-3789 (2000).
- Dakappagari, N. K., et al. Conformational HER-2/neu B-cell epitope peptide vaccine designed to incorporate two native disulfide bonds enhances tumor cell binding and antitumor activities. The Journal of Biological Chemistry. 280 (1), 54-63 (2005).
- Kaumaya, P. T., et al. Phase I active immunotherapy with combination of two chimeric, human epidermal growth factor receptor 2, B-cell epitopes fused to a promiscuous Tcell epitope in patients with metastatic and/or recurrent solid tumors. Journal of Clinical Oncology. 27 (31), 5270-5277 (2009).
- Bekaii-Saab, T., et al. Phase I immunotherapy trial with two chimeric HER-2 B-cell peptide vaccines emulsified in montanide ISA 720VG and Nor-MDP adjuvant in patients with advanced solid tumors. Clinical Cancer Research. 25 (12), 3495-3507 (2019).
- Kaumaya, P. T. P., Guo, L., Overholser, J., Penichet, M. L., Bekaii-Saab, T. Immunogenicity and antitumor efficacy of a novel human PD-1 B-cell vaccine (PD1-Vaxx) and combination immunotherapy with dual trastuzumab/pertuzumab-like HER-2 B-cell epitope vaccines (B-Vaxx) in a syngeneic mouse model. Oncoimmunology. 9 (1), 1818437 (2020).
- Guo, L., Overholser, J., Darby, H., Ede, N. J., Kaumaya, P. T. P. A newly discovered PD-L1 B_cell epitope peptide vaccine (PDL1-Vaxx) exhibits potent immune responses and effective anti-tumor immunity in multiple syngeneic mice models and (synergizes) in combination with a dual HER-2 B-cell vaccine (B-Vaxx). Oncoimmunology. 11 (1), 2127691 (2022).
- . Luminex Corporation. The xMAP® Cookbook, 5th edition Available from: https://info.luminexcorp.com/en-us/research/download-the-xmap-cookbook?utm_referrr=https%3A%2F%2Fwww.luminexcorp.com%2F (2022)
- MagPlex® Microspheres Documentation. Product information sheet. Luminex Corporation Available from: https://www.luminexcorp.com/magplex-microspheres/#overview (2014)
- Green, M. R., Sambrook, J. . Estimation of cell number by hemocytometry counting. 2019 (11), (2019).
- Selecting the Detection System - Colorimetric, Fluorescent, Luminescent Methods for ELISA Assays. Corning Inc Available from: https://www.corning.com/catalog/cls/documents/application-notes/CLS-DD-AN-458.pdf (2019)
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon