Un matériau fantôme stable pour l’imagerie optique et acoustique
Dans cet article
Résumé
Ce protocole décrit la fabrication d’un matériau fantôme stable et biologiquement pertinent pour les applications d’imagerie biomédicale optique et acoustique, présentant des propriétés acoustiques et optiques accordables indépendamment.
Résumé
Il est impératif d’établir des matériaux fantômes biophotoniques imitant les tissus qui offrent une stabilité à long terme pour permettre la comparaison des dispositifs d’imagerie biomédicale entre les fournisseurs et les institutions, soutenir l’élaboration de normes reconnues à l’échelle internationale et faciliter l’application clinique de nouvelles technologies. Ici, un processus de fabrication est présenté qui aboutit à un matériau copolymère dans l’huile stable, peu coûteux et imitant les tissus pour une utilisation dans les efforts de normalisation photoacoustique, optique et ultrasonore.
Le matériau de base se compose d’huile minérale et d’un copolymère avec des numéros CAS (Chemical Abstract Service) définis. Le protocole présenté ici donne un matériau représentatif avec une vitesse du son c(f) = 1 481 ± 0,4 m·s-1 à 5 MHz (correspond à la vitesse du bruit de l’eau à 20 °C), une atténuation acoustique α(f) = 6,1 ± 0,06 dB·cm-1 à 5 MHz, une absorption optique μa(λ) = 0,05 ± 0,005 mm-1 à 800 nm, et la diffusion optique μs'(λ) = 1 ± 0,1 mm-1 à 800 nm. Le matériau permet un réglage indépendant des propriétés acoustiques et optiques en faisant varier respectivement la concentration en polymère ou la diffusion de la lumière (dioxyde de titane) et les agents absorbants (colorant soluble dans l’huile). La fabrication de différents modèles fantômes est affichée et l’homogénéité des objets de test résultants est confirmée à l’aide de l’imagerie photoacoustique.
En raison de son processus de fabrication facile et reproductible et de sa durabilité, ainsi que de ses propriétés biologiquement pertinentes, la recette du matériau est très prometteuse dans les initiatives de normalisation acoustique et optique multimodale.
Introduction
L’établissement de la précision et de l’exactitude de nouveaux biomarqueurs d’imagerie optique par validation technique 1,2 est primordial pour assurer leur mise en œuvre réussie dans la pratique clinique. Pour ce faire, les études de validation technique utilisent fréquemment des fantômes physiques durables, ce qui facilite l’évaluation des performances inter-instruments et le contrôle de la qualité de routine. Pour une utilisation généralisée d’un matériau fantôme dans la recherche et l’application clinique, un protocole de fabrication simple et hautement reproductible est nécessaire. Un matériau fantôme biophotonique idéal devrait comprendre les propriétés suivantes3 : (1) propriétés accordables indépendamment dans des plages biologiquement pertinentes; 2° la robustesse mécanique; 3) la stabilité à long terme; (4) flexibilité dans la géométrie et l’architecture; 5° une manipulation sécuritaire; (6) les ingrédients largement disponibles qui peuvent être achetés auprès de fournisseurs scientifiques standard; et (7) faible coût. À l’heure actuelle, les applications biophotoniques n’ont pas de protocole normalisé pour un matériau fantôme largement accepté qui réponde aux exigences décrites et inclut également des propriétés acoustiques accordables pour les applications hybrides, telles que l’imagerie photoacoustique (PAI).
Les matériaux fantômes biologiquement pertinents ciblés pour les applications optiques et acoustiques combinées comprennent les hydrogels 4,5, l’alcool polyvinylique (PVA)6,7,8,9 et le polychlorure de vinyle plastisol (PVCP)10,11,12,13,14,15,16 . Cependant, ces matériaux sont caractérisés par certaines limitations qui limitent leur application en tant que matériau fantôme stable. Les hydrogels, par exemple, sont sujets à la déshydratation, aux dommages mécaniques et à la croissance bactérienne, ce qui limite leur durée de conservation17,18,19. L’ajout de produits chimiques peut augmenter la longévité, mais les conservateurs courants, tels que le formaldéhyde20 ou le chlorure de benzalkonium21, sont dangereux et nécessitent des mesures de précaution lors de la manipulation. De plus, les cibles contenant des colorants solubles dans l’eau peuvent diffuser dans le matériau de base si elles ne sont pas encapsulées. Les cryogels PVA se caractérisent par une longévité et une robustesse structurelle plus élevées, mais leur processus de préparation implique de longs cycles de gel-dégel22. Cela peut limiter l’accordabilité indépendante des paramètres acoustiques et optiques23 et, s’ils sont légèrement modifiés, peut conduire à des inhomogénéités6, compromettant ainsi la reproductibilité. De plus, la diffusion de colorants à partir d’inclusions a été observée après 1 an13. Le PVCP a un processus de fabrication complexe qui comprend des températures élevées allant jusqu’à 180-220 °C 13,14,24,25. Le PVCP souffre également d’un manque de chaîne d’approvisionnement avec des fournisseurs scientifiques26 et peut contenir des plastifiants à base de phtalates, qui peuvent nuire à la reproduction et au développement27, ce qui en fait des substances contrôlées dans certains pays.
Les compositions copolymères dans l’huile, telles que la cire gel 28,29,30,31 ou les mélanges à base d’élastomères styréniques thermoplastiques 32,33,34,35,36, présentent une bonne stabilité longitudinale et présentent des propriétés acoustiques et optiques semblables à celles des tissus. 31,35,36,37, ayant ainsi un potentiel élevé en tant que candidat fantôme durable dans les applications multimodales. De plus, cette classe de matériaux est rentable, non absorbant l’eau, non toxique et biologiquement inerte35,38. La vitesse du son c(f) et le coefficient d’atténuation acoustique α(f) peuvent être réglés dans une plage biologiquement pertinente (tableau 1) par variation de la concentration du polymère 33,35,39, tandis que l’absorption optique μa(λ) et les coefficients de diffusion réduite μs'(λ) peuvent être principalement modifiés par addition de colorants solubles dans l’huile ou de dioxyde de titane (TiO2)39, respectivement.
Ici, un protocole simple et facile à suivre est présenté pour la création de fantômes copolymères dans l’huile durables adaptés à une utilisation dans l’étalonnage de dispositifs optiques, ultrasonores ou photoacoustiques. Tous les ingrédients ont des numéros définis Chemical Abstract Service (CAS) et sont facilement disponibles auprès des fournisseurs scientifiques standard. Les difficultés potentielles dans la procédure de fabrication sont mises en évidence et les moyens de les surmonter sont présentés. Alors que le protocole permet la fabrication de matériaux avec une gamme de propriétés acoustiques et optiques, le protocole présenté donne un matériau avec une vitesse sonore de ~1 481 m·s-1, alignée sur la vitesse du son de l’eau à température ambiante (20 °C)40. Cette valeur a été choisie comme étalon neutre pour représenter le large éventail de propriétés tissulaires existantes (tableau 1), ce qui a permis d’établir un point de référence cohérent et fiable pour la comparaison. En fournissant ce protocole détaillé, nous visons à élargir l’adoption et la reproductibilité de fabrication de ce type de matériau fantôme prometteur, facilitant ainsi les études de validation biophotonique, acoustique et photoacoustique et soutenant le contrôle qualité de routine dans les applications d’imagerie préclinique et clinique.
Protocole
Tableau 1 : Vue d’ensemble des propriétés acoustiques et optiques trouvées dans les tissus mous. Les propriétés optiques couvrent un spectre allant de 600 à 900 nm. Il convient de noter qu’il ne s’agit que de valeurs représentatives destinées à fournir une orientation générale. Les valeurs précises peuvent varier en fonction des conditions expérimentales (p. ex., température) et de la fréquence/longueur d’onde. La littérature fournit des valeurs plus spécifiques. *Aucune référence spécifique trouvée. Veuillez cliquer ici pour télécharger ce tableau.
Le protocole donné a été développé pour fabriquer ~120 ml de matériau fantôme. Les masses des composants peuvent être mises à l’échelle pour créer différents volumes de matériau fantôme. Veuillez noter que pour les plus grands volumes (> 500 mL), l’équipement proposé peut ne pas être en mesure de chauffer suffisamment le mélange fantôme de manière homogène. À cette fin, les équipements de chauffage devraient être adaptés de manière appropriée.
ATTENTION : Assurez-vous toujours que l’équipement de protection individuelle (EPI) approprié est porté tout au long du processus de fabrication. Cela peut inclure l’utilisation de sarraus de laboratoire, de lunettes de sécurité et de gants de sécurité; Reportez-vous aux directives de sécurité locales et respectez-les. La procédure est adaptée de Hacker et coll.39; un résumé des étapes est illustré à la figure 1.
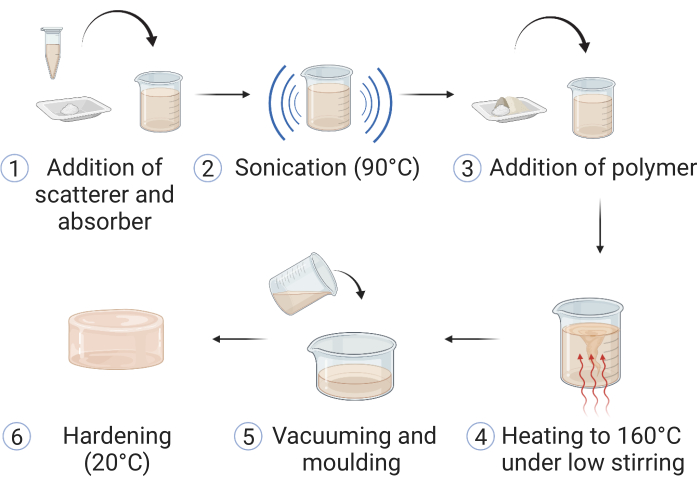
Figure 1 : Fabrication du matériau copolymère dans l’huile. (1) Des matériaux pour la diffusion optique et l’absorption sont ajoutés à l’huile minérale et (2) soniqués à 90 °C jusqu’à dissolution. (3) Addition(s) de polymère(s) et stabilisant(s) et (4) le mélange est chauffé dans un bain d’huile à 160 °C sous agitation faible. (5) Lors de la dissolution de tous les composants, l’échantillon est versé dans un moule fantôme approprié et (6) laissé durcir à température ambiante. Cette figure est reproduite à partir de Hacker et al.39. Veuillez cliquer ici pour voir une version agrandie de cette figure.
1. Préparation du mélange
- Préparer la solution mère de nigcolonine en ajoutant 0,4 g de nigcolonine à 40 ml d’huile minérale. Assurer un mélange homogène par sonication et vortex complet de l’échantillon. Conservez la solution mère à température ambiante.
REMARQUE: La solution mère doit toujours être soigneusement mélangée avant d’être réutilisée. Si un matériau fantôme sans diffuseur optique (TiO 2) ou absorbeur (colorant) est préféré, les étapes 1 et2 peuvent être ignorées. Passez à l’étape 3. - Sonicer 0,15 g deTiO2 et 1 mL de la solution mère de colorant dans 100 mL (83,8 g) d’huile minérale jusqu’à ce que tous les composants aient été complètement dissous (~60 min) (Figure 1 : étapes 1 et 2). Réglez le sonicateur à des températures élevées (90 °C) si l’équipement le permet, car cela facilite le processus de mélange. Passez aux étapes 3 à 5 pendant le temps de sonication.
REMARQUE: Si un fantôme avec des propriétés d’absorption et de diffusion plus élevées est préféré, le temps de sonication peut avoir besoin d’être prolongé. - Peser le polystyrène-bloc-poly(éthylène-ran-butylène)-bloc-polystyrène (SEBS) et le polyéthylène basse densité (LDPE) aux concentrations souhaitées (p. ex. PBU = 25,14 g; PEBD = 6,70 g) (Figure 1 : étape 3).
- Facultatif : Un antioxydant peut être ajouté pour augmenter la stabilité, mais il n’est pas obligatoire si les températures de chauffage ne dépassent pas 180°C.
REMARQUE: Dans le cas où des problèmes de solubilité ou de viscosité sont rencontrés à un stade ultérieur du processus de fabrication, il est conseillé d’exclure le LDPE. Le PEBD est incorporé pour améliorer la vitesse du son dans le matériau (tableau 3); Cependant, il n’est pas obligatoire pour créer un fantôme stable. En omettant le PEBD, le processus de fabrication et de moulage peut être simplifié, mais il en résultera une diminution de la vitesse ultérieure du son du matériau final (tableau 3).
- Facultatif : Un antioxydant peut être ajouté pour augmenter la stabilité, mais il n’est pas obligatoire si les températures de chauffage ne dépassent pas 180°C.
- Créer un bain d’huile en utilisant de la verrerie appropriée et de l’huile de silicone; Fixez-le soigneusement sur la plaque chauffante. Assurez-vous que le thermocouple reste dans le bain d’huile de silicone et ne touche pas les bords de la verrerie tout au long de la procédure (Figure 2).
REMARQUE : Assurez-vous que l’accessoire thermorégulateur est soigneusement monté, conformément aux instructions du fabricant de l’équipement. - Placez une barre d’agitation magnétique d’une longueur adéquate à l’intérieur du bain d’huile pour assurer une répartition uniforme de la chaleur.
- Allumez la plaque chauffante, réglez la température de chauffage à 160 °C et réglez les tours par minute (tr/min) de l’agitateur à 50.
- Transférer le LDPE et le SEBS dans le bécher en verre contenant l’huile minérale soniquée (avec TiO2 et Nigrosin). Introduire une barre d’agitation magnétique de longueur adéquate dans le bécher en verre et la transférer au centre du bain d’huile pour chauffer les composants mesurés. Assurez-vous que le niveau d’huile dans le bain reste supérieur au niveau d’huile minérale à l’intérieur du bécher (Figure 1 : étape 4).
2. Chauffage du mélange
- Si, à un stade quelconque, le polymère ajouté semble flotter sur l’huile minérale, agiter manuellement la solution d’huile minérale à l’aide d’une spatule métallique, de sorte que tout polymère flottant soit distribué à l’intérieur de l’huile minérale. Portez des gants résistants à la chaleur.
- Laisser le mélange à 160 °C jusqu’à ce que tout le polymère soit dissous et que la solution apparaisse uniformément mélangée, avec une texture lisse et homogène (~1,5 h).
3. Passer l’aspirateur
REMARQUE: Pour éliminer les bulles d’air, suivez les étapes suivantes, selon l’équipement disponible.
- Placez soigneusement le bécher chaud dans la chambre à vide et aspirez les échantillons pendant 2-3 minutes sur le réglage le plus élevé ( vide le plus bas). Utilisez une spatule métallique pour éliminer soigneusement les bulles d’air qui s’accumulent à la surface. Si des bulles d’air sont toujours présentes après cette étape, réchauffer le mélange et répéter l’étape d’aspiration jusqu’à ce que toutes les bulles d’air aient été éliminées.
- Allumez le four à vide et chauffez-le jusqu’à 160 °C. Une fois qu’il a atteint la température désirée, transférer le bécher avec la solution dans l’étuve à vide.
REMARQUE: Manipulez toujours le bécher avec des gants de protection contre la chaleur.- Mettez l’aspirateur au réglage le plus élevé (vide le plus bas) disponible. Si une couche de mousse s’est produite sur le dessus de la solution, éteignez l’aspirateur et retirez les bulles de la surface à l’aide d’une spatule (répétez cette étape jusqu’à ce que toutes les bulles d’air aient été éliminées).
- Laisser le bécher dans l’étuve à vide pendant 1 h au réglage de vide le plus élevé.
REMARQUE: Pour garder le four sous vide propre, nettoyez la surface externe du bécher d’huile de silicone avec une serviette en papier.
4. Verser les échantillons dans le moule
- Avant de verser les échantillons dans des moules d’échantillonnage, enlever les bulles d’air restantes à la surface du mélange avec une spatule si nécessaire.
- Versez soigneusement la solution dans un moule approprié, en portant des gants résistants à la chaleur ou en utilisant un équipement de protection adéquat. Assurez-vous d’une coulée régulière et régulière à partir d’une faible hauteur pour réduire le risque de formation de bulles d’air (Figure 1 : étape 5). Pour les moules aux formes complexes, enduisez le moule d’une fine couche d’huile (autre que l’huile minérale [p. ex., l’huile de ricin ou de silicone]) avant de verser pour faciliter le retrait de l’échantillon durci.
REMARQUE: Le préchauffage des moules dans un four peut aider à obtenir une homogénéité d’échantillon plus élevée. - Enlevez rapidement les bulles d’air du haut des échantillons à l’aide d’une spatule métallique une fois versée. Si de nombreuses bulles d’air se sont accumulées dans le mélange, répétez l’étape de vide, à condition que le type et la forme du moule le permettent.
- Laisser la solution prendre à température ambiante. Bien que les échantillons plus petits puissent durcir en moins de 2 heures, laissez les échantillons pendant la nuit pour éliminer tout risque de durcissement incomplet. Conservez les échantillons à température ambiante (Figure 1 : étape 6).
5. Acquisition d’images
- Pour l’acquisition d’images, placez le fantôme dans le champ de vision de l’appareil d’imagerie.
- Pour les systèmes PAI ou à ultrasons, effectuez un couplage acoustique de la surface fantôme au transducteur à ultrasons, par exemple avec du gel à ultrasons ou de l’eau.
REMARQUE: Si le protocole a été suivi correctement, aucune inhomogénéité ne doit perturber le champ de vision. Les porte-fantômes personnalisés peuvent aider au positionnement reproductible de l’échantillon entre les mesures. - Si la température d’acquisition diffère de la température de stockage du fantôme, laissez la température fantôme se stabiliser avec l’environnement.
- Acquérir une image.
6. Mesures de caractérisation des matériaux
NOTE: Le but des mesures de caractérisation des matériaux est la vérification des propriétés optiques et acoustiques du matériau. Il convient de noter que le protocole de fabrication fantôme a montré une reproductibilité élevée39, de sorte que les protocoles de mesure généraux qui suivent ne sont fournis qu’à titre indicatif si d’autres études de vérification sont souhaitées. Les étapes individuelles des mesures dépendront de l’équipement de caractérisation utilisé. Ici, un système basé sur une méthode de substitution de transmission à large bande41 (disponible au National Physical Laboratory (NPL), Royaume-Uni) a été utilisé pour la caractérisation acoustique et un système interne à double sphère d’intégration (DIS) a été utilisé (basé sur 42) pour la caractérisation optique. La configuration des systèmes de caractérisation est illustrée à la figure supplémentaire 1. Des détails supplémentaires sur les configurations de mesure (acoustique43; optique42,44) et la procédure de mesure39 peuvent être trouvés ailleurs. La procédure de mesure doit être adaptée en conséquence à chaque système de caractérisation spécifique utilisé.
- Caractérisation acoustique
NOTE: Les mesures de caractérisation acoustique sont basées sur un système utilisant un transducteur à ultrasons de fréquence centrale de 10 MHz (diamètre de l’élément actif de 10 mm) pour la génération d’impulsions et un hydrophone à large bande (hydrophone à membrane bilaminaire de 30 mm de diamètre de l’élément actif) pour la détection d’impulsions (tous deux placés dans un réservoir d’eau rempli d’eau désionisée; dimensions de 112 cm x 38 cm x 30 cm3). Le transducteur est entraîné par un récepteur d’impulsions. Les formes d’onde sont acquises à l’aide d’un oscilloscope. Vous trouverez plus de détails sur la configuration et la procédure de mesure (y compris les effets de type B spécifiques au système sur les mesures) dans le 43.- Préparer des échantillons adaptés à la configuration de mesure (par exemple, dans ce cas, des échantillons circulaires d’un diamètre de 7 à 8 cm et d’une épaisseur de 6 à 9 mm). Assurez-vous que les échantillons sont de composition homogène et exempts d’impuretés, de bulles d’air ou d’irrégularités de surface.
- Mesurer l’épaisseur de l’échantillon d’essai à l’aide d’étriers vernier et enregistrer la température du réservoir d’eau à l’aide d’un thermomètre étalonné.
- Placez l’échantillon dans le système. Assurez-vous que l’échantillon est correctement aligné avec les composants du système.
REMARQUE: Un porte-échantillon à commande automatique basé sur un support de cardan43 peut aider à contrôler avec précision la rotation et l’inclinaison de l’échantillon. - Acquérir quatre impulsions acoustiques pour chaque ensemble de mesure : une impulsion de référence à travers l’eau sans échantillon présent dans le trajet acoustique ; une transmission à travers l’échantillon; et les réflexions acoustiques reçues à l’émetteur par les surfaces avant et arrière de l’échantillon.
- Dériver les propriétés acoustiques de l’échantillon à partir des mesures. Calculer la vitesse du son c(f ) (en m·s−1) à l’aide de l’équation (1)43.
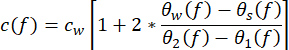 (1)
(1)
C W représente la vitesse du son de l’eau en fonction de la température, et θ1 (F), θ2 (F), θ W (F) et θS (F) sont les spectres de phase non enveloppés correspondants des impulsions de tension réfléchies à l’avant, réfléchies vers le bas, à travers l’eau et à travers l’échantillon, respectivement. Le coefficient d’affaiblissement dépendant de la fréquence (αi(f)) du matériau peut être calculé à l’aide de la technique de substitution à deux échantillons illustrée dans l’équation (2)43.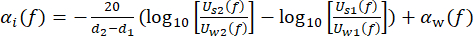 (2)
(2)
U w(f) et Us(f) sont les spectres de grandeur de tension respectifs de l’impulsion traversante et de l’impulsion traversante de l’échantillon, αw(f) est le coefficient d’atténuation des ultrasons (en dB·cm-1) de l’eau pure à la température spécifique du réservoir d’eau45, et d 1 et d 2 (d 2 > d1) sont deux épaisseurs d’échantillon.
NOTE: Pour le présent protocole, l’atténuation tenant compte des pertes interfaciales a été évaluée, estimant que son impact était négligeable. - Répéter la mesure plus de trois fois à différentes positions sur l’échantillon d’essai. Calculer la moyenne et l’écart-type des mesures pour obtenir une valeur finale de l’échantillon.
- Caractérisation optique
REMARQUE: Pour les tests optiques, un système de sphère à double intégration a été utilisé (basé sur 42), utilisant deux sphères intégratrices (50 mm de diamètre interne) qui sont connectées à deux spectromètres via deux fibres optiques. La sphère de réflectance est connectée à une source lumineuse via une troisième fibre optique.- Préparer des échantillons adaptés à la configuration de mesure (par exemple, dans ce cas, des échantillons rectangulaires d’une largeur de 5,9 cm, d’une hauteur de 1,8 cm et d’une épaisseur comprise entre 2 et 3 mm). Assurez-vous que les échantillons sont de composition homogène et exempts d’impuretés, de bulles d’air ou d’irrégularités de surface.
- Allumez la source lumineuse et laissez-la se stabiliser selon les instructions du fabricant (p. ex., 15 min).
- Déterminer l’épaisseur de l’échantillon à l’aide d’étriers verniers. S’il y a lieu, précisez la gamme de longueurs d’onde et la taille des pas pour la mesure (p. ex., 450-900 nm avec une taille de pas de 1 nm).
- Enregistrer les mesures de référence pour la sphère de transmission et de réflectance.
- Pour la sphère de réflectance, prenez d’abord une mesure d’orifice ouvert en enregistrant la valeur de réflectance R0 avec la sphère de transmittance retirée et la source lumineuse allumée. Ensuite, notez la valeur de réflectance R1avec un étalon de référence maintenu devant la sphère de réflectance (source lumineuse allumée).
- Pour la sphère de transmittance, prenez d’abord une mesure de faisceau bloqué en enregistrant la valeur de transmittance T0 avec les sphères de réflectance et de transmittance alignées et la source lumineuse éteinte. Ensuite, prenez une mesure de faisceau incident en enregistrant la valeur de transmittance T1 avec les sphères de réflectance et de transmittance alignées et la source lumineuse allumées.
NOTA: Une surface propre des sphères et un étalon de référence doivent être assurés pour les mesures, car la collation de la poussière ou d’autres contaminants peut avoir une incidence sur la performance des composants46.
- Placez l’échantillon entre les sphères. Mesurer les valeurs de réflectance Rs et de transmittance T. Assurez-vous que l’échantillon n’est pas comprimé, car cela pourrait avoir un impact sur la précision de la mesure. Placer une sphère sur une platine motorisée peut aider à contrôler avec précision la distance entre les sphères en l’adaptant à l’épaisseur de l’échantillon mesurée.
- Calculer les valeurs normalisées de réflectance M R et de transmittance MT à l’aide des équations (3) et (4)42.
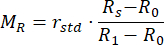 (3)
(3)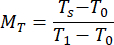 (4)
(4)
RSTD représente l’intensité reflétée par la norme de réflectance de 99 %. - Entrez les valeurs mesurées dans un programme de doublement par addition inverse (IAD) (code source : http://omlc.org/software/iad/)44 pour estimer les propriétés optiques du matériau.
NOTE: Sur la base des rapports précédents, le facteur d’anisotropie de diffusion (g) peut être considéré comme g = 0,7 et l’indice de réfraction comme n = 1,4 30. - Répéter la mesure au moins trois fois à différentes positions le long de l’échantillon d’essai. Calculer la moyenne et l’écart-type des mesures pour obtenir une valeur finale de l’échantillon.
Résultats Représentatifs
Suivant cette recette, trois modèles fantômes représentatifs ont été créés à des fins d’imagerie photoacoustique, ciblés pour différentes conceptions de systèmes avec différentes géométries d’éclairage optique et de détection acoustique (Figure 3A). Si la procédure de préparation fantôme est effectuée avec succès, le matériau fantôme apparaît lisse et homogène sans bulles d’air piégées ni impuretés, et aucun artefact ne peut être vu dans l’image résultante (ici visualisée à l’aide de l’imagerie photoacoustique; Figure 3B, C). Le protocole donne un matériau représentatif avec une vitesse du son c(f) = 1481 ± 0,4 m·s-1 (correspondant à la vitesse du bruit de l’eau à 20 °C40), une atténuation acoustique α(f) = 6,1 ± 0,06 dB·cm-1 (toutes deux à 5 MHz), une absorption optique μa(λ) = 0,05 ± 0,005 mm-1 et une diffusion optique μs'(λ) = 1 ± 0,1 mm-1 (les deux à 800 nm) (l’incertitude illustre l’écart type par rapport à n = 3 lots produits indépendamment par différents opérateurs; toutes les mesures ont été effectuées à température ambiante [20 °C]).
Le coefficient de diffusion optique peut être réglé par la variation de TiO 2, tandis que le coefficient d’absorption optique peut être réglé par l’ajout de tout colorant soluble dans l’huile, démontré ici avec la nigcolonine (Tableau 2 et Figure 3D). Bien que les valeurs du tableau 2 soient axées sur les tissus à faible absorption et diffusion, tels que les muscles ou les seins (tableau 1), nous n’avons rencontré aucune difficulté à ajouter des absorbeurs et des diffuseurs à des concentrations plus élevées. Cependant, l’ajout de diffuseurs/absorbeurs optiques à des concentrations plus élevées peut nécessiter des temps de sonication plus longs pour obtenir un mélange homogène de la solution.
L’atténuation acoustique et la vitesse du son peuvent être réglées par variation de la concentration du polymère (tableau 3). Ici, l’accord est jusqu’à présent limité à une vitesse de gamme sonore de ~1 450-1 516 m·s-1. Des concentrations respectives plus faibles de polymères peuvent entraîner une faible stabilité physique de l’échantillon, entraînant une déformation plastique au fil du temps34. Des concentrations plus élevées de polymères entraînent une fragilité et une texture inégale du matériau. La gamme de propriétés acoustiques peut aider à imiter des tissus tels que le sein ou la graisse (c = 1 450-1 480 m·s−1), mais peut être insuffisante pour des tissus tels que les muscles ou les reins (c > 1 520 m·s−1; Tableau 1).
Les sources d’erreur courantes dans la préparation fantôme comprennent l’élimination insuffisante des bulles d’air et le mélange non homogène des composants de base (figure 4). Cela peut être minimisé en passant l’aspirateur et en versant soigneusement, et en remuant / vortex, respectivement.
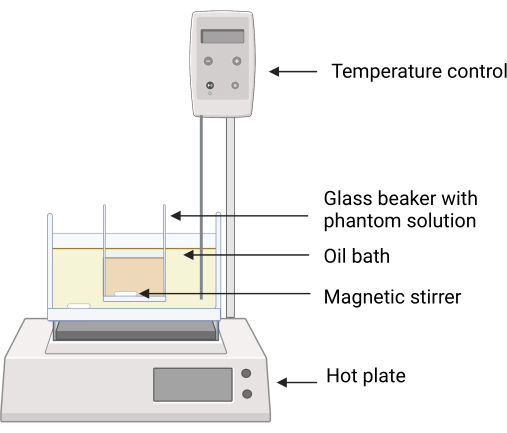
Figure 2 : Installation expérimentale pour la fabrication du fantôme. Le bécher en verre contenant les ingrédients fantômes est placé dans le bain d’huile de silicone à l’aide d’une pince pour éviter tout contact direct entre les surfaces du bain d’huile et le bécher en verre. Le retour de température sur la plaque chauffante assure un contrôle minutieux de la température. Les agitateurs magnétiques permettent de mélanger à la fois l’huile de silicone et les ingrédients fantômes. Veuillez cliquer ici pour voir une version agrandie de cette figure.
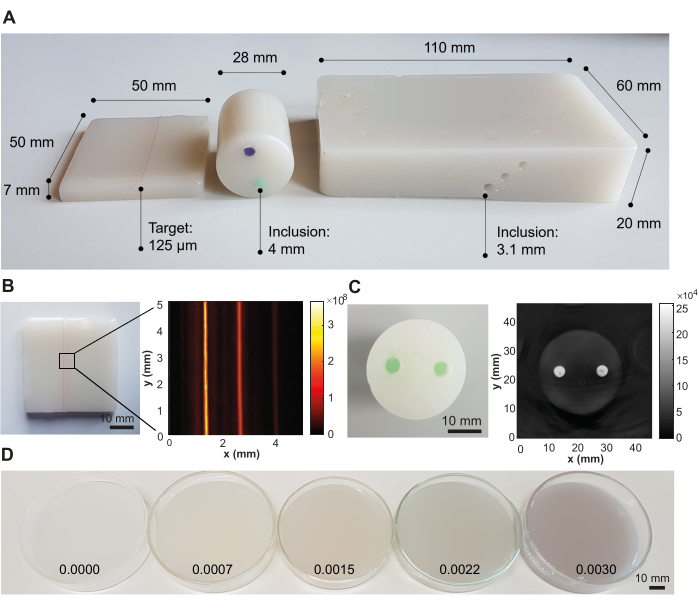
Figure 3 : Résultats représentatifs de la procédure de fabrication du fantôme. (A) Diverses conceptions de fantômes montrant une polyvalence pour une application dans différents systèmes d’imagerie photoacoustique. À gauche : petit fantôme rectangulaire avec des chaînes intégrées à différentes profondeurs (0,5, 1,5 et 2,5 mm ; distance inter-cibles de 1,25 mm) conçu pour tester des systèmes d’imagerie haute résolution ; milieu : fantôme cylindrique avec deux inclusions (distance d’inter-inclusion de 12 mm) utilisant un colorant soluble dans l’huile vert et violet, conçu pour tester les systèmes de tomographie; À droite : Grand fantôme rectangulaire avec canaux intégrés à différentes profondeurs (6 mm, 10 mm et 14 mm ; distance d’inter-inclusion de 3,5 mm), conçu pour tester un système portatif. (B) Exemple d’image photoacoustique du fantôme rectangulaire avec chaînes intégrées, acquise à 532 nm avec un système d’imagerie photoacoustique commercial. (C) Exemple d’image photoacoustique du fantôme tomographique cylindrique, acquise à 800 nm avec un système d’imagerie photoacoustique commercial. (D) Fantômes avec des concentrations d’absorption optique croissantes par des concentrations croissantes de nigcolonine (concentrations données en pourcentage en poids du volume total d’huile minérale sur l’image). La figure 3B,C est tirée de Hacker et coll.39. Barres d’échelle = 10 mm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
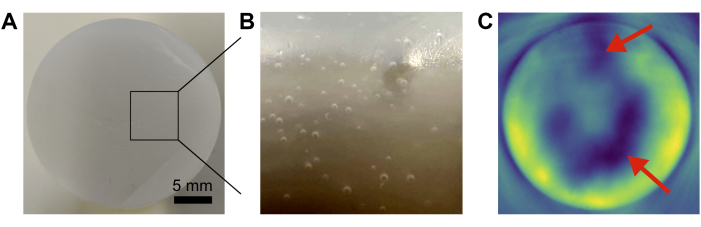
Figure 4 : Défaillances fantômes courantes. (A,B) Photographies montrant des bulles d’air piégées à l’intérieur de la matrice de base. (C) Un mélange insuffisant des composants de base entraîne des inhomogénéités (flèches rouges) dans l’image photoacoustique résultante. Barre d’échelle = 5 mm (A). Veuillez cliquer ici pour voir une version agrandie de cette figure.
Tableau 2 : Vue d’ensemble tabulaire de l’ajustement des valeurs d’absorption optique (μa) et de diffusion (μs'). Les valeurs en pourcentage sont données en pourcentage en poids du volume total de la solution de base (huile minérale, colonne 1) et du poids total de la matière fantôme (colonne 2). Les concentrations de nigcolonine représentent la quantité totale de nigcolonine absolue (et non de solution mère). Tous les échantillons comprenaient de l’hydroxytoluène butylé à 5 % comme antioxydant (facultatif). n = 3 mesures par échantillon. Une représentation visuelle du tableau se trouve dans Hacker et al.39. Abréviation : neg = négligeable. Veuillez cliquer ici pour télécharger ce tableau.
Tableau 3 : Vue d’ensemble tabulaire de l’accord des valeurs d’atténuation acoustique (α) et de vitesse du son (c). Décrit par la loi de puissance α 0f n avec α0 et n paramètres obtenus à partir d’un ajustement non linéaire des moindres carrés (n = 4 mesures par échantillon). F représente la fréquence en MHz. Les valeurs en pourcentage sont données en pourcentage en poids par rapport au poids total de la solution de base (huile minérale). Tous les échantillons comprenaient de l’hydroxytoluène butylé à 5 % comme antioxydant (facultatif). Une représentation visuelle du tableau se trouve dans Hacker et al.39. Veuillez cliquer ici pour télécharger ce tableau.
Figure supplémentaire S1 : Configuration des systèmes de caractérisation acoustique et optique utilisés pour les vérifications. Une photographie (A) et un schéma (B) du système de caractérisation acoustique pour la détermination du coefficient d’atténuation acoustique et de la vitesse du son sont affichés. Les composants individuels du système sont indiqués par des annotations HP (HydroPhone), S (échantillon) et T (transducteur) sur la photo et le schéma. Une photographie (C) et un schéma (D) du système de sphère à double intégration pour l’évaluation du coefficient d’absorption optique et du coefficient de diffusion réduit sont présentés. Les composants individuels du système sont désignés par les annotations S (échantillon), RS (sphère de réflectance), TS (sphère de transmission), OF (fibre optique) et MS (étage motorisé) sur la photo et le schéma. Cette figure est reproduite à partir de Hacker et al. 39. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
Ici, un protocole est présenté qui vise à fournir une recette polyvalente pour un matériau stable et biologiquement pertinent qui peut être utilisé pour créer des fantômes pour les mesures d’étalonnage et la normalisation dans les applications d’imagerie biomédicale acoustique et optique multimodales. Il a déjà été démontré que le matériau était stable dans le temps39, qu’il avait une reproductibilité élevée d’un lot à l’autre, qu’il était sûr à utiliser et qu’il se composait d’ingrédients facilement disponibles et rentables provenant de fournisseurs scientifiques standard. Les propriétés des matériaux sont réglables indépendamment dans les régimes acoustiques et optiques pertinents. De plus, il est mécaniquement robuste et insoluble dans l’eau, résistant ainsi à une manipulation brutale, et il est inerte aux agents de couplage à base d’eau utilisés dans la recherche ultrasonique / photoacoustique. Il a été souligné que différents modèles fantômes peuvent être créés avec différents types d’inclusions, composés du même type de matériau ou de types de matériaux différents. Compte tenu de ces propriétés, le matériau remplit les critères clés susmentionnés pour un fantôme biophotonique idéal et présente des avantages clés par rapport à d’autres matériaux imitant les tissusexistants 3. En détaillant le processus de fabrication exact, nous espérons minimiser les variations découlant de la procédure de fabrication, optimisant ainsi son utilisation pour l’étalonnage, la validation et le suivi des performances des systèmes d’imagerie.
Deux étapes clés ont été identifiées comme étant essentielles au processus de fabrication. Tout d’abord, les ingrédients doivent être soigneusement mélangés et chauffés uniformément pour la création d’un matériau homogène. L’utilisation d’un sonicateur et d’un agitateur magnétique pour le mélange et d’un bain d’huile pour le chauffage assure une répartition uniforme des composants matériels dans la matrice de base. Il faut veiller à ce que le bain d’huile n’atteigne pas des températures très élevées (>180 °C), car cela entraînerait une oxydation des composants du matériau, entraînant une décoloration jaunâtre. L’agitation manuelle peut soutenir le processus de mélange et compenser l’échauffement insuffisant de l’interface matière-air. Le temps de sonication et de mélange peut devoir être prolongé lorsqu’une concentration plus élevée de TiO2 et/ou de polymères est utilisée pour assurer une composition homogène du matériau. Deuxièmement, les bulles d’air doivent être éliminées pour empêcher la formation d’hétérogénéités au sein de la matrice de base. Bien que cela puisse être réalisé avec une pompe à vide ou un four, une coulée prudente à partir d’une faible hauteur doit également être pratiquée pour minimiser le piégeage de l’air dans le matériau.
Un avantage significatif du matériau est ses propriétés thermoplastiques (dérivées du polymère SEBS), ce qui lui permet d’être réchauffé et remoulé sans impact significatif sur ses propriétés acoustiques et optiques39. Cependant, le réchauffage doit être effectué progressivement et soigneusement, car le matériau peut facilement brûler et s’oxyder s’il est réchauffé trop rapidement. Le réchauffage devient également plus difficile lorsque des concentrations plus élevées de LDPE sont utilisées, car le LDPE ne présente pas le même comportement thermoplastique que le SEBS.
Plusieurs limites du protocole demeurent. En raison de la température de fusion élevée des polymères (150 °C), les moules fantômes doivent être fabriqués à partir d’un matériau résistant à la chaleur, tel que le verre ou l’acier inoxydable. De plus, le matériau est assez visqueux à l’état liquide si une concentration élevée de polymère est utilisée pour régler les propriétés acoustiques, ce qui rend difficile le remplissage de petites cibles d’imagerie. Enfin, l’accord des propriétés acoustiques est jusqu’à présent limité à une vitesse de gamme sonore de ~1450-1 516 m·s-1 qui supporte des tissus imitateurs tels que la poitrine ou la graisse (c = 1 450-1 480 m·s−1), mais peut être insuffisant pour des tissus comme les muscles ou les reins (c > 1 520 m·s−1). Le changement concomitant de l’atténuation acoustique doit également être pris en considération.
Ici, nous avons mis en évidence l’application du matériau en tant que fantôme stable pour les applications d’échographie et d’imagerie optique. Cependant, les matériaux copolymères dans l’huile se sont également révélés utiles dans les applications d’élastographie35 et pourraient potentiellement permettre la compatibilité avec d’autres modalités d’imagerie telles que l’imagerie par résonance magnétique. Un réalisme anatomique accru des fantômes peut être obtenu en utilisant des moules imprimés en 3D, comme le montrent des études similaires 29,47,48,49. Les premières études ont également démontré l’imprimabilité 3D du matériau lui-même, ce qui étend encore sa flexibilité en termes de traitement et de fabrication. Ces développements mettent en évidence le potentiel futur passionnant du matériau en tant que milieu fantôme stable et largement utilisé pour les applications d’imagerie multimodale.
Déclarations de divulgation
Sarah Bohndiek a déjà reçu un soutien de recherche de CYBERDYNE INC et iThera Medical GmbH, fournisseurs d’instruments d’imagerie photoacoustique. Les autres auteurs n’ont aucun conflit d’intérêts lié au présent manuscrit à divulguer.
Remerciements
LH a été financé par le programme MedAccel de NPL financé par le Fonds de défi de la stratégie industrielle du ministère des Affaires, de l’Énergie et de la Stratégie industrielle. JMG a reçu un financement de la Deutsche Forschungsgemeinschaft (DFG, Fondation allemande pour la recherche) dans le cadre du projet GR 5824/1. JJ reconnaît le soutien financier de l’Academy of Medical Sciences Springboard (REF: SBF007\100007). SEB reconnaît le soutien de Cancer Research UK sous le numéro de subvention C9545/A29580. AMI, BZ et SR ont été soutenus par le ministère britannique des Affaires, de l’Énergie et de la Stratégie industrielle via le financement du système national de mesure. Les figures 1 et 2 ont été créées avec BioRender.
matériels
| Name | Company | Catalog Number | Comments |
| Low-density Polyethylene (LDPE) | Alfa Aesar | 43949.30 CAS: 9002-88-4 | 6.70 g 5.8% w/w |
| Mineral oil | Sigma Aldrich | 330779-1L CAS: 8042-47-5 | 83.80 g 72.5% w/w |
| Nigrosin | Sigma Aldrich | 211680-100G CAS: 11099-03-9 | 0.4 g |
| Polystyrene-block-poly(ethylene-ran-butylene)-block-polystyrene (SEBS) | Sigma Aldrich | 200557-250G CAS: 66070-58-4 | 25.14 g 21.7% w/w |
| Silicone oil for oil bath | Sigma Aldrich | 85409-1L CAS: 63148-62-9 ~1 L (depending on size of oil bath) | |
| Titanium(IV) oxide, anatase (TiO2) | Sigma Aldrich | 232033 CAS: 1317-70-0 | 0.15 g |
| Antioxidant (optional; e.g., butylated hydroxytoluene) | Sigma Aldrich | W218405-1KG-K CAS: 128-37-0 | may be added to prevent discolouration if higher fabrication temperatures are used |
| Oil-solule dyes for inclusions (optional) | e.g., Caligo safe wash relief inks, Cranfield Colours, Cwmbran, UK* | may be added depending on preferred absorption | |
| Bath Sonicator | Ultrawave Ltd, UK* | U500H Ultrasonic Cleaning Bath* | ideally with temperature control; recommended operating frequencies between 30-50 kHz) |
| Crystallising dish for silicone oil bath (up to +200 °C) | any suitable supplier | (ext. diameter ~140 mm for 250 mL glass beaker) | |
| Glass beaker (~250 mL); glass sample dishes/phantom mould | any suitable supplier | ||
| Hot plate with magnetic stirrer and thermoregulator (external probe thermocouple) with maximum temperature of > 200 °C | Thermo Fisher Scientific, UK* | Velp Scientifica AREC.X Digital Ceramic Hot Plate Stirrer* | |
| Laboratory scales / scientific balances accurate to 0.01 g | any suitable supplier | ||
| Metallic spatula | any suitable supplier | ||
| Vaccuum oven or vaccum chamber | Memmert, Germany (Vacuum oven)* Cole-Parmer Instrument Company, UK (Vaccum chamber)* | VO29 (Vacuum oven) DWK Life Sciences (Kimble) Glass Vacuum Desiccator with Collar (Vaccum chamber)* | |
| 1. Acoustic characterization system* | |||
| Hydrophone | GEC Marconi | 30 mm active element diameter bilaminar membrane hydrophone | |
| Oscilloscope | Tektronix UK, Bracknell, UK | DPO 7254 | |
| Pulser–receiver | Olympus NDT, Waltham, MA, USA | Olympus 5073PR | |
| Sample holder | Newport Spectra-Physics, Didcot, UK | Newport 605-4 Series Low-Distortion Axial Clamping Gimbal Optic Mount | may require additional adaptor for sample holding |
| Thermometer | G. H. Zeal, London, UK | UKAS-calibrated IP 39C spirit-in-glass thermometer | |
| Ultrasound transducer | Force Technology, Brondby, Denmark | Transducer of active element diameter 10 mm | |
| Vernier callipers | any suitable supplier | ||
| Water tank filled with deionized water | any suitable supplier | requires sufficent size (e.g., dimensions 112 × 38 × 30 cm3) | |
| 2.Optical characterization system* | |||
| Integrating sphere (two) | Avantes, Apeldoorn, the Netherlands | AvaSphere-50, 50 cm internal diameter | |
| Light source | Avantes, Apeldoorn, the Netherlands | Avalight-HAL-s-mini | |
| Motorized stage (optional) | Thorlabs, | Thorlabs MTS50 | |
| Optical fibres (three) | any suitable supplier | ||
| Reflectance standard | Labsphere, North Sutton, USA | 99%, white, 1.25" diameter, USRS-99-010, AS-01158-060 | |
| Spectrometer | Avantes, Apeldoorn, the Netherlands | Starline Avaspec-2048 | |
| Software | |||
| Data acqusition software (e.g., Labview) | National Instruments, Austin, TX, USA | ||
| Data analysis software (e.g., Matlab) | Mathworks, Natick, USA | ||
| Inverse adding doubling (IAD) program | Source code: http://omlc.org/software/iad/ | ||
| *Please note that similar equipment may also be used. |
Références
- Waterhouse, D. Translation of optical imaging biomarkers: opportunities and challenges. Nature Biomedical Engineering. 3 (5), 339-353 (2019).
- O'Connor, J. P. B., et al. Imaging biomarker roadmap for cancer studies. Nature Reviews Clinical Oncology. 14 (3), 169-186 (2017).
- Hacker, L., et al. Criteria for the design of tissue-mimicking phantoms for the standardization of biophotonic instrumentation. Nature Biomedical Engineering. 6 (5), 541-558 (2022).
- Laufer, J., Zhang, E., Beard, P. Evaluation of absorbing chromophores used in tissue phantoms for quantitative photoacoustic spectroscopy and imaging. IEEE Journal of Selected Topics in Quantum Electronics. 16 (3), 600-607 (2010).
- Cook, J. R., Bouchard, R. R., Emelianov, S. Y. Tissue-mimicking phantoms for photoacoustic and ultrasonic imaging. Biomedical Optics Express. 2 (11), 3193-3206 (2011).
- Xia, W., et al. Poly(vinyl alcohol) gels as photoacoustic breast phantoms revisited. Journal of Biomedical Optics. 16 (7), 075002 (2011).
- Manohar, S., et al. Photoacoustic mammography laboratory prototype: imaging of breast tissue phantoms. J Biomed Opt. 9, 1172 (2004).
- Blumenröther, E., Melchert, O., Wollweber, M., Roth, B. Detection, numerical simulation and approximate inversion of optoacoustic signals generated in multi-layered PVA hydrogel based tissue phantoms. Photoacoustics. 4 (4), 125-132 (2016).
- Kharine, A., et al. Poly(vinyl alcohol) gels for use as tissue phantoms in photoacoustic mammography. Physics in Medicine and Biology. 48 (3), 357-370 (2003).
- Spirou, G. M., Oraevsky, A. A., Vitkin, I. A., Whelan, W. M. Optical and acoustic properties at 1064 nm of polyvinyl chloride-plastisol for use as a tissue phantom in biomedical optoacoustics. Physics in Medicine and Biology. 50 (14), N141-N153 (2005).
- Bohndiek, S. E., Bodapati, S., Van De Sompel, D., Kothapalli, S. -. R., Gambhir, S. S. Development and application of stable phantoms for the evaluation of photoacoustic imaging instruments. PLoS One. 8 (9), e75533 (2013).
- Fonseca, M., Zeqiri, B., Beard, P. C., Cox, B. T. Characterisation of a phantom for multiwavelength quantitative photoacoustic imaging. Physics in Medicine and Biology. 61 (13), 4950-4973 (2016).
- Vogt, W. C., Jia, C., Wear, K. A., Garra, B. S., Joshua Pfefer, T. Biologically relevant photoacoustic imaging phantoms with tunable optical and acoustic properties. Journal of Biomedical Optics. 21 (10), 101405 (2016).
- Dantuma, M., van Dommelen, R., Manohar, S. Semi-anthropomorphic photoacoustic breast phantom. Biomedical Optics Express. 10 (11), 5921-5939 (2019).
- Jeong, E., et al. Fabrication and characterization of PVCP human breast tissue-mimicking phantom for photoacoustic imaging. BioChip Journal. 11, 67-75 (2017).
- Jia, C., Vogt, W. C., Wear, K. A., Pfefer, T. J., Garra, B. S. Two-layer heterogeneous breast phantom for photoacoustic imaging. Journal of Biomedical Optics. 22 (10), 1-14 (2017).
- Madsen, E. L., Hobson, M. A., Shi, H., Varghese, T., Frank, G. R. Stability of heterogeneous elastography phantoms made from oil dispersions in aqueous gels. Ultrasound in Medicine & Biology. 32 (2), 261-270 (2006).
- Culjat, M. O., Goldenberg, D., Tewari, P., Singh, R. S. A review of tissue substitutes for ultrasound imaging. Ultrasound in Medicine & Biology. 36 (6), 861-873 (2010).
- Zell, K., Sperl, J. I., Vogel, M. W., Niessner, R., Haisch, C. Acoustical properties of selected tissue phantom materials for ultrasound imaging. Physics in Medicine and Biology. 52 (20), N475-N484 (2007).
- Lazebnik, M., Madsen, E. L., Frank, G. R., Hagness, S. C. Tissue-mimicking phantom materials for narrowband and ultrawideband microwave applications. Physics in Medicine and Biology. 50 (18), 4245-4258 (2005).
- Ramnarine, K. V., Anderson, T., Hoskins, P. R. Construction and geometric stability of physiological flow rate wall-less stenosis phantoms. Ultrasound in Medicine & Biology. 27 (2), 245-250 (2001).
- Pogue, B. W., Patterson, M. S. Review of tissue simulating phantoms for optical spectroscopy, imaging and dosimetry. Journal of Biomedical Optics. 11 (4), 041102 (2006).
- Lamouche, G., et al. Review of tissue simulating phantoms with controllable optical, mechanical and structural properties for use in optical coherence tomography. Biomedical Optics Express. 3 (6), 1381-1398 (2012).
- Bohndiek, S. E., Van de Sompel, D., Bodapati, S., Kothapalli, S. R., Gambhir, S. S. Stable phantoms for characterization of photoacoustic tomography (PAT) systems. Design and Performance Validation of Phantoms Used in Conjunction with Optical Measurement of Tissue V. 858308, 30-35 (2013).
- Fenollar, O., Sanchez-Nacher, L., Garcia-Sanoguera, D., López, J., Balart, R. The effect of the curing time and temperature on final properties of flexible PVC with an epoxidized fatty acid ester as natural-based plasticizer. Journal of Materials Science. 44, 3702-3711 (2009).
- Fonseca, M., Zeqiri, B., Beard, P., Cox, B. Characterisation of a PVCP-based tissue-mimicking phantom for quantitative photoacoustic imaging. European Conference on Biomedical Optics. , 953911 (2015).
- Heudorf, U., Mersch-Sundermann, V., Angerer, J. Phthalates: toxicology and exposure. International Journal of Hygiene and Environmental Health. 210 (5), 623-634 (2007).
- Maneas, E., et al. Gel wax-based tissue-mimicking phantoms for multispectral photoacoustic imaging. Biomed. Opt. Express. 9 (3), 1151-1163 (2018).
- Maneas, E., et al. Anatomically realistic ultrasound phantoms using gel wax with 3D printed molds. Physics in Medicine and Biology. 63 (1), 015033 (2018).
- Jones, C. J. M., Munro, P. R. T. Stability of gel wax based optical scattering phantoms. Biomedical Optics Express. 9 (8), 3495-3502 (2018).
- Ivory, A. M., Shah, A., Rajagopal, S., Zeqiri, B. Development and investigation of the acoustic properties of tissue-mimicking materials for photoacoustic imaging techniques. IEEE International Ultrasonics Symposium. IEEE. , 1489-1492 (2019).
- Grillo, F. W., Cabrelli, L. C., Sampaio, D. R. T., Carneiro, A. A. O., Pavan, T. Z. Glycerol in oil-based phantom with improved performance for photoacoustic imaging. 2017 IEEE International Ultrasonics Symposium. IEEE. , 1-4 (2017).
- Cabrelli, L. C., et al. Oil-based gel phantom for ultrasound and optical imaging. Biophotonics South America. SPIE. 9531, 40-46 (2015).
- Cabrelli, L. C., et al. Stable phantom materials for ultrasound and optical imaging. Physics in Medicine and Biology. 62 (2), 432-447 (2017).
- Oudry, J., Bastard, C., Miette, V., Willinger, R., Sandrin, L. Copolymer-in-oil phantom materials for elastography. Ultrasound in Medicine & Biology. 35 (7), 1185-1197 (2009).
- Suzuki, A., et al. Oil gel-based phantom for evaluating quantitative accuracy of speed of sound measured in ultrasound computed tomography. Ultrasound in Medicine & Biology. 45 (9), 2554-2567 (2019).
- Cabrelli, L. C., Grillo, F. W., Carneiro, A. A. O., Pavan, T. Z. Copolymer-in-oil tissue-mimicking material with tunable acoustic properties. 2016 IEEE International Ultrasonics Symposium. IEEE. , 1-4 (2016).
- Cabrelli, L. C., et al. Copolymer-in-oil phantoms for photoacoustic imaging. 2015 IEEE International Ultrasonics Symposium. IEEE. , 1-4 (2015).
- Hacker, L., et al. A copolymer-in-oil tissue-mimicking material with tuneable acoustic and optical characteristics for photoacoustic imaging phantoms. IEEE Transactions on Medical Imaging. 40 (12), 3593-3603 (2021).
- Greenspan, M., Tschiegg, C. E. Speed of sound in water by a direct method. Journal of Research of the National Bureau of Standards. 59 (4), 249-254 (1957).
- Zeqiri, B., Scholl, W., Robinson, S. P. Measurement and testing of the acoustic properties of materials: a review. Metrologia. 47 (2), S156-S171 (2010).
- Pickering, J. W., et al. Double-integrating-sphere system for measuring the optical properties of tissue. Applied Optics. 32 (4), 399-410 (1993).
- Rajagopal, S., Sadhoo, N., Zeqiri, B. Reference characterisation of sound speed and attenuation of the IEC agar-based tissue-mimicking material up to a frequency of 60 MHz. Ultrasound in Medicine & Biology. 41 (1), 317-333 (2015).
- Prahl, S. A. Everything I think you should know about Inverse Adding-Doubling. Oregon Medical Laser Center, St. Vincent Hospital. 1344, 1-74 (2011).
- Pinkerton, J. M. M. The absorption of ultrasonic waves in liquids and its relation to molecular constitution. Proceedings of the Physical Society. Section B. 62 (2), 129-141 (1949).
- Hu, D., Lu, R., Huang, Y., Ying, Y., Fu, X. Effects of optical variables in a single integrating sphere system on estimation of scattering properties of turbid media. Biosystems Engineering. 194, 82-98 (2020).
- Grillo, F. W., et al. Patient-specific neurosurgical phantom: assessment of visual quality, accuracy, and scaling effects. 3D Printing in Medicine. 4 (1), 3 (2018).
- Nikitichev, D. I., et al. Construction of 3-dimensional printed ultrasound phantoms with wall-less vessels. Journal of Ultrasound in Medicine. 35 (6), 1333-1339 (2016).
- West, S. J., et al. Development of an ultrasound phantom for spinal injections with 3-dimensional printing. Regional Anesthesia and Pain Medicine. 39 (5), 429-433 (2014).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon