Imagerie calcique dans les rétines à montage plat stimulées électriquement
Dans cet article
Résumé
Les prothèses rétiniennes ont la capacité de générer des perceptions visuelles. Pour faire progresser le développement de nouvelles prothèses, des méthodes ex vivo sont nécessaires pour tester les dispositifs avant l’implantation. Cet article fournit un protocole complet pour étudier l’activité du calcium dans la couche de cellules ganglionnaires de la rétine lorsqu’elle est soumise à une stimulation électrique.
Résumé
Les dystrophies rétiniennes sont l’une des principales causes de cécité dans le monde. Des efforts considérables sont en cours pour développer des prothèses rétiniennes avancées capables de contourner les cellules photoréceptrices sensibles à la lumière altérées dans la rétine dégénérée, dans le but de restaurer partiellement la vision en induisant des perceptions visuelles. Une piste de recherche courante concerne la conception et la production de dispositifs implantables avec une structure physique flexible, abritant un grand nombre d’électrodes. Cela permet de générer efficacement et précisément des perceptions visuelles. Cependant, à chaque avancée technologique, il est nécessaire de disposer d’une méthode ex vivo fiable et gérable pour vérifier la fonctionnalité de l’appareil avant de passer à des expériences in vivo , où des facteurs autres que les performances de l’appareil entrent en jeu. Cet article présente un protocole complet pour étudier l’activité calcique dans la couche de cellules ganglionnaires de la rétine (GCL) suite à une stimulation électrique. Plus précisément, les étapes suivantes sont décrites : (1) marquage fluorescent de la rétine de rat à l’aide d’indicateurs calciques génétiquement codés, (2) capture du signal de fluorescence à l’aide d’un microscope à fluorescence inversée tout en appliquant des modèles distincts de stimulation électrique, et (3) extraction et analyse des traces de calcium des cellules individuelles dans le GCL. En suivant cette procédure, les chercheurs peuvent tester efficacement de nouveaux protocoles de stimulation avant de mener des expériences in vivo .
Introduction
La rétine contient des photorécepteurs, qui sont des cellules responsables de la détection de la lumière. Ils captent les photons et les convertissent en influx nerveux. Ces impulsions sont ensuite traitées dans la rétine et transmises au cortex visuel, ce qui entraîne la formation d’une image visuelle1. La rétinite pigmentaire (RP) et la dégénérescence maculaire liée à l’âge (DMLA) sont des maladies dégénératives caractérisées par la perte progressive des photorécepteurs. Ces rétinopathies sont parmi les principales causes de cécité dans le monde1, affectant des millions de personnes et ayant des conséquences médicales, personnelles et socio-économiques importantes pour les patients, les systèmes de santé et la société dans son ensemble. De plus, avec le vieillissement de la population, on prévoit que les cas de DMLA augmenteront de 15 % d’ici 20502.
Actuellement, de nombreux efforts de recherche sont en cours pour restaurer la vision chez les patients atteints de ces affections3. Une approche prometteuse est l’utilisation de prothèses rétiniennes, qui ont démontré leur efficacité dans la restauration partielle de la vision 4,5. Ces appareils captent la lumière de la scène visuelle et la convertissent en impulsions électriques. Ces impulsions sont délivrées par des électrodes au sein d’un réseau de microélectrodes (MEA) implanté dans l’œil, stimulant les neurones survivants et contournant la fonction des photorécepteurs perdus. Les cellules ganglionnaires de la rétine activées (CGR) transmettent la sortie au cerveau, où elle est interprétée comme une perception visuelle. Cependant, les principales limites des implants actuels résident dans la résolution de l’interface électrode-tissu6 et la stimulation non sélective de différents types de cellules. Par conséquent, pour optimiser la conception de nouveaux dispositifs implantables pour une restauration plus efficace de la vision, il est crucial de comprendre comment des paradigmes de stimulation peuvent être développés pour activer sélectivement les cellules à proximité des électrodes.
L’imagerie calcique est une technique largement utilisée pour étudier l’activité neuronale, offrant plusieurs avantages par rapport aux méthodes non optiques 7,8. Tout d’abord, il fournit une résolution cellulaire et subcellulaire. Deuxièmement, les marqueurs calciques peuvent cibler des types de cellules spécifiques. Troisièmement, il permet un suivi à long terme, et quatrièmement, il permet d’observer des populations cellulaires entières tout en distinguant les cellules actives et inactives. Cette méthode fournit des preuves indirectes de l’activité cellulaire avec une résolution temporelle de l’ordre de quelques centaines de millisecondes. Les indicateurs de calcium fluorescents codés génétiquement, tels que les capteurs GCaMP, subissent un changement conformationnel lors de la liaison au calcium, ce qui entraîne une augmentation de la fluorescence9. Les vecteurs viraux adéno-associés (AAV) recombinants sont un moyen efficace de transduire les cellules rétiniennes avec GCaMP10.
Ce protocole présente une méthode efficace qui utilise l’imagerie calcique pour tester les protocoles de stimulation des implants rétiniens. Plus précisément, nous nous concentrons sur les tissus rétiniens de rat ex vivo et fournissons des instructions détaillées, étape par étape, de l’acquisition de l’échantillon à l’analyse des données. En proposant ce guide complet, les chercheurs de divers horizons peuvent se lancer dans l’expérimentation de la stimulation électrique en toute confiance.
Protocole
Toutes les procédures animales ont été menées conformément aux directives standard en matière d’éthique animale (directive 86/609/UE des Communautés européennes) et approuvées par les comités locaux d’éthique animale. Des rats Long Evans âgés de 8 semaines ont été utilisés pour la présente étude. Les animaux ont été obtenus auprès d’une source commerciale (voir le tableau des matériaux).
1. Préparation du support et montage à plat
- Ames' Moyen (1 L)
- Dans une bouteille en verre de 1 L, mélanger la poudre Ames' Medium, 1,9 g/L de NaHCO3, 10 ml de pénicilline/streptomycine 100x et 1 L d’eau déminéralisée (voir le tableau des matériaux). Ajustez le pH à 7,4 et l’osmolarité à 280 mOsm avec de l’eau déminéralisée ou du NaHCO3. Stérilisez la solution en la filtrant à travers un filtre de taille de pores de 0,2 μm sous une hotte.
REMARQUE : Conservez le milieu stérilisé à 4 °C. Cette solution reste stable et peut être utilisée jusqu’à 1 mois.
- Dans une bouteille en verre de 1 L, mélanger la poudre Ames' Medium, 1,9 g/L de NaHCO3, 10 ml de pénicilline/streptomycine 100x et 1 L d’eau déminéralisée (voir le tableau des matériaux). Ajustez le pH à 7,4 et l’osmolarité à 280 mOsm avec de l’eau déminéralisée ou du NaHCO3. Stérilisez la solution en la filtrant à travers un filtre de taille de pores de 0,2 μm sous une hotte.
- Membranes de montage
- Fixez une membrane poreuse en PTFE (voir le tableau des matériaux) à une rondelle à l’aide de petites gouttes de colle. Laissez-le sécher pendant au moins 15 min.
- Pour obtenir la translucidité, immergez les membranes dans de l’éthanol à 70% pendant 1 min.
- Rincez les membranes deux fois avec de l’eau déminéralisée pour éliminer complètement l’éthanol. Conservez-les dans de l’eau déminéralisée pour éviter l’opacité.
2. Marquage GCL et montage à plat de la rétine de rat
REMARQUE : Cette méthode de marquage ne différencie pas les CGR des cellules amacrines déplacées. Si un marquage sélectif des CGR est souhaité, envisager d’utiliser des AAV avec des promoteurs spécifiques des CGR11 et/ou un marquage rétrograde à travers le nerf optique12. Pour faire la distinction entre les classes de CGR ON et OFFCENTRÉS, classer les CGR en fonction de leur réponse à la lumière13,14 et utiliser des versions plus récentes d’indicateurs calciques génétiquement codés qui offrent une sensibilité accrue et la capacité de mesurer des potentiels d’action unique15.
- Injection intravitréenne
- Anesthésier le rat Long Evans de 8 semaines avec 2 % d’isoflurane/1 % d’O2 jusqu’à ce qu’il n’y ait plus de réflexe de pédale, et maintenir l’anesthésie avec un masque nasal de rat (voir le tableau des matériaux).
REMARQUE : Pendant l’anesthésie, placez l’animal sur un coussin chauffant pour maintenir la température corporelle. - Administrer une goutte de collyre disponible dans le commerce (voir le tableau des matériaux) pour dilater la pupille.
- Avant de procéder à la chirurgie, examinez l’œil à la recherche d’anomalies à l’aide du fond d’œil et de la tomographie par cohérence optique (OCT) avec un système d’imagerie rétinienne in vivo . Appliquer une goutte de Methocel 2% pour faciliter le contact entre la cornée et l’objectif (voir le tableau des matériaux).
REMARQUE : Si des anomalies sont détectées, ne procédez pas aux étapes suivantes pour cet œil. - Appliquez une goutte de Prescaine comme anesthésique local. Fixez la paupière et la conjonctive limbique à l’aide d’un filament de suture disponible dans le commerce (voir le tableau des matériaux). Créez une sclérotomie de 1 mm à 4 mm du limbe à l’aide d’une aiguille de 30 G.
- Fixez une aiguille émoussée de 36 G à une seringue de précision et injectez les particules AAV transportant l’indicateur de calcium génétiquement codé dans le vitré pendant 30 s, à un angle de 45°. Dans cette étude, nous avons utilisé AAV2-CAG-GCaMP5G (7,5 x10 11 GC/mL dans HBSS) (voir le tableau des matériaux).
REMARQUE : Les constructions AAV qui ne codent pas pour des produits géniques ou des molécules de toxine potentiellement tumorigènes et qui sont produites sans virus auxiliaire peuvent être manipulées dans des installations de niveau de biosécurité 1 (BSL-1). Dans le cas contraire, s’il s’agit d’une matière présentant un danger biologique dans le cadre d’un confinement BSL-2, des précautions appropriées doivent être prises16. L’encodage des AAV pour GCaMP est considéré comme BSL-1 et ne nécessite pas de manipulation sous les enceintes de sécurité biologique.
- Fixez une aiguille émoussée de 36 G à une seringue de précision et injectez les particules AAV transportant l’indicateur de calcium génétiquement codé dans le vitré pendant 30 s, à un angle de 45°. Dans cette étude, nous avons utilisé AAV2-CAG-GCaMP5G (7,5 x10 11 GC/mL dans HBSS) (voir le tableau des matériaux).
- Appliquer une goutte de Tobradex (voir le tableau des matériaux) pour prévenir l’inflammation et comme antibioprophylaxie.
- Si vous le souhaitez, répétez les étapes 2, 3 et 4 avec l’autre œil.
REMARQUE : Vérifiez les animaux 12 à 24 heures après la chirurgie pour vous assurer qu’il n’y a pas d’effets indésirables. - Trois jours après l’injection, examiner la structure rétinienne à l’aide du fond d’œil et de l’OCT avec un système d’imagerie rétinienne in vivo (voir le tableau des matériaux).
- Deux semaines après l’injection, le GCL devrait émettre une fluorescence. Évaluer la structure rétinienne et l’expression de l’AAV par fluorescence du fond d’œil à l’aide d’un système d’imagerie rétinienne in vivo .
REMARQUE : Selon Weitz et al.12, la fluorescence de AAV2-CAG-GCaMP5G devient perceptible à 1 semaine après l’injection et s’intensifie à 2 semaines. À partir de la quatrième semaine, la surexpression de GCaMP induit une cytomorbidité. Les cellules mourantes présentent un signal de fluorescence de base élevé dans le noyau et le cytoplasme qui ne fluctue pas en réponse à la stimulation. Dans les cellules saines, l’expression de GCaMP est confinée au cytoplasme et exclue du noyau 7,8,12,17,18. Ces caractéristiques peuvent être observées ex vivo lors de l’imagerie microscopique. La fenêtre d’expression des gènes peut varier en fonction du vecteur viral et du promoteur choisi.
- Anesthésier le rat Long Evans de 8 semaines avec 2 % d’isoflurane/1 % d’O2 jusqu’à ce qu’il n’y ait plus de réflexe de pédale, et maintenir l’anesthésie avec un masque nasal de rat (voir le tableau des matériaux).
- Excision de la rétine et montage à plat
REMARQUE : Deux à trois semaines après l’injection, les rats injectés par voie intravitrée sont euthanasiés immédiatement avant le début du protocole d’électrophysiologie, conformément aux directives éthiques standard (directive 86/609/UE des Communautés européennes) et approuvés par les comités d’éthique locaux. L’inhalation de dioxyde de carbone (CO2) est utilisée comme méthode d’euthanasie dans ce protocole.- Énucléation de l’œil
- Appuyez doucement sur l’extérieur de l’orbite à l’aide d’une paire de pinces incurvées pour faire légèrement saillir l’œil de l’orbite.
- Utilisez une paire de ciseaux à ressort pour couper les muscles qui maintiennent l’œil et l’énucléer, en prenant soin de ne pas percer le globe oculaire.
REMARQUE : À partir de cette étape, disséquer la rétine sous un stéréomicroscope dans un milieu d’Ames oxygéné (95% O2 / 5% CO2).
- Exérèse de la rétine
- Utilisez une paire de petites pinces incurvées et de fines ciseaux à ressort pour retirer tous les tissus environnants du globe oculaire.
- Prenez un morceau de papier filtre d’environ 3 cm x 3 cm et placez-le sur le couvercle d’un plat de 3,5 cm. Imbibez le papier avec le médium d’Ames.
- Placez le globe oculaire sur le papier, avec le segment antérieur face à l’opérateur. Utilisez une paire de pinces droites pour maintenir le globe oculaire, en les positionnant sur le dessus de l’ora serrata à un angle d’environ 45° par rapport à la surface de la parabole. Faites une petite incision avec une lame, en utilisant l’espace entre les pinces droites comme référence.
- Remboursez le globe oculaire dans le médium d’Ames. Utilisez une pince droite et des ciseaux à ressort fins pour séparer les segments antérieur et postérieur de l’œil.
- Retirez délicatement la lentille à l’aide de deux paires de pinces droites. Ensuite, séparez la rétine de la sclère.
- Coupez la sclérotique vers le nerf optique à l’aide de ciseaux à ressort fins jusqu’à ce que la rétine soit isolée de l’œilleton.
- Utilisez un stéréomicroscope à fluorescence pour identifier la région de la rétine où l’expression de l’indicateur de calcium est la meilleure.
REMARQUE : L’étendue de la propagation virale dépend du succès de l’injection intravitréenne. L’obtention d’une fluorescence sur de grandes parties de la rétine peut nécessiter de la pratique. L’expérience de l’investigateur joue un rôle crucial dans l’obtention de résultats optimaux. - À l’aide d’une pipette en plastique à pointe coupée, transférez le morceau de rétine sélectionné sur la membrane de montage (étapes de montage des membranes). Utilisez une paire de pinces droites pour fixer la rétine à plat avec le GCL vers le haut.
- À l’aide d’une pipette en plastique fixée à une pointe de pipette de 100 μL, retirez le support pour permettre au morceau de rétine d’adhérer à la membrane poreuse. Retournez l’ensemble sur le MEA de manière à ce que le GCL repose sur les électrodes.
- Remplissez le bain d’échantillon avec du milieu d’Ames oxygéné.
- Énucléation de l’œil
3. Imagerie calcique ex vivo par stimulation électrique
NOTE : Dans ce travail, une MEA de preuve de concept a été utilisée pour l’expérimentation ex vivo . Les MEA personnalisés ont été fabriqués avec des électrodes poreuses à base de graphène de 25 μm de diamètre sur du verre borosilicaté de 500 μm d’épaisseur avec des traces de Ti/Au, puis isolées avec du nitrure de silicium et de la résine photosensible SU-812. Cependant, les méthodes d’imagerie calcique sont valables quel que soit le matériau de l’électrode utilisé pour la stimulation.
- Réglez le système de perfusion de manière à ce que le milieu d’Ames oxygéné perbe constamment le bain d’échantillon à 33 °C à un débit constant de 5 mL/min.
- À l’aide d’un microscope à fluorescence inversé équipé d’une lampe fluorescente, d’un cube filtrant FITC et d’une caméra CMOS, inspectez la rétine à la recherche d’une zone où les électrodes de stimulation et la fluorescence des cellules exprimant GCaMP sont visibles. Un objectif aérien 20x NA 0,75 a été utilisé pour cette étude.
REMARQUE : Pour stimuler (et enregistrer) efficacement les cellules avec les électrodes, la rétine et l’électrode doivent être en contact étroit. Ainsi, les cellules sont visiblement dans le même plan focal que les électrodes. Si ce n’est pas le cas, répétez les étapes de l’exérèse de la rétine à partir de l’étape 8. Lors de l’utilisation de rétines provenant de modèles animaux sains (avec des photorécepteurs fonctionnels), notez que chaque fois que la lampe fluorescente est allumée, il y aura des réponses évoquées générées par la lumière car la rétine est sensible à la lumière à la longueur d’onde utilisée pour exciter le capteur GCaMP. Ces changements calciques induits par la lumière peuvent être utilisés pour évaluer l’état de santé des tissus. Pour éviter de mélanger la lumière avec des réponses évoquées électriquement, allumez la lampe fluorescente au moins 1 min avant de commencer l’acquisition de l’image. - Pour obtenir des réponses électriques dans le GCL, sélectionnez une électrode pour envoyer des impulsions contrôlées par le courant. Réglez les paramètres de stimulation électrique dans le logiciel du générateur d’impulsions, tels que : la forme, l’amplitude, la durée, le retard de phase et la fréquence des impulsions à appliquer.
REMARQUE : Les paramètres de stimulus effectifs peuvent varier considérablement de largeurs d’impulsion de 50 μs à 100 ms, avec des amplitudes allant de 0,1 μA à 10 μA. Ces paramètres, ainsi que la fréquence du stimulus, la polarité du stimulus, le nombre d’impulsions et les retards interphasiques, peuvent influencer la réponse spatio-temporelle observée par l’imagerie calcique 19,20,21,22. Un train de 40 impulsions biphasiques délivrant une stimulation de 1 ms, 2 μA génère souvent une réponse visible dans les neurones marqués. - Pour synchroniser l’acquisition de l’image avec la stimulation, utilisez le générateur d’impulsions comme déclencheur externe pour contrôler le début de l’acquisition de l’image. Connectez l’appareil photo (voir le tableau des matériaux) au générateur d’impulsions à l’aide du signal de déclenchement de sortie et réglez le « Mode de capture » du logiciel de l’appareil photo sur « Déclencheur de démarrage externe ». Appuyez sur Start dans le logiciel de l’appareil photo afin qu’il attende qu’un déclencheur externe démarre. Lancez l’acquisition d’images avec le logiciel générateur d’impulsions.
REMARQUE : La commande de déclenchement externe peut être configurée différemment pour différentes caméras. Cette étude a généralement acquis des images (512 x 512 pixels, niveaux de gris 16 bits) à 10 images par seconde pendant 1 minute tout en fournissant des rafales de trains d’impulsions biphasiques toutes les 10 s. L’émission d’impulsions commence après 10 s, de sorte que les premières images de toutes les expériences correspondent à une activité spontanée. En fonction du capteur GCaMP et de l’analyse que l’on effectuera, il peut être nécessaire d’ajuster la fréquence d’enregistrement en fonction des temps de montée et de descente de votre indicateur de calcium8. Tenir compte de la sensibilité à la détection des potentiels d’action unique de l’indicateur calcique15. - Enregistrez les images avec un nom de fichier qui inclut les paramètres de stimulation électrique appliqués, tels que [Numéro d’électrode]_[Amplitude d’impulsion]_[Durée d’impulsion]_[Fréquence d’impulsion]_Image001.
4. Analyse des données
- ImageJ/FIJI pour extraire le profil d’intensité de fluorescence dans le temps et les coordonnées spatiales des somas cellulaires
- Segmentez la région d’intérêt (ROI) à l’aide des « Outils de sélection de zone » et ajoutez-la au gestionnaire de ROI (Outils d’analyse > > Gestionnaire de ROI > Ajouter). Dans le menu Gestionnaire de retour sur investissement, enregistrez-le en tant que dossier .zip (Plus > Enregistrer).
REMARQUE : En règle générale, les mêmes ROI peuvent être appliqués à toutes les expériences de stimulation, car ils correspondent au même champ de vision. - Sélectionnez le paramètre « Valeur de gris moyenne » comme paramètre à extraire (Analyser > Définir les mesures).
- Extrayez la « Valeur de gris moyenne » des somas de la cellule en cliquant sur Plus > Multi Mesure. Une boîte de dialogue s’affiche. Activez les options Mesurer toutes les 600 tranches et Une ligne par tranche pour obtenir un tableau unique dans lequel les colonnes correspondent aux RCI et les lignes correspondent aux périodes. Enregistrez le tableau généré sous forme de feuille de calcul .xls.
- Sélectionnez le « Centroïde » comme paramètre à extraire (Analyser > Définir les mesures).
- Extrayez le « Centroïde » des ROI en cliquant sur Mesurer. La table générée correspond aux coordonnées (X,Y) des ROI. Enregistrez-le sous forme de feuille de calcul .xls.
- Segmentez la région d’intérêt (ROI) à l’aide des « Outils de sélection de zone » et ajoutez-la au gestionnaire de ROI (Outils d’analyse > > Gestionnaire de ROI > Ajouter). Dans le menu Gestionnaire de retour sur investissement, enregistrez-le en tant que dossier .zip (Plus > Enregistrer).
- Script personnalisé pour identifier les cellules qui répondent aux stimuli
REMARQUE : MATLAB (voir Table des matériaux) a été utilisé ici, mais les étapes décrites peuvent être réalisées dans n’importe quel langage de programmation. Les utilisateurs peuvent obtenir notre script personnalisé en demandant l’auteur correspondant.- Correction de l’effet de photoblanchiment : Pour atténuer l’effet d’arrière-plan et de photoblanchiment, prenez 15 à 20 images des périodes non stimulantes avant chaque rafale et ajustez-les à une courbe linéaire [fit (poly1)].
REMARQUE : Dans ce cas, pour un film de 600 images au total dans lequel des rafales périodiques de trains d’impulsions étaient envoyées toutes les 10 s, les images 1 :90, 170 :190, 270 :290, 370 :390, 470 :490, 570 :590 ont été considérées comme des périodes non stimulantes. - Normaliser à l’aide de la formule : (X-min) / (max-min)
- Identification des cellules répondantes
- Calculez la moyenne quadratique (RMS) des périodes non stimulantes à partir des données normalisées. Il s’agit du signal de base.
- Calculez le maximum des périodes stimulantes (images entre les périodes non stimulantes). Dans ce cas, pour un film total de 600 images dans lequel des rafales périodiques de trains d’impulsions ont été envoyées toutes les 10 s, les images 91 :169, 191 :269, 291 :369, 391 :469, 491 :569 ont été considérées comme les périodes stimulantes.
- Si la valeur maximale dépasse le signal de base de 2,5 fois pour un retour sur investissement spécifique, marquez la cellule comme répondant à cette période de stimulation. Si la cellule répond à trois des cinq périodes de stimulation, classez-la comme une cellule répondante.
- Correction de l’effet de photoblanchiment : Pour atténuer l’effet d’arrière-plan et de photoblanchiment, prenez 15 à 20 images des périodes non stimulantes avant chaque rafale et ajustez-les à une courbe linéaire [fit (poly1)].
Résultats Représentatifs
Le protocole décrit dans cette étude est basé sur les études d’imagerie par fluorescence et de stimulation électrique menées par Weitz et al.12. Le protocole se compose de trois parties principales : (1) le marquage fluorescent du GCL et le montage à plat de la rétine sur le MEA (Figure 1 à gauche), (2) la visualisation de l’activité calcique dans le GCL pendant la stimulation électrique (Figure 1 au milieu) et (3) l’extraction, le traitement et l’interprétation des données d’imagerie (Figure 1 à droite).
Tout d’abord, comme le montre la figure 1 à gauche, des rats Long Evans reçoivent une injection intravitrée d’AAV2-CAG-GCaMP5G avant la séance d’imagerie. L’expression virale optimale de ce vecteur se produit 2 à 3 semaines après l’injection12,18. Après l’anesthésie complète de l’animal, un trou pilote est pratiqué à l’aide d’une aiguille de 30 G, puis 5 μL d’AAV2-CAG-GCaMP5G sont lentement injectés dans le vitré à l’aide d’une aiguille émoussée de 36 G attachée à une seringue de précision pour éviter le reflux. Au cours de l’expression virale, un système d’imagerie rétinienne in vivo est utilisé pour évaluer l’état de la rétine après la chirurgie, les images OCT fournissant une visualisation détaillée des couches rétiniennes. Une fois l’expression des gènes atteinte, la rétine est soigneusement extraite de l’œilleton à l’aide d’un stéréomicroscope et d’outils de dissection de haute précision. À partir de ce moment, le tissu est manipulé dans un milieu oxygéné pour préserver l’échantillon. La rétine excisée, avec le GCL vers le haut, est ensuite montée sur une plate-forme conçue pour un montage à plat afin d’assurer la stabilité et d’empêcher l’échantillon de flotter. L’échantillon est monté sur la surface MEA avec le GCL face aux électrodes.
Ensuite, le MEA est monté sur sa carte d’interface sur un microscope fluorescent inversé (Figure 1 au milieu). L’échantillon rétinien est perfusé avec un milieu oxygéné à 33 °C à l’aide d’un système de perfusion. L’échantillon peut être conservé dans cette configuration pendant plusieurs heures. Le schéma de stimulation souhaité est programmé et les images sont acquises à un rythme de 10 images par seconde. Il est recommandé de nommer les films en fonction des paramètres de stimulation électrique appliqués. L’acquisition d’images doit commencer avant le début de la stimulation afin d’obtenir des images de base sans stimulation, ce qui servira de contrôle négatif.
Enfin, comme l’illustre la figure 1 à droite, les données sont extraites des images en accéléré en segmentant les somas cellulaires. Les effets de photoblanchiment sont corrigés en ajustant les données, et les cellules réactives sont identifiées. Les cellules réactives sont définies comme celles dont les pics de fluorescence pendant la stimulation dépassent leur ligne de base de 2,5 fois. Si une cellule répond à trois des cinq rafales de stimulation, elle est considérée comme réceptive à ce train spécifique de stimulation.
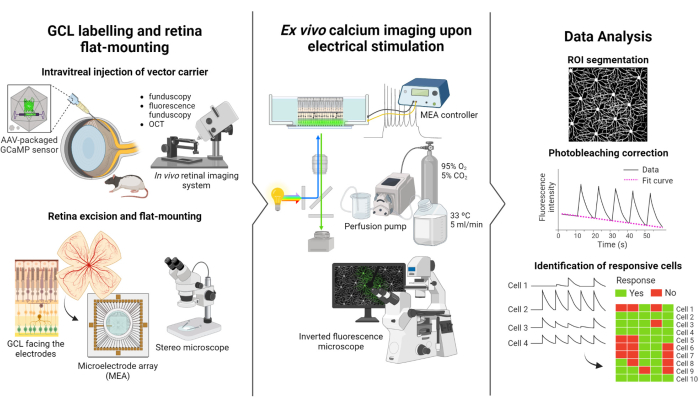
Figure 1 : Vue d’ensemble de l’étude. Illustration schématique du protocole de marquage par fluorescence (à gauche) du GCL de la rétine et du montage de l’échantillon, (au milieu) de la préparation des enregistrements ex vivo avec stimulation électrique fournie par un MEA, et (à droite) de l’analyse des données d’imagerie calcique pour classer les cellules réactives. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Rétine injectée intravitréenne
L’incidence des complications associées aux injections intravitréennes est très faible. Cependant, certaines complications peuvent découler de la chirurgie elle-même, quel que soit le composant injecté. Ces complications comprennent la formation de cataractes, l’hémorragie du vitré, l’élévation de la pression intraoculaire et l’endophtalmie23. Pour déterminer si ces complications sont causées par la chirurgie, l’animal doit subir une évaluation avant l’intervention à l’aide d’une funduscopie et d’une OCT. Trois jours après l’injection, les animaux doivent être suivis. Sur la figure 2A-D, la rétine d’un animal sain ayant reçu l’injection est représentée. Après deux semaines d’injection, les CGR commencent à exprimer une fluorescence, qui peut être visualisée à l’aide d’une fluorescence (Figure 2B,C). Les images OCT fournissent une visualisation détaillée de la disposition et de l’épaisseur des couches rétiniennes (Figure 2D), offrant une résolution plus élevée par rapport au fond d’œil, en particulier lors de l’évaluation du décollement de la rétine. Une fois que la rétine est montée à plat et imagée à l’aide d’un microscope à fluorescence inversée, il devient possible de distinguer les cellules et les faisceaux axonaux. Contrairement à d’autres indicateurs calciques, l’indicateur GCaMP est limité au cytoplasme7 et la fluorescence est exclue du noyau (Figure 2E).
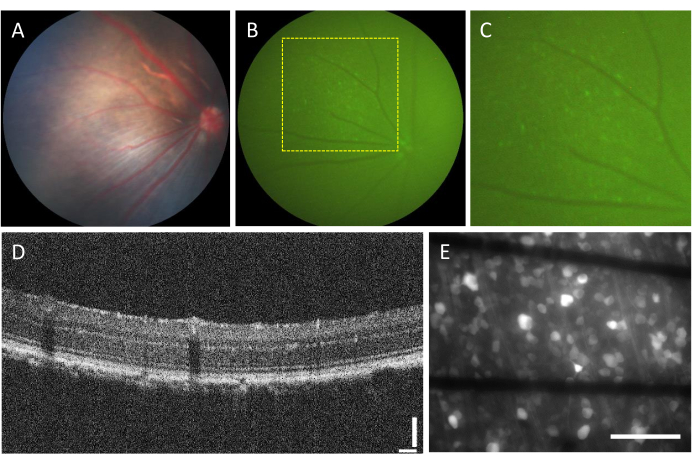
Figure 2 : Images représentatives de la rétine injectée intravitréenne. (A) fundoscopie, (B) fond d’œil à fluorescence, (C) zoom avant du fond d’œil à fluorescence, (D) image OCT et (E) image d’épifluorescence de la rétine excisée montée sur un MEA personnalisé avec des électrodes à base de graphène sur du verre borosilicaté de 500 μm d’épaisseur. En (E), les lignes noires correspondent aux traces Ti/Au. Barres d’échelle : 115 μm (D) et 100 μm (E). Veuillez cliquer ici pour voir une version agrandie de cette figure.
Électrodes et contact GCL
Afin d’évoquer efficacement les réponses neuronales, il est crucial de s’assurer que la rétine montée à plat est en contact étroit avec la surface de l’AME. Un moyen simple de le vérifier est de vérifier visuellement si les cellules et les électrodes sont situées dans le même plan focal (Figure 3A). Si les cellules ne sont pas dans le même plan focal que les électrodes (Figure 3B), cela indique que le contact n’est pas optimal, ce qui se traduira par une stimulation moins efficace.
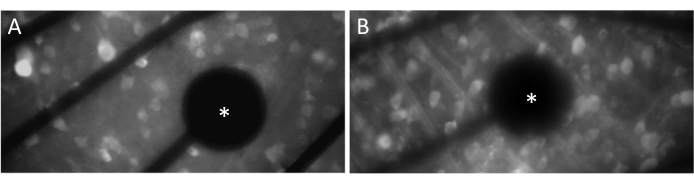
Figure 3 : Électrodes et contact GCL. (A) Cellules et électrode (astérisque) dans le même plan focal. (B) Les cellules et les électrodes ne sont pas dans le même plan focal, ce qui indique un contact sous-optimal pour la stimulation électrique dans cette zone. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Imagerie calcique ex vivo par stimulation électrique fournie par un MEA
Les données obtenues par imagerie calcique consistent en des images en accéléré qui surveillent l’activité neuronale de centaines de cellules en réponse à une stimulation électrique. Les stimuli supraseuils provoquent un afflux de calcium dans les somas cellulaires, ce qui entraîne un changement soudain de l’intensité de la fluorescence (vidéo 1). Ce protocole permet de déterminer si une électrode, un MEA et/ou un algorithme de stimulation suscite la réponse souhaitée dans le tissu neural. La taille et le pas des électrodes sur le MEA, ainsi que la proportion de tissu étudié, détermineront le grossissement objectif approprié à choisir. En règle générale, pour les études de stimulation à électrode unique avec des diamètres allant de 5 μm à 100 μm, un grossissement d’objectif de 20 à 25x convient (Figure 4A), fournissant un champ de vision d’environ 600 μm x 600 μm. Pour les expériences impliquant une stimulation avec plusieurs électrodes, un grossissement de l’objectif de 4 à 10x peut être nécessaire pour évaluer une zone plus large d’environ 2 mm x 2 mm. Les cellules réactives peuvent être facilement identifiées en générant une projection d’image par écart-type de la vidéo en accéléré (Figure 4B et Vidéo 1).
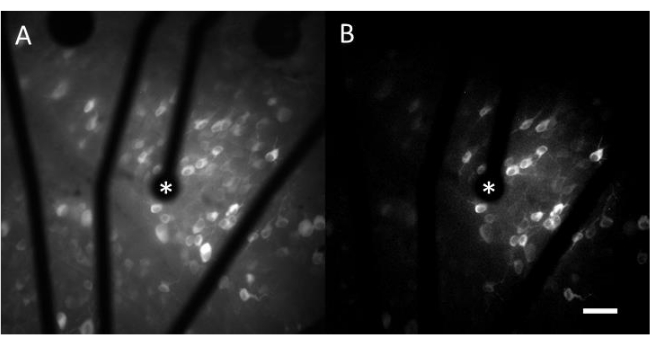
Figure 4 : Imagerie calcique du GCL avec stimulation électrique fournie par une électrode de 25 μm de diamètre. (A) Projection maximale d’un film time-lapse de 60 s et (B) projection de l’écart-type représentant clairement les cellules qui répondent aux stimuli électriques d’une électrode poreuse à base de graphène de 25 μm de diamètre. L’électrode de stimulation est indiquée par un astérisque. Barre d’échelle : 50 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Analyse de la dynamique du calcium au cours du temps lors d’une stimulation contrôlée
Pour chaque soma cellulaire identifié, les valeurs moyennes d’intensité ont été extraites au fil du temps. La figure 5A montre les traces de calcium corrigées par photoblanchiment des cellules réceptives. Dans cet exemple, cinq rafales de trains d’impulsions biphasiques (cathodique d’abord, 40 cycles, durée de 1 ms, amplitude de 2 μA) ont été délivrées toutes les 10 s (indiquées par des lignes noires) au cours d’une acquisition d’image de 60 s. Dans le cadre d’une expérience donnée, les cinq mêmes trains d’impulsions sont appliqués pour tester la cohérence de la réponse. Les images capturées pendant les périodes non stimulantes (surlignées en rouge) sont utilisées pour effectuer un ajustement linéaire, en corrigeant l’effet de photoblanchiment.
Une fois que les cellules répondantes sont identifiées et que leurs coordonnées (x,y) sont connues par rapport à l’électrode de stimulation, on peut examiner la relation entre le courant nécessaire pour activer les cellules et la distance de l’électrode de stimulation (Figure 5B). Comme on pouvait s’y attendre, les cellules situées plus près de l’électrode de stimulation ont besoin de valeurs de courant plus faibles pour susciter une réponse.
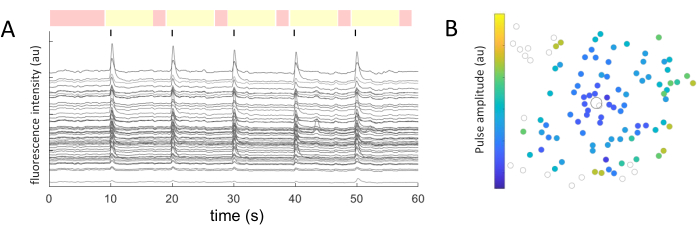
Figure 5 : Représentation des réponses évoquées électriquement. (A) Traces calciques de somas cellulaires sur 5 rafales de trains d’impulsions (biphasique, cathodique d’abord, 40 cycles, durée de 1 ms, amplitude de 2 μA) toutes les 10 s (lignes noires) au cours d’une acquisition d’image de 60 s. Les périodes non stimulantes (images surlignées en rouge) et stimulantes (images surlignées en jaune) sont affichées. Les traces dépassant de 2,5 fois le signal de base (racine carrée moyenne des périodes non stimulantes) sont considérées comme des réponses évoquées. Les cellules qui répondent dans trois des cinq périodes de stimulation sont classées comme des cellules répondantes. (B) Carte de distribution de l’activité calcique montrant l’électrode de stimulation (cercle encadré en noir) et les cellules (cercle en gris). Le code couleur représente l’amplitude d’impulsion minimale nécessaire pour provoquer une réponse cellulaire. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Vidéo 1 : Imagerie calcique du GCL avec stimulation électrique fournie par une électrode de 25 μm de diamètre. La vidéo montre les différences d’intensité de fluorescence dues à la stimulation électrique d’une électrode poreuse à base de graphène de 25 μm de diamètre. Le côté gauche montre le film original et le côté droit montre la projection de l’écart-type où les cellules répondantes peuvent être facilement identifiées. Barre d’échelle : 50 μm. Veuillez cliquer ici pour télécharger cette vidéo.
Discussion
Le protocole décrit ici permet d’étudier la dynamique calcique se produisant dans le GCL rétinien du rat lors d’une stimulation électrique fournie avec un MEA. Il s’agit d’une méthode fiable et gérable, mais qui nécessite une certaine formation, en particulier pour marquer uniformément et efficacement le GCL et pour monter correctement la rétine afin d’assurer un contact optimal entre les tissus et les électrodes. Ce protocole est spécifique aux rongeurs et doit être adapté s’il est appliqué à une autre espèce de laboratoire. Les points critiques, les modifications et les limites de la méthodologie sont présentés en détail.
Injections intravitréennes
Les injections sont largement utilisées pour l’administration de gènes oculaires, les injections intravitréennes étant la procédure préférée. Ils se sont avérés plus sûrs et moins invasifs que les injections sous-rétiniennes, qui introduisent les molécules d’intérêt directement entre les photorécepteurs et l’épithélium pigmentaire rétinien (EPR), risquant ainsi de provoquer un décollement de la rétine10. Cependant, il existe des limites, en particulier lors de la réalisation de ces injections dans des modèles de rongeurs. L’humeur vitrée est gélatineuse, ce qui entrave la diffusion virale. De plus, le cristallin des yeux des rongeurs est grand, ce qui rend non trivial l’insertion de l’aiguille sans la rayer. Les aiguilles de seringue de précision sont délicates et doivent être remplacées souvent. Pour éviter toute obstruction, lavez-les à l’eau déminéralisée avant et après chaque utilisation et remplacez-les régulièrement. De plus, injectez le contenu lentement pour éviter le reflux de la solution et les changements de pression intraoculaire. L’obtention d’une fluorescence importante et uniforme à travers la rétine peut nécessiter de la pratique.
Transduction des cellules rétiniennes
Les vecteurs viraux sont une excellente méthode pour l’administration de gènes in vivo, et les AAV ont été largement utilisés pour la transduction des cellules rétiniennes10. Ils ont été approuvés comme traitement de certaines rétinopathies causant la cécité humaine24. Cependant, leur capacité de support est limitée à 5 kb, y compris les éléments réglementaires requis (par exemple, le promoteur)10,25. Il existe plusieurs sérotypes, chacun ayant un tropisme différent. Choisir l’AAV le plus adapté en fonction des gènes à délivrer et des cellules à transduir26. Pour l’étiquetage des RGC, il est recommandé d’utiliser AAV227.
Fenêtre d’expression génique
L’expression virale optimale de l’AAV2-CAG-GCaMP5G est de 2 à 3 semaines après l’injection12,18. Au-delà de ce laps de temps, les noyaux des cellules transfectées deviennent fluorescents, les cellules cessent de répondre aux stimuli et finissent par mourir 7,28,29. Cela est dû à la surexpression de l’indicateur GCaMP, qui est transloqué dans le noyau. La fenêtre temporelle pour l’expression optimale des gènes varie en fonction du vecteur viral et du promoteur choisi30 et doit être déterminée expérimentalement avant de procéder à ce protocole.
Contact tissu-électrode
Pour obtenir des résultats optimaux et reproductibles, il est essentiel d’obtenir un bon contact entre les tissus et les électrodes. Un mauvais contact est généralement dû à la courbure naturelle de la rétine. Une approche consiste à couper la rétine en quartiers, à monter et à imager une section à la fois. De petites parties de la rétine peuvent être mieux aplaties, ce qui permet un contact plus efficace avec la surface de l’AME. Une autre raison potentielle d’un mauvais contact est la présence d’humeur vitrée. Lors de la réalisation d’expériences de stimulation simulant un implant épi-rétinien, il est important d’enlever soigneusement l’humeur vitrée lors de l’excision de la rétine car elle peut agir comme un isolant du courant. Ici, une méthode simple est décrite pour vérifier si le contact est suffisant en visualisant l’électrode et les cellules dans le même plan focal.
Une alternative aux mesures rétiniennes ex vivo consiste à faire pousser des neurones directement à la surface des électrodes. La culture primaire de neurones, tels que les neurones de l’hippocampe31, peut être utile pour les tests initiaux visant à évaluer la fonctionnalité du nouveau dispositif de stimulation. Cependant, cette approche nécessite toujours l’utilisation d’animaux de laboratoire et ne représente pas la complexité du réseau rétinien, ce qui est important pour évaluer les réponses synaptiques à la stimulation.
Pour visualiser les cellules sous l’électrode et les traces d’électrodes, on peut utiliser des MEA fabriqués avec des matériaux transparents tels que l’oxyde d’indium et d’étain (ITO) 19,20,32. En plus des mesures optiques, l’activité du GCL lors de la stimulation électrique peut être évaluée à l’aide d’enregistrements électriques. Le MEA peut être utilisé pour enregistrer le potentiel de champ local (LFP) du tissu. Cependant, cela compromet la résolution spatiale, car chaque électrode capture l’activité de plusieurs cellules simultanément (en fonction des dimensions de l’électrode). L’enregistrement optique permet de surmonter cette limitation et offre une cartographie à plus haute résolution spatiale. Son principal avantage est la possibilité de distinguer les cellules actives des cellules inactives tout en mesurant un grand champ de vision avec une résolution d’une seule cellule. Parmi tous les rapporteurs d’activité cellulaire, les indicateurs calciques sont bien décrits et les plus couramment utilisés33.
Déclarations de divulgation
Les auteurs n’ont aucune divulgation à ajouter au manuscrit.
Remerciements
Nous remercions Merche Rivas, Angel Sandoval, Jesús Planagumà, Jordi Cortés, Sandra Ortonobés Lara et Alina Hirschmann (ICFO-Institut de Ciències Fotòniques) pour leur soutien technique, Anna Duarri (VHIR, Institut de recherche Vall d’Hebron) du groupe de recherche en ophtalmologie pour leur soutien avec les injections intravitréennes et l’imagerie rétinienne in vivo .
Les organismes de financement qui ont soutenu ce travail sont : Fundació CELLEX ; Fundació Mir-Puig ; Programme Ministerio de Economía y Competitividad - Severo Ochoa pour les centres d’excellence en R&D (CEX2019-000910-S, [MCIN/AEI/10.13039/501100011033]) ; Generalitat de Catalunya à travers le programme CERCA ; Laserlab-Europe (EU-H2020 GA n° 871124) ; Fondation La Caixa (LCF/HR19/52160003) ; et Fondo Social Europeo (PRE2020-095721, M.C.).
matériels
| Name | Company | Catalog Number | Comments |
| 20x NA 0.75 S Fluor air objective | Nikon | CFI Super Fluor 20X | - |
| 3.5 cm Cell culture dish | Nunc | 12-565-90 | - |
| 30 G needle | VWR | 613-5373 | - |
| 36 G blunt needle | World Precision Instruments | NF36BL-2 | - |
| 6 cm Cell culture dish | Nunc | 12-565-94 | - |
| AAV2-CAG-GCaMP5G | Vector Biolabs | - | - |
| Ames' Medium | Sigma Aldrich | A1420 | - |
| Blade | Swann-morton | 0308 | - |
| Camera | Hamamatsu | ORCA Flash v4.0 | - |
| Carbogen | Air liquide | - | - |
| Curved-forceps | - | - | - |
| Fine spring-scissors | FST | 91501-09 | - |
| FITC filter cube | Nikon | Standard series | - |
| Fluorescent lamp | Nikon | C-HGFI | - |
| Fluorescent stereomicroscope | Nikon | SMZ25 | - |
| HBSS | Capricorn | HBSS-1A | - |
| ImageJ/FIJI | NIH | v1.50i | - |
| In vivo retinal imaging system | Phoenix Research Laboratories | Micron III | - |
| Inverted fluorescence microscope | Nikon | Eclipse Ti | - |
| Isofluorane | Arrane Baxter Laboratories | - | - |
| Long-Evans rat | Janvier | - | - |
| MATLAB (Version R2021b) | Mathworks | - | - |
| Media filters | Merckmillipore | SCGPS02RE | - |
| Methocel 2% | Omni Vision | - | - |
| Microelectrode array (MEA) | - | Custom-made | |
| NaHCO3 | Thermofisher | 42427 | - |
| Penicillin/Streptomycin 100x | Thermofisher | 15140122 | - |
| Phenylephrine | Alcon Cusí Laboratories | 653437.3 | 100 mg/mL |
| Plastic pipette | VWR | 612-1793 | - |
| Porous membrane | Merckmillipore | #JVWP01300 | - |
| Precision syringe | World Precision Instruments | 10 µl Nanofil | - |
| Prescaina | Llorens | - | Oxybuprocaine chlorhydrate (2 mg/mL), local anesthetic |
| Rat nasal mask | Xenotec | XRK-RA | - |
| Small curved-forceps | Bbraun | AESCBD311R | - |
| Spring-scissors | FST | 15040-11 | - |
| Stereo microscope | Zeiss | Stemi 2000 | - |
| Straight forceps | FST | 11252-20 | - |
| Suture filament | Vitrex Medical | 4328 | Nilon monofilament, 7/0, DS12 |
| Tobradex | Alcon Cusí Laboratories | - | Tobramycin (3 mg/mL) and dexamethasone (1 mg/mL) |
| Tropicamide | Alcon Cusí Laboratories | 653486 | 10 mg/mL |
| Washer | Thorlabs | W8S038 | - |
Références
- Bourne, R. R. A., et al. Prevalence and causes of vision loss in high-income countries and in Eastern and Central Europe in 2015: Magnitude, temporal trends and projections. British Journal of Ophthalmology. 102 (5), 575-585 (2018).
- Li, J. Q., et al. Prevalence and incidence of age-related macular degeneration in Europe: a systematic review and meta-analysis. British Journal of Ophthalmology. 104 (8), 1077-1084 (2020).
- Roska, B., Sahel, J. A. Restoring vision. Nature. 557 (7705), 359-367 (2018).
- Hornig, R., Velikay-Parel, M. Retina implants. Implantable Sensor Systems for Medical Applications. , 469-496 (2013).
- Lewis, P. M., et al. Advances in implantable bionic devices for blindness: a review. ANZ Journal of Surgery. 86 (9), 654-659 (2016).
- Weiland, J. D., Walston, S. T., Humayun, M. S. Electrical stimulation of the retina to produce artificial vision. Annual Review of Vision Science. 2, 273-294 (2016).
- Tian, L., et al. Imaging neural activity in worms, flies and mice with improved GCaMP calcium indicators. Nature Methods. 6, 875-881 (2009).
- Chen, T. -. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499, 295-300 (2013).
- Nakai, J., Ohkura, M., Imoto, K. A high signal-to-noise Ca2+ probe composed of a single green fluorescent protein. Nature Biotechnology. 19, 137-141 (2001).
- Sahu, B., Chug, I., Khanna, H. The ocular gene delivery landscape. Biomolecules. 11 (8), 1135 (2021).
- Hanlon, K. S., et al. A novel retinal ganglion cell promoter for utility in AAV vectors. Frontiers in Neuroscience. 11, (2017).
- Weitz, A. C., et al. Imaging the response of the retina to electrical stimulation with genetically encoded calcium indicators. Journal of Neurophysiology. 9 (7), 1979-1988 (2013).
- Briggman, K. L., Euler, T. Bulk electroporation and population calcium imaging in the adult mammalian retina. Journal of Neurophysiology. 105 (5), 2601-2609 (2011).
- Baden, T., Berens, P., Franke, K., Román Rosón, M., Euler, T. The functional diversity of retinal ganglion cells in the mouse. Nature. 529, 345-350 (2016).
- Zhang, Y., et al. Fast and sensitive GCaMP calcium indicators for imaging neural populations. Nature. 615, 884-891 (2023).
- Meyer, E. L., Jenkins, C., Rengarajan, K. NIH Guidelines April 2019. Applied Biosafety. 24, (2019).
- Akerboom, J., et al. Optimization of a GCaMP calcium indicator for neural activity imaging. Journal of Neuroscience. 32 (40), 13819-13840 (2012).
- Chang, Y. -. C., Walston, S. T., Chow, R. H., Weiland, J. D. GCaMP expression in retinal ganglion cells characterized using a low-cost fundus imaging system. Journal of Neural Engineering. 14 (5), 056018 (2017).
- Weitz, A. C., et al. Improving the spatial resolution of epiretinal implants by increasing stimulus pulse duration. Science Translational Medicine. 7 (318), 1-12 (2015).
- Chang, Y. C., Ghaffari, D. H., Chow, R. H., Weiland, J. D. Stimulation strategies for selective activation of retinal ganglion cell soma and threshold reduction. Journal of Neural Engineering. 16 (2), 026017 (2019).
- Im, M., Fried, S. I. Temporal properties of network-mediated responses to repetitive stimuli are dependent upon retinal ganglion cell type. Journal of Neural Engineering. 13 (2), 025002 (2016).
- Jensen, R. J., Ziv, O. R., Rizzo, J. F. Thresholds for activation of rabbit retinal ganglion cells with relatively large, extracellular microelectrodes. Investigative Ophthalmology & Visual Science. 46 (4), 1486-1496 (2005).
- Ramos, M. S., et al. Patient-reported complications after intravitreal injection and their predictive factors. Ophthalmology Retina. 5 (7), 625-632 (2021).
- Vandenberghe, L. H., Auricchio, A. Novel adeno-associated viral vectors for retinal gene therapy. Gene Therapy. 19 (2), 162-168 (2012).
- Zin, E. A., Ozturk, B. E., Dalkara, D., Byrne, L. C. Developing new vectors for retinal gene therapy. Cold Spring Harbor Perspectives in Medicine. , a041291 (2023).
- Haggerty, D. L., Grecco, G. G., Reeves, K. C., Atwood, B. Adeno-associated viral vectors in neuroscience research. Molecular Therapy-Methods & Clinical Development. 17, 69-82 (2020).
- Hellström, M., et al. Cellular tropism and transduction properties of seven adeno-associated viral vector serotypes in adult retina after intravitreal injection. Gene Therapy. 16 (4), 521-532 (2009).
- Resendez, S. L., et al. Visualization of cortical, subcortical and deep brain neural circuit dynamics during naturalistic mammalian behavior with head-mounted microscopes and chronically implanted lenses. Nature Protocols. 11, 566-597 (2016).
- Yang, Y., et al. Improved calcium sensor GCaMP-X overcomes the calcium channel perturbations induced by the calmodulin in GCaMP. Nature Communications. 9, 1504 (2018).
- Nieuwenhuis, B., et al. Improving adeno-associated viral (AAV) vector-mediated transgene expression in retinal ganglion cells: comparison of five promoters. Gene Therapy. 30, 503-519 (2023).
- Cunquero, M., Aguilar, E., Loza-Alvarez, P., Planagumà, J. Hippocampal neuronal cultures to detect and study new pathogenic antibodies involved in autoimmune encephalitis. Journal of Visualized Experiments. 184, e63829 (2022).
- Behrend, M. R., Ahuja, A. K., Humayun, M. S., Chow, R. H., Weiland, J. D. Resolution of the epiretinal prosthesis is not limited by electrode size. IEEE Transactions on Neural Systems and Rehabilitation Engineering. 19 (4), 436-442 (2011).
- Grienberger, C., Konnerth, A. Imaging calcium in neurons. Neuron. 73 (5), 862-885 (2012).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon