Évaluation de l’inflammation, de la démyélinisation et des lésions axonales du système nerveux central dans l’encéphalomyélite auto-immune expérimentale
Dans cet article
Résumé
L’encéphalomyélite auto-immune expérimentale (EAE) sert de modèle animal de la sclérose en plaques. Cet article décrit une approche permettant d’évaluer l’inflammation, la démyélinisation et les lésions axonales de la moelle épinière dans l’EAE. De plus, une méthode permettant de quantifier les niveaux de lumière des neurofilaments solubles dans le sérum de souris est présentée, facilitant l’évaluation des lésions axonales chez les souris vivantes.
Résumé
L’encéphalomyélite auto-immune expérimentale (EAE) est un modèle immunitaire courant de la sclérose en plaques (SEP). Cette maladie peut être induite chez les rongeurs par l’immunisation active avec des composants protéiques de la gaine de myéline et l’adjuvant de Complete Freund (CFA) ou par le transfert de cellules T spécifiques de la myéline à partir de rongeurs amorcés avec de la protéine de myéline/CFA à des rongeurs naïfs. La sévérité de l’EAE est généralement évaluée sur une échelle clinique de 5 points qui mesure le degré de paralysie ascendante, mais cette échelle n’est pas optimale pour évaluer l’étendue de la récupération de l’EAE. Par exemple, les scores cliniques restent élevés dans certains modèles d’EAE (par exemple, le modèle d’EAE induit par des peptides d’oligodendrocyte de myéline [MOG]) malgré la résolution de l’inflammation. Ainsi, il est important de compléter la notation clinique par la notation histologique de l’EAE, qui fournit également un moyen d’étudier les mécanismes sous-jacents des lésions cellulaires dans le système nerveux central (SNC).
Ici, un protocole simple est présenté pour préparer et colorer des sections de moelle épinière et de cerveau de souris et pour marquer l’inflammation, la démyélinisation et les lésions axonales dans la moelle épinière. La méthode d’évaluation de l’infiltration leucocytaire dans la moelle épinière peut également être appliquée pour évaluer l’inflammation cérébrale dans l’EAE. Un protocole de mesure de la lumière des neurofilaments solubles (sNF-L) dans le sérum de souris à l’aide d’un test de petites molécules (SIMOA) est également décrit, ce qui fournit un retour d’information sur l’étendue des lésions globales du SNC chez les souris vivantes.
Introduction
L’encéphalomyélite auto-immune expérimentale (EAE) est le modèle murin le plus courant pour la maladie démyélinisante humaine, la sclérose en plaques (SEP)1. La pathologie inflammatoire classique de la SEP, y compris l’infiltration d’IFN-γ (gamma) et de lymphocytes T auxiliaires producteurs d’IL-172, l’infiltration de monocytes inflammatoires3, la formation de lésions inflammatoires démyélinisantes périvasculaires et sous-méningées4 et la survenue d’une lésion axonale4 dans le système nerveux central (SNC), est également observée dans EAE 5,6,7,8,9. La similitude des mécanismes immunitaires entre l’EAE et la SEP a fait de l’EAE un modèle préclinique approprié pour tester l’efficacité et les mécanismes d’action d’un certain nombre de thérapies immunitaires approuvées pour la SEP, notamment le natalizumab, le fingolimod, le fumarate de diméthyle et l’acétate de glatiramère (examiné en 1,5). Certains régimes EAE modélisent d’autres aspects de la pathologie progressive de la SEP au-delà des lésions axonales, notamment le développement d’une inflammation sous-méningée dans le cerveau, la démyélinisation chronique, l’atrophie de la moelle épinière, la synapse et la perte de neurones 6,10,11,12. Ainsi, l’EAE a une utilité pour le dépistage de l’efficacité des thérapies neuroprotectrices contre la SEP.
L’EAE est induite chez les rongeurs de plusieurs façons. L’immunisation active est la méthode d’induction la plus courante et consiste à immuniser les rongeurs avec des antigènes de myéline (protéines entières ou peptides) émulsionnés dans de l’acide CFA, complétés par Mycobacterium tuberculosis13, tué par la chaleur. Selon la souche de souris, la toxine de la coqueluche (PTX) est également administrée le jour 0 et le jour 2 de l’immunisation pour augmenter la pénétrance de la maladie13. L’EAE peut également être induite par le transfert adoptif de lymphocytes T spécifiques de la myéline obtenus à partir de souris amorcées par la myéline/CFA à des souris saines14 ou peut se développer spontanément chez des souris qui surexpriment les récepteurs des lymphocytes T spécifiques des principaux antigènes de la myéline5.
La gravité et la progression de la maladie EAE sont généralement évaluées à l’aide d’une échelle clinique discrète à 5 points : 1 – mollesse de la queue, 2 – faiblesse des membres postérieurs ou des pieds, 3 – paralysie complète d’un ou des deux membres postérieurs, 4 – faiblesse des membres antérieurs, 5 – moribond ou mort13. Ce système de notation clinique est solide pour documenter la progression de la paralysie ascendante qui se produit au début de la maladie, mais il est moins sensible pour saisir l’étendue de la récupération des crises inflammatoires du SNC. Par exemple, les souris qui se déplacent difficilement et les souris qui se déplacent facilement mais qui présentent une faiblesse de préhension des pieds se voient attribuer un score de 2 sur l’échelle EAE. Les scores peuvent rester élevés dans la phase post-aiguë de l’EAE en raison de la présence d’une lésion ou d’une perte axonale permanente, même malgré la résolution de la réponse inflammatoire9. Il y a eu une variété de tentatives pour développer des systèmes de notation plus raffinés, des tests comportementaux, des mesures des membres postérieurs et de la force de préhension, et des systèmes de surveillance infrarouge pour mieux saisir les différences dans les déficits cliniques dans EAE9, 16, 17 et 18 ; Cependant, ces mesures de notation plus complexes ne font pas la distinction entre la contribution de l’inflammation et de la lésion tissulaire aux déficits neurologiques sous-jacents. Ainsi, l’approche de référence pour évaluer la gravité de l’EAE consiste à effectuer à la fois un pointage clinique et histologique.
Ici, un protocole est décrit pour disséquer et intégrer des échantillons de moelle épinière et de cerveau de souris dans de la paraffine d’une manière qui capture le processus stochastique de formation des lésions qui se produit dans l’EAE. Un protocole est également présenté sur la façon de colorer les sections avec Luxol fast blue (LFB), créé à l’origine par Kluver et Barrera19, qui détecte la myéline dans le SNC. Les coupes sont soit colorées avec le LFB seul (pour l’analyse de démyélinisation), soit contre-colorées avec de l’hématoxyline et de l’éosine (H&E) pour aider à visualiser et à noter les lésions inflammatoires. Des protocoles sont également fournis pour quantifier la présence de leucocytes totaux (CD45), la perte de myéline et le nombre d’axones lésés (SMI-32) dans la moelle épinière à l’aide d’anticorps disponibles dans le commerce, de techniques immunohistochimiques (IHC) et de logiciels accessibles au public. Le protocole utilisé pour quantifier les leucocytes dans la moelle épinière peut également être appliqué pour quantifier les leucocytes dans le cerveau.
L’évaluation histologique de la perte et de la lésion axonales dans le cerveau est comparativement plus difficile que dans la moelle épinière, car les voies de la substance blanche du cerveau ne sont pas parallèles les unes aux autres. La mesure de la lumière des neurofilaments sériques (sNF-L) est apparue comme un biomarqueur prometteur des lésions neuronales dans la SEP20,21. Des études récentes ont étendu cette technologie à EAE 22,23,24. Ici, une méthode est présentée pour mesurer la lumière des neurofilaments sériques (sNF-L) chez des souris vivantes à l’aide d’un test de petites molécules (SIMOA). Cette méthode ne nécessite qu’une petite quantité de sérum et peut être réalisée sur des souris vivantes en seulement une demi-journée, ce qui permet de disposer rapidement d’un retour d’information sur la façon dont une thérapie testée affecte l’ensemble des lésions du SNC. Toutes les méthodes décrites ici peuvent être appliquées à des souris de n’importe quel sexe ou souche.
Protocole
Toutes les expériences menées sur des souris ont été réalisées selon des protocoles d’utilisation des animaux approuvés par le comité de protection des animaux de Unity Health Toronto, conformément aux lignes directrices établies par le Conseil canadien de protection des animaux. Assurez-vous de porter une blouse de laboratoire, des gants de protection et des lunettes tout au long des procédures de laboratoire.
1. Prélèvement et réparation du cerveau et de la moelle épinière
- Euthanasier la souris conformément aux politiques de l’établissement. Posez la souris couchée sur une table de dissection et décapitez-la à l’aide de ciseaux chirurgicaux (en coupant vers le bas).
- À l’aide d’une pince Adson (dans une main non dominante), saisissez la peau sur le dessus de la tête de la souris. Faites ensuite une incision de 2,5 cm dans la peau sur le dessus de la tête à l’aide de ciseaux chirurgicaux.
- Utilisez les doigts pour pousser latéralement la peau de la tête afin de visualiser le crâne sous-jacent.
- Stabilisez la tête de la souris en saisissant les orbites à l’aide d’une pince Adson standard.
- À l’aide de ciseaux fins (main dominante), faites de petites cisailles dans le crâne le long de la ligne médiane de la colonne cervicale jusqu’aux bulbes olfactifs.
REMARQUE : Ne placez que quelques millimètres de pointes de ciseaux sous le crâne à la fois pour éviter d’endommager le cerveau sous-jacent. - Utilisez des pinces Adson avec des dents pour réfléchir le crâne latéralement afin de révéler le cerveau sous-jacent.
- Tenez la tête à l’aide de la main non dominante. En tenant les ciseaux fermés (main dominante), retirez la moelle épinière de la colonne cervicale et poussez doucement le cerveau hors du crâne, coupant les nerfs crâniens.
- Placez le cerveau dans un tube conique contenant 10 mL de formol tamponné neutre à 10 % qui est étiqueté avec l’identification de l’animal.
- Inciser la fourrure le long de la ligne médiane du torse de la souris, du cou à la queue.
- Utilisez les doigts pour pousser la peau latéralement afin de visualiser la colonne vertébrale.
- À l’aide de ciseaux chirurgicaux, coupez vers le bas à travers la colonne vertébrale au niveau où les fémurs s’attachent à la hanche.
- Utilisez des ciseaux chirurgicaux pour couper la paroi du corps de chaque côté de la colonne vertébrale, de la hanche au cou. Coupez tous les organes attachés.
- Placez la colonne vertébrale contenant la moelle épinière dans le même tube de formol que celui qui contient le cerveau. Laissez le cerveau et la colonne vertébrale se réparer pendant 5 à 7 jours.
REMARQUE : Le moment de la fixation est important. Certains anticorps ne fonctionneront pas si les tissus sont trop fixés. Si le tissu est sous-fixé, il est difficile d’extruder la moelle épinière de la colonne vertébrale à l’étape 2.
2. Grossisation et traitement de la moelle épinière et du cerveau
REMARQUE : Les étapes suivantes se déroulent dans une hotte. Avant de commencer, préparez 2 boîtes de Pétri propres de 10 cm, un erlenmeyer muni d’un entonnoir doublé de papier filtre, deux scalpels (un pour couper l’os et un pour couper les tissus du SNC), du papier pour lentilles, un crayon, des cassettes d’enrobage et des bocaux à échantillons pré-remplis de formol à 10 %.
- À l’aide de ciseaux, coupez un petit morceau de papier pour lentilles (de la même largeur mais deux fois plus long que la cassette) et placez-le dans une boîte de Pétri.
- Étiquetez une cassette en plastique avec l’identification de l’échantillon à l’aide d’un crayon.
- Versez le tube contenant le cerveau et la colonne vertébrale fixes dans l’entonnoir. Transférez la colonne vertébrale et le cerveau dans la boîte de Pétri vide.
REMARQUE : Le formol usagé filtrera dans l’erlenmeyer et pourra être réutilisé à l’étape 2.13. - Divisez grossièrement le cerveau en six morceaux coronaux à l’aide d’un scalpel. Faites une coupe caudale au cervelet, une au milieu du cervelet, une juste rostrale au cervelet et deux coupes dans le cerveau rostral restant, créant 3 tranches coronales supplémentaires d’épaisseur égale.
- À l’aide d’une pince, transférez des échantillons de cerveau sur la moitié du papier de la lentille dans la boîte de Pétri.
- Coupez la moelle épinière en trois morceaux à l’aide du scalpel : la première coupe est faite au bas de la cage thoracique, et la deuxième coupe est faite juste en dessous de la courbure de la colonne cervicale.
- À l’aide du même scalpel, coupez le morceau de colonne vertébrale sacrée à l’extrémité caudale jusqu’à ce que la moelle épinière puisse être visualisée.
- Prenez la colonne thoracique (main non dominante). Tenez la pince Adson avec les dents bien fermées (main dominante) et poussez doucement l’extrémité de la pince dans la plus petite ouverture de la colonne vertébrale en utilisant un léger mouvement de torsion. Le cordon doit sortir de l’autre extrémité.
REMARQUES : Tout instrument à extrémité ronde de la taille de la moelle épinière fonctionnera à cette fin. Si la moelle épinière ne sort pas naturellement, ne forcez pas. Au lieu de cela, utilisez des ciseaux fins pour couper les os le long du côté de la colonne vertébrale et réfléchissez-le pour révéler la moelle épinière. Alternativement, fixez la moelle épinière et le cerveau pendant quelques jours supplémentaires dans du formol ; Cependant, le même temps de fixation doit être appliqué à tous les échantillons pour éviter d’introduire une variabilité dans la coloration des anticorps. - Prenez la pince Adson standard (main dominante). Toujours en tenant le morceau de moelle épinière avec la main la moins dominante, utilisez une pince pour tirer doucement le cordon émergé hors de la colonne. Placez le morceau de moelle épinière dans la boîte de Pétri contenant le papier pour lentilles.
- Répétez ce processus pour les pièces de la colonne lombaire/sacrée et cervicale.
- Divisez les trois morceaux de moelle épinière (cervicale, thoracique, lombaire/sacrée) en morceaux de section transversale plus petits à l’aide d’un scalpel. Coupez au moins 15 segments, chacun d’entre eux devant avoir moins de 2 mm d’épaisseur.
REMARQUE : Assurez-vous que les segments sont plus courts que larges, ce qui permettra aux sections de tomber plus facilement en coupe transversale pendant le processus d’encastrement à l’étape 3. - Disposez les morceaux de moelle épinière sur la même moitié du papier pour lentilles contenant les morceaux de cerveau. Repliez le papier pour lentilles pour prendre en sandwich les morceaux de tissu et placez-le dans la cassette étiquetée.
REMARQUE : Le papier pour lentilles empêche les petits morceaux de tissu de s’échapper de la cassette pendant le traitement. - Transférez la cassette dans un bocal contenant du formol recyclé ou frais.
- Répétez les étapes 2.1 à 2.13 pour les autres échantillons.
- Après 5 à 7 jours de fixation, transférer les cassettes du récipient de l’échantillon dans le premier bain de formol dans le préparateur automatique de tissus (voir le tableau des matériaux). Faites fonctionner le préparateur de tissus pendant la nuit selon le programme décrit dans le tableau supplémentaire 1. Les échantillons sont maintenus dans de la cire de paraffine chaude jusqu’à l’enrobage.
3. Intégration et découpe de sections de cerveau et de moelle épinière
- Transférez les cassettes du processeur à la chambre de maintien à chaud de la station d’enrobage de paraffine (voir le tableau des matériaux).
- Intégrez les coupes transversales de la moelle épinière et du cerveau de chaque souris dans un seul bloc de paraffine comme suit (Figure 1) :
- Tout d’abord, versez de la cire de paraffine juste pour couvrir le fond du moule. À l’aide d’une pince fine, placez des morceaux de section transversale du cerveau et de la moelle épinière dans la paraffine au fond du moule.
- Transférer le moule sur la surface de refroidissement pendant plusieurs secondes pour fixer les morceaux de cerveau et de moelle épinière en place. Ramenez le moule sur la surface chauffée et remplissez-le jusqu’en haut de paraffine chaude.
- Placez le couvercle de la cassette (qui est étiqueté avec l’identification de l’échantillon) sur le dessus du moule. Versez plus de paraffine sur le couvercle de la cassette. Transférez le moule dans la station de refroidissement pour permettre à la cire de prendre (laisser refroidir pendant 30 à 60 minutes).
REMARQUE : L’intégration de sections de moelle épinière nécessite de la pratique. Pour améliorer le succès, utilisez des longueurs de moelle épinière plus courtes (<2 mm) car celles-ci sont plus susceptibles de tomber en coupe transversale. Des loupes oculaires chirurgicales peuvent être portées pour aider à distinguer si des morceaux de moelle épinière sont en coupe transversale. - Montez le bloc de paraffine sur le microtome rotatif. Couper le bloc jusqu’à ce que les tissus d’intérêt apparaissent dans la section de paraffine.
- Découpez des rubans de 5 μM de sections de chaque bloc et transférez-les dans un bain-marie à 42 °C.
- Rassemblez des sections sur des lames et placez les lames dans un support à lames en verre.
- Cuire les sections à 37 °C dans un four sec pendant la nuit. Laisser refroidir les lames avant de procéder à la coloration.
4. Déparaffinisation et réhydratation des sections en vue de la coloration
REMARQUE : Les étapes sont effectuées dans une hotte. Avant de commencer, préparez des bains de solvants. Préparer 5 L de 1x PBS (1 L ddH2O, 8 g de NaCl, 0,2 g de KCl, 1,44 g de Na2HPO4, 0,24 g de KH2PO4 ; pH = 7,4) avec 0,05 % de Tween-20 (PBS-T) pour toutes les étapes de lavage.
- Déparaffiner en plaçant les lames dans deux bains consécutifs de xylène ou d’un solvant non à base de xylène sur un agitateur pendant 5 minutes chacun avec une légère agitation.
- Réhydrater les tissus en transférant des lames dans des bains successifs de pourcentages décroissants d’éthanol : 2 x 100 % d’éthanol (5 min chacun), 2 x 95 % d’éthanol (3 min chacun) et 1 x 70 % d’éthanol (3 min). Retenir 95 % d’éthanol pour la coloration LFB, et réhydrater à 70 % d’éthanol, et conserver dans du PBS-T pour l’immunohistochimie (IHC).
5. LFB pour la myéline avec H&E
- Préparer une solution de 0,1 % de LFB (0,2 g de LFB, voir le tableau des matériaux, 200 mL d’éthanol à 95 %, 0,5 mL d’acide acétique glacial). Mélangez et filtrez dans un erlenmeyer. Conserver dans une bouteille sombre jusqu’à utilisation.
- Transférez les sections d’éthanol à 95 % dans un support à lames de verre qui est placé dans une boîte de coloration contenant du LFB. Couvrez le plat et scellez avec un film de paraffine pour éviter l’évaporation.
- Incuber les sections à 56 °C pendant la nuit (maximum 16 h).
- Le lendemain matin, transférez les lames dans un bain ddH2O et maintenez-les.
- Pendant ce temps, préparer (1) une solution fraîche de carbonate de lithium à 0,05 % (0,05 g de carbonate de lithium, 100 mL ddH2O) ; (2) Solution d’éosine Y (ajouter 2 g de sel d’éosine à 40 mL ddH20 et mélanger jusqu’à dissolution, puis mélanger avec 160 mL d’éthanol à 95 %).
- Préparez les bains suivants : 1 x carbonate de lithium, 3 x 70 % d’éthanol, 3 x 95 % d’éthanol, 2 x 100 % d’éthanol, 3 x ddH20. Placer les bains dans l’ordre d’utilisation (voir le tableau supplémentaire 2).
- Suivez les étapes décrites dans le tableau supplémentaire 2.
- Une fois les lames sèches, visualisez les lésions démyélinisantes au microscope.
6. LFB pour la myéline sans H&E
- Effectuez cette procédure de coloration pour l’analyse de la myéline.
REMARQUE : La procédure est identique à l’étape 5 (voir le tableau complémentaire 2), mais comporte un flux de travail abrégé. Après l’étape 4, poursuivez la procédure en commençant par l’étape 10.
7. Récupération de l’antigène et trempe de la peroxydase pour les colorations immunohistochimiques (IHC)
REMARQUE : Avant de commencer, préparez 100 mL de peroxyde d’hydrogène dans du méthanol (1 partie de solution de peroxyde d’hydrogène à 30% dans 9 parties de méthanol à 100%, dans une hotte). Préparer 1 L de tampon de citrate de 10 mM avec Tween-20 (2,94 g de citrate trisodique, dissous dans 1 L de ddH20 dans un bécher sur une plaque d’agitation, porter le pH à 6,0 et ajouter 500 μl de Tween-20). Préparez PBS-T (voir étape 4). Tous les lavages se font dans des bains de PBS-T avec une légère agitation (sur un shaker) sauf indication contraire.
- Tremper la peroxydase endogène en plaçant des lames dans du peroxyde d’hydrogène à 3% dans du méthanol pendant 15 min (dans une hotte). Laver les lames deux fois dans du PBS-T (2 min chacune).
- Transférez les lames sur un support de lame en métal et placez-les dans 1 L de tampon de citrate dans un autocuiseur. Scellez le couvercle et ajoutez un bouchon en caoutchouc sur le dessus de l’évent d’évacuation de la vapeur.
- Cuire à feu vif au micro-ondes jusqu’à ce que la languette jaune de l’autocuiseur apparaisse, indiquant que la pression maximale a été atteinte. Faites cuire encore 5 minutes à pression maximale, puis retirez l’autocuiseur du micro-ondes à l’aide de gants de protection.
- Dépressuriser en retirant le bouchon. Retirez le couvercle et laissez les lames refroidir dans le tampon de citrate pendant 20 minutes, puis procédez à la méthode de coloration souhaitée.
ATTENTION : Reculez lorsque vous relâchez la vapeur car cela peut provoquer une brûlure.
8. Immunohistochimie CD45
REMARQUE : Cette méthode IHC est utilisée pour visualiser les leucocytes infiltrants. Les étapes de blocage de l’avidine/biotine sont combinées avec les étapes de blocage et d’incubation primaire des anticorps.
- Préparez un tampon de blocage (2 % de BSA, 2 % de sérum de lapin dans 1x PBS).
- Transférer les lames sur le plateau à lames en verre et les laver deux fois avec du PBS-T (2 min chacune). Préparer l’avidine/solution bloquante (4 gouttes/mL d’avidine dans 2 % de BSA/2 % de sérum de lapin dans 1 x PBS, voir le tableau des matériaux).
- Séchez l’excès de PBS-T autour du tissu à l’aide d’un papier de soie de laboratoire. À l’aide d’un stylo hydrophobe, tracez un cercle autour du tissu et placez la lame dans la chambre humide.
- Appliquer l’avidine/solution bloquante sur chaque section (400 μL/lame).
- Couvrir la chambre humide et incuber pendant 30 min à température ambiante. Au cours de cette étape, préparer l’anticorps anti-CD45 (tableau supplémentaire 3) dans un tampon bloquant contenant de la biotine (4 gouttes/mL de biotine, 2 % de BSA/2 % de sérum de lapin dans 1x PBS).
- Tapotez la solution de blocage de la glissière sur une lingette de laboratoire non pelucheuse. Tamponnez autour du tissu à l’aide d’une lingette de laboratoire pour éliminer l’excès de liquide.
- Replacez la glissière dans une chambre humide. Ajouter 400 μL de solution d’anticorps CD45 (voir le tableau des matériaux) dans la section. Incuber une nuit à 4 °C dans une chambre humide couverte.
- Le lendemain, égouttez les anticorps primaires et lavez les lames 3 fois dans du PBS-T (5 min chacune).
- Sécher la zone autour de la section à l’aide d’un laboratoire non pelucheux, puis ajouter 400 μL d’anticorps secondaires (dilution de 1 :200 dans le tampon bloquant) sur chaque section. Incuber à température ambiante pendant 1 h.
- Pendant ce temps, préparez le réactif ABC (voir le tableau des matériaux) en ajoutant 2 gouttes de réactif A à 5 mL de 1x PBS et mélangez. Ajouter 2 gouttes de réactif B à la même solution et mélanger (préparer ~30 min avant utilisation).
- Lavez les lames en 3 changements de 1x PBS-T (5 min chacun) et placez les lames dans une chambre humide.
- Ajouter 400 μL de réactif ABC aux sections. Couvrir la chambre humide et incuber pendant 30 min à température ambiante.
- Lavez les lames en 3 changements de 1x PBS-T (5 min chacun). Pendant ce temps, préparez une quantité appropriée de solution DAB dans un tube à centrifuger de 15 mL recouvert d’une feuille d’aluminium conformément aux instructions du fabricant (voir le tableau des matériaux).
- Prenez une diapositive et concentrez-vous sur une section de la moelle épinière au microscope. Ajoutez 400 μL DAB à la lame et démarrez le minuteur de laboratoire.
- Visualisez la section pendant qu’elle se développe et arrêtez la minuterie lorsque les leucocytes sont bruns. Transvasez la lame dans un bain ddH20 pour arrêter la réaction. Maintenir dans l’eau pendant 5 min. Le même temps de développement est utilisé pour les diapositives restantes.
ATTENTION : Le DAB est cancérigène. Éliminez les déchets DAB et les déchets post-DAB ddH2O en tant que déchets dangereux. - Contreteindre les lames avec l’hématoxyline de Mayer pendant ~4 à 10 min (voir le tableau supplémentaire 2). Rincez les lames sous l’eau courante du robinet pendant 10 minutes.
- Déshydrater dans de l’éthanol à 95 % (1 x 3 min), suivi d’un éthanol absolu à 100 % (2 x 3 min chacun).
- En vous déplaçant dans une hotte, transférez les lames dans du xylène ou un solvant de substitution du xylène pendant 5 minutes. Collez la lamelle avec du support de montage et laissez sécher les lames pendant 1 à 2 jours dans la hotte.
ATTENTION : Si vous utilisez du xylène, utilisez des gants doubles et des pinces pour manipuler les glissades lors du glissement de couverture, car il est toxique et peut dissoudre les gants. - Nettoyez les lames à l’aide de xylène et numérisez-les à l’aide d’un scanner de lames à un grossissement de 20x.
9. SMI-32 IHC pour les lésions axonales
REMARQUE : Ce protocole utilise un anticorps SMI-32 de souris, qui réagit contre les neurofilaments lourds non phosphorylés, qui peuvent s’accumuler dans les axones lésés25. Étant donné que cet anticorps a été élevé chez la souris et qu’il détecte un antigène de souris, il est recommandé d’utiliser un kit Mouse on Mouse (MOM). Dans cette procédure, l’étape de blocage de l’avidine/biotine est effectuée comme une étape distincte de l’incubation primaire de l’anticorps. Avant de commencer ce protocole, déparaffinez, réhydratez, éteignez l’activité de la peroxydase endogène et effectuez la récupération de l’antigène comme décrit aux étapes 4 et 7.
- Laver les sections deux fois avec 2 x PBS-T (2 min chacune). Retirez l’excès de liquide autour des sections à l’aide d’un mouchoir de laboratoire et tracez un cercle autour des tissus à l’aide d’un stylo hydrophobe.
- Ajouter 400 μL de tampon bloquant (2 % (p/v) de sérum de chèvre dans 1x PBS-T) avec de l’avidine (4 gouttes/mL) dans les sections. Incuber pendant 15 min à température ambiante.
- Trempez les lames deux fois dans 1x PBS-T. Ajouter 400 μL de tampon bloquant avec biotine (4 gouttes/mL) à la lame et incuber pendant 15 min à température ambiante.
- Lavez les lames dans un bain 1 x PBS-T pendant 2 min. Pendant ce temps, préparez le réactif bloquant MOM en ajoutant 2 gouttes de solution mère (voir le tableau des matériaux) à 2,5 mL de PBS 1x.
- Ajouter 400 μL de réactif MOM sur la section. Incuber pendant 1 h à température ambiante.
- Lavez les lames deux fois dans un bain 1x PBS-T pendant 2 min. Pendant ce temps, préparez le diluant MOM en ajoutant 300 μL de solution mère de concentré de protéines à 3,75 mL de PBS 1x.
- Ajouter 400 μL de diluant MOM et incuber 5 min à température ambiante. Pendant ce temps, diluez l’anticorps SMI-32 (voir le tableau des matériaux) dans le diluant MOM.
- Tapotez le diluant des lames et ajoutez 400 μL de solution d’anticorps SMI-32 sur la section. Couvrir la chambre humide et incuber pendant 30 min à température ambiante.
- Lavez les lames deux fois dans un bain 1x PBS-T pendant 2 minutes, chacune en agitant doucement. Pendant ce temps, diluer le réactif de travail anti-souris MOM dans le diluant (10 μL de bouillon dans 2,5 mL de diluant).
- Ajouter 400 μL de réactif de travail anti-IgG souris par lame. Incuber pendant 10 min.
- Lavez les lames deux fois dans un bain 1x PBS-T pendant 2 minutes chacune. Continuez à colorer en suivant les étapes décrites dans le protocole de coloration CD45 (étapes 8.11 – 8.19).
10. Score LFB et H&E pour la présence de lésions démyélinisantes
REMARQUE : Ce qui suit est une approche d’analyse qui peut être appliquée pour obtenir des informations rapides sur la gravité de la démyélinisation inflammatoire. Cette analyse est effectuée dans des sections de la moelle prélevées à différents niveaux (cervical, thoracique et lombaire, au moins 3 sections par niveau). Reportez-vous à l’Atlas du cerveau d’Allen pour la moelle épinièrede souris 26 pour aider à identifier le niveau anatomique de la moelle épinière. Cette analyse nécessite des fichiers TIFF. Si les images numérisées sont au format .czi, suivez les instructions du tableau supplémentaire 4 pour convertir les fichiers czi en fichiers TIFF.
- Ouvrez l’image TIFF de la section à analyser en faisant glisser et en déposant le fichier dans l’ImageJ. Observez la section de la moelle épinière en 4 quadrants : dorsal, latéral gauche, latéral droit et antérieur (Figure 2A,B).
- Score pour la présence de lésions démyélinisantes dans chaque quadrant, comme illustré à la figure 2.
NOTE : La présence d’une lésion entraîne un score de 1 dans ce quadrant, pour un total de 4 points possibles par section. Un score de 1 est attribué même s’il y a plusieurs lésions dans un quadrant. - Additionnez tous les points pour chaque souris et divisez par le nombre total de quadrants échantillonnés pour obtenir la fraction de quadrants présentant des lésions sous-méningées.
11. Calcul de la fraction surfacique de la coloration du LFB dans la substance blanche de la moelle épinière
REMARQUE : Cette analyse mesure la fraction de surface en pourcentage de la substance blanche de la moelle épinière qui est colorée par le LFB.
- Ouvrez une section colorée par le LFB enregistrée en tant que fichier TIFF en la faisant glisser/déposer dans ImageJ.
- Cliquez sur Image > Tapez > 8 bits pour produire une image en niveaux de gris. Cliquez sur l’image > ajuster > seuil. Ajustez le curseur inférieur de manière à ce que la superposition rouge capture toutes les régions sombres (myéline) visibles à l’œil nu (Figure 2C–E). Cliquez sur Appliquer.
- Cliquez sur Outils d’analyse > > Gestion du retour sur investissementpour ouvrir le gestionnaire de retour sur investissement.
- Sélectionnez l’outil de dessin polygonal dans la barre d’outils ImageJ. Cet outil de dessin permet de délimiter une région de la moelle épinière avec la souris de l’ordinateur.
- Tracez le contour de la région dorsale de la moelle épinière et ajoutez le polygone au gestionnaire de retour sur investissement en cliquant sur t sur le clavier.
- Tracez le contour de la région antéro-latérale de la substance blanche de la moelle épinière et ajoutez le polygone au gestionnaire de ROI.
REMARQUE : Lors du traçage, exclure les gros vaisseaux sanguins, les déchirures dans les tissus, les artefacts et les zones adjacentes à la corne dorsale (figure 2A, flèche B ), qui sont normalement moins myélinisées. Soyez aussi précis que possible lors du traçage, car l’inclusion d’un arrière-plan trop blanc faussera les résultats. - Cliquez sur Analyser > définir les mesures et sélectionnez Fraction de surface.
- Cliquez sur Mesurer dans le gestionnaire de retour sur investissement. Cela donnera la fraction de la zone délimitée qui est colorée avec LFB.
- À partir de la zone de résultats nouvellement produite, copiez les valeurs dans Excel et fermez la fenêtre d’image. Calculer le % moyen de la surface de fraction colorée pour les régions dorsale et ventro-latérale. Faites la moyenne de ceux-ci pour obtenir une valeur pour cette section.
- Répétez les étapes 11.1 à 11.9 pour les sections cervicales, thoraciques et lombaires (N = 3/niveau/souris).
- Calculez le pourcentage moyen de fraction de myéline pour toutes les sections de chaque souris. Le pourcentage de démyélinisation est estimé en soustrayant le % de coloration de la surface de 100.
12. Analyse du nombre de cellules CD45+ et d’ovoïdes axonaux SMI-32+
- Faites glisser et déposez une image TIFF colorée CD45 ou SMI-32 dans ImageJ. Cliquez sur Analyser > Définir l’échelle > Global > Ok pour définir la barre d’échelle sur toutes les images. Notez que cela n’est fait que pour la première image.
- Sélectionnez l’outil de dessin polygonal et tracez autour de la matière grise à l’aide de la souris de l’ordinateur. Cliquez sur Analyser > Mesurer et enregistrez les résultats dans Excel en tant que « Zone de matière grise ».
- Avec le polygone dessiné toujours sur l’image, supprimez la matière grise de l’image en cliquant sur la touche Suppr (clavier). Cette action ne laisse que la substance blanche à analyser.
- Tracez le contour de toute la section de la moelle épinière à l’aide de l’outil de dessin polygonal . Excluez toutes les régions de tissu manquantes ou endommagées.
- Cliquez sur Analyser > Mesurer et enregistrez les résultats sous la forme « Surface tissulaire totale » dans le fichier Excel.
- Cliquez sur l’image > la déconvolution des couleurs > les couleurs. Dans la fenêtre déroulante des vecteurs, sélectionnez H DAB. Trois nouvelles fenêtres apparaîtront : conserver la fenêtre de teinte brune (canal DAB) et supprimer les autres fenêtres d’image.
- Cliquez sur l’image > ajuster > seuil. Ajustez le curseur inférieur pour seuiller l’image de manière à ce que la superposition rouge capture la même quantité de coloration brune détectée à l’œil nu. Cliquez sur Appliquer.
- Cliquez sur Traiter > binaire > bassin versant. À cette étape, comparez l’image d’origine et l’image binaire pour vous assurer qu’elles sont en accord.
- Cliquez sur Analyser > Analyser les particules. Sélectionnez Afficher la superposition et modifiez les paramètres : Taille = 5 - 150 μm2, Circularité = 0,4 - 1. Cliquez sur OK.
REMARQUE : Ces paramètres permettent d’inclure des cellules individuelles et de petits groupes de cellules qui n’ont pas été fractionnées avec la fonction Bassin versant au lieu d’être exclues de l’analyse. - Dans la fenêtre des résultats, enregistrez le dernier nombre dans la colonne la plus à gauche d’Excel, qui représente le nombre total de particules. Ensuite, calculez la surface de la substance blanche (surface totale du tissu – aire de la matière grise en mm2). Exprimez le nombre total de particules par zone de substance blanche (nombre/mm2).
- Répétez les étapes pour chaque image RVB enregistrée. Une fois que toutes les sections de la moelle épinière ont été analysées pour une souris, faites la moyenne du nombre de particules par mm2 de tissu pour cette souris.
REMARQUE : Le flux de travail utilisé pour analyser les leucocytes de la moelle épinière peut également être appliqué aux régions du cerveau.
13. Mesure de la sNF-L à l’aide d’un test SIMOA
- Prélever 100 à 200 μL de sang sur des souris vivantes par saignement saphène à l’aide de tubes de microrétention capillaire ou par ponction cardiaque à l’aide d’une seringue et d’une aiguille de 25 G (procédure terminale). Dans ce dernier cas, transférez le sang dans un tube de microcentrifugation de 1,5 ml.
- Laissez le sang coaguler à température ambiante pendant 30 à 60 minutes.
- Centrifuger les échantillons à 2660 x g pendant 5 min à 4 °C et pipeter la fraction supérieure (sérum) dans un nouveau tube de microcentrifugation. Conservez le sérum à -80 °C jusqu’au moment de l’utiliser.
- Préparation : Laisser les calibrateurs et les commandes (kit d’essai NF-light, voir le tableau des matériaux) se réchauffer à température ambiante pendant 1 h avant utilisation. Sortez le substrat enzymatique (RGP) du réfrigérateur et placez-le dans un bain-marie à 30 °C pendant au moins 30 minutes, en effectuant des vortex toutes les 10 minutes.
- Décongeler les échantillons de sérum sur de la glace. Une fois décongelés, vaporisez doucement les échantillons et centrifugez-les à 10000 x g pendant 5 min pour granuler les débris.
- Chargez la plaque : Vortex les calibrateurs et les commandes. Chargez les calibrateurs en double, les contrôles en double et les échantillons de sérum en double sur la plaque à 96 puits fournie avec le kit. Les échantillons de sérum sont dilués dans un rapport de 1 :3 avec le diluant fourni dans le kit. Scellez la plaque.
- Mettez la machine SIMOA sous tension (voir Tableau des matériaux) dans l’ordre de l’ordinateur, du programme, puis de la machine. Autorisez l’ordinateur à initialiser et à exécuter la maintenance de début de journée .
- Vortex les billes magnétiques pendant 30 s.
- Charger les réactifs à l’écran, double-cliquez sur la position de la grille où le flacon de réactif doit être placé, puis scannez le code-barres du flacon.
- Placez les billes magnétiques en position d’agitation sur la grille (positions 1 à 3).
- Continuez en chargeant le détecteur, le réactif SBG et le réactif RGP dans la machine.
- Cliquez sur les paramètres du logiciel. Assurez-vous que le mode d’échantillonnage est sur la plaque. Dans l’onglet Exécution du programme d’installation, nommez l’expérience.
- Attribuez des puits sur la plaque pour les calibrateurs comme suit : Cliquez sur le puits, puis sélectionnez le dosage. Sélectionnez calibrer A puis cliquez sur croissant. Mettez en surbrillance les puits A1 à 8, puis cliquez sur Répliques (2) pour attribuer les coordonnées des calibrateurs à exécuter en double. Exécutez à l’aide du protocole Neat.
REMARQUE : Reportez-vous au certificat d’analyse (site Web du fabricant) pour obtenir les concentrations de chaque calibrateur pour chaque numéro de lot particulier. Une fois les puits attribués, il n’est pas possible de quitter cet écran sans perdre le travail, tant que la plaque n’est pas verrouillée en place. - Attribuez les échantillons en suivant les étapes ci-dessous :
- En bas à droite de l’écran, cliquez sur le bouton pour attribuer les échantillons. Mettez en évidence les puits où les échantillons doivent être situés.
- Cochez le test à exécuter dans la liste, choisissez le nombre de répétitions et spécifiez la dilution embarquée de 4x.
- Les puits étant toujours en surbrillance, entrez un préfixe pour l’ID de l’échantillon et le numéro de départ, puis cliquez sur générer pour produire des ID séquentiels pour les échantillons. Répétez les étapes pour les échantillons témoins.
- Chargez la plaque dans le support de plaque (A1 à A12).
- Sur l’interface de l’écran, cliquez sur Exemples de programmation terminés et passez à l’onglet Ressources système. Vérifiez que tous les conteneurs de réactifs sont pleins et que les conteneurs à déchets sont vides.
- Cliquez sur Exécuter.
- Une fois l’essai terminé, vérifiez la courbe d’étalonnage sous l’onglet « Réduction des données » en sélectionnant le test et le nom de la plaque.
- Allez dans « Historique des exécutions » et utilisez les filtres pour trouver l’exécution la plus récente. Sélectionnez Exécuter , puis tous les résultats. Cliquez sur exporter et enregistrez le fichier .csv. Cliquez sur rapport , puis sélectionnez rapport d’étalonnage par lots et sélectionnez l’exécution récente. Prévisualisez le rapport et exportez-le.
- Exécutez l’entretien de fin de journée recommandé par le fabricant. Éteignez le programme, l’appareil, puis l’ordinateur.
Résultats
La figure 3 montre des colorations histochimiques et de l’IHC représentatives, avec des exemples de lésions aiguës (à gauche) et plus anciennes de l’EAE (à droite). La coloration représentative du CD45 avec la contre-coloration à l’hématoxyline est illustrée à la figure 3A,B. Les figures 3C à F montrent des exemples de coloration LFB avec (Figure 3C,D) ou sans (Figure 3E,F) la contre-coloration H&E. Bien que l’hématoxyline ne soit pas spécifique des cellules immunitaires, les noyaux des cellules immunitaires se colorent plus sombrement et peuvent être distingués des cellules résidentes du SNC. Les figures 3G, H montrent une coloration représentative des axones SMI-32+, contre-colorés à l’hématoxyline. Remarquez l’apparition accrue de cette tache dans les lésions plus anciennes de l’EAE.
Les lésions des pistes myélinisées sont plus fréquentes dans la moelle épinière chez les EAE murins actifs et c’est le principal facteur de paralysie dans cette maladie 7,9. Ainsi, le pointage de la présence d’inflammation et de lésions tissulaires dans la moelle épinière est priorisé dans les analyses histologiques. Les lésions de l’EAE surviennent sporadiquement dans différentes régions (antérieures, latérales ou dorsales) (Figure 2A,B) et à différents niveaux (sacré, lombaire, thoracique, cervical) de la moelle épinière. La méthode d’enrobage décrite assure un bon échantillonnage des lésions dans l’ensemble du cordon. Plus de sections sont incorporées qu’analysées, car certaines sections peuvent être endommagées lors du processus de traitement ou de sectionnement. Pour assurer un échantillonnage représentatif, un minimum de 3 coupes représentatives sont analysées aux niveaux cervical, thoracique et lombaire de la moelle épinière pour chaque souris. L’identité de chaque spécimen est masquée afin que la personne qui effectue l’analyse ne soit pas biaisée lors de la sélection des sections représentatives à analyser.
Pour mieux comprendre rapidement les différences dans la sévérité histologique de l’EAE, on peut noter la présence de lésions démyélinisantes sous-méningées dans les quadrants de la moelle épinière dans des sections sélectionnées (Figure 2A,B). Il s’agit d’une méthode rapide qui peut être réalisée sur des images numérisées ou à l’aide d’un microscope optique. Cette analyse est suffisamment sensible pour détecter des différences dans la sévérité histologique de l’EAE entre les groupes lorsque l’EAE est sévère dans un groupe et légère dans un autre. Par exemple, dans l’expérience de la figure 4, l’EAE a été induite chez les femelles de type sauvage (WT) et les souris présentant une délétion dans OGR1 (OGR1 KO) en utilisant MOG p35-55/CFA plus PTX. Les souris du groupe WT ont développé une EAE sévère avec paralysie complète, tandis que le groupe knock-out OGR1 a développé une maladie bénigne. Cette différence de score clinique correspondait à une différence dans la fraction des quadrants qui présentaient des lésions sous-méningées (Figure 4C).
Il est important de compléter le pointage des lésions démyélinisantes par un pourcentage de fraction de surface de coloration de la myéline pour saisir l’étendue de la perte de myéline et/ou d’axones myélinisés pendant l’attaque auto-immune. Dans l’exemple de la figure 4, le pourcentage de fraction de myéline différait également de manière significative entre les souris OGR1 et WT (figure 4D). Le pourcentage de fraction de myéline est également significativement corrélé avec le score EAE cumulatif chez les souris atteintes d’EAE (Figure 4E) et constitue donc une bonne mesure des lésions tissulaires globales dans cette maladie. Notez que ce protocole ne distingue pas l’intensité de la coloration à la myéline. Si tel est le résultat souhaité, il convient d’effectuer une coloration par immunofluorescence des protéines de myéline telles que la protéine protéolipide ou la protéine basique de la myéline et de mesurer l’intensité de cette coloration.
Dans le cas où l’EAE est sévère dans les deux groupes de comparaison, une fraction plus élevée des quadrants de la moelle épinière contiendra des lésions inflammatoires/démyélinisantes. Dans ce cas, une approche plus sensible pour évaluer l’inflammation consiste à compter le nombre de leucocytes CD45+ par mm2 de substance blanche (voir la coloration représentative à la figure 3A). Le clone d’anticorps CD45 décrit ici détecte toutes les leucocytes infiltrants et ne colore que les microglies occasionnelles qui régulent à la hausse l’expression de CD45 dans l’EAE (voir la flèche ouverte dans la figure 3B) et est donc utile pour capturer l’infiltration des cellules immunitaires périphériques.
Dans les études EAE à plus long terme (>20 jours), il est recommandé d’effectuer également une analyse de la lésion axonale. La coloration SMI-32 dans les sections de moelle épinière est une méthode sensible pour détecter les axones endommagés. Bien que l’inflammation de la moelle épinière s’atténue avec le temps et que les axones épargnés puissent se remyéliniser, les axones survivants présentent une étendue différentielle de lésionrésiduelle 9 (Figure 3G,H). Par exemple, dans le modèle d’EAE induit par MOG p35-55 chez les souris C57BL6/J, l’étendue de la lésion et de la perte axonales est un facteur déterminant des scores cliniques après la fin du processus inflammatoire9. La figure 5 en montre un exemple dans une expérience EAE chez des souris mâles et femelles, des souris WT et des souris déficientes en un gène appelé récepteur-delta activé par les proliférateurs de peroxysomes (PPAR-delta) dans le compartiment myéloïde (LysMCre : Ppardfl/fl). Chez les mâles, les souris WT ont retrouvé la fonction des membres postérieurs, mais les scores cliniques sont restés élevés dans le groupe mâle LysMCre : Ppardfl/fl. En revanche, dans l’expérience chez les femmes, les deux groupes expérimentaux ont obtenu des scores élevés tout au long de l’expérience. À première vue, ce résultat suggère que PPAR-delta a un effet spécifique au sexe dans l’EAE ; cependant, le pointage pathologique de la moelle épinière a révélé que les souris des deux sexes dans le groupe LysMCre : Ppardfl/fl présentaient une lésion axonale plus élevée par rapport à leurs homologues WT (Figure 5B). Un effet du génotype sur les scores cliniques n’a probablement pas été observé chez les femelles parce que les souris femelles WT avaient tendance à présenter une augmentation des lésions axonales, qui se manifestaient par des déficits neurologiques chroniques.
Dans cette même expérience, on a constaté que les souris femelles LysMCre : Ppardfl/fl avaient une infiltration plus étendue des lymphocytes T dans le cervelet, fournissant un exemple de la façon dont le score de l’inflammation cérébrale peut être utile dans l’EAE. Dans l’EAE, l’inflammation dans le cerveau se trouve principalement dans le cervelet et le tronc cérébral (Figure 6A, D, G), mais peut également être trouvée dans les méninges (vues sous l’hippocampe sur la Figure 6C), près des ventricules (Figure 6F) et d’autres voies de la substance blanche, y compris le nerf optique et le corps collosum (Figure 6B, E). L’évaluation de l’inflammation cérébrale se fait dans une région spécifique du cerveau (par exemple, la substance blanche cérébelleuse) en comptant le nombre de cellules CD45 par région tissulaire mm2 en utilisant la même méthodologie que celle décrite pour le protocole de la moelle épinière. Dans la méthode de grossissement décrite ici, une incision se trouve au milieu du cervelet, ce qui donne la perspective du cervelet et du tronc cérébral, comme le montre la figure 6A.
La mesure de la sNF-L à l’aide d’un test SIMOA est devenue un biomarqueur utile pour évaluer les lésions axonales en cours et les réponses au traitement dans la SEP cyclique 20,21,27,28. Le même kit de dosage SIMOA utilisé pour mesurer les humains sNF-L peut être appliqué pour mesurer la sNFL 22,23,24 de souris. Pour explorer dans quelle mesure ce test détecte les lésions axonales dans l’EAE, le sNF-L a été mesuré chez des souris femelles C57BL6/J au point final d’une expérience EAE et les niveaux ont été comparés à ceux de souris témoins saines appariées selon le sexe qui n’avaient pas d’EAE. Il a été constaté que les souris atteintes d’EAE présentaient des niveaux beaucoup plus élevés de sNF-L que chez les souris saines (Figure 7A) et que ces niveaux étaient corrélés à la densité des axones SMI-32+ dans la moelle épinière (Figure 7B). Par rapport à la notation histologique des lésions axonales, le test SIMOA est plus rapide (des souris qui saignent aux résultats peuvent être obtenus en un peu plus d’une demi-journée) et fournit donc un retour rapide sur l’efficacité d’un traitement chez les souris vivantes. Ce test présente également l’avantage de refléter les lésions axonales à la fois dans la moelle épinière et dans le cerveau.

Figure 1 : Bloc de paraffine représentatif de coupes de cerveau et de moelle épinière. Les 5 coupes coronaires du cerveau et les sections transversales de la moelle épinière (1,5 à 2 mm d’épaisseur) sont intégrées dans le même bloc afin de pouvoir être coupées en une seule section. Au moins 15 sections de moelle épinière doivent être intégrées, ce qui permet une sélection adéquate des sections à analyser. Veuillez cliquer ici pour voir une version agrandie de cette figure.
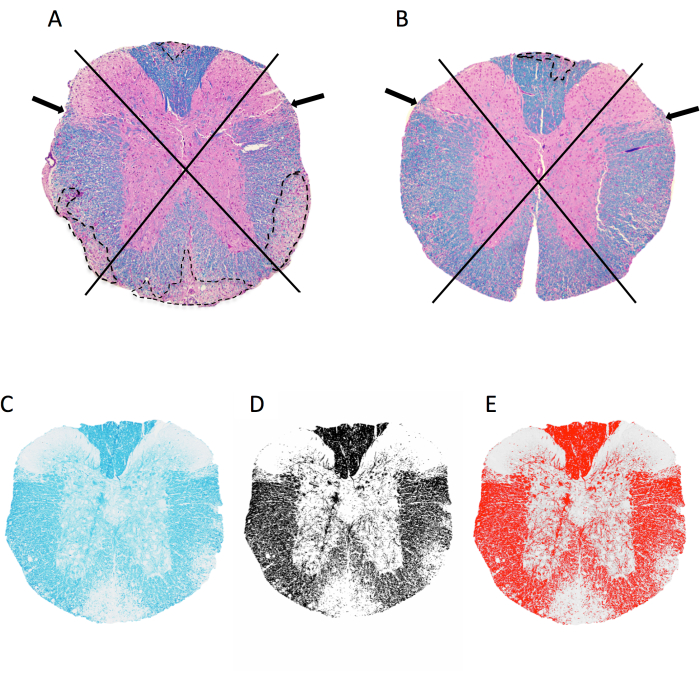
Figure 2 : Évaluation de l’inflammation méningée et du pourcentage de myéline au niveau de la moelle épinière thoracique. (A,B) montrent des images de la moelle épinière thoracique d’une souris femelle C57BL6/J avec un EAE induit par MOG p35-55 coloré avec LFB/H&E. L’approche utilisée pour visualiser les quadrants et des exemples de lésions démyélinisantes (tracées en pointillés) sont illustrées. La souris en A a 4 des 4 quadrants avec des lésions démyélinisantes confluentes, tandis que la souris en B a 1 des 4 quadrants touchés. La souris en B présente une certaine inflammation dans d’autres quadrants, mais celle-ci ne s’est pas manifestée par une lésion confluente et n’est donc pas notée. (C-E) Exemple d’image LFB, et de l’image en niveaux de gris et seuillée dans imageJ. Veuillez cliquer ici pour voir une version agrandie de cette figure.
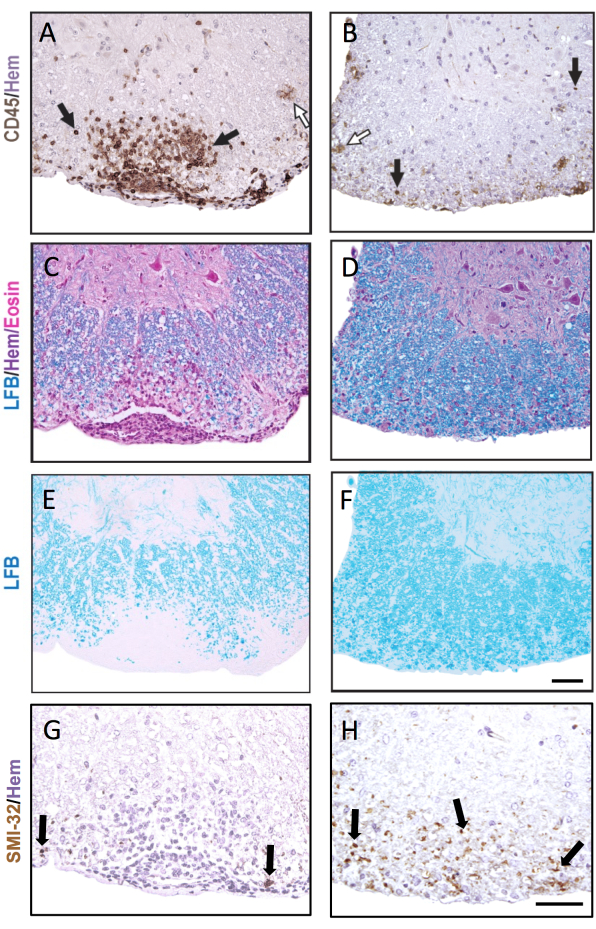
Figure 3 : Coupes de moelle épinière colorées avec CD45, LFB H&E, LFB et SMI-32. Exemples de lésions sous-méningées précoces (A, C, E, G) et tardives (B, D, F, H) de la moelle épinière colorées pour l’anticorps CD45 (A, B), le LFB/H&E (C, D), le LFB seul (E, F) et l’anticorps SMI-32 (G, H). Les flèches noires montrent des exemples de cellules colorées avec chaque anticorps respectif. Les flèches blanches montrent des microglies présumées qui ont été colorées en CD45+. Barre d’échelle = 50 μm. Cette figure montre la coloration représentative des lésions de la moelle épinière d’une souris femelle C57BL6/J au cours de l’EAE et met en évidence comment la pathologie peut être différente selon les différentes sections de la moelle épinière. Veuillez cliquer ici pour voir une version agrandie de cette figure.
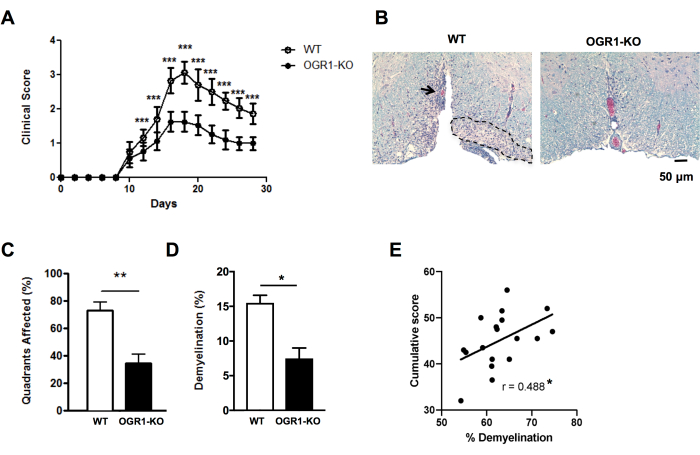
Figure 4 : Application du marquage pour les lésions et le pourcentage de démyélinisation dans l’EAE. L’exemple ci-dessous est un exemple d’une expérience EAE où des souris femelles déficientes en gène du récepteur 1 couplé à la protéine G (OGR1) du cancer de l’ovaire sur le fond C57BL6/J ont développé un EAE clinique moins sévère que les souris femelles C57BL6/J de type sauvage (WT). L’EAE a été induite par l’immunisation avec MOG p35-55/CFA plus PTX et les souris ont été notées selon l’échelle clinique suivante : 1 = paralysie de la queue. 2 = faiblesse des membres postérieurs et des pieds, 3 = paralysie des membres postérieurs, 4 = faiblesse des membres antérieurs, 5 = moribond. (A) Moyenne + scores cliniques SEM des souris au fil du temps. (B) Voici un exemple de coloration LFB/H&E dans la moelle épinière ventrale. Barre d’échelle = 50 μm. (C) Quadrants en pourcentage de la moyenne + MEB contenant des lésions démyélinisantes. (D) Moyenne + pourcentage de démyélinisation SEM dans chaque groupe. (E) montre le résultat d’une autre expérience dans l’EAE induite par MOG p35-55 chez des souris C57BL6/J où les scores EAE de souris individuelles ont été additionnés au cours des 30 jours d’observation et ont été corrélés avec le pourcentage de démyélinisation dans la moelle épinière. Les corrélations ont été effectuées à l’aide d’un test de Spearman. Les panneaux de (A-D) sont adaptés de Souza C et al.29. Les données en (E) sont des données d’origine. *P<0,05, **P<0,01, ***P<0,001. Veuillez cliquer ici pour voir une version agrandie de cette figure.
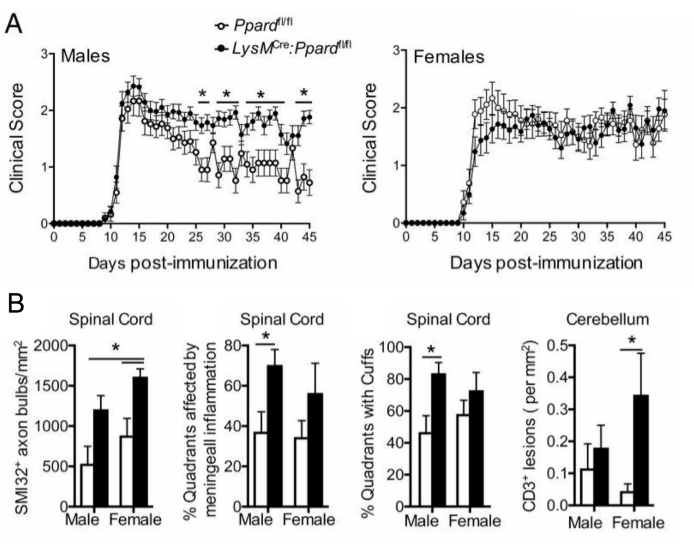
Figure 5 : Application de la coloration SMI-32 pour comprendre l’effet d’un génotype sur le phénotype clinique de l’EAE. Cette figure montre un exemple d’une expérience EAE où des souris mâles et femelles de type sauvage (portent l’allèle floxé de Ppard) et des souris mutantes Ppard spécifiques myéloïdes (LysMCre : Ppardfl/fl) sur le fond C57BL6/J ont été immunisées avec MOG p35-55/CFA et PTX et ont été suivies pendant 45 jours. (A) montre la moyenne + les scores cliniques SEM des souris. (B) montre les résultats moyens + MEB du score histologique du nombre d’axones SMI-32+ dans la moelle épinière, des quadrants % avec des lésions sous-méningées, des quadrants en pourcentage avec des coiffes périvasculaires et des lésions #CD3 dans le cervelet par mm2 tissu. Cette expérience a montré un effet génotypique sur la coloration SMI-32. Cette figure est adaptée de Drohomyrecky. et al.15. Veuillez cliquer ici pour voir une version agrandie de cette figure.
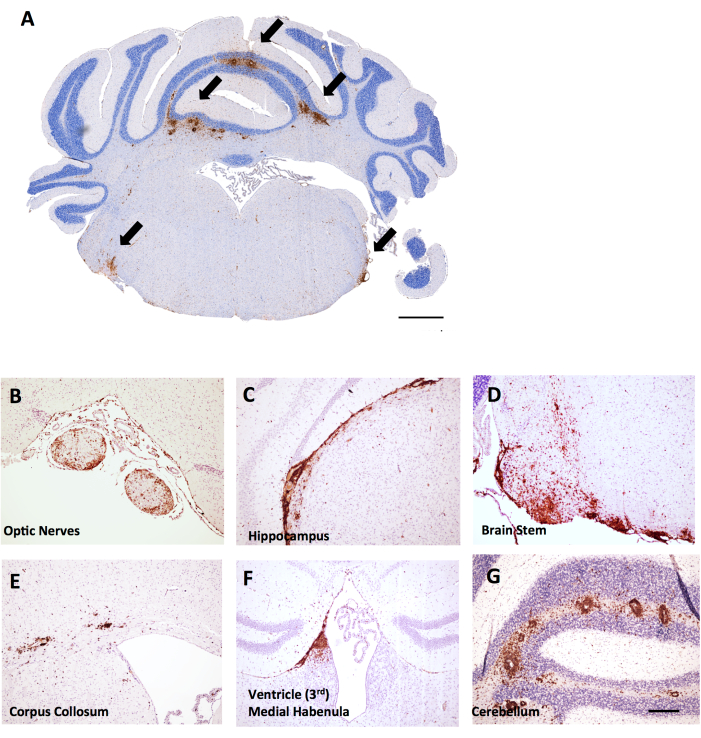
Figure 6 : Exemples de coloration CD45+/hématoxyline dans des coupes coronaires cérébrales dans l’EAE induite par MOG p35-55 chez des souris femelles C57BL6/J. Les lésions CD45+ sont représentées en brun. (A) Lésions CD45+ dans le tronc cérébral des coupes coronales. Barre d’échelle = 150 μm. (B-G) Exemples de lésions CD45+ dans les nerfs optiques (B), les extensions méningées sous l’hippocampe (C), le tronc cérébral (D), le corps collosum (E), l’habenula médiale près du ventricule (F) et le cervelet (G). Barre d’échelle : (B–G) = 50 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
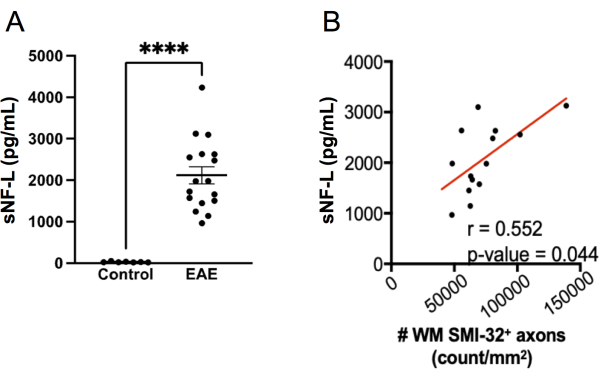
Figure 7 : Taux de sNF-L dans le sérum dans l’EAE induite par MOG p35-55. (A) Taux sériques de NFL prélevés sur des souris témoins femelles et EAE au point final d’une expérience. Les données ont été analysées à l’aide d’un test de Mann Whitney bilatéral. (****p valeur < 0,0001). (B) Des sections de moelle épinière ont été prélevées au point final et colorées au SMI-32. Le nombre de cellules positives par zone tissulaire de la substance blanche a été déterminé et corrélé avec la NF-L sérique au point final à l’aide d’un test de Spearman. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Tableau supplémentaire 1 : Description des bains utilisés dans le traitement des tissus. Les cassettes sont automatiquement déplacées à travers ces séries de bains à l’aide d’un processeur automatisé. Veuillez cliquer ici pour télécharger ce fichier.
Tableau supplémentaire 2 : Étapes de la coloration de Luxol Fast Blue et de l’hématoxyline et de l’éosine. Ce tableau décrit l’ordre des étapes du protocole de coloration Luxol Fast Blue et de l’hématoxyline et de l’éosine. Veuillez cliquer ici pour télécharger ce fichier.
Tableau supplémentaire 3 : Anticorps utilisés pour la coloration immunohistochimique. Les anticorps utilisés dans ce protocole ainsi que ceux qui peuvent être utilisés pour explorer davantage l’inflammation, la microgliose et l’astrogliose sont décrits. Veuillez cliquer ici pour télécharger ce fichier.
Tableau supplémentaire 4 : Comment convertir des fichiers .czi en fichiers TIFF. Notez qu’il est optimal d’utiliser une image haute résolution, mais que les images de résolution moyenne peuvent être enregistrées à la place si la mémoire de travail de l’ordinateur est limitée. Il est impératif d’utiliser des images de même résolution dans toutes les analyses. Notez également que la dernière image de la série est l’étiquette de la diapositive. Évitez de lire l’étiquette pour vous assurer que l’analyse est aveugle. 30,31 Veuillez cliquer ici pour télécharger ce fichier.
Discussion
La coloration histologique de la moelle épinière est un outil important pour évaluer la gravité de la maladie EAE, en particulier dans les cas où il existe des différences entre les groupes de traitement dans l’étendue de la guérison de la maladie dans la phase post-aiguë de la maladie. La coloration de l’infiltration des cellules immunitaires (CD45), de la myéline (LFB) et des lésions axonales (SMI-32) permet de caractériser la cause sous-jacente de l’altération des scores cliniques chez la souris. Le protocole de coloration histologique décrit ici donne une perspective de l’inflammation ainsi que de l’étendue de la myéline et des lésions axonales. De plus, les résultats présentés valident la mesure de la sNF-L en tant que méthode d’évaluation de l’étendue des lésions neuronales globales dans l’EAE.
Les paramètres critiques de cette analyse sont de s’assurer que les chercheurs sont aveugles à l’identité des coupes et qu’il y a un échantillonnage équivalent à chaque niveau de la moelle épinière chez les différentes souris. En effet, la gravité de l’inflammation peut être plus grande à des niveaux inférieurs de la moelle. Un autre paramètre critique est la taille des groupes expérimentaux. La moelle épinière et le cerveau sont généralement prélevés sur 6 à 8 souris par groupe au point final pour voir des différences significatives entre les groupes avec des traitements ou des génotypes ayant des tailles d’effet modestes. Il est également important de s’assurer que les souris sélectionnées, lorsqu’elles font la moyenne, ont des scores moyens représentatifs de l’ensemble du groupe. En ce qui concerne le dépannage, un problème courant rencontré par ceux qui n’ont pas d’expérience avec le protocole est que la moelle épinière est fixée pendant une durée insuffisante et qu’elle n’est pas facilement extrudée de la colonne vertébrale. Si tel est le cas, la moelle épinière peut être disséquée manuellement de la colonne en coupant le long des apophyses épineuses à l’aide de ciseaux fins et en ouvrant la colonne pour révéler la moelle épinière. Alternativement, les tissus peuvent être fixés pendant quelques jours supplémentaires sans interférer avec le succès de la coloration des anticorps. Les clones d’anticorps qui sont décrits ici agissent dans les tissus fixés jusqu’à 2 semaines dans le formol.
L’enfoncement des morceaux de moelle épinière nécessite des compétences et de la pratique. Il est recommandé de porter des loupes oculaires et de diriger une lampe au-dessus de la station d’encastrement pour mieux visualiser si les sections tombent en coupe transversale ou en coupe longitudinale. Maintenir la longueur des morceaux de moelle épinière à moins de 2 mm pendant le grossissement les aidera à tomber en coupe transversale. Un autre problème courant rencontré pour les utilisateurs moins expérimentés est que le LFB s’évapore pendant l’incubation nocturne, laissant la moitié de la lame tachée et l’autre moitié non tachée. Pour éviter l’évaporation, le plat de coloration en verre doit être scellé avec un film thermoplastique, puis une pellicule plastique. Si l’évaporation se produit et que les sections sont colorées de manière inégale, il est recommandé de débleuir complètement les lames avec du carbonate de lithium et de les colorer à nouveau dans le LFB pendant la nuit. Un autre problème courant est que les utilisateurs ne débleuissent pas complètement la matière grise après le LFB. Il est essentiel d’examiner les sections individuelles au microscope pour s’assurer qu’une quantité suffisante de bleuissement a été atteinte avant de procéder à d’autres étapes du protocole. De plus, bien que les colorants IHC CD45 et SMI-32 soient robustes, il est toujours important de dépanner les concentrations d’anticorps dans les expériences préliminaires pour chaque nouveau lot d’anticorps reçu. Cela peut être fait en testant diverses concentrations de l’anticorps sur une section témoin positive (moelle épinière EAE). La première coloration doit également inclure un contrôle négatif qui consiste en un anticorps secondaire seul sans anticorps primaire ajouté. Enfin, il est essentiel dans l’analyse d’images de seuiller les images individuelles, car la coloration peut être inégale d’une diapositive ou d’une section à l’autre.
Ce protocole utilise des logiciels disponibles gratuitement. Si l’on n’a pas accès à un processeur, à un embedder ou à un microtome, ces étapes peuvent être fournies à un centre de pathologie hospitalier qui offre ces services. De plus, si l’on n’a pas accès à un scanner de lames, on peut utiliser un microscope optique équipé d’une caméra vidéo pour enregistrer des images TIFF de la moelle épinière ou des régions du cerveau. Pour un flux de travail basé sur le microscope, capturez des coupes LFB ou LFB/H&E à faible puissance (grossissement 40x) et pour la coloration CD45 et SMI-32, imagez au moins quatre fenêtres centrées dans les parties ventrale, dorsale et latérale de la moelle épinière (grossissement 200x pour CD45 et grossissement 400x pour SMI-32). Une analyse d’image peut être effectuée sur ces images pour quantifier la coloration de la même manière que celle décrite.
La décision de l’approche histologique à adopter pour évaluer l’EAE dépend de la différence entre les scores cliniques entre les groupes. Par exemple, s’il y a des différences drastiques dans le score clinique de l’EAE (un groupe a reçu l’EAE et l’autre non), cela est généralement lié à des différences dans l’inflammation à médiation périphérique. Dans ce cas, le pointage de la présence de lésions démyélinisantes sur les coupes colorées au LFB/H&E est suffisant et révélera des différences entre les groupes. Si les groupes sont plus similaires dans le score clinique au début et qu’il y a plutôt des différences dans l’étendue de la récupération clinique (par exemple, expérience dans la figure 5A), il est préférable d’appliquer le flux de travail histologique complet qui est décrit ici, y compris le pointage de l’inflammation cérébrale dans le tronc cérébral et le cervelet, pour distinguer si les différences de chronicité de la maladie sont liées à des différences d’inflammation ou de lésions tissulaires. Si des différences dans l’inflammation sont constatées telles qu’évaluées par le comptage des CD45, d’autres études IHC peuvent être effectuées pour colorer les lymphocytes T (anti-CD3), les monocytes/macrophages infiltrants (Mac3) et les microglies (Iba-1/TMEM119) (les clones d’anticorps recommandés sont présentés dans le tableau supplémentaire 3). L’activation de la microglie se traduit par une augmentation de l’intensité de la coloration d’Iba-1 sur la microglie Iba-1+TMEM-19+ à double marquage et une rétraction accrue des processus microgliaux qui peuvent être évalués par analyse de Sholl sur les coupes32. De plus, des techniques telles que la cytométrie en flux ou le séquençage de l’ARN unicellulaire peuvent être appliquées pour effectuer une caractérisation plus approfondie de la fréquence et du phénotype des populations immunitaires dans le cerveau et la moelle épinière.
Le comptage des axones SMI-32+ est une méthode sensible pour détecter les lésions axonales dans EAE32,33 et dans MS34. SMI-32, qui détecte la forme non phosphorylée des neurofilaments lourds ou moyens, s’accumule dans les extrémités des neurones transectés. Une alternative pour détecter les axones blessés consiste à colorer avec la protéine précurseur de l’amyloïde (APP) qui peut s’accumuler dans les axones à la suite d’une perturbation du transport axonale33. Le modèle de coloration pour SMI-32 et APP, bien que tous deux reflètent tous deux une lésion axonale, ne se chevauche généralement pas, ce qui indique qu’ils détectent des pathologies différentes33. On peut également compléter les mesures histologiques des lésions axonales en mesurant le sNF-L, qui est une mesure rapide et sensible des lésions axonales en cours à la fois dans la moelle épinière et dans le cerveau. Il offre l’avantage de pouvoir être fait en une demi-journée chez des souris vivantes. L’inconvénient de cette méthode est que les kits sont coûteux et que la machine est hautement spécialisée. L’entreprise qui vend le kit sNF-L propose un service payant pour ceux qui n’ont pas accès à une machine SIMOA. Une alternative à l’évaluation des lésions axonales consiste à évaluer la perte axonale en comptant les axones dans les sections de la moelle épinière colorées en bleu toluidine12 ou en comptant les faisceaux de neurofilaments détectés par SMI-31 dans les zones de la substance blanche de la moelle épinière32. Ces deux approches sont plus laborieuses que la mesure SMI-32 ou sNF-L.
Si les scores cliniques de l’EAE diffèrent d’un groupe à l’autre, mais que le score de l’inflammation, de la démyélinisation et des lésions axonales ne révèle pas de différences entre les groupes, il peut être utile de colorer l’activation des astrocytes à l’aide de GFAP (voir le tableau supplémentaire 3 pour le clone d’anticorps recommandé). L’activation des astrocytes est associée à une augmentation de la coloration GFAP et il a été démontré qu’elle est corrélée à la progression de l’EAE dans certains modèles d’EAE, y compris l’EAE chronique chez le rat DA35.
En conclusion, ce protocole décrit les méthodes et fournit un flux de travail d’analyse pour effectuer un scoring histologique de l’EAE.
Déclarations de divulgation
Shannon Dunn consulte pour FSD Lucid Psycheceuticals.
Remerciements
Nous remercions le Dr Raymond Sobel (Université de Stanford) de nous avoir montré sa méthode de grossissement et de réparation des sections du cerveau et de la moelle épinière. Nous remercions Kyle Roberton et Milan Ganguly, du Centre de phénogénomique de Toronto, d’avoir appris la méthode d’intégration et d’avoir coupé un si grand nombre de nos sections du cerveau et de la moelle épinière. Nous remercions le Dr Matthew Cussick et le Dr Robert Fujinami (Université de l’Utah) d’avoir partagé leurs protocoles pour évaluer l’inflammation sous-méningée et périvasculaire de la moelle épinière. Nous remercions Shalina Ousman d’avoir partagé le clone de l’anticorps CD45. Nous remercions Xiofang Lu d’avoir suivi une formation sur le préparateur de tissus et la station d’enrobage de tissus, ainsi que d’avoir entretenu cet équipement au Centre de recherche biomédicale Keenan de l’Hôpital St. Michael’s. Ces travaux ont été financés par une subvention biomédicale de SP Canada (à SED). Carmen Ucciferri bénéficie d’une bourse d’études du gouvernement du Canada. Nuria Alvarez-Sanchez bénéficie d’une bourse postdoctorale Keenan.
matériels
| Name | Company | Catalog Number | Comments |
| 10% Neutral Buffered Formalin | Sigma Aldrich | HT501128-4L | Used to fix spinal cord and brain specimens |
| 1000 mL Glass Beaker | Pyrex | 1000 | |
| 15 mL Falcon Tube | Starstedt | 62.554.100 | Fixing and storing spinal cord and brain |
| 250 mL Erlenmeyer Flask | Pyrex | 4980 | |
| 500 mL Glass Beaker | Pyrex | 1003 | |
| 92 mm x 16 mm Petri Dishes | Starstedt | 82-1473-001 | Used in the tissue grossing procedure |
| 95% Ethyl Alcohol | Commercial Alcohols | P016EA95 | Dehydration and rehydration steps |
| ABC Elite Kit | Vector Labratories | PK6100 | Used for immunohistochemistry labeling |
| Aqua Hold 2 PAP Pen | Cole Parmer | UZ-75955-53 | Used for drawing around tissue sections in Immunohistochemical Staining |
| Avidin/Biotin Blocking Kit | Vector Labratories | SP-2001 | |
| Biosafety Cabinet | Any | ||
| Biotinylated rabbit anti-rat IgG | Vector Labratories | BA-4000 | Used for CD45 staining |
| C57BL6/J Mice | Jackson Laboratory | Stock # 664 | These mice were used in experiments shown in paper. |
| Centrifuge | Thermo Fisher Scientific | Sorvall ST Plus | |
| CitriSolv | Fisher Scientific | 04-355-121 | Used for de-waxing. Is an alternative to xylene |
| DAB Kit | Vector Labratories | SK-4100 | Used for developing in immunohistochemistry |
| ddH2O | - | - | |
| Disposable Scalpel | Magna | M92-10 | Used for grossing spinal cord and brain |
| DWK Life Sciences (Wheaton) glass staining dish | Cole Parmer | UZ-48585-60 | Used for histochemical staining and washes |
| DWK Life Sciences (Wheaton) glass staining rack | Cole Parmer | 10061392 | Used for immunohistochemistry and histochemistry |
| Eosin Y | Bioshop | 173772-87-1 | Stains cytoplasm |
| Feather Microtome Blades | Fisher Scientific | 12-634-1C | Used for sectioning paraffin |
| Filter Paper | Whatman | 1001110 | Used to filter the formalin (during grossing) and the luxol fast blue |
| Fine Surgical Scissors | Fine Science Tools | 14160-10 | Used to snip brain and the skull |
| Fumehood | Any | ||
| Gibco DPBS | Fisher Scientific | 14190944 | |
| Glacial Acetic Acid | BioShop | ACE333.4 | Used in the luxol fast blue staining procedure |
| Histoplex Histology Containers | Starplex Scientific | 565-060-26 | Fixing spinal cord and brain |
| Hydrogen Peroxide | Fisher Chemicals | H325-500 | Used to remove endogenous peroxidase in the tissue |
| ImageJ | NIH | https://imagej.nih.gov/ij/download.html | |
| Kimtech Science Kimwipes | Kimberly Clark Professional | 34155 | Used for immunohistochemistry |
| Lens paper | VWR | 52846-001 | Used for trapping spinal cord species in cassette during processing |
| Light microscope | Any | ||
| Lithium carbonate | Sigma Aldrich | 554-13-3 | De-blueing after luxol fast blue staining |
| Luxol blue | Sigma Aldrich | 1328-51-4 | Stains CNS myelin |
| M.O.M Immunodetection Kit | Vector Labratories | BMK-2202 | Used to stain SMI-32 |
| Methanol | Fisher Chemicals | A454.2 | Used for fixation |
| Mayer's Hematoxylin | Electron Microscopy Sciences | 26381-02 | Stains nuclei |
| Micro-Adson Forceps with Teeth | Fine Science Tools | 11027-12 | Used for reflecting the skull during dissections |
| Microcentrifuge | Eppendorf | Model 5417R | |
| Microvette Capillary Tubes CB 300 Z | Starstedt | 16.440.100 | Used for blood collection |
| Micrscope Cover Glass | Fisher Scientific | 12545A | Used for coverslipping |
| Mini Shaker | VWR | 12620-938 | Used for making buffers |
| NF light kit | Quanterix | 103186 | This kit can be used for detection of mouse or human soluble neurofilament in serum |
| Nitrile Gloves | VWR | 76307-462 | Safety |
| Normal Goat Serum | Vector Labratories | S-1000 | Blocking reagent |
| Normal Rabbit Serum | Vector Labratories | S-5000 | Blocking reagent |
| OmniSette Tissue Cassettes | Fisher Scientific | M4935FS | Used for embedding spinal cord and brain |
| p1000 Pipette and Tips | various | ||
| p200 Pipette and Tips | various | ||
| Paraffin Embedding station | Leica Biosystems | Model EG1160 | |
| Paraplast Tissue Infiltration/Embedding Medium | Leica Biosystems | 39601006 | Used for embedding spinal cord and brain |
| Permount Mounting Medium | Fisher Chemicals | SP15-100 | Used for mounting coverslips on slides |
| pH meter | Fisher Scientific | 13636AB315B | Used for pHing buffers |
| Plastic Transfer Pipettes | Fisher Scientific | 13-711-20 | Used for pHing buffers |
| Potassium Chloride | BioShop | 7447-40-7 | Used for making PBS |
| Potassium Phosphate Monobasic | BioShop | 7778-77-0 | Used for making PBS |
| Pressure Cooker | Nordic Ware | Tender Cooker | |
| Purified rat anti-mouse CD45 | Vector Labratories | 553076 | Detects leukocytes |
| Reagent grade alcohol 100% | VWR | 89370-084 | Dehydration and rehydration steps |
| Reagent grade alcohol 70% | VWR | 64-17-5 | Dehydration and rehydration steps |
| Rotary Microtome | Leica Biosystems | Model RM2235 | |
| Simoa Machine | Quanterix | HD-X | |
| Slide Scanner | Zeiss | AxioScan.Z1 | |
| SMI-32 mouse IgG1 antibody | Biolegend | 801701 | Detects damaged axons |
| Sodium Chloride | BioShop | 7647-14-5 | Used for making PBS |
| Sodium Phosphate Dibasic | Bioshop | 7558-79-4 | Used for making PBS |
| Standard Adson Forceps | Fine Science Tools | 11150-10 | Used for dissection steps |
| Superfrost Plus Microscope slides | Fisher Scientific | 12-550-15 | Used to collect sections |
| Surgical Tough Cuts | Fine Science Tools | 14110-15 | Used to cut through the spine, body wall, and skin |
| Tissue Processor | Leica Biosystems | Model TP1020 | |
| Tri-soldium citrate | Thermo Fisher Scientific | 03-04-6132 | Used for antigen retrieval |
| Tween-20 | BioBasic | 9005-64-5 | Used for washing sections |
| X-P Pierce XP-100 plate seal | Excel Scientific | 12-140 | Used for the sNF-L Assay |
| Xylene | Fisher Chemicals | 1330-20-7 | Used for de-waxing and clearing sections |
| Funnel | Cole Parmer | RK-63100-64 | Used to filter formalin before grossing tissue |
| Stir Plate | Any | Used to make solutions | |
| Oven | Any | Used to bake tissue sections after cutting | |
| Parafilm | Bemis | 13-374-10 | Used to seal LFB staining dish |
| Microwave | Any | Timing may vary depending on the microwave model | |
| Bovine Serum Albumin (BSA) | Sigma Aldrich | 9048-46-8 | Used to make blocking buffer |
| 1.5 mL Microcentrifuge Tubes | Fisher Scientific | 05-408--129 | Used to store mouse serum samples |
| Vortex | Any | Used to prepare samples for sNF-L assay | |
| Waterbath | Any | Used to warm enzyme substrate for sNF-L assay |
Références
- Constantinescu, C. S., Farooqi, N., O'Brien, K., Gran, B. Experimental autoimmune encephalomyelitis (EAE) as a model for multiple sclerosis (MS). Br J Pharmacol. 164 (4), 1079-1106 (2011).
- Rasouli, J., et al. Expression of GM-CSF in T is increased in multiple sclerosis and suppressed by IFN-beta therapy. J Immunol. 194 (11), 5085-5093 (2015).
- Zrzavy, T., et al. Loss of 'homeostatic' microglia and patterns of their activation in active multiple sclerosis. Brain. 140 (7), 1900-1913 (2017).
- Kutzelnigg, A., Lassmann, H. Pathology of multiple sclerosis and related inflammatory demyelinating diseases. Handb Clin Neurol. 122, 15-58 (2014).
- Glatigny, S., Bettelli, E. Experimental autoimmune encephalomyelitis (EAE) as animal models of multiple sclerosis (MS). Cold Spring Harb Perspect Med. 8 (11), (2018).
- Kipp, M., Nyamoya, S., Hochstrasser, T., Amor, S. Multiple sclerosis animal models: A clinical and histopathological perspective. Brain Pathol. 27 (2), 123-137 (2017).
- Nikic, I., et al. A reversible form of axon damage in experimental autoimmune encephalomyelitis and multiple sclerosis. Nat Med. 17 (4), 495-499 (2011).
- Croxford, A. L., et al. The cytokine GM-CSF the inflammatory signature of CCR2+ monocytes and licenses autoimmunity. Immunity. 43 (3), 502-514 (2015).
- Jones, M. V., et al. Behavioral and pathological outcomes in MOG 35-55 experimental autoimmune encephalomyelitis. J Neuroimmunol. 199 (1-2), 83-93 (2008).
- Zuo, M., et al. Age-dependent gray matter demyelination is associated with leptomeningeal neutrophil accumulation. JCI Insight. 7 (12), 158144 (2022).
- Bannerman, P. G., et al. Motor neuron pathology in experimental autoimmune encephalomyelitis: Studies in thy1-yfp transgenic mice. Brain. 128, 1877-1886 (2005).
- Cahill, L. S., et al. Aged hind-limb clasping experimental autoimmune encephalomyelitis models aspects of the neurodegenerative process seen in multiple sclerosis. Proc Natl Acad Sci U S A. 116 (45), 22710-22720 (2019).
- Stromnes, I. M., Goverman, J. M. Active induction of experimental allergic encephalomyelitis. Nat Protoc. 1 (4), 1810-1819 (2006).
- Stromnes, I. M., Goverman, J. M. Passive induction of experimental allergic encephalomyelitis. Nat Protoc. 1 (4), 1952-1960 (2006).
- Drohomyrecky, P. C. Peroxisome proliferator-activated receptor-delta acts within peripheral myeloid cells to limit the expansion of myelin-reactive T cells during experimental autoimmune encephalomyelitis (EAE). J. Immunol. 10, 2588-2601 (2019).
- Osorio-Querejeta, I., et al. The innovative animal monitoring device for experimental autoimmune encephalomyelitis ("I am D EAE"): A more detailed evaluation for improved results. Mult Scler Relat Disord. 63, 103836 (2022).
- Wang, C., et al. Induction and diverse assessment indicators of experimental autoimmune encephalomyelitis. J Vis Exp. (187), e63866 (2022).
- Shahi, S. K., Freedman, S. N., Dahl, R. A., Karandikar, N. J., Mangalam, A. K. Scoring disease in an animal model of multiple sclerosis using a novel infrared-based automated activity-monitoring system. Sci Rep. 9, 19194 (2019).
- Kluver, H., Barrera, E. A method for the combined staining of cells and fibers in the nervous system. J Neuropathol Exp Neurol. 12 (4), 400-403 (1953).
- Disanto, G., et al. Serum neurofilament light: A biomarker of neuronal damage in multiple sclerosis. Ann Neurol. 81 (6), 857-870 (2017).
- Novakova, L., et al. Monitoring disease activity in multiple sclerosis using serum neurofilament light protein. Neurology. 89 (22), 2230-2237 (2017).
- Pouzol, L., et al. Act-1004-1239, a first-in-class CXCR7 antagonist with both immunomodulatory and promyelinating effects for the treatment of inflammatory demyelinating diseases. FASEB J. 35 (3), 21431 (2021).
- Breakell, T., et al. Obinutuzumab-induced B-cell depletion reduces spinal cord pathology in a CD20 double transgenic mouse model of multiple sclerosis. Int J Mol Sci. 21 (18), 6864 (2020).
- Aharoni, R., et al. Neuroprotective effect of glatiramer acetate on neurofilament light chain leakage and glutamate excess in an animal model of multiple sclerosis. Int J Mol Sci. 22 (24), 13419 (2021).
- Sternberger, L. A., Sternberger, N. H. Monoclonal antibodies distinguish phosphorylated and nonphosphorylated forms of neurofilaments in situ. Proc Natl Acad Sci U S A. 80 (19), 6126-6130 (1983).
- Kuhle, J., et al. Serum neurofilament is associated with progression of brain atrophy and disability in early MS. Neurology. 88 (9), 826-831 (2017).
- Benkert, P., et al. Serum neurofilament light chain for individual prognostication of disease activity in people with multiple sclerosis: A retrospective modelling and validation study. Lancet Neurol. 21 (3), 246-257 (2022).
- D'Souza, C. A., et al. OGR1/GPR68 modulates the severity of experimental autoimmune encephalomyelitis and regulates nitric oxide production by macrophages. PLoS One. 11 (2), 0148439 (2016).
- Doroshenko, E. R., et al. Peroxisome proliferator-activated receptor-delta deficiency in microglia results in exacerbated axonal injury and tissue loss in experimental autoimmune encephalomyelitis. Front Immunol. 12, 570425 (2021).
- Soulika, A. M., et al. Initiation and progression of axonopathy in experimental autoimmune encephalomyelitis. J Neurosci. 29 (47), 14965-14979 (2009).
- Trapp, B. D., et al. Axonal transection in the lesions of multiple sclerosis. N Engl J Med. 338 (5), 278-285 (1998).
- Lassmann, H., Bradl, M. Multiple sclerosis: Experimental models and reality. Acta Neuropathol. 133 (2), 223-244 (2017).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon