Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Visualisation in vivo de l’activité spontanée dans le cortex sensoriel d’une souris néonatale à une résolution d’un seul neurone
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Les zones sensorielles primaires du néocortex présentent des activités spontanées uniques au cours du développement. Cet article décrit comment visualiser les activités neuronales individuelles et les zones sensorielles primaires pour analyser les activités synchrones spécifiques à une zone chez des souris néonatales in vivo.
Résumé
Le cerveau des mammifères subit des changements de développement dynamiques au niveau cellulaire et des circuits tout au long des périodes prénatales et postnatales. Suite à la découverte de nombreux gènes contribuant à ces changements de développement, on sait maintenant que l’activité neuronale module également considérablement ces processus. Dans le cortex cérébral en développement, les neurones présentent des modèles d’activité synchronisés qui sont spécialisés dans chaque zone sensorielle primaire. Ces modèles diffèrent nettement de ceux observés dans le cortex mature, mettant l’accent sur leur rôle dans la régulation des processus de développement spécifiques à une zone. Les déficiences de l’activité neuronale au cours du développement peuvent entraîner diverses maladies cérébrales. Ces résultats soulignent la nécessité d’examiner les mécanismes régulateurs sous-jacents aux modèles d’activité dans le développement neuronal. Cet article résume une série de protocoles permettant de visualiser les zones sensorielles primaires et l’activité neuronale chez les souris néonatales, d’imager l’activité des neurones individuels dans les sous-champs corticaux à l’aide de la microscopie à deux photons in vivo, et d’analyser les corrélations d’activité liées aux sous-champs. Nous montrons des résultats représentatifs d’une activité synchrone de type patchwork dans des barils individuels du cortex somatosensoriel. Nous discutons également de diverses applications potentielles et de certaines limites de ce protocole.
Introduction
Le cortex cérébral contient plusieurs zones sensorielles avec des fonctions distinctes. Les zones reçoivent des informations provenant de leurs organes sensoriels correspondants, principalement véhiculées par la moelle épinière ou le tronc cérébral et relayées par le thalamus 1,2. Notamment, les neurones de chaque aire sensorielle primaire présentent une activité synchronisée unique au cours des premiers stades de développement, qui proviennent également des organes sensoriels ou des centres nerveux inférieurs, mais diffèrent essentiellement des activités observées dans le cortex mature3.
Chez les rongeurs nouveau-nés, par exemple, l’aire visuelle primaire (V1) présente une activité ondulatoire, qui prend naissance dans la rétine (onde rétinienne) et se propage à travers toute la voie visuelle tout en conservant la rétinotopie4. L’aire auditive primaire (A1) présente une activité synchrone organisée en sous-régions en forme de bande qui correspondent aux bandes d’isofréquence dans le cerveau mature. L’activité émane des cellules ciliées internes de la cochlée 5,6. Le cortex du tonneau dans l’aire somatosensorielle primaire (S1) présente un modèle d’activité semblable à un patchwork dans lequel les neurones de la couche 4 à l’intérieur des barils individuels, à savoir les neurones sensibles aux moustaches individuelles, sont activés de manière synchrone7. Bien qu’il soit proposé qu’il provienne du ganglion trijumeau, la source de l’activité reste inconnue7. Par conséquent, les modèles d’activité néonatale sont spécialisés à la fois dans chaque aire sensorielle primaire et dans les sous-domaines intra-aériens. La visualisation simultanée de l’activité neuronale et de la structure des aires sensorielles primaires peut faciliter l’enquête sur la contribution de ces modèles d’activité au développement des systèmes sensoriels.
Dans cet article, nous avons résumé une série de protocoles : (1) visualiser les activités neuronales individuelles à l’aide d’un marquage clairsemé de GCaMP et d’aires sensorielles primaires à l’aide de souris TCA-RFP qui expriment une protéine fluorescente rouge dans les axones thalamocorticaux7, (2) imager l’activité au niveau d’une seule cellule chez des souris néonatales à l’aide de la microscopie à deux photons in vivo, et (3) d’analyser les corrélations d’activité au sein du cortex du baril S1. Les résultats représentatifs montrent une activité synchronisée semblable à celle d’un patchwork dans des barils individuels d’une souris postnatale du jour (P)6. Malgré certaines limites, cette technique peut être utilisée pour l’imagerie chronique, l’imagerie à grand champ dans plusieurs zones sensorielles et diverses expériences de manipulation. L’analyse multidimensionnelle de l’activité neuronale au cours du développement enrichira notre compréhension des mécanismes de formation des circuits cérébraux.
Access restricted. Please log in or start a trial to view this content.
Protocole
Toutes les expériences ont été menées conformément aux directives pour l’expérimentation animale de l’Université de Kumamoto et de l’Institut national de génétique et approuvées par les comités d’expérimentation animale.
1. Électroporation in utero (IUE)
- Accouplez des souris TCA-RFP mâles de fond ICR avec des souris ICR femelles de type sauvage. Observez le plug vaginal pour vérifier s’il y a un accouplement tôt le matin du lendemain. Observez l’abdomen pour vérifier s’il y a une grossesse 2 semaines plus tard.
- Préparez une solution plasmidique contenant 5 ng/μL de TRE-nCre, 1 μg/μL de CAG-loxP-stop-loxP-GCaMP6s-ires-tTA-WPRE et 0,02 % de bleu trypan dans ddH2O pour marquer les neurones de manière clairsemée par GCaMP à l’aide du système Supernova8.
- Préparez une solution analgésique contenant 0,5 mg/mL de carprofène et 0,01 mg/mL de buprénorphine. Protégez-le de la lumière et conservez-le à température ambiante.
- Au jour embryonnaire (E)14, effectuez l’EIU comme suit. Les méthodes de l’IUE sont essentiellement les mêmes que celles des rapports précédents 9,10,11.
- Essuyez la paillasse du laboratoire avec une solution d’éthanol ou de glutaraldéhyde à 70 %. Stériliser tous les instruments chirurgicaux par autoclavage. Portez un masque et une blouse de laboratoire pour réduire le risque d’infection de la souris.
- Préparez les micropipettes en verre à l’aide d’un extracteur de micropipettes. Prélever la solution de mélange plasmidique dans la micropipette en verre à l’aide d’un tube aspirateur.
- Induire l’anesthésie chez les souris gravides à E14 à l’aide d’isoflurane (2,0 % dans l’air). Gardez les souris anesthésiées pendant la procédure avec de l’isoflurane (1,2% dans l’air). Pincez l’orteil pour vous assurer que l’anesthésie est suffisamment profonde. Utilisez une pommade ophtalmique pour prévenir la sécheresse oculaire.
- Désinfectez la région abdominale au moins trois fois avec une alternance de gommage à base d’iode et d’éthanol à 70 %. Placez un champ stérile pour couvrir la zone chirurgicale. Faites une incision médiane et exposez l’utérus sur le drapé.
- Répétez l’utilisation d’une solution saline chaude sur l’utérus pour éviter qu’il ne se dessèche ou ne se refroidisse jusqu’à la fermeture de l’abdomen (étape 1.4.8).
- Injectez la solution plasmidique dans un côté du ventricule latéral des embryons un par un à l’aide d’une micropipette et d’un tube aspirateur.
- À l’aide d’une électrode de type pince, pincez les têtes de l’embryon et délivrez des impulsions électriques carrées (40 V, 50 ms) cinq fois à 1 s d’intervalle à l’aide d’un électroporateur.
- Remettez l’utérus dans la cavité abdominale. Appliquez ~3 ml de solution saline chaude dans la cavité. Suturez la membrane péritonéale et la peau abdominale. Administrer la solution analgésique à raison de 10 μL/g (carprofène à 5 μg/g et buprénorphine à 0,1 μg/g de poids) sous la peau à l’arrière du cou.
- Placez la souris dans une cage de récupération sur un coussin chauffant (37 °C) pour récupérer de l’anesthésie. Posez la souris sur le ventre pour éviter que sa langue et sa salive n’étouffent la gorge. Gardez la souris à l’écart des autres souris et surveillez-la jusqu’à ce qu’elle récupère pour se déplacer normalement. Remettez la souris dans la cage.
- Après la naissance, effectuez un génotypage pour vérifier la présence de l’allèle RFP et euthanasiez les petits sans l’allèle. Cette étape est recommandée, surtout si l’imagerie est effectuée au cours de la deuxième semaine postnatale lorsque le signal TCA-RFP est faible et difficile à vérifier à l’étape 2.2.7.
2. Chirurgie de la fenêtre crânienne
- Préparez le tampon cortex contenant 125 mM de NaCl, 5 mM de KCl, 10 mM de glucose, 10 mM d’HEPES, 2 mM de CaCl2 et 2 mM de MgSO4 dans ddH2O (pH ajusté à 7,4 avec 1 M de NaOH)12 avant le jour de l’opération. Stérilisez le tampon à l’aide d’un filtre sous vide.
REMARQUE : Le tampon peut être conservé à 4 °C jusqu’à 3 mois. Le volume requis est de 5 à 10 ml par chiot. - Effectuez les opérations suivantes à l’adresse P3-12. Voir également les rapports précédents qui ont décrit cette procédure13,14.
- Mélangez 50 mg d’agarose avec 5 ml de tampon cortex et dissolvez complètement l’agarose en chauffant. Prenez une partie de la solution dans un tube de 1,5 mL et maintenez-la à 42 °C.
- Prenez un peu de tampon de cortex dans un tube conique de 50 ml et conservez-le à température ambiante. Prenez du sérum physiologique dans un contenant (p. ex., le capuchon d’un tube conique de 50 ml) et conservez-le à température ambiante.
- Préparez une solution analgésique contenant 0,01 mg/mL de buprénorphine. Protégez-le de la lumière et conservez-le à température ambiante.
- Stériliser tous les instruments chirurgicaux par autoclavage. Désinfectez le stéréomicroscope à fluorescence avec de l’éthanol à 70 %.
- Utilisez un vaporisateur d’isoflurane pour induire une anesthésie chez le chiot avec de l’isoflurane (2,0 % dans l’air). Faites attention au chiot et sortez-le lorsque sa respiration ralentit légèrement.
REMARQUE : Si l’anesthésie est prolongée, la respiration du chiot peut cesser pendant quelques secondes. Même si la respiration du chiot reprend, une anesthésie prolongée peut diminuer le flux sanguin cérébral du chiot et causer des lésions cérébrales irréversibles. - Désinfectez la tête du chiot au moins trois fois avec une alternance de gommage à base d’iode et d’éthanol à 70 %. Placez le chiot sur le coussin chauffant (35 °C) sous un stéréomicroscope à fluorescence. Gardez toujours le chiot anesthésié avec de l’isoflurane (1,5 % à 2,5 % dans l’air).
- Sélectionnez les petits exprimant TCA-RFP et GCaMP en observant la fluorescence à travers le crâne. Euthanasier les chiots qui n’expriment pas les deux.
- Retirez le cuir chevelu au-dessus des hémisphères cérébraux aussi largement que possible avec précaution afin de ne pas provoquer de saignements. Frottez le crâne avec un coton-tige stérile imbibé de solution saline pour enlever le tissu conjonctif.
- Une fois le crâne sec, collez la surface du cuir chevelu incisée sur le crâne avec un adhésif pour tissu.
- Transférez le chiot sur un coussin chauffant à 37 °C pour récupérer de l’anesthésie. Attendez au moins 15 min pour laisser l’adhésif se solidifier.
REMARQUE : Faites une pause jusqu’à 1 h avant de passer à l’étape suivante. Préparez d’autres chiots de la même manière si nécessaire pendant cette période. - Anesthésez le chiot avec de l’isoflurane. Placez le petit sur le coussin chauffant (37 °C) sous un stéréomicroscope à fluorescence pendant qu’il est anesthésié (1,5 % à 2,5 % d’isoflurane dans l’air).
REMARQUE : Si l’anesthésie dure plus longtemps que le temps jusqu’au point final (60 min), euthanasier le petit par décapitation pendant l’anesthésie avec de l’isoflurane. - Marquez l’emplacement d’expression du GCaMP sur le crâne avec un marqueur permanent stérile. Appliquez un tampon cortex sur l’emplacement.
- Insérez le coin d’une lame de rasoir dans le crâne. Poussez lentement la lame pour raser le crâne et faire un trou. Pincez le crâne fissuré avec une pince à épiler et retirez-le.
- Vérifiez que le trou crânien est bien fait en observant les vaisseaux sanguins dans le trou. En cas de saignement, rincez rapidement le trou avec un tampon cortex à l’aide d’une micropipette. Répétez le rinçage jusqu’à ce que le saignement s’arrête complètement.
- Appliquez une goutte de tampon cortex sur le trou crânien et placez-le dans un verre rond stérile de 3 mm de diamètre sur le trou. Essuyez l’excédent de tampon avec un tissu non tissé. Attendez que la zone autour du verre sèche.
- Appliquez une solution chaude d’agarose autour du bord du verre à l’aide d’une micropipette. Étant donné qu’une trop grande quantité d’agarose peut réduire les signaux fluorescents, retirez l’excès de solution sous le verre en poussant doucement le verre par le haut.
- Retirez l’agarose sur le verre ou à l’écart du bord du verre à l’aide d’une pince à épiler. Ne laissez l’agarose qu’autour du périmètre extérieur du verre.
- Attendez que l’agarose se solidifie. Si le retrait de l’agarose fait un espace sous le verre, ajoutez la solution d’agarose sur le côté pour couvrir tout le bord du verre. Retirez tout liquide de la surface du crâne avec un tissu non tissé.
- Mélangez la poudre de résine acrylique et le liquide dans un récipient en caoutchouc. Aspirez le mélange à l’aide d’une micropipette et versez-le pour couvrir de résine l’agarose entourant le bord du verre.
REMARQUE : Étant donné que la résine se solidifie peu de temps après le mélange de la poudre et du liquide, elles doivent être mélangées à plusieurs reprises avant l’application. Les quantités nécessaires dans chaque mélange sont de ~500 μL pour le liquide et de ~0,15 g pour la poudre. - Fixez une barre de titane avec de la résine sur l’hémisphère controlatéral. Gardez l’angle de la barre parallèle à la vitre de protection. Fixez toute la surface du crâne avec de la résine.
- Administrer la solution analgésique à raison de 10 μL/g (buprénorphine à 0,1 μg/g de poids) sous la peau à l’arrière du cou. Remettez le chiot dans un coussin chauffant à 37 °C pour la récupération de l’anesthésie. Attendre >60 min pour la solidification de la résine avant l’imagerie.
REMARQUE : Faites une pause de 1 à 5 h avant l’imagerie. Effectuez une intervention chirurgicale sur d’autres chiots de la même manière pendant cette période.
3. Imagerie calcique à deux photons
- Fixez un goniomètre à deux axes avec une plaque en titane à une plaque de platine avec positionnement XY sous le microscope. Installez un coussin chauffant (35 °C) sur la scène.
- Allumez le logiciel de numérisation dans les conditions suivantes : Pixels, 512 x 512 ; Bidirectionnel, ON ; Calcul de la moyenne, aucun ; Zone d’imagerie, 600 x 600 μm avec un objectif 20x. Réglez les paramètres de manière à ce que la fréquence de balayage soit supérieure à 1 Hz.
- Placez le chiot sur le coussin chauffant et fixez la barre en titane à la plaque de titane à l’aide de vis. Gardez le petit anesthésié en plaçant un port de tube pour l’isoflurane (1,5-2,0% dans l’air).
- Ajustez l’angle de la fenêtre horizontalement à l’aide du goniomètre. Allumez le rétroéclairage et observez la surface du cerveau avec une lentille d’objectif 5x, puis sélectionnez la zone d’imagerie par positionnement XY.
- Mettez des gouttes oculaires sur la fenêtre crânienne. Passez l’objectif à un objectif à immersion dans l’eau 20x. Observez la surface corticale pour confirmer que le flux sanguin est visible à la surface du cerveau.
- Éteignez le rétroéclairage et scannez la surface du cerveau en utilisant le mode à un photon. Augmentez la puissance du laser pour rendre visible l’autofluorescence verte du verre et de la surface du cerveau.
- Abaissez la concentration d’isoflurane à 1,0 % à 1,5 %. Couvrez le microscope pour éviter les fuites de lumière. Basculez le logiciel de numérisation en mode à deux photons.
- Ajustez la puissance laser et le gain du détecteur en fonction du balayage des signaux GCaMP et RFP. Trouvez la profondeur à laquelle les signaux TCA-RFP sont visibles. Assurez-vous que la profondeur est de la couche 4, ~300 μm plus basse que la surface du cerveau à P6. Sélectionnez la zone d’imagerie où de nombreux neurones exprimant GCaMP sont observés.
- Démarrez l’imagerie timelapse des signaux GCaMP et RFP. Si le balayage simultané à deux canaux n’est pas applicable, capturez des images GCaMP et TCA-RFP avant l’imagerie.
- Arrêtez l’isoflurane pour affaiblir l’anesthésie et observez les activités spontanées pendant ~20 min. Surveillez les mouvements du chiot pendant l’imagerie à l’aide d’une caméra infrarouge. Reprendre immédiatement l’anesthésie à l’isoflurane (2 % dans l’air) si une réponse indiquant une détresse est observée.
- Une fois que le chiot a cessé de bouger, répétez l’imagerie à partir de l’étape 3.9. Modifiez la zone d’imagerie si nécessaire.
- Euthanasiez le chiot avec une surdose d’isoflurane. Fixer le cerveau par perfusion transcardique de solution saline et de PFA à 4%, suivie d’une post-fixation dans un PFA à 4% pendant la nuit pour préparer des coupes tangentielles et effectuer une immunohistochimie. Sinon, euthanasiez le chiot avec une surdose d’anesthésique suivie d’une décapitation.
- Si la mère n’a pas d’autres petits, euthanasiez la souris mère avec une surdose d’anesthésique suivie d’une luxation cervicale.
4. Analyse
- Démarrez MATLAB et exécutez EZcalcium toolbox15 pour ouvrir une interface utilisateur graphique (GUI) « Initial GUI ».
- Compensez les dérives du cadre de l’image dues aux mouvements de la souris ou à d’autres causes.
- Cliquez sur Correction de mouvement dans l’interface graphique initiale pour ouvrir l’interface graphique de correction de mouvement. Cliquez sur 'Ajouter des fichiers...' pour charger un fichier TIF des données d’imagerie.
- Réglez les paramètres comme suit : Correction de mouvement non rigide, vierge ; facteur de suréchantillonnage, 50 ; Quart de travail maximum, 15 ; taille initiale du lot, 200 ; Largeur du bac, 200. Cliquez sur « Exécuter la correction de mouvement » pour exécuter la correction. Les données d’imagerie corrigées en mouvement seront enregistrées automatiquement.
REMARQUE : Les paramètres doivent être ajustés aux propriétés des données d’imagerie. Si les dérives de certaines images ne sont pas compensées en raison de distorsions d’image non linéaires ou d’un mouvement du cortex dans le sens de la profondeur, ouvrez les données d’imagerie d’origine sans correction dans ImageJ Fiji et supprimez les images, puis redémarrez l’étape 4.2.
- Détectez les neurones et dessinez des régions d’intérêt (ROI).
- Cliquez sur Détection automatique du retour sur investissement dans l’interface graphique initiale pour ouvrir l’interface graphique de détection du retour sur investissement. Cliquez sur Ajouter des fichiers... pour charger les données d’imagerie corrigées de mouvement.
- Définissez les paramètres comme suit : Initialisation, Gourmand ; méthode de recherche, ellipse ; Déconvolution, FOOPSI-SPGL1 sous contrainte ; Autorégression, décroissance ; # estimé de retours sur investissement, 60 (plus du double du nombre détecté visuellement est recommandé) ; Largeur estimée du retour sur investissement, 17 (~20 μm) ; Seuil de fusion, 0,95 ; facteur de fudge, 0,95 ; sous-échantillonnage spatial, 1 ; Sous-échantillonnage temporaire, 1 ; Itérations temporaires, 5.
REMARQUE : Les paramètres doivent être ajustés aux propriétés des données d’imagerie. - Cliquez sur Exécuter la détection du retour sur investissement pour exécuter la détection. Les données de retour sur investissement seront enregistrées automatiquement.
- Cliquez sur Raffinement de la ROI dans l’interface graphique initiale pour ouvrir l’interface graphique d’affinement de la ROI. Cliquez sur Charger les données pour charger les données de retour sur investissement. Sélectionnez les zones d’intérêt qui avaient une faible fréquence d’activité (<1 Hz), situées sous le crâne ou qui contenaient des neurites d’autres neurones. Cliquez sur Exclure le retour sur investissement pour exclure les retours sur investissement de l’analyse.
- Sélectionnez le format d’exportation de données au format XLSX et cliquez sur Exporter les données pour obtenir un fichier Excel avec des valeurs brutes dF/F. Le dF/F utilise l’équation (1), où F est l’intensité moyenne des pixels dans chaque image, F0 est l’intensité du signal de base et Fb est la fluorescence d’arrière-plan.
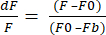 (1)
(1)
- Calculez le coefficient de corrélation de Pearson de dF/F entre les ROI et créez une matrice de coefficient de corrélation. N’utilisez dF/F qu’après que l’anesthésie s’est affaiblie et que l’activité spontanée a commencé à se produire (~10 minutes après l’arrêt de l’isoflurane).
- Définissez les bords du canon à partir de l’image TCA-RFP à l’aide de Fidji. Catégorisez les zones d’intérêt en fonction de leurs fûts ou septa respectifs. Comparez la corrélation par paires au sein d’un même baril et celle entre différents barils.
- Générez 1 000 à 10 000 données de substitution en mélangeant de manière aléatoire la correspondance entre le ROI et les traces Ca2+ . Calculez le coefficient de corrélation moyen à l’intérieur des barils individuels dans chaque donnée de substitution et évaluez la signification statistique de la corrélation dans les données réelles.
REMARQUE : Si l’un des 10 000 substituts a une valeur supérieure à la valeur réelle, la signification statistique est de 0,0001. Les analyses décrites aux étapes 4.5 et 4.6 peuvent être effectuées pour des données regroupées provenant de plusieurs animaux, comme cela a été fait ailleurs 7,16.
Access restricted. Please log in or start a trial to view this content.
Résultats
La figure 1 montre les résultats représentatifs des activités neuronales de la couche 4 dans le cortex cylindrique d’un chiot P6 visualisé à l’aide du protocole actuel. La moyenne temporelle des images à deux photons du canal vert (GCaMP) et du canal rouge (TCA-RFP) a été calculée en moyenne temporelle et illustrée à la figure 1A. Étant donné que la fluorescence TCA-RFP était beaucoup plus faible que la fluores...
Access restricted. Please log in or start a trial to view this content.
Discussion
Étant donné que les activités spontanées émergent de l’organe sensoriel ou du système nerveux inférieur et se déplacent vers l’aire sensorielle primaire par une voie équivalente à celle d’un système nerveux mature3, il est crucial de définir l’aire sensorielle primaire et l’emplacement des neurones imagés dans la zone. Dans ce protocole, nous avons répondu à cette exigence en utilisant des souris transgéniques qui visualisent les axones t...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Les auteurs n’ont aucun intérêt financier concurrent à déclarer.
Remerciements
Ce travail a été soutenu par la Société japonaise pour la promotion des subventions scientifiques pour les domaines de recherche transformatrices (B) (22H05092, 22H05094) et pour les subventions de recherche scientifique 20K06876, AMED sous le numéro de subvention 21wm0525015, la Takeda Science Foundation, la Naito Foundation, la Kato Memorial Bioscience Foundation, la Kowa Life Science Foundation, NIG-JOINT (24A2021) (à H.M.) ; et la Société japonaise pour la promotion de la science (subventions 19K06887 et 22K06446), le Fonds commémoratif Kodama pour la recherche médicale, la Fondation commémorative Uehara, la Fondation Kato Memorial Bioscience et la Fondation scientifique Takeda (à N.N-T.). Nous remercions le Dr Takuji Iwasato pour les souris TCA-RFP.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| 20× objective lens (water immersion) | |||
| 250 mL Vacuum Filter/Storage Bottle System | Corning | 431096 | |
| 4%-paraformaldehyde phosphate buffer solution (4% PFA) | Nacalai | 09154-85 | |
| Acrylic resin (UNIFAST II) | GC | N/A | |
| Agarose | Sigma | A9793 | |
| Aspirator tube assembly | Drummond | 2-040-000 | |
| CaCl2•2H2O | Nacalai | 06731-05 | |
| Electroporator | BEX | GEB14 | |
| Eye drop (Scopisol) | Senju Pharmaceutical | N/A | |
| Fluorescence stereo microscope | Leica | M165FC | |
| Glucose | Nacalai | 16806-25 | |
| Heating pad | Muromachi Kikai | FHC-HPS | |
| HEPES | Gibco | 15630-080 | |
| Isoflurane | Pfizer | N/A | |
| KCl | Nacalai | 28514-75 | |
| MgSO4•7H2O | Wako | 131-00405 | |
| Micropipette puller | Narishige | PC-100 | |
| Multiphoton laser | Spectra-Physics | Mai Tai eHP DeepSee | |
| Multiphoton microscope | Zeiss | LSM 7MP | |
| NaCl | Nacalai | 31320-05 | |
| Non-woven fabric (Kimwipe) | Kimberly Clark | S-200 | |
| Phosphate buffered saline (PBS) | Nacalai | 27575-31 | |
| Plasmid: CAG-loxP-STOP-loxP-GCaMP6s-ires-tTA-WPRE | Addgene | pK175 | |
| Plasmid: TRE-nCre | Addgene | pK031 | |
| Precision calibrated micropipets | Drummond | 2-000-050 | |
| Razor blade | Feather | FA-10 | |
| Rimadyl (50 mg/mL Carprofen) | Zoetis JP | N/A | |
| Round cover glass, 3-mm-diameter | Matsunami | CS01078 | |
| Saline | Otsuka | 035175315 | |
| Sodium pentobarbital | Nacalai | 26427-72 | |
| Stage for imaging living pup (two single-axis translation stage for XY positioning, two-axis goniometer, base plate, adjustable pillar for z positioning) | ThorLabs | LT1/M, GN2/M, BM2060/M, MLP01/M | |
| TCA-RFP mouse | N/A | N/A | Mizuno et al., 2018a |
| Tissue adhesive (Vetbond) | 3M | 1469SB | |
| Titanium bar | Endo Scientific Instrument | N/A | Custom made (Mizuno et al., 2018b) |
| Titanium bar fixing plate | N/A | Custom made (Mizuno et al., 2018b) | |
| Trypan blue | Sigma | T8154 | |
| Tweezers with platinum plate electrode, 5 mm diameter | BEX | CUY650P5 | |
| Wild-type ICR mouse | Nihon SLC | Slc:ICR |
Références
- Rao, M. S., Mizuno, H. Elucidating mechanisms of neuronal circuit formation in layer 4 of the somatosensory cortex via intravital imaging. Neuroscience Research. 167, 47-53 (2021).
- Iwasato, T., Erzurumlu, R. S. Development of tactile sensory circuits in the CNS. Current Opinion in Neurobiology. 53, 66-75 (2018).
- Martini, F. J., Guillamón-Vivancos, T., Moreno-Juan, V., Valdeolmillos, M., López-Bendito, G. Spontaneous activity in developing thalamic and cortical sensory networks. Neuron. 109 (16), 2519-2534 (2021).
- Ackman, J. B., Burbridge, T. J., Crair, M. C. Retinal waves coordinate patterned activity throughout the developing visual system. Nature. 490 (7419), 219-225 (2012).
- Tritsch, N. X., Yi, E., Gale, J. E., Glowatzki, E., Bergles, D. E. The origin of spontaneous activity in the developing auditory system. Nature. 450 (7166), 50-55 (2007).
- Babola, T. A., et al. Homeostatic control of spontaneous activity in the developing auditory system. Neuron. 99 (3), 511-524.e5 (2018).
- Mizuno, H., et al. Patchwork-type spontaneous activity in neonatal barrel cortex layer 4 transmitted via thalamocortical projections. Cell Reports. 22 (1), 123-135 (2018).
- Mizuno, H., et al. NMDAR-regulated dynamics of layer 4 neuronal dendrites during thalamocortical reorganization in neonates. Neuron. 82 (2), 365-379 (2014).
- Tabata, H., Nakajima, K. Efficient in utero gene transfer system to the developing mouse brain using electroporation: visualization of neuronal migration in the developing cortex. Neuroscience. 103 (4), 865-872 (2001).
- Fukuchi-Shimogori, T., Grove, E. A. Neocortex patterning by the secreted signaling molecule FGF8. Science. 294 (5544), 1071-1074 (2001).
- Saito, T., Nakatsuji, N. Efficient gene transfer into the embryonic mouse brain using in vivo electroporation. Developmental Biology. 240 (1), 237-246 (2001).
- Holtmaat, A., et al. Long-term, high-resolution imaging in the mouse neocortex through a chronic cranial window. Nature Protocols. 4 (8), 1128-1144 (2009).
- Mizuno, H., Nakazawa, S., Iwasato, T. In vivo two-photon imaging of cortical neurons in neonatal mice. Journal of Visualized Experiments. 140, e58340(2018).
- Egashira, T., et al. In vivo two-photon calcium imaging of cortical neurons in neonatal mice. STAR Protocols. 4 (2), 102245(2023).
- Cantu, D. A., et al. EZcalcium: Open-source toolbox for analysis of calcium imaging data. Frontiers in Neural Circuits. 14, 25(2020).
- Maruoka, H., et al. Lattice system of functionally distinct cell types in the neocortex. Science. 358 (6363), 610-615 (2017).
- Antón-Bolaños, N., et al. Prenatal activity from thalamic neurons governs the emergence of functional cortical maps in mice. Science. 364 (6444), 987-990 (2019).
- Guillamón-Vivancos, T., et al. Input-dependent segregation of visual and somatosensory circuits in the mouse superior colliculus. Science. 377 (6608), 845-850 (2022).
- Cardin, J. A., Crair, M. C., Higley, M. J. Mesoscopic imaging: Shining a wide light on large-scale neural dynamics. Neuron. 108 (1), 33-43 (2020).
- Chen, J. L., Voigt, F. F., Javadzadeh, M., Krueppel, R., Helmchen, F. Long-range population dynamics of anatomically defined neocortical networks. eLife. 5, e14679(2016).
- Ota, K., et al. cell-resolution, contiguous-wide two-photon imaging to reveal functional network architectures across multi-modal cortical areas. Neuron. 109 (11), 1810-1824 (2021).
- Zariwala, H. A., et al. A Cre-dependent GCaMP3 reporter mouse for neuronal imaging in vivo. The Journal of Neuroscience. 32 (9), 3131-3141 (2012).
- Murakami, T., Matsui, T., Uemura, M., Ohki, K. Modular strategy for development of the hierarchical visual network in mice. Nature. 608 (7923), 578-585 (2022).
- Pnevmatikakis, E. A., et al. Simultaneous denoising, deconvolution, and demixing of Calcium imaging data. Neuron. 89 (2), 285-299 (2016).
- Shemesh, O. A., et al. Precision calcium imaging of dense neural populations via a cell-body-targeted calcium indicator. Neuron. 107 (3), 470-486 (2020).
- Giovannucci, A., et al. CaImAn an open source tool for scalable calcium imaging data analysis. Elife. 8, e38173(2019).
- Pachitariu, M., et al. Suite2p: beyond 10,000 neurons with standard two-photon microscopy. BioRxiv. , (2017).
- Sitdikova, G., et al. Isoflurane suppresses early cortical activity. Annals of Clinical and Translational Neurology. 1 (1), 15-26 (2014).
- Marques-Smith, A., et al. A Transient translaminar GABAergic interneuron circuit connects thalamocortical recipient layers in neonatal somatosensory cortex. Neuron. 89 (3), 536-549 (2016).
- Tuncdemir, S. N., et al. Early somatostatin interneuron connectivity mediates the maturation of deep layer cortical circuits. Neuron. 89 (3), 521-535 (2016).
- Nakazawa, S., Yoshimura, Y., Takagi, M., Mizuno, H., Iwasato, T. Developmental phase transitions in spatial organization of spontaneous activity in postnatal barrel cortex layer 4. The Journal of Neuroscience. 40 (40), 7637-7650 (2020).
- Yu, Y. -C., et al. Preferential electrical coupling regulates neocortical lineage-dependent microcircuit assembly. Nature. 486 (7401), 113-117 (2012).
- Siegel, F., Heimel, J. A., Peters, J., Lohmann, C. Peripheral and central inputs shape network dynamics in the developing visual cortex in vivo. Current Biology. 22 (3), 253-258 (2012).
- Nakagawa, N., Hosoya, T. Slow dynamics in microcolumnar gap junction network of developing neocortical pyramidal neurons. Neuroscience. 406, 554-554 (2019).
- Valiullina, F., et al. Developmental changes in electrophysiological properties and a transition from electrical to chemical coupling between excitatory layer 4 neurons in the rat barrel cortex. Frontiers in Neural Circuits. 10, 1(2016).
- Avitan, L., et al. Spontaneous and evoked activity patterns diverge over development. Elife. 10, e61942(2021).
- Mölter, J., Avitan, L., Goodhill, G. J. Detecting neural assemblies in calcium imaging data. BMC Biology. 16 (1), 143(2018).
- Nakazawa, S., Mizuno, H., Iwasato, T. Differential dynamics of cortical neuron dendritic trees revealed by long-term in vivo imaging in neonates. Nature Communications. 9 (1), 3106(2018).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon