Cristallisation et collecte in situ de données à température ambiante à l’aide de l’installation de cristallisation de Harwell et de la ligne de faisceau VMXi, source de lumière au diamant
Dans cet article
Résumé
Nous présentons un protocole pour la cristallisation des protéines à l’aide de l’installation de cristallisation du complexe de recherche à Harwell et la collecte ultérieure de données cristallographiques aux rayons X in situ à partir de cristaux à l’intérieur des plaques sur la ligne de faisceau VMXi (Versatile Macromolecular Crystallography in situ ) de Diamond. Nous décrivons les exigences en matière d’échantillons, les protocoles de cristallisation et les directives de collecte de données.
Résumé
Les protocoles de cristallisation robotisée des protéines à l’aide de l’installation de cristallisation de Harwell et de collecte de données in situ à température ambiante à partir de plaques de cristallisation à la ligne de lumière VMXi de la source de lumière Diamond sont décrits. Cette approche permet de déterminer facilement des structures cristallines de haute qualité à température ambiante à partir de plusieurs cristaux et fournit un retour d’information très rapide sur les résultats des essais de cristallisation ainsi que la cristallographie en série. La valeur des structures à température ambiante dans la compréhension de la structure des protéines, de la liaison au ligand et de la dynamique est de plus en plus reconnue dans la communauté de la biologie structurale. Ce pipeline est accessible aux utilisateurs du monde entier avec plusieurs modes d’accès disponibles. Les expériences de cristallisation mises en place peuvent être imagées et visualisées à distance avec des cristaux identifiés automatiquement à l’aide d’un outil d’apprentissage automatique. Les données sont mesurées dans un système basé sur une file d’attente avec des ensembles de données de rotation allant jusqu’à 60° à partir de cristaux sélectionnés par l’utilisateur dans une plaque. Les données de tous les cristaux d’un puits ou d’un groupe d’échantillons particuliers sont automatiquement fusionnées à l’aide de xia2.multiplex, les sorties étant facilement accessibles via une interface de navigateur Web.
Introduction
La cristallographie aux rayons X reste un outil clé pour comprendre la structure et la fonction des protéines, en fournissant des structures à haute résolution des protéines ou de leurs complexes avec, par exemple, des substrats ou des candidats médicaments. Dans de nombreux cas, cependant, l’obtention de cristaux aux propriétés souhaitables - très diffractants, forme cristalline susceptible d’être trempée et sans pathologies cristallines telles que le jumelage - reste un goulot d’étranglement considérable1. Comme les conditions chimiques appropriées pour produire des cristaux de protéines ne peuvent généralement pas être prédites, le criblage de cristallisation explorant des milliers de mélanges chimiques potentiels est standard, souvent aidé par l’automatisation/la robotique dans la mise en place d’écrans et d’hôtels à cristaux pour la surveillance, souvent à distance, des images de gouttes de cristallisation qui sont enregistrées.
Lorsque des cristaux apparaissent, ils doivent généralement être récoltés dans l’environnement de cristallisation à l’aide d’une boucle en nylon ou en Kapton, puis transférés dans une gouttelette contenant un agent de cryoprotection (dont la recherche est une variable supplémentaire) avant d’être plongés dans l’azote liquide. Ces étapes supplémentaires entre la cristallisation et la collecte de données radiographiques peuvent impliquer, entre autres facteurs, la déshydratation de la goutte de cristallisation lorsque son environnement scellé est rompu, des contraintes mécaniques sur le cristal lorsqu’il est manipulé et des dommages causés par les agents de cryoprotection au réseau cristallin (entraînant généralement une augmentation de la propagation de la mosaïque)2. De plus, la récolte des cristaux demande beaucoup de temps et de main-d’œuvre et peut entraîner une inhomogénéité entre les échantillons, en particulier lorsque la peau se forme sur les gouttes pendant le processus de récolte. La ligne de lumière VMXi donne accès à des données utilisables à partir de cristaux collés à la plaque, qui seraient autrement rejetées pour la collecte de données.
La grande majorité des structures cristallines des rayons X sont déterminées à 100K à l’aide de l’approche ci-dessus, ce qui permet un transport et une manipulation simples des cristaux et augmente la durée de vie des cristaux dans le faisceau de rayons X de plusieurs ordres de grandeur. Cependant, on s’intéresse de plus en plus à la détermination des structures dans des conditions non cryogéniques, c’est-à-dire beaucoup plus proches des conditions physiologiques pertinentes pour la fonction protéique 2,3,4. Cela permet une bien meilleure appréciation de la structure dynamique des protéines, évite que les conformations ou les boucles d’acides aminés ne soient gelées dans des états fonctionnellement non pertinents5, et permet d’explorer la liaison au ligand dans des conditions beaucoup plus proches de celles de l’environnement naturel de la protéine au sein de la cellule et de l’organisme6.
Une autre approche, mise en œuvre sur la ligne de lumière VMXi (Versatile Macromolecular Crystallography in situ) du synchrotron Diamond Light Source, au Royaume-Uni, consiste à mesurer les données de diffraction directement à partir des cristaux dans l’environnement dans lequel ils se sont développés (c’est-à-dire à l’intérieur de la plaque de cristallisation), dans des conditions ambiantes et sans perturbation 7,8. Cela permet un retour d’information très rapide à partir des écrans de cristallisation et des optimisations pour guider un utilisateur vers une forme cristalline optimale pour ses besoins. Il permet également de produire de manière automatisée des structures à température ambiante de haute qualité9.
Ce protocole suppose qu’un utilisateur dispose d’un échantillon de protéine très pur prêt pour la cristallisation. Nous décrivons l’expérience de l’utilisateur accédant à l’installation de cristallisation de Harwell pour produire des cristaux de protéines, puis utiliser la ligne de lumière VMXi pour la collecte de données (Figure 1).
L’installation de cristallisation à Harwell
L’installation de cristallisation de Harwell (CF) est située dans le complexe de recherche de Harwell (RCaH) adjacent à la source de lumière Diamond. L’installation offre aux utilisateurs un laboratoire automatisé à haut débit pour la cristallisation macromoléculaire, utilisant la robotique pour le criblage de cristallisation, l’optimisation des cristaux, l’imagerie cristalline et la caractérisation. Grâce à une intégration étroite avec la ligne de lumière VMXi hautement automatisée, le rythme de détermination des structures à température ambiante s’est considérablement accéléré et permet la caractérisation de nouvelles structures protéiques, de complexes protéine-ligand et ADN-ligand, ainsi que le criblage automatisé de fragments (Figure 1), le tout dans des conditions non cryogéniques.
Le pipeline CF est constitué d’une suite d’instruments comprenant des robots de cristallisation nanolitres9 pour la cristallisation de protéines solubles et membranaires, des robots de manipulation de liquides pour préparer des cribles de cristallisation commerciaux et des cribles d’optimisation personnalisés complexes, et quatre instruments d’imagerie (un à 4 °C et trois à 20 °C pour l’imagerie des plaques de cristallisation (voir le tableau des matériaux). Un imageur est capable d’imager des plaques de verre en phase cubique lipidique (LCP) et un imageur est équipé d’optiques multi-fluorescence (toutes deux à 20 °C).
L’installation est maintenant largement utilisée par un large éventail d’utilisateurs universitaires et industriels, y compris le Laboratoire des protéines membranaires (MPL ; https://www.diamond.ac.uk/Instruments/Mx/MPL.html), l’installation de criblage de fragments XChem 10, les lignes de lumière MX, le hub XFEL, ainsi que l’Institut Rosalind Franklin (RFI). Ce pipeline bien établi et optimisé a permis de réaliser des expériences de cristallisation dans un large éventail de projets de biologie structurale. Cet article décrit le pipeline de cristaux destinés à la collecte de données à VMXi, bien que les cristaux puissent également être récoltés et refroidis cryogéniquement ou dirigés vers le pipeline XChem.
L’accès des utilisateurs est attribué par le biais du système de proposition Diamond MX (https://www.diamond.ac.uk/Instruments/Mx/Synchrotron-Access.html) et les utilisateurs industriels sont pris en charge par le groupe de liaison avec l’industrie du diamant. Tous les utilisateurs peuvent venir sur le site avec leur(s) échantillon(s) ou leur(s) plaque(s), qui peuvent être transportés à la main. Il n’est pas recommandé d’envoyer les plaques par coursier car notre expérience suggère que les gouttes peuvent s’éloigner de l’endroit où elles ont été distribuées, ou que les gouttes peuvent être endommagées par le réservoir de cristallisation. Alternativement, sur rendez-vous, les utilisateurs peuvent envoyer leurs échantillons de protéines aux FC, où les membres du personnel organisent des expériences de cristallisation en leur nom. Les expériences peuvent être surveillées à distance par l’utilisateur en se connectant à Rock Maker Web dans le cas de CF ou via ISPyB dans le cas de VMXi. L’accès au CF peut se faire de manière itérative sur la base des résultats de diffraction des rayons X recueillis à Diamond.
Ligne de faisceau VMXi à la source de lumière Diamond
La ligne de faisceau VMXi (ci-après dénommée « la ligne de faisceau ») est un instrument unique et récemment développé entièrement dédié à la cristallographie aux rayons X à température ambiante et hautement automatisée, en mettant l’accent sur la mesure des données des cristaux dans des plaques de cristallisation appropriées. La ligne de lumière offre un micro foyer (10 x 10 μm), un faisceau rose (passe-bandede <5 × 10-2 ΔE/E) avec un flux élevé de ~2 ×10 13 photons/s (à 16 KeV)7. Ce faisceau à haut flux, couplé à un détecteur rapide, permet un débit très élevé d’échantillons et la collecte de données à partir d’échantillons d’une taille supérieure à 10 μm.
Les plaques de cristallisation entrent dans la ligne de faisceau en étant stockées dans un système de stockage d’échantillons et imagées en fonction du calendrier fourni par l’utilisateur lors de l’enregistrement des plaques à l’aide de l’interface ISPyB11 SynchWeb12. En règle générale, il est conseillé aux utilisateurs de sélectionner une séquence de Fibonacci de points temporels pour l’imagerie (0, 12, 24, 36, 60... 7 320 h à partir de l’entrée de la plaque dans le système). L’utilisateur est informé par email dès qu’une plaque a été imagée. L’imagerie en lumière visible et en lumière UV est disponible pour les utilisateurs sur demande. Les images prises par le système de stockage d’échantillons sont analysées par un algorithme d’apprentissage automatique ; Cela permet de localiser et de définir automatiquement les points d’intérêt des objets qui ressemblent à des cristaux et d’enregistrer les points d’intérêt prêts à être ajoutés par l’utilisateur à une file d’attente pour la collecte de données. Les utilisateurs peuvent également cliquer manuellement sur les images de lumière visible pour enregistrer des points d’intérêt ou cliquer et faire glisser une région à analyser par balayage matriciel. Ces points sont disponibles pour les utilisateurs qui peuvent les ajouter à la file d’attente en même temps que les points localisés automatiquement.
Une fois que tous les échantillons ont des paramètres appropriés pour la collecte des données, la plaque entre dans une file d’attente. Lorsque la plaque atteint le haut de la file d’attente, elle est automatiquement distribuée à la ligne de faisceau. Les plaques de cristallisation sont chargées automatiquement à partir des hôtels de cristal dans la ligne de faisceau par un bras robotisé, et après l’appariement des images, des ensembles de données cristallographiques d’une rotation allant jusqu’à 60° sont mesurés à partir de chaque cristal sélectionné selon les instructions définies par l’utilisateur. Toutes les gouttes à l’intérieur d’une plaque peuvent être utilisées pour ces expériences sur la ligne de faisceau. Les données sont fusionnées à partir de plusieurs cristaux pour produire de manière automatisée des ensembles de données isomorphes et fusionnés de manière optimale 7,9. Une fois que tous les ensembles de données en file d’attente sont collectés, l’utilisateur reçoit un e-mail contenant un lien à suivre pour afficher les ensembles de données dans ISPyB11, comme dans les autres lignes de faisceaux Diamond MX. Les utilisateurs sont également dirigés vers la page Web de la ligne de faisceau (https://www.diamond.ac.uk/Instruments/Mx/VMXi.html).
Protocole
1. Production de cristaux à l’intérieur de plaques in situ à l’aide de l’installation de cristallisation de Harwell
NOTA : L’accès au FC est pris en charge par un certain nombre de voies différentes et dépend de l’application du projet et du type d’utilisateur (universitaire ou industriel). Les projets XChem et MPL disposent de leur propre système de demande de proposition via le système d’administration des utilisateurs (UAS) et peuvent être soumis soit par la voie d’accès standard (y compris iNEXT Discovery et EUbOPEN), soit par l’accès BAG. Le protocole ci-dessous est spécifique aux utilisateurs de VMXi.
- Soumission des propositions et préparation de la visite
- Fournissez des informations sur le projet à une demande de proposition BAG ou ajoutez-les à une proposition BAG active. Il y a généralement un coordinateur BAG, qui organise les formalités administratives. Vous pouvez également soumettre une proposition d’accès rapide pour accéder à la ligne de faisceau.
- S’assurer que l’échantillon a été enregistré et que la sécurité a été validée dans UAS sur une proposition avant l’arrivée sur place, soit par messagerie, soit en personne.
- Assurez-vous que l’utilisateur est enregistré (avec FedID et mot de passe).
- Assurez-vous que l’utilisateur a été ajouté à une proposition MX en tant qu’associé dans UAS par le coordinateur BAG.
- Remplissez le formulaire de détails de l’échantillon de cristallisation de la ligne de lumière et envoyez-le à VMXi@diamond.ac.uk.
- Communiquer avec le personnel de la ligne de faisceau au sujet des exigences de l’expérience et de la disponibilité de la ligne de faisceau.
- Si des échantillons de protéines sont expédiés, n’envoyez les échantillons que sur rendez-vous. Reportez-vous à la section 1.2 pour plus de détails.
- Si l’utilisateur doit se rendre sur le site pour installer des plaques de cristallisation dans le CF, vérifier auprès du personnel de l’installation la disponibilité d’un créneau horaire pour utiliser l’instrumentation de l’installation et suivre la section 1.2.1.
- Si l’utilisateur apporte des plaques sur le site, assurez-vous que l’échantillon est distribué dans le bon type de plaque et placez les gouttes de cristallisation au bon endroit et en bonne quantité. Suivre la section 1.2.2. La ligne de lumière n’accepte que des plaques de cristallisation in situ spécifiques (Greiner, CrystalQuickX et MiTeGen In Situ-1) ; s’assurer que les gouttes ne dépassent pas 200 nL.
- Expérience de cristallisation menée dans la mucoviscidose
REMARQUE : L’installation offre un certain nombre de méthodes de cristallisation macromoléculaire à haut débit telles que la diffusion de vapeur ainsi que la cristallisation par lots sous huile et LCP. Il est recommandé de commencer avec 70 à 100 μL de protéines pures et d’effectuer des expériences de diffusion de vapeur pour les protéines solubles avec trois cribles en utilisant un rapport de 100 nL de solution protéique et 100 nL de solution de réservoir de cristallisation et en incubant les plaques à 20 °C. Un certain nombre d’écrans commerciaux sont disponibles dans l’établissement. Le contrôle de l’humidité et de la température est disponible avec 4 °C et 20 °C les plus utilisés. Les utilisateurs qui visitent les FC reçoivent une formation et un soutien normalisés pour l’utilisation de l’instrument de cristallisation et utiliseront les paramètres décrits dans le présent document.- Envoi d’échantillons pour l’installation aux FC
REMARQUE : Avant l’arrivée sur place, l’échantillon de protéines doit avoir été validé sur une proposition dans le système UAS. Une fois que l’échantillon de protéine est arrivé sur place, les membres du personnel mettront en place des expériences de cristallisation comme indiqué dans les communications précédentes avec l’utilisateur. Une confirmation sera envoyée par e-mail avec les informations du code-barres pour les plaques de cristallisation expérimentales. Il sera demandé à l’utilisateur d’ajouter les plaques de cristallisation en tant que conteneurs à la proposition correspondante. Une fois que cela a été fait, les plaques peuvent être stockées dans des imageurs automatisés dans l’installation de cristallisation ou sur la ligne de faisceau. ISPyB sera l’interface utilisée pour l’interaction au niveau de la ligne de faisceau.- Fournir la solution d’échantillon de protéine à la concentration pour la cristallisation en multiples de 25 μL d’aliquotes. Étiquetez clairement les tubes d’échantillon contenant l’échantillon de protéines.
- Si nécessaire, fournir une solution tampon de protéines, une solution de ligand ou une solution de réservoir.
- Informez le personnel de l’établissement des écrans et des taux de chute à utiliser.
- Réglages de la plaque de cristallisation
REMARQUE : Nous exigeons que les gouttes de cristallisation dans la plaque Greiner CrystalQuickX et MiTeGen In Situ-1 soient dans un endroit particulier ; Les plaques installées ailleurs doivent utiliser les paramètres Mosquito13 suivants décrits ici.- Pour ajuster la définition de la plaque pour MiTeGen In Situ-1, ouvrez le logiciel Mosquito SPT et cliquez sur la page de définition de la plaque MiTeGen In Situ-1 standard en cliquant sur Setup | 96 Well | MiTeGen In Situ-1 (96 x 2 gouttes) (Figure 2A). Cliquez sur le bouton d’édition et modifiez les valeurs de l’emplacement du sous-puits 2 : Décalage X à - 1,2 et Décalage Y à 1,8 et pour l’emplacement du sous-puits 3 : Décalage X à 1,3 et Décalage Y à 1,8 (Figure 2B,C).
- Pour ajuster la définition de la plaque pour Greiner CrystalQuickX, ouvrez le logiciel Mosquito SPT et cliquez sur la page de définition de la plaque Greiner CrystalQuickX standard en cliquant sur Configuration | 96 puits | Greiner CrystalQuickX (Figure 2D). Cliquez sur le bouton d’édition et modifiez les valeurs de l’emplacement du sous-puits 1 : Décalage X à - 1,95 et Décalage Y à 1,45 et pour l’emplacement du puits secondaire 2 : Décalage X à 1,95 et Décalage Y à 1,45 (Figure 2E,F).
- Envoi d’échantillons pour l’installation aux FC
2. Utilisation de la ligne de faisceau à la source de lumière Diamond
REMARQUE : Toutes les interactions avec la ligne de faisceau par les utilisateurs sont effectuées à distance à l’aide de l’interface ISPyB11 . Aucune présence physique à la ligne de faisceau n’est requise et les données sont collectées à l’aide d’un système basé sur des files d’attente plutôt que d’être programmées à un moment donné. Les utilisateurs auront une proposition associée à leur accès à la Source de lumière Diamant. Au niveau de la ligne de faisceau, chaque plaque de cristallisation se voit attribuer une visite unique et est définie comme un « conteneur » dans ISPyB11 , analogue à une rondelle contenant des échantillons à 100 K. Les écrans d’optimisation ne peuvent pas être créés à l’aide de l’interface SynchWeb et, par conséquent, les informations sont généralement ajoutées dans la section des commentaires (voir l’étape 2.1.4.). La personne qui enregistre la plaque devra vérifier l’adresse e-mail, car le propriétaire de la plaque recevra des e-mails concernant l’imagerie ainsi que des notifications de plaque terminée.
- Plaques d’immatriculation
- Connectez-vous à ISPyB à l’aide d’un identifiant FedID Diamond approprié et sélectionnez Propositions. Recherchez la proposition qui vous intéresse en faisant défiler ou en tapant le numéro de la proposition dans la barre de recherche. Sélectionnez Expédition dans le menu déroulant sous le numéro de la proposition (Figure 3A), ce qui ouvrira la fenêtre Expéditions avec les expéditions de cette proposition. Cliquez sur +Ajouter un envoi en haut à droite (Figure 3B) pour ouvrir la fenêtre Ajouter un nouvel envoi , donnez un nom à l’envoi, cliquez sur Automatisé/Imageur, puis cliquez sur le bouton Ajouter un envoi en bas à gauche (Figure 3C).
- Dans la fenêtre d’expédition (Figure 3D), cliquez sur +Ajouter un conteneur, ce qui affichera alors la vue de la page Ajouter un conteneur (Figure 3E). Choisissez dans le menu déroulant Type de conteneur l’un des types de plaques appropriés. La page changera pour refléter le type de conteneur qui a été choisi. Entrez un code-barres et un nom de conteneur conformément aux instructions par e-mail du personnel de la ligne de faisceau spécifiques aux plaques expérimentales. Notez qu’il est sensible à la casse.
- Sélectionnez l’imageur VMXi 20 °C dans le menu déroulant Requested Imager (Imageur demandé ), la planification de l’imagerie de Fibonacci dans le menu déroulant Imaging Schedule (Programme d’imagerie ), l’écran de cristallisation dans le menu déroulant Crystallization Screen (Écran de cristallisation ) et le nom d’utilisateur dans le menu déroulant Owner (Propriétaire ), cliquez sur le bouton View ( Afficher ) et entrez l’adresse e-mail de contact correcte dans la zone E-mail (Figure 3F).
- Entrez plus de détails sur la plaque dans la zone Commentaires . Sélectionnez l’échantillon pertinent dans le menu déroulant Protéine et utilisez l’acronyme enregistré dans UAS et approuvé par Diamond dans la proposition expérimentale. Entrez le même nom dans la zone Nom de l’échantillon ; Laissez les boîtes restantes vides.
- Cliquez sur l’icône +Plaque pour répliquer l’échantillon sur l’ensemble de la plaque et remplir l’ensemble du conteneur avec des carrés verts. Cliquez sur +Ajouter un conteneur en bas de la page pour enregistrer la plaque. Demandez à un membre du personnel de la ligne de faisceau de transférer la plaque vers l’imageur approprié, où elle sera stockée et imagée. Une visite sera générée lorsque le conteneur sera stocké dans les imageurs et l’utilisateur recevra un e-mail avec un lien vers la plaque et ses images.
- Affichage des résultats d’imagerie
- Naviguez jusqu’à la proposition qui vous intéresse (étapes 2.1.1), sélectionnez Conteneurs dans le menu déroulant sous le numéro de la proposition et observez la liste des conteneurs disponibles pour la proposition. Sélectionnez les plaques filtrantes si d’autres types de porte-échantillons sont présents. Pour affiner davantage la recherche, cochez la case Mes conteneurs pour n’afficher que les conteneurs les plus pertinents associés à l’ID utilisateur actuellement connecté. Cliquez sur le conteneur approprié en déplaçant le curseur sur la ligne individuelle et en cliquant avec le bouton gauche de la souris.
- Lors de la sélection du conteneur, une nouvelle vue s’affiche, montrant une vue d’ensemble de la plaque (Figure 4A). Cliquez sur une goutte dans la représentation de la plaque sur le côté gauche de l’écran pour afficher l’image la plus récente de cette goutte respective. Utilisez les touches fléchées pour naviguer entre les gouttes ou sélectionnez des gouttes individuelles à l’aide d’une souris/curseur.
- Pour afficher les images historiques d’une goutte, cliquez sur le bouton H et attendez qu’une galerie contextuelle d’images apparaisse sur l’image actuelle de la chute du puits. Placez le curseur sur les images individuelles pour mettre à jour l’image principale.
- Marquez les images pour indiquer l’état de chaque goutte en appuyant sur les boutons 0 à 9 . Pour voir les catégories individuelles, ouvrez le menu déroulant Score en haut à gauche de l’image de dépôt. Recherchez des croix bleues dans chacune des images de goutte, qui sont le résultat d’un algorithme (CHiMP) entraîné à rechercher des « cristaux » dans les images.
- Cliquez sur le bouton de la troisième icône appelé Mesurer en haut à droite de l’image pour accéder à un outil de mesure. Pour utiliser cet outil, cliquez sur une ligne et faites-la glisser, et une règle s’étendra et donnera la distance en μm.
- Pour demander une session d’imagerie supplémentaire, cliquez sur Visible ou UV dans la liste déroulante située en bas de la page . Cliquez ensuite sur le bouton Demander l’imagerie de la plaque .
- Sélection des cristaux/CHiMP
- Pour ajouter des points pour la collecte manuelle de données, appuyez sur le bouton +Marquer le point . Passez le curseur sur le point d’intérêt souhaité et sélectionnez-le. Attendez qu’une croix rouge apparaisse.
REMARQUE : Il est possible de créer jusqu’à 100 objets par goutte. - Lorsque tous les points sont marqués, cliquez sur le bouton +Terminer . N’oubliez pas de cliquer également sur le bouton +Terminer avant d’essayer de mesurer des objets. Pour ajouter des régions pour la collecte de données via des balayages de grille, cliquez sur le bouton +Marquer la région . Cliquez sur le point en haut à gauche et faites-le glisser vers le bas et vers la droite pour créer une région qui sera balayée en raster sur la ligne de faisceau. Comme pour les points, cliquez sur le bouton +Terminer lorsque toutes les régions souhaitées sont créées.
REMARQUE : Il est préférable de créer une région plus grande que de nombreuses petites régions. - Observez les croix bleues déjà présentes sur les images de goutte, qui sont le résultat d’un algorithme conçu pour localiser automatiquement les objets cristallins (CHiMP). Pour visualiser l’évaluation CHiMP des gouttes de cristallisation, cochez la case Afficher les scores automatiques , puis modifiez le menu déroulant pour Classe. En règle générale, le paramètre le plus utile ici est l’option cristal (Figure 4B).
REMARQUE : Il s’agit d’une nouvelle fonctionnalité et il n’est pas garanti de trouver tous les cristaux et peut également trouver d’autres objets qui ne sont pas des cristaux. - Lorsque tous les points et régions ont été marqués dans les dépôts respectifs, cliquez sur le bouton Préparer la collecte de données en bas de la page.
- Pour ajouter des points pour la collecte manuelle de données, appuyez sur le bouton +Marquer le point . Passez le curseur sur le point d’intérêt souhaité et sélectionnez-le. Attendez qu’une croix rouge apparaisse.
- Préparation des échantillons pour la collecte de données
- Observez la liste des échantillons contenant les points ou les régions sélectionnés à l’étape précédente, ou localisés automatiquement (Figure 4C). Ajoutez des points ou des régions individuels en appuyant sur le bouton + ou ajoutez tous les échantillons affichés en cliquant sur le bouton Ajouter la page actuelle à la file d’attente .
- Les filtres sont disponibles pour afficher uniquement les points Point, Région, Auto ou Manuel. Pour afficher uniquement les échantillons qui n’ont pas été photographiés (c’est-à-dire exposés aux rayons X), cliquez sur les options Sans données et Non terminé au-dessus des boutons de filtre.
- Sélectionnez des échantillons individuels en cliquant sur la ligne correspondante et mettez à jour l’image sur le côté droit de l’écran pour afficher le point de chute et le point individuel corrects. S’il y a beaucoup d’échantillons dans la liste, augmentez le nombre d’échantillons affichés par page en sélectionnant le menu déroulant avec 10 par défaut et jusqu’à 100 comme nombre maximal d’échantillons affichés.
- Une fois que tous les points et régions ont été ajoutés à la file d’attente, assurez-vous que tous les paramètres de collecte de données expérimentales sont associés à chaque expérience.
- Utilisez des filtres pour Point, Région, Manuel et Auto. Cliquez sur le filtre Point et cochez la case Sélectionner tout sous les boutons de filtre pour appliquer simultanément des paramètres à tous les échantillons visibles dans la liste actuelle des échantillons en file d’attente .
- Sélectionnez les paramètres expérimentaux dans le menu déroulant situé sur le côté droit de l’écran, sous la photo de dépôt (Figure 4D). Pour les régions, sélectionnez l’option Grid Scan DMM par pas de 10 microns, transmission à 100 %. Pour toutes les autres expériences ponctuelles , sélectionnez d’autres options dans le menu déroulant, le cas échéant.
- Pour les collectes de données d’oscillation, cliquez sur l’option Omega Scan DMM 60 degrés 5 % de transmission pour collecter la quantité maximale de données d’un échantillon individuel. Appliquez de petites rotations pour les très petits cristaux ou les échantillons sensibles aux rayonnements et faites varier la transmission en fonction de l’expérience antérieure avec une forme cristalline particulière. Une fois que les paramètres expérimentaux sont correctement appliqués à tous les échantillons, cliquez sur le bouton Conteneur de file d’attente en bas de la page.
- Une fois que la plaque a atteint le haut de la file d’attente, elle sera présentée à la ligne de faisceau, les jeux de données seront collectés, puis elle retournera à nouveau au stockage de l’échantillon dans la ligne de faisceau. Une fois la collecte des données d’une plaque terminée, recherchez un e-mail avec un lien à suivre pour accéder aux données pertinentes.
- Création de groupes d’échantillons
REMARQUE : Des groupes d’échantillons peuvent être créés pour regrouper des échantillons similaires sur plusieurs gouttes ou plaques. Tous les jeux de données au sein de ces groupes d’échantillons seront traités à l’aide du pipeline xia2.multiplex14 une fois traités par DIALS. Cela peut être utile lors de la collecte de nombreux très petits blocs de données et peut également être utile pour augmenter le rapport signal/bruit pour les expériences de liaison aux ligands.- Sélectionnez Gestion des groupes d’échantillons dans le menu déroulant sous le numéro de la proposition. Recherchez une liste de groupes s’ils ont déjà été créés par d’autres utilisateurs. Pour générer un nouveau groupe, cliquez sur le bouton +Créer un exemple de groupe . Cliquez sur un envoi dans le menu déroulant de la page Créer un groupe d’échantillons pour afficher l’exemple de visionneuse (Figure 5A). Cliquez sur le conteneur contenant les échantillons pertinents dans la liste renseignée.
- Lorsque vous avez cliqué sur un conteneur, recherchez un graphique montrant la vue d’ensemble de la plaque.
- Cliquez sur les gouttes individuellement en cliquant sur la goutte individuelle (Figure 5B) ou cliquez sur les gouttes dans les lignes ou les colonnes en cliquant sur la lettre de ligne ou le numéro de colonne approprié. Lorsque tous les puits associés à un groupe individuel ont été sélectionnés, entrez un nom pour le groupe dans la zone Nom du groupe d’échantillons , puis cliquez sur le bouton Enregistrer le groupe d’échantillons . Cliquez sur le bouton Afficher les groupes d’échantillons sur cette page pour revenir à la liste des groupes d’échantillons déjà générés associés à la proposition (Figure 5C).
- Modification des groupes d’échantillons
- Cliquez sur un exemple de groupe dans la liste des groupes de la page Gestion des exemples de groupes .
- Cliquez sur le bouton +Edit Sample Group (Modifier le groupe d’échantillons ) à côté des conteneurs qui apparaissent sous les informations sur le groupe (Figure 5C).
- Observez les gouttes, déjà associées à un groupe d’échantillons, mises en évidence sur l’aperçu de la plaque.
- Ajoutez d’autres gouttes au groupe d’échantillons en cliquant sur Gouttes, Puits ou Colonnes comme précédemment.
REMARQUE : Les gouttes ne peuvent pas être retirées d’un groupe d’échantillons. - Une fois que d’autres gouttes ont été ajoutées, modifiez le nom du groupe d’échantillons , puis enregistrez-le, ou enregistrez-le simplement en cliquant sur le bouton Enregistrer le groupe d’échantillons .
- Visualisation et analyse des résultats des groupes d’échantillons
- Cliquez sur un groupe individuel dans la liste des groupes d’échantillons pour afficher la vue d’ensemble des plaques du ou des conteneurs associés au groupe. Les gouttes incluses dans le groupe seront mises en évidence sur cet écran (Figure 5D).
- Recherchez une liste contenant les trois derniers travaux de multiplexage chronologiques si des données ont été collectées dans ce groupe.
- Cliquez sur la ligne d’une exécution de multiplex pour mettre à jour les résultats de traitement ci-dessous.
- Observez le bouton de lien rapide , qui indique le nombre de jeux de données associés au groupe. Cliquez sur ce bouton pour ouvrir une nouvelle page Collections de données affichant les collections de jeux de données individuelles.
3. Accès au traitement automatisé des données
REMARQUE : Une fois que les données ont été collectées, elles sont transmises à plusieurs pipelines de traitement automatique des données. Les quatre pipelines standard utilisés sur les lignes de faisceau MX à Diamond sont également exploités à partir des données recueillies sur la ligne de faisceau. Il s’agit de 'fast_dp', 'xia2 dials', 'xia2 3dii' et 'autoPROC'15. 'fast_dp' fournira une réduction rapide des données pour évaluer rapidement la qualité. Les trois autres pipelines nécessiteront plus de temps de calcul et exécuteront une variété de progiciels de réduction de données différents à des fins de comparaison. En conséquence, la sortie est généralement de meilleure qualité que la sortie « fast_dp ». Les ensembles de données collectés sur la ligne de faisceau passeront également par le logiciel de fusion automatique multicristallines 'xia2.multiplex'14, qui fusionnera tous les ensembles de données au sein d’un groupe défini. Notez que bien que les scans de grille ne soient actuellement pas traités automatiquement, les données peuvent être traitées manuellement à l’aide du pipeline 'xia2.ssx'. Les résultats des pipelines de traitement automatique sont disponibles dans ISPyB11 à l’aide du protocole suivant.
- Localisation des jeux de données
- Connectez-vous à ISPyB comme décrit ci-dessus et sélectionnez Propositions.
- Recherchez la proposition qui vous intéresse en faisant défiler ou en tapant le numéro de la proposition dans la barre de recherche.
- Cliquez sur la visite souhaitée dans la liste qui s’affiche à l’écran pour accéder à la fenêtre Collections de données de cette visite.
- Appliquez les filtres souhaités.
REMARQUE : Un filtre populaire est le filtre « Intégration automatique », qui n’affiche que les jeux de données qui ont été exécutés avec succès dans un ou plusieurs pipelines de traitement. Cela exclura les analyses de grille, car elles ne sont actuellement pas traitées automatiquement par ISPyB. - Faites défiler la page vers le bas pour trouver le jeu de données qui vous intéresse.
REMARQUE : Chaque jeu de données affichera l’ID de l’échantillon, les paramètres expérimentaux utilisés, une visionneuse d’images de diffraction, une visionneuse d’images cristallines et un tracé d’analyse par image pour une observation rapide de la qualité des données.
- Pour accéder aux résultats du traitement automatique
- Cliquez sur l’onglet Traitement automatique sous le résumé des données d’une expérience spécifique pour inspecter les résultats de la réduction automatique des données (Figure 6A).
- Cliquez sur les différents onglets correspondant aux différents pipelines pour voir un résumé détaillé de chaque sortie.
REMARQUE : Si des groupes d’échantillons ont été définis, il y aura deux onglets correspondant aux tâches multiplexes. L’un correspondra à la fusion de tous les jeux de données du groupe jusqu’à ce point, tandis que l’autre correspondra à la fusion des jeux de données au sein de ce dépôt uniquement. - Cliquez sur le bouton Journaux et fichiers pour télécharger les fichiers .mtz résultants si le traitement a réussi et tous les fichiers journaux associés. Cliquez sur l’onglet Traitement en aval sous la section Traitement automatique pour afficher la sortie de DIMPLE.
REMARQUE : DIMPLE ne s’exécutera que si un fichier PDB a été fourni lors de l’envoi de l’échantillon. - Cliquez sur le bouton Logs & Files pour télécharger n’importe quelle sortie résultante de DIMPLE.
- Pour accéder aux résultats du multiplexage de groupe, ouvrez le menu déroulant en haut de l’écran avec le numéro de proposition inscrit dessus et cliquez sur Gestion des groupes d’échantillons. Cliquez sur la ligne correspondant au groupe souhaité dans le bon conteneur. Faites défiler vers le bas pour trouver la liste des sorties multiplex correspondant au groupe tel que représenté visuellement par un schéma de la plaque.
- Cliquez sur la sortie multiplex souhaitée dans la liste indiquée. Cliquez sur le bouton xxx Data Sets (Ensembles de données xxx ), où xxx correspond au nombre de jeux de données fusionnés (Figure 6B).
REMARQUE : L’écran Collections de données s’ouvre, mais seuls les jeux de données de la tâche multiplex sélectionnée s’affichent. - Cliquez sur l’onglet Traitement automatique de l’expérience supérieure.
- Cliquez sur l’onglet Traitement multiplex qui correspond au nombre correct de jeux de données fusionnés.
- Cliquez sur le bouton Logs & Files pour télécharger le fichier .mtz et les fichiers journaux correspondants (comme à l’étape 3.2.3).
- Cliquez sur la sortie multiplex souhaitée dans la liste indiquée. Cliquez sur le bouton xxx Data Sets (Ensembles de données xxx ), où xxx correspond au nombre de jeux de données fusionnés (Figure 6B).
- Pour accéder aux résultats de l’analyse de la grille
- Accédez à l’écran Collections de données de la visite souhaitée. Les résultats des données de balayage de la grille seront affichés à côté de toutes les données de rotation collectées.
REMARQUE : Il n’y aura pas de résultats de traitement automatique. - L’image de la goutte de cristal aura la grille recouverte d’une carte thermique représentant la présence de diffraction. Cliquez sur un carré pour afficher l’image de diffraction correspondant à cette position dans la grille. Cliquez sur le menu déroulant en haut de l’image du puits de cristal pour modifier ce que représente la carte thermique. La valeur par défaut est l’intensité totale de la diffraction, mais elle peut être remplacée par le nombre total de taches, la résolution estimée ou les images sans glace.
- Accédez à l’écran Collections de données de la visite souhaitée. Les résultats des données de balayage de la grille seront affichés à côté de toutes les données de rotation collectées.
4. Retraitement des données
REMARQUE : Les jeux de données sélectionnés peuvent être retraités via l’interface ISPyB11 à l’aide des mêmes pipelines de traitement qui sont exécutés automatiquement avec les paramètres modifiés définis par l’utilisateur. Un seuil de résolution peut être appliqué ; Si la symétrie/cellule du cristal est connue, elle peut également être définie pour s’assurer que les pipelines de traitement fonctionnent dans le bon réglage. Certaines plages d’images dans des jeux de données spécifiques peuvent également être fusionnées à l’aide des pipelines multicristaux disponibles. Cela peut s’avérer avantageux si les dommages causés par les rayonnements systématiques entraînent une mauvaise qualité de la dernière partie des images de diffraction. Il est également possible pour l’utilisateur de télécharger ses jeux de données en utilisant le protocole décrit ci-dessus et d’exécuter localement le logiciel de retraitement de son choix, dont les didacticiels sont disponibles gratuitement ailleurs (https://dials.github.io/documentation/tutorials/index.html# ).
- Pour retraiter plusieurs jeux de données individuels
- Connectez-vous à ISPyB et accédez aux ensembles de données qui vous intéressent (étape 3.1).
- Cliquez sur un jeu de données , puis sur l’icône en forme de roue dentée dans la barre de titre du jeu de données (Figure 6) pour ouvrir la fenêtre de retraitement.
- Configurez les paramètres souhaités et sélectionnez les images qui seront incluses dans le retraitement.
REMARQUE : La plage d’images peut être définie soit en tapant une plage dans les zones étiquetées, soit en cliquant et en faisant glisser la région souhaitée dans le tracé d’analyse par image (Figure 7A). - FACULTATIF : Pour ajouter un autre jeu de données pour un retraitement individuel, cliquez sur son icône en forme de roue dentée et il apparaîtra dans la fenêtre de retraitement sous le premier jeu de données. Cochez la case Traiter individuellement.
- Cliquez sur le bouton Intégrer .
- Pour retraiter des données multicristaux
- Ouvrez la fenêtre de retraitement à partir de n’importe quel jeu de données.
- Cliquez sur le bouton Multicristal pour ouvrir un nouvel écran.
- Faites défiler vers le bas pour trouver une série de graphiques d’analyse par image à partir d’expériences menées pendant la visite.
- Choisissez un pipeline de traitement dans le menu déroulant.
- FACULTATIF : Définissez des limites de résolution ou des paramètres de cellule unitaire connus.
- Cliquez et faites glisser pour définir les plages d’images à inclure dans le retraitement multicristallin (Figure 7).
REMARQUE : Cette opération doit être effectuée sur plusieurs tracés différents afin que les jeux de données de plusieurs cristaux différents soient fusionnés. - Cliquez sur le bouton Integrate (Intégrer ) (Figure 7B).
- Pour accéder aux données retraitées
- Accédez à la page Collections de données de la visite spécifique (étapes 3.1.1 à 3.1.3).
- Cliquez sur le bouton Retraitement en haut de l’écran.
- Faites défiler vers le bas pour localiser la tâche souhaitée.
- Cliquez sur le chemin d’accès au fichier dans la colonne de droite pour ouvrir l’écran Collections de données pour les données retraitées.
- Ouvrez l’onglet Traitement automatique et téléchargez les données comme décrit précédemment (étape 3.2).
REMARQUE : Tous les travaux de retraitement sont identifiables par le symbole des flèches circulaires à côté du nom du pipeline.
Résultats Représentatifs
L’installation de cristallisation et la ligne de lumière VMXi ont été utilisées pour une grande variété de types de projets et de cas d’utilisation. Voici un petit nombre d’exemples pour illustrer ce que les utilisateurs peuvent souhaiter poursuivre.
Étude de cas 1 : Collecte de données standard
La ligne de faisceau permet de déterminer rapidement les structures cristallines à température ambiante à partir d’un petit nombre de cristaux à l’intérieur d’une plaque de cristallisation. Le nombre minimum de cristaux dépend du groupe d’espace et de l’orientation des cristaux, mais il est souvent compris entre 1 et 4, bien que l’amélioration de la qualité des données puisse être obtenue en fusionnant les données de plusieurs dizaines de cristaux. Un exemple récent est l’une des normes de la ligne de faisceau, la thaumatine. Les cristaux multiples, illustrés à la figure 8A, ont été balisés pour la collecte manuelle des données, comme décrit dans la section 2.3 du protocole. Ces cristaux ont été ajoutés à la file d’attente comme décrit dans la section 2.4 du protocole et les paramètres expérimentaux ont été sélectionnés dans la liste déroulante. Une fois les paramètres expérimentaux appliqués, la plaque a été mise en file d’attente pour la collecte des données. Les jeux de données ont été collectés, automatiquement mis à l’échelle et fusionnés à l’aide du pipeline xia2.multiplex, comme décrit dans la section 3 du protocole. Un exemple de sortie de SynchWeb est illustré à la figure 8A du milieu. Cinq jeux de données fusionnés ont donné lieu à un jeu de données d’une résolution de 1,66 Å. Pour la collecte de données standard d’environ cinq cristaux dans un puits, les ensembles de données ont été recueillis en 2,5 minutes.
Étude de cas 2 : Liaison au ligand – Expérience de fragment utilisant la protéine Mac1
La production de structures de complexes protéine-ligand à température ambiante peut être réalisée directement à l’aide de la ligne de faisceau. Des ligands peuvent être ajoutés aux gouttes sur les plaques de cristallisation (manuellement ou par injection acoustique) et les données peuvent être mesurées après un temps d’incubation approprié. Dans l’exemple décrit ici, une série de fragments ont été distribués dans des puits contenant des cristaux du premier macrodomaine du SRAS-CoV-2 de la protéine nsp3 (Mac-1) dans une plaque de cristallisation. Deux des puits contenant le même fragment ont été attribués en tant que groupe, comme décrit à l’étape 2.5 du protocole. Des cristaux multiples (42) ont été marqués pour la collecte de données comme décrit dans les étapes 2.3 et 2.4 du protocole, et les ensembles de données ont été recueillis à l’aide de paramètres standard (rotation de 60°, pas de 0,1°, exposition de 0,00178 s, transmission de 5 %, 16 KeV - par cristal) (Figure 8B). Les ensembles de données des deux puits ont été automatiquement traités à l’aide du pipeline xia2.dials et, par la suite, le pipeline xia2.multiplex a été lancé pour fusionner automatiquement 22 de ces ensembles de données. DIMPLE a ensuite été exécuté sur la sortie de ces pipelines et a produit des cartes qui montraient clairement la preuve du fragment lié. Le modèle de fragment a été intégré à la densité inoccupée et affiné (figure 8B à droite). Les structures liées aux ligands à température ambiante peuvent facilement être déterminées à l’aide de cette série d’étapes pour fournir des informations et des commentaires inestimables au processus de conception de médicaments basé sur la structure. Pour cette collecte de données de 42 cristaux dans un certain nombre de puits, les ensembles de données ont été collectés en 10 minutes.
Étude de cas 3 : Solution de structure avec un groupe d’espaces à faible symétrie et des orientations préférées Un empilement de plusieurs cristaux avec une morphologie en forme de plaque a été produit à partir d’expériences de cristallisation avec un cytochrome de liaison au gaz de type c (Figure 8C). En sélectionnant plusieurs positions autour du bord de la pile où il n’y avait qu’un seul cristal dans le faisceau de rayons X, il a été possible d’obtenir un jeu de données de bonne qualité à une résolution de 1,75 Å en fusionnant des coins de quatre cristaux, malgré un groupe d’espace monoclinique (C2). Cela a permis d’avancer rapidement dans le projet sans qu’il soit nécessaire d’optimiser davantage les conditions de cristallisation. Ce résultat a été décrit précédemment9. Pour cette collecte de données de quatre cristaux dans un puits, les ensembles de données ont été collectés en 2 minutes.
Étude de cas 4 : Obtention d’informations et d’une structure à température ambiante à partir de microcristaux dans une plaque à l’aide de la cristallographie en série
Souvent, lorsque des microcristaux apparaissent dans une goutte ou lorsque les utilisateurs cherchent à optimiser les protocoles de microcristallisation par lots en tant que précurseur d’expériences de cristallographie en série à des sources synchrotron ou XFEL, il est très utile d’obtenir rapidement un retour d’information sur les propriétés de diffraction et les dimensions des cellules unitaires de différents essais en utilisant un minimum de matériel. Dans ce cas d’utilisation, des microcristaux de lysozyme poussant par lots ont été pipetés dans une plaque de cristallisation (volume de 200 nL par goutte) et des données ont été recueillies à partir de huit gouttes à l’aide d’un balayage en grille avec une taille de pas de 10 μm (Figure 9). Les 25 906 images fixes qui en ont résulté ont été traitées à l’aide d’un logiciel de cristallographie en série, ce qui a donné lieu à un ensemble de données, où 9 891 diagrammes de diffraction ont été indexés et fusionnés, produisant un ensemble de données à une résolution de 2,0 Å qui s’est bien affiné par rapport à la structure de température ambiante publiée (travail R = 19,6 %, Rlibre = 23,6 % en utilisant PDB 8A9D) (Tableau 1). Cela a permis une analyse détaillée de la distribution des cellules unitaires et une détermination de la structure de la température ambiante des microcristaux qui pourrait alimenter des expériences complexes de cristallographie en série, y compris des études résolues en temps. Le volume total de suspension microcristalline nécessaire était de 1,6 μL. Pour cette collecte de données de microcristaux dans huit puits à l’aide de balayages de grille, les ensembles de données ont été collectés en 40 minutes.
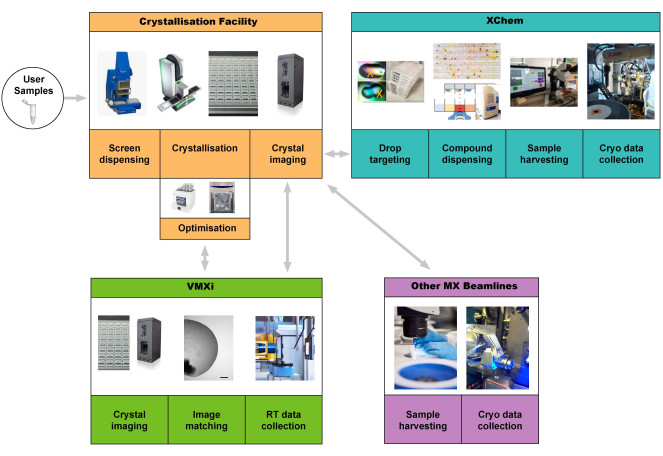
Figure 1 : Schéma de la canalisation protéine-structure intégrant le criblage de cristallisation, l’optimisation à l’installation de cristallisation, la collecte et le traitement automatisés des données à température ambiante sans récolte d’échantillons à VMXi, le criblage de fragments XChem et la collecte de données sur d’autres lignes de lumière MX. Les utilisateurs peuvent démarrer le pipeline en fournissant un échantillon ou en apportant des plaques à la ligne de faisceau VMXi. Abréviation : Cristallographie macromoléculaire polyvalente in situ. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : L’interface Mosquito SPT Labtech pour la mise en place des plaques de cristallisation. (A) (1) La vue de configuration MiTeGen In Situ-1. Choisissez la plaque standard MiTeGen 2 en accédant à (2) le type de plaque à 96 puits et en sélectionnant (3) la plaque de dérivation MiTeGen 2. Pour modifier les paramètres de définition des dépôts 1 et 2, qui sont requis pour VMXi, cliquez sur l’icône d’édition (4). Cela ouvre une nouvelle fenêtre (B) où (5) les décalages X et Y doivent être modifiés comme indiqué. Sélectionnez (B) le sous-puits 2 et (C) le sous-puits 3 et modifiez les valeurs en conséquence. (D) La vue de configuration de CrystalQuickX. Choisissez la plaque standard CrystalQuickX 2 en accédant au type de plaque à 96 puits et en sélectionnant la plaque de dérivation MiTeGen 2. Pour modifier les paramètres de définition des dépôts 1 et 2, qui sont requis pour VMXi, cliquez sur l’icône de modification identique à celle ci-dessus. Cela ouvre une nouvelle fenêtre dans laquelle (E,F) les décalages X et Y doivent être modifiés comme indiqué. Veuillez cliquer ici pour voir une version agrandie de cette figure.
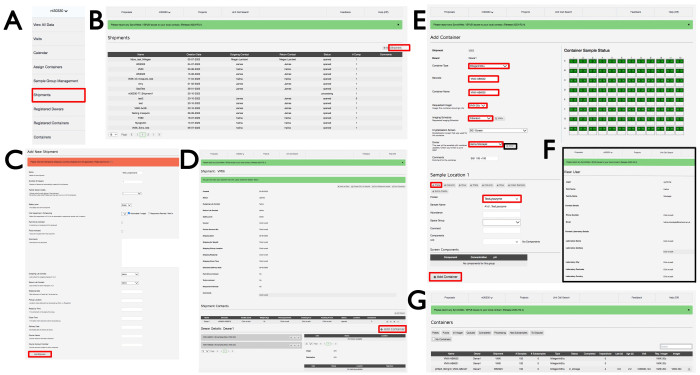
Figure 3 : L’interface SynchWeb montre comment créer un envoi VMXi, enregistrer une plaque et vérifier les coordonnées. Des captures d’écran des différentes étapes du téléchargement d’informations dans l’interface SynchWeb sont affichées à partir (A) du menu déroulant, (B, C) de l’enregistrement d’un nouvel envoi, (D) de l’enregistrement d’un nouveau conteneur, (E) de la saisie des informations sur la plaque, (F) de la vérification des coordonnées et (G) d’une liste des conteneurs enregistrés dans une proposition. Veuillez cliquer ici pour voir une version agrandie de cette figure.
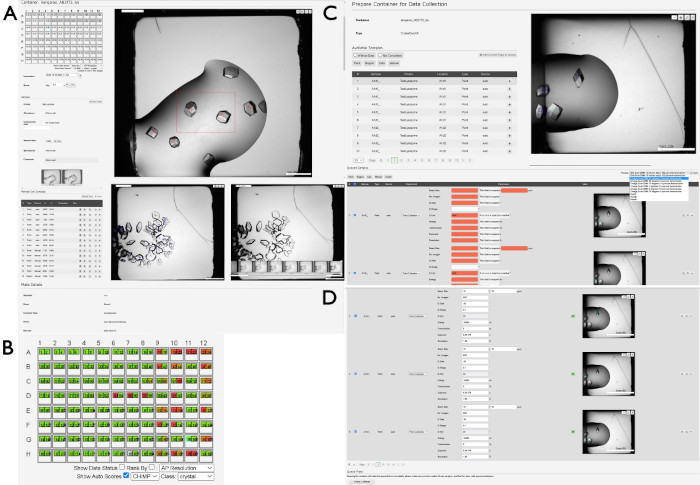
Figure 4 : Sélection et préparation d’échantillons pour la collecte de données à l’aide de SynchWeb. Une série de captures d’écran montrant les différentes étapes de la préparation des échantillons pour la collecte de données à l’aide de l’interface SynchWeb s’affiche. (A) Les points et les régions d’intérêt sont sélectionnés dans l’aperçu du dépôt. Dans la partie inférieure de ce panneau, il y a une série chronologique de photographies d’une goutte. (B) Un exemple de sortie CHiMP pour une plaque mettant en évidence les résultats de la catégorie « cristal ». (C) Ajouter des échantillons à la file d’attente à partir de la liste des points et régions sélectionnés et (D) appliquer des paramètres de collecte de données aux échantillons en file d’attente à partir de la liste déroulante des paramètres d’expérience créés par la ligne de faisceau. Notez la différence entre les échantillons sans paramètres expérimentaux (en rouge) et ceux qui ont des paramètres correctement appliqués (en haut et en bas). Au bas de ce panneau se trouve le bouton Conteneur de file d’attente, qui met en file d’attente la plaque à collecter sur la ligne de faisceau. Veuillez cliquer ici pour voir une version agrandie de cette figure.
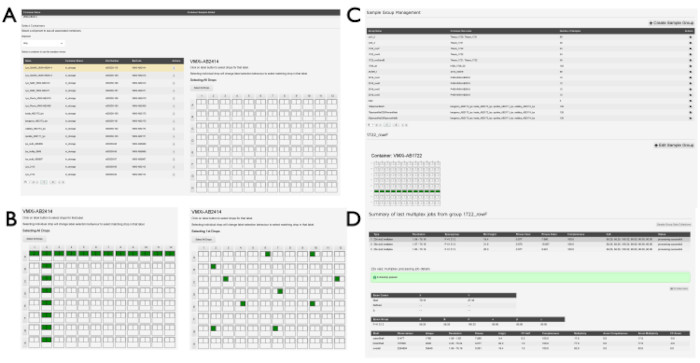
Figure 5 : Création d’un exemple de groupe dans SynchWeb. Une série de captures d’écran montrant les différentes étapes de la création d’échantillons de groupes. (A) La ou les plaques contenant des échantillons sont sélectionnées dans l’expédition concernée et (B) les gouttes à l’intérieur de la plaque sont sélectionnées. Il peut s’agir de gouttes individuelles ou d’une ligne et/ou d’une colonne. (C) Une liste des groupes d’échantillons qui ont déjà été créés. (D) Les sorties des trois derniers travaux de traitement multiplex sont répertoriées et peuvent être sélectionnées pour afficher les statistiques du pipeline de traitement. Veuillez cliquer ici pour voir une version agrandie de cette figure.
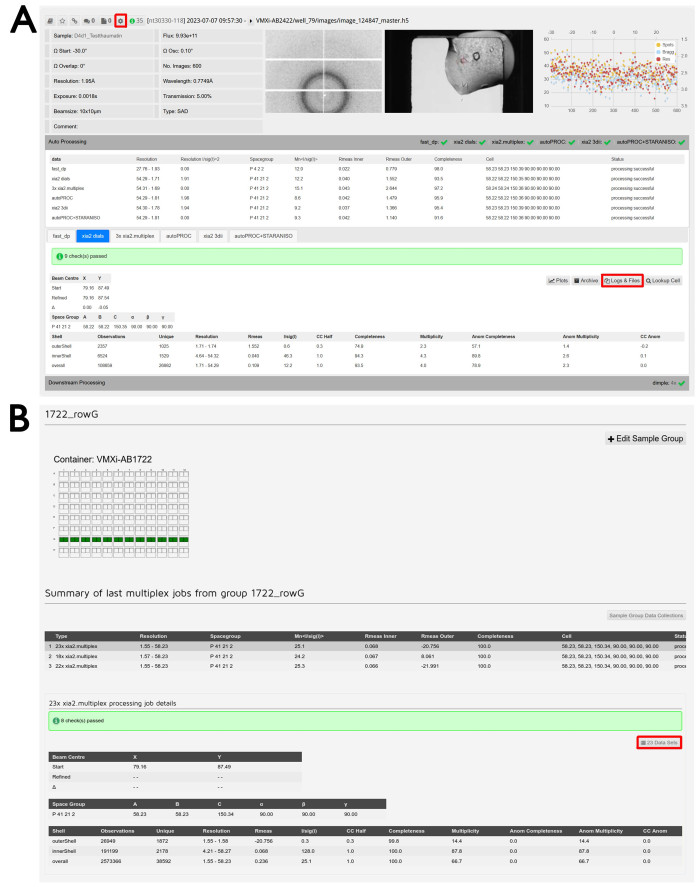
Figure 6 : Traitement et réduction des données. (A) Capture d’écran d’un jeu de données traité dans ISPyB11. Le bouton permettant d’accéder aux fonctions de retraitement est mis en surbrillance. L’ID de l’échantillon et les paramètres expérimentaux sont affichés en haut à gauche et la visionneuse d’images de diffraction au milieu. En cliquant sur cette image, une fenêtre interactive s’ouvrira pour examiner différentes images. La visionneuse d’images cristallines est affichée sur la droite et en cliquant sur cette image, une fenêtre interactive s’ouvrira pour comparer les images de ligne de faisceau et de stockage Formulatrix. Le tracé d’analyse par image est affiché à l’extrême droite et en cliquant sur cette image, vous ouvrirez une version agrandie de cette sortie. En cliquant sur l’onglet Traitement automatique, vous verrez le traitement automatique et faciliterez la comparaison entre les résultats des différents pipelines. Cliquez sur les onglets pour passer d’un pipeline de traitement à l’autre et afficher la sortie détaillée du pipeline sélectionné. Le bouton Journaux et fichiers pour le téléchargement des données est mis en surbrillance. En cliquant sur l’onglet Traitement en aval, vous développerez et fournirez des résultats pour tous les ensembles de données exécutés par le biais de pipelines de réduction post-données, le cas échéant. (B) Capture d’écran de l’écran Gestion des groupes d’échantillons. Le nom du groupe défini par l’utilisateur se trouve en haut et la description visuelle des puits inclus peut être vue ci-dessous. Un puits vert indique que tous les cristaux mesurés à partir de cette goutte seront inclus dans le groupe. Un récapitulatif des différentes tâches de multiplexage effectuées sur ce groupe peut être vu et en dessous se trouve la sortie détaillée du multiplex. Le bouton Data Sets (Ensembles de données) permettant d’examiner les expériences incluses est mis en surbrillance. Veuillez cliquer ici pour voir une version agrandie de cette figure.
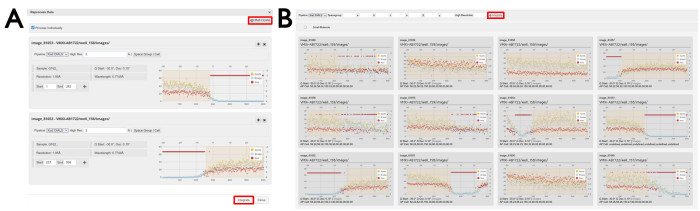
Figure 7 : Fenêtres de retraitement des données. (A) Ensembles de données individuels et (B) multicristallins. Deux jeux de données individuels sont affichés dans lesquels des régions de données ont été sélectionnées. Lorsque la case Traiter individuellement est cochée, les images de diffraction sélectionnées seront traitées individuellement en appuyant sur le bouton Intégrer. Cliquez sur le bouton Multicristal pour ouvrir un affichage des jeux de données individuels. Pour retraiter des images de diffraction à partir de plusieurs jeux de données, les régions des images sont sélectionnées comme affichées et le retraitement est lancé en cliquant sur le bouton Intégrer comme mis en surbrillance. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 8 : Résultats représentatifs du pipeline VMXi. (A) Cristaux marqués pour la protéine thaumatine dans une goutte de cristallisation (panneau de gauche), résultats du traitement des données (panneau central) et densité électronique (panneau de droite). (B) Collecte sur plusieurs cristaux pour déterminer la liaison du fragment au domaine macro du SRAS-CoV-2. Les ensembles de données ont été collectés sur plusieurs cristaux en présence d’un fragment de l’écran de fragments EU-OPENSCREEN en utilisant des paramètres expérimentaux standard. Des exemples de ces collectes de données sont présentés dans cet extrait de SynchWeb. Le fragment a été intégré dans la densité correspondante et affiné comme on peut le voir dans le plus à droite. (C) Cristaux monocliniques marqués dans une pile à partir d’un coup de cristallisation difficile utilisé pour la collecte de données. Les croix vertes et les chiffres rouges indiquent où les données ont été mesurées à l’aide d’un faisceau de 10 μm et d’une rotation de 60°. Quatre des coins résultants ont été fusionnés pour produire un ensemble de données à une résolution de 1,75 Å. La densité électronique autour du groupe hème est affichée à droite. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 9 : Cristallographie en série dans la plaque de cristallisation. (A) Image optique de la goutte de cristallisation, avec une boîte blanche représentant la région d’intérêt. (B) Définition des points de balayage de la grille. (C) Carte thermique indiquant la diffraction. (D) Carte de densité électronique à partir d’un ensemble de données de cristallographie en série à partir de plus de 9 000 diagrammes de diffraction immobile. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Résolution (Å) | Exhaustivité (%) | Multiplicité | I/σ(I) | Fractionnement R | CC1/2 | Observations uniques |
| Total | 100 | 95.5 | 20.8 | 0.063 | 0.998 | 8422 |
| Faible (55,55 - 5,43) | 100 | 147.1 | 81.7 | 0.028 | 0.999 | 488 |
| Élevé (2.03 -2.00) | 100 | 75.3 | 1.2 | 1.092 | 0.410 | 411 |
Tableau 1 : Statistiques de données pour le jeu de données série VMXi RT. Abréviations : I = intensité moyenne des observations mises à l’échelle ; R split = une mesure de l’écart des intensités mesurées ; CC 1/2 = coefficient de corrélation entre deux moitiés aléatoires de l’ensemble de données.
Discussion
Nous avons décrit la procédure complète depuis l’arrivée d’un échantillon de protéines dans le CF jusqu’au téléchargement des données finales par l’utilisateur pour d’autres applications. Les étapes critiques sont la production d’un échantillon de protéines de haute qualité et de cribles cristallins appropriés, soit à l’aide de cribles à matrice creuse commerciale, soit à l’aide de cribles d’optimisation basés sur des conditions établies. Ce processus peut avoir lieu dans les FC, ou les utilisateurs peuvent effectuer les procédures de cristallisation dans les laboratoires d’origine et apporter des plaques de cristallisation appropriées à la ligne de faisceau. L’identification de paramètres de collecte de données appropriés peut être importante pour certains échantillons, en particulier lorsque les dommages causés par les rayonnements sont préoccupants. Dans la plupart des cas, le traitement automatisé des données est tout à fait suffisant pour répondre à la question scientifique, bien que les utilisateurs conservent la possibilité de procéder à un retraitement à l’aide des outils de ligne de faisceau, par exemple, lorsque le groupe spatial est ambigu ou que seule la partie initiale des données collectées est utilisée pour minimiser les effets des dommages causés par les rayonnements.
Si des cristaux appropriés ne sont pas produits à partir des essais de cristallisation initiaux, des changements dans la concentration en protéines, la pureté ou les écrans de cristallisation peuvent être explorés, tout comme l’utilisation de l’ensemencement des cristaux. Si les cristaux ne se diffractent pas à une résolution utile à la ligne de faisceau, des balayages de grille peuvent être utilisés avec un faisceau non atténué pour évaluer la limite de diffraction inhérente et la cellule unitaire des cristaux afin de guider les efforts d’optimisation. Les cristaux qui sont trop petits pour la collecte de données à l’intérieur des plaques (par exemple, <10 μm) peuvent plutôt convenir à la cristallographie en série ou aux expériences de nanofocalisation (par exemple, à la ligne de faisceau Diamond VMXm). La résolution de structures à l’aide de données VMXi est généralement simple par remplacement moléculaire, en particulier depuis l’avènement d’Alphafold16 pour donner des modèles de recherche efficaces. Si cela ne réussit pas, les cristaux peuvent être récoltés et cryorefroidis à partir de plaques pour permettre des expériences conventionnelles de diffraction anormale à une seule longueur d’onde, de diffraction anormale à plusieurs longueurs d’onde ou de phase à grande longueur d’onde.
Les avantages de cette méthode incluent la possibilité d’obtenir des ensembles de données rapides et de haute qualité et un retour d’information directement à partir des plaques de cristallisation sans avoir besoin de perturber les cristaux des environnements dans lesquels ils se sont développés. Ce que l’on appelle la « renaissance à température ambiante » en biologie structurale privilégie les structures obtenues dans des conditions non cryogéniques pour permettre d’explorer davantage la pertinence physiologique et la dynamique des protéines2. Habituellement, une résolution légèrement inférieure est obtenue par rapport à un cristal cryorefroidi optimisé, mais seulement lorsque des conditions cryogéniques appropriées ont été établies et si les cristaux sont robustes à la manipulation mécanique et à l’ouverture de la goutte de cristallisation3. Une application à venir pour laquelle ce pipeline est très bien adapté est le criblage à grande échelle de complexes protéine-ligand ou de campagnes de fragments à température ambiante dans la découverte de médicaments. Les ligands ou les fragments peuvent être cocristallisés ou ajoutés par pipette ou par éjection de gouttes acoustiques avant la collecte de données à température ambiante. Une autre application consiste à mesurer rapidement les données de plusieurs centaines ou milliers de cristaux de manière très efficace, puis à utiliser le logiciel DIALS17 multiplex14 pour extraire des amas isomorphes qui peuvent représenter différentes entités biologiques ou pour établir des différences statistiquement significatives entre des populations de cristaux qui ont été traités d’une manière différente ou exposés à des ligands ou des signaux différents.
Déclarations de divulgation
Les auteurs ne déclarent aucun conflit d’intérêts.
Remerciements
Nous remercions les nombreux scientifiques de Diamond Light Source et les membres de l’équipe de soutien qui ont contribué à la conception, à la construction et à l’exploitation de la ligne de lumière VMXi. Nous sommes reconnaissants envers les utilisateurs de la ligne de faisceau, qui ont apporté des idées plus tard au développement des pipelines de cristallisation et de collecte de données. L’installation de cristallisation de Harwell est soutenue par Diamond Light Source Ltd, l’Institut Rosalind Franklin et le Conseil de recherches médicales.
matériels
| Name | Company | Catalog Number | Comments |
| Formulator | Formulatrix | on request | Liquid handling robot |
| Formulatrix imager | Formulatrix | on request | Crystallisation plate imager |
| Greiner CrystalQuick X | Greiner | Z617644 | Crystallisation plate |
| Gryphon | Art Robbins Instruments | 620-1000-10 | Crystalisation robot |
| MiTeGen Insitu-1 | Mitegen | InSitu-01CL-40 | Crystallisation plate |
| Mosquito LCP | (SPT Labtech) | on request | Crystallisation robot |
| Rock Imager & Maker | Formualtrix | on request |
Software for Imager [1] https://formulatrix.com/protein-crystallization-systems/rock-maker-crystallization-software/ |
| Scorpion | Art Robbins Instruments | 640-1000-10 |
Liquid handling robot https://www.artrobbins.com/scorpion |
Références
- Lynch, M. L., Snell, M. E., Potter, S. A., Snell, E. H., Bowman, S. E. J. 20 years of crystal hits: Progress and promise in ultrahigh-throughput crystallization screening. Acta Crystallographica Section D Structural Biology. 79 (Pt 3), 198-205 (2023).
- Fischer, M. Macromolecular room temperature crystallography. Quarterly Reviews of Biophysics. 54, 1 (2021).
- Helliwell, J. R. What is the structural chemistry of the living organism at its temperature and pressure. Acta Crystallographica Section D Structural Biology. 76 (Pt 2), 87-93 (2020).
- Thorne, R. E. Determining biomolecular structures near room temperature using x-ray crystallography: Concepts, methods and future optimization. Acta Crystallographica Section D Structural Biology. 79 (Pt 1), 78-94 (2023).
- Keedy, D. A., et al. Crystal cryocooling distorts conformational heterogeneity in a model michaelis complex of dhfr. Structure. 22 (6), 899-910 (2014).
- Huang, C. Y., et al. Probing ligand binding of endothiapepsin by 'temperature-resolved' macromolecular crystallography. Acta Crystallographica Section D Structural Biology. 78 (Pt 8), 964-974 (2022).
- Sanchez-Weatherby, J., et al. Vmxi: A fully automated, fully remote, high-flux in situ macromolecular crystallography beamline. Journal of Synchrotron Radiation. 26 (Pt 1), 291-301 (2019).
- Jacquamet, L., et al. Automated analysis of vapor diffusion crystallization drops with an x-ray beam. Structure. 12 (7), 1219-1225 (2004).
- Mikolajek, H., et al. Protein-to-structure pipeline for ambient-temperature in situ crystallography at vmxi. IUCrJ. 10, 420-429 (2023).
- Douangamath, A., et al. Achieving efficient fragment screening at xchem facility at diamond light source. Journal of Visualised Experiments. (171), (2021).
- Delageniere, S., et al. Ispyb: An information management system for synchrotron macromolecular crystallography. Bioinformatics. 27 (22), 3186-3192 (2011).
- Fisher, S. J., Levik, K. E., Williams, M. A., Ashton, A. W., Mcauley, K. E. Synchweb: A modern interface for ispyb. Journal of Applied Crystallography. 48 (Pt 3), 927-932 (2015).
- Jenkins, J., Cook, M. Mosquito®: An accurate nanoliter dispensing technology. JALA: Journal of the Association for Laboratory Automation. 9 (4), 257-261 (2016).
- Gildea, R. J., et al. Xia2.Multiplex: A multi-crystal data-analysis pipeline. Acta Crystallographica Section D Structural Biology. 78 (Pt 6), 752-769 (2022).
- Winter, G., Mcauley, K. E. Automated data collection for macromolecular crystallography. Methods. 55 (1), 81-93 (2011).
- Jumper, J., et al. Highly accurate protein structure prediction with alphafold. Nature. 596 (7873), 583-589 (2021).
- Winter, G., et al. Dials as a toolkit. Protein Science. 31 (1), 232-250 (2022).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon