Ingénierie d’assembloïdes tendineux pour sonder la diaphonie cellulaire dans la maladie et la réparation
Dans cet article
Résumé
Ici, nous présentons un système modèle assembloïde pour imiter la diaphonie cellulaire tendineuse entre le tissu central du tendon porteur et un compartiment extrinsèque contenant des populations cellulaires activées par la maladie et la blessure. Comme cas d’utilisation important, nous démontrons comment le système peut être déployé pour sonder l’activation des cellules endothéliales extrinsèques pertinentes pour la maladie.
Résumé
Les tendons permettent la locomotion en transférant les forces musculaires aux os. Ils reposent sur un noyau tendineux résistant comprenant des fibres de collagène et des populations de cellules stromales. Ce noyau porteur est englobé, nourri et réparé par une couche de tissu de type synovial comprenant le compartiment tendineux extrinsèque. Malgré cette conception sophistiquée, les blessures aux tendons sont courantes et le traitement clinique repose toujours sur la physiothérapie et la chirurgie. Les limites des systèmes modèles expérimentaux disponibles ont ralenti le développement de nouveaux traitements modificateurs de la maladie et de régimes cliniques de prévention des rechutes.
Les études in vivo chez l’homme se limitent à comparer des tendons sains à des tissus malades ou rompus en phase terminale prélevés lors d’une chirurgie réparatrice et ne permettent pas l’étude longitudinale de la maladie tendineuse sous-jacente. Les modèles animaux in vivo présentent également des limites importantes en ce qui concerne la complexité physiologique opaque, le fardeau éthique pour les animaux et les coûts économiques importants associés à leur utilisation. De plus, les modèles animaux in vivo sont mal adaptés à l’exploration systématique des médicaments et des voies d’interaction multicellulaires et multitissulaires. Les systèmes modèles in vitro plus simples ont également échoué. L’une des principales raisons est l’incapacité à reproduire correctement la charge mécanique tridimensionnelle nécessaire pour étudier de manière significative les cellules tendineuses et leur fonction.
Le nouveau système de modèle 3D présenté ici atténue certains de ces problèmes en exploitant les explants de noyau de tendon de la queue murine. Il est important de noter que ces explants sont facilement accessibles en grand nombre à partir d’une seule souris, conservent des modèles de charge in situ 3D au niveau cellulaire et présentent une matrice extracellulaire de type in vivo. Dans ce protocole, des instructions étape par étape sont données sur la façon d’augmenter les explants de noyau tendineux avec des hydrogels de collagène chargés de cellules endothéliales dérivées de muscles, de fibroblastes dérivés de tendons et de macrophages dérivés de la moelle osseuse pour remplacer les populations de cellules activées par les maladies et les blessures dans le compartiment tendineux extrinsèque. Il est démontré comment les assembloïdes tendineux qui en résultent peuvent être mis à l’épreuve mécaniquement ou par des stimuli microenvironnementaux définis pour étudier la diaphonie multicellulaire émergente pendant la maladie et la blessure.
Introduction
Dans leur fonction de transfert des forces musculaires vers les os pour permettre le mouvement, les tendons sont confrontés à certaines des contraintes mécaniques les plus extrêmes du corps humain 1,2,3. En raison du vieillissement des sociétés, de l’augmentation de la prévalence de l’obésité et de la popularité croissante des activités sportives exigeantes mécaniquement, la prévalence des maladies et des blessures des tendons devrait augmenter dans les pays développés 4,5,6. La mise au point de nouveaux schémas thérapeutiques modificateurs de la maladie fondés sur des données probantes pour lutter contre cette augmentation a été entravée par les limites des systèmes modèles actuellement disponibles 1,7,8.
Idéalement, les modèles de réparation des maladies et des blessures permettraient d’étudier comment l’organe cible traite un ensemble défini de paramètres d’entrée (imitant les déclencheurs de la maladie, tableau 1) en paramètres de sortie mesurables (représentant les caractéristiques de la maladie, tableau 2) tout en contrôlant les facteurs de confusion. Les études utilisant de tels systèmes modèles seraient alors en mesure d’identifier les processus (patho-)physiologiques sous-jacents à la réparation des maladies et des blessures et d’acquérir des connaissances qui pourraient être exploitées pour prévenir ou réduire les caractéristiques des maladies et des blessures dans les cliniques. En appliquant ce principe aux tendons, un système modèle utile devrait récapituler les parties centrales de la réponse tendineuse in vivo à la maladie et à la lésion, qui englobent les caractéristiques suivantes : microdommages, inflammation, néovascularisation, hypercellularité, renouvellement accéléré de la matrice et décloisonnement 9,10,11,12,13,14,15 . En utilisant ces caractéristiques comme base, les exigences suivantes pour un système de modèle de réparation des maladies et des blessures tendineuses réussi peuvent être déduites.
On suppose que la surcharge mécanique est un facteur central dans les blessures aux tendons et la pathogenèse des maladies et constitue donc une approche expérimentale couramment utilisée pour créer des microdommages16. La capacité de charge mécanique contrôlable est donc une condition préalable essentielle pour les modèles de réparation des maladies et des blessures des tendons. Idéalement, le système de modèle permet trois modes principaux : le chargement par étirement unique jusqu’à l’endommagement, le chargement par fatigue et le déchargement 8,17,18. Lors de la déformation mécanique, les cellules résidentes des tissus subissent une combinaison complexe de forces de tension, de forces de cisaillement (dues au glissement des fibres de collagène entourant les cellules) et de forces de compression se produisant pendant le déchargement ou à proximité de l’enthèse19,20. Les systèmes modèles doivent recréer ces modèles de charge complexes aussi fidèlement que possible.
Une autre façon d’introduire des microdommages matriciels consiste à tirer parti des facteurs de stress biochimiques qui imitent les prédispositions systémiques aux maladies et aux lésions tendineuses, telles que les cytokines (pro-)inflammatoires, le stress oxydatif ou les concentrations élevées de glucose 21,22,23. Par conséquent, un microenvironnement de niche contrôlable est avantageux pour un système modèle de réparation des maladies et des blessures des tendons.
Une condition préalable commune pour que les systèmes modèles soient capables de récapituler l’inflammation, la néovascularisation et l’hypercellularité est la présence sélective de populations cellulaires qui pilotent ces processus24. Pour les processus inflammatoires, ces populations comprennent les neutrophiles, les lymphocytes T et les macrophages, tandis que les cellules endothéliales et les péricytes seraient nécessaires pour étudier la néovascularisation 25,26,27,28,29. Les fibroblastes tendineux sont non seulement vitaux pour la réparation des tendons mais, en tant que cellules prolifératives et migratrices, ils sont également partiellement responsables de l’hypercellularité locale observée dans les maladies tendineuses 30,31,32,33,34,35,36.
Outre les changements dans les populations cellulaires résidentes, la composition de la matrice tendineuse est également modifiée dans les maladies et les lésions tendineuses 7,37,38,39,40. Pour présenter les bons signaux microenvironnementaux pertinents pour la maladie, les systèmes modèles devraient être capables d’intégrer une composition matricielle extracellulaire adaptée au stade de la maladie ou de la lésion ciblée, par exemple, en permettant des combinaisons proportionnelles pertinentes de collagène-1, de collagène-3 et de fibronectinecellulaire 41.
La compartimentation des tendons sains dans le noyau tendineux et les compartiments extrinsèques (c’est-à-dire endoténon, épiténon et paraténon) est essentielle à leur fonction et souvent perturbée dans les tendons malades ou blessés 1,42,43,44,45,46,47 . L’intégration de la compartimentation tendineuse 3D dans les systèmes modèles tendineux est donc non seulement nécessaire pour simuler plus étroitement les processus sous-jacents à la décompartimentation et à la recompartimentation, mais aide également à établir les gradients spatio-temporels corrects des cytokines et des nutriments48,49.
Enfin, la modularité est un autre atout central des systèmes modèles, permettant aux chercheurs de combiner la contribution relative correcte et l’interaction entre les facteurs de stress décrits précédemment au cours des processus étudiés 8,17.
Outre la sélection des modalités d’entrée optimales, une étape importante consiste à être capable de mesurer, d’observer et de suivre les changements dans la sortie résultante. Les propriétés mécaniques du système modèle (c’est-à-dire la longueur de la région des orteils, le module d’élasticité linéaire, la déformation de traction maximale, la contrainte de traction maximale, la résistance à la fatigue et la relaxation des contraintes) sont centrales ici, car elles caractérisent la fonction principale du tendon 50,51,52. Pour relier ces changements fonctionnels aux changements au niveau des tissus, il est important de mettre en place des méthodes de détection des dommages structurels à la matrice (collagène) et de suivre la prolifération et le recrutement de populations cellulaires pertinentes pour la maladie et la réparation 30,53,54,55,56,57,58,59,60.
Pour étudier l’interaction intercalaire émergente entre cellules et entre cellules et cellules, il faut être en mesure d’isoler ou de marquer des protéines en quantités adéquates pour la quantification (c.-à-d. ELISA, protéomique, immunohistochimie, cytométrie en flux)14,21,61,62. L’analyse de l’expression génique spécifique à la population ou au moins au compartiment devrait également être possible (c.-à-d. tri cellulaire activé par fluorescence [FACS], séquençage de l’ARN unicellulaire/en vrac et réaction en chaîne par polymérase quantitative en temps réel (RT-qPCR))21,24,27,63. Le système de modèle doit permettre de mesurer autant de paramètres de sortie susmentionnés sur le même échantillon et sur plusieurs échantillons d’une manière suffisamment rapide pour débloquer des études à haut débit.
Parmi les systèmes modèles actuellement disponibles pour étudier les maladies et les blessures des tendons humains, le corps humain lui-même est, bien sûr, le plus représentatif. C’est aussi le moins compatible avec une intervention expérimentale. Alors que les patients souffrant de lésions tendineuses aiguës sont abondamment disponibles pour des études cliniques, les patients atteints de tendinopathie précoce (la maladie tendineuse la plus courante) sont en grande partie asymptomatiques et ne sont souvent pas détectés cliniquement jusqu’à ce que des changements plus graves se manifestent 14,64,65. Il est donc difficile de déterminer le moment critique où l’homéostasie tendineuse déraille et les mécanismes à l’origine de ce déraillement 16,66,67,68,69. De plus, l’extraction de biopsies de tendons sains est un défi éthique, car elle peut entraîner des dommages persistants. Les restes de tendon des ischio-jambiers provenant d’une chirurgie de reconstruction du ligament croisé antérieur sont souvent utilisés comme témoins sains, mais diffèrent sans doute par leur fonction, leurs propriétés mécaniques, leurs populations cellulaires et la composition de la matrice par rapport à la coiffe des rotateurs, au tendon d’Achille et aux tendons rotuliens couramment touchés par les maladies et les blessures tendineuses 70,71,72,73.
Les modèles animaux in vivo sont plus accessibles et plus faciles à utiliser, mais leur utilisation impose un fardeau éthique important aux animaux et un coût économique aux chercheurs. De plus, la plupart des animaux modèles populaires ne développent pas spontanément de lésions tendinopathiques (c’est-à-dire les rats, les souris, les lapins) ou n’ont pas les amorces et les souches génétiquement modifiées nécessaires pour suivre les voies de communication multicellulaires impliquées (c’est-à-dire les chevaux, les lapins).
Les systèmes de modèles in vitro 2D simples se situent de l’autre côté du spectre de la complexité/traçabilité et permettent une étude contrôlée et rapide de voies de communication intercellulaires spécifiques en réponse à un ensemble de déclencheurs plus contrôlables 8,74. Cependant, ces systèmes simplifiés ne parviennent généralement pas à récapituler la charge mécanique multidimensionnelle (c’est-à-dire la traction, la compression et le cisaillement) qui est au cœur de la fonctionnalité des tendons. De plus, les rigidités (trop) élevées du plastique de culture tissulaire ont tendance à l’emporter sur les signaux matriciels fournis par les revêtements destinés à imiter l’état pathologique d’intérêt75,76.
Pour surmonter cet inconvénient, des systèmes de modèles 3D d’ingénierie tissulaire de plus en plus sophistiqués ont été développés pour fournir une matrice chargeable dont la composition peut au moins être partiellement adaptée à l’état pathologique souhaité 77,78,79. Pourtant, ces systèmes ont non seulement du mal à reproduire avec précision les compositions complexes de la matrice extracellulaire in vivo et les modèles de charge cellulaire, mais manquent généralement de chargeabilité à long terme et d’interfaces compartimentales nécessaires pour étudier les voies de communication intercompartimentales qui coordonnent la réparation des maladies et des lésions tendineuses 48,49,80.
Les systèmes de modèles d’explants de tendons ex vivo présentent l’avantage distinct d’une composition matricielle intégrée de type in vivo qui comprend des niches péricellulaires, des barrières intercompartimentales, ainsi que des gradients spatio-temporels de cytokines/nutriments et récapitule des schémas de charge complexes lorsqu’ils sont étirés8. En raison des limites de diffusion des nutriments en fonction de la taille, les explants provenant de modèles animaux plus grands (c.-à-d. les chevaux) sont difficiles à maintenir en vie pour l’étude à long terme des maladies tendineuses et de la réparation des blessures 81,82,83. Pendant ce temps, les petits explants d’espèces murines (c’est-à-dire le tendon d’Achille, le tendon rotulien) sont difficiles à serrer et à charger mécaniquement de manière reproductible. Leur taille limite également la quantité de matériel qui peut être collectée pour les lectures au niveau des cellules, des protéines et des gènes sans regrouper les échantillons et diminuer le débit. En ce sens, les faisceaux tendineux de la queue murine offrent le potentiel de débloquer l’étude à haut débit des maladies tendineuses et de la réparation des blessures, car ils sont facilement disponibles en grande quantité à partir d’une seule souris, préservent la composition complexe de la matrice péricellulaire in vivo et récapitulent les modèles de charge cellulaire. Au cours du processus d’extraction, cependant, ils perdent la majeure partie de leur compartiment extrinsèque et les populations vasculaires, immunitaires et fibroblastiques qui sont maintenant considérées comme à l’origine des maladies tendineuses et de la réparation 8,18.
Pour combler cette lacune, un système modèle combinant les avantages des explants de noyau dérivés du tendon de la queue murine avec les avantages des systèmes de modèles 3D à base d’hydrogel a été développé. Ce système modèle consiste en un hydrogel chargé de cellules (collagène-1) moulé autour des explants du tendon de la queue84,85. Dans cet article, les étapes de fabrication nécessaires sont fournies en détail ainsi que des lectures utiles qui peuvent être obtenues en co-cultivant des explants de noyau (compartiment intrinsèque) dans un hydrogel de collagène de type 1 chargé de cellules endothéliales (compartiment extrinsèque).
Protocole
Toutes les méthodes décrites ici ont été approuvées par les autorités compétentes (numéros de licence du canton de Zurich ZH104-18 et ZH058-21). Une vue d’ensemble est présentée à la figure 1.
1. Isolement des composants assembloïdes tendineux de souris âgées de 12 à 15 semaines (c.-à-d. B6/J-Rj)
- Euthanasier les souris par asphyxie induite par le gazCO2 . Pour maximiser le rendement, ne traitez pas plus de 3 souris à la fois et procédez à l’isolement cellulaire immédiatement après l’euthanasie.
- Assurer la mort par induction bilatérale du pneumothorax.
- Stérilisez la peau de la souris avec de l’éthanol à 80 % et déplacez la souris vers une cagoule de biosécurité stérile.
- Isoler les explants du noyau du tendon de la queue.
- Utilisez un scalpel (n° 21) pour séparer la queue de la souris en la coupant à sa base.
- En commençant par le bout de la queue, saisissez-la avec la pince à épiler et remuez-la pour casser la peau. Ensuite, retirez doucement la pince à épiler de la queue pour exposer les explants du noyau du tendon.
- Placer les explants du noyau tendineux dans le milieu de culture standard (DMEM/F12 + 10 % FBS + 1 % pénicilline/streptomycine + 1 % amphotéricine + 1 % d’acides aminés non essentiels) et les séparer de la partie de la queue arrachée à l’aide d’une lame de scalpel fraîche (n° 21).
- Répétez les étapes 1.4.2. et 1.4.3. jusqu’à ce que toute la queue soit traitée et que les explants tendineux deviennent plus courts que 25 mm.
- Coupez les explants isolés en morceaux de 25 mm de long à l’aide d’une nouvelle lame de scalpel (n° 21).
- Mesurez le diamètre moyen des explants de carottes avec un microscope optique connecté à un logiciel d’analyse d’images via une caméra numérique à monture C amovible.
- Utilisez pointer-cliquer pour sélectionner l’outil de mesure de ligne sur le côté droit.
- Mesurez le diamètre de l’explant à trois endroits différents et calculez leur diamètre moyen.
- Pour faciliter le serrage et les essais mécaniques ultérieurs, ne procéder qu’avec des explants de carottes d’un diamètre moyen supérieur à 100 μm.
- Le déchargement combiné à l’exposition à des conditions de culture standard (37 °C, 20 %O2, supplémentation sérique) modifie l’expression des gènes dans les 6 heures suivant l’isolement et entraîne une dégradation dans les 7 jours21. Pour commencer avec un état quasi-homéostatique, produisez les assembloïdes tendineux et commencez les expériences immédiatement après l’isolement du noyau tendineux.
- Selon la configuration expérimentale, des explants de noyau de tendon dévitalisés sont nécessaires comme groupe témoin. Pour dévitaliser les explants de noyaux tendineux, congelez-les dans un petit récipient rempli d’azote liquide pendant 5 s à l’aide d’une pince à épiler, puis décongelez-les pendant 5 s à température ambiante (RT). Répétez ce cycle de gel-dégel 3 fois et passez à l’étape 4 (« Serrage des explants du noyau »).
ATTENTION : L’azote liquide peut provoquer des brûlures par le froid, l’asphyxie et fragiliser de nombreux matériaux ordinaires. N’utilisez que des contenants conçus pour les liquides à basse température et portez des vêtements de protection (c.-à-d. écran facial, gants appropriés, chaussures fermées).
- Isolez les fibroblastes tendineux.
- Utilisez un scalpel (n° 21) pour faire une incision transversale au milieu du pied de la souris. Faites deux coupes perpendiculaires au pied le long des côtés des pattes arrière et jusqu’aux hanches à partir de chaque extrémité de cette incision.
- Utilisez la pince à épiler pour fixer le rabat de peau découpé au pied et décoller la peau recouvrant les muscles du mollet. Lorsque vous isolez les cellules endothéliales de la même souris, retirez toute la peau à la place.
- Séparez le tendon d’Achille de l’os du calcanéum avec une nouvelle lame de scalpel (n° 21). Fixez l’extrémité libre du tendon d’Achille avec la pince à épiler et séparez l’autre extrémité du muscle gastrocnémien.
- Lavez le tendon d’Achille une fois dans PBS et utilisez le scalpel (n° 21) pour retirer tout le tissu musculaire restant jusqu’à ce qu’il ne reste que le tissu tendineux blanc. Si les cellules endothéliales sont isolées de la même souris, laissez le tendon d’Achille dans le PBS et passez à l’étape 1.6. premier.
- Mettez en commun les tendons d’Achille d’un animal dans un tube en plastique de 15 mL contenant 10 mL de milieu de digestion tendineux (DMEM/F12 + 1 % de pénicilline/streptomycine + 1 % d’amphotéricine + 2 mg/mL de collagénase 1) et digérez pendant 6 à 8 h à 37 °C sous une agitation lente et constante à l’aide d’un agitateur orbital à basse vitesse à 15 tr/min.
- Centrifuger la solution tendineuse digérée à 500 x g pendant 5 min à RT, aspirer le surnageant et remettre en suspension dans 8 mL de milieu de culture standard (DMEM/F12 + 10 % FBS + 1 % pénicilline/streptomycine + 1 % amphotéricine + 1 % d’acides aminés non essentiels) et culture dans un ballon de culture T25 dans des conditions de culture standard (37 °C, 20 % O2) pendant 7 jours sans changement de milieu. Après cela, changez de support une fois par semaine.
- Diviser les cellules à 80 % de confluence dans une fiole de culture T150 (1:6). Congeler les cellules au passage 2 dans 2 mL de milieu de congélation filtré stérile (70 % DMEM/F12 + 20 % FBS + 10 % DMSO) répartis dans deux cryotubes de 1,5 mL et les conserver à -80 °C jusqu’à nouvel ordre. Utilisez de la trypsine pour retirer les cellules du plastique de culture tissulaire.
- Isolez les cellules endothéliales d’origine musculaire.
- Si les fibroblastes tendineux ne sont pas isolés de la même souris, commencez par les étapes 1.5.1 et 1.5.2.
- Utilisez des ciseaux pour séparer les pattes arrière du corps en coupant au niveau de l’articulation de la hanche.
- Lavez les pattes arrière une fois dans du PBS froid (~ 4 °C), retirez les muscles (quadriceps fémoral, long extenseur des doigts, soléaire et gastrocnémien) avec un scalpel (n° 21) et placez les muscles dans une boîte de Pétri sur de la glace.
- Utilisez une lame de scalpel fraîche (n° 21) pour émincer le tissu musculaire en morceaux de moins de 1 mm3 tout en gardant la boîte de Pétri sur de la glace.
- Regrouper le tissu musculaire haché des deux pattes arrière dans un tube en plastique de 50 mL contenant 12,5 mL de milieu de digestion musculaire (PBS + 2 mg/mL de collagénase IV + 2 mg/mL de dispase II + 2 mM de CaCl2).
- Placez le tube en plastique dans un bain-marie à 37 °C pendant 10 min. Agitez vigoureusement la solution et remettez-la en place pendant 10 minutes supplémentaires. Répétez jusqu’à ce que la solution semble homogène et qu’il ne reste que des morceaux (blancs) de tendon et de fascia (environ 4 x 10 min). Pendant ce temps, continuez avec l’isolement des fibroblastes tendineux ou l’isolement des macrophages.
- Ajoutez 12,5 ml de PBS froid + 10 % de FBS dans le tube en plastique pour arrêter la digestion.
- Utilisez un porte-pipette à piles équipé d’une pipette de 50 ml pour aspirer la suspension du tube en plastique. Équipez le tube en plastique d’une crépine à cellules de 400 μm et filtrez la suspension pour éliminer les débris. Répétez le processus avec une crépine de 100 μm.
- Centrifuger la suspension filtrée à 400 x g pendant 5 min à RT. Remettre en suspension dans 10 mL de PBS froid + 10 % FBS et centrifuger à nouveau.
- Remettre en suspension dans 8 mL de milieu de culture endothélial (mélange 1:1 de DMEM/F12 et de la trousse d’endopan 3 + 10 U/mL d’héparine + 20 % de FBS + 1 % de pénicilline/streptomycine + 1 % d’amphotéricine + 30 mg/mL de supplément de croissance endothéliale) complété par de la puromycine (4 mg/mL) pour la sélection de la population.
- Ensemencer les cellules d’une souris dans une fiole de culture T25 préalablement enduite de 2 mL d’une solution de gélatine stérile à 0,2 % pendant 2 h à 37 °C, puis séchée pendant une nuit à RT après avoir retiré l’excédent de solution. Préparez les flacons la veille de l’isolement.
- Après 24 h dans des conditions de culture standard (37 °C, 20 % O2), prélever le milieu de supplémentation en puromycine, laver les cellules fixées une fois avec du PBS et les cultiver dans 8 mL de milieu de culture endothélial.
- Passer les cellules 1:5 à 80 % de confluence dans des flacons recouverts de gélatine et les utiliser dans des expériences jusqu’à P2. Utilisez une solution de détachement cellulaire autre que la trypsine (Table des matières) pour retirer les cellules du plastique de culture tissulaire et ne les congelez pas.
- Isoler les macrophages dérivés de la moelle osseuse.
- Si les fibroblastes tendineux ou les cellules endothéliales ne sont pas isolés de la même souris, effectuez d’abord les étapes 1.5.1, 1.5.2, 1.6.2 et 1.6.3.
- Après avoir enlevé la peau, le tendon et les tissus musculaires, lavez les os restants (fémur et tibia) une fois dans du PBS froid (~4 °C).
- Placer les os dans du PBS frais et froid (~4 °C) et utiliser un scalpel (n° 21) pour couper progressivement les épiphyses jusqu’à ce que la moelle osseuse soit exposée. Il apparaît sous la forme d’un point rouge des deux côtés de l’os.
- Équiper une seringue d’une aiguille d’injection de 0,4 mm x 25 mm (G27) et la remplir de 10 mL de milieu de culture de macrophages (DMEM/F12 + 10 % FBS + 1 % pénicilline/streptomycine + 1 % d’amphotéricine + 1 % d’acides aminés non essentiels).
- Tenir un os après l’autre au-dessus d’un tube en plastique de 50 mL, insérer l’aiguille d’injection à environ 1 mm de profondeur dans la moelle osseuse exposée sur le dessus et rincer la moelle osseuse en vidant la seringue. La moelle osseuse évacuée apparaît comme une structure en forme de tube rougeâtre lorsqu’elle est suspendue dans le milieu.
- Dissoudre la moelle osseuse en la pipetant doucement de haut en bas à plusieurs reprises à l’aide d’une pointe de pipette de 1 ml. Utilisez un porte-pipette à piles équipé d’une pipette de 50 ml pour filtrer la suspension cellulaire à travers une crépine de 100 μm dans le tube en plastique de 50 ml et centrifugez-la à 350 x g pendant 5 min à RT.
- Retirer le surnageant, remettre la pastille en suspension dans 10 mL de tampon de lyse des globules rouges (GR) et centrifuger à nouveau à 350 x g pendant 10 min à température ambiante.
- Remettre la pastille en suspension dans 5 mL de milieu de culture de macrophages (DMEM/F12 + 10 % FBS + 1 % pénicilline/streptomycine + 1 % d’amphotéricine + 1 % d’acides aminés non essentiels) et l’ensemencer dans des boîtes de Pétri non traitées d’un diamètre de 100 mm (5-8 x 106 cellules par boîte).
- Après 4 h, ajouter 5 mL de milieu de culture de macrophages complété par 40 ng/mL de facteur de stimulation des colonies de macrophages (m-CSF) au milieu de culture cellulaire sans m-CSF (mélange 1:1) pour obtenir une concentration finale de 20 ng/mL de m-CSF.
- Après 6 jours, utilisez les cellules dans des expériences ou congelez-les jusqu’à nouvel ordre. Utilisez une solution de détachement cellulaire autre que la trypsine (Table des matières) pour retirer les cellules du plastique de culture tissulaire.
REMARQUE : Une fois isolées, les cellules ne se dilatent plus. Les méthodes d’isolement cellulaire décrites ici fonctionnent également avec des souris et des rats en dehors de la tranche d’âge indiquée.
- Pour vérifier le phénotype des populations cellulaires isolées par cytométrie en flux, passez à l’étape 6.3.4.
2. Isolement du collagène de rats Wistar ou Sprague-Dawley
- Suivez le protocole d’isolement décrit en détail ailleurs86. Il fonctionne également avec les souris, bien qu’avec un rendement beaucoup plus faible.
- Déterminer la concentration de la solution obtenue avec un test d’hydroxyproline, évaluer la pureté avec SDS-page et stocker la solution à 4 °C jusqu’à son utilisation dans les expériences.
3. Production des composants du système de culture
- Imprimez en 3D les supports de pince, la station de montage et les moules de la chambre.
- Chargez le fichier .stl joint (fichier supplémentaire 1) pour les supports de pince, la station de montage et les moules de la chambre dans le logiciel de tranchage. Pour adapter les numéros d’objet selon vos besoins, utilisez le pointer-cliquer pour sélectionner les objets et copiez-collez pour les multiplier.
- Appuyez sur Exporter le code G (Ctrl-R) pour générer le code G, puis exportez-le (Ctrl-G).
- Chargez le G-code dans une imprimante 3D.
- Utilisez des filaments non colorés et biocompatibles pour le processus d’impression (c’est-à-dire de l’acide polylactique).
- Coupez des filets de 3 mm dans les trous du support de pince qui portera les vis à l’aide d’un coupe-filet (Fichier supplémentaire 2 et Fichier supplémentaire 3, trous 1 et 3).
- Placez des goupilles en acier inoxydable dans le trou à l’arrière du support de pince (fichier supplémentaire 2 et fichier supplémentaire 3, trou 4).
- Stérilisez les supports de pince et la station de montage avec une lumière UV pendant au moins 1 h avant utilisation. Ne réutilisez pas les supports de pince imprimés en 3D.
- Vous pouvez également produire les supports de pinces et la station de montage avec du polyétherimide en utilisant les plans joints (fichier supplémentaire 2, fichier supplémentaire 3 et fichier supplémentaire 4), ce qui est plus coûteux mais permet de meilleures méthodes de stérilisation (c.-à-d. autoclavage) et une utilisation répétée.
- Coulez les chambres à l’aide des moules imprimés en 3D.
- Remplissez les moules de la chambre avec du silicone.
- Dégazer le silicone dans une chambre à vide (90 mbar) pendant 30 min.
- Laisser polymériser la solution à RT pendant une nuit ou sur une plaque chauffante à 70 °C pendant 1 h, en fonction de la résistance à la chaleur des filaments utilisés pour les moules.
- Retirez délicatement les chambres polymérisées des moules et coupez le silicone superflu avec un scalpel (n° 21).
- FACULTATIF : Si les assemblages et, par conséquent, les chambres environnantes doivent être chargés mécaniquement, renforcer les trous dans les chambres en silicone avec des tubes creux en acier inoxydable.
- Usinez les pinces métalliques en acier inoxydable à l’aide du plan ci-joint (fichier supplémentaire 5).
- Avant chaque utilisation, lavez les pinces en acier inoxydable, les supports de pinces en polyétherimide, les vis et la chambre en silicone.
- Sonicate pendant 10 min dans de l’éthanol à 80 % (EtOH) et de l’eau osmosée à 20 % (ROW).
- Sonicate pendant 10 min dans 50% d’EtOH et 50% d’Isopropanol.
- Rincer 3x avec ROW.
- Sonicate pendant 10 min dans un concentré de nettoyage alcalin à 0,5 % (c.-à-d. 3 mL dans 600 mL de ROW).
- Sonicate pendant 10 min dans un concentré de nettoyage alcalin à 0,5 %.
- Laisser agir le concentré de nettoyage alcalin à 0,5% en agitant pendant 1 h 50 min.
- Rincer 3x avec ROW.
- Sonicate pendant 10 min d’emboîtement.
- Séchez les composants à l’air libre et autoclavez-les.
4. Serrage des explants du noyau
- Placez les supports de pince assortis avec une pince métallique chacun dans la station de montage.
- Placez des morceaux de papier autoclave humide (4 mm x 25 mm) sur les pinces métalliques, puis coupez le papier le long des bords intérieurs des pinces avec un scalpel (n° 21). Découpez 2 autres morceaux de papier plus petits (4 mm x 1,5 mm) d’un autre morceau de papier et gardez-les humides.
- À l’aide d’une pince à épiler pointue, placez 8 explants de carottes sur le papier entre les pinces métalliques avec leurs extrémités sur les pinces métalliques.
- Couvrez les extrémités des explants de carottes avec les petits morceaux de papier préparés (4 mm x 1,5 mm), puis placez des pinces métalliques dessus. Utilisez un tournevis et les petites vis (M3 x 6 mm) pour fixer les explants du noyau entre les pinces métalliques et le support de pince.
- Transférez soigneusement les explants du noyau clampé dans les chambres de culture en silicone et remplissez ces chambres avec 2 mL de milieu de culture cellulaire standard (DMEM/F12 + 10 % FBS + 1 % pénicilline/streptomycine + 1 % d’amphotéricine + 1 % d’acides aminés non essentiels).
- FACULTATIF : Si les assemblages/chambres environnantes doivent être chargés mécaniquement, fixez-les avec des vis supplémentaires (M3 x 16 mm) dans le trou 3 (Fichier supplémentaire 2 et Fichier supplémentaire 3, trou 3).
5. Préparation et coulée d’hydrogel de collagène
- Retirer les cellules cibles du plastique de culture tissulaire avec la solution de détachement cellulaire, les centrifuger à 400 x g pendant 5 min à RT et les remettre en suspension dans 1 mL de milieu de culture standard.
- Pour un assembloïde, 10 μL de PBS (20x), 1,28 μL de 1 M de NaOH (125x), 8,72 μL d’eau doublement distillée (ddH2O, 23x), 80 μL de collagène-1 (2,5x ou 1,6 mg/mL final) et 100 μL (2x) de milieu de culture standard (pour les assembloïdes à noyau // acellulaires) ou de suspension cellulaire sont nécessaires. Préparez ces composants dans deux solutions distinctes et mélangez-les uniquement immédiatement avant la coulée.
- Solution de réticulation : Regrouper le PBS, le NaOH, le ddH20 et la suspension cellulaire de jusqu’à 12 assembloïdes (+marge de sécurité de 10 %) dans une solution de réticulation et la conserver dans un tube en plastique de 15 mL sur de la glace. Ajustez la concentration de la suspension cellulaire pour obtenir les concentrations finales suivantes après avoir mélangé les deux solutions : 250 000 cellules/mL de fibroblastes tendineux, 500 000 cellules/mL de cellules endothéliales dérivées de muscles ou 370 000 cellules/mL de macrophages dérivés de la moelle osseuse.
- Solution de collagène-1 : Regrouper la solution de collagène-1 nécessaire pour un maximum de 12 assembloïdes (+marge de sécurité de 10 %) dans un autre tube en plastique de 15 ml et la conserver sur de la glace.
- Une fois que la solution de réticulation et la solution de collagène-1 sont prêtes sur la glace, aspirer le milieu de culture cellulaire des chambres de culture contenant les explants à noyau serré.
- Ajoutez la solution de collagène-1 à la solution de réticulation avec une pipette de 1000 μL et mélangez les deux solutions en pipetant rapidement de haut en bas sans créer de bulles. Couvrir les explants de chaque noyau tendineux avec 200 μL de solution mélangée en les pipetant dans les rainures prévues par les chambres en silicone.
- Laissez les hydrogels polymériser pendant 50 min à 37 °C.
- Remplissez soigneusement les chambres de culture en silicone avec 1,5 ml du milieu de co-culture respectif en le pipetant dans les coins des chambres.
- Pour la co-culture de fibroblastes de base/fibroblastes, remplissez DMEM/F12, 10 % FBS, 1 % d’acides aminés non essentiels, 1 % de pénicilline/streptomycine, 1 % d’amphotéricine, 200 μM d’acide L-ascorbique, 20 ng/mL de facteur de stimulation des colonies de macrophages.
- Pour la co-culture de carottes // macrophages, remplir DMEM/F12, 10 % FBS, 1 % d’acides aminés non essentiels, 1 % de pénicilline/streptomycine, 1 % d’amphotéricine, 200 μM d’acide L-ascorbique, 20 ng/mL de facteur de stimulation des colonies de macrophages.
- Pour la co-culture de cellules endothéliales de base, remplissez le mélange 1:1 de DMEM/F12 et le kit endopan 3 + 10 U/mL d’héparine + 20 % de FBS + 1 % de pénicilline/streptomycine + 1 % d’amphotéricine + 30 mg/mL de supplément de croissance endothéliale.
- Cultivez les assembloïdes dans les conditions de culture appropriées à l’hypothèse. Pour imiter un environnement de niche semblable à une lésion, par exemple, cultivez-les à 37 °C et 20 %O2. Changez le milieu de culture deux fois en 1 semaine. Pour prévenir les infections, placez les chambres dans une grande boîte de Pétri ou une boîte stérile avant de les mettre dans un incubateur.
REMARQUE : Le temps de culture dépend de l’hypothèse et de la configuration de la co-culture. Par exemple, les assembloïdes de fibroblastes dans un environnement de niche semblable à une lésion deviennent mécaniquement instables après environ 3 semaines.
6. Méthodes de lecture disponibles
- Effectuer une microscopie à fluorescence, y compris des tests de viabilité et de morphologie.
- En général, les assembloïdes peuvent être imagés comme des montages complets. Pour ce faire, retirez les assemblages des pinces en les coupant avec des ciseaux près des pinces et en les transférant sur une plaque à 12 puits.
- Lavez les assembloïdes une fois avec du PBS.
- Si une analyse de viabilité est effectuée, colorer chaque assembloïde avec 100 μL d’homodimère d’éthidium 4 x 10−6 M dans du PBS (EthD-1) pendant 20 min à 37 °C dans l’obscurité.
- Lavez les assembloïdes 3 fois avec du PBS, puis fixez-les avec 500 μL de formaldéhyde à 4 % chacun pendant 20 min à RT.
ATTENTION : Le formaldéhyde à 4 % a des effets allergènes, cancérigènes et mutagènes, est toxique pour la reproduction et peut causer une toxicité pour le développement (reprotoxicité) ou des dommages aux organes. Portez des vêtements et des gants de protection, des lunettes de protection et un masque ou une autre protection respiratoire. - Lavez les assembloïdes 3x avec du PBS et continuez avec le protocole de coloration de votre choix. Une sélection de taches a été décrite précédemment84,85.
REMARQUE : Évitez les colorations qui utilisent des fluorophores dont la longueur d’onde d’émission est proche de celle de l’autofluorescence du collagène (environ 480 nm).
- Selon les instructions du fabricant, effectuez l’isolement de l’ARN spécifique au compartiment pour la RT-qPCR ou le séquençage de l’ARN à l’échelle du génome.
- Retirez les assemblages des pinces avec des ciseaux.
- FACULTATIF : Utilisez une pince à épiler pour séparer les explants du noyau du compartiment d’hydrogel extrinsèque.
- Pool 20-24 explants de 20 mm ou 2 hydrogels de collagène chargés de cellules pour isoler des quantités suffisantes d’ARN.
- Utilisez 1 mL de trizol froid et de perturbation mécanique (c’est-à-dire des billes métalliques ou un broyage cryogénique) pour détruire la matrice extracellulaire des explants de noyau ou des hydrogels de collagène regroupés.
ATTENTION : Toxicité orale, cutanée et par inhalation. Provoque une irritation de la peau et des yeux. Ne manipulez qu’avec des gants et dans une enceinte de sécurité chimique. - Poursuivre l’isolement de l’ARN du lysat cellulaire à l’aide de trousses d’extraction d’ARN standard décrites précédemment ou décrites dans les instructions du fabricant84,85.
- Cytométrie en flux spécifique au compartiment.
- Retirez les assemblages des pinces avec des ciseaux.
- FACULTATIF : Utilisez la pince à épiler pour séparer les explants du noyau du compartiment d’hydrogel extrinsèque.
- Digérer les compartiments dans 1 mL de PBS avec la collagénase I (3 mg/mL) et la dispase II (4 mg/mL) pendant 4 h à 37 °C sous agitation constante.
- Centrifuger la solution digérée à 500 x g pendant 5 min à RT et aspirer le surnageant.
- Remettre la pastille en suspension dans 100 μL de tampon FACS (1 % FBS dans PBS) contenant les anticorps conjugués au fluorophore de votre choix. Une sélection d’anticorps conjugués aux fluorophores fonctionnels a été décrite précédemment84,85.
- Incuber la solution de coloration pendant 30 min à RT.
- Diluer la solution de coloration avec 1,4 mL de tampon FACS et la centrifuger pendant 5 min à 500 x g à RT.
- Remettre la pastille en suspension dans 350 μL de tampon FACS et filtrer la solution à travers un capuchon de crépine en maille de nylon de 100 μm avant de l’analyser avec le cytomètre en flux de votre choix selon les instructions du fabricant.
- Analysez le surnageant.
- Remplacer le milieu de coculture par un milieu de coculture sans sérum 3 jours avant le prélèvement surnageant.
- Effectuez une analyse immédiate et différée du surnageant enrichi et non dilué avec des kits de test immuno-enzymatique (ELISA) et de découverte à méso-échelle (MSD). Pour l’analyse retardée, conserver le surnageant dans des tubes en plastique de 1,5 mL à -80 °C.
- Évaluer les propriétés mécaniques de l’assemblage.
- Utiliser un dispositif d’étirement sur mesure pour appliquer des forces mécaniques et mesurer les propriétés mécaniques22. Les goupilles en acier inoxydable et les vis en acier inoxydable permettent également de fixer les pinces à d’autres appareils d’étirement.
- Comme les propriétés mécaniques de l’assembloïde sont largement déterminées par celles de l’explant de noyau intégré 18, mesurez les propriétés mécaniques de l’explant de noyau avant de l’intégrer dans un hydrogel afin de réduire le risque de destruction de l’hydrogel fraîchement coulé dans le processus de mesure.
Résultats
Isolation des composants (Figure 1 et Figure 2)
Avant d’utiliser les explants de base et les populations cellulaires en co-culture assembloïde, ces composants doivent être vérifiés au microscope (Figure 1). Les explants de carottes doivent avoir un diamètre uniforme (100-200 μm) et ne pas présenter de plis ou de rides visibles. Les cellules endothéliales doivent présenter une forme allongée au contact d’autres cellules, ce qui n’est pas le cas lorsqu’elles sont ensemencées à une densité trop faible en raison d’un faible rendement initial de l’isolement. Dans ce cas, les cellules endothéliales prennent une forme plus arrondie avec des extensions cytosquelettiques et prolifèrent nettement plus lentement. Divisez-les 1:5 après 7 à 10 jours. Les fibroblastes tendineux isolés des tendons d’Achille prennent une morphologie plus arrondie par rapport à leurs homologues humains en 1 à 2 passages (10 à 14 jours chacun) lorsqu’ils ont été divisés 1:6. Les macrophages sont beaucoup plus petits que les fibroblastes ou les cellules endothéliales et ne prolifèrent pas après l’isolement. Selon le lot, leur forme peut varier de pyramidale à ronde.
Les phénotypes des composants cellulaires ont été vérifiés par cytométrie en flux. Un anticorps conjugué CD31 a été utilisé comme marqueur pour les cellules endothéliales (Figure 2A). En fixant le seuil de fluorescence sur la base d’un échantillon de contrôle non coloré (gris), 90,1 % des cellules endothéliales du passage 1 (P1) et 48,7 % des cellules endothéliales du passage 2 (P2) ont été identifiées comme CD31-positives. Une lignée de souris génétiquement modifiée co-exprimant le marqueur de fibroblastes tendineux Scleraxis avec une protéine fluorescente verte (ScxGFP) et un anticorps conjugué CD146 a été utilisée pour caractériser les fibroblastes tendineux (Figure 2B)35,60. Après un passage (P1), 37,3 % des fibroblastes étaient ScxGFP+CD146-, 0,2 % étaient ScxGFP+CD146+, 4,3 % étaient ScxGFP-CD146+ et 58 % étaient ScxGFP-CD146-. Après deux passages (P2), le pourcentage de cellules ScxGFP+CD146- a diminué à 27,6 %, le pourcentage de cellules ScxGFP+CD146+ est passé à 6,9 %, le pourcentage de cellules ScxGFP-CD146+ a augmenté à 10,6 % et le pourcentage de cellules ScxGFP-CD146- a diminué à 54,9 %. Pour identifier et caractériser les macrophages, un anticorps F4/80 a été utilisé en combinaison avec un anticorps CD86 et un anticorps CD206 (Figure 2C). Après isolement et culture, 96,4 % des cellules dérivées de la moelle osseuse étaient F4/80 positives. Parmi ces cellules F4/80 positives, 8,6 % étaient CD206+CD86-, 23,6 % étaient CD206+CD86+, 28,3 % étaient CD206-CD86+ et 39,4 % étaient CD206-CD86-. La vitesse de réticulation du collagène peut varier d’un lot à l’autre et doit être testée avant de commencer les expériences.
Apparence de l’assembloïde (Figure 3)
Dans des conditions de culture semblables à des lésions (36 °C, 20 %O2), l’explant du noyau est resté mécaniquement extensible, n’a pas changé d’apparence et a continué à être visuellement distinguable et physiquement séparable de l’hydrogel environnant pendant au moins 21 jours (Figure 3A,B). L’hydrogel environnant a été compacté au fil du temps, la vitesse de compactage dépendant de la population cellulaire qui y est ensemencée. Les fibroblastes dérivés du tendon d’Achille contractaient l’hydrogel environnant le plus rapidement et le faisaient radialement lorsqu’ils étaient dans un hydrogel moulé autour d’un explant de noyau et dans toutes les directions lorsqu’ils ne le faisaient pas (Figure 3B,C). Initialement, les hydrogels acellulaires placés autour d’un explant central se compactaient également. Cette contraction a probablement été causée par la migration des cellules de l’explant central, indiquant une interface intercompartimentale dynamique. Comme les hydrogels acellulaires sans explant de noyau intégré ne se sont pas compactés de manière détectable, la contribution du rétrécissement induit par la perte d’eau semble négligeable (figure 3B et fichier supplémentaire 6).
Un manque de compactage de l’hydrogel peut donc être utilisé pour détecter des erreurs dans l’assemblage de l’assembloïde (c’est-à-dire de faibles concentrations cellulaires) et doit être vérifié avant de poursuivre avec des méthodes de lecture plus coûteuses. Lors de la mise en place de cette méthode, les erreurs courantes de réduction de la concentration cellulaire comprenaient la mort des cellules dans l’hydrogel extrinsèque parce qu’elles étaient laissées trop longtemps dans la solution de réticulation relativement dure (pH élevé, basse température) et le séchage des explants de noyau parce que le temps entre l’aspiration moyenne et l’injection d’hydrogel était trop long, ou parce que l’explant de noyau était serré trop haut pour être incorporé dans le collagène.
Microscopie confocale à fluorescence : analyse de la viabilité et de la morphologie (Figure 3)
Une fois retirés des pinces avec des ciseaux (Figure 3B), les assemblages peuvent être fixés, colorés et imagés avec un microscope confocal dans son ensemble sans section. Ici, des assembloïdes de carottes // cellules endothéliales, carottes // macrophages et carottes // fibroblastes ont été colorés avec du DAPI (NucBlue) et de l’Ethidium Homodimer (EthD-1) pour analyser la viabilité et du DAPI et de l’actine F pour analyser la morphologie et la propagation cellulaire dans l’hydrogel de collagène 3D (Figure 3D). La viabilité des assembloïdes de cellules endothéliales (Figure 3E) a été quantifiée et s’est avérée généralement plus faible après assemblage des assembloïdes que celle rapportée précédemment pour les assembloïdes de macrophages et de fibroblastes84. Cependant, la viabilité est restée stable pendant la culture assembloïde jusqu’au moins au jour 7.
Microdommages d’origine mécanique et mesure des propriétés mécaniques (Figure 4)
Les vis et les goupilles fixées aux supports de serrage permettent la fixation d’assemblages serrés sur des dispositifs d’étirement uniaxiaux. Le dispositif d’étirement sur mesure utilisé ici est équipé d’un capteur de pesage de 10 N et a été décrit dans des publications précédentes (Figure 4A)22. Tous les échantillons ont été préconditionnés avec cinq cycles d’étirement à 1 % de déformation avant les mesures.
L’enregistrement de la courbe contrainte-déformation complète des explants ou des assembloïdes du noyau (Figure 4B) permettrait de quantifier le module d’élasticité linéaire (α), la contrainte maximale (β) et la déformation maximale (у). Cependant, il endommage également de manière irréversible l’explant du noyau ou l’assembloïde, ce qui rend impossible l’évaluation du développement longitudinal de la contrainte maximale (β) et de la déformation maximale (у) pour les mêmes échantillons (Figure 4B). Ici, le module d’élasticité linéaire a été utilisé comme mesure de la capacité de l’échantillon à résister aux forces, car cette mesure nécessite d’étirer l’échantillon à seulement 2 % de déformation, ce qui a été démontré précédemment comme n’entraînant pas de réduction permanente du module d’élasticité linéaire18. En particulier, les assembloïdes de cellules endothéliales ont été exposés à la procédure de serrage à une déformation de 2 % (environ la fin de la région élastique linéaire) ou de 6 % (environ la déformation maximale). Les microdommages qui en résultent ont été évalués en mesurant le module d’élasticité linéaire avant et après l’intervention (figure 4C).
Conformément aux expériences précédemment menées exploitant des explants de carottes en monoculture, les assembloïdes de cellules endothéliales ont conservé leur module d’élasticité linéaire pendant au moins 14 jours lorsqu’ils ont été cultivés dans des conditions de niche quasi-homéostatiques (29 °C, 3 %O2) et exposés à des souches ne dépassant pas 2 %18,21. En ce qui concerne la stimulation mécanique de base, l’étirement statique appliqué à travers les pinces semblait imiter suffisamment les niveaux de déformation natifs subis par les unités centrales tendineuses in vivo pour empêcher les processus cataboliques généralement associés à la décharge matricielle87. En effet, le déclin progressif et statistiquement significatif du module d’élasticité linéaire observé dans les assembloïdes de cellules endothéliales du noyau // exposés à une déformation de 6% pourrait être attribué à la décharge de la matrice résultant de microdommages de matrice induits mécaniquement.
Lors de la réalisation de ces expériences, il est important d’éviter le dessèchement de l’assembloïde. Ici, ils étaient enfermés dans du papier autoclavé et mouillé, mais d’autres méthodes pouvaient également être viables en fonction de leur compatibilité avec le dispositif d’étirement utilisé. Comme le frottement entre les pinces métalliques et l’explant du noyau est limité, ajoutez de petits morceaux de papier entre le métal et l’explant du noyau pendant le serrage pour éviter le glissement et surveillez de près le processus d’étirement pour détecter et exclure les explants et les assembloïdes glissés.
Analyse du transcriptome spécifique au compartiment et du sécrétome spécifique à l’assembloïde (Figure 5 et Figure 6)
Dans la première série d’expériences de monoculture de base présentées ici, la stabilité de l’expression des gènes de base après isolement d’explant a été évaluée pour découpler l’isolement des effets expérimentaux (Figure 5A). Bien qu’un nombre plus élevé de répétitions soit nécessaire pour des conclusions précises, l’expression de Vegfa et de Mmps a fortement augmenté dans les explants de carottes fraîchement isolés dans les heures qui ont suivi l’isolement de l’explant lorsqu’ils ont été cultivés dans des conditions de niche semblables à des lésions (37 °C, 20 %O2).
La néovascularisation est une caractéristique centrale de la maladie et de la réparation des tendons qui pourrait, en partie, être entraînée par les cellules endothéliales activées par des facteurs pro-angiogéniques (c’est-à-dire le facteur de croissance de l’endothélium vasculaire, Vegfa) sécrétés par le noyau tendineux sous hypoxie88. En examinant la première étape de cette diaphonie potentielle (Figure 5B), l’expression de Vegfa et du marqueur d’hypoxie anhydrase carbonique 9 (Ca9) s’est avérée statistiquement significative chez les explants en monoculture sous faible tension d’oxygène (3 %O2) par rapport à ceux en monoculture sous forte tension d’oxygène (20 % O2). Pendant ce temps, la tension d’oxygène plus faible ne semblait pas provoquer de changements dans l’expression des marqueurs des fibroblastes tendineux tels que la sclérosie (Scx) et le collagène-1 (Col1a1). Ensemble, ces résultats identifient les cellules résidentes du noyau comme des contributeurs plausibles à la signalisation pro-angiogénique dans une niche hypoxique.
Ensuite, l’activation des cellules endothéliales par la signalisation pro-angiogénique a été évaluée dans la co-culture d’assembloïdes de cellules endothéliales sous une tension d’oxygène élevée (20 % O2) et faible (3 % O2). Heureusement, la composition modulaire des assembloïdes permet une analyse du transcriptome spécifique au compartiment après culture en séparant physiquement l’explant central de l’hydrogel de collagène extrinsèque (Figure 6A). Dans l’explant de base (Figure 6D), l’expression de Vegfa a de nouveau été confirmée comme augmentant sous une faible tension d’oxygène, bien que l’effet sur d’autres marqueurs hypoxiques tels que Fgf2 soit moins clair et nécessite un nombre de répétitions plus élevé pour des conclusions précises. De plus, l’expression de marqueurs pro-inflammatoires tels que Tnf-α et de marqueurs de dégradation de la matrice extracellulaire tels que Mmp3 ont été diminués dans le noyau sous une faible tension d’oxygène. Dans l’hydrogel extrinsèque initialement ensemencé avec des cellules endothéliales (Figure 6E), la présence d’un explant de noyau vivant (aC) a diminué l’expression de Vegfa sous une faible tension d’oxygène, mais pas sous une tension d’oxygène élevée. De plus, la présence d’un explant de noyau dévitalisé (dC) sous faible tension d’oxygène n’a pas non plus diminué l’expression du Vegfa . Sous une faible tension d’oxygène, l’expression de Tnf-α dans l’hydrogel extrinsèque était comparable autour de aC/dC mais augmentait sous une tension d’oxygène élevée autour des explants de noyau vivants. L’expression de Fgf2 a diminué dans toutes les conditions par rapport à l’hydrogel extrinsèque chargé de cellules endothéliales cultivé autour d’un explant de noyau dévitalisé sous haute tension d’oxygène, mais la plupart sous une faible tension d’oxygène. L’expression de Mmp3 était la plus élevée autour des explants vivants sous haute tension d’oxygène et la plus faible autour des explants dévitalisés sous faible tension d’oxygène. Dans l’ensemble, les cellules endothéliales co-cultivées semblent sensibles à la fois à l’explant central actif, qui est capable d’initier la diaphonie et les variations des niveaux d’oxygène. Une analyse plus complète du transcriptome faciliterait l’élucidation de leurs contributions respectives.
La modularité du système assembloïde permet l’intégration de cellules génétiquement modifiées contenant des gènes rapporteurs fluorescents. Ici, des cellules endothéliales isolées de souris Pdgfb-iCreER mG89 ont été ensemencées dans le compartiment hydrogel. Ces cellules co-expriment la sous-unité b du facteur de croissance dérivé des plaquettes (Pdgfb), marqueur des cellules endothéliales, avec la protéine fluorescente verte améliorée (EGFP), ce qui fait apparaître les cellules endothéliales exprimant Pdgfb en vert à la microscopie (Figure 6C). En utilisant cette méthode, la présence de cellules endothéliales exprimant le Pdgfb a été confirmée comme étant maintenue pendant 7 jours en culture (37 °C) et semblait être indépendante de la tension de l’oxygène (20 % O2 contre 3 % O2).
Pour analyser le sécrétome des assembloïdes, le milieu de culture utilisé respectivement pour la co-culture de carottes // acellulaires et de carottes // fibroblastes, de carottes // macrophages ou de carottes de cellules endothéliales a été remplacé par son homologue sans sérum trois jours avant l’aspiration et la congélation du surnageant maintenant enrichi en sécrétome (Figure 6A). Ce temps d’enrichissement a été suffisant pour détecter des cytokines telles que le facteur de croissance de l’endothélium vasculaire (VEGF) avec un test MSD, comme le montre ici pour les explants de carottes et les assembloïdes de fibroblastes de carottes // cultivés dans des conditions de niche de type lésionnel (Figure 6B).
Des considérations importantes lors de l’analyse des sécrétomes et des transcriptomes des explants et des assembloïdes de carottes concernent l’utilisation de contrôles appropriés. Les explants de carottes fraîchement isolés ont une valeur limitée, car leur expression de Vegfa et de Mmps augmente fortement dans les heures qui suivent l’isolement (Figure 5A). Les explants appariés dans le temps entourés d’un hydrogel initialement acellulaire sont plus appropriés comme témoins de l’expression génique du compartiment central. Pour l’hydrogel extrinsèque, les hydrogels chargés de cellules cultivés sans explant de noyau sont des témoins inférieurs par rapport aux hydrogels chargés de cellules cultivés autour d’explants de noyau dévitalisé (fichier supplémentaire 7), principalement parce qu’ils se compactent en formes arrondies au lieu d’hydrogels allongés, ce qui modifie considérablement la morphologie cellulaire (Figure 3A).
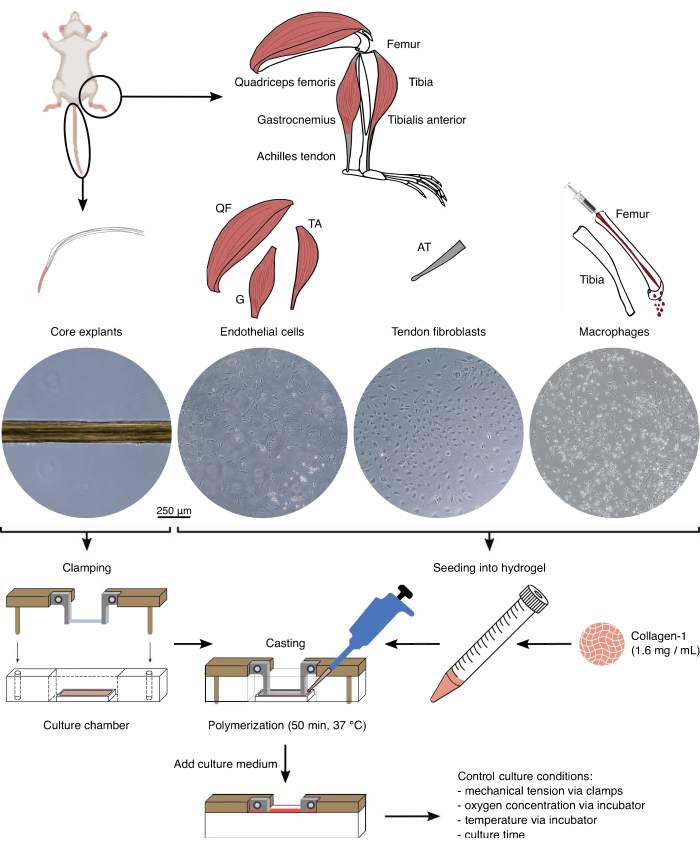
Figure 1 : Isolation et assemblage de composants assembloïdes pour modéliser la diaphonie in vivo. Des explants de noyau de tendon ont été extraits de queues de souris, coupés et serrés. Les muscles des pattes de souris (c.-à-d. quadriceps fémoral (QF), gastrocnémien (G) et tibial antérieur (TA)) ont été digérés pour isoler les cellules endothéliales qui ont ensuite été cultivées sur du plastique de culture tissulaire. Les tendons d’Achille (AT) ont également été digérés pour isoler les fibroblastes tendineux, qui ont ensuite été cultivés sur du plastique de culture tissulaire. La moelle osseuse du tibia et du fémur a été évacuée des os. Ensuite, les monocytes isolés ont été cultivés sur du plastique de culture tissulaire et différenciés en macrophages naïfs. Les images de microscopie optique (10x) montrent l’apparition d’explants de noyaux, de cellules endothéliales, de fibroblastes tendineux et de macrophages immédiatement avant leur intégration dans les assembloïdes. Lors de l’assemblage, les cellules cultivées sur plastique ont été mises en suspension, puis ensemencées dans une solution de collagène-1 (1,6 mg/mL). Ensuite, le mélange cellule-hydrogel a été coulé autour de l’explant de noyau serré et polymérisé pendant 50 min à 37 °C avant d’ajouter du milieu de culture. Les conditions de culture ont été contrôlées via les pinces (tension mécanique) et les réglages de l’incubateur (concentration en oxygène, température). Veuillez cliquer ici pour voir une version agrandie de cette figure.
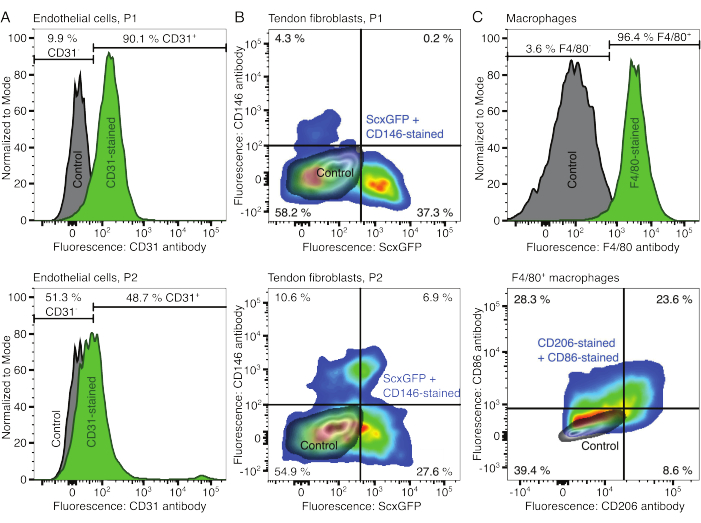
Figure 2 : Caractérisation des composants assembloïdes cellulaires. (A) Analyse cytométrique en flux représentative des cellules endothéliales dérivées du muscle après un passage (P1, rangée du haut) et deux passages (P2, rangée du bas). Le nombre de cellules non colorées (grises) et de CD31 (vertes) a été normalisé en modal. Les pourcentages sont donnés pour le groupe coloré au CD31. (B) Analyse cytométrique en flux représentative des fibroblastes dérivés du tendon d’Achille après un passage (P1, rangée du haut) et deux passages (P2, rangée du bas). Les axes rapportent les intensités de fluorescence des cellules non colorées (gris) et des cellules exprimant ScxGFP et colorées avec des anticorps CD146 (couleurs arc-en-ciel). (C) Analyse cytométrique en flux représentative des macrophages dérivés de la moelle osseuse après culture. Dans la rangée du haut, le nombre de cellules non colorées (grises) et colorées en F4/80 (vert) a été normalisé en modal. Les pourcentages sont donnés pour le groupe coloré F4/80. Le graphique de la ligne du bas indique les intensités de fluorescence des cellules non colorées (gris) et du sous-ensemble F4/80+ de cellules colorées avec des anticorps CD206 et des anticorps CD86 (couleurs arc-en-ciel). Veuillez cliquer ici pour voir une version agrandie de cette figure.
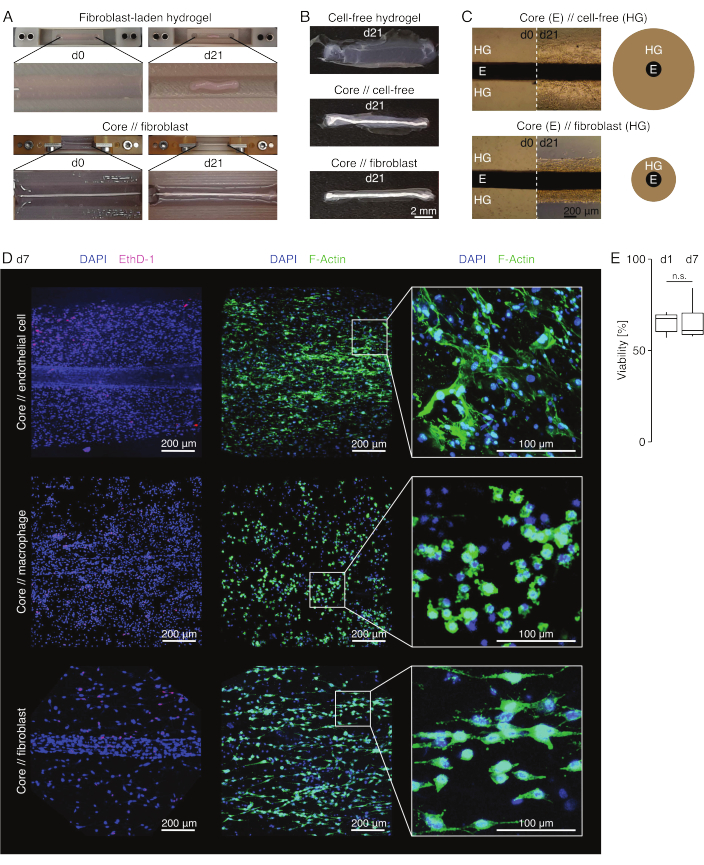
Figure 3 : Imagerie et apparence des assembloïdes. (A) Des photographies représentatives prises au jour 0 (j0) et au jour 21 (j21) de culture (37 °C, 20 %O2) montrent une contraction multidimensionnelle d’un hydrogel contenant des fibroblastes extrinsèques sans explant de noyau intégré et une forte compaction radiale d’un hydrogel contenant des fibroblastes extrinsèques autour d’un explant de noyau. (B) Des photographies représentatives prises au jour 21 (j21) de la culture (37 °C, 20 %O2) montrent des différences de vitesse de compactage entre les hydrogels acellulaires, les hydrogels acellulaires coulés autour d’un explant de noyau et les hydrogels chargés de fibroblastes tendineux coulés autour d’un explant de noyau. (C) Les images représentatives de microscopie optique (10x) prises au jour 0 (j0) et au jour 21 (j21) de culture (37 °C, 20 %O2) indiquent des changements longitudinaux dans la présence de populations cellulaires et la vitesse de compactage de l’hydrogel de collagène (HG) autour de l’explant de cœur (E) en co-culture d’assembloïdes de noyau // acellulaire et de noyau // assembloïde de fibroblastes. La représentation schématique illustre les différences de compactage de l’hydrogel entre la co-culture d’un assembloïde libre de noyau // acellulaire et d’un noyau // assembloïde de fibroblastes. (D) Images représentatives de microscopie confocale prises au jour 7 (j7) de la co-culture d’assembloïdes de carottes // cellules endothéliales, carottes // macrophages et carottes // assembloïdes de fibroblastes (37 °C, 20 %O2). Les images de la rangée de gauche montrent des assembloïdes avec des noyaux cellulaires colorés en bleu (DAPI) et des cellules mortes colorées en rose (Ethidium homodimère-1). Les deux autres rangées représentent des assembloïdes avec des noyaux cellulaires colorés en bleu (DAPI) et des filaments d’actine en vert (F-actine). (E) Boîtes à moustaches illustrant la viabilité quantifiée des assembloïdes de cellules endothéliales principales au jour 1 (j1) et au jour 7 (j7) de la coculture. N = 5. Les charnières supérieure et inférieure correspondent aux premier et troisième quartiles (25e et 75e percentiles) et celle du milieu à la médiane. Les moustaches s’étendent de la charnière supérieure/inférieure à la valeur la plus grande/la plus petite ne dépassant pas 1,5 fois l’écart interquartile. Valeurs p : n.s.p > 0,05. Veuillez cliquer ici pour voir une version agrandie de cette figure.
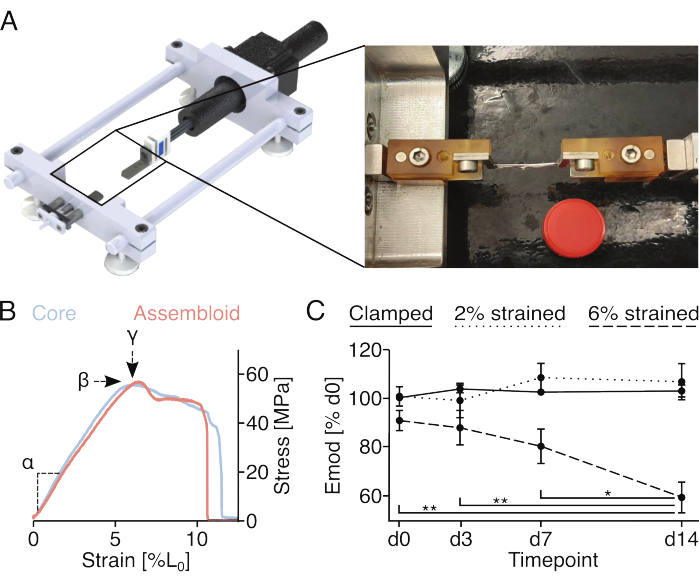
Figure 4 : Stimulation mécanique des assembloïdes et mesure des propriétés mécaniques des assembloïdes. (A) Représentation graphique du dispositif d’étirement sur mesure comprenant les plates-formes porte-pinces, un capteur de force et un moteur pas à pas. L’image photographique montre un ensemble monté sur le dispositif d’étirement avec des pinces. Le couvercle d’un tube en plastique de 15 mL (Ø : 17 mm) utilisé pour le tartre. (B) Graphique illustrant les courbes de contrainte/déformation représentatives pour les explants de carottes (bleu clair) et les assembloïdes (rouge clair). Le module d’élasticité linéaire (α), la contrainte maximale (β) et la déformation maximale (у) peuvent être extraits des données pour caractériser mécaniquement l’explant ou l’assemblage du noyau. (C) Graphique montrant le module d’élasticité linéaire (Emod) d’assemblages de cellules endothéliales co-cultivées (29 °C, 3 % O2) sur une période de 14 jours après avoir été clampés (ligne continue), serrés et étirés à 2 % de déformation L0 (ligne pointillée), ou serrés et étirés à 6 % de déformation L0 (ligne pointillée) au début de l’expérience. N = 5. Les points de données ont été normalisés au module d’élasticité linéaire du module initial avant l’étirement et sont tous affichés sous forme de moyenne (±sem). Valeurs de p : *p < 0,05, **p < 0,01. Veuillez cliquer ici pour voir une version agrandie de cette figure.
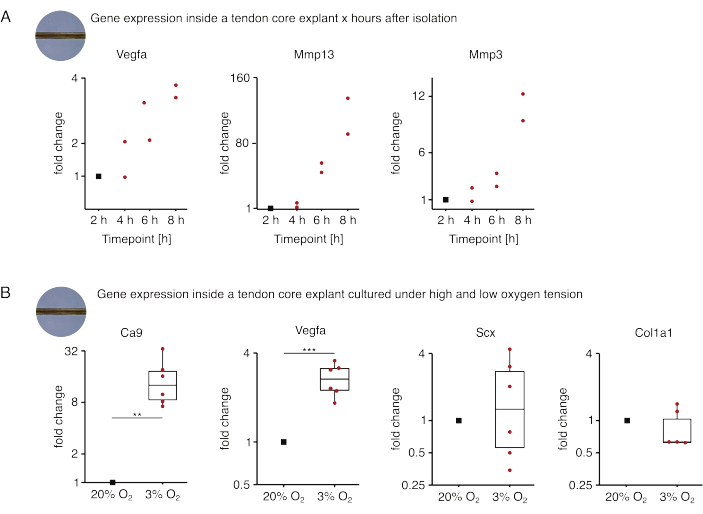
Figure 5 : Changements dans le transcriptome du noyau après isolement et culture dans différentes conditions de niche. (A) Nuage de points illustrant les changements de pli dans l’expression des gènes Vegfa, Mmp13 et Mmp3 dans des explants de noyau murin en monoculture (37 °C, 20 % O2) 2 h, 4 h, 6 h et 8 h après les avoir isolés de la queue. Les changements de pli aux points temporels respectifs ont été normalisés à l’expression génique 2 heures après l’isolement. N = 2. (B) Boîtes à moustaches illustrant les changements de pli dans l’expression des gènes Ca9, Vegfa, Scx et Col1a1 dans les explants de carottes mono-cultivés sous faible tension d’oxygène (3%O2) normalisés et comparés à ceux mono-cultivés sous haute tension d’oxygène (20%O2). N = 5-6. Les charnières supérieure et inférieure des boîtes à moustaches correspondent aux premier et troisième quartiles (25e et 75e percentiles) et celle du milieu à la médiane. Les moustaches s’étendent de la charnière supérieure/inférieure à la valeur la plus grande/la plus petite ne dépassant pas 1,5 fois l’écart interquartile. Les points de données utilisés pour la normalisation sont représentés par des points noirs et les points de données individuels par des points rouges. Valeurs P : **p < 0,01, ***p < 0,001. Veuillez cliquer ici pour voir une version agrandie de cette figure.
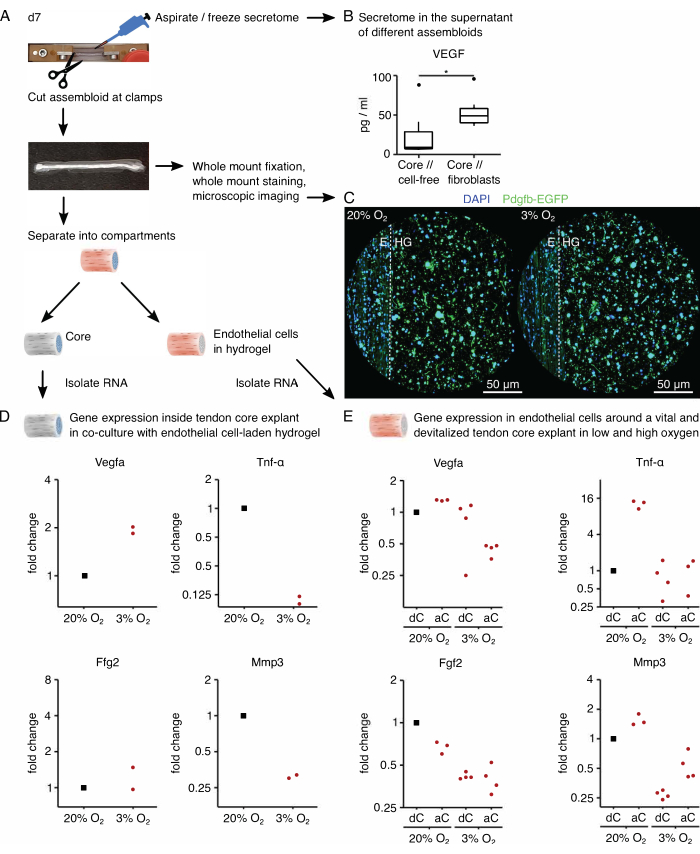
Figure 6 : Analyse du sécrétome spécifique à l’assembloïde et du transcriptome spécifique au compartiment. (A) Photographie représentative montrant l’assembloïde au jour 7 (j7), lorsque des échantillons de sécrétome et de transcriptome ont été prélevés, et représentation du flux de travail sous-jacent. (B) Concentration de VEGF (pg/mL) dans le surnageant des assembloïdes de noyau // acellulaire et de noyau // fibroblastes après 7 jours de coculture (37 °C, 20 %O2) représentés sous forme de boîtes à moustaches. N = 6. (C) Images représentatives en microscopie confocale d’assembloïdes de cellules centrales / endothéliales après 7 jours de co-culture (37 °C) sous haute tension d’oxygène (20 %O2) et faible tension d’oxygène (3 %O2). Les noyaux cellulaires sont colorés en bleu (DAPI) et les cellules endothéliales intégrées co-expriment la protéine fluorescente verte améliorée (EGFP) avec le marqueur du facteur de croissance dérivé des plaquettes (Pdgfb). La ligne pointillée indique l’interface compartimentale entre l’explant central (E) et l’hydrogel chargé de cellules endothéliales (HG). (D) Nuage de points illustrant les changements de pliage dans l’expression des gènes Vegfa, Tnf-α, Fgf2 et Mmp3 dans le compartiment central des assembloïdes de cellules endothéliales co-cultivés sous faible tension d’oxygène (3 %O2) normalisés et comparés à ceux cultivés sous haute tension d’oxygène (20 %O2). N = 2. (E) Nuage de points illustrant les changements de pliage dans l’expression des gènes Vegfa, Tnf-α, Fgf2 et Mmp3 dans le compartiment extrinsèque des assembloïdes de cellules endothéliales du noyau // avec un noyau vivant (aC) ou un noyau dévitalisé (dC) co-cultivés sous une tension d’oxygène élevée (20 %O2) et une faible tension d’oxygène (3 %O2). Les changements de plis dans les conditions respectives ont été normalisés au compartiment extrinsèque d’un noyau // assembloïde de cellules endothéliales avec un noyau dévitalisé (dC) co-cultivé sous haute tension d’oxygène (20% O2). N = 3-4. Dans B, les charnières supérieure et inférieure des boîtes à moustaches correspondent aux premier et troisième quartiles (25e et 75e percentiles) et celle du milieu à la médiane. Les moustaches s’étendent de la charnière supérieure / inférieure à la valeur la plus grande / la plus petite pas plus de 1,5 fois l’écart interquartile. Les valeurs aberrantes sont représentées par des points noirs. Valeurs p : *p < 0,05. En D et E, les points de données utilisés pour la normalisation sont représentés par des points noirs et les points de données individuels sont représentés par des points rouges. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Tableau 1 : Exigences en matière d’intrants pour les systèmes modèles de maladies et de blessures tendineuses. Une liste de déclencheurs de maladies tendineuses primaires et de moteurs secondaires correspondant à une sélection de paramètres d’entrée dont la traçabilité est essentielle pour la modélisation des maladies et des lésions tendineuses. Veuillez cliquer ici pour télécharger ce tableau.
Tableau 2 : Exigences de production pour les systèmes modèles de maladies et de blessures tendineuses. Une sélection de caractéristiques de maladies tendineuses appariées à une sélection de paramètres de sortie dont la quantifiabilité est essentielle pour l’interprétation du comportement des modèles de maladies et de lésions tendineuses. Veuillez cliquer ici pour télécharger ce tableau.
Fichier supplémentaire 1 : fichier .stl pour les supports de pinces, la station de montage et les moules de la chambre. Veuillez cliquer ici pour télécharger ce fichier.
Dossier supplémentaire 2 : Plan du support de pince droit. Veuillez cliquer ici pour télécharger ce fichier.
Dossier supplémentaire 3 : Plan du support de pince gauche. Veuillez cliquer ici pour télécharger ce fichier.
Dossier supplémentaire 4 : Plan de la plate-forme de montage Veuillez cliquer ici pour télécharger ce fichier.
Dossier supplémentaire 5 : Plan des pinces métalliques. Veuillez cliquer ici pour télécharger ce fichier.
Fichier supplémentaire 6 : Image montrant le rétrécissement de l’hydrogel acellulaire. Veuillez cliquer ici pour télécharger ce fichier.
Dossier supplémentaire 7 : Image montrant un explant de noyau dévitalisé. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
Dans l’ensemble, le système de modèles assembloïdes présenté ici comporte plusieurs étapes critiques à souligner. Premièrement, la qualité du système modèle dépend de la qualité de ses composants. Il est essentiel de vérifier l’explant du noyau et les populations cellulaires à ensemencer au microscope avant de lancer le processus d’assemblage. Il est également important de vérifier le phénotype des populations cellulaires isolées au moins une fois par cytométrie en flux. En particulier lorsqu’un nouveau lot de collagène-1 est utilisé pour la première fois, il est avantageux de vérifier la vitesse de réticulation lors d’un essai avant d’y intégrer des cellules. L’assemblage assembloïde nécessite beaucoup de manutention manuelle, ce qui augmente le risque d’infections. Pour minimiser le risque d’infections, travaillez dans une cagoule de biosécurité stérile avec un flux d’air laminaire, changez souvent de gants et décontaminez les gants ainsi que l’espace de travail avec de l’éthanol à 80 %. Pour des raisons similaires, n’utilisez pas les porte-pinces imprimés en 3D plus d’une fois. Avant le processus d’enrobage lui-même, il est important de garder tous les composants de l’hydrogel (solution de réticulation, solution de collagène-1) sur de la glace pour éviter une réticulation prématurée. Par conséquent, il faut travailler rapidement une fois que les cellules sont ajoutées à la solution de réticulation pour limiter la mort cellulaire due au pH élevé et à la basse température de la solution de réticulation. Pour éviter la mort cellulaire liée au dessèchement dans l’explant de noyau, aspirez le milieu recouvrant les explants de noyau clampé immédiatement avant de mélanger la solution de réticulation avec la solution de collagène-1. Pour garantir le placement central de l’explant de noyau dans l’hydrogel, il est idéal de couler l’hydrogel autour d’un explant de noyau serré et légèrement tendu. Pour ce faire, utilisez la goujon et la vis à boulon M3 x 16 mm pour fixer les supports de serrage à un jeu de plaques (imprimées en 3D) avec des trous aux longueurs appropriées. Après le temps de polymérisation de 50 minutes, l’explant de noyau intégré peut être à nouveau détendu en fonction des conditions de culture souhaitées. La tension subie par l’assemblage pendant la culture a un impact profond sur les résultats expérimentaux et doit être maintenue uniforme entre les échantillons et les conditions21.
Néanmoins, l’impact important de la (dé)charge mécanique sur les résultats expérimentaux est un avantage majeur du modèle assembloïde par rapport à la plupart des alternatives d’ingénierie tissulaire, d’autant plus que la composition matricielle maintenue de l’explant central devrait également recréer les modèles complexes de charge in vivo au niveau cellulaire90. Alors qu’en pratique, seules les mesures du module d’élasticité linéaire, de la déformation maximale en traction et de la contrainte de traction maximale des assembloïdes ont été démontrées jusqu’à présent, des protocoles de mesure de la résistance à la fatigue et de la relaxation des contraintes ont été décrits ailleurs pour les explants de noyau de tendon et devraient être applicables aux assembloïdes91,92. En plus des modèles de chargement in vivo, la modularité à plusieurs niveaux de l’assembloïde est probablement son plus grand avantage. Grâce aux chambres de culture individuelles, un ensemble contrôlable de conditions de niche peut être réglé séparément pour chaque échantillon (c’est-à-dire la température, la tension en oxygène, la concentration de glucose, la supplémentation, les stimulateurs, les inhibiteurs et l’étirement statique avec une plaque). Ensuite, la rigidité de la matrice et la composition matricielle du compartiment extrinsèque sont personnalisables grâce à la composition de l’hydrogel et permettraient par exemple d’étudier l’impact d’un microenvironnement tissulaire de plus en plus malade en incorporant plus de collagène-3 et de fibronectine cellulaire 93,94,95. Les populations cellulaires évaluées dans le compartiment extrinsèque sont facilement adaptables en sélectionnant les cellules à ensemencer, mais peuvent également être modifiées dans l’explant du noyau tendineux en tirant parti des lignées cellulaires génétiquement modifiées établies et des lignées de souris (c’est-à-dire la déplétion cellulaire de ScxLin)96. La composition matricielle et cellulaire différente des deux compartiments fournit en outre une structure 3D compartimentée unique qui est une autre caractéristique du tendon central 1,30,46.
Lors de l’utilisation de ce système, il est important de considérer les conséquences de la modularité du système sur la granularité des paramètres de résultat. Bien que la prolifération et le recrutement cellulaires puissent être évalués séparément pour chaque compartiment, les propriétés mécaniques, les composants du sécrétome et les produits de dégradation ne sont actuellement mesurables que pour l’assembloïde complet. En ce qui concerne le débit, une personne correctement formée peut préparer jusqu’à 50 assemblages en une journée de travail normale, le principal goulot d’étranglement étant la procédure de serrage. Bien que certaines des méthodes de lecture s’excluent mutuellement, il est possible d’évaluer les propriétés mécaniques et les composants du sécrétome de manière répétitive sur le même échantillon, ainsi que la composition de la population cellulaire (cytométrie en flux), le transcriptome cellulaire (RT-qPCR, séquençage de l’ARN) ou la distribution de la matrice et des cellules (immunocytochimie/microscopie à fluorescence) aux points d’évaluation. Dans des publications antérieures, ces méthodes ont été déployées pour caractériser de manière approfondie les interactions intercellulaires et intercompartimentales dans les assembloïdes de cœur / fibroblaste et noyau // macrophage exposés à une niche de type lésionnel84,85. Dans ce travail, la capacité du système modèle assembloïde à sonder l’interaction intercompartimentale entre les cellules endothéliales centrales et extrinsèques sous différents stimuli microenvironnementaux a été explorée.
La modularité du système de modèle permet d’affiner la méthode à l’avenir, ce qui est nécessaire pour surmonter les limitations suivantes de l’itération de conception actuelle. L’analyse cytométrique en flux présentée dans ce travail et les données de séquençage de l’ARN unicellulaire publiées récemment ont révélé que les populations de ténocytes résidents du noyau tendineux et de tendons d’Achille sont plus hétérogènes qu’on ne le pensait auparavant 24,34,59,84,97. De plus, le comportement migratoire des populations cellulaires initialement résidentes du noyau ou de l’hydrogel brouille la compartimentation assembloïde pendant la culture. Ces deux facteurs combinés rendent difficile l’attribution de différences transcriptomiques à des types cellulaires spécifiques et la séparation des processus basés sur la prolifération et la migration. Cette limitation pourrait être surmontée en affinant la population d’entrée avec le tri cellulaire activé par fluorescence (FACS) basé sur la composition cellulaire des tendons sains ou malades caractérisés dans des études in vivo récentes, en améliorant la lecture en mettant en œuvre le séquençage de l’ARN unicellulaire et en intégrant des marqueurs de prolifération tels qu’une coloration EdU (5-éthynyl-2'-désoxyuridine) pendant la microscopie.
Les assembloïdes présentés ici partagent également une faiblesse avec la plupart des systèmes in vitro actuellement disponibles qui simulent des organes malades déconnectés du reste du corps98,99. Cependant, la plate-forme basée sur la chambre de culture utilisée ici positionne bien le système modèle pour l’intégration dans une plate-forme multi-organes où des assembloïdes imitant différents organes sont connectés et les interactions inter-organes peuvent être étudiées.
À la base, le système de modèle est basé sur la position des tendons de rongeurs, ce qui entraîne son propre ensemble unique d’inconvénients. Premièrement, la traduisibilité des résultats est entravée par le fait que les souris de type sauvage ne développent pas ou ne souffrent pas de maladies tendineuses 8,100,101. L’intégration de tissus et de cellules d’humains ou de souches de souris nouvellement développées qui présentent des aspects de la maladie tendineuse pourrait atténuer ce problème102. Le passage à un assembloïde d’origine humaine est particulièrement intéressant, car il permettrait des études avec des tissus dérivés de patients provenant de tendons de différentes maladies (c’est-à-dire tendinite, tendinose ou péritendinite) et même des donneurs résistants au traitement qui pourraient débloquer des programmes de traitement plus personnalisés. Deuxièmement, les explants de tendon de la queue murine ne gèrent pas particulièrement bien les microdommages induits par la surcharge, ce qui limite l’applicabilité du système modèle pour l’étude des lésions tendineuses aiguës.
Pour toutes ces raisons, les assembloïdes explant // hydrogel sont dans une position privilégiée pour étudier la biologie du noyau tendineux, les interactions structure-fonction de la matrice et les interactions intercompartimentales entre des populations cellulaires spécifiques en réponse à des microdommages induits par des niches. Les informations recueillies à partir de ces études à haut débit pourraient orienter la recherche in vivo et le développement de traitements.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été financé par la subvention 1-005733 de l’EPF
matériels
| Name | Company | Catalog Number | Comments |
| 0.4 mm x 25 mm injection needle (G27) | Sterican | 9186174 | |
| 3D printing filament: Clear polylactic acid prusament | Prusa | NA | |
| 4% formaldehyde | Roti-Histofix | P087.4 | |
| Accutase cell detachment solution | Sigma-Aldrich | A6964-100ML | |
| Amphotericin | VWR | L0009-100 | |
| Attachable digital C-mount camera: Moticam 2 | Motic | NA | |
| Bolt screw M3 x 16 mm, stainless steel | RS PRO | 1871235 | |
| Bolt screw M3 x 6 mm, stainless steel | RS PRO | 1871207 | |
| CaCl2 | Sigma-Aldrich | C5670 | |
| CD146 antibody: PE anti-mouse | BioLegend | 134703 | |
| CD206 antibody: Alexa Fluor 488 anti-mouse | BioLegend | 141709 | |
| CD31 antibody: Alexa Fluor 488 anti-mouse | BioLegend | 102413 | |
| CD86 antibody: PE anti-mouse | BioLegend | 105007 | |
| Collagenase I | Thermo Fisher Scientific | 17100017 | |
| Collagenase IV | Gibco | 17104-019 | |
| Dialyzed Fetal Bovine Serum (FBS) | Sigma-Aldrich | F0392-100ML | |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | 7000183 | |
| Dispase II | Sigma-Aldrich | D4693-1G | |
| DMEM/F12 | Sigma | 7002211 | |
| Dowel Pin, 3 mm x 16 mm, stainless steel | Accu | HDP-3-16-A1 | |
| Dragon Skin 10 Slow/1 silicone | KauPO | 09301-004-000001 | |
| Endopan 3 Kit | Pan-Biotech | P04-0010K | |
| Endothelial cell growth supplement | Lonza | CC-3162 | |
| Eppendorf safe-lock plastic tubes (1.5 mL) | Eppendorf | 30121023 | |
| Ethidium homodimer, EthD-1, 2 mM stock in DMSO | Sigma-Aldrich | 46043-1MG-F | |
| F4/80 antibody: Apc/fire 750 anti-mouse | BioLegend | 123151 | |
| Falcon plastic tube (15 mL) | Corning | 352096 | |
| Falcon plastic tube (50 mL) | Corning | 352070 | |
| Flow cytometer: LSR II Fortessa | BD Bioscience | 23-11617-02 | |
| Gelatin | Invitrogen | D12054 | |
| Hellmanex III alkaline cleaning concentrate | Sigma | Z805939-1EA | |
| Heparin | Sigma-Aldrich | H3149-10KU | |
| Hydroxyproline assay | Sigma-Aldrich | MAK008 | |
| Image analysis software: Motic Images Plus 3.0 ML | Motic | NA | |
| L-Ascorbic Acid Phosphate Magnesium Salt n-Hydrate | Wako Chemicals | 013-19641 | |
| LSE Low Speed Orbital Shaker | Corning | 6780-FP | |
| MEM non-essential amino acids | Sigma | 7002231 | |
| Mouse macrophage-stimulating factor (m-CSF) | PeproTech | 315-02-50ug | |
| MSD assay | Mesoscale Discovery | various | |
| NucBlue | Thermo Fisher Scientific | R37605 | |
| Nylon mesh strainer cap, 100 µm | Corning | 734-2761 | |
| Original Prusa i3 MK3S 3D printer | Prusa | i3 MK3S | |
| Penicillin-Streptomycin | Sigma-Aldrich | P4333 | |
| Phosphate-buffered saline (PBS), ph 7.4, sterile, 10 L | Gibco | 10010001 | |
| Puromycin | Gibco | A1113803 | |
| RBC lysis buffer | VWR | 786-650 | |
| recombinant m-CSF | PeproTech | 315-02 | |
| RNA extraction kit: Rneasy plus Micro | Qiagen | 74034 | |
| Slicing software: PrusaSlicer | Prusa | NA | Version 2.6.0 or higher |
| Sterile Cell Strainer 100 µm | Fisherbrand | 22363549 | |
| Surgical scalpel blade No. 21 | Swann-Morton | 307 | |
| Trizol reagent | Thermo Fisher Scientific | 15596018 | |
| Trypsin-EDTA (0.5 %) | Gibco | 15400054 |
Références
- Snedeker, J. G., Foolen, J. Tendon injury and repair - A perspective on the basic mechanisms of tendon disease and future clinical therapy. Acta Biomaterialia. 63, 18-36 (2017).
- Wang, J. H. C. Mechanobiology of tendon. Journal of Biomechanics. 39 (9), 1563-1582 (2006).
- Kirkendall, D. T., Garrett, W. E. Function and biomechanics of tendons. Scandinavian Journal of Medicine and Science in Sports. 7 (2), 62-66 (1997).
- Götmark, F., Cafaro, P., O'Sullivan, J. Aging human populations: Good for us, good for the earth. Trends in Ecology and Evolution. 33 (11), 851-862 (2018).
- Maffulli, N., Wong, J., Almekinders, L. C. Types and epidemiology of tendinopathy. Clinics in Sports Medicine. 22 (4), 675-692 (2003).
- Renström, P. A. F. H., Woo, S. L. -. Y. Tendinopathy: A major medical problem in sport. Tendinopathy in Athletes. , (2007).
- Screen, H. R. C., Birk, D. E., Kadler, K. E., Ramirez, F., Young, M. Tendon functional extracellular matrix. Journal of Orthopaedic Research. 33 (6), 793-799 (2016).
- Wunderli, S. L., Blache, U., Snedeker, J. G., Wunderli, S. L., Blache, U., Tendon, J. G. S. Tendon explant models for physiologically relevant in vitro study of tissue biology - a perspective. Connective Tissue Research. 61 (3-4), 262-277 (2020).
- Magnusson, S. P., Langberg, H., Kjaer, M. The pathogenesis of tendinopathy: balancing the response to loading. Nature Reviews Rheumatology. 6 (5), 262-268 (2010).
- Heinemeier, K. M., Schjerling, P., Øhlenschlæger, T. F., Eismark, C., Olsen, J., Kjær, M. Carbon-14 bomb pulse dating shows that tendinopathy is preceded by years of abnormally high collagen turnover. FASEB Journal. 32 (9), 4763-4775 (2018).
- Andersson, G., Backman, L. J., Scott, A., Lorentzon, R., Forsgren, S., Danielson, P. Substance P accelerates hypercellularity and angiogenesis in tendon tissue and enhances paratendinitis in response to Achilles tendon overuse in a tendinopathy model. British Journal of Sports Medicine. 45 (13), 1017-1022 (2011).
- Rolf, C. G., Fu, B. S. C., Pau, A., Wang, W., Chan, B. Increased cell proliferation and associated expression of PDGFRβ causing hypercellularity in patellar tendinosis. Rheumatology. 40 (3), 256-261 (2001).
- Riley, G. The pathogenesis of tendinopathy. A molecular perspective. Rheumatology. 43 (2), 131-142 (2004).
- Jarvinen, M., Jozsa, L., Kannus, P., Järvinen, T. L., Kvist, M., Leadbetter, W. Histopathological findings in chronic tendon disorders. Scandinavian Journal of Medicine & Science in Sports. 7 (2), 86-95 (1997).
- Soslowsky, L. J., et al. Overuse activity injures the supraspinatus tendon in an animal model: A histologic and biomechanical study. Journal of Shoulder and Elbow Surgery. 9 (2), 79-84 (2000).
- Tran, P. H. T., et al. Early development of tendinopathy in humans: Sequence of pathological changes in structure and tissue turnover signaling. FASEB Journal. 34 (1), 776-788 (2020).
- Theodossiou, S. K., Schiele, N. R. Models of tendon development and injury. BMC Biomedical Engineering. 1 (1), 1-24 (2019).
- Stauber, T., Blache, U., Snedeker, J. G. Tendon tissue microdamage and the limits of intrinsic repair. Matrix Biology. 85-86, 68-79 (2020).
- Wang, T., et al. In vitro loading models for tendon mechanobiology. Journal of Orthopaedic Research. 36 (2), 566-575 (2018).
- Fang, F., Sawhney, A. S., Lake, S. P. Different regions of bovine deep digital flexor tendon exhibit distinct elastic, but not viscous, mechanical properties under both compression and shear loading. Journal of Biomechanics. 47 (12), 2869-2877 (2014).
- Wunderli, S. L., et al. Tendon response to matrix unloading is determined by the patho-physiological niche. Matrix Biology. 89, 11-26 (2020).
- Wunderli, S. L., et al. Minimal mechanical load and tissue culture conditions preserve native cell phenotype and morphology in tendon - A novel ex vivo mouse explant model. Journal of Orthopaedic Research. 36 (5), 1383-1390 (2017).
- Arnoczky, S. P., Lavagnino, M., Egerbacher, M., Caballero, O., Gardner, K. Matrix metalloproteinase inhibitors prevent a decrease in the mechanical properties of stress-deprived tendons. The American Journal of Sports Medicine. 35 (5), 763-769 (2007).
- de Micheli, A. J., et al. Single-cell transcriptomic analysis identifies extensive heterogeneity in the cellular composition of mouse Achilles tendons. American Journal of Physiology - Cell Physiology. 319 (5), C885-C894 (2020).
- Arvind, V., Huang, A. H. Reparative and maladaptive inflammation in tendon healing. Frontiers in Bioengineering and Biotechnology. 9 (July), 1-16 (2021).
- Marsolais, D., Côté, C. H., Frenette, J. Neutrophils and macrophages accumulate sequentially following Achilles tendon injury. Journal of Orthopaedic Research. 19 (6), 1203-1209 (2001).
- Garcia-Melchor, E., et al. Novel self-amplificatory loop between T cells and tenocytes as a driver of chronicity in tendon disease. Annals of the Rheumatic Diseases. 80 (8), 1075-1085 (2021).
- Stolk, M., Klatte-Schulz, F., Schmock, A., Minkwitz, S., Wildemann, B., Seifert, M. New insights into tenocyte-immune cell interplay in an in vitro model of inflammation. Scientific Reports. 7 (1), 9801 (2017).
- Tempfer, H., Traweger, A. Tendon vasculature in health and disease. Frontiers in Physiology. 6, 330 (2015).
- Mienaltowski, M. J., Adams, S. M., Birk, D. E. Regional differences in stem cell/progenitor cell populations from the mouse achilles tendon. Tissue Engineering - Part A. 19 (1-2), 199-210 (2013).
- Sakabe, T., et al. Transcription factor scleraxis vitally contributes to progenitor lineage direction in wound healing of adult tendon in mice. Journal of Biological Chemistry. 293, (2018).
- Dyment, N. A., Hagiwara, Y., Matthews, B. G., Li, Y., Kalajzic, I., Rowe, D. W. Lineage tracing of resident tendon progenitor cells during growth and natural healing. PLoS One. 9 (4), e96113 (2014).
- Harvey, T., Flamenco, S., Fan, C. M. A Tppp3 + Pdgfra + tendon stem cell population contributes to regeneration and reveals a shared role for PDGF signalling in regeneration and fibrosis. Nature Cell Biology. 21 (12), 1490-1503 (2019).
- Zhang, J., et al. Characterization of the structure, vascularity, and stem/progenitor cell populations in porcine Achilles tendon (PAT). Cell and Tissue Research. 384 (2), 367-387 (2021).
- Tarafder, S., et al. Tendon stem/progenitor cells regulate inflammation in tendon healing via JNK and STAT3 signaling. FASEB Journal. 31 (9), 3991-3998 (2017).
- Lee, C. H., et al. Harnessing endogenous stem/progenitor cells for tendon regeneration Find the latest version Harnessing endogenous stem/progenitor cells for tendon regeneration. J Clin Invest. 125 (7), 2690-2701 (2015).
- Lui, P. P. Y., Chan, L. S., Cheuk, Y. C., Lee, Y. W., Chan, K. M. Expression of bone morphogenetic protein-2 in the chondrogenic and ossifying sites of calcific tendinopathy and traumatic tendon injury rat models. Journal of Orthopaedic Surgery and Research. 4, 27 (2009).
- Takeuchi, E., et al. Localization and expression of osteopontin in the rotator cuff tendons in patients with calcifying tendinitis. Virchows Archiv. 438 (6), 612-617 (2001).
- Kadler, K. E., Hill, A., Canty-Laird, E. G. Collagen fibrillogenesis: fibronectin, integrins, and minor collagens as organizers and nucleators. Current Opinion in Cell Biology. 20 (5), 495-501 (2008).
- Millar, N. L., et al. MicroRNA29a regulates IL-33-mediated tissue remodelling in tendon disease. Nature Communications. 6, 6774 (2015).
- Riley, G. P., Harrall, R. L., Constant, C. R., Chard, M. D., Cawston, T. E., Hazleman, B. L. Tendon degeneration and chronic shoulder pain: changes in the collagen composition of the human rotator cuff tendons in rotator cuff tendinitis. Annals of the Rheumatic Diseases. 53 (6), 359-366 (1994).
- Thorpe, C. T., Peffers, M. J., Simpson, D., Halliwell, E., Screen, H. R. C., Clegg, P. D. Anatomical heterogeneity of tendon: Fascicular and interfascicular tendon compartments have distinct proteomic composition. Scientific Reports. 6, 20455 (2016).
- Thorpe, C. T., et al. Distribution of proteins within different compartments of tendon varies according to tendon type. Journal of Anatomy. 229 (3), 450-458 (2016).
- Choi, H., et al. Heterogeneity of proteome dynamics between connective tissue phases of adult Tendon. eLife. 9, e55262 (2020).
- Spiesz, E. M., et al. Tendon extracellular matrix damage, degradation and inflammation in response to in vitro overload exercise. Journal of Orthopaedic Research. 33 (6), 889-897 (2015).
- Dyment, N. A., et al. The paratenon contributes to scleraxis-expressing cells during patellar tendon healing. PLoS One. 8 (3), e59944 (2013).
- Cadby, J. A., Buehler, E., Godbout, C., Van Weeren, P. R., Snedeker, J. G. Differences between the cell populations from the peritenon and the tendon core with regard to their potential implication in tendon repair. PLoS One. 9 (3), e92474 (2014).
- Huh, D., Hamilton, G. A., Ingber, D. E. From three-dimensional cell culture to organs-on-chips. Trends in Cell Biology. 21 (12), 745-754 (2011).
- Duval, K., et al. Modeling physiological events in 2D vs. 3D cell culture. Physiology. 32 (4), 266 (2017).
- Wang, J. H. C. Mechanobiology of tendon. Journal of Biomechanics. 39 (9), 1563-1582 (2006).
- Derwin, K. A., Soslowsky, L. J. A quantitative investigation of structure-function relationships in a tendon fascicle model. Journal of Biomechanical Engineering. 121 (6), 598-604 (1999).
- Herod, T. W., Veres, S. P. Development of overuse tendinopathy: A new descriptive model for the initiation of tendon damage during cyclic loading. Journal of Orthopaedic Research. 36 (1), 467-476 (2017).
- Andersen, M. B., Pingel, J., Kjær, M., Langberg, H. Interleukin-6: A growth factor stimulating collagen synthesis in human tendon. Journal of Applied Physiology. 110 (6), 1549-1554 (2011).
- Langberg, H., Rosendal, L., Kjær, M. Training-induced changes in peritendinous type I collagen turnover determined by microdialysis in humans. Journal of Physiology. 534 (1), 297-302 (2001).
- Zitnay, J. L., et al. Molecular level detection and localization of mechanical damage in collagen enabled by collagen hybridizing peptides. Nature Communications. 8, 14913 (2017).
- Hwang, J., et al. Molecular assessment of collagen denaturation in decellularized tissues using a collagen hybridizing peptide. Acta Biomaterialia. 53, 268-278 (2016).
- Lin, A. H., Zitnay, J. L., Li, Y., Yu, S. M., Weiss, J. A. Microplate assay for denatured collagen using collagen hybridizing peptides. Journal of Orthopaedic Research. 37 (2), 431-438 (2019).
- Blomgran, P., Blomgran, R., Ernerudh, J., Aspenberg, P. A possible link between loading, inflammation and healing: Immune cell populations during tendon healing in the rat. Scientific Reports. 6, 29824 (2016).
- Harvey, T., Flamenco, S., Fan, C. -. M. A Tppp3+Pdgfra+ tendon stem cell population contributes to regeneration and reveals a shared role for PDGF signalling in regeneration and fibrosis. Nature Cell Biology. 21 (12), 1490-1503 (2019).
- Pryce, B. A., Brent, A. E., Murchison, N. D., Tabin, C. J., Schweitzer, R. Generation of transgenic tendon reporters, ScxGFP and ScxAP, using regulatory elements of the scleraxis gene. Developmental Dynamics. 236 (6), 1677-1682 (2007).
- Godinho, M. S. C., Thorpe, C. T., Greenwald, S. E., Screen, H. R. C. Elastin is localised to the interfascicular matrix of energy storing tendons and becomes increasingly disorganised with ageing. Scientific Reports. 7 (1), 9713 (2017).
- Smith, M. M., et al. Modulation of aggrecan and ADAMTS expression in ovine tendinopathy induced by altered strain. Arthritis and Rheumatism. 58 (4), 1055-1066 (2008).
- Asundi, K. R., Rempel, D. M. MMP-1, IL-1β, and COX-2 mRNA expression is modulated by static load in rabbit flexor tendons. Annals of Biomedical Engineering. 36 (2), 237-243 (2008).
- Millar, N. L., et al. Inflammation is present in early human tendinopathy. American Journal of Sports Medicine. 38 (10), 2085-2091 (2010).
- Dakin, S. G., et al. Inflammation activation and resolution in human tendon disease. Science Translational Medicine. 7 (311), 311ra173 (2015).
- Jelinsky, S. A., Rodeo, S. A., Li, J., Gulotta, L. V., Archambault, J. M., Seeherman, H. J. Regulation of gene expression in human tendinopathy. BMC Musculoskeletal Disorders. 12, 86 (2011).
- Kannus, P., Józsa, L. Histopathological changes preceding spontaneous rupture of a tendon. A controlled study of 891 patients. The Journal of Bone and Joint Surgery. American. 73 (10), 1507-1525 (1991).
- Comin, J., et al. The prevalence and clinical significance of sonographic tendon abnormalities in asymptomatic ballet dancers: A 24-month longitudinal study. British Journal of Sports Medicine. 47 (2), 89-92 (2013).
- Schubert, T. E. O., Weidler, C., Lerch, K., Hofstädter, F., Straub, R. H. Achilles tendinosis is associated with sprouting of substance P positive nerve fibres. Annals of the Rheumatic Diseases. 64 (7), 1083-1086 (2005).
- Quigley, A. S., Bancelin, S., Deska-Gauthier, D., Légaré, F., Kreplak, L., Veres, S. P. In tendons, differing physiological requirements lead to functionally distinct nanostructures. Scientific Reports. 8 (1), 4409 (2018).
- Herod, T. W., Chambers, N. C., Veres, S. P. Collagen fibrils in functionally distinct tendons have differing structural responses to tendon rupture and fatigue loading. Acta Biomaterialia. 42, 296-307 (2016).
- Shepherd, J. H., Riley, G. P., Screen, H. R. C. Early stage fatigue damage occurs in bovine tendon fascicles in the absence of changes in mechanics at either the gross or micro-structural level. Journal of the Mechanical Behavior of Biomedical Materials. 38, 163-172 (2014).
- Birch, H. L. Tendon matrix composition and turnover in relation to functional requirements. International Journal of Experimental Pathology. 88 (4), 241-248 (2007).
- Kapałczyńska, M., et al. 2D and 3D cell cultures - a comparison of different types of cancer cell cultures. Archives of Medical Science. 14 (4), 910-919 (2018).
- Hussien, A. A., Niederoest, B., Bollhalder, M., Goedecke, N., Snedeker, J. G. The stiffness-sensitive transcriptome of human tendon stromal cells. Advanced Healthcare Materials. 12 (7), 2101216 (2023).
- Heo, S. J., et al. Aberrant chromatin reorganization in cells from diseased fibrous connective tissue in response to altered chemomechanical cues. Nature Biomedical Engineering. 7 (2), 177-191 (2023).
- Liu, C. -. F., Aschbacher-Smith, L., Barthelery, N. J., Dyment, N., Butler, D., Wylie, C. What we should know before using tissue engineering techniques to repair injured tendons: A developmental biology perspective. Tissue Engineering Part B: Reviews. 17 (3), 165-176 (2011).
- Ruiz-Alonso, S., Lafuente-Merchan, M., Ciriza, J., Saenz-del-Burgo, L., Pedraz, J. L. Tendon tissue engineering: Cells, growth factors, scaffolds and production techniques. Journal of Controlled Release. 333, 448-486 (2021).
- Rinoldi, C., et al. Tendon tissue engineering: Effects of mechanical and biochemical stimulation on stem cell alignment on cell-laden hydrogel yarns. Advanced Healthcare Materials. 8 (7), e1801218 (2019).
- Walia, B., Huang, A. H. Tendon stem progenitor cells: Understanding the biology to inform therapeutic strategies for tendon repair. Journal of Orthopaedic Research. 37 (6), 1270-1280 (2018).
- Thorpe, C. T., Riley, G. P., Birch, H. L., Clegg, P. D., Screen, H. R. C. Fascicles from energy-storing tendons show an age-specific response to cyclic fatigue loading. Journal of The Royal Society Interface. 11 (92), 20131058-20131058 (2014).
- Thorpe, C. T., Riley, G. P., Birch, H. L., Clegg, P. D., Screen, H. R. C. Fascicles and the interfascicular matrix show decreased fatigue life with ageing in energy storing tendons. Acta Biomaterialia. 56, 58-64 (2017).
- Youngstrom, D. W., Rajpar, I., Kaplan, D. L., Barrett, J. G. A bioreactor system for in vitro tendon differentiation and tendon tissue engineering. Journal of Orthopaedic Research. 33 (6), 911-918 (2015).
- Stauber, T., et al. Extrinsic macrophages protect while tendon progenitors degrade: Insights from a tissue engineered model of tendon compartmental crosstalk. Advanced Healthcare Materials. 10 (20), e2100741 (2021).
- Stauber, T., Moschini, G., Hussien, A. A., Jaeger, P. K., De Bock, K., Snedeker, J. G. IL-6 signaling exacerbates hallmarks of chronic tendon disease by stimulating progenitor proliferation & migration to damage. eLife. 12, RP87092 (2023).
- Doillon, C. J., Mantovani, D., Rajan, N., Habermehl, J., Cote, M. Preparation of ready-to-use storable and reconstituted type I collagen from rat tail tendon for tissue engineering applications. Nature Protocols. 1 (6), 2753-2758 (2007).
- Blache, U., et al. Inhibition of ERK 1/2 kinases prevents tendon matrix breakdown. Scientific Reports. 11 (1), 6838 (2021).
- Liu, X., et al. The role of vascular endothelial growth factor in tendon healing. Frontiers in Physiology. 12, 766080 (2021).
- Claxton, S., Kostourou, V., Jadeja, S., Chambon, P., Hodivala-dilke, K., Fruttiger, M. Efficient, inducible Cre-recombinase activation in vascular endothelium. Genesis. 46 (2), 74-80 (2008).
- Passini, F. S., et al. Shear-stress sensing by PIEZO1 regulates tendon stiffness in rodents and influences jumping performance in humans. Nature Biomedical Engineering. 5 (12), 1457-1471 (2021).
- Lee, A. H., Szczesny, S. E., Santare, M. H., Elliott, D. M. Investigating mechanisms of tendon damage by measuring multi-scale recovery following tensile loading. Acta Biomaterialia. 57, 363-372 (2017).
- Lee, A. H., Elliott, D. M. Multi-scale loading and damage mechanisms of plantaris and rat tail tendons. Journal of Orthopaedic Research. 37 (8), 1827-1837 (2019).
- Williams, I. F., Heaton, A., McCullagh, K. G. Cell morphology and collagen types in equine tendon scar. Research in Veterinary Science. 28 (3), 302-310 (1980).
- Maffulli, N., Ewen, S. W. B., Waterston, S. W., Reaper, J., Barrass, V. Tenocytes from ruptured and tendinopathic achilles tendons produce greater quantities of type III collagen than tenocytes from normal achilles tendons: An in vitro model of human tendon healing. American Journal of Sports Medicine. 28 (4), 499-505 (2000).
- Pajala, A., Melkko, J., Leppilahti, J., Ohtonen, P., Soini, Y., Risteli, J. Tenascin-C and type I and III collagen expression in total Achilles tendon rupture. An immunohistochemical study. Histology and Histopathology. 24 (10), 1207-1211 (2009).
- Best, K. T., et al. Scleraxis-lineage cell depletion improves tendon healing and disrupts adult tendon homeostasis. eLife. 10, e62203 (2021).
- Lehner, C., et al. Tenophages: A novel macrophage-like tendon cell population expressing CX3CL1 and CX3CR1. DMM Disease Models and Mechanisms. 12 (12), dmm041384 (2019).
- Ajalik, R. E., et al. Human organ-on-a-chip microphysiological systems to model musculoskeletal pathologies and accelerate therapeutic discovery. Frontiers in Bioengineering and Biotechnology. 10, 846230 (2022).
- Ingber, D. E. Human organs-on-chips for disease modelling, drug development and personalized medicine. Nature Reviews Genetics. 23 (8), 467-491 (2022).
- Brehm, M. A., Shultz, L. D., Luban, J., Greiner, D. L. Overcoming current limitations in humanized mouse research. The Journal of Infectious Diseases. 208 Suppl (Suppl 2), 125-130 (2013).
- Nunan, R., Harding, K. G., Martin, P. Clinical challenges of chronic wounds: searching for an optimal animal model to recapitulate their complexity. Disease Models & Mechanisms. 7 (11), 1205-1213 (2014).
- Costa-Almeida, R., Calejo, I., Reis, R. L., Gomes, M. E. Crosstalk between adipose stem cells and tendon cells reveals a temporal regulation of tenogenesis by matrix deposition and remodeling. Journal of Cellular Physiology. 233 (7), 5383-5395 (2018).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon