Technique chirurgicale de l’implant de hanche personnalisé imprimé en 3 dimensions pour le traitement de la dysplasie canine de la hanche
Dans cet article
Résumé
Ce travail décrit une nouvelle technique chirurgicale pour l’implantation extracapsulaire d’un implant préservant l’articulation personnalisé, imprimé en 3 dimensions. Ce nouveau traitement vise à restaurer la stabilité de la hanche chez les jeunes chiens adultes souffrant de dysplasie de la hanche avec laxité en reproduisant de manière unique la forme anatomique du bord acétabulaire de l’articulation de la hanche.
Résumé
La dysplasie de la hanche provoque un handicap majeur chez les chiens. Les options de traitement se limitent aux traitements palliatifs (par exemple, le soulagement de la douleur, l’exercice physique, les changements de mode de vie et le contrôle du poids) ou aux chirurgies invasives telles que les ostéotomies pelviennes et l’arthroplastie totale de la hanche. Par conséquent, il existe un fort besoin non satisfait d’une solution efficace et adaptée aux chiens qui améliore la qualité de vie du meilleur ami de l’homme. Nous comblons cette lacune de traitement en proposant un implant de hanche (3DHIP) minimalement traumatisant et extraarticulaire, spécifique au chien, imprimé en 3 dimensions qui restaure la stabilité de l’articulation de la hanche. Le traitement chirurgical à l’aide d’un implant 3DHIP est moins invasif que les ostéotomies et peut être réalisé bilatéralement en une seule séance chirurgicale. L’implant 3DHIP étend le bord acétabulaire dorsal de l’articulation dysplasique de la hanche, augmentant ainsi la couverture de la tête fémorale et inhibant la subluxation articulaire avec une récupération rapide. Un accès suffisant au bord acétabulaire dorsal et au bord ventral du corps iliaque, ainsi qu’un ajustement et une fixation optimaux de l’implant, sont des étapes clés pour une implantation réussie de 3DHIP et impliquent la nécessité d’une approche spécifique. Le présent article vise à présenter cette technique chirurgicale innovante avec des conseils et astuces en tant que manuel chirurgical pour l’implantation de l’implant 3DHIP chez les chiens atteints de dysplasie de la hanche.
Introduction
La dysplasie de la hanche (MH) chez le chien se manifeste en raison d’un mauvais ajustement entre la cavité de la hanche (acétabulum) et la tête fémorale, entraînant une subluxation de l’articulation de la hanche. Elle affecte principalement les jeunes chiens de moyenne à grande taille, entraînant une détérioration du cartilage articulaire et, finalement, une arthrose sévère entraînant des douleurs chroniques et une faible qualité devie1,2. La prévalence globale de la dysplasie de la hanche chez le chien est de 15,56 %, ce qui varie considérablement en fonction de la race et des systèmes de classification 3,4.
Outre les changements de mode de vie, les patients atteints de dysplasie de la hanche sont traités avec des anti-inflammatoires et des analgésiques pour contrôler la douleur et maintenir la mobilité4. En cas de laxité de la hanche chez les jeunes chiens adultes, le seul recours chirurgical est l’ostéotomie pelvienne double (DPO) ou triple (TPO), une procédure impliquant deux ou trois coupes complètes des os pelviens pour étendre la couverture de la tête fémorale. Cependant, les complications après les ostéotomies sont fréquentes et la progression de l’arthrose est toujours observée 5,6,7,8,9. Une fois que l’arthrose sévère et la douleur chronique se sont développées,il ne reste que la chirurgie complexe à fort impact comme le remplacement total de la hanche (THR) ou l’ostectomie fémorale de la tête et du cou (FHO) de sauvetage. Cependant, le FHO présente des résultats moins favorables chez les chiens de grande race et nécessite une thérapie physique prolongée pour la restauration de la fonction des membres11. De plus, la THR est techniquement difficile et intrinsèquement associée à des complications graves 12,13,14. Par conséquent, un traitement efficace de la dysplasie de la hanche ne nécessitant qu’une intervention chirurgicale à faible impact et avec un risque de complication plus faible est nécessaire avant que cette étape finale ne soit atteinte.
L’implant de hanche personnalisé imprimé en 3D (3D) (3DHIP) est un traitement unique en son genre pour la dysplasie canine de la hanche, développé dans le but d’offrir un implant traumatique minimal spécifique au chien qui restaure la stabilité de l’articulation de la hanche. La technique consiste en un implant en titane pour traiter principalement des patients canins jeunes adultes (6 mois à 2 ans) présentant une articulation de la hanche dysfonctionnelle présentant une laxité de la hanche de grade B (limite) à D (modérée) selon la Fédération Cynologique Internationale (FCI)15. Après une tomodensitométrie (TDM) de l’articulation dysplasique, un implant est conçu en suivant l’anatomie spécifique de l’articulation de la hanche de manière personnalisée pour étendre le bord acétabulaire dorsal, empêchant ainsi la subluxation de l’articulation de la hanche et rétablissant la stabilité de l’articulation de la hanche.
Une étude antérieure sur des cadavres canins a révélé que l’implant améliorait la couverture de la tête fémorale et démontrait une défaillance sous une force d’impact de 1 330 ± 320 Newtons16. Par la suite, une étude pilote sur des chiens expérimentaux a démontré une meilleure couverture de la tête fémorale, une réduction de la laxité de la hanche et une augmentation de la mise en charge grâce à l’analyse de la plaque de force. De plus, l’examen des hanches intervenues à 6 mois après l’implantation a révélé un volume normal et une surface lisse de la tête fémorale et du cartilage de l’acétabulum, accompagnée d’une hypertrophie de la capsule articulaire basée sur des évaluations macroscopiques et histologiques17. Après confirmation de l’efficacité et de l’innocuité de l’implant et du concept de traitement, une enquête clinique a été menée sur des chiens appartenant à des clients souffrant de dysplasie de la hanche. L’étude à court terme a révélé que les avantages de l’implant d’extension de jante acétabulaire imprimé en 3D sont un bon ajustement personnalisé de l’implant à l’acétabulum restaurant la stabilité de l’articulation de la hanche, une diminution des activités liées à la douleur et une intervention chirurgicale à faible impact18. L’application de l’implant nécessite l’accès à la face ventroc-audale du corps iliaque et à la face craniodorsale de l’articulation de la hanche. Dans cet article, nous décrivons notre planification chirurgicale et notre procédure chirurgicale avec une approche craniodorsale modifiée de l’articulation de la hanche comme manuel pour l’implantation du 3DHIP chez les chiens touchés par la dysplasie de la hanche.
Protocole
Cette étude a été considérée comme une pratique vétérinaire clinique non expérimentale au sens de l’article 1 à 5, point b), de la directive 2010/63/UE et a été approuvée par les comités d’études cliniques vétérinaires (VCSC) de l’Université d’Utrecht, à Utrecht, aux Pays-Bas. Cette étude portait sur le traitement de chiens appartenant à des clients, tous les chiens continuant à être sous la garde de leurs propriétaires respectifs. Tous les propriétaires de chiens ont reçu une lettre d’information détaillant le protocole de l’étude, toutes les complications potentielles (par exemple, infection, échec de l’implant, déficits neurologiques, etc.) et les traitements alternatifs comme l’ostéotomie pelvienne. De plus, sous cette forme, les aspects de la confidentialité et la gestion inhérente des données ont été expliqués. Tous les clients ont signé un formulaire de consentement éclairé. L’ensemble du protocole de cette étude est divisé en plusieurs étapes : la sélection des patients, la conception et la production de l’implant 3DHIP, la prise en charge préopératoire et l’anesthésie, l’intervention chirurgicale et la prise en charge postopératoire.
1. Sélection des patients
- Identifiez les chiens appartenant au client âgés de > 6 mois présentant des signes cliniques liés à la MH qui présentent un signe de subluxation d’Ortolani positif (Figure 1) et des signes radiographiques de MH de grade B à D (Figure 2).
REMARQUE : Le test de subluxation Ortolani est une manœuvre de diagnostic utilisée en médecine vétérinaire pour évaluer la stabilité de l’articulation de la hanche chez le chien. Lors du test Ortolani chez le chien, l’examinateur positionne l’animal sur le dos et fléchit les hanches à 90° tout en stabilisant le bassin. Chaque membre postérieur est doucement enlevé, dans le but de déplacer la tête fémorale de l’acétabulum afin d’évaluer la stabilité de l’articulation de la hanche. Un signe d’Ortolani positif, indiqué par un « claquement » ou un mouvement caractéristique, suggère une dysplasie de la hanche et un potentiel d’instabilité de l’articulation de la hanche. - Excluez les chiens avec une plaque de croissance acétabulaire ouverte, des hanches luxueuses ou une chirurgie de la hanche antérieure.
- Effectuez une tomodensitométrie des hanches pour exclure les chiens présentant des changements arthrosiques modérés à sévères des hanches et pour la conception de l’implant.
REMARQUE : Les chiens qui ont un col fémoral et/ou des ostéophytes du bord acétabulaire crânien et caudal, > 2 mm sont exclus (Figure 3).
2. Conception et production d’implants 3DHIP
- Concevoir l’implant 3DHIP (numéro de brevet EP3463198B119) à partir d’images CT DICOM préopératoires de l’ensemble du bassin, comme décrit par Willemsen et al.16 et Kwananocha et al.18 en laboratoire (se référer au tableau des matériaux).
- Segmentez l’os pelvien et le fémur de chaque chien candidat à partir de la tomodensitométrie préopératoire et créez un modèle 3D à l’aide d’un logiciel spécialisé (voir le tableau des matériaux et la figure 4A).
- Créez un système de coordonnées locales pour le bassin, basé sur le plan pelvien postérieur incliné.
- Mesurez l’angle de Norberg natif (NA) des hanches de chaque chien candidat sur le modèle 3D (Figure 4B).
- Utilisez le logiciel spécialisé (référez-vous à la Table des Matériaux) pour concevoir l’implant 3DHIP sur le modèle 3D du bassin. Utilisez l’AN natif pour déterminer la quantité d’extension du bord acétabulaire dorsal qui est nécessaire ; l’implant 3DHIP augmente l’AN de 25 à 35 degrés (Figure 4C et Figure 4D).
- Assurez-vous que l’implant 3DHIP se compose de deux sous-sections : la partie de fixation et la partie d’extension de jante. Concevez la pièce de fixation pour qu’elle soit constituée d’une coque intérieure poreuse et incorporez quatre trous de vis de verrouillage et une bride d’ilium ventrale supplémentaire pour faciliter et préciser le positionnement. Concevoir la partie d’extension de la jante de manière à ce que la jante acétabulaire dorsale soit prolongée avec un décalage interne de 1,5 mm permettant une fixation sans entrave de la capsule articulaire (figures 5A et 5B).
- Imprimez l’implant 3DHIP créé (Figure 5C) à partir d’un alliage de titane de qualité médicale (Ti6AI4V ELI grade 23) en utilisant la technologie de fusion laser sélective avec une machine d’impression directe en métal, exploitée par le fabricant de l’implant (reportez-vous au tableau des matériaux).
- Post-traitez l’implant 3DHIP imprimé, y compris la libération des contraintes (recuit sous vide), le polissage manuel du miroir et le nettoyage par ultrasons, opérés par le fabricant de l’implant (reportez-vous à la table des matériaux).
- Effectuer le nettoyage final à l’unité de stérilisation de l’hôpital afin d’éliminer toute poussière métallique résiduelle du processus de fabrication.
- Lavez manuellement l’implant 3DHIP à l’aide d’un shampooing à la povidone iodée (reportez-vous au tableau des matériaux) et d’eau stérile.
- Nettoyez l’implant 3DHIP à l’aide de la machine à laver hygiénique (voir le tableau des matériaux) à une température de 94 °C pendant 90 min.
- Enfermez l’implant 3DHIP dans des stratifiés de stérilisation doubles transparents (reportez-vous au tableau des matériaux) et scellez chaque stratifié séparément.
- Stérilisez l’implant à l’aide d’un autoclave à la vapeur (voir le tableau des matériaux) à une température de 134 °C pendant 80 min.
3. Prise en charge préopératoire et anesthésie
- Effectuez un examen général du chien appartenant au client avant l’anesthésie et catégorisez le risque d’anesthésie à l’aide de l’échelle de patient de l’American Society of Anesthesiologists (ASA) (échelle de 1 à 5)20.
REMARQUE : L’échelle de patient de l’American Society of Anesthesiologists (ASA) est utilisée pour catégoriser le risque d’anesthésie des chiens et aide les vétérinaires à déterminer les protocoles d’anesthésie appropriés pour chaque chien. Il classe les chiens en différentes classes en fonction de leur état de santé, allant de la classe I pour les chiens en bonne santé à la classe V pour ceux dans un état critique qui ne devraient pas survivre à la chirurgie. Les chiens classés dans les catégories ASA 1 (chien normal et sain) et ASA 2 (chiens atteints d’une maladie systémique bénigne) sont considérés comme des candidats appropriés pour ce traitement chirurgical. Ces chiens n’ont généralement pas ou pas de maladies systémiques sous-jacentes bénignes, sont en bonne santé générale et présentent des fonctions physiologiques normales. Ils sont considérés comme des candidats à faible risque pour la chirurgie et l’anesthésie. L’animal doit être à jeun pendant au moins 6 heures avant l’heure d’induction prévue. - Anesthésie le chien en suivant la catégorisation de l’AAS en fonction des besoins de chaque patient.
- Administrer par voie intraveineuse de la dexmédétomidine à une dose de 2 μg/kg et du chlorhydrate de méthadone à une dose de 0,3 mg/kg pour la prémédication chez le chien. (se référer à la table des matières).
REMARQUE : La sélection des prémédications et la voie d’administration peuvent différer en fonction de la préférence de l’anesthésiste et de l’état de santé et du comportement du chien. - Administrer du propofol par voie intraveineuse à une dose de 2 à 4 mg/kg (se référer au tableau des matériaux) pour l’induction de l’anesthésie.
- Intubez le chien et maintenez l’anesthésie avec de l’isoflurane inhalé (reportez-vous au tableau des matériaux) et de l’oxygène.
- Administrer par voie intraveineuse de la dexmédétomidine à une dose de 2 μg/kg et du chlorhydrate de méthadone à une dose de 0,3 mg/kg pour la prémédication chez le chien. (se référer à la table des matières).
- Surveillez en permanence et assurez la stabilité des signes vitaux, y compris la fréquence cardiaque, la fréquence respiratoire, les niveaux de dioxyde de carbone en fin d’expiration, la saturation artérielle percutanée en oxygène, la pression artérielle non invasive, la température œsophagienne et l’électrocardiographie.
- Effectuer une analgésie péridurale à l’aide d’une technique stérile.
- Positionnez le chien en position couchée sternale et fléchissez doucement les membres postérieurs vers l’avant pour créer plus d’espace entre la dernière vertèbre lombaire et le sacrum.
- Identifiez le site d’injection situé juste en queue de caudale par rapport à la 7e apophyse vertébrale dorsale, où une « fossette » peut être palpée.
- Effectuez un nettoyage stérile et enfilez des gants stériles en utilisant des techniques aseptiques.
- Insérez l’extrémité de l’aiguille vertébrale dans l’espace épidural et vérifiez son bon placement à l’aide de la technique de la « goutte suspendue ». Brièvement, introduisez une goutte de solution saline dans le moyeu de l’aiguille vertébrale. Lorsque l’extrémité de l’aiguille vertébrale pénètre dans le ligamentum flavum et pénètre dans l’espace épidural, la solution saline à l’intérieur du moyeu migre du moyeu vers l’aiguille21.
- Injecter les drogues (morphine 0,1 mg/kg diluée avec de la lévobupivacaïne 1 mL/5 kg) (voir la table des matières) à un rythme lent et constant pour assurer une distribution uniforme de la drogue lorsque l’application correcte est confirmée.
- Placez un cathéter urinaire de Foley à demeure (reportez-vous à la Table des matières) dans la vessie à l’aide d’une technique stérile et laissez-le en place pendant 12 à 24 h.
- Assurer un environnement propre et stérile pour la procédure de cathétérisme ; Coupez les poils du prépuce chez les chiens mâles et la voûte vaginale ventrale environnante chez les chiennes.
- Nettoyez la zone avec une solution de povidone iodée (reportez-vous à la table des matières) et rincez le prépuce/voûte vaginale avec 2 à 12 ml de solution de povidone iodé diluée (le volume varie en fonction de la taille du chien).
- Lavez-vous soigneusement les mains et portez des gants stériles pour minimiser le risque de contamination.
- Appliquez de la gelée lubrifiante stérile sur l’extrémité distale du cathéter de Foley et utilisez une technique aseptique lors de l’insertion du cathéter de Foley.
- Une fois le cathéter correctement positionné dans la vessie, gonflez le ballonnet avec de l’eau stérile selon le volume spécifié sur l’emballage. Cela permet de maintenir le cathéter en place et d’éviter tout délogement accidentel.
- Connectez l’orifice de drainage du cathéter de Foley à l’orifice de réception d’un sac de collecte d’urine.
- Coupez tout le membre sur la circonférence en commençant par la colonne vertébrale jusqu’à distal du jarret. Dans le cas d’une implantation bilatérale 3DHIP en une seule étape, clipsez l’autre membre de la même manière et connectez les côtés gauche et droit sur le dos lombo-sacré.
- Enveloppez la partie distale du membre avec un bandage cohésif non stérile. Choisissez une largeur et une longueur appropriées de bandage cohésif non stérile, en commençant légèrement sous le site chirurgical et en l’enroulant en spirale le long du membre, en couvrant la patte et les ongles.
- Administrer la céfazoline pour injection à une dose de 20 mg/kg (se référer au tableau des matières) par voie intraveineuse 30 minutes avant l’incision cutanée et répéter toutes les 90 minutes jusqu’à la fin de la chirurgie.
- Placez le chien sur une table d’opération standard en position couchée latérale et mettez le membre affecté en position suspendue. Sécurisez le patient dans cette position à l’aide d’un positionneur de poufs sous vide
- Effectuez le dernier gommage chirurgical stérile sur le membre en préparation de la chirurgie. Frottez la peau 2 fois avec du gluconate de chlorhexidine à 4 % et terminez par deux applications de spray d’éthanol à 70 % (v/v) (reportez-vous au tableau des matériaux).
- Placez quatre champs chirurgicaux étanches autour du site chirurgical. Demandez à un assistant de libérer le membre distal de sa position suspendue, tandis que le chirurgien sécurise et couvre le membre distal avec une chaussette imperméable stérile. Ajoutez une couche de pellicule cohésive stérile pour une protection supplémentaire.
- Couvrez la peau exposée de toute la zone chirurgicale avec un champ imprégné d’iode (reportez-vous au tableau des matériaux), puis fixez-le à l’aide de pinces à serviettes.
4. Intervention chirurgicale
- Identifiez l’extrémité du grand trochanter, le bord crânien du fémur proximal et l’aile iliaque par palpation pour établir l’orientation.
- Inciser la peau avec un couteau chirurgical à partir de l’épine iliaque dorsale crânienne, en commençant par 6-10 cm crânien jusqu’au grand trochanter. Ensuite, tournez-vous légèrement ventralement le long du bord crânien du fémur proximal. Arrêtez l’incision de 2 à 5 cm distale du grand trochanter. La longueur de l’incision est d’environ 8 à 15 cm (selon la taille du chien ; Figure 6A).
REMARQUE : Cette approche chirurgicale a été modifiée à partir de l’approche craniodorsale de l’articulation de la hanche précédemment signalée par Johnson22. - Faites une incision à travers la graisse sous-cutanée jusqu’au fascia pour établir une dissection anatomique suivant les plans anatomiques (Figure 6B).
- Séparez et incisez brusquement la feuille superficielle du muscle fascia latae le long du bord crânien du muscle biceps fémoral. Rétractez le muscle biceps fémoral vers la queue.
- Identifiez le triangle graisseux, qui est bordé par le muscle tenseur du fascia latea, le muscle fessier et le muscle biceps fémoral. Séparez le triangle graisseux à l’aide d’un ciseau de dissection à bout émoussé et d’un index, ce qui vous permettra d’accéder aux couches plus profondes.
- Inciser le septum intermusculaire entre le muscle fessier superficiel, le muscle fessier moyen et le muscle tenseur du fascia lata à l’aide d’un couteau chirurgical (Figure 7A et Figure 7E).
- Utilisez un écarteur à main pour séparer et rétracter les muscles fessiers superficiels et moyens dorsalement, ce qui exposera l’insertion du muscle fessier profond.
- Minez le muscle fessier profond près du grand trochanter à l’aide de ciseaux de dissection à pointe émoussée.
- Placez une suture de maintien sur le tendon fessier profond à environ 1-1,5 cm proximal de son insertion sur le grand trochanter.
- Effectuez une ténotomie fessière profonde complète près de l’os (à environ 0,5-1 cm de son insertion) à l’aide d’un couteau chirurgical (Figure 7B et Figure 7F).
- Faites une dissection émoussée à l’aide de ciseaux de dissection à pointe émoussée pour libérer le muscle fessier profond de la capsule articulaire sous-jacente, après quoi il peut être surélevé sous-périostéal de l’ilium à l’aide d’un élévateur périosté et d’un index.
- Utilisez l’électrocautérisation bipolaire pour l’hémostase des petits vaisseaux entre le muscle fessier profond et la capsule articulaire. Ensuite, rétractez le muscle fessier profond dorsalement en remplaçant les écarteurs Amry Navy.
- Libérer partiellement le muscle iliaque du bord caudo-ventral de la diaphyse iliaque à l’aide d’un élévateur périosté et identifier l’insertion du muscle droit fémoral (Figure 7C et Figure 7G).
- Utilisez un élévateur périosté pour retirer tous les tissus mous restants de la diaphyse iliaque exposée afin de préparer le positionnement précis de l’implant 3DHIP et grattez le périoste pour stimuler la croissance osseuse pour la fixation secondaire de l’implant.
- Identifiez le muscle articulaire coxaire caudale au muscle droit fémoral recouvrant la capsule articulaire.
REMARQUE : Le muscle articulaire coxae peut être libéré de son insertion s’il interfère avec le positionnement de l’implant. - Installez l’implant 3DHIP dans sa position désignée, avec la bride de l’implant de la partie de fixation, en s’accrochant sous le bord ventral de la diaphyse iliaque caudo-ventrale exposée, juste crânienne à la proéminence osseuse qui marque l’insertion du muscle droit fémoral (Figure 7D et Figure 7H).
- Vérifiez que la partie d’extension de la jante de l’implant recouvre la partie craniodorsale de la capsule articulaire de la hanche sans interférer avec la fixation de la capsule articulaire sur la jante acétabulaire et qu’aucun muscle fessier profond n’est capturé sous la partie d’extension.
REMARQUE : Une exposition adéquate pour le positionnement de l’implant et l’insertion de la vis peut être obtenue par une abduction continue, une rotation externe et une flexion de l’articulation de la hanche par un assistant pour relâcher la tension sur le complexe musculaire fessier facilitant l’exposition chirurgicale. - Vérifiez le positionnement idéal de l’implant en visualisant et en sondant avec la canule d’aspiration pour un stock osseux parfait dans les quatre trous de vis exposés et en sondant l’absence d’espace entre la bride iliale et la diaphyse iliaque caudo-ventrale.
- Fixez temporairement l’implant dans la position souhaitée à l’aide d’une vis de blocage autotaraudeuse en titane (2,4 mm, 2,7 mm ou 3,5 mm) (reportez-vous au tableau des matériaux), qui n’est pas complètement serrée pour permettre des ajustements de rotation minimaux de l’implant lors de la mise en place de la deuxième vis.
REMARQUE : L’ordre de placement des quatre vis peut être adapté en fonction de leur accessibilité pratique (Figure 5C). - Effectuer une fluoroscopie peropératoire (se référer à la table des matériaux) en vues latérale (Figure 8A) et latéro-oblique (Figure 8B) pour évaluer de manière exhaustive la position et l’alignement de l’implant. Comparer les images fluoroscopiques obtenues avec la planification préopératoire pour s’assurer que l’implant est positionné conformément au plan chirurgical.
- Vérifiez que la courbure de la partie d’extension du rebord de l’implant est exactement congruente avec la courbure de la tête fémorale et du rebord acétabulaire caudal et crânien visible qui ne sont pas couverts par l’implant.
REMARQUE : Si nécessaire, des ajustements peuvent être effectués. La première vis est retirée, l’implant remplacé et fixé temporairement avec une vis dans le nouveau stock osseux, et la fluoroscopie est répétée. - Insérez trois vis de blocage autotaraudeuses en titane (2,4 mm, 2,7 mm ou 3,5 mm) dans les trous de vis restants pour fixer l’implant à la tige iliale. Une fois la deuxième vis placée, serrez complètement la première vis.
- Vérifiez une dernière fois que toutes les vis sont serrées à la main sur le mécanisme de verrouillage.
- Effectuez la flexion, l’extension et l’abduction de l’articulation de la hanche ainsi que le test de subluxation d’Ortolani pour exclure le conflit fémoral tête/cou et s’assurer que la laxité de la hanche est inversée.
- Rattachez les extrémités coupées du tendon insertionnel du muscle fessier profond à l’aide d’un motif de suture à boucle de verrouillage et de 1 à 2 sutures de matelas avec un matériau de suture monofilament synthétique résorbable (voir le tableau des matériaux) qui sont destinées à l’approximation des tissus pendant de longues périodes. Étendez et tournez intérieurement l’articulation de la hanche pour diminuer la tension sur le tendon insertionnel du muscle fessier profond pendant la suture.
- Réparez le fascia fessier et le fascia lata tenseur avec une suture résorbable en monofilament synthétique selon un motif simple et interrompu.
- Fermez le tissu sous-cutané avec une suture résorbable en monofilament synthétique selon un motif interrompu simple et fermez la peau avec une suture non résorbable en monofilament synthétique selon un motif interrompu simple (reportez-vous au tableau des matériaux).
REMARQUE : Si une procédure bilatérale en une seule étape est prévue, tournez le chien de l’autre côté avec le membre non traité en position suspendue. Après la préparation aseptique, les étapes de l’intervention chirurgicale 3.10-4.27 sont effectuées de la même manière. - Effectuer une imagerie postopératoire consistant en une tomodensitométrie des hanches ou des radiographies orthogonales de la hanche en vues latéro-oblique et ventro-dorsale pour l’évaluation finale du positionnement de l’implant et de la mise en place de la vis (Figure 9).
5. Prise en charge postopératoire
- Fournir des soins de nuit aux patients hospitalisés et gérer la douleur (p. ex., avec des perfusions continues [IRC] de kétamine HCl 2-10 mcg∙kg-1∙min-1 ou de citrate de sufentanil 0,1 mcg∙kg-1∙h-1 avec de la méthadone (IV, 0,2 mg/kg toutes les 6 h), du carprofène (IV, 4 mg/kg une fois par jour) et de la gabapentine (PO, 10 mg/kg toutes les 8 h) (voir la table des matières).
- Permettre une courte laisse postopératoire directe au besoin pour uriner et déféquer sur le sol non glissant le lendemain (voir vidéo supplémentaire S1).
REMARQUE : En cas d’instabilité des membres postérieurs ou de problèmes de remontée, utilisez une écharpe de soutien ou une serviette sous le ventre pour soutenir les membres postérieurs. - Permettre le congé à domicile le lendemain de l’intervention chirurgicale après le retrait du cathéter de Foley et lorsque l’on observe une miction volontaire.
- Prescrire des médicaments pour la gestion de la douleur à la maison (p. ex. des médicaments oraux tels que le carprofène 2 mg/kg deux fois par jour et la gabapentine 10 mg/kg toutes les 8 h pendant 14 jours) (voir le tableau des matières).
REMARQUE : Chez les chiens hyperactifs, le chlorhydrate de trazodone 2-5 mg / kg deux fois par jour (reportez-vous au tableau des matériaux), par voie orale peut être administré. Cela peut être poursuivi pendant 1 à 2 semaines postopératoires pour assurer une rééducation sûre sans activités à fort impact. - Interdisez les activités à fort impact (par exemple, sauter, courir, monter les escaliers, courir avec d’autres animaux de compagnie ou « logement brutal ») pendant 6 semaines postopératoires. À la maison, promenez lentement les chiens et encouragez-les à utiliser le(s) membre(s) postérieur(s) opéré(s) selon un programme d’exercice hebdomadaire. Dans les 6 semaines postopératoires, laissez le patient chien se promener avec une laisse 4 à 6 fois par jour, d’abord pendant 5 à 10 minutes chacune au cours des 2 premières semaines, puis prolongez la durée de 5 minutes toutes les 2 semaines.
- Avisez un professionnel de la physiothérapie et/ou de l’hydrothérapie à partir de la deuxième semaine après la chirurgie, lorsque la cicatrisation de la peau est terminée.
Résultats Représentatifs
Des résultats à court terme de l’extension du rebord acétabulaire ont déjà été publiés, issus d’une étude observationnelle en cours au Département des sciences cliniques de l’Université d’Utrecht18. De décembre 2019 à mars 2022, un total de 61 hanches de 34 chiens ont été incluses dans l’étude. La cohorte était composée de 24 mâles et 10 femelles, d’un âge médian de 12 mois (allant de 7 à 38 mois) et d’un poids corporel médian de 27,3 kg (allant de 12 à 86 kg). Sept chiens ont subi une intervention chirurgicale unilatérale de la hanche, tandis que vingt chiens ont subi une chirurgie bilatérale de la hanche en une seule séance. De plus, sept chiens ont subi une intervention chirurgicale aux deux hanches, menée en deux séances distinctes.
L’étude précédente a révélé une augmentation significative de l’angle de Norberg (NA), du pourcentage linéaire de couverture de la tête fémorale (LFO) et du pourcentage de couverture de la tête fémorale (PC) immédiatement après l’implantation (Tableau 1). De plus, le signe de subluxation postopératoire d’Ortolani était négatif dans 96,7 % des membres opérés, ce qui indique que l’implant d’extension du rebord acétabulaire a restauré la congruence de la hanche et diminué la laxité des hanches dysplasiques18. En particulier, la possibilité d’augmenter la couverture de la tête fémorale sans effectuer d’ostéotomie redirectionnelle a permis de conserver la géométrie pelvienne physiologique. La technique mini-invasive a entraîné une faible incidence de complications (4,9 %) à court terme, a encouragé la mobilisation précoce et a diminué la douleur liée à l’activité (tableau 1).
De plus, cette technique a permis la pose d’implants bilatéraux 3DHIP en une seule étape. Les membres traités ont été mis en charge sans soutien pelvien dans les 12 à 24 heures suivant la chirurgie. Au cours de la période de surveillance de 12 mois, 3 chiens ont nécessité une chirurgie de révision en raison soit d’une défaillance de l’implant (2 chiens), soit d’une avancée significative de l’arthrose (1 chien). En utilisant l’approche chirurgicale présentée en même temps que les mouvements suggérés de l’articulation de la hanche (abduction, flexion et rotation externe), une meilleure exposition de la face ventroc-audale de la diaphyse iliaque et de la face craniodorsale de l’articulation de la hanche a été obtenue, facilitant le positionnement de l’implant 3DHIP. De plus, la fluoroscopie peropératoire a augmenté la précision du positionnement de l’implant.
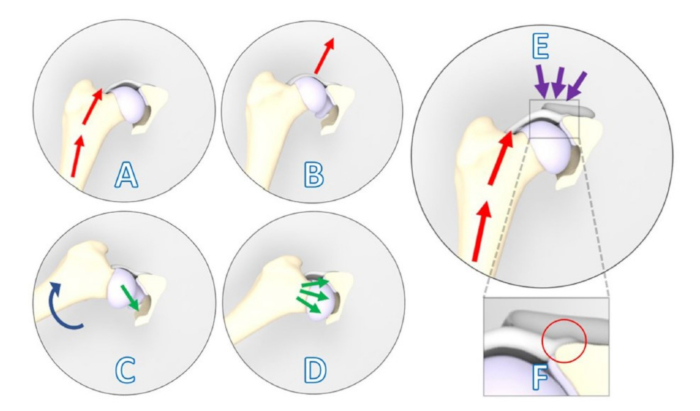
Figure 1 : Illustrations schématiques montrant un signe de subluxation d’Ortolani positif contrecarré par l’implant 3DHIP. (A-D) Signe de subluxation d’Ortolani positif. (A) Le membre du chien est positionné en flexion et adduction neutres, et une force (flèches rouges) est exercée vers le dos du chien le long de l’axe fémoral qui provoque (B) une subluxation dorsale de l’articulation dysplasique de la hanche. (C) L’abduction progressive d’un membre (flèche bleue) est effectuée tout en maintenant la pression sur le fémur. (D) En fonction de l’insuffisance du bord acétabulaire, la tête fémorale subluxée retombe dans la cavité (flèches vertes). (E) L’implant 3DHIP est introduit pour améliorer la stabilité de l’articulation dysplasique de la hanche en renforçant la capsule de la hanche et le labrum, qui servent de surfaces de mise en charge et de stabilisation (flèches violettes). (F) Lors de l’agrandissement de la zone rectangulaire, le décalage interne de 1,5 mm de l’implant est visible dans le cercle rouge, ce qui garantit que la fixation de la capsule ne reste pas affectée. Cette figure a été modifiée à partir de Willemsen et al.17. Abréviation : 3DHIP = imprimé en 3 dimensions, implant de hanche. Veuillez cliquer ici pour voir une version agrandie de cette figure.
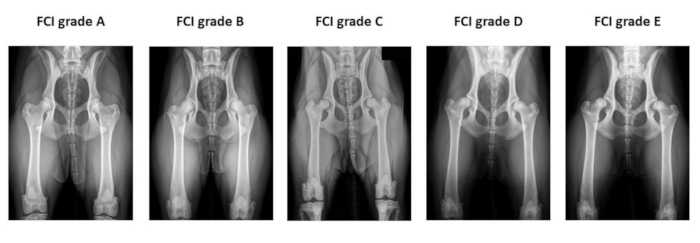
Figure 2 : Exemple de radiographies préopératoires de la hanche utilisées pour la classification de la dysplasie de la hanche de la Fédération Cynologique Internationale. Les radiographies sont prises en position ventro-dorsale de la hanche étendue. De gauche à droite, la FCI classe la dysplasie de la hanche en cinq catégories différentes : A (normale), B (limite), C (dysplasie légère de la hanche), D (dysplasie modérée de la hanche) et E (dysplasie sévère de la hanche). Abréviation : FCI = Fédération Cynologique Internationale. Veuillez cliquer ici pour voir une version agrandie de cette figure.
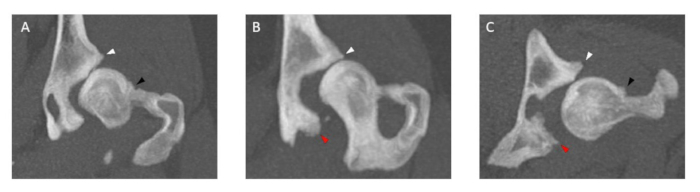
Figure 3 : Images d’examens de TDM de l’articulation de la hanche illustrant des ostéophytes de tailles variables. L’épaisseur de tous les ostéophytes est mesurée à la fois dans les plans coronaux (A, B) et dans les plans transversaux (C) au niveau du bord acétabulaire du crâne (pointe de flèche blanche) et de la caudale (pointe de flèche rouge) et du col fémoral (pointe de flèche noire). Les chiens qui ont des ostéophytes du col fémoral et/ou du bord acétabulaire crânien et caudal, > 2 mm sont exclus. L’épaisseur de la coupe de l’examen CT est de 5 mm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
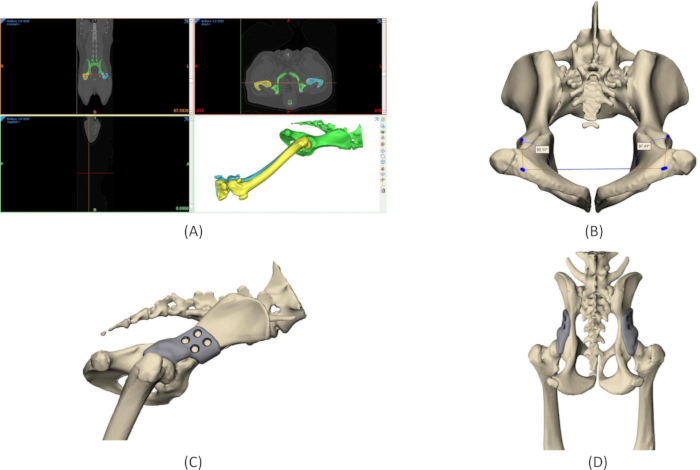
Figure 4 : Processus de conception de l’implant 3DHIP. (A) Segmentation de la région d’intérêt à partir des données CT DICOM. (B) Mesures des angles de Norberg natifs sur le modèle 3D du bassin. (C) Rendu d’un implant 3DHIP sur la hanche droite, vue latérale. (D) Rendu d’implants bilatéraux 3DHIP, vue dorsale-ventrale. Abréviation : 3DHIP = imprimé en 3 dimensions, implant de hanche. Veuillez cliquer ici pour voir une version agrandie de cette figure.
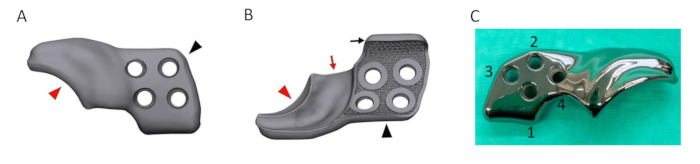
Figure 5 : Rendu d’un implant 3DHIP conçu. (A) Image rendue de la face latérale/externe de l’implant 3DHIP. (B) Image rendue de la surface interne de l’implant montrant la surface poreuse permettant la croissance osseuse pour l’ostéointégration. La partie de fixation osseuse (pointe de flèche noire) de l’implant enduit incorporant 4 trous de vis de verrouillage et la bride de l’ilium ventral (flèche noire) pour aider au positionnement et à la stabilisation corrects de l’implant. La partie d’extension de la jante (pointe de flèche rouge) de l’implant rendu avec le décalage interne de 1,5 mm (flèche rouge) permettant une fixation sans entrave de la capsule articulaire. (C) Photographie d’un implant 3DHIP en titane présentant 4 trous de vis disposés dans l’ordre d’insertion de la vis. Abréviation : 3DHIP = imprimé en 3 dimensions, implant de hanche. Veuillez cliquer ici pour voir une version agrandie de cette figure.
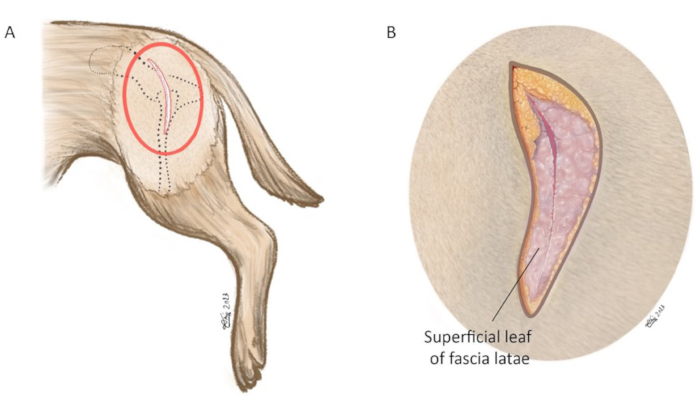
Figure 6 : Illustration schématique de l’incision cutanée. (A) L’ovale rouge marque la zone dans laquelle l’incision cutanée est pratiquée. (B) Grossissement du cercle rouge en (A). L’incision cutanée est faite à l’aide d’une lame #10 centrée sur l’extrémité du grand trochanter visant l’épine iliaque dorsale crânienne. La longueur de l’incision est d’environ 8 à 15 cm. Dans l’image agrandie, la feuille superficielle du fascia latae est incisée le long du bord du muscle crânien du muscle biceps fémoral. Orientation : la gauche est crânienne, le haut est dorsal. Veuillez cliquer ici pour voir une version agrandie de cette figure.
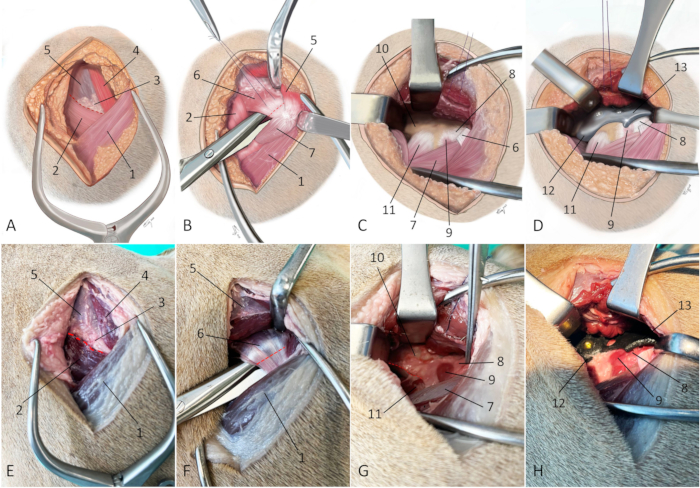
Figure 7 : Illustrations schématiques et photographies d’un cadavre embaumé illustrant l’approche chirurgicale pour l’implantation 3DHIP. (A-D) Les illustrations schématiques et les photographies (E-H) d’un cadavre embaumé illustrent l’approche chirurgicale pour l’implantation 3DHIP. (A et E) La ligne pointillée rouge marque la ligne de l’incision à travers le septum intermusculaire entre le muscle fessier superficiel, le muscle fessier moyen et le muscle tenseur du fascia latae. (B et F) La ligne pointillée rouge marque le site de ténotomie. Les muscles fessiers superficiels et moyens sont rétractés dorsalement pour exposer le muscle fessier profond. Les ciseaux de dissection sont utilisés pour saper le muscle fessier profond près de son insertion sur le grand trochanter. Une ténotomie est réalisée à proximité (à 0,5-1 cm) de son insertion sur l’os. (C et G) Une exposition adéquate pour la pose d’un implant 3DHIP nécessite de libérer le muscle fessier profond de la capsule articulaire et de la surface latérale du corps iliaque et de libérer partiellement le muscle iliaque et les muscles droits du fémur du bord caudo-ventral de la diaphyse iliaque (ligne pointillée rouge). (D et H) L’implant 3DHIP est placé à l’extérieur de la capsule de l’articulation de la hanche. Pour plus de précision et de facilité de positionnement, la bride de l’ilium de la partie de fixation de l’implant est placée sous le bord ventral de la diaphyse iliaque caudo-ventrale exposée. Orientation : la gauche est crânienne, le haut est dorsal. 1) muscle biceps fémoral, 2) muscle tenseur du fascia latae, 3) triangle graisseux, 4) muscle fessier superficiel, 5) muscle fessier moyen, 6) muscle fessier profond, 7) muscle large latéral, 8) capsule articulaire de la hanche, 9) muscle articulaire coxae, 10) partie caudale du corps iliaque, 11) muscle droit fémoral, 12) bride de l’implant et 13) partie d’extension du bord de l’implant. Veuillez cliquer ici pour voir une version agrandie de cette figure.
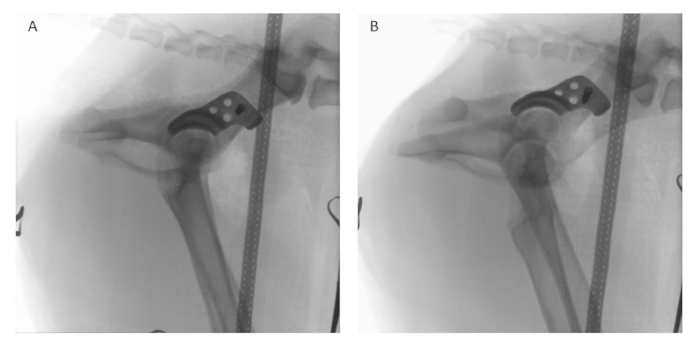
Figure 8 : Fluoroscopie peropératoire. Après le positionnement de l’implant et la fixation temporaire à l’aide d’une vis de blocage, la fluoroscopie peropératoire est réalisée en vue latérale (A) et (B) latéro-oblique à l’aide d’un intensificateur d’image numérique pour évaluer et comparer le positionnement de l’implant à la planification préopératoire. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 9 : Exemples de radiographies postopératoires dans trois plans et de tomodensitométrie postopératoire après une chirurgie bilatérale d’implant 3DHIP en une seule étape chez un chien. (A) Vue ventro-dorsale radiographique ; (B) radiographie vue latéro-oblique droite ; (C) radiographie vue latéro-oblique gauche. Reconstruction 3D à partir d’un scanner postopératoire en vue latérale montrant la hanche droite (D) et la vue dorso-ventrale. (F) TDM postopératoire des deux hanches dans le plan transversal avec une épaisseur de tranche de 5 mm. Les implants 3DHIP ont été fixés à l’aide de quatre vis de blocage de chaque côté. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Mesures des résultats | Préopératoire | Postopératoire immédiat | 1,5 mois | 3 mois | Valeur p |
| NA (◦) | 87 ± 13a | 134 ± 19b | - | 131 ± 20b | 0,001 <* |
| LFO (%) | 22 ± 15A | 81 ± 16b | - | 76 ± 19b | 0,001 <* |
| PC (%) | 33 ± 17A | 79 ± 21b | - | 77 ± 20b | 0.002* |
| IPHC (%) | 31.44 ± 11.9A | - | 20.39 ± 10.09b | 17,69 ± 10,8b | <0,001** |
Tableau 1 : Résultats à court terme (moyenne ± écart-type) des mesures radiographiques à l’aide de la tomodensitométrie coronale et du questionnaire du propriétaire lié à la douleur à l’aide de l’indice de douleur chronique d’Helsinki chez les chiens atteints de dysplasie de la hanche ayant subi une implantation 3DHIP. Ce tableau a été modifié à partir de Kwananocha et al.18. HCPI (%) = 100 % × score total de l’indice/score maximal possible des questions répondues. La valeur p a,b< 0,05 de Bonferroni, la valeur p* de l’analyse de mesures répétées, la valeur p** du modèle mixte linéaire généralisé. Abréviations : NA = angle de Norberg ; LFO = pourcentage linéaire de chevauchement de la tête fémorale ; PC = pourcentage de couverture de la tête fémorale ; ET = écart-type ; HCPI = Indice de douleur chronique d’Helsinki.
Vidéo supplémentaire S1 : La mise en charge postopératoire directe est autorisée avec seulement de courtes promenades en laisse sur un sol antidérapant dès le lendemain de l’opération. Veuillez cliquer ici pour télécharger cette vidéo.
Discussion
L’extension du rebord acétabulaire à l’aide de l’implant 3DHIP offre des avantages par rapport aux thérapies chirurgicales conventionnelles pour la dysplasie canine de la hanche et a montré des résultats prometteurs pour augmenter la couverture de l’articulation dysplasique de la hanche et inverser la laxité de la hanche dans le suivi à court terme17,18. Cette publication visait à présenter la technique chirurgicale avec des trucs et astuces sous forme de manuel chirurgical pour l’implantation de l’implant 3DHIP chez les chiens atteints de dysplasie de la hanche.
Sélection des candidats pour la pose de l’implant 3DHIP - les jeunes chiens âgés de 6 à 24 mois atteints de dysplasie clinique de la hanche marquée par une laxité de la hanche (grade FCI B-D) avec un test de subluxation Ortolani positif sont des candidats adéquats. La plaque de croissance acétabulaire triradiée doit être fermée et, de préférence, aucune arthrose n’est présente sur l’imagerie CT, bien que des ostéophytes mineurs jusqu’à 2 mm soient acceptés. Les chiens avec des hanches luxueuses avec une luxation presque complète de la tête fémorale ne sont pas acceptés pour la pose d’implants 3DHIP en raison de la progression rapide de l’arthrose, de l’incapacité de la tête fémorale à se déplacer dans l’acétabulum et de la conversion précoce attendue en remplacement total de la hanche.
Il y a quelques étapes critiques dans la technique chirurgicale.
Conception de l’implant
Compte tenu de la conception individualisée des implants 3DHIP, une évaluation préopératoire de l’articulation dysplasique de la hanche à l’aide d’un scanner est absolument obligatoire. En plus de la détermination de la taille correcte de l’implant et de la position de la bride iliale ventrale, il est possible de déterminer en particulier la quantité d’extension du rebord acétabulaire nécessaire pour couvrir suffisamment la tête fémorale.
Approche chirurgicale
Une étape critique de la chirurgie est l’exposition suffisante du bord acétabulaire dorsal et du bord ventral du corps iliaque caudal pour la pose de l’implant. L’approche chirurgicale du corps iliaque et des aspects craniodorsaux de l’articulation de la hanche dans l’implantation 3DHIP diffère des approches conventionnelles22. Dans la technique présentée, une ostéotomie trochantérienne a été omise et une ténotomie fessière profonde a été réalisée tout en préservant les muscles fessiers superficiels et moyens. Ainsi, le risque de complications associées aux ostéotomies trochantériennes 23,24,25 telles que le retard ou l’absence de consolidation a été évité et le processus de récupération a été accéléré. De plus, cette approche craniodorsale modifiée peut être utilisée dans une variété d’âges, de races et de tailles de chiens sans aucune modification nécessaire. Notamment, aucune complication n’a été signalée en association avec l’approche chirurgicale présentée.
Pose correcte de l’implant
Même si l’implant de hanche imprimé en 3D sur mesure est conçu pour s’adapter parfaitement à l’anatomie acétabulaire unique de chaque chien, un placement imparfait de l’implant avec une déviation craniocaudale de 4 à 5 mm par rapport à la position cible de planification a été observé dans la première cohorte de chiens, peut-être liée à la courbe d’apprentissage avec la technique18. La bride iliale ventrale de la partie d’attache osseuse de l’implant 3DHIP permet un positionnement plus précis, en particulier dans la direction dorso-ventrale. Cependant, en raison de la position extracapsulaire de l’implant, il est encore difficile d’obtenir un positionnement parfait de l’implant ; Le bord interne de l’acétabulum est obscurci par la membrane synoviale. De plus, la formation d’ostéophytes pendant le délai de production de l’implant peut influencer le bon positionnement de l’implant. Pour garantir un positionnement précis de l’implant selon le plan préopératoire, une vérification par fluoroscopie peropératoire est actuellement nécessaire. On s’attend également à ce qu’avec une expérience accrue, la précision du positionnement de l’implant diminue encore pour atteindre une précision de placement inférieure à 1-2 mm. À l’avenir, la chirurgie guidée à l’aide de guides de forage chirurgicaux imprimés en 3D pourrait éviter le besoin de fluoroscopie.
Cette technique présente également certaines limites. Les résultats précédents à court terme suggèrent une large bande passante d’anatomies de hanche différentes qui peuvent être traitées à l’aide d’implants 3DHIP. Bien que les résultats de l’étude à long terme ne soient pas encore disponibles, il est conseillé d’envisager l’implantation de 3DHIP pour les chiens qui ne présentent pas de signes d’arthrose (OA) ou qui n’ont qu’un léger degré d’arthrose dans les articulations de la hanche. La pose d’implants 3DHIP vise à ralentir efficacement la progression de la détérioration de l’articulation de la hanche. Les chiens présentant des hanches luxueuses et une dégénérescence modérée à sévère de la hanche, telle que déterminée lors de l’évaluation préopératoire, doivent être exclus.
Par rapport à l’implantation 3DHIP, les chirurgies conventionnelles pour traiter la dysplasie de la hanche canine telles que DPO/TPO présentent plus de défis, en particulier dans une procédure bilatérale en une seule étape et/ou chez les chiens géants en raison de leur nature invasive impliquant deux ou trois ostéotomies pelviennes 5,6,7,26. Par conséquent, les chiens atteints de MH bilatérale peuvent bénéficier d’une extension du bord acétabulaire à l’aide d’un implant 3DHIP ; Il s’agit d’une procédure bilatérale en une seule étape efficace et peu invasive. De plus, l’implantation 3DHIP permet de gagner un temps précieux et peut prévenir le développement ultérieur de l’arthrose qui pourrait survenir dans les procédures bilatérales en deux étapes.
Pour conclure, l’utilisation de l’implant 3DHIP présenté pour étendre le bord acétabulaire dorsal est très prometteuse en tant que traitement chirurgical alternatif de la dysplasie de la hanche chez les chiens. En particulier, la possibilité d’offrir une procédure bilatérale en une seule étape efficace et peu invasive pour les chiens atteints de dysplasie bilatérale de la hanche et de laxité est un énorme avantage par rapport aux traitements alternatifs actuels. Un suivi plus poussé de cette nouvelle technique à moyen et long terme est obligatoire.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à déclarer. BM est l’un des cinq inventeurs de la méthode de fabrication d’un implant d’extension du bord acétabulaire dorsal (2021) dont le brevet (EP3463198B1) a été concédé sous licence à Rita Leibinger.
Remerciements
La présente étude a été principalement soutenue financièrement par la fondation Vrienden Diergeneeskunde Universiteit Utrecht ; MT a reçu un financement à long terme de la Société néerlandaise de l’arthrite (LLP22) ; FV et JM sont financés par Eurostars Project E115515 - 3DHIP. IK est titulaire d’une bourse de la Faculté de médecine vétérinaire de l’Université de Kasetsart, en Thaïlande.
matériels
| Name | Company | Catalog Number | Comments |
| The laborotory for implant design | |||
| 3D Lab | University Medical Center Utrecht 3D, Utrecht, Netherlands | The laboratory responsible for designing the 3DHIP implant. [https://www.umcutrecht.nl/nl/3d-lab/] | |
| Software | |||
| 3-Matic software version 17 | Materialise, Leuven, Belgium | CT DICOM data processing | |
| Materialise Mimics software version 25.1 | Materialise, Leuven, Belgium | Software to design the 3DHIP implant on the 3D model of the pelvis | |
| Implant manufacturer | |||
| Amnovis | Amnovis, Aarschot, Belgium | Printing and postprocessing of the 3DHIP implant. [https://www.amnovis.com/] | |
| Instrument and machine | |||
| 2.4 LeiLOX locking screw titanium | Rita Leibinger, BW, Germany | 242-224 | Titanium self tapping locking screw 2.4 mm. |
| 2.7 LeiLOX locking screw titanium | Rita Leibinger, BW, Germany | 242-227 | Titanium self tapping locking screw 2.7 mm. |
| 3.5 LeiLOX locking screw titanium | Rita Leibinger, BW, Germany | 242-235 | Titanium self tapping locking screw 3.5 mm. |
| BLUE SEAL 100 x 360 mm | Interster, Wormerveer, Netherlands | 3FKFB210819 | The transparent sterilization laminate size 100 x 360 mm |
| ETHILON 3-0 with FS-1 needle | Johnson & Johnson Medical GmbH, Norderstedt, Germany | 669H | Polyamide 6 3-0 (non-absorbable suture material) with 24 mm 3/8c reverse cutting needle using for skin closure |
| Fluoroscopy model NZS 229 | Philips, Eindhoven, Netherlands | Fluoroscopy | |
| Foley Catheter 10 fr x 90 cm (36") with 3 cc Balloon | MILA international inc., Kentucky, USA | MLIUC1036 | Foley urine catheter size 10 fr |
| Foley Catheter 6 fr x 60 cm (24") with 3 cc Balloon | MILA international inc., Kentucky, USA | MLIUC624 | Foley urine catheter size 6 fr |
| Foley Catheter 8 fr x 90 cm (36") with 3 cc Balloon | MILA international inc., Kentucky, USA | MLIUC836 | Foley urine catheter size 8 fr |
| Ioban 2 | 3M, MN, USA | 6640EU | Iodine-impregnated surgical drape |
| Miele professional G 7826 | Miele Nederland B.V., Vianen, Netherlands | The hygienic washing machine | |
| MMM sterilizer OB10643 | MMM Group, Planegg, Germany | Steam autoclave | |
| MONOCRYL 2-0 with SH Plus needle | Johnson & Johnson Medical GmbH, Norderstedt, Germany | MCP3170H | Poliglecaprone 25 plus antibacterial 2-0 (absorbable suture material) with 26 mm 1/2c taperpoint needle using for subcutaneous tissue closure |
| MONOCRYL 3-0 with SH Plus needle | Johnson & Johnson Medical GmbH, Norderstedt, Germany | MCP3160H | Poliglecaprone 25 plus antibacterial 3-0 (absorbable suture material) with 26 mm 1/2c taperpoint needle using for subcutaneous tissue closure |
| PDS 0 with CP needle | Johnson & Johnson Medical GmbH, Norderstedt, Germany | PDP485H | Polydioxanone plus antibacterial 0 (absorbable suture material) with 40 mm 1/2c reverse cutting needle using for muscle fascia and tendon closure |
| PDS 2-0 with CP-1 needle | Johnson & Johnson Medical GmbH, Norderstedt, Germany | PDP466H | Polydioxanone plus antibacterial 2-0 (absorbable suture material) with 36 mm 1/2c reverse cutting needle using for muscle fascia and tendon closure |
| ProX DMP320 | 3D systems, South Carolina, USA | Direct metal printing machine using selective laser melting technology | |
| Medications | |||
| Betadine oplossing | Mylan B.V., Amstelveen, Netherlands | RVG 01331 | Povidone-iodine solution 100 mg/mL (500 mL) |
| Betadine shampoo | Mylan B.V., Amstelveen, Netherlands | RVG 08943 | Povidone-iodine 75 mg/mL (120 mL) |
| Carporal 20 mg | AST Farma B.V. Oudewater, Netherlands | REG NL 101766 | Carprofen 20 mg/tablet |
| Carporal 40 mg | AST Farma B.V. Oudewater, Netherlands | REG NL 115715 | Carprofen 40 mg/tablet |
| Carporal 50 mg | AST Farma B.V. Oudewater, Netherlands | REG NL 101767 | Carprofen 50 mg/tablet |
| Cefazolin Mylan 1 g | Mylan B.V., Amstelveen, Netherlands | RVG 16532 | Cefazolin powder 1 g for injection |
| Chlorhexidine 0.5% in alcohol 70% spray | Orphi Farma BV, Lage Zwaluwe, Netherlands | 8711407672906 | Chlorhexidine 0.5% in alcohol 70% spray (250 mL) |
| Dexdomitor 0.5 mg/mL | Orion Corporation, Espoo, Finland | EU/2/02/033/001-002 | Dexmedetomidine hydrochloride 0.5 mg/mL for injection (20 mL) |
| Gabapentin Sandoz 300 mg | Sandoz B.V., Almere, Netherlands | RVG 33681 | Gabapentin 300 mg/capsule |
| GABAPENTINE TEVA 100 mg | Teva B.V., Haarlem, Netherlands | RVG 31980 | Gabapentin 100 mg/capsule |
| HiBiScrub | Mölnlycke Health Care AB., Utrecht, Netherlands | RVG 10156 | Chlorhexidine digluconate 40 mg/mL (500 mL) |
| Insistor 10 mg/mL | Richter pharma AG, Oostenrijk, Netherlands | REG NL 121166 | Methadone hydrochloride 10 mg/mL for injection (10 mL) |
| Isoflutek 1000 mg/g | Laboratorios Karizoo S.A., Barcelona, Spain | REG NL 118938 | Isoflurane 1000 mg/g (250 mL) |
| Levobupivacaine Fresenius Kabi 2.5 mg/mL | Fresenius Kabi Nederland b.v., Huis ter Heide, Netherlands | AWA 0611 | Levobupivacaine 2.5 mg/mL solution for injection (10 mL) |
| Morfine HCI CF 10 mg/mL | Centrafarm B.V., Breda, Netherlands | RVG 50836 | Morphine hydrochloride 10 mg/mL (1 mL) |
| Narketan 10 | Vetoquinol B.V., Breda, Netherlands | vm08007/4090 | Ketamine 10 mg/mL (10 mL) |
| Propofol 10 mg/mL | Fresenius Kabi Nederland b.v., Huis ter Heide, Netherlands | RVG 110627 | Propofol 10 mg/mL emulsion for injection or infusion (50 mL) |
| Rimadyl | Zoetis B.V., Capelle a/d Ijssel, Netherlands | REG NL 10101 | Carprofen 50 mL/mL for injection (20 mL) |
| Sufentanil-hameln 50 mcg/mL | Hameln pharma gmbh, Hameln, Germany | 4260016653249 | Sufentanil citrate 50 mcg/mL for injection |
| Trazadone EG 100 mg | EG (Eurogenerics) NV Heizel, Brussel, Belgium | BE439607 | Trazadone hydrochloride 100 mg/tablet |
Références
- King, M. D. Etiopathogenesis of canine hip dysplasia, prevalence, and genetics. Vet Clin North Am Small Anim Pract. 47 (4), 753-767 (2017).
- Akis, I., et al. The association of genetic polymorphisms of bone formation genes with canine hip dysplasia. Iran J Vet Res. 21 (1), 40-45 (2020).
- Loder, R. T., Todhunter, R. J. The demographics of canine hip dysplasia in the United States and Canada. J Vet Med. 2017, 1-15 (2017).
- Schachner, E. R., Lopez, M. J. Diagnosis, prevention, and management of canine hip dysplasia: a review. Vet Med (Auck)l. 6, 181-192 (2015).
- Vezzoni, A., Boiocchi, S., Vezzoni, L., Vanelli, A. B., Bronzo, V. Double pelvic osteotomy for the treatment of hip dysplasia in young dogs). Vet Comp Orthop Traumatol. 23 (6), 444-452 (2010).
- Tavola, F., Drudi, D., Vezzoni, L., Vezzoni, A. Postoperative complications of double pelvic osteotomy using specific plates in 305 dogs. Vet Comp Orthop Traumatol. 35 (1), 47-56 (2022).
- Koch, D. A., Hazewinkel, H. A. W., Nap, R. C., Meij, B. P., Wolvekamp, W. T. C. Radiographic evaluation and comparison of plate fixation after triple pelvic osteotomy in 32 dogs with hip dysplasia. Vet Comp Orthop Traumatol. 06 (01), 09-15 (1993).
- Rose, S. A., Bruecker, K. A., Petersen, S. W., Uddin, N. Use of locking plate and screws for triple pelvic osteotomy. Vet Surg. 41 (1), 114-120 (2012).
- Remedios, A. M., Fries, C. L. Implant complications in 20 triple pelvic osteotomies. Vet Comp Orthop Traumatol. 06 (04), 202-207 (1993).
- Moses, P. A. Alternative surgical methods for treating juvenile canine hip dysplasia. Aust Vet J. 78 (12), 822-824 (2000).
- Harper, T. A. M. Femoral head and neck excision. Vet Clin North Am Small Anim Pract. 47 (4), 885-897 (2017).
- Forster, K. E., et al. Complications and owner assessment of canine total hip replacement: a multicenter internet based survey. Vet Surg. 41 (5), 545-550 (2012).
- Volstad, N. J., Schaefer, S. L., Snyder, L. A., Meinen, J. B., Sample, S. J. Metallosis with pseudotumour formation: Long-term complication following cementless total hip replacement in a dog. Vet Comp Orthop Traumatol. 29 (4), 283-289 (2016).
- Nesser, V. E., Kowaleski, M. P., Boudrieau, R. J. Severe polyethylene wear requiring revision total hip arthroplasty in three dogs. Vet Surg. 45 (5), 664-671 (2016).
- Verhoeven, G., Fortrie, R., Van Ryssen, B., Coopman, F. Worldwide screening for canine hip dysplasia: where are we now. Vet Surg. 41 (1), 10-19 (2012).
- Willemsen, K., et al. Patient-specific 3D-printed shelf implant for the treatment of hip dysplasia: Anatomical and biomechanical outcomes in a canine model. J Orthop Res. 40 (5), 1154-1162 (2021).
- Willemsen, K., et al. Patient-specific 3D-printed shelf implant for the treatment of hip dysplasia tested in an experimental animal pilot in canines. Sci Rep. 12 (1), 3032 (2022).
- Kwananocha, I., et al. Acetabular rim extension using a personalized titanium implant for treatment of hip dysplasia in dogs: short-term results. Front Vet Sci. 10, 1160177 (2023).
- Van Der Wal, B. C. H., Sakkers, R. J. B., Meij, B. P., Evers, L. A. M., Weinans, H. H. . Method of manufacturing an implant. EP3463198B1. , (2021).
- Brainard, B. M., Hofmeister, E. H. Anesthesia principles and monitoring. Small Animal Surgery. , (2012).
- Martinez-Taboada, F., Redondo, J. I. Comparison of the hanging-drop technique and running-drip method for identifying the epidural space in dogs. Vet Anaesth Analg. 44 (2), 329-336 (2017).
- Johnson, K. A. Approach to the craniodorsal aspect of the hip joint through a craniolateral incision in the dog. Piermattei's Atlas of Surgical Approaches to the Bones and Joints of the dog and cat. , (2014).
- Whitelock, R. G., Dyce, J., Houlton, J. E. Repair of femoral trochanteric osteotomy in the dog. J Small Anim Pract. 38 (5), 195-199 (1997).
- Silveira, C. J., Saunders, W. B. Greater trochanter osteotomy as a component of cementless total hip replacement: Five cases in four dogs. Vet Surg. 51 (2), 303-310 (2022).
- Archibeck, M. J., Rosenberg, A. G., Berger, R. A., Silverton, C. D. Trochanteric osteotomy and fixation during total hip arthroplasty. J Am Acad Orthop Surg. 11 (3), 163-173 (2003).
- Vezzoni, A. Complications of double and triple pelvic osteotomies. Complications in Small Animal Surgery. , (2016).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon