Method Article
Détection et isolement de Campylobacter spp. à partir de viande crue
Dans cet article
Résumé
Campylobacter est la principale cause de gastro-entérite bactérienne d’origine alimentaire dans le monde. Bien que les établissements aient adopté des mesures pour réduire la prévalence dans leurs installations, les produits contaminés atteignent systématiquement les consommateurs. La technique mise au point au cours des douze dernières années vise à remédier aux limites des méthodes existantes d’isolement et de détection de Campylobacter spp. dans la viande crue.
Résumé
Cet article présente un protocole rapide mais robuste pour isoler Campylobacter spp. des viandes crues, en se concentrant spécifiquement sur Campylobacter jejuni et Campylobacter coli. Le protocole s’appuie sur des méthodes établies, assurant la compatibilité avec les techniques courantes employées par les organismes de réglementation tels que la Food and Drug Administration (FDA) et le ministère américain de l’Agriculture (USDA) aux États-Unis, ainsi que l’Organisation internationale de normalisation (ISO) en Europe. Au cœur de ce protocole se trouve la collecte d’un rinçage, qui est concentré et remis en suspension dans un milieu Bolton Broth contenant du sang de cheval. Il a été prouvé que ce milieu facilite la récupération des cellules de Campylobacter stressées et réduit de 50 % la durée d’enrichissement requise. Les échantillons enrichis sont ensuite transférés sur des membranes de nitrocellulose sur des plaques de brucella. Pour améliorer la sensibilité et la spécificité de la méthode, des membranes filtrantes de 0,45 μm et 0,65 μm de la taille des pores ont été évaluées. Les données ont révélé une augmentation de 29 fois de la récupération cellulaire avec le filtre de 0,65 μm par rapport au filtre de 0,45 μm sans impact sur la spécificité. Les caractéristiques très mobiles de Campylobacter permettent aux cellules de se déplacer activement à travers les filtres membranaires vers le milieu gélosée, ce qui permet d’isoler efficacement les colonies de Campylobacter pures. Le protocole intègre un test multiplex d’amplification quantitative en chaîne par polymérase en temps réel (mqPCR) pour identifier les isolats au niveau de l’espèce. Cette technique moléculaire offre un moyen fiable et efficace d’identification des espèces. Des études menées au cours des douze dernières années sur des viandes vendues au détail ont démontré la capacité de cette méthode à améliorer la récupération de Campylobacter à partir d’échantillons de viande naturellement contaminés par rapport aux méthodes de référence actuelles. De plus, ce protocole permet de réduire le temps de préparation et de traitement. En conséquence, il présente une alternative prometteuse pour la récupération efficace de Campylobacter à partir de la viande. De plus, cette procédure peut être intégrée de manière transparente aux méthodes basées sur l’ADN, facilitant le dépistage rapide des échantillons positifs ainsi que l’analyse complète du séquençage du génome entier.
Introduction
Campylobacter spp. est la principale cause de gastro-entérite bactérienne d’origine alimentaire dans le monde, avec environ 800 millions de cas par an1. En tant que bactérie zoonotique majeure, Campylobacter colonise naturellement le tractus gastro-intestinal d’un large éventail d’animaux, y compris les oiseaux sauvages, les animaux de ferme et les animaux domestiques2. Lors de l’abattage ou de la transformation des aliments, Campylobacter spp. contamine fréquemment les carcasses ou les produits carnés3. La campylobactériose est généralement associée à la consommation de volaille insuffisamment cuite ou à la contamination croisée d’autres aliments par des jus de volaille crus2. Elle peut entraîner des complications graves, telles que le syndrome de Guillain-Barré, l’arthrite réactionnelle et la septicémie chez les personnes immunodéprimées4. La détection et l’isolement de Campylobacter à partir de sources alimentaires, en particulier de produits de volaille, sont essentiels pour la surveillance de la santé publique, les enquêtes sur les éclosions et l’évaluation des risques.
Les méthodes conventionnelles basées sur la culture sont les méthodes traditionnelles et standard de détection de Campylobacter 5,6. Cependant, il existe plusieurs limites, notamment de longues durées d’incubation (48 h ou plus), une faible sensibilité (jusqu’à 50 %) et ne sont pas universelles pour toutes les souches (certaines cellules stressées de Campylobacter peuvent ne pas bien se développer ou ne pas se développer du tout dans le milieu)7. Les méthodes moléculaires, comme la réaction en chaîne par polymérase (PCR), sont plus rapides et plus sensibles que les méthodes fondées sur la culture, mais elles ne fournissent pas d’isolats viables pour une caractérisation plus poussée 8,9.
Les méthodes immunologiques sont des méthodes alternatives et complémentaires pour la détection de Campylobacter . Celles-ci sont rapides, simples et polyvalentes, mais présentent également plusieurs limites, notamment la réactivité croisée (certains anticorps peuvent se lier à des bactéries autres que Campylobacter ou à d’autres substances partageant des antigènes similaires), une faible spécificité (certains anticorps peuvent ne pas se lier à toutes les souches ou sérotypes de Campylobacter ) et des exigences en matière de préparation des échantillons (les méthodes immunologiques nécessitent souvent un prétraitement des échantillons pour éliminer les substances interférentes afin d’améliorer la liaison des anticorps)10.
Dans le genre Campylobacter, C. jejuni et C. coli sont à l’origine de la plupart des infections humaines à Campylobacter (81 % et 8,4 %, respectivement)11. Les deux sont des bactéries microaérophiles et thermophiles en forme de spirale contenant un flagelle unipolaire ou bipolaire. La rotation d’un flagelle à chaque pôle est considérée à la fois comme la principale force motrice de sa motilité caractéristique en tire-bouchon et cruciale pour sa pathogenèse car elle permet à la bactérie de nager à travers la muqueuse visqueuse du tractus gastro-intestinal de l’hôte. La motilité de Campylobacter est contrôlée par son système chimiosensoriel qui permet aux cellules de se déplacer vers des environnements favorables12,13. D’après la morphologie cellulaire et les caractéristiques physiologiques de Campylobacter, quelques études ont utilisé la filtration membranaire pour isoler Campylobacter spp. à partir d’échantillons fécaux et environnementaux 14,15,16.
Cette étude présente un protocole rapide et robuste pour l’isolement et la détection ultérieure de C. jejuni et C . coli à partir de viande crue, qui permet de surmonter les inconvénients des méthodes existantes et offre plusieurs avantages. Les colonies provisoires peuvent être confirmées comme étant Campylobacter spp. à l’aide de diverses méthodes, telles que la microscopie, les tests biochimiques (p. ex., les tests d’activité de la catalase et de l’oxydase) ou les méthodes moléculaires6. La méthode identifie les isolats au niveau de l’espèce à l’aide d’un test de PCR multiplex en temps réel (mqPCR) qui cible les gènes uniques à C. jejuni et C. coli. Cette méthode est relativement peu coûteuse, rapide et sélective, ce qui la rend adaptée à une utilisation dans divers contextes, y compris les installations de transformation des aliments, les laboratoires cliniques et les laboratoires de recherche.
Protocole
Tous les travaux associés à ce protocole doivent être effectués dans une enceinte de sécurité biologique (ESB) afin de maintenir des conditions aseptiques et de réduire au minimum le risque de contamination des échantillons ou d’exposition de l’opérateur à des agents pathogènes microbiens. Lorsque vous transférez des échantillons à l’extérieur de l’ESB, utilisez des contenants scellés pour éviter tout déversement en cas de chute accidentelle, tout en préservant l’intégrité de l’échantillon. De préférence, des composants jetables doivent être utilisés tout au long de la procédure pour atténuer le risque de contamination croisée. Dans les cas où les produits jetables ne sont pas réalisables, assurez-vous que tout l’équipement et le matériel sont stériles avant utilisation. Une bonne gestion des déchets est cruciale ; Tous les composants jetables usagés doivent être jetés comme déchets biologiques. Autoclavez les matériaux avant de les jeter pour assurer une stérilisation adéquate et éviter le confinement des matières potentiellement dangereuses. Le respect de ces précautions permet non seulement de préserver l’intégrité de l’échantillon, mais aussi de minimiser le risque d’exposition de l’opérateur à des agents pathogènes microbiens. La figure 1 illustre le flux de travail de la préparation des échantillons, de l’enrichissement sélectif, de l’isolement par filtre et de la différenciation mqPCR des espèces de Campylobacter . Le fichier supplémentaire 1 décrit un flux de travail et des images plus détaillés tout au long du processus.
1. Préparation des échantillons de viande
- Acquisition d’échantillons de viande
- Achetez divers emballages de viande fraîche, y compris des cuisses de poulet, des ailes, des pilons et des foies auprès de détaillants locaux.
- Transférer tous les échantillons dans un stockage à 4 °C et traiter dans les 24 heures suivant leur réception.
REMARQUE : L’entreposage des échantillons frais à des températures plus basses, par exemple en dessous de zéro, affectera la récupération.
- Traitement des échantillons de viande
- Suivre le rapport des composantes prescrit dans la directived’échantillonnage 6,17 du FSIS.
- Coupez 450 g de morceaux de poulet dans chaque paquet et placez-les dans un sac gastrique (voir tableau des matériaux).
REMARQUE : Les sacs Stomacher sont suggérés car ils ont une résistance mécanique suffisante pour assurer les processus en aval, et ne se rompent pas et ne fuient pas. - Préparez de l’eau peptonée tamponnée (EPT).
- Dissoudre 20 g de poudre (voir tableau des matériaux) dans 1 L d’eau purifiée. Autoclaver la solution à 121 °C pendant 15 min. Diluer la solution dans de l’eau stérile à une concentration de 0,1 %.
- Ajouter 200 ml d’EPT à 0,1 % dans le sac contenant le poulet.
- Masser/palper manuellement l’échantillon de l’extérieur du sac stomacher pendant 2 min.
- Prélevez tout le rinçage du poulet du côté filtré du sac à l’aide d’un contrôleur de pipette motorisé (voir le tableau des matériaux).
- Distribuer le rinçage du poulet dans des bouteilles à centrifuger stériles. Centrifuger à 10 000 x g pendant 10 min à température ambiante.
- Prélever soigneusement le surnageant à l’aide d’un contrôleur de pipette motorisé avec une pipette sérologique jetable en plastique de 25 ml. Évitez de déranger le granulé.
- Répétez le processus si nécessaire pour vous assurer que tout le surnageant est éliminé.
- Jetez le surnageant collecté.
2. Enrichissement sélectif de Campylobacter à partir de viande crue
- Préparation du bouillon de Bolton avec des suppléments
- Dissoudre 13,8 g de poudre (voir tableau des matières) dans 500 mL d’eau purifiée. Stériliser le bouillon en autoclave pendant 15 min à 121 °C.
- Ajouter 25 mL de sang de cheval lacé (voir le tableau des matières) au bouillon Bolton stérilisé de 500 mL.
REMARQUE : L’ajout de sang de cheval agit comme un agent de trempe à l’oxygène pour aider à la récupération des cellules de Campylobacter blessées de la matrice alimentaire. - Reconstituer 1 flacon de supplément d’antibiotiques (céfopérazone, cycloheximide, triméthoprime et vancomycine, voir le tableau des matériaux) dans 5 ml d’éthanol à 50 %.
- Ajouter le supplément d’antibiotiques reconstitué au bouillon Bolton.
- Procédure d’enrichissement
- Remettre la pastille en suspension dans 50 ml de bouillon Bolton contenant du sang de cheval lacé et des antibiotiques.
- Placer les échantillons (avec les bouchons desserrés) dans un récipient scellé qui maintient un mélange gazeux de 85 % de N2, 10 % de CO2 et 5 % d’O2.
- Assurez-vous que le bouchon est desserré, mais que le récipient est hermétiquement fermé pour produire les besoins de croissance microaérophiles et thermophiles de Campylobacter.
REMARQUE : Les blocs de gaz qui maintiennent une atmosphère de 85 % de N2, 10 % de CO2 et 5 % de O2 peuvent être utilisés lorsque les chambres environnementales ne sont pas disponibles. - Incuber les échantillons à 42 °C pendant 24 h.
- Assurez-vous que le bouchon est desserré, mais que le récipient est hermétiquement fermé pour produire les besoins de croissance microaérophiles et thermophiles de Campylobacter.
3. Isolement et purification de C. jejuni et de C. coli à partir de poulet cru
- Préparation des plaques de gélose Brucella
- Dissoudre 28 g de poudre de Brucella (voir tableau des matériaux) dans 1 L d’eau purifiée. Dissoudre 15 g de gélose dans la solution Brucella.
- Stériliser la gélose Brucella en autoclave pendant 15 min à 121 °C. Refroidir le mélange de gélose moyenne au bain-marie à 55 °C.
- Verser 20 mL de gélose Brucella dans chaque boîte de Pétri de 100 mm de diamètre.
- Méthode de filtration et culture en colonie
- Évaluer l’effet de l’humidité sur Campylobacter traversant les filtres en séchant les plaques de gélose Brucella avec couvercles ouverts dans une enceinte de biosécurité pendant 0 h, 1 h, 2 h et 3 h.
- Préparer un contrôle sans filtre en étalant directement 80 μL de l’échantillon sur la plaque de gélose Brucella.
- Placer un filtre en acétate de cellulose (0,45 μm ou 0,65 taille de pores, voir Tableau des matériaux) au centre d’une plaque de gélose Brucella.
- Pipeter 4 gouttes/filtre et 20 μL/goutte d’échantillon enrichi sur le filtre.
- Placez les gouttes près du centre du filtre pour vous assurer que le liquide qui atteint la plaque traverse le filtre, et non autour du filtre.
- Placez les gouttes de manière à ce qu’elles ne s’étalent pas et ne s’agrègent pas.
- Incuber les gouttes à température ambiante pendant 15 min et retirer délicatement les filtres.
REMARQUE : Cette étape laisse suffisamment de temps aux cellules de Campylobacter pour traverser la membrane et atteindre le milieu gélosé sans séchage excessif. - Incuber les plaques à 42 °C pendant environ 24 h dans les conditions microaérobies décrites précédemment.
- Choisissez des colonies de Campylobacter caractéristiques avec des caractères spécifiques.
REMARQUE : Les colonies de Campylobacter sont généralement rondes avec des bords lisses, brillants et de couleur jaunâtre ou rosée translucide6. - Striez les colonies sur des plaques de gélose Brucella pour la purification. Répétez cette étape jusqu’à l’obtention de plaques avec une seule morphologie de colonie uniforme.
- Préparer les échantillons pour l’entreposage à long terme.
- Préparez le bouillon de Bolton comme décrit précédemment. Ajouter une colonie de la plaque avec une morphologie de colonie uniforme.
- Cultiver pendant la nuit (24 h) dans les conditions microaérophiles décrites précédemment. Ajouter 900 μL de la culture de nuit dans un flacon cryogénique de 2 mL contenant 100 μL de DMSO.
- Refroidir rapidement dans un bain de glace carbonique et d’éthanol (environ -72 °C) pendant 10 min. Transférer au congélateur à -80 °C pour un stockage à long terme.
4. Identification des espèces de C. jejuni et de C. coli
- Effectuer l’identification au niveau de l’espèce de C. jejuni et de C. coli à l’aide d’un test qPCR multiplex (mqPCR) précédemment développé18,19.
- Effectuez une lyse cellulaire rapide et une extraction d’ADN génomique dans un format de plaque à 96 puits.
REMARQUE : Il est fortement recommandé d’envisager d’utiliser des trousses commerciales (voir le tableau des matières) pour s’assurer que l’échantillon est suffisamment exempt d’inhibiteurs connus de la PCR.- Disperser les colonies de Campylobacter purifiées dans 100 μL de solution d’extraction.
- Lyse des échantillons à 99 °C pendant 10 min suivie d’un refroidissement à 20 °C pendant 2 min dans un thermocycleur.
- Centrifuger la plaque à 8 000 x g pendant 10 min à température ambiante. Prélever 2 μL d’aliquotes du surnageant pour le test mqPCR.
- Préparez un mélange réactionnel de 20 μL composé de 10 μL de 2x Master Mix, 2,0 μL d’échantillon d’ADN, 104 copies de matrice de contrôle d’amplification interne (IAC) et 200 nM de chaque amorce et sonde (voir Tableau des matériaux).
REMARQUE : Les amorces et les sondes de hipO et de cdtA sont les gènes cibles exclusifs de C. jejuni et de C. coli, respectivement. L’IAC se compose d’un segment d’ADN de 79 pb de l’adénovirus humain et est inclus comme témoin positif pour assurer une activité constante de l’ADN polymérase dans tous les échantillons.
- Chargez tous les échantillons en trois exemplaires dans une plaque optique de 96 puits recouverte d’un film optique et placez-les dans un système de PCR en temps réel (voir Tableau des matériaux).
- Amorcez une activation à chaud de l’ADN polymérase à 95 °C pendant 10 min. Poursuivre avec 40 cycles de dénaturation à 95 °C pendant 15 s et de recuit/extension à 60 °C pendant 1 min.
- Effectuez une lyse cellulaire rapide et une extraction d’ADN génomique dans un format de plaque à 96 puits.
5. Énumérer les suspensions cellulaires
- Dénombrer les suspensions cellulaires à l’aide d’une procédure de plaque de chute 6 x 620. Reportez-vous au fichier supplémentaire 1 pour des images illustrant la méthode de la plaque de chute 6 x 6.
- Sécher à l’air libre les plaques de gélose Brucella avec le couvercle retiré dans une hotte à flux laminaire pendant 45 min.
- Ajouter 200 μL de suspension bactérienne à six rangées (A-F) dans la première colonne d’une plaque à 96 puits.
- Répartir 180 μL de milieu Brucella sur six rangées des colonnes restantes (2-12).
- Préparer des dilutions en série de dix fois en utilisant des transferts de 20 μL.
- Par exemple, transférez 20 μL d’échantillon de la première à la deuxième colonne. Répétez ce processus pour un minimum de 6 colonnes.
- Reflux mélanger chaque suspension dix fois à l’aide de la pipette, en changeant les pointes entre chaque transfert.
- À l’aide d’une pipette multicanaux, déposer des gouttes de 7 μL provenant de six rangées d’une colonne sur la surface d’une plaque de gélose Brucella.
- Répétez l’opération pour créer un tableau 6 x 6, en vous assurant que les lignes sont des répliques techniques sur les colonnes.
- Faites sécher les plaques à l’air libre pendant 5 min, puis retournez la plaque. Incuber les plaques à 42 °C pendant 24 h.
- Comptez le nombre de colonies dans chaque dilution représentative.
Résultats
Effet de l’humidité dans les plaques de gélose Brucella pour la filtration passive de Campylobacter
Campylobacter a un petit génome et ne possède pas plusieurs gènes de réponse au stress couramment présents chez d’autres bactéries, telles que E. coli O157 :H7 et Salmonella. Par conséquent, il est plus sensible aux divers stress environnementaux et ne peut pas tolérer la déshydratation ou les niveaux d’oxygène ambiant. À l’inverse, un milieu de gélose trop humide peut inonder le filtre. Cela provoque non seulement la diffusion de l’échantillon à l’extérieur du filtre, mais augmente également le temps d’exposition à l’oxygène21.
Afin de déterminer les conditions appropriées pour l’isolement de Campylobacter par filtre, des plaques de gélose Brucella ont été séchées et les couvercles retirés pendant 0 h, 1 h, 2 h et 3 h à l’intérieur d’une enceinte de sécurité biologique et évaluées pour l’efficacité des cellules de Campylobacter à traverser un filtre de 0,65 μm de la taille d’un pore. Quatre aliquotes de 20 μL de cultures de C. jejuni S27 à des concentrations de 1,53 x 104 et 1,53 x 105 UFC/mL ont été pipetées sur chaque membrane filtrante qui avait été placée sur une plaque Brucella. Après 15 minutes de pénétration, les filtres ont été retirés et les plaques ont été incubées pendant la nuit pour la croissance cellulaire.
Les cellules de 5 plaques répétées ont ensuite été comptées et notées dans le tableau 1. Les résultats ont indiqué que les plaques de gélose séchées pendant 2 h et 3 h ont donné des résultats similaires avec un nombre presque égal de cellules récupérées par filtration passive. Il est à noter que les plaques séchées dans ces conditions pendant 0 h et 1 h n’ont pas permis aux cellules de traverser complètement la membrane dans le délai de 15 minutes utilisé.
Comparaison de différentes membranes filtrantes de la taille des pores pour isoler Campylobacter des foies de poulet
Compte tenu de la taille des cellules de Campylobacter (0,5 à 5 m de longueur et 0,2 à 0,9 m de largeur) et d’une large gamme de tailles de particules alimentaires, des filtres en acétate de cellulose avec des pores de 0,45 m et 0,65 m ont été testés pour l’efficacité du passage de Campylobacter lorsqu’ils ont été incubés pendant 15 minutes. Des échantillons d’aliments composés de 450 g de foies de poulet enrichis de 153 UFC de C. jejuni puis enrichis pendant la nuit ont été utilisés pour l’expérience. En tant que contrôle sans filtre, le placage direct de l’échantillon d’enrichissement a été inclus en parallèle. Les résultats (Figure 2) de 5 plaques répétées ont montré de manière cohérente que le filtre de 0,65 μm de taille de pore permettait à plus de cellules de traverser que les filtres de 0,45 μm de taille de pore, ce qui entraînait une augmentation de ~29 fois plus de cellules obtenues. Le filtre à pores de 0,45 μm a conservé trop de cellules sur la face supérieure du filtre, ce qui a entraîné une récupération significativement plus faible de Campylobacter à partir des aliments par rapport au filtre à pores de 0,65 μm. Comme prévu, il y avait une pelouse de différents organismes de fond poussant sur les plaques de contrôle sans filtre.
Application de la filtration passive dans l’isolement de Campylobacter à partir de poulet vendu au détail
En raison de la motilité inhabituelle des cellules de Campylobacter , la technique de filtration passive a été choisie pour isoler C . jejuni et C. coli des produits de viande vendus au détail, qui sont généralement contaminés par de nombreux organismes de fond. Entre 2014 et 2023, un total de 79 emballages de viande crue, comprenant différentes parties de viande de poulet, de foie de poulet, de foie de bœuf et de foie de veau, ont été collectés dans divers supermarchés locaux. Dans chaque emballage, 450 g ont été prélevés pour l’isolement de Campylobacter spp. En combinant l’enrichissement sélectif de Campylobacter dans un bouillon de Bolton contenant du sang et la filtration passive des cellules à travers un filtre en acétate de cellulose de 0,65 μm directement sur une plaque de gélose Brucella, 49 souches de Campylobacter ont été isolées avec succès à partir de 79 échantillons de viande (tableau 2). La figure 3 représente le résultat de l’isolement d’une nouvelle souche de Campylobacter à partir de foies de poulet. La méthode s’est avérée à plusieurs reprises sensible, spécifique et rentable.
Identification et différenciation des isolats de C. jejuni et de C. coli
Pour vérifier le genre et différencier les espèces d’isolats de Campylobacter obtenus à partir de viande crue, un test qPCR multiplex amplifiant les cibles génétiques spécifiques (hipO et cdtA) pour C. jejuni et C. coli, et un contrôle d’amplification interne (IAC) ont été utilisés. L’IAC a été inclus comme indicateur faux négatif dans l’amplification concomitante de plusieurs gènes. Le test a été mis en œuvre dans un format de 96 puits avec lyse cellulaire rapide et extraction de l’ADN à l’aide d’un réactif disponible dans le commerce (voir le tableau des matériaux). Le tableau 2 résume les résultats de l’identification des espèces des souches de C. jejuni et de C. coli . À titre de vérification supplémentaire, les résultats du séquençage du génome entier ont confirmé l’espèce de tous les isolats (données non présentées).

Figure 1 : Diagramme du flux de travail pour l’isolement et l’identification des espèces de Campylobacter dans la viande vendue au détail. Veuillez cliquer ici pour voir une version agrandie de cette figure.
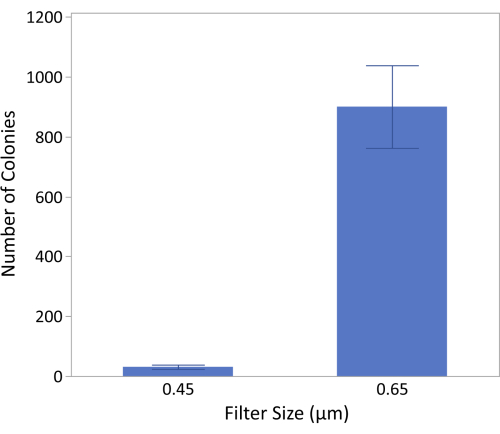
Figure 2 : L’impact de la taille du filtre sur la récupération de Campylobacter. Les résultats indiquent que le filtre de 0,65 μm peut récupérer en moyenne 900 ± 138 colonies, tandis que le filtre de 0,45 μm récupère 31 ± 7 colonies. Les résultats ont été générés à partir de N = 20 (5 plaques avec 4 gouttes/plaque) et un test t de Student indique que les moyennes sont statistiquement différentes (p < 0,0001). Veuillez cliquer ici pour voir une version agrandie de cette figure.
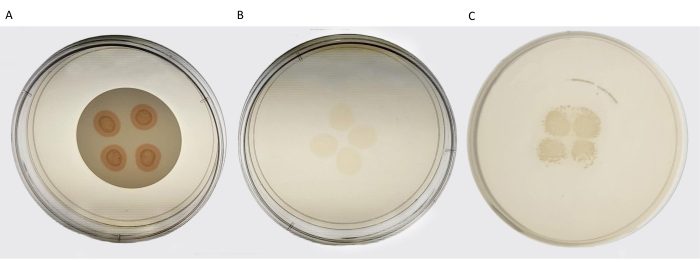
Figure 3 : Isolement de Campylobacter par filtration passive d’échantillons de volaille enrichis. (A) Représente les quatre gouttes de 20 μL d’échantillon enrichi déposées sur le filtre à membrane de nitrocellulose. L’image a été collectée pendant les 15 min de filtration passive. (B) Représente la plaque après le retrait du filtre en nitrocellulose. Les quatre points indiquent où l’échantillon enrichi a traversé la membrane. (C) Représente la plaque après 24 h d’incubation. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Tableau 1 : L’effet du temps de séchage des plaques de gélose Brucella sur la filtration passive de C. jejuni. Veuillez cliquer ici pour télécharger ce tableau.
Tableau 2 : Souches de C. jejuni et de C. coli isolées de la viande crue. Au cours de la période allant de 2008 à 2023, 36 souches de C. jejuni et 13 souches de C. coli ont été isolées dans 79 emballages de viande de 24 produits de détail uniques. Veuillez cliquer ici pour télécharger ce tableau.
Fichier supplémentaire 1 : Images tout au long des processus d’isolement et de dénombrement. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
Importance du protocole
C. jejuni et C. coli étaient les deux principales espèces de Campylobacter répandues dans les volailles22 et les foies d’animaux23,24. Dans cette étude, des échantillons de viande de morceaux de poulet (cuisses, ailes et cuisses), de foies de poulet et de foies de bœuf ont été prélevés au hasard à différentes périodes et dans différents magasins de détail et fabricants pour l’isolement de Campylobacter spp. Sur les 49 souches de Campylobacter isolées, 36 ont été identifiées comme étant des C. jejuni et 13 comme étant des C. coli, et aucune autre espèce de Campylobacter n’a été trouvée, ce qui concorde avec d’autres rapports25.
Le test est basé sur la morphologie cellulaire en forme de spirale et la motilité caractéristique en forme de tire-bouchon de Campylobacter spp. Une technique de filtration passive simple, mais efficace 26,27 qui exploitait sa morphologie cellulaire en forme de spirale (longue, mince, 0,2-0,9 sur 0,5-5 μm) et sa forte motilité en tire-bouchon a été utilisée pour séparer Campylobacter d’un mélange d’organismes de fond. La motilité élevée de Campylobacter a permis aux cellules de traverser les filtres membranaires et de se déplacer vers des conditions favorables trouvées dans le milieu gélosée, tandis que d’autres micro-organismes de fond des produits carnés n’ont pas pu passer. Cette méthode est relativement peu coûteuse, rapide et sélective, ce qui la rend adaptée à une utilisation dans divers contextes, y compris les installations de transformation des aliments, les laboratoires cliniques et les laboratoires de recherche.
Un article pionnier souvent cité affirme que le filtre de 0,45 μm a si bien fonctionné que 0,65 μm n’a pas été évalué28. Les résultats de cette étude indiquent que le filtre de 0,65 μm de taille de pore a donné de meilleurs résultats que le filtre de 0,45 μm, ce qui a entraîné une augmentation de 29 fois du nombre de cellules récupérées de l’enrichissement. Ceci est important car les filtres sélectionnés n’affichent pas une sélectivité réduite comme indiqué précédemment29. De plus, comme on sait que le filtrage réduira considérablement la quantité de Campylobacter récupérée par rapport à l’ensemencement direct30, par conséquent, l’augmentation de la taille des pores améliore la récupération du microorganisme, ce qui est conforme aux résultats précédemment rapportés21. Ceci est important car toutes les cellules qui traversaient les filtres formaient des colonies uniformes de Campylobacter , indiquant que les deux filtres étaient suffisants pour empêcher le passage d’autres particules de microflore et de nourriture. De plus, l’organigramme7 du FSIS note la possibilité d’une production prolongée de résultats en raison de la reprise des isolats sur des plaques Campy-Cefex contenant des antibiotiques. En revanche, le protocole décrit dans ce manuscrit, qui combine l’utilisation de la filtration et de l’enrichissement sélectif avec de la céfopérazone, du cycloheximide, du triméthoprime et de la vancomycine, n’a pas nécessité de re-streaking.
La méthode actuelle utilisée est conforme aux programmes actuels d’échantillonnage et de vérification du FSIS17. Comme le niveau de contamination par Campylobacter peut être faible (153 UFC/450 g de poulet), le rinçage est centrifugé pour concentrer l’échantillon d’un facteur quatre, ce qui augmente la sensibilité du test. Après avoir concentré le rinçage par un facteur de 4x, les échantillons sont enrichis pendant 48 h et criblés avec le système de détection moléculaire (MDS) pour reproduire la méthode utilisée par les laboratoires du FSIS (données non présentées). Notamment, la méthode décrite n’a pas encore permis d’identifier les souches positives dans les 24 heures qui ont été détectées par le système de détection moléculaire en utilisant 48 heures d’enrichissement (données non présentées). Enfin, un autre avantage de ce protocole est qu’il peut fournir des informations relatives à l’espèce bactérienne et identifier si Campylobacter est C. coli, C. jejuni ou C. lari, alors que les DMS adoptées dans la MLG 41.07 ne peuvent fournir qu’une réponse binaire positive/négative pour Campylobacter.
Étapes critiques
Le protocole d’isolement et d’identification de Campylobacter nécessite une précision lors de la centrifugation, de la filtration et de l’analyse moléculaire. Des dilutions précises, des conditions d’incubation appropriées et un respect méticuleux des conditions de test qPCR sont essentiels pour une identification fiable des espèces.
En tant que bactérie microaérophile, Campylobacter est très fragile et sensible à divers stress environnementaux et nécessite des conditions de croissance particulièrement exigeantes 31,32,33. Dans les échantillons d’aliments subissant généralement de longues périodes de transport et de stockage, de nombreuses cellules de Campylobacter sont peut-être en dormance ou dans un état de lésion sublétale/létale34,35. Il est donc important de récupérer les cellules stressées de leurs matrices alimentaires et de les faire croître à une concentration plus élevée. Dans la première étape de la procédure, nous avons utilisé du bouillon de Bolton complété par du sang de cheval lacé et des antibiotiques pour l’enrichissement sélectif de Campylobacter à partir de la nourriture. Le sang d’appoint a servi d’agent d’extinction de l’oxygène pour surmonter les effets indésirables des radicaux libres d’oxygène36. Les antibiotiques ont été utilisés pour inhiber la croissance de la microflore de fond37.
Pour minimiser le temps d’exposition de Campylobacter à l’oxygène atmosphérique ambiant, une période d’incubation de 15 minutes a été choisie pour permettre aux cellules de traverser le filtre. De plus, l’humidité de la plaque de gélose Brucella sous le filtre a joué un rôle important dans la vitesse de passage. Plus précisément, les résultats des tests sur des plaques de gélose séchées pendant 0 h, 1 h, 2 h et 3 h suggèrent qu’une teneur élevée en humidité dans le filtre empêche les cellules de passer. Tout aussi critique est le placement précis des filtres et des gouttes sur les plaques et les filtres, tous deux influençant le succès de l’isolement des cellules.
Pièges et limites potentiels
Bien qu’il présente une approche structurée pour isoler et identifier les espèces de Campylobacter à partir d’échantillons de poulet cru, plusieurs limites de ce protocole méritent l’attention. La contamination externe, les plaques insuffisamment séchées, le colmatage des filtres entravant le mouvement microbien, le piégeage des micro-organismes dans la pastille, l’étanchéité incomplète de la chambre atmosphérique et les gouttes se propageant au-delà des limites du filtre sont parmi les principaux pièges.
Une séparation inadéquate des micro-organismes des surfaces alimentaires ou leur confinement dans la masse de l’échantillon peut entraver leur isolement par cette méthode. De plus, s’appuyer sur la motilité microbienne pour la traversée à travers des filtres passifs présente une limitation notable ; il est possible que les membranes filtrantes aient conservé certaines souches de Campylobacter moins mobiles, car il a été démontré que les filtres peuvent réduire l’efficacité de capture des agents pathogènes microbiens dans les aliments38. D’autres limitations englobent la nature discontinue des processus de centrifugation et de filtration, la susceptibilité au colmatage des filtres et l’inefficacité de la dispersion des granulés formés, ce qui aura un impact sur la précision des charges microbiennes. Ces limites soulignent collectivement la nécessité de faire preuve de prudence et de méthodologies supplémentaires pour assurer une analyse complète, en particulier lorsqu’il s’agit de types d’échantillons variés ou de capacités à haut débit.
Suggestions de dépannage
Pour prévenir les problèmes potentiels, assurez-vous d’abord que tous les matériaux respectent les normes de qualité nécessaires et n’ont pas expiré. Dépannez les filtres obstrués en utilisant éventuellement une filtration supplémentaire pour éliminer les contaminants importants qui pourraient restreindre le passage de Campylobacter à travers la membrane de nitrocellulose. Si une contamination est observée, vérifiez que les gouttes n’ont pas été placées trop près du bord du filtre et ont permis au liquide d’atteindre la gélose en faisant le tour du filtre plutôt qu’à travers les pores. Si la croissance est insuffisante après l’enrichissement, vérifiez que les joints des récipients atmosphériques sont étanches et ne fuient pas.
Perfectionnement et expansion potentiels
L’exploration de matériaux filtrants alternatifs peut améliorer la traversée microbienne et permettre d’étendre ce protocole pour isoler d’autres micro-organismes mobiles à partir de mélanges hétérogènes tels que les aliments. Il est conseillé d’identifier des contrôles permettant de conserver les variants de Campylobacter moins mobiles sans impact négatif sur la spécificité. De plus, bien que le test qPCR multiplexé utilisé dans cette étude ait démontré sa capacité à détecter C.lari,18 autres espèces de Campylobacter d’intérêt peuvent être incluses dans ce test.
En résumé, en évaluant différents paramètres et réglages, les conditions appropriées pour l’isolement par filtre et l’identification au niveau de l’espèce de C. jejuni et de C. coli dans les aliments ont été établies. La méthode s’est avérée sensible, spécifique, robuste et rentable. En l’appliquant à des échantillons d’aliments réels, le protocole a permis d’isoler 36 souches de C. jejuni et 13 souches de C. coli dans 79 emballages de viande.
Le protocole est conforme à la directive 10,250.117 du FSIS, qui décrit la procédure d’échantillonnage des parties de poulet cru, et à la MLG 41.076 pour l’isolement et l’identification de Campylobacter. Les données suggèrent que la concentration de l’échantillon par 4 fois et son enrichissement pendant 24 h, associés à la filtration et à l’ensemencement, donnent des colonies isolées et confirmées en 48 heures au lieu de 96 heures. Le protocole est compatible avec les méthodes basées sur l’ADN telles que le séquençage du génome pour fournir une caractérisation complète des souches de Campylobacter , y compris leurs profils de résistance aux antimicrobiens, leurs prédictions de virulence et leurs relations phylogénétiques. Le protocole représente une alternative prometteuse pour la récupération et l’isolement efficaces de Campylobacter spp. à partir de volailles crues, ce qui peut faciliter les études épidémiologiques et les interventions de santé publique.
Déclarations de divulgation
Tous les auteurs déclarent qu’il n’y a pas de conflit d’intérêts.
Remerciements
Cette recherche a été soutenue par le département de l’Agriculture des États-Unis, Agricultural Research Service (USDA-ARS), National Program 108, Current Research Information System numéros 8072-42000-093 et 8072-42000-094-000-D. La mention de noms commerciaux ou de produits commerciaux dans cet article est uniquement dans le but de fournir des informations spécifiques et n’implique pas une recommandation ou une approbation par le département de l’Agriculture des États-Unis. L’USDA est un fournisseur et un employeur qui souscrit au principe de l’égalité des chances.
matériels
| Name | Company | Catalog Number | Comments |
| Agar - Solidifying Agent (Difco) | Becton, Dickinson and Company (BD) | 281230 | |
| Analytical Balance | Mettler Toledo | JL602-G/L | Equipment |
| Analytical Balance | Mettler Toledo | AB54-S | Equipment |
| Antibiotic supplements cefoperazone, cycloheximide, trimethoprim, vancomycin | Oxoid Ltd. | SR0183E | |
| Atmosphere Control Gas Pak (Campy, 85% N2, 10% CO2, and 5% O2) | Becton, Dickinson and Company (BD) | 260680 | |
| Atmosphere Control Vessel, GasPak EZ CampyPak container system | Becton, Dickinson and Company (BD) | 260678 | |
| Autoclave - Amsco Lab250, Laboratory Steam Sterilizer | Steris plc | LV-250 | Equipment |
| Biological Safety Cabinet, Type A2, Purifier Logic+ | Labconco Corporation | 302411101 | Equipment |
| Bolton broth | Oxoid Ltd. | CM0983 | |
| Brucella broth (Difco) | Becton, Dickinson and Company (BD) | 211088 | |
| Buffered Peptone Water | Bio-Rad Laboratories Inc. | 3564684 | |
| Centrifuge Microcentrifuge 5424 | Eppendorf | 5424 | Equipment |
| Centrifuge, Avanti J-25 | Beckman Coulter, Inc. | Equipment | |
| Chicken thighs, wings, drumsticks, livers | Local retailers | ||
| DNA Extraction - PreMan Ultra Sample Preparation Reagent | Thermo Fisher Scientific Inc. | 4318930 | |
| FAM probe for hipO (Sequence 5'-TTGCAACCTCACTAGCAAAATCC ACAGCT-3') | Integrated DNA Technologies | ||
| Filter - 0.45 µm sterile cellulose acetate filter | Merck-Millipore LTD | DAWP04700 | |
| Filter - 0.65 µm sterile cellulose acetate filter | Merck-Millipore LTD | HAWG04700 | |
| forward primer for cdtA (Sequence 5'-TGTCAAACAAAAAACACCAAGCT T-3' ') | Integrated DNA Technologies | ||
| forward primer for hipO (Sequence 5'-TCCAAAATCCTCACTTGCCATT-3') | Integrated DNA Technologies | ||
| forward primer for IAC (Sequence 5'-GGCGCGCCTAACACATCT-3') | Integrated DNA Technologies | ||
| HEX probe for cdtA (Sequence 5'-AAAATTTCCCGCCATACCACTTG TCCC-3') | Integrated DNA Technologies | ||
| Incubator - Inova 4230 refrigerated incubator shaker | New Brunswick Scientific | 4230 | Equipment |
| Inoculating Loop - Combi Loop 10µL and 1µL | Fisher Scientific International, Inc | 22-363-602 | |
| Internal Amplification Control (IAC) DNA fragment (Sequence 5'-TGGAAGCAATGCCAAATGTGTAT GTGGTGGCATTGTCTTCTCCC GTTGTAACTATCCACTGAGATG TGTTAGGCGCGCC-3') | Integrated DNA Technologies | ||
| Laked horse blood | Remel Inc. | R54072 | |
| Manual pipette Pipet-Lite LTS Pipette L-1000XLS+ | Mettler Toledo | 17014382 | Equipment |
| Manual pipette Pipet-Lite LTS Pipette L-100XLS+ | Mettler Toledo | 17014384 | Equipment |
| Manual pipette Pipet-Lite LTS Pipette L-10XLS+ | Mettler Toledo | 17014388 | Equipment |
| Manual pipette Pipet-Lite LTS Pipette L-200XLS+ | Mettler Toledo | 17014391 | Equipment |
| Manual pipette Pipet-Lite LTS Pipette L-20XLS+ | Mettler Toledo | 17014392 | Equipment |
| Manual pipette Pipet-Lite Multi Pipette L8-200XLS+ | Mettler Toledo | 17013805 | Equipment |
| Manual pipette Pipet-Lite Multi Pipette L8-20XLS+ | Mettler Toledo | 17013803 | Equipment |
| Media Storage Bottle -PYREX 1 L Square Glass Bottle, with GL45 Screw Cap | Corning Inc. | 1396-1L | Equipment |
| Media Storage Bottle -PYREX 2 L Round Wide Mouth Bottle, with GLS80 Screw Cap | Corning Inc. | 1397-2L | Equipment |
| Microtiter plate, 96 well plate, flat bottom, polystyrene, 0.34 cm2, sterile, 108/cs | MilliporeSigma | Z707902 | |
| Mixer - Vortex Genie 2 | Scientific Industries Inc. | SI-0236 | Equipment |
| Motorized pipette controller, PIPETBOY2 | INTEGRA Biosciences Corp. | Equipment | |
| PCR Mastermix 2× TaqMan Gene Expression | Thermo Fisher Scientific Inc. | 4369542 | |
| Petri Dish Rotator - bioWORLD Inoculation Turntable | Fisher Scientific International, Inc | 3489E20 | Equipment |
| Petri Dishes with Clear Lid (100 mm x 15mm) | Fisher Scientific International, Inc | FB0875713 | |
| Pipette Tips GP LTS 1000µL S 768A/8 | Mettler Toledo | 30389273 | |
| Pipette Tips GP LTS 20µL 960A/10 | Mettler Toledo | 30389270 | |
| Pipette Tips GP LTS 200µL F 960A/10 | Mettler Toledo | 30389276 | |
| Reagent Reservoir, 25 mL sterile reservoir used with multichannel pipettors | Thermo Fisher Scientific Inc. | 8093-11 | |
| Realtime PCR - 7500 Real-Time PCR system | (Applied Biosystems, Foster City, CA) | Equipment | |
| reverse primer for cdtA (Sequence 5'-CCTTTGACGGCATTATCTCCTT-3') | Integrated DNA Technologies | ||
| reverse primer for hipO (Sequence 5'-TGCACCAGTGACTATGAATAACG A-3') | Integrated DNA Technologies | ||
| reverse primer for IAC (Sequence 5'-TGGAAGCAATGCCAAATGTGTA -3') | Integrated DNA Technologies | ||
| Serological Pipettes, Nunc Serological Pipettes (10 mL) | Thermo Fisher Scientific Inc. | 170356N | |
| Serological Pipettes, Nunc Serological Pipettes (2 mL) | Thermo Fisher Scientific Inc. | 170372N | |
| Serological Pipettes, Nunc Serological Pipettes (25 mL) | Thermo Fisher Scientific Inc. | 170357N | |
| Serological Pipettes, Nunc Serological Pipettes (50 mL) | Thermo Fisher Scientific Inc. | 170376N | |
| Spreader - Fisherbrand L-Shaped Cell Spreaders | Fisher Scientific International, Inc | 14-665-230 | |
| Stomacher bag, Nasco Whirl-Pak Write-On Homogenizer Blender Filter Bags | Thermo Fisher Scientific Inc. | 01-812 | |
| TAMRA probe for IAC (Sequence 5'-TTACAACGGGAGAAGACAATGCC ACCA-3') | Integrated DNA Technologies | ||
| Thermocycler (GeneAmp PCR system 9700) | Applied Biosystems | Equipment | |
| Water Filtration - Elga Veolia Purelab Flex | Elga LabWater | PF2XXXXM1-US | Equipment |
Références
- Rushton, S. P., et al. Climate, human or environment: Individual-based modelling of Campylobacter seasonality and strategies to reduce disease burden. J Transl Med. 17 (1), 34 (2019).
- Facciolà, A., et al. Campylobacter: From microbiology to prevention. J Prev Med Hyg. 58 (2), E79-E92 (2017).
- Perez-Arnedo, I., Gonzalez-Fandos, E. Prevalence of Campylobacter spp. In poultry in three spanish farms, a slaughterhouse and a further processing plant. Foods. 8 (3), 111 (2019).
- Nachamkin, I., Allos, B. M., Ho, T. Campylobacter species and guillain-barré syndrome. Clin Microbiol Rev. 11 (3), 555-567 (1998).
- Department of Food Administration. Bacteriological analytical manual. Department of Food Administration. , (1992).
- USDA Office of Public Health Science. Isolating and identifying Campylobacter jejuni/coli/lari from poultry rinsate, sponge and raw product samples. Microbiology Laboratory Guidebook. , (2022).
- Singh, H., Rathore, R. S., Singh, S., Cheema, P. S. Comparative analysis of cultural isolation and PCR based assay for detection of Campylobacter jejuni in food and faecal samples. Braz J Microbiol. 42 (1), 181-186 (2011).
- Kralik, P., Ricchi, M. A basic guide to real time pcr in microbial diagnostics: Definitions, parameters, and everything. Front Microbiol. 8, (2017).
- Linton, D., Lawson, A. J., Owen, R. J., Stanley, J. PCR detection, identification to species level, and fingerprinting of Campylobacter jejuni and Campylobacter coli direct from diarrheic samples. J Clin Microbiol. 35 (10), 2568-2572 (1997).
- Kabiraz, M. P., Majumdar, P. R., Mahmud, M. M. C., Bhowmik, S., Ali, A. Conventional and advanced detection techniques of foodborne pathogens: A comprehensive review. Heliyon. 9 (4), e15482 (2023).
- Kaakoush, N. O., Castaño-Rodríguez, N., Mitchell, H. M., Man, S. M. Global epidemiology of Campylobacter infection. Clin Microbiol Rev. 28 (3), 687-720 (2015).
- Gilbreath, J. J., Cody, W. L., Merrell, D. S., Hendrixson, D. R. Change is good: Variations in common biological mechanisms in the epsilonproteobacterial genera Campylobacter and Helicobacter. Microbiol Mol Biol Rev. 75 (1), 84-132 (2011).
- Lertsethtakarn, P., Ottemann, K. M., Hendrixson, D. R. Motility and chemotaxis in campylobacter and helicobacter. Annu Rev Microbiol. 65, 389-410 (2011).
- Jokinen, C. C., et al. An enhanced technique combining pre-enrichment and passive filtration increases the isolation efficiency of Campylobacter jejuni and Campylobacter coli from water and animal fecal samples. J Microbiol Methods. 91 (3), 506-513 (2012).
- Engberg, J., On, S. L., Harrington, C. S., Gerner-Smidt, P. Prevalence of Campylobacter, Arcobacter, Helicobacter, and Sutterella spp. In human fecal samples as estimated by a reevaluation of isolation methods for Campylobacters. J Clin Microbiol. 38 (1), 286-291 (2000).
- Lastovica, A. J., Le Roux, E. Efficient isolation of campylobacteria from stools. J Clin Microbiol. 38 (7), 2798-2799 (2000).
- USDA. Salmonella and Campylobacter verification program for raw poultry products. FSIS Directive 10250.1. 10000 Series: Laboratory Services. USDA. , (2021).
- He, Y., et al. Simultaneous detection and differentiation of Campylobacter jejuni, c. Coli, and c. Lari in chickens using a multiplex real-time PCR assay. Food Anal Methods. 3, 321-329 (2010).
- Suo, B., He, Y., Tu, S. -. I., Shi, X. A multiplex real-time polymerase chain reaction for simultaneous detection of salmonella spp., escherichia coli o157, and listeria monocytogenes in meat products. Foodborne Pathog Dis. 7 (6), 619-628 (2010).
- Chen, C. Y., Nace, G. W., Irwin, P. L. A 6 x 6 drop plate method for simultaneous colony counting and MPN enumeration of Campylobacter jejuni, listeria monocytogenes, and escherichia coli. J Microbiol Methods. 55 (2), 475-479 (2003).
- Speegle, L., Miller, M. E., Backert, S., Oyarzabal, O. A. Use of cellulose filters to isolate Campylobacter spp. From naturally contaminated retail broiler meat. J Food Prot. 72 (12), 2592-2596 (2009).
- Guirin, G. F., Brusa, V., Adriani, C. D., Leotta, G. A. Prevalence of Campylobacter jejuni and Campylobacter coli from broilers at conventional and kosher abattoirs and retail stores. Rev Argent Microbiol. 52 (3), 217-220 (2020).
- Noormohamed, A., Fakhr, M. K. A higher prevalence rate of Campylobacter in retail beef livers compared to other beef and pork meat cuts. Int J Environ Res Public Health. 10 (5), 2058-2068 (2013).
- Walker, L. J., et al. Prevalence of Campylobacter coli and Campylobacter jejuni in retail chicken, beef, lamb, and pork products in three Australian states. J Food Prot. 82 (12), 2126-2134 (2019).
- Zhao, C., et al. Prevalence of Campylobacter spp., Escherichia coli, and Salmonella serovars in retail chicken, turkey, pork, and beef from the greater Washington, D.C., area. Appl Environ Microbiol. 67 (12), 5431-5436 (2001).
- Honsheng, H., Manuel Mariano, G., Guillermo, T. -. I., Saeed, E. -. A. . Campylobacter. , (2022).
- He, Y., et al. Rapid identification and classification of Campylobacter spp. using laser optical scattering technology. Food Microbiol. 47, 28-35 (2015).
- Steele, T. W., Mcdermott, S. N. The use of membrane filters applied directly to the surface of agar plates for the isolation of Campylobacter jejuni from feces. Pathology. 16 (3), 263-265 (1984).
- Bourke, B., Chan, V. L., Sherman, P. Campylobacter upsaliensis: Waiting in the wings. Clin Microbiol Rev. 11 (3), 440-449 (1998).
- Berrang, M. E., Meinersmann, R. J., Cox, N. A. Passage of Campylobacter jejuni and Campylobacter coli subtypes through 0.45- and 0.65-micrometer-pore-size nitrocellulose filters. J Food Prot. 80 (12), 2029-2032 (2017).
- Hill, G. N., et al. Optimizing enrichment of Campylobacter on poultry. J App Poult Res. 26 (3), 307-315 (2017).
- Kim, J. C., Oh, E., Kim, J., Jeon, B. Regulation of oxidative stress resistance in Campylobacter jejuni, a microaerophilic foodborne pathogen. Front Microbiol. 6, 751 (2015).
- Nennig, M., et al. Metaphenotypes associated with recurrent genomic lineages of Campylobacter jejuni responsible for human infections in luxembourg. Front Microbiol. 13, (2022).
- Moore, J. E. Bacterial dormancy in Campylobacter: Abstract theory or cause for concern. Int J Food Sci Technol. 36 (6), 593-600 (2001).
- Saha, S., Saha, S., Sanyal, S. Recovery of injured Campylobacter jejuni cells after animal passage. Appl Environ Microbiol. 57 (11), 3388-3389 (1991).
- Baylis, C. L., Macphee, S., Martin, K. W., Humphrey, T. J., Betts, R. P. Comparison of three enrichment media for the isolation of Campylobacter spp. From foods. J Appl Microbiol. 89 (5), 884-891 (2000).
- Line, J. E. Development of a selective differential agar for isolation and enumeration of Campylobacter spp. J Food Prot. 64 (11), 1711-1715 (2001).
- Armstrong, C. M., et al. Impacts of clarification techniques on sample constituents and pathogen retention. Foods. 8 (12), 636 (2019).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon