Method Article
Procédé modifié de cathétérisme intrathécal chez le rat
Dans cet article
Résumé
Dans cet article, nous présentons une méthode modifiée pour le cathétérisme intrathécal chez le rat qui représente une approche simple, pratique et fiable pour l’administration répétitive de médicaments par voie intrathécale.
Résumé
Le cathétérisme intrathécal a été largement appliqué dans les expériences sur les animaux, en particulier celles sur la douleur neuropathique. Cependant, les méthodes traditionnelles ont encore plusieurs limites. Bien que certains chercheurs aient tenté d’améliorer les méthodes traditionnelles, les méthodes disponibles doivent encore être modifiées. Dans cet article, nous présentons une méthode modifiée pour le cathétérisme intrathécal chez le rat.
Cette méthode utilise un fil d’acier inoxydable de 20 cm de long (0,2 mm de diamètre), un tube en plastique PE10 de 15 cm de long, un capuchon d’étanchéité fait maison et une bande antiallergique de 0,3 cm × 0,5 cm. Notre méthode modifiée de cathétérisme intrathécal présente plusieurs avantages. Tout d’abord, l’introduction d’un fil d’acier inoxydable dans le tube PE10 augmente l’élasticité du tube, améliore le taux de réussite du cathétérisme intrathécal, réduit la quantité d’espace nécessaire à l’opération et minimise les dommages aux tissus autour de la colonne lombaire. Deuxièmement, la longueur du tube PE10 est déterminée avant la chirurgie, et le temps d’habitation du cathéter peut être supérieur à une semaine. Troisièmement, le tube PE10 est fixé par une suture en forme de 8, 4 fois, ce qui empêche le mouvement et la rétraction du tube lorsque l’animal se déplace. Quatrièmement, un capuchon d’étanchéité fait maison est utilisé pour sceller le tube PE10, ce qui empêche non seulement les fuites de liquide céphalo-rachidien, mais réduit également le besoin de couper à plusieurs reprises le tube PE10. Enfin, l’extrémité extracorporelle du tube PE10 est attachée avec une bande, ce qui empêche la rétraction du tube lorsque l’animal se déplace.
Cette méthode peut augmenter le taux de réussite du cathétérisme chez les rats, car environ 80 % des tubes PE10 sont restés en place même 28 jours après la chirurgie. Ainsi, cette méthode modifiée peut représenter une approche simple, pratique et fiable pour l’administration intrathécale répétitive de médicaments.
Introduction
Le cathétérisme intrathécal (également connu sous le nom de cathétérisme sous-arachnoïdien) chez le rat est une méthode qui consiste à insérer un cathéter dans l’espace sous-arachnoïdien à travers l’espace intervertébral1. Les médicaments sont injectés directement dans l’espace sous-arachnoïdien par le cathéter, ce qui aide les chercheurs à étudier les effets des médicaments sur la moelle épinière sans tenir compte des effets des médicaments qui pénètrent la barrière hémato-encéphalique 2,3. De plus, le liquide céphalo-rachidien peut être prélevé après un cathétérisme intrathécal pour étudier le microenvironnement du système nerveux central 4,5. La méthode actuellement utilisée pour le cathétérisme intrathécal a été établie pour la première fois par Yaksh et Rudy6 en 1976, et depuis lors, elle a été largement appliquée dans les expériences animales dans les domaines des neurosciences, de l’anesthésie et de l’analgésie, de la régulation cardiovasculaire médiée par la moelle épinière et en particulier de la douleur neuropathique 2,7. Cependant, cette méthode présente encore plusieurs limites, telles qu’une incidence élevée de lésions de la moelle épinière, d’hémorragie sous-arachnoïdienne, de dysfonctionnement sensoriel et moteur postopératoire, une mortalité postopératoire élevée et un risque élevé de déficience neurologique 4,5,8,9,10 . Dans le but de surmonter ces limitations, le cathétérisme de l’espace sous-arachnoïdien par les espaces lombaires a été proposé par Størkson et al. en 199611, et un taux de réussite postopératoire plus élevé a été signalé. Notamment, la fixation du cathéter à demeure reste un défi dans cette méthode, et la rétraction du cathéter est courante en raison du mouvement de l’animal, ce qui rend l’administration de médicaments intrathécale peu pratique.
En raison des limitations ci-dessus, certains chercheurs 12,13,14,15 ont tenté d’améliorer les outils de ponction, les méthodes de cathétérisme et les méthodes de fixation du cathéter, mais les méthodes disponibles doivent encore être modifiées en raison de la difficulté de quantifier le diamètre des billes utilisées, de la nécessité de ponctions répétées et de la courte longueur du cathéter, etc.11
Selon l’approche lombaire pour le cathétérisme intrathécal1 et la technique Seldinger pour le cathétérisme veineux central16 , nous avons développé une méthode de cathétérisme intrathécal chez le rat qui utilise un fil d’acier inoxydable, un capuchon d’étanchéité fait maison et une bande antiallergique pour simplifier la méthode existante. Grâce à cette méthode, le cathéter peut être facilement inséré dans l’espace sous-arachnoïdien et fixé de manière stable sur le dos du rat, et la nécessité de ponctions répétées pour l’administration répétée de médicaments par voie intrathécale est évitée.
Ici, nous présentons une méthode modifiée qui pourrait améliorer le taux de réussite du cathétérisme intrathécal chez le rat et représente une approche simple, pratique et fiable pour l’administration intrathécale répétitive de médicaments.
Protocole
Le cathétérisme intrathécal a été effectué en stricte conformité avec les recommandations des Directives pour le soin et l’utilisation des animaux de laboratoire des National Institutes of Health, et le protocole a été approuvé par le Comité d’éthique des animaux d’expérimentation de la Chine (n° 100). TJBH15523201). Des rats Sprague-Dawley (SD) mâles ont été utilisés dans l’expérience. Des précautions ont été prises pour minimiser la douleur et l’inconfort des animaux.
1. Préparation du matériel et de l’instrument
REMARQUE : La préparation du matériel et des instruments est très importante pour un cathétérisme intrathécal réussi.
- Préparez un tube PE10 de 15 cm de long (la longueur est déterminée en fonction de la distance entre la tête du rat et l’extrémité de la queue), insérez un fil d’acier inoxydable de 20 cm de long (0,2 mm de diamètre) avec deux extrémités polies dans le tube PE10 comme support, et marquez le tube à 2 cm d’une extrémité pour indiquer la profondeur d’insertion (comme indiqué par des croix noires sur la figure 1A, B).
- Coupez la pointe pointue d’une aiguille de 22 G et scellez l’extrémité distale (Figure 1C).
- Coupez un cathéter péridural (1,0 mm de diamètre externe) en fragments de 1 cm. Ensuite, insérez un fragment dans une aiguille de 22 G sans pointe pointue (figure 1D) et scellez l’extrémité distale du fragment à l’aide d’une paire de pinces droites chauffées. Cet appareil s’appelle le capuchon d’étanchéité du tube (Figure 1E).
- Préparez une bande antiallergique de 0,3 cm × 0,5 cm en coupant un ruban de soie (1,25 cm × 9,1 m) à l’aide d’une paire de ciseaux (Figure 1F).
2. Préparation à l’intervention chirurgicale
- Préparez les instruments pour le cathétérisme intrathécal en les stérilisant avant la chirurgie. Les instruments utilisés pour la chirurgie sont des pinces dentées, des ciseaux, un appareil de gavage, un manche de scalpel et des lames #10. (Figure 2).
- Immergez le tube PE10 et le fil de guidage dans de l’éthanol à 75 % pour la stérilisation pendant environ 2 h.
3. Chirurgie
- Anesthésier le rat avec de l’isoflurane à 3 % à un débit de 3 L/min.
- Placez le rat sur la table d’opération et observez le réflexe de retrait lorsque vous pincez la patte arrière avec une pince. L’absence de mouvement de la patte arrière en réponse à la stimulation a confirmé la réussite de l’anesthésie. Administrer une analgésie adéquate par injection intramusculaire de 1 mg/kg de méloxicam avant le cathétérisme intrathécal.
- Enlevez les poils de la région de la colonne lombaire du dos et de la zone entre deux oreilles avec un rasoir.
- Placez un tube de centrifugation (3 cm de diamètre) sous l’abdomen du rat à la jonction taille-hanche pour augmenter la flexion de la colonne lombaire, en laissant plus d’espace pour le passage de l’aiguille et du cathéter.
- Stérilisez les sites chirurgicaux (la zone au-dessus de la région de la colonne lombaire et la zone entre deux oreilles) avec une solution de povidone iodée, puis avec une solution d’éthanol trois fois. Couvrez le rat avec un pansement aseptique et exposez les sites chirurgicaux. Lavez ensuite le tube PE10 et le fil de guidage avec une solution saline normale avant l’opération.
REMARQUE : La queue n’a pas été couverte afin que le mouvement de la queue puisse être observé pendant le cathétérisme intrathécal. - Déterminez l’emplacement de l’espace intervertébral entre L5 et L6 en localisant l’apophyse épineuse de L6 au milieu entre les crêtes iliaques bilatérales gauche et droite. Fixez la peau avec le pouce gauche et l’index gauche de l’opérateur, puis faites une incision médiane de 3 à 4 cm de long juste au-dessus de l’apophyse épineuse entre L4 et S1.
- Séparez brutalement les tissus sous-cutanés à l’aide d’une paire de ciseaux. Localisez à nouveau l’espace intervertébral entre L5 et L6 et faites une petite incision (0,3 à 0,5 cm) des deux côtés des apophyses dorsales L5 et L6.
- Serrez et soulevez l’apophyse dorsale L5 à l’aide d’une paire de pinces dentées pour élargir l’espace intervertébral. Ensuite, séparez brutalement les muscles autour du corps vertébral avec une paire de ciseaux jusqu’à ce que le haut de l’apophyse dorsale L6 soit complètement exposé.
REMARQUE : L’ablation de toute partie du corps vertébral et des muscles doit être évitée, dans le but de minimiser les dommages aux tissus environnants. - Lorsque l’apophyse dorsale L5 est soulevée à l’aide d’une pince dentée et que l’espace intervertébral est élargi à l’aide d’une autre paire de pinces, nettoyez l’espace intervertébral L5-6 à l’aide d’une boule de coton jusqu’à ce que la zone en « V » inversé soit complètement exposée.
- Perforez la colonne vertébrale avec une aiguille de 23 G dans la zone en « V » inversé juste sous le haut de l’apophyse dorsale L6.
REMARQUE : Un mouvement de la queue est observé et/ou un liquide transparent incolore s’écoule de l’espace sous-arachnoïdien, indiquant une perforation réussie dans l’espace sous-arachnoïdien. - Insérez avec précaution le tube PE10 contenant du fil d’acier inoxydable dans le canal rachidien au site de ponction, en l’inclinant de 30° vers la queue. Ajustez l’angle d’insertion jusqu’à ce que le tube PE10 puisse être inséré avec succès sans résistance (un mouvement de queue a été observé pendant ce processus).
- Lorsque la zone marquée du tube PE10 atteint le muscle postérieur, le cathétérisme est arrêté.
- Retirez lentement le fil inoxydable du tube PE10. Un mouvement de la queue peut être observé.
REMARQUE : Un mouvement de queue peut être observé, et une fois le fil retiré, un liquide transparent (ou un liquide rouge clair) peut s’écouler du tube. - Ensuite, connectez le tube PE10 à une seringue de 1 ml, à travers laquelle 20 μL de solution saline normale sont injectés. Une fois la seringue retirée, la solution saline s’écoulera continuellement du tube PE10, indiquant qu’elle a été insérée avec succès dans l’espace sous-arachnoïdien.
- Une fois que la sonde PE10 est confirmée comme étant non obstruée, suturez les muscles d’un côté du corps vertébral avec une suture 4-0 et faites un nœud. Ensuite, attachez la suture autour du tube PE10 et faites un autre nœud. Ne coupez pas la suture ; suturer les muscles de l’autre côté ; attachez à nouveau la suture au tube PE10, faites un troisième nœud et coupez la suture.
REMARQUE : Ce processus fixe le tube PE10 avec une suture en forme de 8 pour réduire la possibilité de déplacement et de rétraction du tube. - Faites une incision de 0,5 cm de long à 1 cm sous le point médian entre les oreilles. Séparez brutalement les tissus sous-cutanés avec des ciseaux et insérez un tube de gavage métallique vers la queue jusqu’à ce que la pointe soit visible dans l’incision lombaire.
- Insérez l’extrémité distale du tube PE10 dans le tube de gavage jusqu’à ce que le tube PE10 sorte de l’autre extrémité du tube de gavage ; Puis retirez délicatement le gavage.
- Lorsqu’il est confirmé que le tube PE10 n’est pas obstrué à nouveau, suturez les muscles restants autour de l’incision lombaire avec une suture 4-0, attachez la suture autour du tube PE10 et faites un autre nœud pour fixer à nouveau le tube PE10.
- Suturez la peau, en évitant d’endommager le tube PE10. Ensuite, suturez la peau du cou avec une suture 4-0, attachez la suture autour du tube PE10 et faites un nœud pour fixer le tube PE10.
- Lorsqu’il est confirmé que le tube PE10 n’est pas obstrué à nouveau, scellez l’extrémité extracorporelle du tube PE10 avec un capuchon d’étanchéité.
- Séchez le tube PE10 avec un morceau de tissu, puis attachez plusieurs fois la bande antiallergique autour du tube PE10 pour éviter la rétraction du tube PE10 pendant le mouvement du rat.
4. Expérience de validation de la lidocaïne
- Après l’opération, remettez le rat dans sa cage (une par cage) et surveillez-le de près pendant la récupération de l’anesthésie jusqu’à ce que le rat reprenne conscience.
- Une fois que le rat est complètement réveillé, retirer le capuchon d’étanchéité et injecter 20 μL de lidocaïne à 2 % dans le tube PE10 à un taux de 0,02 mL/s à l’aide d’une seringue Hamilton, suivie de l’injection de 10 μL de solution saline normale.
- Scellez le tube PE10 avec le capuchon d’étanchéité.
- Placez le rat sur une table et observez attentivement. La présence d’une paralysie des membres postérieurs après une injection intrathécale de lidocaïne (à partir du tube PE10) indique un cathétérisme réussi (Figure 3). La paralysie des membres postérieurs dure généralement environ 30 min10.
REMARQUE : Laissez le rat récupérer pendant 5 à 7 jours avant les expériences suivantes. - Surveillez de près le rat pendant la période de récupération jusqu’à ce que la fonction des membres soit complètement rétablie.
Résultats
Pour l’injection intrathécale, l’extrémité extracorporelle du tube PE10 a été coupée et le tube PE10 a été scellé avec un capuchon d’étanchéité entre deux injections de médicament. Dans notre étude pilote, le taux de réussite du cathétérisme intrathécal était d’environ 95 % (19 rats sur 20) ; Le succès a été indiqué par un mouvement de la queue et/ou la libération d’un liquide transparent incolore pendant la procédure. Environ 85 % des trompes sont restées en place 7 jours après la chirurgie, et environ 80 % sont restées en place 28 jours après la chirurgie. Les rats se sont rétablis peu de temps après l’opération, et aucune complication n’a été observée dans les 7 jours suivant l’opération. Les mouvements quotidiens étaient normaux et aucune anomalie comportementale n’a été observée. Ces résultats indiquent que notre méthode est supérieure à celles précédemment rapportées en termes de taux de réussite et de taux de longue résidence.
Une paralysie complète des membres inférieurs lors de l’injection de lidocaïne via des cathéters indique un cathétérisme intrathécalréussi15. Le taux de réussite du cathétérisme intrathécal est calculé en divisant le nombre total de rats par le nombre de rats ayant réussi le cathétérisme. Avec notre méthode modifiée, le taux de réussite était de 95 %, ce qui était supérieur au taux obtenu avec la méthode rapportée par Hou et al. (88 %)15. C’est ce que montre la figure 4.
Le tube intrathécal a été surveillé 2, 5 et 7 jours après le cathétérisme intrathécal et le taux de réussite du cathéter à demeure a été calculé en fonction du nombre de rats avec un cathéter à demeure réussi/nombre total de rats × 100 %. À 2, 5 et 7 jours après le cathétérisme intrathécal, le taux de réussite du cathéter à demeure était de 94 %, 81 % et 65 %, respectivement, dans l’étude de StØrkson et al.11. Le taux de réussite du cathéter à demeure 2, 5 et 7 jours après le cathétérisme intrathécal était de 95 %, 90 % et 85 %, respectivement, avec notre technique (Figure 5).

Graphique 1. Matériaux et instruments utilisés pour le cathétérisme intrathécal. (A) Un tube PE10 de 15 cm de long a été préparé, et le tube a été marqué à 2 cm d’une extrémité pour indiquer la profondeur d’insertion. (B) Un fil d’acier inoxydable de 20 cm de long avec deux extrémités polies a été inséré dans le tube PE10 comme support. (C) La pointe pointue de l’aiguille 22G a été coupée à l’aide d’une paire de ciseaux, et l’extrémité distale a été scellée à l’aide d’une pince. (D) Un cathéter péridural (1,0 mm de diamètre externe) a été coupé en fragments de 1 cm, qui ont ensuite été insérés dans l’aiguille 22G sans pointe pointue. (E) L’extrémité distale du cathéter péridural a été scellée à l’aide d’une paire de pinces droites chauffées ; Cet appareil s’appelait le capuchon d’étanchéité des tubes. (F) Une bande antiallergique de 0,3 cm × 0,5 cm (ruban de soie, 1,25 cm × 9,1 m) a été préparée à l’aide d’une paire de ciseaux. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Graphique 2. Préparation d’instruments pour le cathétérisme intrathécal. Les instruments (tels que des pinces dentées, des ciseaux, un appareil de gavage, un manche de scalpel et des lames #10) ont été stérilisés à l’éthanol pendant environ 2 heures, puis lavés avec une solution saline normale environ 30 minutes avant l’opération. Veuillez cliquer ici pour voir une version agrandie de cette figure.
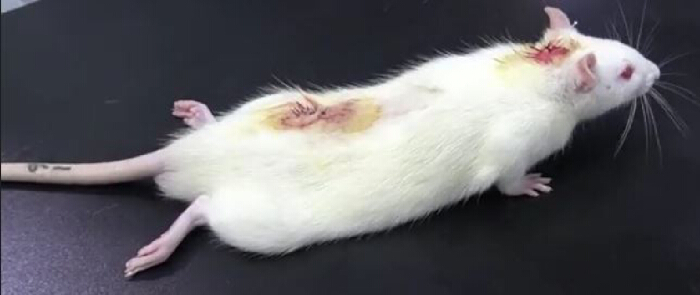
Graphique 3. Résultats de l’expérience de validation de la lidocaïne après cathétérisme intrathécal. Après l’injection intrathécale de 20 μL de lidocaïne à 2 % suivie d’une injection de 10 μL de solution saline normale, le rat a été temporairement paralysé : une paralysie des membres inférieurs s’est produite dans les 30 secondes et a disparu 30 minutes plus tard, indiquant une réussite du cathétérisme intrathécal. Veuillez cliquer ici pour voir une version agrandie de cette figure.
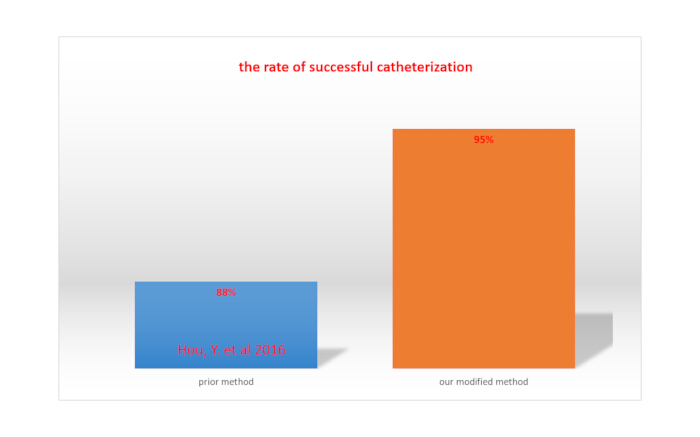
Graphique 4. Comparaison du taux de réussite du cathétérisme entre notre méthode modifiée et une méthode précédemment rapportée. Veuillez cliquer ici pour voir une version agrandie de cette figure.
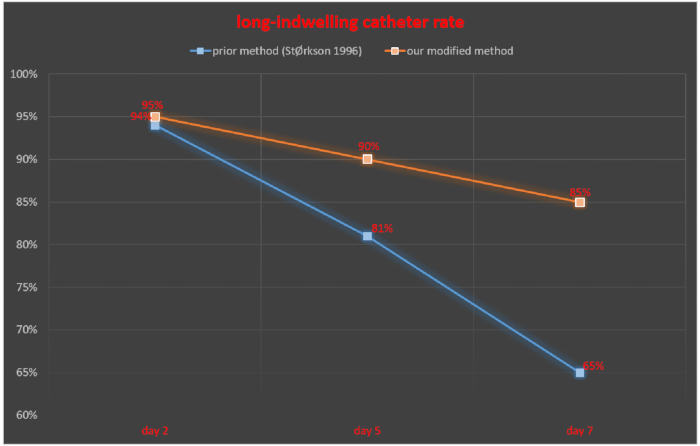
Graphique 5. Comparaison du taux de cathéter à longue demeure entre notre méthode modifiée et une méthode précédemment publiée. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Méthode modifiée | Méthode préalable | Avantages de la méthode modifiée | Inconvénients de la méthode a priori | |
| Méthode de guidage pour l’insertion | un fil d’acier inoxydable | Guide-canule (20G 0,9× 38 mm) | Augmente l’élasticité du tube, | La résistance est difficile à ressentir, ce qui augmente la difficulté de fonctionnement |
| Améliore le taux de réussite du cathétérisme intrathécal | Dommages aux tissus dus à des ponctions répétées | |||
| Réduit l’espace de travail requis | Une extrémité du tube est étirée à 1,5 fois la longueur d’origine, ce qui rend le diamètre des deux extrémités différent | |||
| Minimise les dommages aux tissus autour de la colonne lombaire | Sensibilité aux fuites de liquide céphalo-rachidien car le diamètre de la canule guide 20G est 2 fois ou plus celui du tube PE10 étiré | |||
| Longueur du tube PE10 | 15 cm | 14 ou 28 cm | Détermination facile de la longueur du tube PE10, quelle que soit la durée du cathéter à demeure | La durée d’entrée du cathéter est plus courte pour un tube PE10 plus court ; sensibilité à la chute du corps pour un long tube PE10 |
| Méthode de fixation | Suture « 8 » et 4 fois | 1 ou 2 perles | Évite le mouvement et la rétraction du tube pendant les activités des animaux | Différence de diamètre du tube aux deux extrémités et sensibilité au déplacement du tube PE10 lors de la fabrication du cordon |
| Méthode d’étanchéité des tubes | Casquette faite maison | Non | Empêche la fuite de liquide céphalo-rachidien | Exigence de découpe répétée du tube PE10 |
| Évite la découpe répétée du tube PE10 | ||||
| Méthode de prévention de la rétraction | Bande anti-allergique | 1 ou 2 perles | Empêche le tube de se rétracter pendant les activités des animaux | Sensibilité à la rétraction |
Tableau 1. Avantages et inconvénients de la méthode modifiée et d’une méthode précédemment signalée.
Discussion
Il existe plusieurs conseils essentiels pour cette méthode modifiée afin de maximiser le taux de réussite du cathétérisme intrathécal. Tout d’abord, un fil d’acier inoxydable de 20 cm de long avec deux extrémités polies doit être préparé et inséré dans un tube PE10 comme support. Deuxièmement, l’opérateur doit exposer complètement la zone en « V » inversé après avoir nettoyé l’espace intervertébral L5-6 avec une boule de coton, et l’espace intervertébral doit être élargi avec une autre pince tout en soulevant l’apophyse dorsale L5 avec une pince dentée. Troisièmement, le tube PE10 doit être fixé quatre fois avec une suture en forme de 8. Enfin, l’extrémité extracorporelle du tube PE10 doit être attachée avec une bande et scellée avec un capuchon fait maison.
Le taux de réussite du cathétérisme intrathécal et les dommages aux tissus autour des corps vertébraux peuvent influencer de manière significative la fiabilité des résultats expérimentaux15. Ainsi, l’amélioration autant que possible du taux de réussite et la réduction des dommages aux tissus environnants sont cruciales pour établir des modèles animaux et des expériences pertinentes1. Dans cette méthode modifiée, un fil d’acier inoxydable est inséré dans le tube PE10 pour le guidage, ce qui augmente l’élasticité du tube et améliore le taux de réussite du cathétérisme intrathécal. De plus, la quantité d’espace nécessaire pour l’opération est réduite avec cette méthode modifiée, et les dommages aux tissus autour de la colonne lombaire sont minimisés car les tissus environnants sont carrément séparés, mais pas coupés. En comparaison, dans la méthode11 précédemment rapportée, une canule guide de 20 G est utilisée pour réduire la résistance lors de la ponction, et une ponction répétée est souvent nécessaire, ce qui peut blesser les tissus. De plus, dans la méthode décrite précédemment, pour réduire le diamètre du tube PE10, il est immergé dans de l’eau chaude (60 °C), puis étiré à une extrémité à environ 150 % de la longueur d’origine, ce qui peut ne pas assurer la cohérence du diamètre du tube et donc provoquer une fuite de liquide céphalo-rachidien car le diamètre de la canule guide 20G est environ deux fois supérieur ou égal à celui du tube PE10 étiré. De plus, dans notre méthode, la fonction lombaire est préservée dans la plus grande mesure, ce qui évite l’influence de la chirurgie sur les résultats des expériences ultérieures. Ces résultats sont cohérents avec ceux rapportés par Xu et al2.
Dans la méthode11 précédemment rapportée, la longueur du tube PE10 est d’environ 14 cm si le tube est fixé au site autour du site de ponction, mais le temps d’habitation du cathéter est souvent inférieur à 7 jours dans ces conditions (ou le tube est retiré du corps par le rat). La longueur du tube PE10 est d’environ 28 cm si le tube est fixé à l’arrière du cou, ce qui est nettement plus long que le tube PE10 utilisé dans notre méthode (15 cm). Bien que des billes aient été formées selon le protocole rapporté par Størkson et al.11, certains tubes ont été retirés du corps, et seulement environ 65 % des tubes étaient encore fixés en place 7 jours après la chirurgie, ce qui a considérablement affecté les résultats des expériences ultérieures. Dans notre méthode, le tube PE10 est fixé 4 fois avec une suture en forme de 8, et l’extrémité extracorporelle du tube PE10 est attachée avec une bande pour réduire la possibilité de déplacement et de rétraction. Selon notre méthode, environ 85 % des trompes sont restées en place 7 jours après la chirurgie, et environ 80 % des trompes sont restées en place 28 jours après la chirurgie.
Dans la méthode11 précédemment rapportée, l’extrémité extracorporelle du cathéter intrathécal doit être coupée à chaque administration de médicament. Cependant, l’administration intrathécale répétée de médicaments peut raccourcir le temps d’habitation du cathéter, ce qui rend l’administration intrathécale de médicaments peu pratique. Par conséquent, dans notre méthode, un bouchon fait maison est utilisé pour sceller le tube PE10, qui est stérilisé à l’éthanol une fois par jour. Cela empêche non seulement la fuite de liquide céphalo-rachidien, mais réduit également la nécessité de couper à plusieurs reprises le tube PE10 pour l’administration intrathécale de médicaments, assurant ainsi l’administration efficace des médicaments.
Les avantages et les inconvénients de la méthode modifiée et de la méthode précédemment signalée sont résumés dans le tableau 1. Tout d’abord, pour la méthode modifiée, l’utilisation de fil d’acier inoxydable dans le tube PE10 augmente l’élasticité du tube et améliore le taux de réussite du cathétérisme intrathécal, la quantité d’espace nécessaire pour l’opération est réduite et les dommages aux tissus autour de la colonne lombaire sont minimisés. Dans la méthode précédemment rapportée, une canule guide 20G est insérée jusqu’à ce qu’une résistance soit ressentie, et une ponction répétée est souvent nécessaire, ce qui peut entraîner des dommages aux tissus. De plus, le tube PE10 à une extrémité est étiré jusqu’à ce que sa longueur atteigne environ 150 % de la longueur d’origine, ce qui peut provoquer une fuite de liquide céphalo-rachidien car le diamètre de la canule guide 20G est 2 fois supérieur ou égal à celui du tube PE10 étiré. Deuxièmement, dans la méthode modifiée, la longueur du tube PE10 est déterminée avant la chirurgie, et le temps d’habitation du cathéter peut être supérieur à une semaine. Dans la méthode précédemment rapportée, la longueur du tube PE10 est d’environ 14 cm s’il est fixé au site de ponction, mais le temps d’habitation du cathéter est souvent inférieur à 7 jours car le tube est susceptible d’être retiré du corps par le rat ; la longueur du tube PE10 est d’environ 28 cm s’il est fixé à l’arrière du cou, ce qui est nettement plus long que la longueur du tube utilisé dans notre méthode. Troisièmement, dans la méthode modifiée, le tube PE10 est fixé 4 fois avec une suture en forme de 8 pour empêcher le mouvement et la rétraction du tube ; un capuchon fait maison est utilisé pour sceller le tube PE10, ce qui empêche non seulement les fuites de liquide céphalo-rachidien, mais évite également la nécessité de couper à plusieurs reprises le tube PE10. Dans la méthode précédemment rapportée, il est difficile d’obtenir des billes d’un diamètre constant, le déplacement du tube PE10 est courant lorsque des billes sont formées et une coupe répétée du tube PE10 est souvent nécessaire. Enfin, dans la méthode modifiée, l’extrémité extracorporelle du tube PE10 est attachée par une bande, ce qui empêche le tube de se rétracter pendant le mouvement. Cependant, dans la méthode précédente, les billes ne peuvent pas empêcher de manière fiable la rétraction du tube PE10 car il est difficile d’obtenir des billes de diamètre constant.
Dans l’ensemble, cette méthode modifiée de cathétérisme intrathécal présente les avantages suivants. Tout d’abord, l’utilisation d’un fil d’acier inoxydable dans le tube PE10 augmente l’élasticité du tube et améliore le taux de réussite du cathétérisme intrathécal, l’espace nécessaire à l’opération est réduit et les dommages aux tissus autour de la colonne lombaire sont minimisés, ce qui préserve la fonction lombaire dans toute la mesure du possible et évite l’influence de la chirurgie sur les résultats des expériences ultérieures. Deuxièmement, le tube PE10 est fixé 4 fois avec une suture en forme de 8, ce qui empêche le mouvement et la rétraction du tube pendant le mouvement. Troisièmement, un capuchon d’étanchéité fait maison est utilisé pour sceller le tube PE10, ce qui empêche non seulement les fuites de liquide céphalo-rachidien, mais évite également la nécessité de couper à plusieurs reprises le tube PE10. La coupe répétée du cathéter peut raccourcir le cathéter, ce qui rend l’administration de médicaments peu pratique. Enfin, l’extrémité extracorporelle de la sonde PE10 est attachée avec une bande antiallergique, qui empêche la sonde de se rétracter pendant le mouvement.
Cependant, cette technique de cathétérisme intrathécal modifié présente plusieurs limites. Tout d’abord, après l’opération, les rats doivent être logés séparément (un par cage) pour éviter d’endommager l’extrémité extracorporelle du tube PE10. Deuxièmement, une récupération de 5 à 7 jours après l’injection intrathécale de lidocaïne est nécessaire avant les expériences ultérieures.
En conclusion, cette méthode modifiée de cathétérisme intrathécal peut servir d’outil utile pour l’administration intrathécale répétitive de médicaments et représenter un moyen simple, pratique et fiable de raccourcir la durée des expériences.
Déclarations de divulgation
Les auteurs de ce manuscrit déclarent qu’il n’y a pas de conflits d’intérêts.
Remerciements
Ce travail a été soutenu par la Fondation nationale des sciences naturelles (n° 81971042) et les projets de spécialistes du soutien clé de la Commission de la santé du district de Shanghai Hongkou (n° 100). HKZK2020A06).
matériels
| Name | Company | Catalog Number | Comments |
| 1 cc syringe | Jiangxi Hongda Medical Equipment Co., Ltd | 1 cc | |
| 22 gauge × 1” needles | Jiangxi Hongda Medical Equipment Co., Ltd | 22G | |
| 23 gauge × 1” needles | Jiangxi Hongda Medical Equipment Co., Ltd | 23G | |
| 25 μL Hamilton Syringes | Shanghai Bolige Co.,Ltd | 0.31mm 25 μL | |
| 4-O MERSILK NON-ABSORBABLE SUTURE | ETHICON | SA83G | |
| 50 mL corning centrifuge tubes 3 cm diameter | 430820 | CORNING | |
| Epidural catheter and connector | Henan Tuoren Medical Device Co., Ltd | regular type | |
| Gavage apparatus | Shanghai Bolige Co.,Ltd | 8# | |
| PE-10 Mirco Medical Tubing | BB31695-PE/1 | Scientific Commodities, Inc | |
| Scalpel handle and #10 blades | Jiangsu Songxin Medical Equipment Co., Ltd | 125mm | |
| Scissors | Jiangsu Songxin Medical Equipment Co., Ltd | 100mm | |
| Sprague-Dawley (SD) rats | Shanghai BK/KY Biotechnology Co., Ltd | Male | |
| Stainless steel wire 0.2 mm diameter | Dongguan Jiazhi Metal Products Technology Co., Ltd. | 0.2mm × 1m | |
| Toothed forceps | Jiangsu Songxin Medical Equipment Co., Ltd | 18cm | |
| URGO silk tape | URGO | 1.25cm × 9.1m |
Références
- Kong, G., Huang, Z., Zhu, Q., Wan, Y. Comparison of two modified methods of intrathecal catheterization in rats. Exp Anim. 69 (2), 219-223 (2020).
- Xu, C. S., Sun, P., Lin, C. a new design puncture needle and a device of microcatheter protection for lumbar intrathecal catheterization in rats. Zhongguo Ying Yong Sheng Li Xue Za Zhi. 36 (3), 283-288 (2020).
- Yamamoto, G., et al. Neurosteroid dehydroepiandrosterone sulphate enhances pain transmission in rat spinal cord dorsal horn. Br J Anaesth. 123 (2), e215-e225 (2019).
- Mattioli, T. A., Sutak, M., Milne, B., Jhamandas, K., Cahill, C. M. Intrathecal catheterization influences tolerance to chronic morphine in rats. Anesth Analg. 114 (3), 690-693 (2012).
- Wang, B. C., Hillman, D. E., Li, D., Turndorf, H. Lumbar subarachnoid catheterization in rats. Pharmacol Biochem Behav. 38 (3), 685-688 (1991).
- Yaksh, T. L., Rudy, T. A. Chronic catheterization of the spinal subarachnoid space. Physiol Behav. 17 (6), 1031-1036 (1976).
- Martin, H., Kocher, L., Chery-Croze, S. Chronic lumbar intrathecal catheterization in the rat with reduced-length spinal compression. Physiol Behav. 33 (1), 159-161 (1984).
- Mazur, C., et al. Development of a simple, rapid, and robust intrathecal catheterization method in the rat. J Neurosci Methods. 280, 36-46 (2017).
- Zhang, S. X., Huang, F., Gates, M., White, J., Holmberg, E. G. Extensive scarring induced by chronic intrathecal tubing augmented cord tissue damage and worsened functional recovery after rat spinal cord injury. J Neurosci Methods. 191 (2), 201-207 (2010).
- Ohara, P. T. Long-term intrathecal catheterization in the rat. J Neurosci Methods. 110 (1-2), 81-89 (2001).
- StØrkson, R. V., KjØrsvik, A., TjØlsen, A., Hole, K. Lumbar catheterization of the spinal subarachnoid space in the rat. J Neurosci Methods. 65 (2), 167-172 (1996).
- Poon, Y. Y., Chang, A. Y., Ko, S. F., Chan, S. H. An improved procedure for catheterization of the thoracic spinal subarachnoid space in the rat. Anesth Analg. 101 (1), table of contents 155-160 (2005).
- Xu, F., Li, T., Zhang, B. An improved method for protecting and fixing the lumbar catheters placed in the spinal subarachnoid space of rats. J Neurosci Methods. 183 (2), 114-118 (2009).
- Igawa, Y., Andersson, K. E., Post, C., Uvelius, B., Mattiasson, A. A rat model for investigation of spinal mechanisms in detrusor instability associated with infravesical outflow obstruction. Urol Res. 21 (4), 239-244 (1993).
- Hou, Y., et al. A modified procedure for lumbar intrathecal catheterization in rats. Neurol Res. 38 (8), 725-732 (2016).
- Farhadi, E., et al. Comparison of open and ultrasound-guided placement of central venous catheter in children weighing less than five kilograms; a randomized clinical trial. Acad Radiol. 30 (7), 1419-1425 (2023).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon