Évaluation en temps réel du Ca2+ absolu, cytosolique, libre et de la contractilité correspondante dans les vaisseaux lymphatiques isolés et pressurisés
Dans cet article
Résumé
Ce protocole décrit une méthode permettant de mesurer simultanément le calcium cytosolique, libre [Ca2+]i et le diamètre des vaisseaux dans les vaisseaux lymphatiques en contraction en temps réel, puis de calculer les concentrations absolues de Ca2+ ainsi que les paramètres de contractilité/rythmicité. Ce protocole peut être utilisé pour étudier le Ca2+ et la dynamique contractile dans diverses conditions expérimentales.
Résumé
Le système vasculaire lymphatique, aujourd’hui souvent appelé « troisième circulation », est situé dans de nombreux systèmes d’organes vitaux. L’une des principales fonctions mécaniques du système vasculaire lymphatique est de renvoyer le liquide des espaces extracellulaires vers les canaux veineux centraux. Le transport lymphatique est médié par des contractions rythmiques spontanées des vaisseaux lymphatiques (VG). Les contractions du VG sont largement régulées par la montée et la descente cycliques du calcium libre cytosolique ([Ca2+]i).
Cet article présente une méthode permettant de calculer simultanément les changements dans les concentrations absolues de [Ca2+]i et la contractilité/rythmicité des vaisseaux en temps réel dans les VG isolés et pressurisés. En utilisant des VG mésentériques de rat isolés, nous avons étudié les changements de [Ca2+]i et de contractilité/rythmicité en réponse à l’ajout de médicament. Des VG isolés ont été chargés avec l’indicateur de détection ratiométrique Ca2+ Fura-2AM, et la microscopie vidéo couplée à un logiciel de détection des bords a été utilisée pour capturer les mesures de [Ca2+]i et de diamètre en continu et en temps réel.
Le signal Fura-2AM de chaque BT a été calibré sur le signal minimum et maximum pour chaque navire et utilisé pour calculer le [Ca2+]i absolu. Les mesures de diamètre ont été utilisées pour calculer les paramètres contractiles (amplitude, diamètre diastolique fin, diamètre systolique fin, débit calculé) et la rythmicité (fréquence, temps de contraction, temps de relaxation) et corrélées avec les mesures absolues [Ca2+]i .
Introduction
Le système vasculaire lymphatique se trouve dans de nombreux systèmes organiques, notamment le cerveau, le cœur, les poumons, les reins et le mésentère 1,2,3,4,5,6, et fonctionne en propulsant le liquide (lymphe) des espaces interstitiels vers les canaux veineux centraux pour maintenir l’homéostasie du fluide 7,8,9,10 . Cela commence par des capillaires lymphatiques à extrémité aveugle dans les lits capillaires vasculaires qui se drainent dans les vaisseaux lymphatiques collecteurs (VG). Les VG collecteurs sont constitués de deux couches de cellules : une couche de cellules endothéliales englobée par une couche de cellules musculaires lymphatiques (LMC)10,11. Le transport du liquide lymphatique est réalisé à la fois par des forces extrinsèques (par exemple, la formation de nouvelles lymphes, des pulsations artérielles, des fluctuations de la pression veineuse centrale) et des forces intrinsèques12.
La force intrinsèque du transport lymphatique est la contraction rythmique spontanée des VG collecteurs, qui est au centre de la majorité des études portant sur la fonction lymphatique. Cette pompe lymphatique intrinsèque est principalement régulée par la montée et la descente cycliques du Ca2+ libre cytosolique ([Ca2+]i). La dépolarisation spontanée de la membrane plasmique dans les LMC active les canaux Ca2+ (Cav1.x) voltage-dépendants, déclenchant l’influx de Ca2+ et la contraction rythmique VG 8,9,10. Ce rôle a été démontré en bloquant Cav1.x avec des agents spécifiques, comme la nifédipine, qui inhibe les contractions du VG et provoque une dilatation des vaisseaux13,14. L’augmentation transitoire de [Ca2+]i ou « pic Ca2+ » dans les LMC médiée par les canaux Cav1.x peut également mobiliser les réserves intracellulaires de Ca2+ en activant les récepteurs de l’inositol triphosphate (IP3) et des récepteurs de la ryanodine (RyRs) sur le réticulum sarcoplasmique (SR)15,16,17,18. Les preuves actuelles suggèrent que les récepteurs IP3 contribuent davantage au Ca2+ nécessaire aux contractions normales du VG par rapport àRyRs 15,16,19,20,21 ; cependant, les RyR peuvent jouer un rôle au cours d’une pathologie ou en réponse à une intervention pharmaceutique17,18. De plus, l’activation des canaux K+ 22 activés par Ca2+ et des canaux potassiques sensibles à l’ATP (KATP)23,24 peut hyperpolariser la membrane LMC et inhiber l’activité contractile spontanée.
Il existe de nombreux autres canaux ioniques et protéines qui peuvent réguler la dynamique du Ca2+ dans la collecte des VG. Il est important d’utiliser des méthodes pour étudier les changements du Ca2+ et de la contractilité des vaisseaux en réponse aux agents pharmacologiques en temps réel pour comprendre ces régulateurs potentiels. Une méthode antérieure utilisant Fura-2 pour mesurer les variations relatives du VG [Ca2+]i a été décrite25. Étant donné que la constante de dissociation pour Fura-2 et Ca2+ est connue26, il est possible de calculer les concentrations réelles de Ca2+, ce qui élargit l’application de cette méthode et fournit des informations supplémentaires sur la signalisation Ca2+ , l’excitabilité membranaire et les mécanismes de contractilité27, tout en permettant des comparaisons de base entre les groupes expérimentaux. Cette dernière approche a été utilisée dans les cardiomyocytes28 et peut donc être adaptée aux VG. Cet article présente une méthode améliorée qui combine ces deux approches pour mesurer et calculer les changements de [Ca2+]i absolu ainsi que la contractilité/rythmicité des vaisseaux en continu et en temps réel dans les VG isolés et pressurisés. Nous fournissons également des résultats représentatifs pour les VG traités avec de la nifédipine.
Protocole
Des rats Sprague-Dawley mâles âgés de neuf à 13 semaines ont été achetés auprès d’un vendeur commercial. Après leur arrivée, tous les rats ont été logés et maintenus dans les installations de la Division de la médecine des animaux de laboratoire (DLAM) de l’Université de l’Arkansas (UAMS) avec un régime de laboratoire standard et exposés à 12 h de cycle lumière/obscurité à 25 °C. Toutes les procédures ont été effectuées conformément au protocole d’utilisation des animaux approuvé #4127 par le Comité institutionnel de soin et d’utilisation des animaux (IACUC) de l’UAMS.
1. Dissection et canulation des VG mésentériques
REMARQUE : Il est important de mettre en place la chambre de perfusion avant l’isolement des VG mésentériques pour s’assurer qu’il n’y a pas d’interruption du débit ou de fuite qui perturberait l’expérience.
- Préparation du bain de perfusion
- Achetez des micropipettes en verre borosilicaté (diamètre extérieur de 1,2 mm, diamètre intérieur de 0,68 mm et tirées à un diamètre de pointe extérieur de 75 à 100 μm) auprès d’un vendeur commercial. Coupez et polissez les micropipettes (c’est-à-dire les canules) à environ 1 à 2 cm de longueur pour les monter dans la chambre de perfusion du récipient isolé.
- Connectez chaque canule en verre montée dans la chambre de perfusion du récipient à des transducteurs de pression indépendants situés en ligne avec des régulateurs de pression indépendants alimentés par gravité à l’aide d’un tube en polyéthylène.
REMARQUE : Cela permet une manipulation indépendante des pressions d’entrée et de sortie en fonction de la conception de l’étude. La figure 1 illustre cette configuration en détail. - Remplissez la chambre de perfusion (5 mL), les micropipettes en verre et le régulateur de pression indépendant alimenté par gravité avec un tube de polyéthylène avec une solution saline physiologique (PSS ; 119 mM NaCl ; 24 mM NaHCO3 ; 1,17 mM NaH2PO4 ; 4,7 mM KCl ; 1,17 mM MgSO4 ; 5,5 mM C6H12O6 (glucose) ; 0,026 mM C10H16N2O8 (EDTA) ; et 1,6 mM CaCl2) dépourvu de bulles d’air. Ensuite, clampez la pression pour que les canules ne soient pas pressurisées.
REMARQUE : Le pH de cette solution est de ~7,5. Un pH de 7,4 est maintenu dans le bain de perfusion en utilisant des bulles de CO2 pour agir sur le système tampon de bicarbonate dans le PSS, comme décrit à l’étape 1.3.7. L’EDTA est utilisé ici pour chélater les ions Ca2+ en excès.
- Préparation des nœuds
- Faites des nœuds doubles au microscope à l’aide de fil de suture en soie tressé (taille 8-0). Les principales étapes sont illustrées à la figure 2.
- Séparez un seul filament.
- Utilisez deux pinces Dumont #5 avec des pointes micro-émoussées et à l’aide d’une pince, faites une double boucle autour de la pointe de l’autre pince.
- Avec la pince à boucle, saisissez l’extrémité libre de la suture et tirez-la à travers les deux boucles en veillant à ne pas fermer complètement le nœud et en laissant une petite ouverture.
- Utilisez des ciseaux à ressort Vanna pour couper l’excès de suture de chaque côté. Utilisez ces nœuds plus tard pour fixer le VG sur les canules.
REMARQUE : N’utilisez pas les mêmes pinces que celles avec lesquelles vous allez disséquer ou canuler, car il y a plus de risque d’endommager les pointes des pinces pendant le nouage.
- Faites des nœuds doubles au microscope à l’aide de fil de suture en soie tressé (taille 8-0). Les principales étapes sont illustrées à la figure 2.
- Isolement et canulation des VG mésentériques
- Anesthésier profondément les animaux en leur administrant un isoflurane à 5% avec un surdosage de 1,5 L/min d’O2 et exsanguler par décapitation.
- Isolez des mésentères entiers pour la dissection des VG mésentériques en faisant d’abord une coupe dans le sens de la longueur le long de la ligne médiane de la paroi abdominale, en extériorisant le mésentère, puis en coupant la connexion juste en dessous du sphincter pylorique et à ~2-3 cm au-dessus du cæcum ainsi que la connexion au rectum.
- Lavez les mésentères entiers disséqués dans 200 mL de PSS glacé, puis transférez-les dans une boîte de Petri (100 mm) doublée de silicone (8-10 mm) contenant du PSS glacé.
- Disséquez les VG mésentériques de deuxième ordre de la graisse et du tissu conjonctif environnants à l’aide d’un stéréomicroscope, d’une pince fine Dumont #5 Inox et de ciseaux à ressort Vanna. Pour aider à identifier les extrémités des VG une fois retirées du tissu, laissez un petit morceau de graisse sur l’extrémité proximale du VG.
- Transférez les VG disséqués dans la chambre de perfusion du vaisseau pour la canulation sur des canules en verre.
- Utilisez deux pinces fines Dumont #5 Inox pré-affûtées, pointe droite (0,05 x 0,01 mm) pour canuler les VG avec l’extrémité distale du VG sur la canule P1 (entrée) et l’extrémité proximale du vaisseau sur la canule P2 (sortie) pour imiter la direction de l’écoulement lymphatique.
REMARQUE : Les canules P1 et P2 sont identiques et ne diffèrent que par l’extrémité du VG qui est connectée. Il est important d’utiliser des pinces qui se rejoignent parfaitement à la pointe et sans dommage pour faciliter la saisie de la paroi mince du vaisseau.- Glissez un seul nœud pré-noué sur chaque canule en verre pour fixer plus tard le récipient sur les canules.
- En utilisant le petit morceau de graisse pour aider à orienter la direction VG, canulez d’abord l’extrémité distale sur P1.
- Faites glisser le nœud le long de la canule et serrez pour fixer le LV. Assurez-vous de ne pas trop serrer et casser l’extrémité de la canule.
- Pressurisez le VG à 4-5 mm Hg dans la chambre de perfusion.
REMARQUE : Pour nos besoins, nous définissons la pression P1 et P2 pour qu’elles soient égales ; Cependant, selon les conditions expérimentales, la pression peut être ajustée à chaque canule pour induire une contrainte de cisaillement ou un reflux. - Répétez les étapes 1.3.6.1 à 1.3.6.4 pour canuler l’extrémité proximale du VG sur P2.
- Placez la pierre bouillonnante avec 7 % de dioxyde de carbone (CO2) / 93 % d’oxygène (O2) dans la chambre du bain pour maintenir le pH physiologique.
- Raccordez la chambre au régulateur de température et réglez-la à 37 °C pour que les VG s’équilibrent et développent des contractions stables et spontanées (environ 30 min).
REMARQUE : la figure 1 illustre cette configuration en détail.
2. Mesure des concentrations absolues de [Ca2+]i dans les VG
- Coloration Fura-2AM des VG canulés
- Après l’apparition de contractions spontanées (à partir de l’étape 1.3.8), incuber les VG avec de l’ester de Fura-2-acétoxyméthyle (Fura-2AM ; 2 μM ou 10 μL/5 mL) et de l’acide pluronique (PA ; 0,02 % P/V ou 5 μL/5 mL de 20 % PA) pendant 30 min dans l’obscurité.
REMARQUE : Après l’ajout de Fura-2AM, toutes les étapes restantes doivent être effectuées dans l’obscurité. - Après 30 min, remplacer la solution dans la chambre de perfusion 3 fois en vidant tout le volume du bain avec un vide à pression négative, en le remplaçant par du PSS sans réactif adapté à la température (37 °C).
REMARQUE : Cela doit être fait rapidement pour minimiser le temps pendant lequel le VG est en suspension dans l’air. Utilisez les deux mains, par exemple, la main droite pour le vide et la main gauche pour le remplacement du nouveau PSS sans réactif. - Après le lavage, incubez les LV pendant 15 min dans l’obscurité pour éliminer l’excès d’indicateur et permettre la désestérification.
- Après l’apparition de contractions spontanées (à partir de l’étape 1.3.8), incuber les VG avec de l’ester de Fura-2-acétoxyméthyle (Fura-2AM ; 2 μM ou 10 μL/5 mL) et de l’acide pluronique (PA ; 0,02 % P/V ou 5 μL/5 mL de 20 % PA) pendant 30 min dans l’obscurité.
- Capturer le Ca2+ fluorescence et diamètre du vaisseau
- Transférez la chambre sur la platine de microscope à fluorescence inversée équipée d’une source lumineuse LED, d’un objectif S Fluor 20x, d’un adaptateur de cadre de cellule et d’un système de caméra vidéo CMOS rapide, qui permet une capture de fluorescence image par image à 15 Hz.
REMARQUE : La figure 3 présente un schéma de cette configuration de flux de travail. Le signal Ca2+ peut être capturé à l’aide d’une caméra CCD avec au moins 15 ips. - Connectez le microscope à l’ordinateur équipé d’un logiciel d’imagerie pour enregistrer la fluorescence et la détection des bords.
REMARQUE : Le logiciel référencé permet également l’enregistrement simultané de la pression ; Cependant, cela n’est pas inclus ici. - Allumez la source lumineuse LED et l’interface du système fluorescent.
REMARQUE : Les instructions logicielles décrites ici concernent les logiciels référencés, mais d’autres logiciels peuvent être utilisés pour obtenir ces données. - Ouvrez le logiciel (IonWizard).
- Sous l’onglet Fichier , sélectionnez Nouveau.
- Sous l’onglet Collecter , sélectionnez Test.
- Chargez le modèle expérimental souhaité et cliquez sur OK.
REMARQUE : Vous devrez mettre en place un modèle expérimental avec les paramètres à mesurer. Les instructions pour la configuration du modèle se trouvent dans le manuel du logiciel29. - Ajustez les traces à l’écran pour afficher le diamètre du récipient, le numérateur (signal 340), le dénominateur (signal 380) et le rapport dans l’ordre décroissant.
- Ajustez l’échelle de l’axe Y si nécessaire pour faciliter la visualisation des traces.
- Sous Traces, sélectionnez Modifier les limites d’utilisateurs. Assurez-vous que l’option Limites automatiques n’est pas cochée.
- Sélectionnez le paramètre que vous souhaitez ajuster, entrez les valeurs minimale et maximale de l’axe, puis sélectionnez OK.
- Pour commencer l’expérience, cliquez sur DÉMARRER (en bas de l’écran).
- Pour mesurer simultanément le diamètre des VG, utilisez le logiciel de détection des bords intégré au système d’imagerie, qui génère des traces contractiles de VG à 3 Hz. Utilisez ces mesures pour analyser les paramètres contractiles et rythmiques décrits dans la section 3 et illustrés à la figure 4.
- Assurez-vous d’ajuster l’éclairage de manière à ce que le mur LV apparaisse sous forme de lignes sombres.
- Sélectionnez une région d’intérêt (ROI) dépourvue de graisse et de débris. Une fois l’expérience lancée, ne déplacez pas ce ROI.
- Assurez-vous que le seuil est réglé de manière à ce que le bord de la paroi du vaisseau soit détecté tout au long du cycle de contraction.
- Pour les mesures de fluorescence, allumez le tube photomultiplicateur (PMT).
- Excitez Fura-2, un indicateur ratiométrique, en alternant les longueurs d’onde de 340 et 380 nm lors d’expositions de 50 ms à l’aide d’illuminateurs LED, et capturez les spectres d’émission à 510 nm à 15 Hz sur l’ensemble du champ d’imagerie.
REMARQUE : Il est important de garder tous les paramètres optiques (paramètres d’excitation, filtres d’émission, lentille d’objectif et miroirs dichroïques) identiques pour toute une série d’expériences afin d’obtenir des mesures de Ca2+ reproductibles. - Mesurez le rapport signal/bruit de fond en obtenant d’abord les fluorescences 340 et 380 avec le BT au milieu du champ de vision (signal) puis, à l’aide des manipulateurs de platine, déplacer le champ de vision vers le bord du bain sans récipient (en prenant soin d’éviter le bord doublé de silicone et/ou en enlevant tout débris du bain) pour capturer l’arrière-plan.
REMARQUE : Il est important de revenir à la section d’origine du récipient à chaque fois pour les mesures Ca2+ . - Remplacez la solution de bain par du PSS sans réactif de température adaptée pour éliminer l’indicateur en excès dans le bain. Il peut falloir plusieurs changements de bain pour éliminer l’excès de Fura-2, alors répétez cet échange jusqu’à ce que le rapport signal/bruit de fond soit d’environ 10:1.
- Enregistrer le signal de fluorescence Fura-2 de base et les contractions spontanées pendant environ 30 minutes, suivis d’une réponse de concentration cumulative de nifédipine (NIF ; 0,1-100 nM), un antagoniste Cav1,x dépendant de la tension. Obtenez des mesures de fond pour chaque concentration de médicament.
- À la fin de chaque expérience, laver les VG avec du PSS sans Ca2+ adapté à la température pour obtenir le signal de fluorescence Fura-2 minimum (Rmin) et le diamètre maximal des VG en l’absence de Ca2+. Assurez-vous de mesurer l’arrière-plan.
REMARQUE : Le PSS sans Ca2+ a la même composition que le PSS mais sans CaCl2, et l’EDTA est remplacé par 1 mM d’EGTA (C14H24N2O10) (pH ~7,5). - Remplacez la solution de bain par un PSS adapté à la température contenant 10 mM de Ca2+ et de l’ionomycine (10 μM IONO), un ionophore de Ca2+ , pour obtenir le signal de fluorescence Fura-2 maximal (Rmax) et le diamètre minimum des VG dans des conditions de saturation de Ca2+. Assurez-vous de mesurer l’arrière-plan.
- Transférez la chambre sur la platine de microscope à fluorescence inversée équipée d’une source lumineuse LED, d’un objectif S Fluor 20x, d’un adaptateur de cadre de cellule et d’un système de caméra vidéo CMOS rapide, qui permet une capture de fluorescence image par image à 15 Hz.
- La formule de mesure absolue [Ca2+]i
- Utilisez Rmin et Rmax pour calibrer le rapport des longueurs d’onde de 340 et 380 nm et calculer la concentration absolue de Ca2+ sans cytosolique ([Ca2+]i).
- Calculer la concentration absolue de Ca2+ cytosolique libre ([Ca2+]i) à l’aide de l’équation (1)26 :
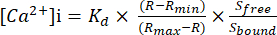 (1)
(1)
Où Kd = 225 nM (constante de dissociation pour Fura-2)26, R = rapport 340/380, Rmin = rapport 340/380 en l’absence de Ca2+, Rmax = rapport 340/380 avec des conditions de saturation de Ca2+, Slibre = 380 signal en l’absence de Ca2+, Slié = 380 signal avec des conditions de saturation de Ca2+
REMARQUE : Tous les signaux fluorescents ont été corrigés pour la fluorescence de fond. - La figure 5 est un exemple de trace Ca2+ détaillant les paramètres enregistrés. Définissez la ligne de base Ca2+ comme le Ca2+ au repos le plus bas avant le pic Ca2+ et le pic Ca2+ comme le Ca2+ le plus élevé atteint pendant le pic Ca2+ . L’amplitude est la différence entre le pic et la ligne de base Ca2+. Exportez tous les paramètres directement depuis le logiciel d’imagerie, à l’exception de la fréquence des pointes de Ca2+ qui doit être calculée hors ligne comme le nombre de pointes de Ca2+ /s. Vous trouverez ci-dessous les étapes clés au sein du logiciel référencé pour obtenir ces paramètres.
REMARQUE : Des traces entières peuvent être exportées dans un fichier .txt et tous les paramètres peuvent être analysés ou calculés dans le logiciel de votre choix. - Pour Rmin, mettez en surbrillance la section de la trace du numérateur qui correspond à l’arrière-plan pendant le PSS sans Ca2+. Une boîte de dialogue s’ouvre et fournit les valeurs de cette partie de la trace.
- Sous Opérations, sélectionnez Constantes.
- Sélectionnez Arrière-plan Calcium-Numérique et entrez les numéros d’arrière-plan pour le numérateur et le dénominateur de l’étape précédente. Cliquez sur OK.
- Mettez en surbrillance la section de la trace Ratio qui correspond au ratio le plus bas pendant le PSS sans Ca2+. Il s’agit de Rmin. Notez également la valeur du dénominateur pour cette section ; c’estS gratuit.
- Répétez les étapes 2.3.4 à 2.3.7 pour Rmax et Slié à la section de la trace qui correspond à un PSS libre Ca2+ élevé et au rapport le plus élevé.
- Sous Opérations, sélectionnez Constantes.
- Sélectionnez Étalonnage calcium-calcium et entrez les valeurs répertoriées dans l’équation 1. Cliquez sur OK.
- Ajustez l’une des traces à l’écran comme décrit à l’étape 2.2.8 afin de voir le calcium-numérique soustrait le calcium.
- Effectuez une analyse transitoire monotone pour acquérir les paramètres restants. Vous trouverez des instructions à ce sujet dans le manuel du logiciel30.
- Sinon, sous Exporter, sélectionnez Trace actuelle.
- Sélectionnez l’emplacement vers lequel vous souhaitez exporter le fichier .txt et cliquez sur OK.
REMARQUE : Assurez-vous de cliquer sur la trace individuelle que vous souhaitez exporter. Vous pouvez exporter l’intégralité de la trace ou des sections sélectionnées de la trace.
3. Mesure de la contractilité et de la rythmicité du VG
- Le logiciel de détection des bords intégré au système d’imagerie génère des traces contractiles pour les mesures de diamètre BT comme décrit ci-dessus. Utilisez ces mesures pour analyser les paramètres contractiles et rythmiques. La figure 4 est un exemple de trace contractile détaillant les paramètres contractiles à enregistrer. Exportez tous les paramètres directement depuis le logiciel d’imagerie à l’aide de la fonction d’analyse transitoire monotone sur le tracé Diameter30, à l’exception de la fréquence des contractions, du débit calculé et de l’intervalle, qui doivent être calculés hors ligne.
REMARQUE : Des traces entières peuvent être exportées dans un fichier .txt et tous les paramètres peuvent être analysés ou calculés dans le logiciel de votre choix à l’aide des équations ci-dessous. - EDD, ESD, amplitude, fréquence et mesures de débit calculées
- Mesurez les diamètres maximum et minimum (diamètre diastolique final [EDD] et diamètre systolique final [ESD], respectivement) que les VG peuvent atteindre lors de leurs contractions rythmiques et spontanées.
- Calculez l’amplitude des contractions (AMP) comme la différence entre EDD et ESD.
- Calculez la fréquence en nombre de contractions par période de mesure (en s).
- Calculer le débit par μm calculé à l’aide de l’équation (2) :
Débit calculé = π/4(EDD2- ESD2)F (2)
Où EDD2 = section transversale du vaisseau pendant l’état de relâchement, ESD2 = mesure de la section transversale du vaisseau pendant la constriction, F = fréquence des contractions/s
- Rythmicité : contraction et temps de relaxation :
- D’autres mesures de la rythmicité du VG sont le temps de contraction et le temps de relaxation.
- Définissez le temps de contraction comme le temps mis par le VG pour atteindre l’ESD à chaque contraction.
- Définir le temps de relaxation comme le temps mis par le VG pour atteindre l’EDD pour chaque relaxation, ce qui donnera une indication globale de la rythmicité corrélée avec le [Ca2+]i absolu dans un laps de temps spécifique.
- Calculer le temps d’intervalle (ΔT) à partir de l’équation (3).
Δt = t2 (ESD2)-t1 (ESD1) (3)
Résultats Représentatifs
La contractilité des VG et les altérations correspondantes du Ca2+ libre cytosolique ([Ca2+]i) ont été évaluées dans des VG mésentériques de rat isolés lors d’une exposition à des concentrations variables de nifédipine (NIF ; 0,1-100 nM) (figure 6). Les paramètres, y compris l’amplitude du pic de Ca2+, le Ca2+ de base et le pic de Ca2+, ont montré une réduction dépendante de la concentration avec l’ajout progressif de NIF dans la chambre de perfusion (Figure 7A). Parallèlement, les paramètres contractiles tels que l’amplitude de contraction et l’écoulement calculé ont également montré une diminution progressive (Figure 7B). Il y a eu une légère augmentation du diamètre EDD avec le NIF (Figure 7B). La fréquence de pic et la fréquence de contraction de Ca2+ semblent être une réponse tout ou rien. Cependant, cet effet s’est produit à 10 nM pour un VG, alors que tous les VG avaient cessé leurs contractions à 100 nM. Ainsi, les données combinées génèrent des graphiques qui ressemblent à une réponse de concentration graduelle. Cet effet est cohérent avec les publications antérieures qui utilisaient le NIF sur les VG dans d’autres préparations (myographie par fil et pression13,14). Les graphiques de Manhattan montrent les réponses individuelles du VG pour les mesures de la rythmique, y compris l’intervalle, le temps de contraction et le temps de relaxation (Figure 7C). Ce type de représentation des données permet au chercheur de démêler ces réponses tout ou rien ou la variabilité des rythmes de contraction afin de fournir des informations supplémentaires sur les mécanismes sous-jacents. En fin de compte, les diminutions de l’amplitude et de la fréquence de contraction ont entraîné une réduction du débit calculé à travers ces VG isolés, qui sert d’indicateur de substitution pour la fonction in vivo. Dans l’ensemble, la baisse de la contractilité du VG était corrélée à la réduction de [Ca2+]i. Nos résultats fournissent des preuves directes que dans la gamme de 100 nM, le NIF a efficacement arrêté les contractions et les oscillations de [Ca2+]i dans les VG en antagonisant les canaux Cav1.x présents dans les cellules musculaires lymphatiques (LMC).
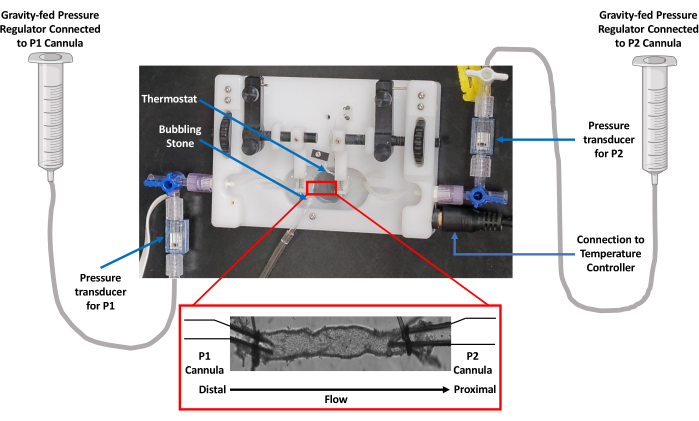
Figure 1 : Image de la configuration isolée de la chambre de la cuve. Les études de perfusion vasculaire ont utilisé une chambre vasculaire isolée équipée d’un thermorégulateur. La gravité a été utilisée pour contrôler la pression via un réservoir PSS. La pression a été surveillée par des transducteurs reliés à des canules d’entrée (P1) et de sortie (P2). Abréviation : PSS = solution saline physiologique. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Préparation du nœud en un coup d’œil. (A) Préparation à double boucle sous le microscope de dissection à l’aide d’un seul filament de fil de suture en soie à 3 plis, (B) saisir l’extrémité libre et la tirer à travers les deux boucles, (C) tirer le nœud des deux extrémités pour garder une petite ouverture, et (D) couper l’excédent de filament de chaque côté et la boîte bleue montrant un double nœud plat complet prêt à l’emploi. Barre d’échelle = 1,5 mm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
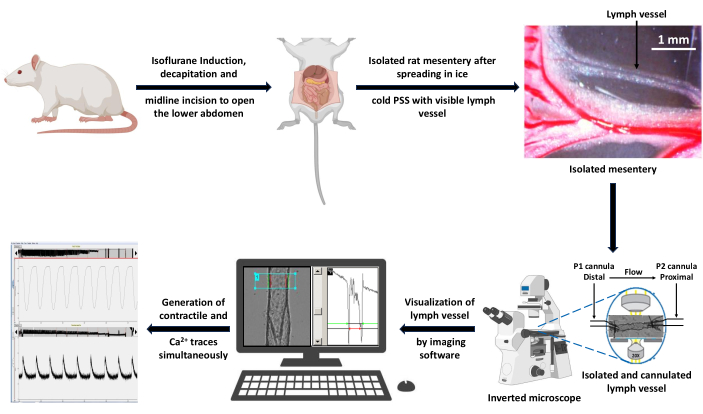
Figure 3 : Schéma du flux de travail expérimental pour l’acquisition de données. Un rat en bonne santé a été anesthésié avec une induction d’isoflurane à 5 % et une décapitation a été effectuée pour enlever le sang du tronc. Une incision médiane a été pratiquée pour exposer et isoler le mésentère. Le mésentère isolé a été étalé dans une solution glacée de PSS et un VG a été disséqué sans graisse pour la canulation dans une chambre de perfusion de vaisseaux isolés. Le bain a été placé sur la platine du microscope inversé à l’aide d’un objectif 20x. Le vaisseau a été excité alternativement avec une lumière de longueur d’onde de 340 et 380 nm et les spectres fluorescents d’émission ont été collectés à l’aide d’une caméra CCD à 510 nm. L’ordinateur connecté au microscope a généré les traces contractiles et Ca2+ à l’aide d’un logiciel d’imagerie par capture de fluorescence et détection de bord. Barre d’échelle = 1 mm. Abréviations : PSS = solution saline physiologique ; LV = vaisseau lymphatique ; CCD = dispositif à couplage de charge. Veuillez cliquer ici pour voir une version agrandie de cette figure.
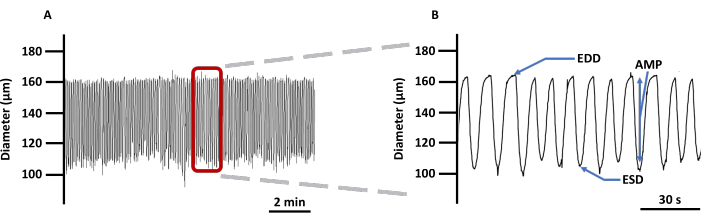
(A) Exemple d’enregistrement des changements de diamètre des VG canulés chargés avec l’indicateur d’imagerie Ca2+ Fura 2 AM en PSS et (B) une trace zoomée pour montrer tous les paramètres liés à la contractilité du vaisseau : EDD, ESD, AMP, et fréquence. Ces valeurs ont été utilisées pour calculer la rythmicité et le débit. Abréviations : PSS = solution saline physiologique ; LV = vaisseau lymphatique ; EDD = diamètre diastolique final ; ESD = diamètre systolique final ; AMP = amplitude. Veuillez cliquer ici pour voir une version agrandie de cette figure.
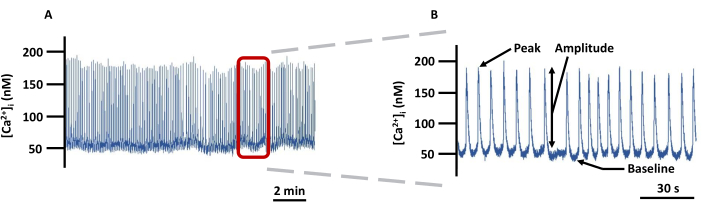
Figure 5 : Trace d’imagerie VG Ca2+ représentative. (A) Exemple d’enregistrement des changements de [Ca2+]i absolu dans les VG canulés chargés de Fura-2 dans PSS et (B) une trace zoomée pour montrer tous les paramètres (Peak, Amplitude et Baseline) liés à [Ca2+]i (non corrigé en arrière-plan). Abréviation : PSS = solution saline physiologique. Veuillez cliquer ici pour voir une version agrandie de cette figure.
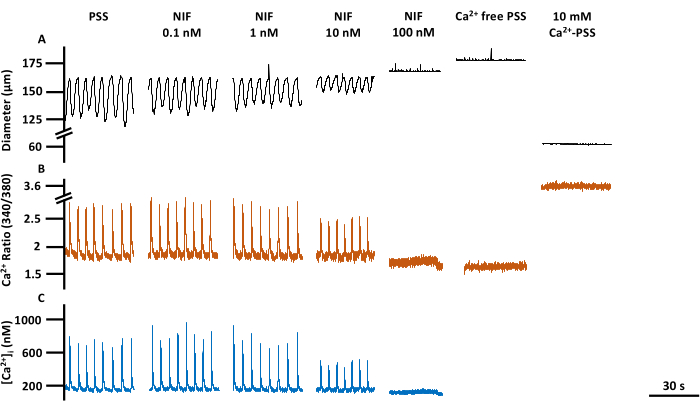
Figure 6 : Aperçu de la contractilité du VG et de l’imagerie Ca2+. Traces représentatives correspondant à (A) le diamètre, (B) le rapport 340/380 et (C) absolu [Ca2+]i de la ligne de base du PSS, la nifédipine, un antagoniste des canaux Cav1.x (Ca2+), la réponse à la concentration, y compris Rmin et Rmax. Abréviations : PSS = solution saline physiologique ; LV = vaisseau lymphatique ; NIF = nifédipine ; Rmin = signal de fluorescence Fura-2 minimal ; Rmax = signal de fluorescence Fura-2 maximal. Veuillez cliquer ici pour voir une version agrandie de cette figure.
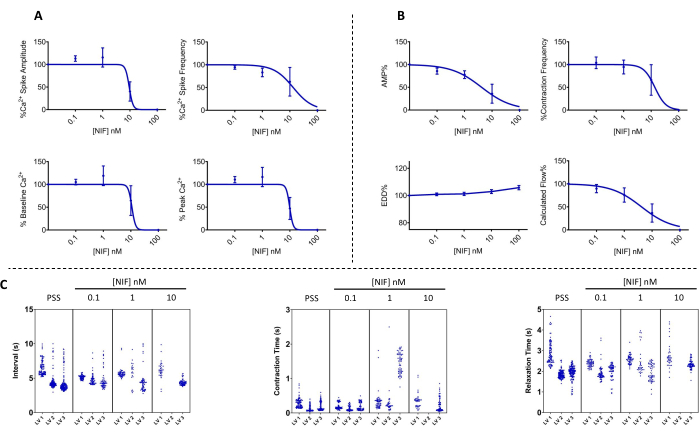
Figure 7 : Oscillation Ca2+ et contractilité correspondante bloquée par la nifédipine dans les VG. (A) Les paramètres Ca2+ (n = 3) et (B) contractile (n = 3) ont diminué de manière dépendante de la concentration avec l’ajout de nifédipine, un antagoniste des canaux Cav1.x (Ca2+) dépendant de la tension. (C) Les graphiques représentatifs de Manhattan montrent l’intervalle de temps moyen (Δt) entre les contractions et les temps de contraction et de relaxation. Données présentées en moyenne ± MEB. Abréviations : PSS = solution saline physiologique ; LV = vaisseau lymphatique ; NIF = nifédipine ; EDD = diamètre diastolique final ; AMP = amplitude. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
En raison de la nature fragile et minuscule des VG, il est impératif de faire preuve de la plus grande prudence pendant les processus de dissection et de canulation. Même des dommages mineurs au vaisseau pourraient entraîner le développement d’un VG non viable ou donner lieu à des anomalies dans les transitoires [Ca2+]i . La cohérence des paramètres d’excitation est tout aussi cruciale tout au long de la série expérimentale pour assurer la comparabilité des mesures de [Ca2+]i entre les groupes témoins et traités. Le fait de ne pas maintenir des paramètres uniformes présente un risque important de surestimation ou de sous-estimation de [Ca2+]i entre les récipients d’une série expérimentale. De même, il est tout aussi important d’identifier et de surveiller avec précision la même région du vaisseau tout au long de chaque expérience.
L’utilisation de l’indicateur ratiométrique Fura-2AM normalise les variations de fluorescence causées par l’épaisseur inégale des tissus, la distribution/fuite de fluorophores ou le photoblanchiment, problèmes courants avec les colorants à longueur d’onde unique. 31 Cela permet la surveillance continue décrite dans le présent protocole. Cependant, comme Fura-2 agit en chélant le Ca2+, il est possible de surcharger les VG et de réduire le [Ca2+]i disponible pour la contraction ou la réponse médicamenteuse. Dans ces cas, des pics de Ca2+ peuvent encore être observés en l’absence de contractions rythmiques. La longueur variable du VG peut également contribuer à ce phénomène. Bien que ces mesures de Ca2+ puissent probablement être encore valides, il peut être nécessaire de réduire la concentration de Fura-2AM dans les configurations répétées pour réussir à obtenir des mesures de Ca2+ et de diamètre. Nos résultats n’incluent que les VG pour lesquels des pics de Ca2+ et des contractions rythmiques étaient présents au départ.
La mesure de Rmin et Rmax est une étape critique dans le calcul absolu de [Ca2+]i. Étant donné que Rmin devrait être le rapport Fura-2 en l’absence de Ca2+, une forte concentration d’EGTA a été ajoutée au PSS sans Ca2+ pour assurer la chélation de tout Ca2+ résiduel. Des études initiales ont été menées avec de l’EDTA dans le PSS sans Ca2+, ce qui a entraîné des contractions sporadiques des vaisseaux avec des pics de Ca2+ correspondants. Pour Rmax, une forte concentration de Ca2+ a été ajoutée au PSS avec un ionophore, l’ionomycine, pour maximiser le signal [Ca2+]i . La solution à haute teneur en Ca2+ peut précipiter, ce qui peut nécessiter l’élimination de l’EDTA du PSS. Il est important de noter que ces mesures supplémentaires de Rmin et Rmax offrent l’occasion d’évaluer des changements physiologiquement pertinents dans [Ca2+]i, ce qui peut fournir des informations sur les mécanismes d’excitabilité et de contractilité membranaires27 et permettre des comparaisons de base entre les groupes expérimentaux par rapport aux protocoles qui ne rapportent que le rapport 340/380 pour Fura-2. L’incapacité d’atteindre des valeurs Rmin et Rmax adéquates empêche de calculer le [Ca2+]i absolu.
En raison de la nature contractile des VG, cette méthode ne peut fournir qu’une mesure des niveaux globaux de Ca2+ plutôt que des événements locaux de libération de Ca2+ qui peuvent être mesurés dans les vaisseaux paralysés32. Cependant, cette méthode est avantageuse pour corréler les changements de la dynamique absolue du [Ca2+]i avec la contractilité par rapport aux méthodes utilisant des vaisseaux paralysés ou des cellules individuelles28,32. Pour cette approche, on suppose que la majorité du Ca2+ mesuré provient des cellules musculaires lymphatiques. Cependant, les cellules endothéliales, qui sont également présentes dans ces VG isolés, peuvent contribuer au signal Ca2+ total observé33. Cette contribution a pu être estimée à l’aide de VG qui ont été dénudés de l’endothélium34. Les contractions du VG peuvent également entraîner un léger décalage de la paroi du vaisseau vers l’intérieur et vers l’extérieur pendant le cycle de contraction. Par conséquent, il est important d’utiliser des segments de récipient courts qui peuvent être tendus mais sans étirer le récipient.
Au-delà de son application dans les VG, cette méthode pourrait être utilisée pour étudier des vaisseaux isolés d’autres lits vasculaires, y compris les artérioles et les veines, et est prometteuse pour une utilisation potentielle en neurobiologie et dans d’autres branches de la biologie vasculaire. L’exploration des effets de divers agonistes ou antagonistes ciblant différentes voies de transduction du signal est une autre voie pour étudier la dynamique sous-jacente du Ca2+ . En outre, cette technique peut également être utilisée pour des recherches comparatives impliquant des échantillons de contrôle et traités d’animaux respectifs. De plus, cette approche est adaptable pour être mise en œuvre au niveau cellulaire, par exemple dans des cellules musculaires lymphatiques isolées, nécessitant des ajustements minimes de la chambre de perfusion et des objectifs du microscope. En résumé, cette méthode fournit un aperçu physiologiquement pertinent de la dynamique globale du Ca2+ , car elle est corrélée à la contractilité et à la rythmicité dans les VG et fournit une évaluation robuste des régulateurs potentiels de la dynamique du Ca2+ dans la collecte des VG.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à divulguer.
Remerciements
Ce travail a été soutenu par les National Institutes of Health, y compris le National Institute of General Medical Sciences, les Centers of Biomedical Research Excellence (COBRE), le Center for Studies of Host Response to Cancer Therapy [P20-GM109005], le National Cancer Institute [1R37CA282349-01] et l’American Heart Association Predoctoral Fellowship [Numéro d’attribution : 23PRE1020738 ; https://doi.org/10.58275/AHA.23PRE1020738.pc.gr.161089]. Le contenu relève de la seule responsabilité des auteurs et ne représente pas nécessairement les opinions officielles du NIH ou de l’AHA. Les figures 1 et 3 ont été créées avec BioRender.com.
matériels
| Name | Company | Catalog Number | Comments |
| 20x S Fluor objective | Olympus Corporation of the Americas (Center Valley, PA, United States) | UPlanSApo | |
| Borosilicate glass micropipettes | Living Systems Instrumentation (Burlington, VT, United States) | GCP-75-100 | |
| Calcium chloride (CaCl2) | Fisher Bioreagents (Waltham, MA, United States) | BP510-500 | |
| Carbon dioxide (CO2) | nexAir (Memphis, TN, United States) | UN3156 | |
| Dissection forceps | Fine Science Tools (Foster City, CA, United States) | 11254-20 | |
| EDTA (C10H16N2O8) | Fisher Bioreagents (Waltham, MA, United States) | BP118-500 | |
| EGTA (C14H24N2O10) | Fisher Bioreagents (Waltham, MA, United States) | O2783-100 | |
| Fura-2AM | Invitrogen (Waltham, MA, United States) | F1221 | |
| Glucose (C6H12O6) | Fisher Bioreagents (Waltham, MA, United States) | D16-500 | |
| Gravity-Fed Pressure regulator | custom-made in the lab | ||
| Heating unit | Living Systems Instrumentation (Burlington, VT, United States) | TC-09S | |
| Imaging software | IonOptix (Westwood, MA, United States) | ||
| Inverted fluorescent microscope | Olympus Corporation of the Americas (Center Valley, PA, United States) | IX73 | |
| Ionomycin | Invitrogen (Waltham, MA, United States) | I24222 | |
| IonOptix Cell Framing Adaptor | IonOptix (Westwood, MA, United States) | 665 DXR | |
| Isoflurane | Piramal Critical Care (Telangana, India) | NDC 66794-017-10 | |
| Isolated vessel perfusion chamber | Living Systems Instrumentation (Burlington, VT, United States) | CH-1 | |
| Knot preparation forceps | Fine Science Tools (Foster City, CA, United States) | 11253-20 | |
| LED light source | Olympus Corporation of the Americas (Center Valley, PA, United States) | TL4 | |
| Magnesium sulfate (MgSO4) | Acros Organics (New Jersey, NJ, Unites States) | 213115000 | |
| MyoCam-S3 Fast CMOS video system | IonOptix (Westwood, MA, United States) | MCS300 | |
| Nifedipine | Sigma (St. Louis, MO, United States) | N7634 | |
| Ophthalmic sutures | |||
| Oxygen (O2) | nexAir (Memphis, TN, United States) | UN1072 | |
| Pluronic acid | Sigma (St. Louis, MO, United States) | P2443 | |
| Potassium chloride (KCl) | Fisher Bioreagents (Waltham, MA, United States | BP366-500 | |
| Pressure monitor system | Living Systems Instrumentation (Burlington, VT, United States) | PM-4 | |
| Pressure Transducer | Living Systems Instrumentation (Burlington, VT, United States) | PT-F | |
| Silicone-lined petri-dish | custom-made in the lab | ||
| Sodium bicarbonate (NaHCO3) | Fisher Bioreagents (Waltham, MA, United States | BP328-500 | |
| Sodium chloride (NaCl) | Fisher Bioreagents (Waltham, MA, United States | BP358-212 | |
| Sodium phosphate (NaH2PO4) | Fisher Bioreagents (Waltham, MA, United States | BP329-500 | |
| Sprague-Dawley rats | Envigo RMS (Indianapolis, IN, USA) | Male | 9-13 weeks old |
| Stereomicroscope | Leica Microsystems (Wetzlar, Germany) | S9D | |
| Vannas spring scissors | Fine Science Tools (Foster City, CA, United States) | 15000-03 |
Références
- Takahashi, T., Shibata, M., Kamiya, A. Mechanism of macromolecule concentration in collecting lymphatics in rat mesentery. Microvasc Res. 54 (3), 193-205 (1997).
- Ishikawa, Y., et al. The human renal lymphatics under normal and pathological conditions. Histopathology. 49 (3), 265-273 (2006).
- Fanous, M. Y. Z., Phillips, A. J., Windsor, J. A. Mesenteric lymph: the bridge to future management of critical illness. JOP. 8 (4), 374-399 (2007).
- El-Chemaly, S., Levine, S. J., Moss, J. Lymphatics in lung disease. Ann N Y Acad Sci. 1131 (1), 195-202 (2008).
- Klotz, L., et al. Cardiac lymphatics are heterogeneous in origin and respond to injury. Nature. 522 (7554), 62-67 (2015).
- Louveau, A., et al. Structural and functional features of central nervous system lymphatic vessels. Nature. 523 (7560), 337-341 (2015).
- Aukland, K., Reed, R. K. Interstitial-lymphatic mechanisms in the control of extracellular fluid volume. Physiol Rev. 73 (1), 1-78 (1993).
- Zawieja, D. C. Contractile physiology of lymphatics. Lymphat Res Biol. 7 (2), 87-96 (2009).
- Nipper, M. E., Dixon, J. B. Engineering the Lymphatic System. Cardiovasc Eng Technol. 2 (4), 296-308 (2011).
- Choi, I., Lee, S., Hong, Y. K. The new era of the lymphatic system: No longer secondary to the blood vascular system. Cold Spring Harb Perspect Med. 2 (4), 006445 (2012).
- Ji, R. C. Lymphatic endothelial cells, lymphedematous lymphangiogenesis, and molecular control of edema formation. Lymphat Res Biol. 6 (3-4), 123-137 (2008).
- Scallan, J. P., Zawieja, S. D., Castorena-Gonzalez, J. A., Davis, M. J. Lymphatic pumping: mechanics, mechanisms and malfunction. J Physiol. 594 (20), 5749-5768 (2016).
- Lee, S., Roizes, S., vonder Weid, P. Y. Distinct roles of L- and T-type voltage-dependent Ca2+ channels in regulation of lymphatic vessel contractile activity. J Physiol. 592 (24), 5409-5427 (2014).
- Telinius, N., et al. Human lymphatic vessel contractile activity is inhibited in vitro but not in vivo by the calcium channel blocker nifedipine. J Physiol. 592 (21), 4697-4714 (2014).
- Imtiaz, M. S., Zhao, J., Hosaka, K., vonder Weid, P. Y., Crowe, M., van Helden, D. F. Pacemaking through Ca2+ stores interacting as coupled oscillators via membrane depolarization. Biophys J. 92 (11), 3843-3861 (2007).
- Jo, M., Trujillo, A. N., Yang, Y., Breslin, J. W. Evidence of functional ryanodine receptors in rat mesenteric collecting lymphatic vessels. Am J Physiol Heart Circ Physiol. 317 (3), H561-H574 (2019).
- Stolarz, A. J., et al. Doxorubicin Activates Ryanodine Receptors in Rat Lymphatic Muscle Cells to Attenuate Rhythmic Contractions and Lymph Flow. J Pharmacol Exp Ther. 371 (2), 278-289 (2019).
- Van, S., et al. Dantrolene Prevents the Lymphostasis Caused by Doxorubicin in the Rat Mesenteric Circulation. Front Pharmacol. 12, 727526 (2021).
- Atchison, D. J., Johnston, M. G. Role of extra- and intracellular Ca2+ in the lymphatic myogenic response. Am J Physiol Regul Integr Comp Physiol. 272 (1), R326-R333 (1997).
- Atchison, D. J., Rodela, H., Johnston, M. G. Intracellular calcium stores modulation in lymph vessels depends on wall stretch. Can J Physiol Pharmacol. 76 (4), 367-372 (1998).
- Zhao, J., van Helden, D. F. ET-1-associated vasomotion and vasospasm in lymphatic vessels of the guinea-pig mesentery. Br J Pharmacol. 140 (8), 1399-1413 (2003).
- Cotton, K. D., Hollywood, M. A., McHale, N. G., Thornbury, K. D. Outward currents in smooth muscle cells isolated from sheep mesenteric lymphatics. J Physiol. 503 (1), 1-11 (1997).
- Mathias, R., vonder Weid, P. Y. Involvement of the NO-cGMP-KATP channel pathway in the mesenteric lymphatic pump dysfunction observed in the guinea pig model of TNBS-induced ileitis. Am J Physiol Gastrointest Liver Physiol. 304 (6), G623-G634 (2013).
- Garner, B. R., et al. KATP channel openers inhibit lymphatic contractions and lymph flow as a possible mechanism of peripheral edema. J Pharmacol Exp Ther. 376 (1), 40-50 (2021).
- Souza-Smith, F. M., Kurtz, K. M., Breslin, J. W. Measurement of cytosolic Ca2+ in isolated contractile lymphatics. J Vis Exp. (58), e3438 (2011).
- Grynkiewicz, G., Poenie, M., Tsien, R. Y. A new generation of Ca2+ indicators with greatly improved fluorescence properties. J Biol Chem. 260 (6), 3440-3450 (1985).
- Hill-Eubanks, D. C., Werner, M. E., Heppner, T. J., Nelson, M. T. Calcium signaling in smooth muscle. Cold Spring Harb Perspect Biol. 3 (9), 1-20 (2011).
- Harmer, A. R., Abi-Gerges, N., Morton, M. J., Pullen, G. F., Valentin, J. P., Pollard, C. E. Validation of an in vitro contractility assay using canine ventricular myocytes. Toxicol Appl Pharmacol. 260 (2), 162-172 (2012).
- IonOptix LLC. . IonWizard 7.2 Acquisition. , (2017).
- IonOptix LLC. IonWizard 7.2 Core & Analysis Functions. IonOptix LLC. , (2017).
- Roe, M. W., Lemasters, J. J., Herman, B. Assessment of Fura-2 for measurements of cytosolic free calcium. Cell Calcium. 11 (2-3), 63-73 (1990).
- Zawieja, S. D., et al. Ano1 mediates pressure-sensitive contraction frequency changes in mouse lymphatic collecting vessels. J Gen Physiol. 151 (4), 532-554 (2019).
- Behringer, E. J., et al. Calcium and electrical dynamics in lymphatic endothelium. J Physiol. 595 (24), 7347-7368 (2017).
- Ferrusi, I., Zhao, J., van Helden, D., vonder Weid, P. Y. Cyclopiazonic acid decreases spontaneous transient depolarizations in guinea pig mesenteric lymphatic vessels in endothelium-dependent and -independent manners. Am J Physiol Heart Circ Physiol. 286 (6), H2287-H2295 (2004).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon