Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Mesures de microdureté sur les dents et l’os alvéolaire dans des modèles de maladies bucco-dentaires chez les rongeurs
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
La microdureté est une propriété mécanique et un paramètre informatif pour l’évaluation de la physiopathologie des tissus durs. Ici, nous démontrons un protocole standardisé (préparation d’échantillons, polissage, surface plane et sites d’indentation) pour l’analyse de la microdureté dans les dents et l’os alvéolaire dans des modèles de maladies bucco-dentaires de rongeurs, à savoir la fluorose dentaire et la résorption osseuse parodontale induite par la ligature.
Résumé
La propriété mécanique, la microdureté, est évaluée dans l’émail dentaire, la dentine et l’os dans des modèles de maladies bucco-dentaires, y compris la fluorose dentaire et la parodontite. La micro-tomodensitométrie (μCT) fournit des informations d’imagerie 3D (volume et densité minérale) et la microscopie électronique à balayage (MEB) produit des images de microstructure (prisme d’émail et os lacuna-canaliculaire). En complément de l’analyse structurelle par μCT et MEB, la microdureté est l’un des paramètres informatifs pour évaluer comment les changements structurels modifient les propriétés mécaniques. Bien qu’il s’agisse d’un paramètre utile, les études sur la microdureté de l’os alvéolaire dans les maladies bucco-dentaires sont limitées. À ce jour, des méthodes de mesure de microdureté divergentes ont été rapportées. Étant donné que les valeurs de microdureté varient en fonction de la préparation de l’échantillon (polissage et surface plane) et des sites d’indentation, divers protocoles peuvent entraîner des divergences entre les études. La normalisation du protocole de microdureté est essentielle pour une évaluation cohérente et précise dans les modèles de maladies buccales. Dans la présente étude, nous démontrons un protocole standardisé pour l’analyse de la microdureté dans les dents et l’os alvéolaire. Les échantillons utilisés sont les suivants : pour le modèle de fluorose dentaire, des incisives ont été prélevées sur des souris traitées avec ou sans eau contenant du fluorure pendant 6 semaines ; pour le modèle de résorption osseuse parodontale induite par la ligature (L-PBR), des os alvéolaires avec résorption osseuse parodontale ont été prélevés sur des souris ligaturées sur la 2emolaire maxillaire. 2 semaines après la ligature, le maxillaire a été prélevé. La dureté Vickers a été analysée dans ces éprouvettes selon le protocole normalisé. Le protocole fournit des matériaux et des méthodes détaillés pour l’incorporation de résine, le polissage en série et les sites d’indentation des incisives et des alvéolaires. À notre connaissance, il s’agit du premier protocole de microdureté standardisé permettant d’évaluer les propriétés mécaniques des dents et de l’os alvéolaire dans des modèles de maladies bucco-dentaires chez les rongeurs.
Introduction
La dureté est l’une des propriétés mécaniques (par exemple, l’élasticité, la dureté, la viscoélasticité et le comportement à la rupture) et est couramment utilisée pour caractériser la capacité à résister à la déformation par compression et à la rupture d’une zone locale d’un matériau. L’essai de dureté par indentation statique est la méthode la plus utilisée, y compris la dureté Vickers et la dureté Knoop1. L’essai de dureté Vickers est réalisé en pressant un pénétrateur diamanté dans la surface sous une charge d’essai fixe. Le pénétrateur est de forme pyramidale, avec une base carrée et un angle de 136° entre les faces opposées. La longueur des deux diagonales formées sur la surface d’essai est mesurée et la moyenne est utilisée pour calculer la dureté, qui est déterminée par le rapport F/A (où F est la force et A est la surface de l’indentation). L’indice de microdureté Vickers (HV=F/A) est généralement exprimé en kilogrammes-force (kgf) par mm2 d’indentation, avec 1 HV ≈ 0,1891 F/d2 (N/mm2). La dureté Knoop se compose également d’un pénétrateur pyramidal carré en diamant formé de deux angles opposés inégaux. L’indice de dureté Knoop (HK) est égal au rapport entre la charge appliquée et la surface de contact projetée. Les essais de dureté sont classés en essais de micro-indentation (microdureté) et en essais de macro-indentation, en fonction de la force appliquée au matériau d’essai. Les essais de micro-indentation utilisent généralement des charges comprises entre 0,01 et 2 N (environ 1 à 203 gf) ; pendant ce temps, les tests de macro-indentation utilisent plus de 10 N (10119 gf)1.
Pour évaluer les caractéristiques des tissus durs dentaires dans les maladies bucco-dentaires, y compris les dents et l’os alvéolaire, la micro-TDM (μCT) et la microscopie électronique à balayage (MEB) sont utilisées pour l’analyse structurelle. La tomodensitométrie fournit des informations d’imagerie 3D (volume et densité minérale)2, et la MEB produit des images de microstructure (prisme d’émail et os lacuna-canaliculaire)3. En complément de l’analyse structurale par μCT et MEB, la microdureté est l’un des paramètres informatifs pour évaluer comment les changements structurels modifient les propriétés mécaniques de la dent et de l’os alvéolaire dans les maladies bucco-dentaires, par exemple, la malformation de l’émail et la résorption osseuse parodontale. La valeur de microdureté Vickers de l’émail humain (HV = 283-374) est environ 4 à 5 fois supérieure à celle de la dentine (HV = 53-63)4,5. Dans les modèles de fluorose dentaire de rongeur, la microdureté de l’émail diminue significativement dans les incisives de souris traitées au fluorure (HV = 136) par rapport à l’émail témoin (HV = 334)6,7. Cela suggère que l’émail fluorosé est plus doux et plus faible, avec une teneur en minéraux plus faible et une teneur en protéines plus élevée que celle trouvée dans l’émail non fluorosé. La microdureté est utilisée pour évaluer les propriétés mécaniques osseuses. Plusieurs études antérieures ont examiné le comportement mécanique de l’os humain à partir de différents sites anatomiques, y compris la microdureté de l’os long 8,9,10. La microdureté moyenne des fémurs fluorés humains a montré une diminution significative (HV = 222,4) par rapport aux fémurs non fluorés (HV = 294,4)11. Bien qu’il s’agisse d’un paramètre utile, il existe une rareté de la littérature décrivant la microdureté (soit Vickers12 ou Knoop 13,14) de l’os alvéolaire dans les maladies bucco-dentaires.
À ce jour, des méthodes de mesure de microdureté divergentes ont été rapportées. Étant donné que les valeurs de microdureté varient de15 en fonction de la préparation de l’échantillon (polissage et surface plane) et du site d’indentation, divers protocoles peuvent entraîner des divergences entre les études. La normalisation du protocole d’essai de microdureté est essentielle pour une évaluation cohérente et précise dans les modèles de maladies buccales. Dans la présente étude, nous démontrons un protocole standardisé pour l’analyse de la microdureté dans la dent et l’os alvéolaire dans un modèle de fluorose dentaire de souris et un modèle de résorption osseuse parodontale.
Protocole
Toutes les procédures décrites dans ce protocole ont été exécutées conformément aux lignes directrices et aux règlements pour l’utilisation des animaux vertébrés approuvés par l’Institutional Animal Care Use Committee (IACUC) de l’Université Augusta et de la Nova Southeastern University, qui est accréditée par l’Association for Assessment and Accreditation of Laboratory Animal Care International (AAALAC). Il est à noter que le Dr Suzuki était employé par l’Université Augusta, où les expériences sur la fluorose dentaire de souris ont été réalisées.
1. Extraction d’incisives mandibulaires dans un modèle de fluorose dentaire de souris
- Donner des régimes sans fluorure aux souris C57BL/6 (mâles de 5 semaines) à partir de 1 semaine avant le fluorure jusqu’à la fin du traitement au fluorure.
- Préparez de l’eau fluorée en ajoutant du NaF dans de l’eau distillée, puis une filtration sous vide à l’aide d’un filtre de 0,2 μm. Donnez aux animaux de l’eau fluorée sous forme de NaF (0 ppm et 125 ppm ; N=5/groupe) à volonté pendant 6 semaines. Remplacez l’eau fluorée par un lot fraîchement préparé tous les 2 jours.
- Après 6 semaines de traitement de l’eau au fluorure, euthanasier les animaux avec duCO2 suivi de la décapitation.
- Extrayez l’hémisphère mandibulaire avec incisive de chaque souris. Pour recueillir l’hémisphère mandibulaire avec incisive, coupez les muscles autour de la mâchoire mandibulaire sans appliquer de force excessive.
- Placez l’hémi-mandibulaire dans du PBS et maintenez-le à 4 °C jusqu’à l’analyse μ-CT (facultatif). Séparez l’incisive de la mandibulaire à l’aide d’un scalpel (#15) et de ciseaux sans endommager ni casser l’échantillon.
- Lavez l’incisive isolée avec du PBS et effectuez la déshydratation en l’immergeant dans une force d’alcool croissante (70% et 100% d’éthanol) pendant 2-3 h.
REMARQUE : Si le tissu (p. ex., la pulpe) n’est pas suffisamment déshydraté, l’imprégnation de la résine risque d’être inhibée et l’évaluation subséquente sera probablement inadéquate. - Après déshydratation à l’éthanol, enfoncez l’incisive horizontalement dans la résine. Passez à l’étape 3.
2. Extraction d’os alvéolaires maxillaires dans un modèle de résorption osseuse parodontale induite par la ligature de souris (L-PBR)
- Administrer 0,8 mL de kétamine (100 mg/mL) + 0,1 mL de xylazine (100 mg/mL) + 9,1 mL de PBS par voie intrapéritonéale (i.p.) à une souris (C57BL/6, âgée de 8 à 12 semaines, mâle) comme anesthésique. La posologie est de 0,01 mL/g (poids). Appliquez une pommade ophtalmique sur les deux yeux pour prévenir la sécheresse sous anesthésie.
- Placez la souris anesthésiée sur un coussin chauffant pendant 5 à 10 min. Évaluez les réponses aux pincements de la queue ou des orteils et l’intégrité du réflexe oculaire. Confirmez que la souris ne répond pas aux stimuli nocifs et que le réflexe est absent.
- Placez la souris sur la table de traitement et maintenez la bouche ouverte à l’aide d’une suture en soie ligature 5-0 attachée à un poteau magnétique sur la table de traitement.
- Sous un microscope chirurgical, enroulez la ligature (suture en soie tressée 6-0) autour d’un côté de la deuxième molaire maxillaire (simple couche) à l’aide de micro-porte-aiguilles. Minimisez les différences individuelles dans l’analyse en utilisant un côté comme côté traitement et l’autre côté comme témoin.
- Faites la ligature et faites un nœud côté palais. Après avoir fait un nœud, coupez la ligature restante aussi courte que possible afin que la ligature excessive n’interfère pas avec la mastication ou l’alimentation. Ceci est important pour s’assurer que la ligature ne se desserrera pas en mâchant pendant la période d’observation suivante.
REMARQUE : Ne laissez pas l’animal sans surveillance jusqu’à ce qu’il ait repris une conscience suffisante pour maintenir la décubitus sternal. Ne retournez pas l’animal qui a subi une intervention chirurgicale en compagnie d’autres animaux avant qu’il ne soit complètement rétabli. Maintenir des conditions stériles pendant la survie. - Donnez de l’engrais et de l’eau aux souris à volonté pendant 2 semaines. Après 2 semaines de ligature, euthanasier les souris avec du CO2 suivi de la décapitation.
- Extrayez les deux maxillaires latéraux (côté ligature et côté contrôle) avec les molaires de chaque souris. Pour prélever des maxillaires avec des molaires, coupez les muscles et l’os autour de la mâchoire maxillaire à l’aide de ciseaux sans appliquer de force excessive. Placez chaque maxillaire dans du PBS et maintenez-le à 4 °C jusqu’à l’analyse par tomodensitométrie (facultatif).
- Séparez l’os alvéolaire avec les molaires (1ère à 3ème) du maxillaire à l’aide d’un scalpel (#15) et de ciseaux sans endommager ni casser l’échantillon.
- Lavez l’os alvéolaire isolé avec du PBS puis déshydratez et dégraissez par immersion dans une force d’alcool croissante (70% et 100% d’éthanol) pendant 2-3 h.
REMARQUE : Si les tissus (p. ex., la pulpe et l’os) ne sont pas suffisamment déshydratés, l’imprégnation de la résine risque d’être inhibée et l’évaluation subséquente sera probablement inadéquate. - Après déshydratation à l’éthanol, encastrer l’os alvéolaire horizontalement dans la résine. Passez à l’étape 3.
- Facultatif : Effectuez l’évaluation μCT avant le test de microdureté.
- Avant l’essai de microdureté, effectuez une analyse structurelle non destructive (par exemple, μCT) en utilisant le même échantillon pour l’essai de microdureté à titre d’évaluation complémentaire (Figure 1). Les informations structurelles (image 3D, densité minérale, volume) par tomodensitométrie pourraient permettre d’évaluer les propriétés mécaniques et la qualité de l’échantillon susceptibles d’affecter les résultats de microdureté.
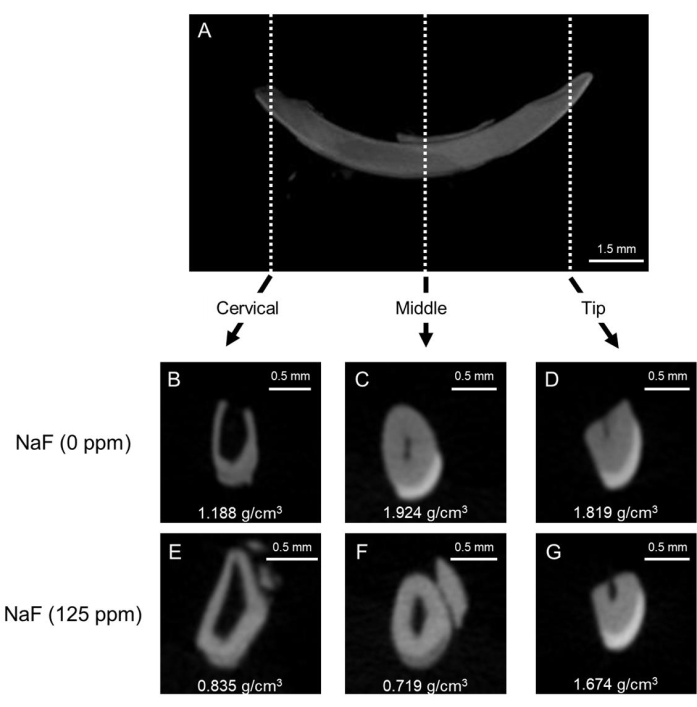
Figure 1 : Images μCT représentatives de l’émail dans les incisives de souris témoins et traitées au fluorure. (A) Image sagittale représentative de la μCT de l’incisive mandibulaire. (B-D) Images coronales μCT de l’incisive témoin (NaF 0 ppm). (E-G) Images coronales μCT d’incisives traitées avec NaF (125 ppm). La densité minérale représentative de l’émail (DME) est indiquée (g/cm3). Veuillez cliquer ici pour voir une version agrandie de cette figure.
3. Enrobage d’échantillons dans de la résine
- Continuez à partir de l’étape 1.7 (modèle de fluorose dentaire) ou de l’étape 2.10 (modèle L-PBR).
- Enduisez la surface intérieure de la coupelle de montage (1 pouce) d’une fine couche de vaseline. Mélanger la résine (résine d’enrobage à froid) selon les instructions. Versez la résine et le durcisseur dans le gobelet en plastique fourni dans un rapport de volume de 15:2 et mélangez soigneusement avec une spatule en bois pendant au moins 2 min. Évitez les bulles d’air.
- Placez l’incisive déshydratée et dégraissée (figure 2A) ou l’os alvéolaire avec les molaires (figure 2B) orientés horizontalement et parallèlement au bas de la coupelle de montage (1 échantillon par ventouse).
- Versez la résine mélangée (juste assez de résine, environ 1,5 ml) dans la coupelle de montage pour couvrir complètement l’échantillon. Évitez d’ajouter plus de résine que nécessaire, car un excès de résine entravera le processus de polissage (Figure 2C,D). Placez la coupelle de montage contenant l’échantillon sur une plaque chauffante à 50 °C pendant au moins 8 h pour favoriser la polymérisation de la résine. Cette procédure contribue à maintenir l’échantillon dans une position stable.
REMARQUE : En fonction de la taille de l’échantillon, ajustez la quantité de résine pour recouvrir complètement l’échantillon. Ne remplissez pas trop de résine, sinon il faudra plus de temps pour éliminer la résine superflue. - Après le durcissement, retirez la résine contenant l’échantillon de la coupelle de montage. Enlevez les bavures et disposez le rabot de l’échantillon et le plan latéral opposé de manière à ce qu’ils soient parallèles et plats à l’aide d’une meuleuse-polisseuse avancée avec du papier abrasif rugueux résistant à l’eau (grain 60/P60 et 120/P120) sous l’inondation par l’eau. Maintenir la hauteur de l’échantillon à environ 3 mm pour les incisives et l’os alvéolaire (Figure 2E, F).
REMARQUE : Lorsque l’échantillon est analysé par MEB après la mesure de la microdureté, l’épaisseur de l’échantillon doit être d’environ 3 mm afin que l’observation ultérieure du MEB ne soit pas affectée. Les échantillons plus petits sont plus difficiles à manipuler avec le broyeur. Pour les échantillons destinés à la microdureté uniquement, la hauteur de l’échantillon peut augmenter jusqu’à environ 10-20 mm. - Coupez la forme externe pour obtenir un bloc de résine solide rectangulaire et des coins arrondis (environ 30 mm de largeur, 10 mm de longueur pour l’incisive (figure 2G) et 10 mm de largeur, 5 mm de longueur pour l’os alvéolaire (figure 2H)) à l’aide d’une scie à tronçonner de précision.
- Une fois la correction de forme rugueuse terminée, retirez les débris et les particules du bloc de résine à l’aide d’un nettoyeur à ultrasons (environ 1 min). Passez à l’étape 4.

Figure 2 : Écoulement de la procédure d’enrobage et de polissage de la résine. (A) Incisive déshydratée et dégraissée. (B) Os alvéolaire déshydraté et dégraissé dans le L-PBR. (C, D) Incisives et os alvéolaires immergés dans la résine. (E, F) En coupant la résine, il est plus facile de polir la surface du tissu cible. (G, H) Coins en résine arrondis pour le processus de polissage. Abréviations : L-PBR = résorption osseuse parodontale induite par la ligature. Veuillez cliquer ici pour voir une version agrandie de cette figure.
4. Polissage des éprouvettes
REMARQUE : Le polissage des échantillons est effectué manuellement à l’aide de papiers abrasifs imperméables (de rugueux à plus fin) sur une meuleuse-polisseuse avancée sous inondation d’eau.
- Placez un papier abrasif rugueux résistant à l’eau (grain 600/P1200) sur la meuleuse. Placez le bloc de résine coupé et nettoyé (à partir de l’étape 3.7) sur le papier abrasif rugueux résistant à l’eau.
- Pendant que vous versez de l’eau, tenez le bloc de résine et polissez la surface d’évaluation de l’échantillon sur la meuleuse-polisseuse (vitesse 1-10 x g). À ce moment, veillez à tenir le bloc de résine de manière à ce que la surface d’évaluation soit parallèle au sol. Pour garder la surface d’évaluation intacte, vérifiez-la à l’œil nu ou au microscope.
REMARQUE : Notez que le moulin tourne dans le sens des aiguilles d’une montre et qu’une pression uniforme peut conduire à une surface non parallèle. Pour obtenir une surface parallèle, maintenez la vitesse de rotation de l’aile constante et appuyez soigneusement sur l’échantillon pendant quelques secondes, puis tournez l’échantillon de 180° pour appuyer pendant le même laps de temps. Le papier abrasif rugueux peut enlever non seulement la résine, mais également l’échantillon. - Remplacez le papier abrasif par le Grit 800/P2400 et placez le bloc de résine dessus. Répétez l’étape 4.2.
- Retirez les débris et les particules du bloc de résine à l’aide d’un nettoyeur à ultrasons (environ 1 min).
REMARQUE : Avant de continuer, il est recommandé d’utiliser un nettoyeur à ultrasons pour enlever tous les débris de surface afin d’éviter le colmatage. - Ensuite, effectuez un polissage en série à l’aide de papiers abrasifs plus fins ; L’ordre de polissage est de 12 μm, 9 μm, 3 μm, 1 μm et 0,3 μm.
- Placez un film de rodage (12 μm) sur la table de la meuleuse-polisseuse sans rotation et placez le bloc de résine sur le film de rodage.
REMARQUE : Dans cette expérience, la table de broyage est adaptée pour obtenir une condition de surface plane sous inondation d’eau. Alternativement, un grand miroir plan (ou similaire) qui fournit un parallélisme peut également être utilisé. - Sous le refroidissement à l’eau, polissez soigneusement à la main la surface d’évaluation de l’échantillon sur le film de rodage. Déplacez l’échantillon verticalement, horizontalement et en diagonale pendant le même nombre de secondes sous injection d’eau avec des mouvements de 2 à 3 cm (1 pouce). Lorsque la procédure de polissage est correctement réalisée, l’échantillon de résine se colle au film de rodage.
- Retirez les débris et les particules comme à l’étape 4.4. Changez le papier abrasif à la taille suivante selon l’ordre de polissage en série (de 12 μm à 0,3 μm) et placez le bloc de résine dessus.
- Pendant que vous versez de l’eau, tenez le bloc de résine et polissez soigneusement la surface de l’échantillon sur le film de rodage à la main. Retirez les débris et les particules comme à l’étape 4.4.
- Répétez les étapes 4,5 à 4,8 pour terminer le polissage final (0,3 μm). Une fois le polissage final terminé (0,3 μm), l’échantillon doit avoir une surface de finition miroir (Figure 3A).
- Nettoyez la surface de l’échantillon avec de l’éthanol (100%) pour dégraisser et déshydrater et stockez les blocs de résine à température ambiante jusqu’au test de microdureté. Pendant le stockage, évitez l’humidité et la poussière excessives. Passez à l’étape 5.
5. Test de microdureté Vickers
REMARQUE : L’indentation d’un échantillon de surface au fini miroir est effectuée à l’aide d’un testeur de microdureté. L’essai est effectué avec une charge de 25 g pendant 10 s avec une pointe Vickers.
- Test de microdureté Vickers pour incisives (modèle de fluorose dentaire)
REMARQUE : L’émail peut être divisé en trois couches de l’extérieur (côté de la cavité buccale) vers l’intérieur (côté pulpe) ; à savoir, la couche superficielle, la couche intermédiaire et la couche profonde (jonction dentine-émail, DEJ) (Figure 3B)16. Dans ce protocole, trois couches d’émail sont testées.- Réglez la force de charge sur 25 g et la durée de charge sur 10 s. Placez le bloc de résine sur la scène.
- Retrait de 6 points dans chaque couche d’émail (superficielle, moyenne et DEJ) et de dentine dans chaque région (cervicale, moyenne et pointe ; Figure 3B).
- Mesurez la longueur des deux diagonales (d1 et d2 ; Graphique 3B) pour calculer la valeur de microdureté Vickers (HV ; Figure 4).
- Test de microdureté Vickers pour l’os alvéolaire (modèle L-PBR)
- Réglez la force de charge sur 25 g et la durée de charge sur 10 s. Placez le bloc de résine sur la scène.
- Retrait de 3 à 6 points dans chaque face mésiale et distale de l’os alvéolaire à partir de la crête alvéolaire. Os alvéolaires indentés entre la 1èreet la 2èmemolaire (carré blanc), et les 2ème et 3èmemolaire .
REMARQUE : Dans ce protocole, 6 points de chaque côté mésial et distal (total de 12 points) ont été évalués pour l’os témoin (intact), et 3 points de chaque côté (total de 6 points) ont été évalués pour le L-PBR. Le nombre de points d’indentation dépend de l’état de la lésion (par exemple, une perte osseuse trop importante limite la zone d’indentation).
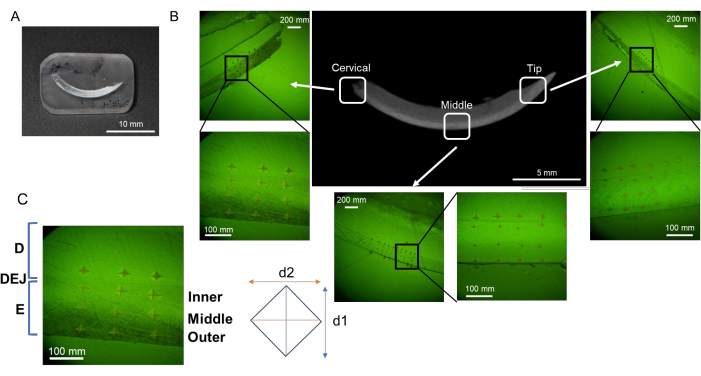
Figure 3 : Régions d’évaluation de la microdureté dans l’incisive mandibulaire. (A) Échantillon de surface au fini miroir contenant l’incisive mandibulaire. (B) Indentations dans chaque région ; cervicale, médiane et pointe (NaF 0 ppm). (C) Trois couches d’émail ; de DEJ, émail intérieur, moyen et extérieur. Abréviations : D = dentine, E = émail, DEJ = jonction dentinaire-émail Veuillez cliquer ici pour voir une version agrandie de cette figure.
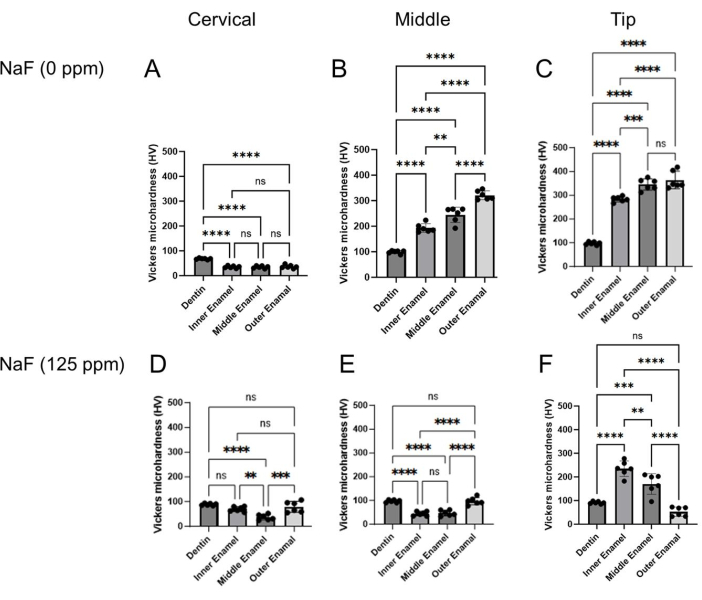
Figure 4 : Microdureté Vickers d’un émail traité avec ou sans NaF. La microdureté de la dentine et de trois couches d’émail a été évaluée dans chaque région, cervicale, moyenne et pointe. (A-C) Contrôle et traitement (D-F) NaF (125 ppm). Les données sont présentées sous forme de moyenne ± écart-type. Les différences significatives ont été évaluées par ANOVA à un facteur avec le test post-hoc de Tukey. Les valeurs p < 0,05 ont été considérées comme statistiquement significatives. **p < 0,005, ***p < 0,0005, ****p < 0,0001 Veuillez cliquer ici pour voir une version agrandie de ce chiffre.
Résultats
Modèle de fluorose dentaire : La figure 1 montre des images μCT représentatives des incisives chez les souris témoins et traitées au fluorure. Chez le témoin (figure 1B-D), la région cervicale présentait une densité minérale de l’émail (DME) inférieure de 1,188 g/cm3 (figure 1B) par rapport au milieu (1,924 g/cm3) et à la pointe (1,819 g/cm3 ; Figu...
Discussion
La microdureté est réalisée pour évaluer les propriétés mécaniques des tissus durs comme les dents et les os. À ce jour, des méthodes de mesure de microdureté divergentes ont été rapportées. La plupart des informations de mesure, en particulier les préparations d’échantillons et les sites d’indentation, sont probablement insuffisantes. Cette étude s’est concentrée sur le protocole de microdureté de l’émail et de l’os alvéolaire dans des modèles de fluorose dentaire et de maladies parodontal...
Déclarations de divulgation
Les auteurs ne déclarent aucun conflit d’intérêts.
Remerciements
Les recherches dont il est rendu compte dans cette publication ont été soutenues par JSPS KAKENHI JP21K09915 (MO) et l’Institut national des sciences médicales générales ; T34GM145509 (MM) et l’Institut national de recherches dentaires et craniofaciales ; R01DE025255 et R21DE032156 (XH) ; R01DE029709, R21DE028715 et R15DE027851 (TK) ; R01DE027648 et K02DE029531 (MS).
matériels
| Name | Company | Catalog Number | Comments |
| Braided Silk Suture 6-0 | Teleflex | ||
| Canica Small Animal Surgery System | Kent Scientific Corporation | SURGI 5001 | |
| CarbiMet PSA 120/P120 | Buehler | 30080120 | |
| CarbiMet PSA 60/P60 | Buehler | 36080060 | |
| CarbiMet PSA 600/P1200 | Buehler | 36080600 | |
| Castroviejo Micro Needle hilder | F.S.T | 12060-01 | |
| Epofix cold setting embeding Resin | Electron Microscopey Science | CAT-1237 | |
| Fisherbrand 112xx Series Advanced Ultrasonic Cleaner | Fisher Brand | FB11201 | |
| Fluoride-free Rodent diet | Bio Serv | F1515 | AIN-76A, 1/2" Pellets |
| in-vivo microCT Skyscan 1176 | Bruker | ||
| Isomet 1000 Precison saw | Buehler | MA112180 | |
| Lapping film 0.3µm | Maruto instrument co, LTD. Japan | 26-4203 | Alternative A3-0.3 SHT, 3M USA |
| Lapping film 1µm | Maruto instrument co, LTD. Japan | 26-4206 | Alternative A3-1 SHT, 3M USA |
| Lapping film 12µm | Maruto instrument co, LTD. Japan | 26-4211 | Alternative A3-12 SHT, 3M USA |
| Lapping film 3µm | Maruto instrument co, LTD. Japan | 26-4204 | Alternative A3-3 SHT, 3M USA |
| Lapping film 9µm | Maruto instrument co, LTD. Japan | 26-4201 | Alternative A3-9 SHT, 3M USA |
| Leica wild microscope | Leica | LEIC M690 | |
| Metaserv 2000 Variable speed Grinder polisher | Buehler | No: 557-MG1-1160 | |
| MicroCut PSA 1200/P2500 | Buehler | 36081200 | |
| MicroCut PSA P4000 | Buehler | 36084000 | |
| Microhardness tester, ALPHA-MHT-1000Z | PACE Technologies | ||
| SamplKups 1 inch | Buehler | No: 209178 | |
| Sodium Fluoride | Fisher Scientific | S299-100 | |
| West cott Stitch Scissor | JEDMED | Cat. #25-1180 | |
| ZooMed Repti Thern Undertank heater (U.T.H) | Zoo Med Laboratories, Inc. | RH-4 |
Références
- Broitman, E. Indentation hardness measurements at macro-, micro-, and nanoscale: A critical overview. Tribol Lett. 65 (1), 23 (2017).
- Lee, M. J., et al. Sirt6 activation ameliorates inflammatory bone loss in ligature-induced periodontitis in mice. Int J Mol Sci. 24 (13), 10714 (2023).
- Min, J., et al. Investigation on the gradient nanomechanical behavior of dental fluorosis enamel. Nanoscale Res Lett. 13 (1), 347 (2018).
- Craig, R. G., Peyton, F. A. The micro-hardness of enamel and dentin. J Dent Res. 37 (4), 661-668 (1958).
- Chun, K., Choi, H., Lee, J. Comparison of mechanical property and role between enamel and dentin in the human teeth. J Dent Biomech. 5, (2014).
- Suzuki, M., Everett, E. T., Whitford, G. M., Bartlett, J. D. 4-phenylbutyrate mitigates fluoride-induced cytotoxicity in alc cells. Front Physiol. 8, 302 (2017).
- Sharma, R., et al. Assessment of dental fluorosis in mmp20 +/- mice. J Dent Res. 90 (6), 788-792 (2011).
- Wu, W. W., et al. Bone hardness of different anatomical regions of human radius and its impact on the pullout strength of screws. Orthop Surg. 11 (2), 270-276 (2019).
- Li, S., et al. Atlas of human skeleton hardness obtained using the micro-indentation technique. Orthop Surg. 13 (4), 1417-1422 (2021).
- Ibrahim, A., et al. Hardness an important indicator of bone quality, and the role of collagen in bone hardness. J Funct Biomater. 11 (4), 85 (2020).
- Vandana, K. L., Srishti Raj, B., Desai, R. Dental fluorosis and periodontium: An original research report of in vitro and in vivo institutional studies. Biol Trace Elem Res. 199 (10), 3579-3592 (2021).
- Xia, P. F., et al. Microcarriers containing "hypoxia-engine" for simultaneous enhanced osteogenesis and angiogenesis. Chemical Engineering Journal. 456, 141014 (2023).
- Chiu, R., et al. Effects of biglycan on physico-chemical properties of ligament-mineralized tissue attachment sites. Arch Oral Biol. 57 (2), 177-187 (2012).
- Leong, N. L., et al. Age-related adaptation of bone-pdl-tooth complex: Rattus-norvegicus as a model system. PLoS One. 7 (4), e35980 (2012).
- Johnson, W. M., Rapoff, A. J. Microindentation in bone: Hardness variation with five independent variables. J Mater Sci Mater Med. 18 (4), 591-597 (2007).
- Kweon, Y. S., et al. Effects of fam83h overexpression on enamel and dentine formation. Arch Oral Biol. 58 (9), 1148-1154 (2013).
- Boivin, G., et al. The role of mineralization and organic matrix in the microhardness of bone tissue from controls and osteoporotic patients. Bone. 43 (3), 532-538 (2008).
- Okamoto, M., et al. Microstructural evaluation of the mineralized apical barrier induced by a calcium hydroxide paste containing iodoform: A case report. J Endod. 2 (2), 243-251 (2024).
- Wang, Y., et al. B10 cells alleviate periodontal bone loss in experimental periodontitis. Infect Immun. 85 (9), e00335 (2017).
- Chen, Y., et al. Nlrp3 regulates alveolar bone loss in ligature-induced periodontitis by promoting osteoclastic differentiation. Cell Prolif. 54 (2), e12973 (2021).
- Robinson, J. W., et al. Male mice with elevated c-type natriuretic peptide-dependent guanylyl cyclase-b activity have increased osteoblasts, bone mass and bone strength. Bone. 135, 115320 (2020).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon