Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Modèle d’intestin sur puce immunocompétent pour l’analyse des réponses immunitaires de la muqueuse intestinale
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Notre protocole détaillé décrit la création et l’utilisation du modèle avancé d’intestin sur puce, qui simule la muqueuse intestinale humaine avec des structures 3D et divers types de cellules, permettant une analyse approfondie des réponses immunitaires et des fonctions cellulaires en réponse à la colonisation microbienne.
Résumé
Un modèle avancé d’intestin sur puce recréant des structures épithéliales organotypiques 3D semblables à des villosités et à des cryptes a été développé. Le modèle immunocompétent comprend des cellules endothéliales de la veine ombilicale humaine (HUVEC), des cellules épithéliales intestinales Caco-2, des macrophages résidant dans les tissus et des cellules dendritiques, qui s’auto-organisent au sein du tissu, reflétant les caractéristiques de la muqueuse intestinale humaine. Un aspect unique de cette plateforme est sa capacité à intégrer les cellules immunitaires primaires humaines circulantes, améliorant ainsi la pertinence physiologique. Le modèle est conçu pour étudier la réponse du système immunitaire intestinal à la colonisation et à l’infection bactériennes et fongiques. En raison de la taille de sa cavité élargie, le modèle offre diverses lectures fonctionnelles telles que les tests de perméation, la libération de cytokines et l’infiltration des cellules immunitaires, et est compatible avec la mesure par immunofluorescence des structures 3D formées par la couche de cellules épithéliales. Il fournit ainsi des informations complètes sur la différenciation et la fonction cellulaires. La plateforme d’intestin sur puce a démontré son potentiel dans l’élucidation d’interactions complexes entre les substituts d’un microbiote vivant et le tissu de l’hôte humain au sein d’une plateforme de biopuce perfusée microphysiologique.
Introduction
Les systèmes d’organes sur puce (OoC) représentent une technique émergente de culture cellulaire 3D capable de combler le fossé entre la culture cellulaire 2D conventionnelle et les modèles animaux. Les plateformes OoC se composent généralement d’un ou plusieurs compartiments contenant des cellules spécifiques aux tissus cultivées sur une large gamme d’échafaudages tels que des membranes ou des hydrogels1. Les modèles sont capables d’imiter une ou plusieurs fonctions organotypiques définies. Les pompes permettent la perfusion microfluidique continue de milieux de culture cellulaire pour l’élimination des déchets cellulaires, l’alimentation en facteurs de nutrition et de croissance pour une meilleure différenciation cellulaire et la recréation de conditions in vivo essentielles. Grâce à l’intégration des cellules immunitaires, les systèmes OoC peuvent imiter la réponse immunitaire humaine in vitro2. À ce jour, un large éventail d’organes et d’unités fonctionnelles ont été présentés1. Ces systèmes comprennent des modèles du système vasculaire3, du poumon4, du foie 2,5 et de l’intestin6 qui peuvent être facilités pour les tests de dépistage de drogues 5,7 et les études d’infection 6,8.
Nous présentons ici un modèle d’intestin humain sur puce intégrant des cellules épithéliales humaines formant une topographie 3D organotypique de structures ressemblant à des villosités et à des cryptes combinées à une muqueuse endothéliale et à des macrophages résidant dans les tissus. Le modèle est cultivé dans une biopuce perfusée de manière microfluidique sous la forme d’une lame microscopique. Chaque biopuce se compose de deux cavités microfluidiques distinctes. Chaque cavité est divisée par une membrane poreuse en polyéthylène téréphtalate (PET) en une chambre supérieure et une chambre inférieure. La membrane elle-même sert également d’échafaudage pour que les cellules se développent de chaque côté. Les pores de la membrane permettent la diaphonie cellulaire et la migration cellulaire entre les couches cellulaires. Chaque chambre est accessible par deux orifices femelles de la taille d’un Luer Lock. En option, un orifice supplémentaire de la taille d’un mini-luer peut permettre d’accéder à la chambre supérieure ou inférieure (Figure 1).
La plate-forme OoC offre un certain nombre de lectures qui peuvent être obtenues à partir d’une seule expérience. L’intestin sur puce est conçu pour combiner la culture cellulaire 3D perfusée, l’analyse des effluents et la microscopie à fluorescence pour évaluer l’expression des marqueurs cellulaires, les taux de métabolisation, la réponse immunitaire, la colonisation et l’infection microbiennes, et la fonction barrière 3,6,8. Le modèle comprend des cellules immunitaires résidentes des tissus et un contact direct de micro-organismes vivants avec le tissu hôte, ce qui est un avantage par rapport aux autres modèles publiés9. De plus, les cellules épithéliales s’auto-organisent en structures tridimensionnelles qui fournissent une interface physiologiquement pertinente pour la colonisation avec un microbiote vivant6.
Access restricted. Please log in or start a trial to view this content.
Protocole
Ce protocole exige l’accès à ~20 ml de sang frais par biopuce provenant de donneurs sains afin d’isoler les monocytes humains primaires. Tous les donateurs ont donné leur consentement écrit et éclairé pour participer à cette étude, qui a été approuvée par le comité d’éthique de l’hôpital universitaire d’Iéna (numéro d’autorisation 2018-1052-BO). Pour plus de détails sur les matériaux, reportez-vous à la Table des matériaux. Pour plus de détails sur la composition de toutes les solutions et de tous les milieux, reportez-vous au tableau 1.
1. Remarques générales sur la manipulation des biopuces
- Séparez soigneusement une bande de réservoirs et détachez les couvercles à l’aide d’un couteau chauffé pour obtenir des réservoirs et des couvercles uniques. Élargissez le trou du couvercle pour que le tube en silicone soit bien ajusté.
- Le tube en silicone a un diamètre intérieur de 0,5 mm, est asymétrique et est séparé en côtés plus longs (20 cm) et plus courts (12 cm) par deux bouchons de pompe péristaltiques. Assemblez deux tubes de chaque symétrie par biopuce en fixant un tube à un connecteur Luer Lock mâle et le couvercle sur le côté opposé du tube. Assemblez également quatre réservoirs par biopuce.
REMARQUE : Préparez les tubes et les réservoirs à l’avance et stérilisez-les à l’autoclave avant utilisation. Comme le tube en silicone a une durée de vie limitée, remplacez-le après 3 à 5 expériences. Pour certains intérêts de recherche, tels que les tests de drogues, il est conseillé de préparer de nouveaux tubes pour chaque expérience. De nombreuses étapes de ce protocole se déroulent en parallèle ; reportez-vous à la figure d’ensemble, qui met en évidence les différentes étapes effectuées au cours d’une même journée, comme le montre la figure 2.
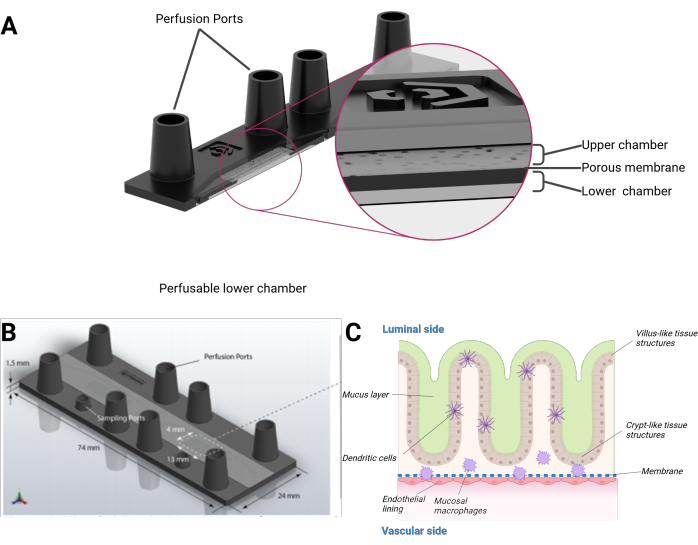
Figure 1 : Représentation schématique d’un modèle d’intestin sur puce. (A) La biopuce est présentée en coupe transversale. (B) La dimension de l’ensemble de la biopuce ainsi que de la membrane PET plate et amovible est visible. Le volume total de la chambre supérieure, y compris les orifices femelles de la taille d’un Luer Lock, est de 290 μL et de 270 μL pour la chambre inférieure, respectivement. (C) Une composition schématique de la biopuce intestinale, de l’épithélium de croissance tridimensionnel ressemblant à des villosités et à des structures cryptiques, y compris des cellules immunitaires différenciées et une couche de mucus, peut être observée. L’autre côté de la membrane PET est recouvert d’une monocouche endothéliale. Veuillez cliquer ici pour voir une version agrandie de cette figure.
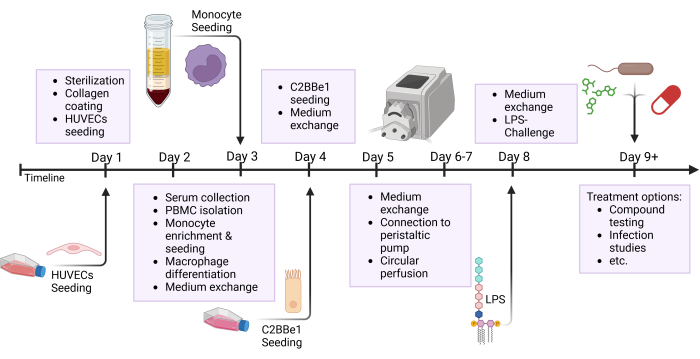
Figure 2 : Vue d’ensemble schématique de la chronologie de construction du modèle et de la configuration expérimentale. Cette figure montre la vue d’ensemble schématique du protocole présenté. Les procédures importantes, telles que l’ensemencement des cellules et le défi épithélial avec le LPS, sont indiquées par des flèches. Abréviations : HUVECs = cellules endothéliales veineuses ombilicales humaines ; LPS = lipopolysaccharide. Veuillez cliquer ici pour voir une version agrandie de cette figure.
2. Stérilisation par biopuce
- Remplissez une boîte de Pétri en verre stérile d’un diamètre de 15 cm avec 70 % d’éthanol non dénaturé. Placez la biopuce à l’intérieur de manière à ce que tous les ports de la biopuce soient complètement recouverts par la solution d’éthanol.
- Deux fois par orifice, tirez 1 ml d’éthanol à 70 % à travers toutes les chambres de la puce. Incuber pendant 45-60 min à température ambiante (RT).
REMARQUE : Assurez-vous qu’aucun air n’est emprisonné à l’intérieur de la biopuce. À partir de ce moment, aucun air ne doit pénétrer dans le système de biopuce et les cavités doivent rester remplies de liquide. - Retirez l’éthanol dans la boîte de Pétri et remplacez-le par de l’eau stérile bidistillée (ddH2O) jusqu’à ce que tous les ports soient complètement couverts. Encore une fois, deux fois par port, aspirez 1 mL de ddH2O à travers la cavité de la biopuce. Rafraîchissez le ddH2O dans la boîte de Pétri et répétez la procédure.
- Retirez tout le liquide de la boîte de Pétri. Par la suite, conservez les biopuces entièrement stérilisées à l’intérieur de la boîte de Pétri fermée chaque fois qu’elles se trouvent à l’extérieur d’un environnement stérile. Ajoutez un petit réservoir (p. ex., le couvercle d’un tube de 50 ml) de 2 à 5 mL de ddH2O dans la boîte de Pétri pour réduire l’évaporation du liquide à l’intérieur de la biopuce.
REMARQUE : Les biopuces peuvent être stérilisées jusqu’à 3 jours à l’avance si elles sont conservées dans un environnement stérile jusqu’à leur utilisation. Cela permet une flexibilité dans la charge de travail en une seule journée.
3. Récolte et ensemencement des HUVECs
REMARQUE : Les cellules endothéliales veineuses ombilicales humaines (HUVEC) ont été isolées à partir des cordons ombilicaux, comme publié avant10.
- Avant d’ensemencer les HUVEC, enduisez la membrane de collagène humain IV. Pour cela, préparez une dilution 1:100 d’une solution mère de collagène (tableau 1) dans la solution saline tamponnée au phosphate de Dulbecco contenant du magnésium et du calcium (PBS +/+). Ajoutez 350 μL de la solution mère diluée dans la chambre correspondante. Incuber pendant 5 min à RT.
REMARQUE : Si vous manipulez la biopuce dans le capot stérile, nous vous recommandons de placer un tissu stérile en dessous pour recueillir l’excès de milieu. - Rincez toutes les chambres deux fois avec 350 μL de PBS +/+ pour éliminer le collagène et l’acide acétique restants. Ensuite, ajoutez 350 μL de milieu de croissance cellulaire endothéliale (EC) dans chaque chambre.
REMARQUE : À partir de là, les biopuces sont prêtes pour l’ensemencement cellulaire et peuvent être stockées à 37 °C jusqu’à leur utilisation. - Utilisez les HUVECs aux passages 1 à 3 à 80-90 % de confluence des cellules. Cultivez des HUVECs dans un milieu EC contenant un mélange de suppléments défini fourni par le fabricant. Une image représentative en fond clair d’une culture cellulaire HUVEC est présentée à la figure 3A.
REMARQUE : Selon le donneur, les HUVECs des passages supérieurs peuvent commencer à se dédifférencier et ne peuvent pas former de manière fiable une monocouche dense et confluente à l’intérieur de la biopuce. L’utilisation d’antibiotiques, c’est-à-dire 100 μg/ml de pénicilline et 100 μg/ml de streptomycine, est facultative, mais recommandée en complément du milieu EC pour prévenir la contamination microbienne. - Retirer le milieu de culture cellulaire d’un flacon de culture cellulaire T25 et laver délicatement les cellules avec 3 à 5 ml de solution saline tamponnée au phosphate de Dulbecco sans magnésium ni calcium (PBS -/-). Retirer le PBS -/- et ajouter 1 mL de réactif de dissociation de la trypsine (tableau 1). Incuber pendant 5 min à 37 °C jusqu’à ce que les cellules se détachent de la fiole de culture cellulaire.
- Transférez les cellules détachées dans un tube à l’aide de 9 ml de sérum de veau fœtal (FBS) à 5 % dans du PBS -/-. Centrifuger à 350 × g pendant 5 min à RT. Retirer le surnageant, remettre en suspension dans 1 mL de milieu EC et déterminer le nombre de cellules. Ajuster la concentration cellulaire à 0,4 × 106 cellules par 150 μL (ensemencement dans la chambre inférieure) ou par 250 μL (ensemencement dans la chambre supérieure).
- Ajoutez le volume respectif de cellules dans la chambre. En cas d’ensemencement dans la chambre inférieure, fermez tous les orifices et positionnez immédiatement la biopuce à l’envers pour que les cellules tombent sur la membrane PET. Incuber les biopuces dans un incubateur humidifié à 37 °C et 5% de CO2.
- Effectuez un remplacement du fluide de la chambre contenant HUVEC avec 350 μL de fluide EC après 24 h. Le fluide dans la chambre opposée n’a pas besoin d’être remplacé.
4. Prélèvement de sérum humain et isolement de monocytes dérivés de cellules mononucléées du sang périphérique (PBMC)
REMARQUE : Les PBMC ont été isolés comme décrit dans Mosig et al.11.
- Prélever du sang veineux humain de donneurs sains. Par biopuce, procurez-vous un minimum de 10 ml de sang total dans des tubes de prélèvement sanguin contenant du silicate pour le prélèvement du sérum. Après une coagulation complète, centrifuger les tubes de prélèvement sanguin à 2 500 × g pendant 10 min à RT. Prélever le sérum, l’aliquote et le conserver à -20 °C jusqu’à nouvel ordre.
- Procurez-vous un minimum de 10 ml de sang total du même donneur dans des tubes de prélèvement sanguin contenant de l’EDTA pour l’isolement des PBMC. Mélangez doucement le sang non coagulé 1:1 avec un iso-tampon (tableau 1) par inversion et superposez lentement 35 mL de ce mélange sur 15 mL d’un milieu à gradient de densité de 1,077 g/mL dans un tube de 50 mL.
- Centrifuger à 800 × g pendant 20 min sans frein à RT. Retirer soigneusement la couche de cellules immunitaires résultante, apparaissant au-dessus du milieu à gradient de densité, et la transférer dans un nouveau tube de 50 mL. Remplissez jusqu’à 50 ml d’iso-tampon froid et lavez les cellules par inversion douce.
- Centrifugeuse à 200 × g pendant 8 min sans frein à 4 °C. Jeter le surnageant et le remettre en suspension dans 10 mL d’iso-tampon par gradient de densité. Facultatif : Regroupez les PBMC d’un donateur si plusieurs gradients sont exécutés en parallèle.
- Centrifuger à 150 × g pendant 8 min à 4 °C. Jeter le surnageant et remettre la pastille en suspension dans 10 mL d’iso-tampon par gradient de densité. Répétez l’étape de centrifugation 4.4. Enfin, jeter le surnageant et remettre les cellules en suspension dans 2 mL de milieu de différenciation des monocytes (tableau 1).
REMARQUE : L’ajout de M-CSF et de GM-CSF renforce la différenciation des monocytes isolés en macrophages dérivés de monocytes et en cellules dendritiques dérivées de monocytes (en combinaison avec le lipopolysaccharide [LPS], qui est ajouté ultérieurement dans ce protocole). L’utilisation d’antibiotiques, c’est-à-dire 100 μg/ml de pénicilline et 100 μg/ml de streptomycine, est facultative, mais recommandée en complément du milieu pour prévenir la contamination microbienne. - Déterminer le nombre de cellules et la graine ~10 × 106 cellules par puits d’une plaque à 6 puits dans 2 mL de milieu de différenciation des monocytes (tableau 1). Incuber dans un incubateur humidifié à 37 °C pendant 1 h pour permettre la fixation des monocytes sur le plastique de la plaque à 6 puits.
- Jetez soigneusement le surnageant et lavez-le 2 fois avec 2 ml de milieu cellulaire hématopoïétique préchauffé pour éliminer les cellules non liées. Incuber à 37 °C pendant encore 24 h dans un milieu de différenciation des monocytes.
- Pour récolter les monocytes, jetez soigneusement le surnageant et lavez-le une fois avec 2 ml de PBS -/-. Voir la figure 3B pour un exemple d’image en fond clair de la culture de monocytes à ce stade. Ensuite, incubez les cellules pendant 7 minutes dans 1 mL de réactif de détachement des monocytes préchauffé (tableau 1) à 37 °C pour renforcer le détachement des monocytes du plastique de la plaque à 6 puits.
- Transférez les monocytes détachés dans un tube à faible liaison. Facultatif : pour obtenir un rendement cellulaire plus élevé, lavez soigneusement la plaque à 6 puits plusieurs fois avec du PBS -/-.
- Centrifuger à 300 × g pendant 8 min à RT. Jeter le surnageant et le remettre en suspension dans un milieu conditionné par EC (Tableau 1). Déterminer le nombre de cellules et ajuster la concentration cellulaire à 0,1 × 106 cellules par 150 μL (ensemencement dans la cavité inférieure) ou par 250 μL (ensemencement dans la cavité supérieure).
REMARQUE : Soyez doux à toutes les étapes de l’isolement des cellules immunitaires et réduisez les forces de cisaillement pour empêcher l’activation des cellules immunitaires. Lors de l’établissement de cet isolement, vérifiez la pureté des monocytes dérivés du PBMC (par exemple, par cytométrie en flux). Plus de 95 % de toutes les cellules devraient être positives pour les marqueurs monocytaires typiques tels que CD14.
5. Ensemencement des monocytes
- Effectuez un remplacement de fluide dans la chambre contenant HUVEC avec 350 μL de fluide préchauffé conditionné par EC.
- Ajouter 150 μL (chambre inférieure) ou 250 μL (chambre supérieure) de la suspension de monocytes préparée (voir étape 4.10) dans la même chambre. En cas d’ensemencement dans la chambre inférieure, fermez tous les orifices et positionnez immédiatement la biopuce à l’envers pour que les cellules tombent sur la couche HUVEC. Incuber la biopuce dans un incubateur humidifié à 37 °C et 5 % de CO2.
- Effectuez un échange de fluide dans la chambre contenant des monocytes HUVEC + avec 350 μL de fluide conditionné CE toutes les 24 h.
6. Récolte et semis C2BBe1
REMARQUE : Les cellules exprimant la bordure en brosse Caco-2 1 (C2BBe1)12 sont utilisées jusqu’au passage 35 et sont prélevées dans des flacons de 80-90% de confluence. Une image représentative en fond clair d’une culture C2BBe1 est présentée à la figure 3C.
- Cultivez des cellules C2BBe1 dans un milieu C2 (tableau 1).
REMARQUE : L’utilisation d’antibiotiques, c’est-à-dire 20 μg/mL de gentamicine, est facultative, mais recommandée en complément du milieu C2 pour prévenir la contamination microbienne. - Retirer le milieu de culture cellulaire d’une fiole de culture cellulaire T25 et laver délicatement les cellules avec 3 à 5 mL de PBS -/-. Retirer le PBS -/- et ajouter 1 mL de réactif de dissociation de la trypsine (tableau 1). Incuber pendant 5 min à 37 °C jusqu’à ce que les cellules se détachent de la fiole de culture cellulaire.
- Transférez les cellules détachées dans un tube en utilisant 9 mL de sérum de veau fœtal (FBS) à 5 % dans du PBS -/-. Centrifuger à 350 × g pendant 5 min à RT. Retirer le surnageant, le remettre en suspension dans 1 mL de milieu C2 et déterminer le nombre de cellules. Ajuster la concentration cellulaire à 0,5 × 10à 6 cellules par 150 μL (ensemencement dans la chambre inférieure) ou par 250 μL (ensemencement dans la chambre supérieure).
- Avant l’ensemencement du C2BBe1, lavez délicatement la chambre correspondante avec 350 μL de milieu C2.
- Ajouter 150 μL (chambre inférieure) ou 250 μL (chambre supérieure) de la suspension C2BBe1 préparée (voir étape 6.3) dans la chambre correspondante. En cas d’ensemencement dans la chambre inférieure, fermez tous les orifices et positionnez immédiatement la biopuce à l’envers pour que les cellules tombent sur la membrane PET. Incuber les biopuces dans un incubateur humidifié à 37 °C et 5% de CO2.

Figure 3 : Morphologie cellulaire des HUVEC, des monocytes et du C2BBe1 avant l’ensemencement dans la biopuce. Cette figure montre des images représentatives en fond clair des différentes sources de cellules utilisées dans l’ensemble du protocole. Les images ont été prises avec un microscope à fond clair inversé avec un grossissement de 10x. Tous les types de cellules, (A) les HUVEC, (B) les monocytes et (C) le C2BBe1 ont été cultivés en culture cellulaire monocouche 2D comme décrit dans leurs sections de protocole spécifiques. Barres d’échelle = 200 μm. Abréviations : HUVECs = cellules endothéliales veineuses ombilicales humaines ; PBMC = cellules mononucléées du sang périphérique. Veuillez cliquer ici pour voir une version agrandie de cette figure.
7. Raccordement à la pompe péristaltique et perfusion circulaire
- Préparez un incubateur vide avec l’ajout d’une pompe péristaltique. Nettoyez soigneusement toutes les zones de l’incubateur et pompez avec un désinfectant pour créer un environnement quasi stérile.
REMARQUE : Les pompes péristaltiques peuvent produire beaucoup de chaleur pendant le travail. Dans les incubateurs bien isolés ou les laboratoires mal climatisés, le nombre de pompes utilisables par incubateur peut être limité car les incubateurs ont tendance à surchauffer. Deux pompes péristaltiques par incubateur devraient suffire. - Avant de fixer les tubes stérilisés à la biopuce, rincez chaque tube avec 700 μL de PBS +/+ suivi de 500 μL de milieu C2 ou de milieu conditionné EC. Préparez un tube de chaque symétrie par milieu (voir étape 1.2). Utilisez le tube avec la courte distance entre l’écluse Luer et le bouchon de pompe péristaltique pour la cavité gauche et le tube avec l’autre symétrie pour la cavité droite.
- Récupérez la biopuce de l’incubateur et effectuez un échange de fluide avec 350 μL pour chaque chambre. Retirez toutes les fiches et remplissez tous les ports jusqu’en haut.
- En commençant par la cavité gauche, connectez le premier tube à l’orifice droit de la chambre supérieure en insérant l’adaptateur Luer Lock dans l’orifice de la biopuce. Ensuite, connectez le deuxième tube à l’orifice gauche de la chambre inférieure. Répétez cette procédure pour la cavité microfluidique droite.
- Prenez un réservoir et ajoutez une petite goutte de milieu de culture cellulaire au fond du réservoir. Ensuite, insérez le réservoir du côté opposé du premier tube et répétez l’opération pour l’autre chambre. Une fois que tous les orifices sont connectés à un tube ou à un réservoir, remplissez les réservoirs avec 3,5 ml de milieu de culture cellulaire.
- Placez le côté lâche du tube, auquel est fixé le couvercle, sur le dessus du réservoir pour fermer le système microfluidique de chaque chambre. Dans cet état, transportez la biopuce vers la pompe péristaltique.
REMARQUE : En fonction de la distance par rapport à l’incubateur et de l’environnement du laboratoire, une boîte préalablement nettoyée et autoclavée peut être utilisée pour transférer les puces vers l’incubateur. - Utilisez les bouchons de pompe péristaltique pour connecter le tube à la pompe. Raccordez chaque tube à la pompe péristaltique de manière à ce que le fluide s’écoule du réservoir dans la cavité, dans le tube et, via la pompe, dans le réservoir (Figure 4). Le réservoir sert de piège à bulles dans la perfusion circulaire et empêche l’air de s’emprisonner dans le système. Perfusion de chaque chambre avec un débit de 50 μL/min, ce qui entraîne une contrainte de cisaillement de 0,013 dyn/cm2 dans la chambre supérieure et de 0,006 dyn/cm2 dans la chambre inférieure8.
REMARQUE : Si le milieu des cavités inférieure et supérieure est déplacé dans des directions opposées, une excroissance tridimensionnelle plus élevée du tissu intestinal peut être obtenue13. Par conséquent, les réservoirs des cavités supérieure et inférieure sont placés sur des côtés opposés (Figure 4). La perfusion circulaire réduit la quantité de milieu de culture cellulaire nécessaire, mais pourrait potentiellement entraîner l’enrichissement des cytokines et des métabolites. Si vous le souhaitez, une perfusion linéaire de la biopuce est également possible. - Perfuser la biopuce pendant 72 h à 37 °C et 5% de CO2.

Figure 4 : Biopuce connectée à une pompe péristaltique. Un exemple de biopuce connectée à une pompe péristaltique est présenté. Les cellules épithéliales C2BBe1 sont cultivées dans la chambre inférieure (le milieu C2 rouge se trouve dans les réservoirs à l’avant) tandis que les HUVECs sont cultivés dans la chambre supérieure (le milieu jaunâtre conditionné par l’EC se trouve dans les réservoirs à l’arrière). Les différents milieux de culture cellulaire ne se mélangent pas en raison de la fonction barrière du tissu cultivé. La biopuce est reliée à la pompe péristaltique de telle sorte que le fluide s’écoule du réservoir dans la cavité. De là, le fluide retourne dans le réservoir à travers le tube via la pompe. Veuillez cliquer ici pour voir une version agrandie de cette figure.
8. Conditionnement LPS de la barrière épithéliale
- Après 72 h de préperfusion, arrêtez la pompe péristaltique et retirez le couvercle relié au tube de chaque réservoir. Placez-le sur un mouchoir stérile à côté de la pompe.
- Retirer tout le milieu et remplir les réservoirs de 2 ml de milieu fraîchement préparé. Pour le côté épithélial contenant les cellules C2BBe1, ajoutez 100 ng/mL de LPS au milieu.
REMARQUE : Le LPS augmente la fonction barrière du tissu, stimule la migration des macrophages dérivés des monocytes dans le tissu épithélial et permet la différenciation des cellules dendritiques dérivées des monocytes. - Reconnectez le tube et les couvercles au réservoir et poursuivez la perfusion circulaire à un débit de 50 μL/min pendant 24 h supplémentaires.
REMARQUE : À partir de ce moment, le modèle de puce peut être utilisé dans des expériences, des tests de composés ou des études d’infection. Nous recommandons un remplacement moyen de 2 mL par réservoir toutes les 24 h.
9. Accès au tissu pour différentes méthodes de lecture
- Prélever les surnageants du milieu de culture cellulaire dans les réservoirs en tout temps de la perfusion. Ouvrez le réservoir et récupérez le volume souhaité (voir étapes 8.1-8.3). Utilisez ces surnageants pour la détection de métabolites, de cytokines ou d’autres molécules.
- Pour accéder au tissu, utilisez un scalpel pour faire une coupe précise le long de l’extérieur de la chambre supérieure et retirez la feuille de liaison pour ouvrir la cavité microfluidique. Le tissu du modèle de biopuce intestinale est maintenant accessible. Coupez soigneusement le long de l’extérieur de la chambre microfluidique pour détacher la membrane de la biopuce. Prélever la membrane contenant le tissu à l’aide d’une pince à épiler.
ATTENTION : Faites attention au placement des doigts pendant cette étape et travaillez avec précaution pour éviter les accidents. Des gants résistants aux coupures sont recommandés. - Vous pouvez également prélever les cellules à partir de couches distinctes à l’intérieur de la biopuce à l’aide de solutions enzymatiques, c’est-à-dire de trypsine ou de cellules lysées à l’aide de tampons contenant du Triton X-100.
10. Évaluation de la perméabilité par diffusion FITC-dextran
REMARQUE : La fonction barrière du tissu peut être analysée via un test de perméabilité FITC-dextran après déconnexion de la pompe péristaltique. L’évaluation de la perméabilité FITC-dextran a été adaptée de Deinhardt-Emmer et al.4.
- Préparez une solution mère d’isothiocyanate de fluorescéine (FITC)-dextran (poids moléculaire de 3 à 5 kDa, tableau 1).
- Videz les réservoirs et débranchez la puce de la perfusion.
- Effectuez un échange de fluide dans les chambres supérieure et inférieure avec un milieu sans rouge de phénol.
REMARQUE : Cette étape n’est pas nécessaire si un milieu sans rouge de phénol a déjà été utilisé pendant l’expérience. - Ajouter 350 μL de solution de FITC-dextran à 1 mg/mL dans la chambre contenant les cellules C2BBe1.
- Fermez les orifices et incubez la puce pendant 60 min à 37 °C, le côté épithélial vers le haut.
- Après le temps d’incubation, prélever le milieu de culture dans les deux chambres de la puce séparément et le stocker à 4 °C, à l’abri de la lumière jusqu’à la mesure.
- Pour la mesure, préparer une courbe standard en milieu C2 et le milieu conditionné CE sans rouge de phénol dans la plage de 1 000 μg/mL à 0 μg/mL de FITC-dextran avec 11 dilutions consécutives en série 1:2.
- Transvaser 200 μL de chaque échantillon dans une plaque noire de 96 puits à fond transparent. Mesurez la fluorescence avec un lecteur de microplaques à une longueur d’onde d’excitation de 495 nm et une longueur d’onde d’émission de 517 nm.
- Utilisez la courbe standard pour calculer la concentration FITC-dextran des échantillons et, par conséquent, le coefficient de perméabilité.
11. Coloration par immunofluorescence
REMARQUE : Les tissus vivants peuvent être étudiés au microscope. Pour faciliter la manipulation, nous recommandons le détachement de la biopuce de la pompe péristaltique et l’utilisation d’objectifs longue distance sur un microscope inversé. En tant qu’analyse finale, le tissu peut être fixé à l’intérieur de la biopuce pour des procédures telles que la coloration par immunofluorescence.
- Arrêtez la pompe péristaltique et ouvrez les réservoirs de toutes les cavités. Videz les réservoirs et débranchez la tubulure, ainsi que les réservoirs de la biopuce.
- Deux fois par chambre, laver les cavités microfluidiques avec 500 μL de PBS +/+ froid. Ajouter 500 μL de méthanol glacé dans toutes les cavités et incuber pendant 15 min à -20 °C. Ensuite, deux fois par cavité, laver la chambre microfluidique avec 500 μL de PBS +/+.
REMARQUE : D’autres méthodes de fixation, telles que la fixation avec du paraformaldéhyde à 4 % ou le fixateur de Carnoy, conviennent également. Après fixation, les puces peuvent être stockées à 4 °C ou procéder directement à la coloration par fluorescence immunitaire. ATTENTION : Les produits chimiques de fixation tels que le méthanol ou le paraformaldéhyde sont toxiques. Effectuez les tâches respectives sous une hotte et collectez les déchets en conséquence. - Ouvrez la puce comme décrit à l’étape 9.2 pour accéder au tissu. Coupez la membrane PET contenant du tissu en trois morceaux maximum pour la colorer en parallèle avec différents immunopanels.
- Transférez chacun des morceaux de membrane dans une plaque séparée à 24 puits contenant une solution de blocage et de perméabilisation (tableau 1) à l’aide d’une pince à épiler de précision. Assurez-vous que la couche cellulaire d’intérêt est toujours tournée vers le haut pendant tout le processus de coloration. Incuber les morceaux de membrane pendant 30 min à RT.
REMARQUE : Les meilleurs résultats de coloration sont obtenus en faisant correspondre le sérum à l’anticorps secondaire. Par exemple, si des anticorps secondaires sont obtenus à partir d’espèces de chèvres, nous recommandons l’utilisation de sérum de chèvre normal. - Transférez les morceaux de membrane sur une lame de verre propre à l’intérieur d’une chambre humide. Préparez le panneau d’anticorps primaires dans la solution de coloration (tableau 1) et ajoutez 50 μL à chaque morceau de membrane. Incuber toute la nuit à 4 °C.
REMARQUE : La concentration optimale d’anticorps et l’efficacité de la coloration peuvent différer d’un fabricant à l’autre et d’un clone à l’autre. Nous vous recommandons de tester les panneaux de coloration au préalable dans une culture cellulaire 2D. - Après l’incubation, transférez les échantillons dans une plaque à 24 puits et lavez doucement les membranes pendant 3 x 5 minutes avec une solution de lavage (tableau 1).
- Encore une fois, transférez les morceaux de membrane sur une lame de verre propre à l’intérieur d’une chambre humide. Préparez le panneau d’anticorps secondaire dans une solution de coloration (tableau 1) et ajoutez 50 μL à chaque morceau de membrane. Si nécessaire, ajoutez une contrecoloration nucléaire telle que le 4',6-diamidino-2-phénylindole (DAPI) ou Hoechst. Incuber pendant 30 min à RT.
REMARQUE : Lorsque vous travaillez avec des fluorophores, gardez les échantillons à l’abri de la lumière pour éviter le photoblanchiment et augmenter la qualité de l’image. - Après l’incubation, transférez les échantillons dans une plaque à 24 puits et lavez doucement les membranes 2 x 5 min avec une solution de lavage (tableau 1). Ensuite, laver une fois avec PBS +/+ pendant 5 min.
- Montez les morceaux de membrane sur une lame de verre propre à l’aide d’un support de montage à fluorescence et d’un verre de protection. Conserver à 4 °C jusqu’à l’obtention d’une imagerie microscopique.
Access restricted. Please log in or start a trial to view this content.
Résultats
Ces résultats représentatifs montrent les couches tissulaires distinctes du modèle d’intestin sur puce. Ils sont colorés par immunofluorescence comme décrit dans la section 11 du protocole. Les images ont été prises à l’aide d’un microscope à épifluorescence ou à fluorescence confocale sous forme d’empilements z et traitées selon une projection orthogonale. Voir la table des matériaux pour plus de détails sur la configuration microscopique et le logiciel. La fig...
Access restricted. Please log in or start a trial to view this content.
Discussion
Le protocole présenté détaille les étapes nécessaires à la génération d’un modèle d’intestin sur puce immunocompétent. Nous avons décrit des techniques spécifiques et des méthodes de lecture possibles telles que la microscopie d’immunofluorescence, l’analyse des cytokines et des métabolites, la cytométrie en flux, l’analyse des protéines et de la génétique, et la mesure de la perméabilité.
Le modèle décrit se compose de HUVEC primaires, de macrophages dérivés ...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
M.R. est PDG de Dynamic42 GmbH et détient des parts dans l’entreprise. A.S.M. est conseiller scientifique de Dynamic 42 GmbH et détient des actions de l’entreprise.
Remerciements
Le travail a été soutenu financièrement par le Centre de recherche collaborative PolyTarget 1278 (numéro de projet 316213987) à V.D.W. et A.S.M., A.F. et A.S.M. reconnaissent en outre le soutien financier du pôle d’excellence « Balance of the Microverse » dans le cadre de la stratégie d’excellence de l’Allemagne - EXC 2051 - Project-ID 690 390713860. Nous tenons à remercier Astrid Tannert et le Laboratoire de biophotonique et d’imagerie d’Iéna (JBIL) de nous avoir donné accès à leur microscope confocal à balayage laser ZEISS LSM980. Les figures 1C et 2 ont été créées avec Biorender.com.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| 96-well plate black, clear bottom | Thermo Fisher | 10000631 | Consumables |
| Acetic acid | Roth | 3738.4 | Chemicals |
| Alexa Fluor 488 AffiniPure, donkey, anti-mouse IgG (H+L) | Jackson Immuno Research | 715-545-150 | Secondary Antibody Vascular Staining and Epithelial Staining |
| Alexa Fluor 647 AffiniPure, donkey, anti-rabbit IgG (H+L) | Jackson Immuno Research | 711-605-152 | Secondary Antibody Epithelial Staining |
| Alexa Fluor 647, donkey, anti-rabbit IgG (H+L) | Thermo Fisher Scientific, Invitrogen | A31573 | Secondary Antibody Vascular Staining |
| Axiocam ERc5s camera | Zeiss | 426540-9901-000 | Technical equipment |
| Basal Medium MV, phenol red-free | Promocell | C-22225 | Cell culture consumables |
| Biochip | Dynamic 42 | BC002 | Microfluidic consumables |
| BSA fraction V | Gibco | 15260-037 | Cell culture consumables |
| C2BBe1 (clone of Caco-2) | ATCC | CRL-2102 | Epithelial Cell Source |
| Chloroform | Sigma | C2432 | Chemicals |
| CO2 Incubator | Heracell | 150i | Technical equipment |
| Collagen IV from human placenta | Sigma-Aldrich | C5533 | Cell culture consumables |
| Coverslips (24 x 40 mm; #1.5) | Menzel-Gläser | 15747592 | Consumables |
| Cy3 AffiniPure, donkey, anti-goat IgG (H+L) | Jackson Immuno Research | 705-165-147 | Secondary Antibody Vascular Staining |
| Cy3 AffiniPure, donkey, anti-rat IgG (H+L) | Jackson Immuno Research | 712-165-150 | Secondary Antibody Epithelial Staining |
| Descosept PUR | Dr.Schuhmacher | 00-323-100 | Cell culture consumables |
| DMEM high glucose | Gibco | 41965-062 | Cell culture consumables |
| DMEM high glucose w/o phenol red | Gibco | 31053028 | Cell culture consumables |
| DPBS (-/-) | Gibco | 14190-169 | Cell culture consumables |
| DPBS (+/+) | Gibco | 14040-133 | Cell culture consumables |
| EDTA solution | Invitrogen | 15575-038 | Cell culture consumables |
| Endothelial Cell Growth Medium | Promocell | C-22020 | Cell culture consumables |
| Endothelial Cell Growth Medium supplement mix | Promocell | C-39225 | Cell culture consumables |
| Ethanol 96%, undenatured | Nordbrand-Nordhausen | 410 | Chemicals |
| Fetal bovine Serum | invitrogen | 10270106 | Cell culture consumables |
| Fluorescein isothiocyanate (FITC)-dextran (3-5 kDa) | Sigma Aldrich | FD4-100MG | Chemicals |
| Fluorescent Mounting Medium | Dako | S3023 | Chemicals |
| Gentamycin (10mg/mL) | Sigma Aldrich | G1272 | Cell culture consumables |
| GlutaMAX Supplement (100x) | Gibco | 35050061 | Cell culture consumables |
| Histopaque | Sigma-Aldrich | 10771 | Cell culture consumables |
| Hoechst (bisBenzimid) H33342 | Sigma-Aldrich | 14533 | Epithelial Staining |
| Holotransferrin (5mg/mL) Transferrin, Holo, Human Plasma | Millipore | 616397 | Cell culture consumables |
| Human recombinant GM-CSF | Peprotech | 300-30 | Cell culture consumables |
| Human recombinant M-CSF | Peprotech | 300-25 | Cell culture consumables |
| Illumination device | Zeiss | HXP 120 C | Fluorescence Microscope Setup |
| Laser Scanning Microscope | Zeiss | CLSM980 | Fluorescence Microscope Setup |
| Lidocain hydrochloride | Sigma-Aldrich | L5647 | Cell culture consumables |
| Lipopolysaccharide (LPS) | Sigma | L2630 | Cell culture consumables |
| Loftex Wipes | Loftex | 1250115 | Consumables |
| Low attachment tubes (PS, 5 mL) | Falcon | 352052 | Consumables |
| Luer adapter for the top cap (M) | Mo Bi Tec | M3003 | Microfluidic consumables |
| Male mini luer plugs, row of four,PP, opaque | Microfluidic chipshop | 09-0556-0336-09 | Microfluidic consumables |
| MEM Non-Essential Amino Acids Solution | Gibco | 11140 | Cell culture consumables |
| Methanol | Roth | 8388.2 | Chemicals |
| Microscope | Zeiss | Axio Observer 5 | Fluorescence Microscope Setup |
| Microscope slides | Menzel | MZ-0002 | Consumables |
| Monoclonal, mouse, anti-human CD68 Antibody (KP1) | Thermo Fisher Scientific, Invitrogen | 14-0688-82 | Primary Antibody Vascular Staining |
| Monoclonal, rat, anti-human E-Cadherin antibody (DECMA-1) | Sigma-Aldrich, Millipore | MABT26 | Primary Antibody Epithelial Staining |
| Multiskan Go plate reader | Thermo Fisher | 51119300 | Technical equipment |
| Normal donkey serum | Biozol | LIN-END9010-10 | Chemicals |
| Optical Sectioning | Zeiss | ApoTome | Fluorescence Microscope Setup |
| Penicillin-Streptomycin (10,000 U/mL) | Gibco | 15140-122 | Cell culture consumables |
| Plugs | Cole Parmer | GZ-45555-56 | Microfluidic consumables |
| Polyclonal, goat, anti-human VE-Cadherin Antibody | R&D Systems | AF938 | Primary Antibody Vascular Staining |
| Polyclonal, rabbit, anti-human Von Willebrand Factor Antibody | Dako | A0082 | Primary Antibody Vascular Staining |
| Polyclonal, rabbit, anti-human ZO-1 antibody | Thermo Fisher Scientific, Invitrogen | 61-7300 | Primary Antibody Epithelial Staining |
| Power Supply Microscope | Zeiss | Eplax Vp232 | Fluorescence Microscope Setup |
| Primovert microscope | Zeiss | 415510-1101-000 | Technical equipment |
| Reglo ICC peristaltic pump | Ismatec | ISM4412 | Technical equipment |
| SAHA (Vorinostat) | Sigma Aldrich | SML0061-25MG | Chemicals |
| Saponin | Fluka | 47036 | Chemicals |
| S-Monovette, 7.5 mL Z-Gel | Sarstedt | 01.1602 | Consumables |
| S-Monovette, 9.0 mL K3E | Sarstedt | 02.1066.001 | Consumables |
| Sodium Pyruvate | Gibco | 11360-088 | Cell culture consumables |
| Tank 4.5 mL | ChipShop | 10000079 | Microfluidic consumables |
| Trypane blue stain 0.4% | Invitrogen | T10282 | Cell culture consumables |
| Trypsin | Gibco | 11538876 | Cell culture consumables |
| Tubing | Dynamic 42 | ST001 | Microfluidic consumables |
| Tweezers (Präzisionspinzette DUMONT abgewinkelt Inox08, 5/45, 0,06 mm) | Roth | K343.1 | Consumables |
| Wheat Germ Agglutinin (WGA) | Thermo Fisher Scientific, Invitrogen | W32464 | Epithelial Staining |
| X-VIVO 15 | Lonza | BE02-060F | Cell culture consumables, Hematopoietic cell medium |
| Zellkultur Multiwell Platten, 24 Well, sterile | Greiner Bio-One | 662 160 | Consumables |
| Zellkultur Multiwell Platten, 6 Well, sterile | Greiner Bio-One | 657 160 | Consumables |
| Zen Blue Software | Zeiss | Version 3.7 | Microscopy Software |
Références
- Alonso-Roman, R., et al. Organ-on-chip models for infectious disease research. Nat Microbiol. 9 (4), 891-904 (2024).
- Fahrner, R., Groger, M., Settmacher, U., Mosig, A. S. Functional integration of natural killer cells in a microfluidically perfused liver on-a-chip model. BMC Res Notes. 16 (1), 285(2023).
- Raasch, M., et al. Microfluidically supported biochip design for culture of endothelial cell layers with improved perfusion conditions. Biofabrication. 7 (1), 015013(2015).
- Deinhardt-Emmer, S., et al. Co-infection with Staphylococcus aureus after primary influenza virus infection leads to damage of the endothelium in a human alveolus-on-a-chip model. Biofabrication. 12 (2), 025012(2020).
- Kaden, T., et al. Generation & characterization of expandable human liver sinusoidal endothelial cells and their application to assess hepatotoxicity in an advanced in vitro liver model. Toxicology. 483, 153374(2023).
- Maurer, M., et al. A three-dimensional immunocompetent intestine-on-chip model as in vitro platform for functional and microbial interaction studies. Biomaterials. 220, 119396(2019).
- Hoang, T. N. M., et al. Invasive aspergillosis-on-chip: A quantitative treatment study of human aspergillus fumigatus infection. Biomaterials. 283, 121420(2022).
- Kaden, T., et al. Modeling of intravenous caspofungin administration using an intestine-on-chip reveals altered Candida albicans microcolonies and pathogenicity. Biomaterials. 307, 122525(2024).
- Shah, P., et al. A microfluidics-based in vitro model of the gastrointestinal human-microbe interface. Nat Commun. 7, 11535(2016).
- Jaffe, E. A., Nachman, R. L., Becker, C. G., Minick, C. R. Culture of human endothelial cells derived from umbilical veins. Identification by morphologic and immunologic criteria. J Clin Invest. 52 (11), 2745-2756 (1973).
- Mosig, S., et al. Different functions of monocyte subsets in familial hypercholesterolemia: Potential function of cd14+ cd16+ monocytes in detoxification of oxidized ldl. FASEB J. 23 (3), 866-874 (2009).
- Peterson, M., Mooseker, M. Characterization of the enterocyte-like brush border cytoskeieton of the c2bbe clones of the human intestinal cell line, caco-2. J Cell Sci. 102, Pt 3 581-600 (1992).
- Shin, W., Hinojosa, C. D., Ingber, D. E., Kim, H. J. Human intestinal morphogenesis controlled by transepithelial morphogen gradient and flow-dependent physical cues in a microengineered gut-on-a-chip. iScience. 15, 391-406 (2019).
- Kim, H. J., Ingber, D. E. Gut-on-a-chip microenvironment induces human intestinal cells to undergo villus differentiation. Integr Biol (Camb). 5 (9), 1130-1140 (2013).
- Kim, H. J., Huh, D., Hamilton, G., Ingber, D. E. Human gut-on-a-chip inhabited by microbial flora that experiences intestinal peristalsis-like motions and flow. Lab Chip. 12 (12), 2165-2174 (2012).
- Karra, N., Fernandes, J., James, J., Swindle, E. J., Morgan, H. The effect of membrane properties on cell growth in an 'airway barrier on a chip'. Organs-on-a-Chip. 5, 10025(2023).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon