Démystifier l’imagerie par bioluminescence in vivo d’un modèle murin de la maladie de Chagas pour des études d’efficacité de médicaments
Dans cet article
Résumé
Le protocole fourni ici décrit en détail les étapes détaillées de la réalisation d’études d’efficacité médicamenteuse dans un modèle bioluminescent d’infection à Trypanosoma cruzi , en mettant l’accent sur l’acquisition, l’analyse et l’interprétation des données. Des procédures de dépannage et de contrôle de la qualité visant à minimiser les problèmes techniques sont également fournies.
Résumé
Pour contrôler et réduire l’impact sur la santé publique des protozoaires humains tels que la maladie de Chagas, la leishmaniose et la trypanosomiase humaine africaine, il est nécessaire d’accélérer le développement de nouveaux médicaments et vaccins. Cependant, ce processus est rempli de difficultés telles que la biologie très complexe des parasites et la pathogenèse des maladies et, comme c’est souvent le cas pour les maladies tropicales négligées, le financement relativement limité de la recherche et du développement. Ainsi, des modèles d’étude in vitro et in vivo capables de reproduire suffisamment les principales caractéristiques de l’infection et de la maladie tout en assurant une utilisation rationnelle des ressources sont essentiels pour faire progresser la recherche sur ces maladies. Un exemple est le modèle murin d’imagerie par bioluminescence in vivo (BLI) pour la maladie de Chagas, qui permet une détection très sensible de la lumière à longue longueur d’onde générée par les parasites Trypanosoma cruzi exprimant la luciférase. Bien que cette technique soit devenue l’approche standard pour les études in vivo sur l’efficacité des médicaments, les groupes de recherche peuvent encore avoir du mal à la mettre en œuvre en raison d’un manque de formation pratique appropriée sur la manipulation de l’équipement et l’application des procédures de contrôle de la qualité, même lorsque l’équipement BLI approprié est facilement disponible. Compte tenu de ce scénario, ce protocole vise à guider de la planification des expériences à l’acquisition et à l’analyse des données, avec des détails qui facilitent la mise en œuvre de protocoles dans des groupes de recherche ayant peu ou pas d’expérience avec le BLI, que ce soit pour la maladie de Chagas ou pour d’autres modèles murins de maladies infectieuses.
Introduction
La maladie de Chagas est endémique en Amérique latine et touche environ sept millions de personnes dans le monde1. Chaque année, plus de 50 000 décès et des pertes économiques d’environ 7 milliards de dollars résultent du caractère invalidant de cette maladie2. La maladie de Chagas est causée par le protozoaire Trypanosoma cruzi, un parasite hétéroxénique hémafloguélate capable d’infecter les mammifères (sauvages et domestiques) et les vecteurs triatomes (Hemiptera, Reduviidae)3 dans les Amériques, où la transmission vectorielle est établie. D’autres voies d’infection importantes comprennent la transfusion sanguine, la transplantation d’organes, la transmission orale (par l’ingestion d’aliments contaminés par un triatome infecté)4 et la transmission congénitale. Les voies de transmission non vectorielles ont contribué à la propagation de la maladie de Chagas dans les zones non endémiques 3,5.
La maladie de Chagas se manifeste en deux phases cliniques. La phase aiguë est, dans la plupart des cas, asymptomatique. Les infections symptomatiques sont généralement associées à des signes non spécifiques tels que la fièvre, la fatigue, la myalgie, la lymphadénopathie, la splénomégalie et l’hépatomégalie. La phase aiguë est également souvent associée à une parasitémie patente et à une circulation systémique des parasites. La mort peut survenir dans jusqu’à 10 % des cas diagnostiqués, en particulier dans les cas d’infection buccale6. La phase chronique est souvent caractérisée par une longue période d’absence de tout symptôme. Avec le temps, environ un tiers des patients infectés des décennies plus tôt présentent des manifestations cardiaques, généralement accompagnées de fibrose et d’inflammation du myocarde, et/ou de troubles gastro-intestinaux principalement liés au développement de syndromes du méga-œsophage et/ou du méga-côlon 3,5,6.
Le traitement étiologique de la maladie de Chagas ne comprend que deux médicaments : le benznidazole et le nifurtimox. Ces agents antiparasitaires sont disponibles depuis plus de 50 ans et ont une toxicité considérable et une efficacité limitée 5,7,8. Par conséquent, il est urgent de développer de nouveaux traitements sûrs et plus efficaces pour les patients atteints de la maladie de Chagas.
Des techniques plus sophistiquées et plus précises permettent aujourd’hui d’obtenir des réponses à des questions anciennes qui permettent des avancées dans la recherche de nouveaux traitements pour la maladie de Chagas. En ce sens, la communauté scientifique bénéficie grandement des parasites génétiquement modifiés pour les études in vivo sur l’évolution de l’infection et l’évaluation de l’efficacité des médicaments 9,10,11,12. Un test longitudinal basé sur le système d’imagerie par bioluminescence (BLI) permet d’évaluer l’efficacité pendant et après le schéma thérapeutique, conduisant à l’identification de composés ayant une activité trypanocide10,13. La méthode BLI fournit une mesure directe de la charge parasitaire, à la fois en circulation ou dans les tissus et les organes, grâce à la quantification de la lumière produite par la lignée11 de T. cruzi CL Brener Luc ::Neon génétiquement modifiée, qui exprime constitutivement la luciférase12 décalée vers le rouge.
Néanmoins, près de 10 ans après la mise en place du modèle animal BLI de la maladie de Chagas et des études d’efficacité des médicaments, seuls quelques groupes de recherche dominent cette technique. Cela est dû non seulement à l’accès limité à un équipement d’imagerie approprié, mais aussi au manque de formation et de disponibilité de protocoles structurés et détaillés. Cette méthode présente plusieurs avantages par rapport à d’autres approches, qui reposent sur l’évaluation de la parasitémie par microscopie, sérologie ou l’évaluation des infections d’organes/tissus par qPCR pour la détection de l’ADN du parasite, car elle permet d’améliorer le bien-être des souris et de réduire l’utilisation d’animaux par la possibilité de générer des données in vivo plus robustes et intégrées. De plus, cette méthode est sans doute plus sensible, car elle permet de détecter facilement les foyers parasitaires dans les organes viscéraux après un traitement médicamenteux10,12. Par conséquent, ce protocole vise à guider les groupes de recherche en parasitologie et autres maladies infectieuses pour établir cette méthodologie dans leurs laboratoires en détaillant les procédures techniques. Nous partageons ici l’expérience acquise grâce à la mise en œuvre du modèle BLI de la maladie de Chagas au Brésil, le premier du genre en Amérique latine, dans le cadre des efforts de découverte de médicaments coordonnés par l’initiative Médicaments contre les maladies négligées (DNDi).
Protocole
Toutes les procédures décrites dans ce protocole ont été soumises, approuvées et conduites conformément aux directives14 préétablies par le Comité d’éthique animale de l’Instituto de Ciências Biomédicas de l’Universidade de São Paulo : protocole CEUA ICB/USP no 5787250522.
1. Les solutions
REMARQUE : Considérez le volume administré prédéfini de 10 mL/kg (200 μL pour un poids de souris de 20 g)15,16. Par exemple, préparez une solution de travail de 15 mg/mL pour atteindre une dose animale de 150 mg/kg.
- Véhicule suspendu à l’hydroxypropylméthylcellulose (HPMC-SV)
REMARQUE : Les réactifs requis sont 0,5 % (p/v) d’hydroxypropylméthylcellulose (HPMC), 0,4 % (v/v) de Tween 80 et 0,5 % (v/v) d’alcool benzylique.- Pour 200 mL de solution pour véhicule, peser 1 g de HPMC et dissoudre dans 64 mL d’eau chaude ultrapure. Remuer pendant 2 min.
- Ajouter 120 ml d’eau ultrapure glacée et remuer pendant 1 h. Ajouter 1 mL d’alcool benzylique.
- Ajoutez ensuite 0,8 ml de Tween 80 en utilisant la technique de pipetage inverse et continuez à remuer jusqu’à ce que la solution devienne transparente.
- Ajustez la solution pour obtenir le volume final de 200 ml. Conservez le HPMC-SV au réfrigérateur (4 °C) pendant 3 mois maximum.
- Benznidazole
- Calculez la quantité nécessaire de solution composée, comme suit :
volume de solution composée = (nombre de doses par jour x nombre de jours x nombre de souris à traiter x volume administré par chaque souris) + 30 % supplémentaires. - Peser la quantité nécessaire de benznidazole (BZ), en tenant compte de la dose souhaitée. Pour le traitement curatif, une dose orale de 100 mg/kg une fois par jour pendant 10 jours permet une guérison de 100 % dans le modèle chronique de la MC17.
- En tenant compte du volume final souhaité, calculez la quantité appropriée pour atteindre une concentration de 5 % (v/v) de DMSO et dissoudre complètement le BZ dans du DMSO pur.
- Ajoutez le volume approprié du véhicule dans un tube de verre pour atteindre une concentration de 95% (v/v) HPMC-SV. Transférez le BZ dissous dans le DMSO dans le tube en verre contenant le HPMC-SV. Homogénéisez vigoureusement la suspension et stockez-la à 4 °C.
Ex. : Volume final de la formulation BZ = 10 mL (étape 1.2.1)
Quantité de BZ = 100 mg (étape 1.2.2)
DMSO à 5 % = 0,5 mL (étape 1.2.3) et HPMC-SV à 95 % = 9,5 mL (étape 1.2.4) - Avant chaque administration de médicament, les formulations sont placées dans un bain d’eau à ultrasons pendant 5 min à 37 °C et vigoureusement homogénéisées avant le dosage sur l’animal.
- Calculez la quantité nécessaire de solution composée, comme suit :
- Cyclophosphamide
- Dissoudre la quantité nécessaire de cyclophosphamide dans de l’eau ultrapure pour obtenir une solution de 12,5 mg/mL.
- Stériliser la solution par filtration et la conserver à 4 °C.
- Teinture Giemsa
- Dissoudre 0,6 mg de réactif en poudre Giemsa dans 50 mL de méthanol. Ajouter 25 mL de glycérol et mélanger. Retirez les précipités à l’aide de papier filtre et d’un entonnoir. Conservez la solution mère à température ambiante (RT), à l’abri de la lumière.
- Préparez une solution de travail en diluant 10 mL de solution de Giemsa dans 90 mL de tampon Mix-Phosphate (20,5 M Na2HPO4, 65,4 M KH2PO4 à pH 7,2).
2. La culture de Trypanosoma cruzi
- En travaillant dans une enceinte de sécurité biologique (ESB), cultiver 4 x 106 épimastigotes/mL de T. cruzi CL Brener Luc ::Neon11 dans un milieu LIT (68,44 mM NaCl, 5,36 mM KCl, 112,7 mM Na2HPO4, 5 g/L de tryptone, 5 g/L de bouillon de perfusion hépatique, 0,03 M d’hémine, 4,16 mM de glucose), complété par 10 % (v/v) de sérum fœtal de veau (FBS), 100 μg/mL de pénicilline, 100 μg/mL de streptomycine et 150 μg/mL d’hygromycine comme médicament sélectif à 28 °C. Les parasites atteignent généralement une phase stationnaire en 3-4 jours.
- Induire la métacyclogenèse pour obtenir des parasites infectieux en incubant 3 x 108 épimastigotes dans 10 mL de milieu Grace’s Insect avec 10 % (v/v) de FBS dans des tubes coniques de 15 mL à 28 °C pendant 7 à 10 jours.
- Évaluer le taux de différenciation par frottis de coloration Giemsa. Pour cela, étalez 20 μL des parasites différenciés dans une lame de verre et laissez sécher pendant 10 min.
- Dans une hotte, procéder à la fixation de l’échantillon en recouvrant la lame de verre de méthanol pur et laisser sécher complètement (1-2 min). Couvrir la lame de verre avec la solution de travail Giemsa pendant 20 min.
- Lavez délicatement la lame de verre avec de l’eau distillée. Au microscope, comptez le pourcentage de trypomastigotes métacycliques. Si un taux de différenciation d’au moins 10 % est atteint, passez à l’étape suivante.
- Centrifugez les parasites (120 x g pendant 10 min) et remettez la pastille en suspension avec 10 mL de DPBS. Centrifugez une fois de plus et mettez les parasites en suspension dans 5 mL de DMEM complété par 10 % (v/v) de FBS, 100 μg/mL de pénicilline et 100 U/mL de streptomycine.
- Dans une fiole de culture de 25 cm2 , effectuer l’infection de 1,66 x 10cellules 5 LLC-MK2 (cellules épithéliales rénales de Macaca mulatta) à 37 °C dans 5% de CO2, dans un incubateur humidifié18.
- Les trypomastigotes de culture tissulaire (TCT) sont libérés dans le milieu après 8 à 9 jours. Infectez les monocouches de cellules LLC-MK2 fraîches avec des TCT à une multiplicité d’infection (MOI) de 1:40.
3. Analyse de l’homogénéité de la population de Trypanosoma cruzi par cytomètre en flux
- Récupérez les TCT des souches de type sauvage CL Brener Luc ::Neon et CL Brener, centrifugez à 120 x g pendant 10 min, et remettez les TCT en suspension dans DPBS. Ajustez la densité du parasite pour obtenir 1 x 106/mL.
- Procéder à l’analyse de la population par cytomètre en flux sur la base de la fluorescence mNeonGreen (ex. 506/em. 517 nm)19, en acquérant au moins 20 000 événements pour chaque échantillon.
REMARQUE : Le pourcentage de population fluorescente est obtenu en comparant le type sauvage au parasite transfecté. Pour procéder à l’infection des souris, un minimum de 95% de la population de parasites fluorescents de la lignée CL Brener Luc ::Neon doit être atteint (Figure supplémentaire 1).
4. Infection expérimentale chez la souris
REMARQUE : Pour augmenter la quantité de parasites, les trypomastigotes sanguins (BT) sont fréquemment obtenus à partir de souris immunodéficientes10,13. Ici, l’immunosuppression chimique des souris BALB/C est utilisée pour obtenir la BT. Pour cela, une immunosuppression légère est obtenue avec quatre injections intrapéritonéales de cyclophosphamide (CTX) à 62,5 mg/kg avec des intervalles de 96 heures, ce qui est effectué en concomitance à l’infection à T. cruzi.
- Administrer 62,5 mg/kg de cyclophosphamide stérile par injection intrapéritonéale (i.p.) 1 jour avant l’infection à T. cruzi .
- Infectez chaque souris avec 1 x 104 TCT dans 0,2 mL de DPBS par voie intrapéritonéale. Attention au risque élevé d’incidents lors de la manipulation d’agents pathogènes et d’aiguilles. Effectuez l’infection dans un BSC, en portant des gants et un écran facial pendant toute la procédure.
- Surveiller quotidiennement la parasitémie par observation directe de la BT dans le sang (méthode Pizzi-Brener)20. Au pic de parasitémie, environ 13 à 17 jours après l’infection (dpi), effectuez le prélèvement sanguin. Pour cela, anesthésez les souris avec 100 mg/kg de kétamine et 10 mg/kg de xylazine.
- Lorsque les souris sont complètement anesthésiées21, procéder à la ponction cardiaque à l’aide d’une seringue de 1 mL fixée à une aiguille X3/4 de 24 G contenant 50 μL de citrate de sodium à 3,8 % (p/v). Débranchez l’aiguille et placez délicatement le sang dans un tube à centrifuger.
- Dans une ESB, effectuer une dilution d’une aliquote de sang dans un tampon de lyse ammoniac-chlorure-potassium (ACK) et compter les parasites dans la chambre de Neubauer. Répétez cette procédure au moins deux fois, car de petits caillots sanguins influencent le nombre de parasites.
REMARQUE : Pour éviter les erreurs de comptage, ajustez le facteur de dilution pour éviter les comptages inférieurs à 30 et supérieurs à 300 trypomastigotes dans la chambre Neubauer. - Ajustez la densité du parasite à 5 x 103 BT/mL en mélangeant la quantité nécessaire de sang pur dans le DPBS.
- Infecter des souris BALB/c non immunodéprimées avec 1 x 103 BT dans 0,2 mL de DPBS par souris (5 x 103 BT/mL) par voie intrapéritonéale à l’aide d’une aiguille de 26 G (des aiguilles plus étroites entraînent une lyse parasitaire)22. Après avoir injecté le volume par voie intrapéritonéale, maintenez l’aiguille à l’intérieur de la souris pendant 5 secondes pour éviter le reflux.
- Placez temporairement les souris infectées dans une boîte avec une serviette en papier pour identifier les fuites ou les saignements potentiels, puis renvoyez les souris dans leurs cages.
5. L’imagerie in vivo
REMARQUE : Le glossaire des termes utilisés ici est le suivant :
Séance d’imagerie : Acquisition de la bioluminescence effectuée dans tous les groupes d’une certaine expérience un jour donné. La figure 1A présente une vue d’ensemble de la procédure.
Cycle d’imagerie : Procédure réalisée en sous-groupes de trois souris, de l’injection de D-luciférine à la récupération de l’anesthésie. Il est recommandé que chaque groupe expérimental contienne 6 souris, en raison de la variabilité intrinsèque de la charge parasitaire des souris et d’autres facteurs qui influencent la quantification de l’IBL décrits ci-dessous.
Acquisition d’imagerie : Prise de photos effectuée par l’équipement d’imagerie pour quantifier la bioluminescence, ce qui se traduit par une superposition d’image d’une photographie et la bioluminescence quantifiée représentée par une échelle de pseudo-couleurs.
Procédure d’imagerie : Toutes les étapes abordées dans cette session du protocole.
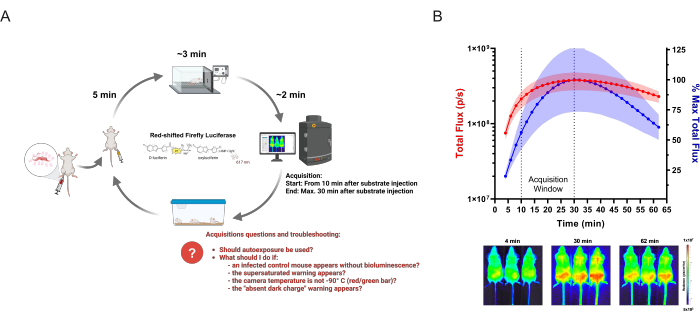
Figure 1 : Acquisition des données BLI. (A) Schéma du flux de travail d’acquisition appliqué aux études sur les maladies infectieuses, en utilisant le modèle de souris bioluminescentes de la maladie de Chagas comme exemple. Les souris infectées par T. cruzi génétiquement modifié sont analysées par imagerie in vivo sur les points temporels établis. À chaque cycle d’imagerie, des groupes d’un maximum de trois souris reçoivent une injection de 150 mg/kg de substrat enzymatique (D-luciférine). Après 5 min, l’anesthésie est administrée à 2,5% (v/v) d’isoflurane dans de l’oxygène. Lorsqu’elles sont complètement immobiles, les souris sont placées dans un système d’imagerie et l’acquisition est lancée selon les paramètres définis. Après l’imagerie, les souris se remettent de l’anesthésie et sont renvoyées dans des cages. Les questions et les problèmes fréquents que les chercheurs peuvent avoir et auxquels ils peuvent être confrontés lors de l’acquisition sont surlignés en rouge. Ce schéma a été modifié à partir de Lewis et al. (2014)12 (créé avec BioRender.com : UD26KWEVS2). (B) Cinétique in vivo de la D-luciférine/luciférase décalée vers le rouge (PpyRE9h). Les souris au pic de parasitémie de T. cruzi (n = 3) ont été anesthésiées et injectées avec 150 mg/kg de D-luciférine. Les images ont été acquises pendant 1 h (temps de pose : 2 min ; binning : 4). En haut : quantification du flux total ventral (p/s) (axe Y gauche, en rouge) et en pourcentage de la mesure moyenne la plus élevée (axe Y droit, en bleu). Les données sont présentées sous forme de moyenne (courbes) et d’écart-type (zone ombrée). En bas : images acquises du premier (4 min), du signal BLI le plus élevé (30 min) et du dernier (62 min) points de temps. Veuillez cliquer ici pour voir une version agrandie de cette figure.
- Vérifiez la barre verte dans la fenêtre d’acquisition pour vérifier si la caméra CCD (Load-Coupled Device) est froide (-90 °C). Cliquez sur la barre (verte ou rouge) pour visualiser la température.
REMARQUE : Selon le manuel de l’équipement d’imagerie, l’équipement d’imagerie et le logiciel doivent être allumés en permanence pour garder le CCD froid. - Vérifiez si le réglage automatique de l’arrière-plan a été effectué. Pour ce faire, cliquez sur Acquisition > Arrière-plan > Voir les frais invisibles disponibles. Une liste avec plusieurs combinaisons de paramètres apparaîtra.
REMARQUE : Cette procédure réduit le bruit de luminescence. Si la configuration choisie aboutit à une valeur supérieure à 1000, basée sur la formule « temps d’exposition x (binning²) », alors la charge d’obscurité ne doit pas être ignorée. Selon les configurations logicielles, le regroupement peut être affiché sous la forme d’un nombre (facteur de compartimentage) ou d’une plage allant de « petit » à « grand ». La correspondance entre la plage et le facteur de binning se trouve dans le manuel de l’appareil. - Si la fenêtre d’activité (zone blanche en bas du logiciel) n’est pas affichée, activez-la dans la vue de menu > fenêtre d’activité.
- Définissez la zone d’imagerie en cliquant sur Fenêtre d’acquisition > Champ de vision. L’option C (13,2 cm) acquiert 3 souris, et l’option D (22 cm) acquiert 5 souris.
- Sélectionnez l’option d’enregistrement automatique en cliquant sur Acquisition > Enregistrement automatique et sélectionnez ou créez un nouveau dossier pour chaque point temporel.
- Posez un papier noir mat sur la zone d’imagerie et placez les lames de séparation perpendiculairement entre les entrées. Si le fabricant n’a pas fourni les diapositives, utilisez des morceaux (3 cm x 15 cm) de papier noir mat.
- Ajustez la zone interne de la chambre d’imagerie pour accueillir les cônes de nez en verre aux entrées de l’anesthésie. Utilisez de petits morceaux de ruban isolant noir pour fixer le système d’anesthésie à la plate-forme (à l’extérieur de la zone de l’image).
REMARQUE : Dans certaines versions d’appareils d’imagerie, un laser définit la zone d’imagerie. Si cet outil n’est pas disponible, acquérez des images via le logiciel pour vérifier le partitionnement des lames dans la zone d’imagerie. - Réglez le vaporisateur d’isoflurane à 2,5 % (v/v) en oxygène pour les chambres d’imagerie et d’induction. Vérifiez à l’aide du manomètre si le gaz circule dans le système21.
REMARQUE : Si l’appareil d’imagerie n’est pas équipé d’un système d’anesthésie par inhalation, d’autres options d’anesthésie sont possibles, telles que la xylazine injectable et la kétamine23. Dans ce cas, la récupération des souris est lente et le risque de décès est élevé24. - Remplissez des seringues (aiguilles de 31 G) avec de la D-luciférine (un protocole complet pour préparer la D-luciférine est fourni par différents fournisseurs)25,26, protégez-les de la lumière directe et préparez quelques récipients en plastique ou des cages supplémentaires en couvrant l’intérieur avec une serviette en papier.
- Gardez une horloge/montre à proximité pour suivre facilement le temps et un cahier de laboratoire pour enregistrer les groupes de souris, le temps d’injection de luciférine et toute autre information pendant la procédure.
- Pesez toutes les souris et enregistrez leur poids. Marquez chaque souris avec un marqueur, un stylo ou un tatouage sur la queue. Gardez l’identification des souris bien affichée pendant toute la durée de l’expérience. Cette étape peut également être effectuée la veille de l’acquisition.
REMARQUE : La marque ne doit pas occuper une grande surface corporelle car l’encre peut interférer avec le signal bioluminescent. Des marqueurs permanents de différentes couleurs peuvent également aider à différencier les groupes. - Pour démarrer la session d’imagerie, enregistrez une image luminescente d’arrière-plan (paramètres : Temps d’exposition : 5 min ; Binning : 'grand' ou '16', f/stop : 1) de la chambre d’imagerie sans souris. Cette procédure permet d’identifier les sources lumineuses autoluminescentes ou les problèmes indésirables sur l’équipement.
REMARQUE : Étant donné que le BLI est basé sur la réaction enzymatique, le temps est une caractéristique essentielle de l’expérience. Vérifiez tous les éléments énumérés ci-dessus et les paramètres de l’équipement avant de commencer à manipuler les animaux. - Injecter 150 mg/kg (i.p.) de D-luciférine dans les 3 premières souris sans atteindre les organes internes. Placez les souris dans la boîte du récipient pour évaluer si la D-luciférine fuit (solution jaune vif). Prenez des notes si cela se produit et enregistrez le groupe de souris et le temps d’injection de D-luciférine.
- Attendez 5 min puis transférez les souris dans la chambre d’induction de l’anesthésie. Mettez le système sous tension. Il faut environ 3 minutes pour que les souris soient complètement anesthésiées (absence de réponses comme des jambes tremblantes, la queue, etc.) 21. Aéroport de Lyna
- Ouvrez la porte de l’appareil d’imagerie, allumez le flux d’anesthésique vers la chambre d’imagerie et, en même temps, éteignez la chambre d’induction.
- Placez chaque souris dans la position des cônes nasaux : de la souris 1 à 3, de gauche à droite. Accueillez doucement les souris avec la face ventrale vers le haut à l’intérieur de la zone d’imagerie indiquée par le laser. Pendant l’hébergement, vérifiez l’identité et la position des souris. Ne forcez pas l’entrée des souris partiellement anesthésiées dans les cônes nasaux.
- Placez les lames de séparation entre les souris et fermez la porte de l’équipement d’imagerie.
- Ajustez les paramètres d’acquisition dans la fenêtre d’acquisition du logiciel, comme suit :
- Pour les souris non infectées, temps d’exposition = 5 min / Binning = « grand » ou « 16 »
(ensemble de configurations le plus sensible aux mathématiques pour définir les valeurs de seuil). - Pour les souris infectées dans le modèle aigu : Temps d’exposition = 2 min/ Binning = « moyen » ou « 4 ».
- Pour les souris infectées dans le modèle chronique : Temps d’exposition = 5 min/ Binning = « grande » ou « 16 ».
- Pour les souris non infectées, temps d’exposition = 5 min / Binning = « grand » ou « 16 »
- Vérifiez si l’injection de D-luciférine a été effectuée au moins 10 minutes avant de commencer l’acquisition. Si ce n’est pas le cas, attendez la période nécessaire pour obtenir les images pendant le pic du signal de luciférase (Figure 1B) ; sinon, cliquez sur Acquérir pour lancer l’acquisition de l’imagerie.
- La fenêtre Etiquettes d’image s’affiche après le démarrage de l’imagerie. Remplissez les cases avec les informations appropriées sur chaque groupe, y compris le temps d’injection de luciférine, l’expérience, l’identification des souris, le point temporel et toute autre information souhaitée qui peut aider à tenir un registre. Ces informations seront incluses dans le fichier de la table de mesures.
- Vérifiez si le signe d’avertissement Image saturée s’affiche à la fin de l’acquisition de l’image. Les images saturées ne sont pas acceptables. Si cela se produit, diminuez le binning et acquérez une nouvelle image. Prenez des notes à prendre en compte dans l’analyse.
- Une fois l’image acquise, ouvrez la porte de la machine d’imagerie et tournez les souris vers la vue dorsale (dos vers le haut). Effectuez à nouveau l’acquisition et étiquetez-la de manière appropriée.
- À la fin de cette acquisition d’imagerie, coupez le flux d’anesthésique. Retirez délicatement les souris de la chambre d’imagerie et placez-les dans un récipient.
- Enregistrez le poids corporel des souris tout en observant la récupération de l’anesthésie. Notez tout comportement anormal ou anomalie corporelle constaté au cours de la procédure. Une fois que les souris se remettent en mouvement, placez-les dans leurs cages.
REMARQUE : Vérifiez l’intensité BLI pour chaque image acquise. Une fois l’acquisition terminée, l’image bioluminescente enregistrée et la photographie seront affichées sur le logiciel avec une échelle automatique qui ne doit pas être prise en compte. Définissez l’échelle définie dans l’analyse des données (décrite ci-dessous) dans la fenêtre Palette d’outils .
6. Analyse des données
REMARQUE : Le protocole ci-dessus est basé sur un logiciel d’imagerie in vivo commercial. Cependant, une version sans licence du logiciel peut effectuer l’analyse la plus élémentaire. Les détails du logiciel se trouvent dans la table des matériaux.
- Ouvrez les fichiers.
- Ouvrez le dossier qui contient les données acquises à partir d’un certain point temporel de l’imagerie en sélectionnant Menu Fichier > Navigateur > Sélectionnez le dossier (Figure 2A - Étape 1).
REMARQUE : Une nouvelle fenêtre s’ouvrira sous forme de tableau avec toutes les données acquises enregistrées dans le fichier choisi. Il affichera le signe du numéro de clic , qui est l’ID de l’image automatiquement donné par le logiciel (données et numéros d’heure), les informations fournies par le chercheur dans la fenêtre Étiquettes d’image lors de l’acquisition et les paramètres d’acquisition. Toutes ces données permettent de trier les images qui peuvent être utilisées dans l’analyse, étant donné qu’il ne faut pas utiliser d’images saturées. - Sélectionnez plusieurs lignes associées aux images choisies, y compris les contrôles non infectés. Notez l’ID de l’image dans le cahier de laboratoire avec les informations enregistrées pendant la session d’imagerie.
- Assemblez les images sélectionnées en cliquant sur Charger en tant que groupe. Cette procédure crée une nouvelle image de séquence. Par conséquent, il est possible d’ajuster les fonctionnalités de toutes les images simultanément. Enregistrez la nouvelle image de séquence dans un nouveau dossier différent de celui utilisé à l’étape 6.1 pour faciliter la réanalyse des données brutes si nécessaire.
- Dans l’image de la séquence, identifiez le regroupement utilisé pour chaque image en cliquant sur Options > Afficher > Sélectionner le facteur de regroupement (Figure 2A - Étape 2). Le facteur de compartimentage acquis sera affiché en haut de chaque image de la séquence.
- Corrigez tous les facteurs de compartimentage au même nombre. Pour ce faire, double-cliquez sur l’image à ajuster. Dans la fenêtre Palette d’outils > section Réglage de l’image , choisissez le facteur de regroupement approprié (Figure 2A - Étape 3) - voir l’étape 5.18 pour le choix du facteur de regroupement. Effectuez cette procédure sur toutes les images divergentes.
REMARQUE : Cette procédure influence directement la quantification de l’INB (tableau 1) et est abordée plus en détail dans la section Discussion.
- Ouvrez le dossier qui contient les données acquises à partir d’un certain point temporel de l’imagerie en sélectionnant Menu Fichier > Navigateur > Sélectionnez le dossier (Figure 2A - Étape 1).
- Réglez l’échelle.
- Distinguer le signal bioluminescent valide (supérieur à 600 points selon le manuel de l’appareil) en fonction de la commande non infectée. Pour cela, double-cliquez sur l’image des souris non infectées. Ensuite, dans le coin supérieur gauche de la nouvelle fenêtre, sélectionnez l’option Nombre dans le champ Unités . Ensuite, ajustez l’échelle de couleurs pour la valeur minimale de 600. L’image résultante sera la ligne de base pour définir l’échelle minimale de luminance.
- Avec la fenêtre de séquence active, sélectionnez l’option Radiance dans le champ Unités . Ajustez l’échelle de couleurs et la table des couleurs dans la palette d’outils. Pour cela, désactivez la case Individuel dans la zone Limites de l’échelle de couleurs .
- Cochez les cases Échelle logarithmique et Manuel (Figure 2A - Étape 4). Réglez les numéros d’échelle minimaux en fonction du témoin non infecté (comme observé à l’étape 6.8) et la zone avec le signal le plus élevé comme maximum (comme indiqué à la figure 2A par les flèches).
REMARQUE : Le rendement de la lumière 2D in vivo est une quantification relative. Différentes valeurs d’échelle peuvent être trouvées en raison des différences dans la version et l’étalonnage de chaque appareil. Par conséquent, les valeurs démontrées dans les résultats représentatifs ne pourraient pas correspondre à d’autres expériences réalisées sur d’autres dispositifs et pourtant être tout aussi valables selon les contrôles internes (non infectés et infectés non traités). - Après avoir défini la même échelle pour toutes les images, double-cliquez sur chaque image, agrandissez la fenêtre et exportez la vue de l’image dans un format d’image (.jpg, .tiff, etc.) à l’aide du bouton Exporter les graphiques , en nommant les fichiers par treatment_miceID_time point. (Figure 2A - Étape 5). Effectuez cette procédure pour toutes les images.
- Effectuer des mesures.
- Choisissez n’importe quelle image de la séquence et double-cliquez dessus. Dans la fenêtre Palette d’outils > section Outils de retour d’intérêt , cliquez sur le bouton Carré (Figure 2B - Étape 1) et tracez un rectangle couvrant l’ensemble de la souris.
- Cliquez sur la bordure du retour sur investissement créé et copiez et collez le même retour sur investissement pour chaque souris (ce qui donne trois points d’intérêt dans l’image). Enregistrez les retours sur investissement en cliquant sur Enregistrer dans la section Outils de retour sur investissement. Appliquez les retours d’investissement enregistrés pour toutes les images en cochant la case Appliquer à la séquence, puis cliquez sur Charger. Les retours d’expérience enregistrés seront utilisés pour toutes les souris de l’ensemble de l’expérience.
- Ajustez la position ROI dans chaque souris pour mieux adapter l’animal à la zone de mesure. Lorsque toutes les souris sont étiquetées, cliquez sur le bouton Mesurer les retours sur investissement (Figure 2B - Étape 2). Le tableau des mesures du retour sur investissement s’affiche. Sélectionnez les types de mesure : Radiance ; Attributs de l’image : toutes les valeurs possibles ; ROI Dimensions : cm. Ensuite, cliquez sur le bouton Sélectionner tout , puis sur le bouton Copier .
- Collez les données directement dans un logiciel d’analyse de tables (tableur). Vous pouvez également exporter un fichier au format .csv ou .txt.
- Travaillez sur les données.
- Dans un logiciel d’analyse de tableaux, organisez les données par groupes (traitement, contrôle non infecté, non traité, etc.).
- La charge parasitaire est représentée par la bioluminescence du corps entier. Par conséquent, organisez les données pour qu’elles correspondent aux valeurs de flux total ventral et dorsal des mêmes souris et additionnez-les.
- Calculer la moyenne et l’écart-type des valeurs additionnées en tenant compte de chaque groupe (par exemple : tableau supplémentaire 1). Tracez les données dans un logiciel de graphiques et de statistiques.
- Préparez un panneau avec des images bioluminescentes dans un logiciel de présentation d’images ou de diapositives. Placez chaque souris dans une colonne et chaque point temporel de la ligne pour créer une matrice d’efficacité du médicament afin de faciliter la visualisation et l’interprétation des données.
REMARQUE : Il est possible de créer les images directement dans le logiciel d’imagerie sans effectuer l’étape 6.2.4 (Affichage > fenêtre de mise en page d’image). Cependant, l’interface et les outils du logiciel limitent l’organisation des données.
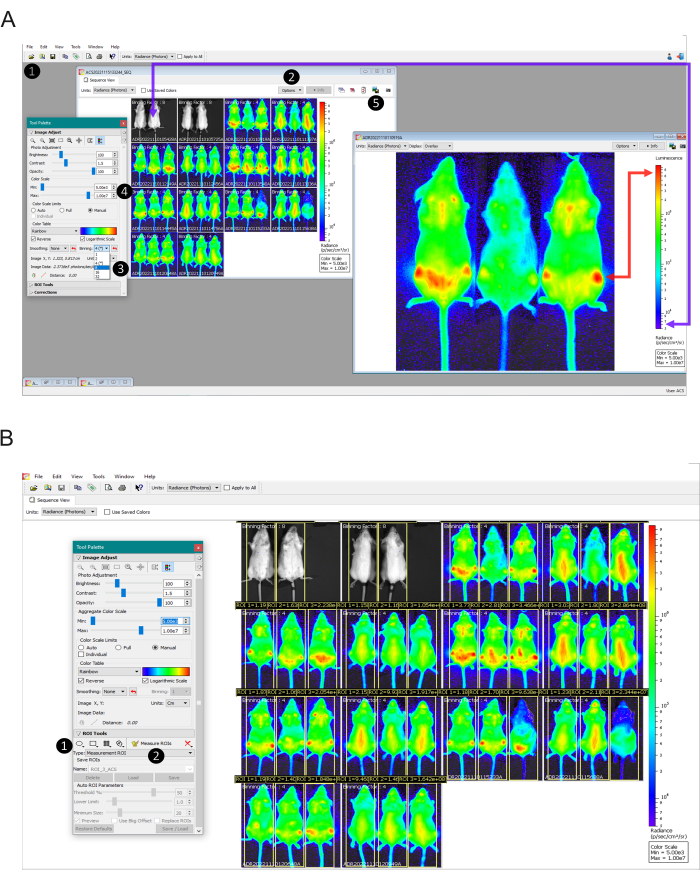
Figure 2 : Étapes d’analyse des données, de la définition des échelles d’image à la quantification de la luminescence. (A) Vue du logiciel d’image vivante pour le traitement des données d’image. Étape 1 : Téléchargez les données acquises sous forme de séquence à l’aide de l’outil Navigateur. Étape 2 : Identifiez le binning utilisé pour chaque acquisition (apparaîtra au-dessus des images individuelles). Étape 3 : Réglez toutes les images de souris infectées sur le même facteur de binning et appliquez le facteur de binning 16 pour les souris non infectées. Étape 4 : Réglez manuellement l’échelle de couleurs en fonction des souris non infectées (flèche violette), qui doivent être vues à l’écran comme non bioluminescentes, et des souris infectées et non traitées aux foyers bioluminescents les plus élevés (flèche rouge), qui doivent être vus en rouge. Étape 5 : Pour obtenir une image exempte de toute information écrite, double-cliquez sur chaque image et exportez l’image à l’aide du bouton Exporter les graphiques. (b) Outils de visualisation des régions d’intérêt (ROI). Étape 1 : Dessinez un ROI couvrant entièrement une souris et copiez-collez le même ROI pour chaque animal. Enregistrez les retours sur investissement ajustés et appliquez-les à toutes les images de l’expérience. Étape 2 : Cliquez sur le bouton Mesurer les retours sur investissement pour générer le tableau à exporter en tant que .csv ou .txt. Veuillez cliquer ici pour voir une version agrandie de cette figure.
7. Procédure ex vivo
- Injecter 150 mg/kg de D-luciférine i.p. dans la souris (un par cycle ex vivo ) et attendre 3 min. Anesthésier les souris à l’aide de 100 mg/kg de kétamine et de 10 mg/kg de xylazine i.p.
- Dans une enceinte de sécurité biologique, lorsque la souris est complètement insensible au pincement des pattes, coupez la peau de la souris pour exposer le péritoine (sans ouvrir la cavité péritoine) et le tissu de l’axillaire gauche. Procédez à l’exsanguination en coupant l’artère axillaire et le vaisseau.
- Prélevez le sang à l’aide d’une pipette Pasteur jetable. Ensuite, perfuser 10 ml de 0,3 mg/mL de D-luciférine dans une solution de DPBS à travers le ventricule gauche du cœur.
- Disposez les organes sélectionnés à des endroits préétablis sur une boîte de Pétri et faites-les tremper dans une solution de d-luciférine à 0,3 mg/ml. Cette procédure doit être effectuée dans un délai de 30 minutes maximum.
- Obtenir l’image luminescente des organes excisés (cœur, poumons, thymus, foie, muscle quadriceps, mésentère, rate, rein, glande surrénale, graisse viscérale, œsophage, estomac, intestin grêle, caecum, côlon, cerveau, graisse sous-cutanée, utérus, graisse gonadique, vessie et membrane péritoine) en utilisant 5 min de temps d’exposition et 16 binning, en fonction de l’intensité du signal (les images saturées ne sont pas acceptables)22.
REMARQUE : La même procédure doit être effectuée sur une souris non infectée avant les souris infectées pour définir le seuil.
Résultats Représentatifs
En utilisant un modèle murin adéquat basé sur des parasites transgéniques qui expriment constitutivement la luciférase, il est possible de reproduire les principales caractéristiques de l’infection humaine à T. cruzi causant un minimum de dommages à l’hôte, permettant un suivi en temps réel des parasites par BLI du corps entier de l’hôte de manière longitudinale (à vie), jusqu’à plusieurs mois12.
La figure 3 montre une expérience pilote démontrant l’évolution temporelle de l’infection par CL Brener Luc ::Neon du jour 1 post-infection jusqu’à 150 dpi chez des souris BALB/c. Dans les premiers 20 dpi, la charge parasitaire déduite de la bioluminescence augmente, typique du pic de parasitémie, suivie d’une forte diminution de la charge parasitaire, en raison du contrôle immunitaire des souris. Ainsi, la phase aiguë de l’infection est considérée comme les premiers 50 dpi. La phase chronique est définie lorsque l’infection atteint un taux de bioluminescence constant, de 100 à 150 dpi.
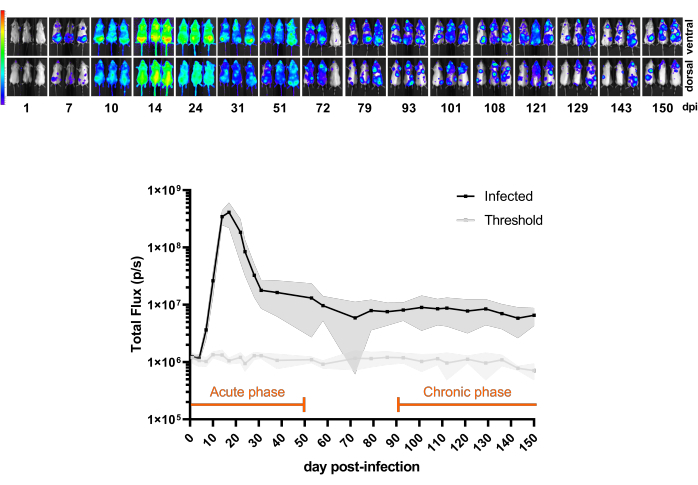
Figure 3 : Comprendre le modèle. Cinétique de l’infection à Trypanosoma cruzi CL Brener Luc ::Neon chez les souris BALB/c (n = 11). Panneau supérieur : images bioluminescentes ventrales et dorsales de différents points temporels pendant 150 jours post-infection (dpi) avec 1 x 10³ de trypomastigotes sanguins par injection intrapéritonéale. Échelle de la carte thermique (en Log10) du signal bioluminescent en radiance (p/s/cm2/sr). Code couleur : Violet = 5 x 103 ; rouge = 1 x 107. Panneau inférieur : quantification du signal bioluminescent en flux total (p/s) de souris corps entier. Les données sont exprimées sous forme de moyennes (lignes) et d’écarts-types (régions ombrées). Les périodes définies pour les phases aiguës et chroniques de l’infection dans ce modèle de souris sont surlignées en orange. Les valeurs moyennes de luminescence des souris non infectées (n = 3) sont indiquées par le seuil (ligne gris clair). Veuillez cliquer ici pour voir une version agrandie de cette figure.
Les résultats thérapeutiques peuvent également être prédits puisque les principales phases de l’infection sont bien reproduites dans un modèle murin. Ainsi, la BLI est maintenant appliquée à la science translationnelle par le biais d’études de preuve de concept qui soutiennent la prise de décision sur le potentiel d’efficacité des composés et la progression dans le pipeline de développement10,27. Dans le modèle murin aigu, le traitement oral doit commencer lorsque l’infection atteint le pic de parasitémie (environ 14-21 dpi), caractérisé par un nombre élevé de trypomastigotes dans la circulation sanguine (environ 1 x 105 trypomastigotes/mL - données non présentées) et une infection systémique. Dans la phase chronique, le traitement des souris commence à 100 dpi, lorsque la charge parasitaire est comparativement beaucoup plus faible, avec une parasitémie subpatente stable.
Pour démontrer l’application du protocole décrit ci-dessus dans l’évaluation des agents antiparasitaires, nous avons comparé l’efficacité thérapeutique du benznidazole (BZ), le médicament standard utilisé pour le traitement de la maladie de Chagas, et du posaconazole (Posa), un inhibiteur de la stérol 14α-déméthylase (CYP51) qui a échoué dans les essais cliniques pour la maladie de Chagas, et qui s’est également avéré inefficace en tant qu’agent antiparasitaire contre T. cruzi in vitro et in vivo, y compris dans le modèle BLI décrit dans le présent protocole 13,18,28,29,30.
Pour le modèle de souris aiguë, des cohortes de 6 souris par groupe ont été traitées par voie orale par gavage31 pendant 20 jours avec Posa à 20 mg/kg ou BZ à 100 mg/kg, une fois par jour. Des souris ont également été traitées avec du BZ pendant 5 jours à raison de 100 mg/kg une fois par jour afin d’évaluer l’effet des traitements courts. Après l’élimination du composé (10 jours après la fin du traitement), les souris BLI négatives ont été immunosupprimées, une condition qui favorise la rechute de l’infection lorsqu’une guérison parasitologique n’est pas obtenue (Figure 4A). Le traitement Posa a entraîné une réduction de 99,49 % ± 0,27 % (moyenne ± écart-type) de la charge parasitaire déduite par bioluminescence à la fin du traitement et est restée à des niveaux similaires à ceux des souris non infectées pendant la période d’élimination du composé médicamenteux (à l’exception de la souris #3, avec un signal transitoire à 40 dpi, et de la souris #2, qui a démontré un point BLI faible à 44 dpi). Par rapport au groupe non traité, le traitement BZ pendant 20 jours a réduit de 100 % ± 0,01 % la charge parasitaire induite par la bioluminescence à la fin du traitement. En revanche, le traitement court avec BZ pendant 5 jours a entraîné une réduction de 99,98 % ± 0,03 % à 19 dpi (similaire au niveau seuil). Cependant, dans ce cas, la réduction de l’IBB était transitoire et, dans les acquisitions subséquentes, toutes les souris présentaient une réactivation de l’infection (figure 4B).
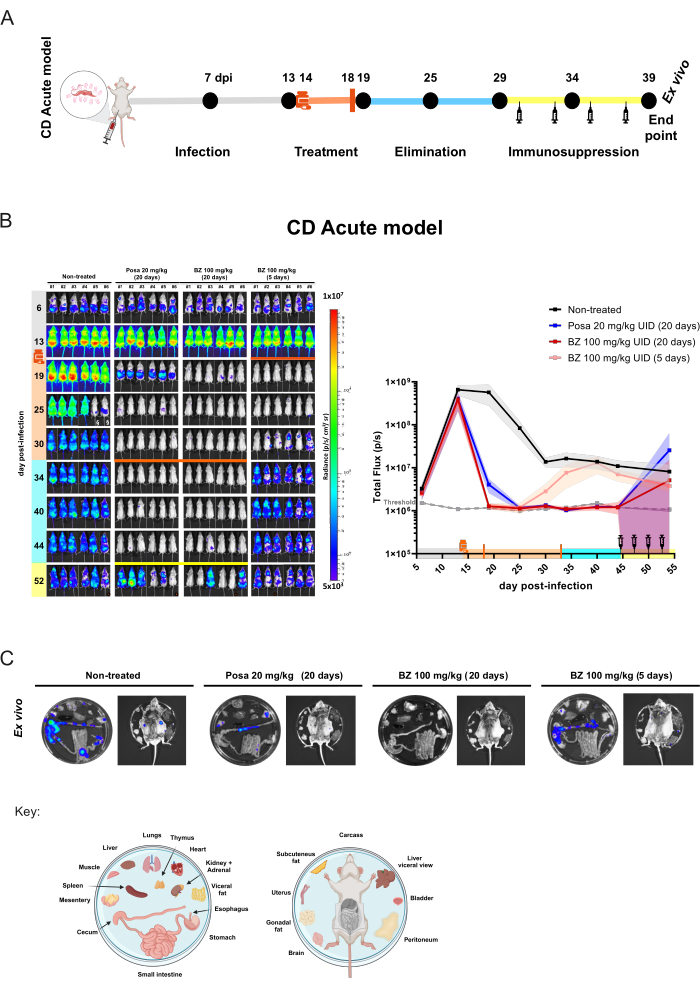
Figure 4 : Conception de l’expérience de preuve de concept et résultats obtenus avec l’imagerie par bioluminescence dans un modèle aigu de la maladie de Chagas. (A) Schéma du processus chronologique dans un modèle murin de la maladie de Chagas aiguë pour les études précliniques pour l’évaluation de l’efficacité du composé. Points noirs : images de points temporels. Fiole de médecine et barre orange : début et fin du traitement, respectivement. Icône de la seringue : injections de cyclophosphamide. DPP : jour post-infection. Code couleur : gris = infection non traitée ; orange = période de traitement ; bleu = phase d’élimination du composé ; jaune = période d’immunosuppression. (B) Évolution temporelle du traitement de Trypanosoma cruzi. Panneau de gauche : images de bioluminescence ventrale de souris BALB/c (i) non traitées ou traitées pendant 20 jours avec (ii) du posaconazole (Posa) à 20 mg/kg, (iii) du benznidazole (BZ) à 100 mg/kg traités pendant 20 jours et (iv) du BZ à 100 mg/kg traités pendant 5 jours avec (n = 6/groupe). Tous les traitements ont été administrés par voie orale par gavage (10 mL/kg) une fois par jour. La carte thermique à l’échelleLog 10 indique l’intensité du signal bioluminescent de bas niveau (bleu) à élevé (rouge). Graphique de droite : quantification du corps entier des données d’imagerie de bioluminescence. Les données sont exprimées sous forme de moyennes (lignes) et d’écarts-types (régions ombrées). Légende : Fiole de médecine : début du traitement (14 dpi) ; barre orange : fin de traitement (18 dpi/33 dpi) ; injections de cyclophosphamide à l’aide d’une seringue (du 44e au 53e jour) ; point orange : souris analysée par procédure ex vivo ; § données exclues en raison d’une fuite de D-luciférine dans l’urine. (C) Procédure ex vivo pour la détection des foyers de T. cruzi dans les organes et les tissus. La clé de distribution des plaques est présentée au bas de la figure (créée avec BioRender.com : ZY26LG8AOF). Même échelle de radiance que celle montrée dans le panneau in vivo. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Dans ce modèle, le traitement antiparasitaire peut réduire la charge parasitaire en dessous de la limite de détection BLI de 1000 parasites. Ainsi, les souris apparaissent comme BLI moins10. Pour s’assurer qu’une guérison parasitologique a été obtenue, il est nécessaire de promouvoir l’immunosuppression des souris à l’aide d’un traitement au cyclophosphamide29,32. Les souris qui ont encore une charge parasitaire indétectable après un traitement médicamenteux deviendront positives au BLI après l’immunosuppression. Cet effet est montré plus largement par le traitement Posa dans le modèle aigu, qui favorise la rechute du parasite. Dans cette expérience, la procédure ex vivo a été réalisée sur des souris avec le signal bioluminescent le plus faible pour évaluer le tropisme tissulaire du parasite (Figure 4C). Les souris non traitées présentent de forts signaux bioluminescents, en particulier dans le tractus gastro-intestinal (TGI) et les tissus associés tels que la graisse viscérale et le mésentère. De plus, la peau était un site associé à la persistance du parasite. Les souris traitées avec Posa présentaient des taches bioluminescentes de plus faible intensité qui étaient plus limitées au côlon, au mésentère et à la graisse viscérale. D’autre part, chez les souris traitées avec un régime de traitement curatif, comme BZ 100 mg/kg pendant 20 jours, aucun signal bioluminescent n’est détecté même en cas d’immunosuppression. Par conséquent, considérant qu’après avoir favorisé des conditions pour que le signal bioluminescent dépasse le niveau seuil de 1000 parasites10, et augmenté la sensibilité en exposant les organes viscéraux, on considère que BZ 100 mg/kg pendant 20 jours fournit une guérison stérile. L’évaluation de la guérison stérile a été préalablement validée par différentes techniques 10,13,17,33,34.
Un plan d’étude similaire a été appliqué au modèle chronique (figure 5A), dans lequel les souris (n = 6/groupe) ont commencé à être traitées au 100e jour après l’infection. À ce stade, Posa 20 mg/kg, BZ à 100 mg/kg ou 10 mg/kg une fois par jour ont été administrés par voie orale pendant 20 jours. Après la période d’élimination du médicament, les souris BLI négatives ont été immunosupprimées. De plus, pour évaluer la guérison stérile, les souris qui étaient encore BLI-négatives à la fin de la phase d’immunosuppression ont été soumises à une analyse ex vivo .
Dans les infections chroniques, le traitement avec Posa à 20 mg/kg a entraîné une diminution de 95,03 % ± 6,18 % de la charge parasitaire déduite de la bioluminescence à la fin du traitement et est resté à des niveaux similaires chez les souris non infectées pendant la période d’élimination du médicament. Après l’immunosuppression, la majorité des souris ont montré un niveau variable de signal et de distribution BLI (Figure 5B). La procédure ex vivo a révélé qu’une souris BLI négative du corps entier traitée avec Posa avait une tache bioluminescente dans le côlon détectable par examen ex vivo (Figure 5C).
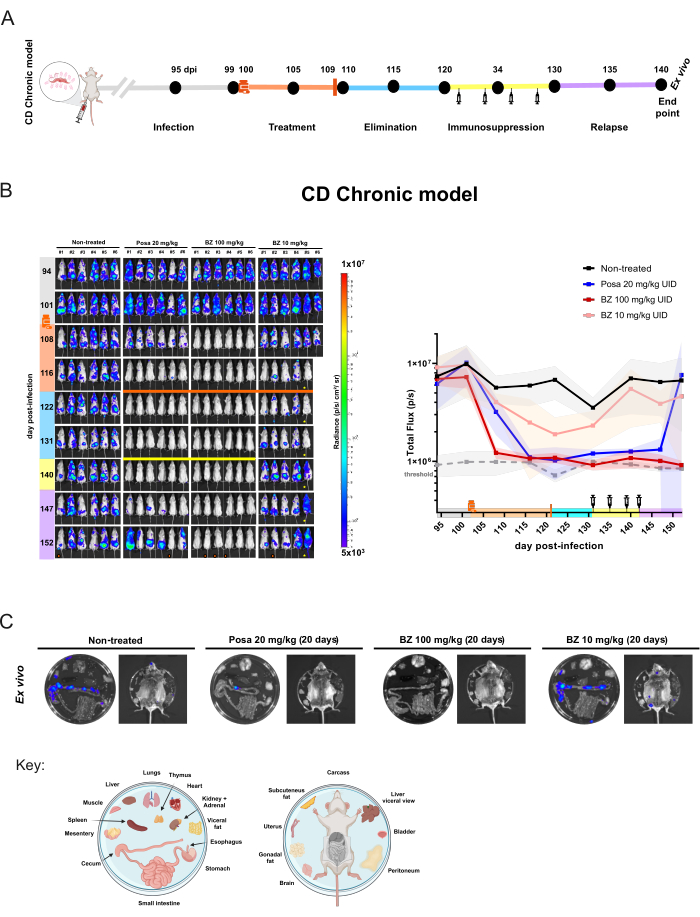
Figure 5 : Conception de l’expérience d’évaluation des médicaments et résultats obtenus dans le modèle chronique de l’infection à Trypanosoma cruzi par imagerie par bioluminescence. (A) Schéma de conception d’expérience d’un modèle murin de maladie de Chagas chronique. Points noirs : images de points temporels. Fiole de médecine et barre orange : début et fin du traitement, respectivement. Icône de la seringue : injections de cyclophosphamide. Dpi : jour post-infection. Code couleur : Gris = infection non traitée ; orange = période de traitement ; bleu = phase d’élimination du composé ; jaune = immunosuppression ; lilas = rechute. (B) Évaluation longitudinale de l’efficacité du traitement dans le modèle chronique de la maladie de Chagas. Panneau gauche : BLI ventral de souris BALB/c (i) non traitées ou traitées pendant 20 jours avec (ii) posaconazole (Posa) à 20 mg/kg ; (iii) benznidazole (BZ) à 100 mg/kg, et (iv) BZ à 10 mg/kg (n = 6/groupe). Tous les traitements ont été administrés par voie orale par gavage une fois par jour. Graphique de droite : somme des données brutes de flux total ventral et dorsal. Légende : fiole de médecine : début du traitement (102 dpi) ; barre orange : fin de traitement (121 dpi) ; Barre jaune et icône de seringue : injections de cyclophosphamide (du jour 131 au jour 142). Point orange : souris analysée par procédure ex vivo. ! La souris est morte pendant l’anesthésie.  La souris présente des anomalies abdominales. L’échelle de la carte thermique (Log10) indique l’intensité de bioluminescence en unité de luminance de niveau faible (3 × 10,5 en bleu) à élevée (1 × 10,7 en rouge). (C) Analyse ex vivo du tropisme de T. cruzi dans les tissus. Détection par bioluminescence d’organes excisés chez des souris immunodéprimées in vivo BLI-négatives après traitement avec Posa et BZ à 100 mg/kg ou des souris avec le signal le plus faible dans les groupes non traités et BZ à 10 mg/kg. La clé de distribution des plaques est illustrée au bas de la figure (créée avec BioRender.com : ZY26LG8AOF). L’échelle de radiance est égale à celle d’un panneau in vivo. Veuillez cliquer ici pour voir une version agrandie de cette figure.
La souris présente des anomalies abdominales. L’échelle de la carte thermique (Log10) indique l’intensité de bioluminescence en unité de luminance de niveau faible (3 × 10,5 en bleu) à élevée (1 × 10,7 en rouge). (C) Analyse ex vivo du tropisme de T. cruzi dans les tissus. Détection par bioluminescence d’organes excisés chez des souris immunodéprimées in vivo BLI-négatives après traitement avec Posa et BZ à 100 mg/kg ou des souris avec le signal le plus faible dans les groupes non traités et BZ à 10 mg/kg. La clé de distribution des plaques est illustrée au bas de la figure (créée avec BioRender.com : ZY26LG8AOF). L’échelle de radiance est égale à celle d’un panneau in vivo. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Le traitement avec BZ à 100 mg/kg a réduit la bioluminescence à des niveaux seuils (93,87 % ± 2,14 %) à 122 dpi et au-delà jusqu’à la fin de l’expérience. Si l’on considère l’analyse ex vivo , BZ a atteint un taux de guérison de 100% (6/6 souris), car aucune souris n’a présenté un retour de signal bioluminescent même lorsque les organes immunodéprimés et internes ont été examinés. Cela signifie qu’il n’y a pas de rechute. Néanmoins, le schéma de traitement BZ avec une concentration plus faible a entraîné une légère réduction de la bioluminescence (85,95 % ± 18,43 %), mais aucun remède, car les souris ont continué à montrer des foyers de signal bioluminescents détectables à tous les points temporels ultérieurs. Ainsi, ce modèle permet une différenciation quantitative entre les traitements inefficaces (posaconazole et traitement sous-optimal au benznidazole) et les traitements efficaces (dosage optimal et durée du traitement au benznidazole).
Figure supplémentaire 1 : Analyse pré-infection de l’expression de la luciférase dans la population de T. cruzi par mesure de la fluorescence du gène rapporteur mNeonGreen. Cytométrie en flux de la protéine fluorescente mNeonGreen exprimée constitutivement par le parasite CL Brener Luc ::Neon. Histogramme normalisé du nombre de parasites (axe Y) par l’intensité de fluorescence mNeonGreen (axe X). La légende interne montre la souche et la forme analysées, la médiane de fluorescence et le pourcentage de la population de fluorescence. Les lignes de grille sont définies par la souche de type sauvage (WT) de CL Brener comme contrôle non fluorescent. Veuillez cliquer ici pour télécharger ce fichier.
Tableau supplémentaire 1 : Exemple de table d’analyse dans la mesure BLI. Données brutes obtenues à partir de la quantification par imagerie par bioluminescence du 19e jour post-infection dans le modèle aigu utilisé dans les résultats représentatifs présentés à la figure 4B. Description des groupes : Témoin en tant que souris non infectées (n = 3/groupe) ; véhicule comme des souris infectées non traitées ; posaconazole (Posa) à 20 mg/kg pendant 20 jours ; benznidazole (BZ) à 100 mg/kg pendant 20 jours ; BZ à 100 mg/kg traité pendant 5 jours (n = 6/groupe). Veuillez cliquer ici pour télécharger ce fichier.
Discussion
L’imagerie par bioluminescence est une méthode révolutionnaire qui permet de détecter un gène rapport à l’aide d’un spectre visible et infrarouge de rayonnement électromagnétique. Par conséquent, il n’est pas nécessaire d’utiliser des marqueurs radiomarqués pour tracer votre échantillon35. BLI convient aux modèles de rongeurs et à d’autres petites espèces. Il est très utile pour les études précliniques car il est plus sûr et permet plusieurs tours d’image, causant un minimum d’inconfort chez les animaux. De plus, l’imagerie in vivo est très flexible en raison de la possibilité de combiner la bioluminescence, la fluorescence et d’autres techniques telles que la tomographie par émission de positons36.
L’imagerie optique est régie par des propriétés physiques optiques, comme l’absorption et la diffusion. Tous les tissus absorbent et diffusent différemment la lumière de longueurs d’onde distinctes37. Une étape critique consiste à sélectionner un gène rapporteur sans tenir compte de la longueur d’onde émise de la lumière produite par la réaction chimique. Bien que le niveau d’expression d’un gène rapporteur puisse être élevé in vitro dans les essais bioluminescents, les mêmes niveaux d’expression peuvent ne pas être atteints lors de la progression vers le réglage in vivo. Dans ce protocole, nous avons utilisé la version optimisée pour le codon de Photinus pyralis luciferase (PpyRE9H)38 décalée vers le rouge pour les trypanosomatides9, qui émet de la lumière à 617 nm, l’une des plus appropriées pour les études in vivo 39. Les longueurs d’onde supérieures à 600 nm sont moins absorbées et diffusées par les chromophores endogènes du corps, en particulier l’hémoglobine et la mélanine. Ainsi, les lumières rouges peuvent être transmises à travers plusieurs centimètres de tissu, permettant aux photons d’atteindre la caméra CCD même depuis l’intérieur des tissus viscéraux39,40.
L’un des sujets de préoccupation dans les contextes d’imagerie est le manque de compréhension complète de leur fonction et de leurs effets. Le binning, une technique de prétraitement, combine les informations acquises par des détecteurs contigus dans un pixel plus grand. Ce processus améliore le rapport signal/bruit, réduisant le bruit de fond et améliorant la sensibilité. Cependant, il diminue la précision de la résolution spatiale, ce qui donne une image pixélisée41,42. Ce compromis est un élément important à prendre en compte dans votre stratégie d’imagerie.
Basée sur le profil de produit cible et le profil candidat cible pour la maladie de Chagas34, l’étude de preuve de concept est axée sur la sensibilité pour détecter T. cruzi et aider à établir si un nouveau candidat médicament peut obtenir une guérison stérile (représentée par l’absence de rechute après plusieurs cycles d’immunosuppression). Par conséquent, nous exécutons le BLI en utilisant le facteur de binning le plus élevé sans suraturer l’image. Lorsque l’image est saturée, une nouvelle acquisition est effectuée à l’aide d’un facteur de regroupement inférieur. Au cours de l’analyse, une correction mathématique est appliquée aux images qui nécessitent un regroupement différent. De cette façon, les données finales doivent être présentées à l’aide du même compartimentage. Le tableau 1 montre les différentes valeurs obtenues lorsque des facteurs de compartimentage distincts ont été appliqués dans la même image et les mêmes ROI.
Tableau 1 : Influence des paramètres de compartimentage sur la quantification du BLI. Quantification de trois ROI sur l’image du modèle aigu (d13) et du modèle chronique (d118), analysés dans différents facteurs de binning. Veuillez cliquer ici pour télécharger ce tableau.
En raison du scénario actuel de la maladie de Chagas en clinique, les efforts de découverte de médicaments visent à éliminer complètement les parasites (guérison parasitologique)27,34. Par conséquent, le protocole préclinique in vivo comprend des approches qui surmontent les limites de la sensibilité technique du BLI. L’une des approches consiste à traiter les souris avec du cyclophosphamide pour diminuer la réponse immunitaire qui contrôle la charge parasitaire. Une autre stratégie consiste à diminuer la profondeur des tissus et à éliminer les couches de muscles, de peau et de fourrure qui obstruent le chemin de la lumière vers l’appareil photo. Grâce à la procédure ex vivo, de petites taches bioluminescentes peuvent être détectées, révélant des foyers parasitaires inférieurs au seuil BLI in vivo, comme le montre la figure 5C résultant ex vivo de souris traitées par Posa.
La conception d’une expérience pilote pour évaluer le modèle lui-même et la dynamique de l’infection est cruciale pour établir une expérience précise d’évaluation de l’efficacité des médicaments antiparasitaires. Par conséquent, le chercheur sera en mesure de définir à l’avance les paramètres BLI appropriés et l’évolution du temps d’infection. Dans une expérience exploratoire, un outil qui peut être utile pour définir les paramètres d’acquisition est l'« exposition automatique ». À l’aide de cet outil, le chercheur établit la priorité de trois paramètres (Temps d’exposition, Binning et F/Stop) pour acquérir la meilleure image possible. En particulier, le chercheur doit s’assurer que les images sont acquises dans la plage dynamique de la caméra CCD, sans sursaturation ni sous-exposition, qui peut être vérifiée à travers les limites minimales et maximales de l’échelle et la fonction d’exposition automatique (Menu Édition > Préférences > Acquisition des onglets > Onglet Autoexposition). Dans ce protocole, l’ouverture de l’appareil photo a été réglée à la valeur maximale (F/Stop : 1), et différents temps d’exposition et facteurs de binning ont été définis pour les modèles aigus et chroniques. Ces paramètres permettent de prévoir le temps pour effectuer simultanément différents tours d’image. Étant donné que la méthode du rapporteur est basée sur une réaction enzymatique, la biodistribution du substrat dans la souris et la cinétique de la luciférase influencent le signal bioluminescent et, par conséquent, la quantification de l’infection (Figure 1B). Par conséquent, l’acquisition d’images à différents moments de la cinétique enzymatique introduit une variabilité des données qui ne peut être prise en compte ou corrigée et impacte le calcul du flux total (photons/seconde) ou de la luminance (photons/seconde/cm2/stéradian). De plus, l’infection à T. cruzi présente un positionnement spatial dynamique chez la souris (différentes zones et tissus, profondeur et charge parasitaire). Par conséquent, l’établissement d’une valeur de comptages à acquérir pourrait manquer des sources de signal plus faibles (faible nombre de parasites à un certain endroit plus profond dans le tissu) si la source d’un autre signal plus fort répond aux critères d’auto-exposition définis.
Une fonctionnalité délicate du logiciel Living Image est l’affichage de l’image acquise dans une échelle de couleurs automatique. Il n’est pas possible de prérégler l’échelle pour afficher automatiquement une toute nouvelle image acquise en fonction des valeurs d’échelle sélectionnées (voir l’étape 6.2 du protocole). Cette situation oblige le chercheur à modifier manuellement les images une par une aux valeurs max et min choisies. Par conséquent, les utilisateurs non expérimentés et mal formés ne disposent pas d’une lecture correcte pendant la session d’acquisition, et ils peuvent induire les données en erreur ou perdre des informations importantes à ce moment-là. Pour cela, l’expérience pilote est bénéfique.
L’une des questions les plus courantes concernant la conception de l’expérience de preuve de concept est de savoir comment choisir la durée et la dose du traitement. Pour les nouvelles entités chimiques, ces paramètres sont généralement définis par l’activité et la sélectivité du composé in vitro, en combinaison avec les données générées par le métabolisme et la pharmacocinétique des médicaments (DMPK) et les études de tolérabilité menées avant les tests d’efficacité in vivo. En résumé, après avoir identifié des composés capables de tuer sélectivement le parasite à l’intérieur des cellules, les premières expériences ADME (absorption, distribution, métabolisme et excrétion) sont réalisées in vitro pour estimer la solubilité aqueuse, la perméabilité cellulaire et la stabilité métabolique des composés, entre autres paramètres. Si les composés présentent un bon équilibre entre les propriétés in vitro (généralement définies dans les profils candidats cibles), ces candidats sont ensuite soumis à des études de pharmacocinétique (PK) in vivo chez des souris saines, qui décrivent l’exposition du composé dans le sang (et éventuellement aussi dans les tissus) et donnent une idée générale de la tolérabilité à différents niveaux de dose17, 34 et 43. Idéalement, l’objectif de l’évaluation pharmacocinétique dans la plupart des maladies infectieuses est de déterminer s’il est possible d’atteindre des concentrations plasmatiques libres (corrigées de la liaison aux protéines plasmatiques) supérieures aux concentrations EC50/EC90 44 - la concentration efficace qui tue ou au moins inhibe la croissance de 50 % ou 90 % des parasites, respectivement - pendant une période suffisamment longue. Si l’exposition est suffisante à un certain niveau de dose, ce schéma peut être utilisé lors des études d’efficacité en utilisant le modèle BLI de Chagas. Pour les études de repositionnement de médicaments, des données pharmacocinétiques in vitro et in vivo doivent être disponibles. Les bases de données chimiques telles que PubChem45 constituent un bon point de départ pour le reprofilage des médicaments, qui fournissent des données reconnues qui peuvent être converties en souris à l’aide de l’échelle allométrique46 pour estimer les schémas de traitement sûrs et non toxiques à tester. Cependant, ce n’est pas toujours le cas. Les études pharmacocinétiques sont encore un domaine négligé dans la science universitaire, et peu d’entreprises pharmaceutiques publient leurs résultats pharmacocinétiques. La communauté scientifique de la découverte de médicaments recommande d’inclure l’évaluation pharmacocinétique in vivo ainsi que les tests d’efficacité des médicaments (pharmacodynamique)47. Par conséquent, l’imagerie préclinique est compatible avec les mesures simultanées de composés, et cette approche associée améliore la robustesse des données.
De plus, la manipulation, le poids et l’état de santé des souris sont surveillés tout au long de l’expérience. Les signes de toxicité et les effets secondaires tels que la courbure, les tremblements, la perte d’équilibre, la réticence à bouger, la réticence à manger ou à boire, la prostration ou toute autre anomalie présente dans le groupe ou par des affections individuelles chez la souris doivent être enregistrés et signalés dans les études précliniques. L’un des objectifs de l’imagerie optique est d’assurer le bien-être des animaux. Ainsi, des critères d’évaluation sans cruauté doivent être appliqués chez les souris présentant des signes de douleur décrits sur l’échelle de Grimace48. De plus, les souris ont été pesées chaque semaine lors de l’acquisition de BLI et, plus souvent, lors de l’administration de médicaments et du traitement CTX. Conformément à la réglementation sur le bien-être animal, les souris qui perdent plus de 20 % de leur poids corporel doivent être immédiatement euthanasiées sans cruauté.
Le modèle bioluminescent de T. cruzi est aujourd’hui le modèle expérimental de pointe pour la découverte et le développement de nouveaux traitements contre la maladie de Chagas. Un modèle qui reproduit les principales caractéristiques de l’infection à T. cruzi et de la maladie de Chagas49, permettant de surveiller en temps réel la parasitémie et la différenciation de composés avec des profils d’efficacité variés associés à des modes d’action connus. BLI est une technique qui renforce l’affirmation de soi dans l’identification des tissus infectés. Il permet la sélection précise des tissus infectés à utiliser dans un large éventail d’approches, y compris toutes les méthodes classiques déjà appliquées dans la recherche sur T. cruzi 50,51. De plus, il permet aux chercheurs d’explorer des technologies de pointe et d’en développer de nouvelles33. De plus, BLI permet une amélioration du bien-être animal et une utilisation plus rationnelle selon les principes 3R 10,35, tout à la fois.
Plusieurs groupes de recherche axés sur les maladies tropicales négligées sont placés dans des pays où les appareils d’imagerie in vivo ne sont pas disponibles. Pour surmonter le scénario actuel, de nouveaux réseaux internationaux tels que Global BioImaging et leurs consortiums associés promeuvent des actions visant à fournir un accès ouvert aux plateformes d’imagerie et à améliorer la formation du personnel et des scientifiques en imagerie52,53. Ces initiatives, ainsi que des protocoles d’utilisation conviviaux comme celui-ci, peuvent offrir des conditions de démocratisation des technologies haut de gamme pour tous les chercheurs. La mise en œuvre de cette méthode dans la découverte préclinique de médicaments a offert une solide lecture de l’efficacité et une valeur prédictive des résultats cliniques, facilitant ainsi la découverte de médicaments pour la maladie de Chagas.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à déclarer.
Remerciements
Les auteurs remercient Amanda Franscisco, John Kelly et Fanny Escudié pour leur formation et leur soutien sur les tests d’efficacité des médicaments, John Kelly et Simone Calderano pour leur soutien dans les études sur les animaux. A.C.S a reçu une bourse CAPES PSDE pour une formation à la London School of Hygiene and Tropical Medicine (Royaume-Uni). Les auteurs tiennent également à remercier la plateforme de recherche en cytométrie en flux et en imagerie (FLUIR) de la plateforme de recherche scientifique de l’Université de São Paulo (CEFAP-USP) pour son soutien technique pour l’analyse de l’équipement IVIS Spectrum, et le Laboratoire de génétique et de contrôle sanitaire ICB-USP pour les tests post-expérimentation pour le contrôle de la qualité des souris en tant qu’exemptes d’agents pathogènes spécifiques. Ce projet a été financé par DNDi. DNDi est reconnaissante envers ses donateurs, publics et privés, qui ont financé toutes les activités de DNDi depuis sa création en 2003. Une liste complète des donateurs de DNDi se trouve à https://dndi.org/about/donors/.
matériels
| Name | Company | Catalog Number | Comments |
| BD LSRFortessa™ X-20 Cell Analyzer | BD Biosciences | ||
| Weighing Balance (animal facility) | Available from several suppliers | ||
| IVIS Spectrum In Vivo Imaging System | Revvity (former PerkinElmer) | ||
| FlowJ Software v10.7.1 | BD Biosciences | ||
| Living Image Software for Spectrum v4.7.1 | Revvity (former PerkinElmer) | License Free Analysis Software called 'Aura Imaging' could be used for the most basic features provided by Spectral Instruments Imaging (Bruker company) (https://spectralinvivo.com/software/) | |
| Microsoft Office software | Microsoft | ||
| GraphPad Prism v8.4.0 | GraphPad Software Inc. | ||
| DMEM Low Glucose | Vitrocell | D0025 | |
| Sodium bicarbonate | Sigma-Aldrich | S5761-500G | |
| Foetal Bovine Serum (FBS) | Gibco | 16000-044 | |
| Penicillin-Streptomycin | Gibco | 15140-122 | |
| Trypsin 0.5% EDTA | Gibco | 25300-062 | |
| LIT medium | In house | ||
| Hygromycin B (50 mg/mL) | Gibco | 10687010 | |
| Grace′s Insect Medium | Sigma-Aldrich | G9771 | |
| HEPES | Sigma-Aldrich | 54457 | |
| IVISBrite d-luciferin potassium salt | Revvity (former PerkinElmer) | 122799 | Also could be used: VivoGlo Luciferin, in vivo grade (Promega/P1043); D-Luciferin, Monopotassium Salt (Thermo Scientific/88293) or PierceD-Luciferin, Monosodium* Salt (Thermo Scientific/88291); D-Luciferin, Potassium Salt (GoldBio/LUCK or eLUCK); D-Luciferin, Sodium* Salt (GoldBio/LUCNA or eLUCNA) *Sodium or potassium salt differences relies minimal chances on solubility, however do not affect in vivo performance. |
| DPBS | Gibco | 21600-044 | |
| Cyclophosphamide (CTX) | Sigma-Aldrich | C0768-5g | |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | D5879 | |
| (Hydroxypropyl)methyl cellulose (HPMC) | Sigma-Aldrich | 09963-25G | |
| Benzyl alcohol | Sigma-Aldrich | 402834 | |
| Tween 80 | Sigma-Aldrich | P1754-1L | |
| Benznidazole | ELEA | ||
| Posaconazole (Noxafil commercial formulation) | Schering-Phough | ||
| Giemsa | Available from several suppliers | ||
| gavage needle (stainless-steel straight) - 22GA | Aton | CA2003 | |
| 1 mL Syringe and 31G needle | Available from several suppliers | ||
| 1 mL Syringe and removable 26G needle | Available from several suppliers | ||
| 1 mL Syringe and removable 24G X¾ needle | Available from several suppliers | ||
| Sterile Syringe Filter 0.2 µm | Available from several suppliers | ||
| A4 Matte Black paper 120gr or thicker | Paper Color/ Canson (Available from several suppliers) | ||
| aluminum foil | Available from several suppliers | ||
| Neubauer chamber | Available from several suppliers |
Références
- WHO fact sheet. Chagas disease (also known as American trypanosomiasis). WHO, World Health Organization Available from: https://www.who.int/news-room/fact-sheets/detail/chagas-disease (2023)
- Lee, B. Y., Bacon, K. M., Bottazzi, M. E., Hotez, P. J. Global economic burden of Chagas disease: a computational simulation model. Lancet Infect Dis. 13 (4), 342-348 (2013).
- Bern, C. Chagas' disease. N Engl J Med. 373 (5), 456-466 (2015).
- Shikanai-Yasuda, M. A., Carvalho, N. B. Oral transmission of Chagas disease. Clin Infect Dis. 54 (6), 845-852 (2012).
- Lidani, K. C. F., et al. Chagas disease: From discovery to a worldwide health problem. Front Public Health. 7, 166 (2019).
- Perez-Molina, J. A., Molina, I. Chagas disease. Lancet. 391 (10115), 82-94 (2018).
- Field, M. C., et al. Anti-trypanosomatid drug discovery: An ongoing challenge and a continuing need. Nat Rev Microbiol. 15 (7), 447 (2017).
- Kratz, J. M. Drug discovery for chagas disease: A viewpoint. Acta Trop. 198, 105107 (2019).
- McLatchie, A. P., et al. Highly sensitive in vivo imaging of Trypanosoma brucei expressing 'red-shifted' luciferase. PLoS Negl Trop Dis. 7 (11), e2571 (2013).
- Lewis, M. D., Francisco, A. F., Taylor, M. C., Kelly, J. M. A new experimental model for assessing drug efficacy against Trypanosoma cruzi infection based on highly sensitive in vivo imaging. J Biomol Screen. 20 (1), 36-43 (2015).
- Costa, F. C., et al. Expanding the toolbox for Trypanosoma cruzi: A parasite line incorporating a bioluminescence-fluorescence dual reporter and streamlined CRISPR/Cas9 functionality for rapid in vivo localisation and phenotyping. PLoS Negl Trop Dis. 12 (4), e0006388 (2018).
- Lewis, M. D., et al. Bioluminescence imaging of chronic Trypanosoma cruzi infections reveals tissue-specific parasite dynamics and heart disease in the absence of locally persistent infection. Cell Microbiol. 16 (9), 1285-1300 (2014).
- Francisco, A. F., et al. Limited ability of posaconazole to cure both acute and chronic Trypanosoma cruzi infections revealed by highly sensitive in vivo imaging. Antimicrob Agents Chemother. 59 (8), 4653-4661 (2015).
- du Sert, N. P., et al. The arrive guidelines 2.0: Updated guidelines for reporting animal research. PLoS Biol. 18 (7), e3000410 (2020).
- Turner, P. V., Brabb, T., Pekow, C., Vasbinder, M. A. Administration of substances to laboratory animals: routes of administration and factors to consider. J Am Assoc Lab Anim Sci. 50 (5), 600-613 (2011).
- Turner, P. V., Pekow, C., Vasbinder, M. A., Brabb, T. Administration of substances to laboratory animals: equipment considerations, vehicle selection, and solute preparation. J Am Assoc Lab Anim Sci. 50 (5), 614-627 (2011).
- Francisco, A. F., et al. Nitroheterocyclic drugs cure experimental Trypanosoma cruzi infections more effectively in the chronic stage than in the acute stage. Sci Rep. 6, 35351 (2016).
- Moraes, C. B., et al. Nitroheterocyclic compounds are more efficacious than CYP51 inhibitors against Trypanosoma cruzi: implications for Chagas disease drug discovery and development. Sci Rep. 4, 4703 (2014).
- Shaner, N. C., et al. A bright monomeric green fluorescent protein derived from Branchiostoma lanceolatum. Nat Methods. 10 (5), 407-409 (2013).
- de Araújo-Jorge, T. C., de Castro, S. L. . Chagas Disease: Manual for Animal Experimentation. , (2000).
- JoVE. JoVE Science Education Database. Anesthesia Induction and Maintenance. JoVE. , (2023).
- Taylor, M. C., et al. Exploiting genetically modified dual-reporter strains to monitor experimental Trypanosoma cruzi infections and host-parasite interactions. Methods Mol Biol. 1955, 147-163 (2019).
- Keyaerts, M., et al. Inhibition of firefly luciferase by general anesthetics: effect on in vitro and in vivo bioluminescence imaging. PLoS One. 7 (1), e30061 (2012).
- Jiron, J. M., et al. Comparison of isoflurane, ketamine-dexmedetomidine, and ketamine-xylazine for general anesthesia during oral Procedures in rice rats (Oryzomys palustris). J Am Assoc Lab Anim Sci. 58 (1), 40-49 (2019).
- GoldBio. GoldBio Luciferin In Vivo Handbook - a detailed method for Luciferin preparation and administration for model animals. GoldBio Protocol Available from: https://goldbio.com/documents/1068/Luciferin%20in%20vivo%20handbook.pdf (2013)
- Revity. Preparation of IVISbriteTM D-Luciferin for in vitro and in vivo bioluminescent assays. Revvity Standard Operate Procedure (Tech Notes) Available from: https://resources.perkinelmer.com/lab-solutions/resources/docs/SOP_LuciferinPrep_InVitroInVivo_BLI-Assays.pdf (2023)
- Chatelain, E., Scandale, I. Animal models of Chagas disease and their translational value to drug development). Expert Opin Drug Discov. 15 (12), 1381-1402 (2020).
- Khare, S., et al. Antitrypanosomal treatment with benznidazole is superior to posaconazole regimens in mouse models of Chagas disease. Antimicrob Agents Chemother. 59 (10), 6385-6394 (2015).
- Bustamante, J. M., Craft, J. M., Crowe, B. D., Ketchie, S. A., Tarleton, R. L. New, combined, and reduced dosing treatment protocols cure Trypanosoma cruzi infection in mice. J Infect Dis. 209 (1), 150-162 (2014).
- Molina, I., et al. Randomized trial of posaconazole and benznidazole for chronic Chagas' disease. N Engl J Med. 370 (20), 1899-1908 (2014).
- JoVE. Science Education Database. Compound Administration II. JoVE. , (2023).
- Pukhalsky, A. L., Toptygina, A. P., Viktorov, V. V. Immunosuppressive action of cyclophosphamide in mice: Contribution of some factors to determination of strain differences. Int J Immunopharmacol. 15 (4), 509-514 (1993).
- Francisco, A. F., et al. Comparing in vivo bioluminescence imaging and the Multi-Cruzi immunoassay platform to develop improved Chagas disease diagnostic procedures and biomarkers for monitoring parasitological cure. PLoS Negl Trop Dis. 16 (10), e0010827 (2022).
- Kratz, J. M., et al. The translational challenge in Chagas disease drug development. Mem Inst Oswaldo Cruz. 117, e200501 (2022).
- Youn, H., Hong, K. -. J. In vivo noninvasive small animal molecular imaging. Osong Public Health Res Perspect. 3 (1), 48-59 (2012).
- Refaat, A., et al. In vivo fluorescence imaging: success in preclinical imaging paves the way for clinical applications. J Nanobiotechnology. 20 (1), 450 (2022).
- Pirovano, G., Roberts, S., Kossatz, S., Reiner, T. Optical imaging modalities: Principles and applications in preclinical research and clinical settings. J Nucl Med. 61 (10), 1419-1427 (2020).
- Branchini, B. R., Southworth, T. L., Khattak, N. F., Michelini, E., Roda, A. Red- and green-emitting firefly luciferase mutants for bioluminescent reporter applications. Anal Biochem. 345 (1), 140-148 (2005).
- Zhao, H., et al. Emission spectra of bioluminescent reporters and interaction with mammalian tissue determine the sensitivity of detection in vivo. J Biomed Opt. 10 (4), 041210 (2005).
- O'Neill, K., Lyons, S. K., Gallagher, W. M., Curran, K. M., Byrne, A. T. Bioluminescent imaging: a critical tool in pre-clinical oncology research. J Pathol. 220 (3), 317-327 (2010).
- Mennel, L., et al. A photosensor employing data-driven binning for ultrafast image recognition. Sci Rep. 12 (1), 14441 (2022).
- Yoo, Y., Im, J., Paik, J. Low-light image enhancement using adaptive digital pixel binning. Sensors. 15 (7), 14917-14931 (2015).
- Moraes, C. B., et al. Accelerating drug discovery efforts for trypanosomatidic infections using an integrated transnational academic drug discovery platform. SLAS Discov. 24 (3), 346-361 (2019).
- Sebaugh, J. L. Guidelines for accurate EC50/IC50 estimation. Pharm Stat. 10 (2), 128-134 (2011).
- Kim, S., et al. PubChem 2023 update. Nucleic Acids Res. 51, D1373-D1380 (2023).
- Sharma, V., McNeill, J. H. To scale or not to scale: the principles of dose extrapolation. Br J Pharmacol. 157 (6), 907-921 (2009).
- Barrow, J. C., Lindsley, C. W. The importance of PK-PD. J Med Chem. 66 (7), 4273-4274 (2023).
- Langford, D. J., et al. Coding of facial expressions of pain in the laboratory mouse. Nat Methods. 7 (6), 447-449 (2010).
- Lewis, M. D., Kelly, J. M. Putting infection dynamics at the heart of Chagas disease. Trends Parasitol. 32 (11), 899-911 (2016).
- Brener, Z. Therapeutic activity and criterion of cure on mice experimentally infected with Trypanosoma cruzi. Rev Inst Med Trop Sao Paulo. 4, 389-396 (1962).
- Cummings, K. L., Tarleton, R. L. Rapid quantitation of Trypanosoma cruzi in host tissue by real-time PCR. Mol Biochem Parasitol. 129 (1), 53-59 (2003).
- . Global BioImaging Available from: https://globalbioimaging.org (2024)
- Pfander, C., et al. Euro-BioImaging - Interdisciplinary research infrastructure bringing together communities and imaging facilities to support excellent research. iScience. 25 (2), 103800 (2022).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon