Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Développement d’une électrode d’électromyographie épimysiale à faible coût : un flux de travail simplifié pour la fabrication et les tests
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Notre objectif était de fournir un guide mis à jour et facile à suivre sur la fabrication et les tests d’électrodes d’électromyographie épimysiale. À cette fin, nous fournissons des instructions pour l’approvisionnement en matériaux et une présentation détaillée du processus de fabrication et de test.
Résumé
L’électromyographie (EMG) est un outil de diagnostic précieux pour détecter les anomalies neuromusculaires. Les électrodes épimysiales implantables sont couramment utilisées pour mesurer les signaux EMG dans les modèles précliniques. Bien qu’il existe des ressources classiques décrivant les principes de la fabrication des électrodes épimysiales, il existe une rareté d’informations illustratives traduisant la théorie des électrodes en pratique. Pour remédier à cela, nous fournissons un guide mis à jour et facile à suivre sur la fabrication et le test d’une électrode épimysiale à faible coût.
Les électrodes ont été fabriquées en pliant et en insérant deux feuilles de platine-iridium dans une base en silicone prédécoupée pour former les surfaces de contact. Ensuite, des fils d’acier inoxydable revêtus ont été soudés à chaque surface de contact pour former les fils d’électrode. Enfin, un mélange de silicone a été utilisé pour sceller l’électrode. Des tests ex vivo ont été effectués pour comparer notre électrode fabriquée sur mesure à une électrode standard de l’industrie dans un bain salin, où des niveaux élevés d’accord du signal (sinus [corrélation intraclasse - ICC = 0,993], carré [ICC = 0,995], triangle [ICC = 0,958]) et temporel synchronisé (sinus [r = 0,987], carré [r = 0,990], triangle [r = 0,931]) ont été trouvés dans toutes les formes d’onde. De faibles niveaux d’impédance d’électrode ont également été quantifiés par spectroscopie d’impédance électrochimique.
Une évaluation de la performance in vivo a également été réalisée où le muscle vaste latéral d’un rat a été instrumenté chirurgicalement avec l’électrode fabriquée sur mesure et la signalisation a été acquise pendant la marche en montée et en descente. Comme prévu, l’activité maximale de l’EMG était significativement plus faible pendant la marche en descente (0,008 ± 0,005 mV) qu’en montée (0,031 ± 0,180 mV, p = 0,005), ce qui confirme la validité de l’appareil. La fiabilité et la biocompatibilité du dispositif ont également été soutenues par une signalisation cohérente pendant la marche horizontale à 14 jours et 56 jours après l’implantation (0,01 ± 0,007 mV, 0,012 ± 0,007 mV respectivement ; p > 0,05) et l’absence d’inflammation histologique. Collectivement, nous fournissons un flux de travail mis à jour pour la fabrication et le test d’électrodes épimysiales à faible coût.
Introduction
L’électromyographie (EMG) est un outil puissant pour étudier l’activité électrique du muscle. Les enregistrements EMG peuvent être particulièrement utiles dans les modèles animaux précliniques pour évaluer l’efficacité des interventions visant à traiter le dysfonctionnement neuromusculaire. Dans ces modèles, des électrodes biocompatibles implantables sont couramment utilisées pour évaluer l’interface neurophysiologique entre les motoneurones et les fibres musculaires. Ces électrodes implantables peuvent fournir des mesures localisées de l’excitation musculaire et peuvent être diverses en termes de configuration, de forme et de matériau, la conception optimale étant finalement dictée par l’emplacement et l’utilisation prévue.
Malgré leur aptitude à évaluer l’excitation musculaire dans des modèles précliniques, l’utilisation d’électrodes épimysiales peut être limitée par le coût. Par conséquent, de nombreux chercheurs utilisent des électrodes épimysiales fabriquées sur mesure qui sont produites en interne. Bien qu’il existe des ressources détaillant les considérations fondamentales de la fabrication, de l’essai et de l’utilisation des électrodes 1,2, il est nécessaire de disposer d’un guide d’instruction mis à jour détaillant l’approvisionnement, la fabrication et la validation des électrodes épimysiales à l’aide de méthodes modernes. S’appuyant sur les travaux fondamentaux de Loeb et Gans3 et d’autres en théorie des électrodes, nous présentons des instructions modernes sur l’approvisionnement et la fabrication d’électrodes épimysiales à faible coût et testons leurs performances dans une série d’expériences ex vivo et in vivo. L’objectif est d’offrir un guide convivial à d’autres membres de la communauté scientifique pour trouver, fabriquer et tester en interne des électrodes épimysiales à faible coût à usage animal, permettant une quantification plus large de l’excitation musculaire dans des modèles précliniques.
Dans ce protocole, nous fournissons un guide pédagogique sur l’approvisionnement, la fabrication et les tests d’électrodes épimysiales à usage animal dans le laboratoire d’électrophysiologie moderne. Les paramètres d’électrode choisis pour la fabrication, tels que la forme, les dimensions, la surface de contact, la distance entre électrodes, la longueur du câble, etc., ont été sélectionnés pour répondre à nos besoins expérimentaux et étaient comparables à une électrode épimysiale standard de l’industrie disponible dans le commerce (voir le tableau des matériaux). Nous encourageons d’autres groupes à modifier ces paramètres en fonction de leurs besoins, en plus de choisir une électrode standard fiable qui correspond à leur cas d’utilisation.
Dans le but de donner aux lecteurs une idée relativement rapide des performances des électrodes, nous fournissons également un exemple de protocole de test ex vivo avec la possibilité de mesurer l’impédance des électrodes. De plus, nous donnons un exemple d’évaluation des performances des électrodes in vivo. L’expérience ex vivo a comparé l’électrode fabriquée sur mesure à une norme industrielle dans un bain salin pour imiter des conditions physiologiques stables. L’impédance a également été évaluée ex vivo par spectroscopie d’impédance électrochimique (EIS). L’expérience in vivo a consisté en l’implantation chirurgicale de l’électrode fabriquée sur mesure dans le muscle vaste latéral (VL) d’un rat Long Evans femelle de 16 semaines (HsdBlu : LE, Envigo) pour mesurer le signal EMG dans des conditions connues pour susciter un signal haut ou bas (marche en montée, en descente). Pour évaluer la fiabilité de l’électrode fabriquée sur mesure, la signalisation EMG a été acquise pendant la marche à niveau après une récupération chirurgicale complète et avant le sacrifice (14 jours et 56 jours après l’implantation, respectivement). Une coloration à l’hématoxyline-éosine (H&E) a été effectuée sur le muscle instrumenté afin d’évaluer la biocompatibilité de l’électrode fabriquée sur mesure.
Access restricted. Please log in or start a trial to view this content.
Protocole
La procédure in vivo a été menée sous l’approbation de l’Institutional Animal Care & Use Committee de l’Université du Michigan (approbation de l’IACUC #PRO00010765) et conformément aux directives des National Institutes of Health sur le soin et l’utilisation des animaux de laboratoire.
1. Approvisionnement et fabrication des électrodes
REMARQUE : La figure 1 fournit un résumé de haut niveau de toutes les étapes de fabrication clés avec un lien QR qui fournit des instructions visuelles supplémentaires.
- Procurez-vous des matériaux d’électrode biocompatibles directement auprès du fabricant en vrac pour la fabrication. Voir le tableau des matériaux, qui contient tous les composants de l’électrode et des détails sur l’approvisionnement.
REMARQUE : Assurez-vous que la base de silicone, le mastic silicone et les feuilles de contact platine-iridium sont biocompatibles pour éviter une réponse immunitaire indésirable et permettre une implantation chronique. Pour soutenir les avantages économiques de la fabrication interne, nous présentons une analyse détaillée des coûts de l’électrode épimysiale fabriquée sur mesure par rapport à la norme de l’industrie (Tableau des matériaux). - Préparez le gabarit de coupe et de pliage (lime supplémentaire 1, lime supplémentaire 2). Utilisez un logiciel d’impression 3D sélectionné pour concevoir des gabarits de découpe et de pliage pour la production en série d’électrodes épimyliales identiques.
- Concevez le gabarit de coupe de manière à ce que la taille et l’espacement constants de la base en silicone soient de taille et d’espacement pour une surface de contact et une distance interélectrodes égales entre toutes les électrodes.
- Créez le gabarit de pliage pour plier les surfaces de contact platine-iridium et simplifier le placement des feuilles dans la base en silicone.
REMARQUE : Les fichiers Gcode sont fournis ; Modifier les dimensions et les spécifications du gabarit de coupe et de pliage pour répondre aux besoins expérimentaux.
- Perforez la base en silicone. Placez la base en silicone sur le gabarit de coupe et collez-la. Perforez le silicone à l’aide des guides dans le gabarit de coupe à l’aide d’un couteau X-acto pour la pose des feuilles de contact.
- Insérez les feuilles dans la base en silicone pour former les surfaces de contact. Pliez les feuilles de contact platine-iridium biocompatibles prédécoupées (1,25 mm x 5 mm) en forme de U à l’aide du gabarit de pliage. Ensuite, guidez les bras des feuilles pliées dans les fentes perforées de la base en silicone pour construire les surfaces de contact de l’électrode. De cette manière, insérez les 12 feuilles dans la base en silicone ; Laissez une seule colonne ouverte entre les électrodes pour assurer un espacement approprié.
REMARQUE : Cette configuration permettra la fabrication de 6 électrodes épimysiales bipolaires ; L’édition du gabarit de coupe peut augmenter la capacité si nécessaire. - Retirez la base en silicone du gabarit de coupe. Placez un morceau de ruban adhésif chirurgical sur les surfaces de contact pour maintenir les feuilles en place. Ensuite, retirez la base en silicone du gabarit de coupe, retournez-la pour que les bras de la feuille en forme de U soient exposés et pliez un bras de la feuille en forme de U au ras de la base en silicone.
- Connectez les fils d’électrode. Préparez un fil d’acier inoxydable revêtu de perfluoroalcoxy (PFA) en le coupant à la longueur souhaitée. Ensuite, dénudez une extrémité du fil d’acier inoxydable de ~ 1 cm à l’aide d’un briquet disponible dans le commerce. Positionnez l’extrémité dénudée du fil d’acier inoxydable à l’intérieur du bras déplié de la feuille. Soudez le fil d’acier inoxydable au bras de la feuille à l’aide d’une soudeuse Micro TIG (largeur d’impulsion = 0, énergie de soudage = 25).
- Inspectez l’interface plomb-feuille. Testez la connexion fil-feuille en appliquant une tension sur le fil d’acier inoxydable. Si la connexion tient, repliez le bras de la feuille au ras de la base en silicone et retirez le ruban adhésif bordant la feuille de silicone.
REMARQUE : Appliquez une tension représentative de la tension appliquée dans le cas d’utilisation spécifié. - Scellez l’électrode. Pour obtenir une consistance plus fine, mélangez 1 g de silicone liquide biocompatible avec 0,75 ml de toluène. Prélevez le mélange à l’aide d’une seringue à embout émoussé de 18 G et appliquez-le sur le côté soudé de chaque électrode pour sceller l’arrière des électrodes.
ATTENTION : Le toluène est inflammable, peut être mortel s’il est avalé ou pénètre dans les voies respiratoires et provoque une irritation cutanée. Travaillez sous la hotte et tenez-le à l’écart des flammes nues. - Séparez le lot en électrodes individuelles. Laissez le silicone-toluène prendre pendant 72 h avant de manipuler l’électrode. Ensuite, à l’aide de ciseaux, coupez la base en silicone en électrodes individuelles d’une taille de 10 x 5 mm.
REMARQUE : La taille de l’électrode dépendra des dimensions du gabarit de coupe et du cas d’utilisation spécifique. Autoclave et/ou nettoyage des électrodes dans un bain à ultrasons.
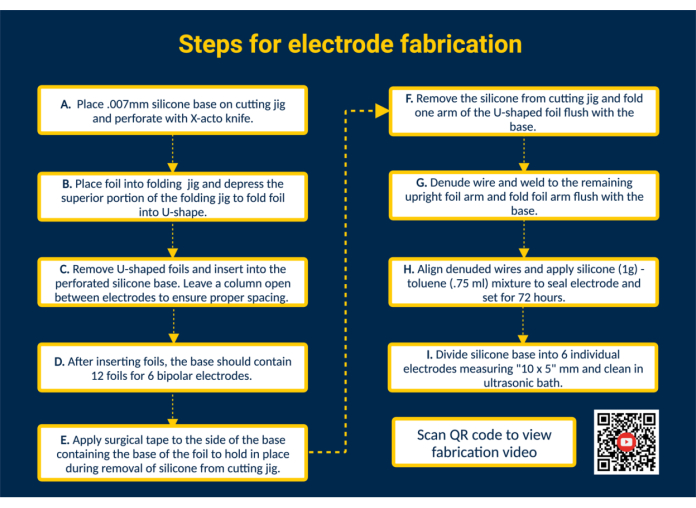
Graphique 1. Étapes de fabrication de l’électrode. (A) Base en silicone perforée. (B) Formez des feuilles en forme de U à l’aide du gabarit de pliage. (C) Insérez des feuilles en forme de U dans la base en silicone perforée. (D) La base en silicone contient 12 feuilles pour former 6 électrodes bipolaires. (E) Appliquez du ruban chirurgical sur la base pour fixer les feuilles lors du retrait du gabarit de coupe. (F) Retirez la base en silicone du gabarit de coupe. (G) Dénuder le fil d’acier inoxydable revêtu de PFA et souder au bras vertical de la feuille à l’aide d’une soudeuse Micro TIG. (H) Alignez les fils dénudés, appliquez un scellant silicone-toluène et laissez prendre. (I) Divisez la base en silicone en électrodes individuelles et nettoyez-la dans un bain à ultrasons. Veuillez cliquer ici pour voir une version agrandie de cette figure.
2. Tests ex vivo
- Connectez les électrodes à un appareil d’enregistrement. Épinglez chaque fil conducteur d’électrode à un canal sur une carte d’interface d’électrode (EIB). Répétez cette étape (en utilisant le même EIB) pour une électrode standard de l’industrie sélectionnée à des fins de comparaison. Connectez la BEI à une plate-forme d’acquisition de données au moyen d’un système de câble magnétique attaché.
REMARQUE : L’électrode standard de l’industrie peut être n’importe quelle électrode jugée fiable et qui répond aux besoins expérimentaux. - Clouer la BEI au sol. Dénudez une extrémité d’un acier inoxydable revêtu de PFA et soudez par points à une source de mise à la terre (par exemple, une vis en acier inoxydable). Épinglez le fil conducteur de terre à la même carte d’interface d’électrode dans la position « terre » désignée.
- Mettez en place le bain salin. Remplissez un bécher en verre (250 ml) avec 180 ml de solution saline physiologique (solution saline stérile à 0,9 %)4. Immergez les électrodes épimysiales fabriquées sur mesure et conformes aux normes de l’industrie dans le bain salin et fixez-les dans une position stable. Ensuite, plongez la source de mise à la terre dans le bain salin et sécurisez sa position. Enfin, immergez et fixez deux électrodes à aiguille de stimulation dans le bain salin et connectez les électrodes de stimulation au générateur de signaux.
- Utilisez un générateur de signaux pour évaluer l’accord des signaux et la synchronie temporelle. À l’aide d’un générateur de signaux, vous pouvez délivrer des formes d’onde répétées à une tension et une fréquence sélectionnées (0,1 V et 5 Hz) dans le bain salin à l’aide des électrodes de stimulation (Figure 2). Fournissez différentes formes d’onde (sinusoïdale, carrée et triangulaire) pour comparer les signaux enregistrés entre l’électrode épimysiale fabriquée sur mesure par rapport à la norme industrielle.
- Évaluez les performances de manière informelle et visuelle en temps réel pour évaluer le degré de variation des signaux entre les électrodes. Effectuez des corrélations intra-classe (ICC) et des corrélations de Pearson pour évaluer respectivement l’accord du signal et la synchronie temporelle.
REMARQUE : Pour les besoins de notre analyse, 8 000 échantillons ont été acquis à 4 000 Hz et filtrés en temps réel à l’aide d’un filtre Butterworth passe-haut et passe-bas (passe-haut = 75 Hz ; passe-bas = 2 kHz). - Mesurez l’impédance de l’électrode. Pour mesurer l’impédance des électrodes, collectez l’EIS sur les électrodes fabriquées sur mesure (par exemple, 10 électrodes) sur les fréquences 10 Hz-31 kHz5 avec un potentiostat en utilisant la procédure décrite ci-dessous par Richie et al.6. Voir Sarolic et al. pour plus d’informations sur la mesure de l’impédance des électrodes sur les électrodes bipolaires7.
- En suivant la procédure de Richie et al., immerger l’électrode épimysiale de 1 mm dans une solution saline tamponnée au phosphate (PBS). Utilisez un chlorure d’argent-argent (Ag|AgCl) et une tige en acier inoxydable comme contre-électrode pour compléter le circuit.
- Suspendre l’Ag|Électrode de référence AgCl et la tige en acier inoxydable dans le 1x PBS à l’aide d’une pince à bécher. Connectez l’électrode de référence à la référence du système d’impédance utilisé et connectez-vous à l’entrée de la contre-électrode du système d’impédance utilisé.
- Utilisez un potentiostat pour exécuter un balayage d’impédance de 1 kHz. Réglé sur une fréquence de balayage de 1 kHz à 0,01 Vrms dans une seule forme d’onde sinusoïdale. Pendant les 5 premières secondes du balayage, réglez le potentiostat sur 0 V pour stabiliser le signal enregistré. Utilisez le logiciel associé au potentiostat pour enregistrer les mesures.
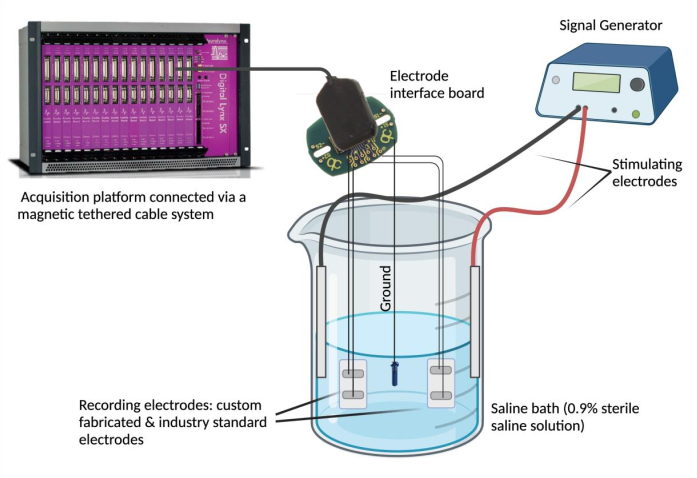
Figure 2 : Essai ex vivo : Bain salin contenant l’électrode fabriquée sur mesure, des électrodes standard de l’industrie, deux électrodes stimulantes et une source de terre. L’accord du signal et la synchronie temporelle ont été évalués en délivrant des ondes sinusoïdales, carrées et triangulaires dans le bain salin à partir du générateur de signaux et en enregistrant les formes d’onde détectées par les électrodes respectives à l’aide d’une plate-forme d’acquisition de données. REMARQUE : La spectroscopie d’impédance électrochimique n’est pas illustrée. Veuillez cliquer ici pour voir une version agrandie de cette figure.
3. Essais in vivo
REMARQUE : La procédure de test in vivo décrit notre cas d’utilisation expérimental. Il est recommandé que les électrodes épimysiales fabriquées sur mesure soient testées in vivo d’une manière qui correspond aux conditions expérimentales prévues par l’utilisateur.
- Examiner les informations chirurgicales ; Consultez l’information pour les chirurgiens qui apprennent le processus d’implantation d’électrodes d’enregistrement neuronal chronique à l’aide des ressources suivantes 8,9.
REMARQUE : Étant donné que notre manuscrit se concentre sur la fabrication et les tests d’électrodes, nous ne donnons ici qu’un bref aperçu des techniques chirurgicales utilisées dans notre laboratoire pour les tests d’électrodes in vivo . - Choisissez un rat à instrumenter (p. ex., un rat Long Evans femelle à l’âge de 16 semaines). Faites subir au rat une période d’acclimatation en laboratoire d’une semaine avant l’acclimatation sur tapis roulant. Après l’acclimatation en laboratoire, exposez progressivement le rat à un tapis roulant pour rongeurs à des vitesses croissantes allant jusqu’à 16 m/min.
- Préparez l’EIB en fixant d’abord une électrode épimysiale fabriquée sur mesure à l’EIB en épinglant chaque fil d’électrode à un canal de l’EIB. Pour mettre à la terre l’EIB, dénudez une extrémité d’un fil d’acier inoxydable revêtu de PFA et soudez par points à une mise à la terre sélectionnée (par exemple, une vis en acier inoxydable). Ensuite, épinglez le fil conducteur de terre à la même EIB dans la position « terre » désignée.
REMARQUE : Pour protéger l’électrode pendant l’instrumentation, enveloppez-la d’un revêtement protecteur (par exemple, un parafilm). - Désinfectez tous les outils chirurgicaux ainsi que la zone chirurgicale avant de commencer. Utilisez des fournitures chirurgicales scellées et aseptiques et autoclavez tous les instruments chirurgicaux qui ne sont pas dans des emballages stériles. Créez un champ opératoire stérile à l’aide d’un champ chirurgical.
- Anesthésier l’animal à l’aide d’une chambre d’induction contenant 3 à 5 % d’isoflurane et 1 L/min d’oxygène et maintenir à l’aide d’un cône nasal contenant 2 % d’isoflurane et 500 ml d’oxygène pendant la préparation du rat. Après avoir atteint le plan chirurgical de l’anesthésie, évalué par pincement des orteils, appliquez une pommade oculaire, surveillez la fréquence respiratoire (70-110 respirations/min) et évaluez la température centrale à l’aide d’une sonde rectale.
- Ensuite, rasez le site chirurgical avec une tondeuse à animaux et retirez les débris du site chirurgical. Une fois la zone chirurgicale rasée, désinfectez le site chirurgical à l’aide de chlorhexidine, d’alcool isopropylique et de povidone iodée en frottant du centre vers l’extérieur de la zone chirurgicale. Administrer les analgésiques au besoin et avec approbation et fournir de la chaleur pour maintenir la température corporelle centrale (37,5-38,5 °C). Après la préparation, positionnez le rat dans un cadre stéréotaxique et établissez le champ stérile.
- Pour une bonne préparation chirurgicale du chirurgien, lavez-vous soigneusement les mains avec du savon et/ou un désinfectant (chlorhexidine). Enfilez l’EPI approprié : masque, gants stériles et blouse jetable. Enfilez des gants stériles neufs si la technique d’asepsie est violée pour une raison quelconque.
- Pour instrumenter le VL droit, utilisez un scalpel pour faire une incision de 3 à 5 cm sur la partie antérolatérale du membre postérieur droit et utilisez une dissection contondante pour identifier le muscle VL.
- Faites une incision dans le plan sagittal de 1 cm le long de la suture coronale et exposez le crâne. À l’aide d’une fine paire de pinces, faites un tunnel sous-cutané entre la patte arrière droite et la base du crâne. Utilisez la pince pour saisir l’électrode et acheminer l’électrode vers le VL.
- Utilisez une perceuse à os pour créer un trou dans la calvaria (assurez-vous que les spécifications de la perceuse correspondent à celles de la vis de terre). Fixez la vis de terre et fixez l’EIB au crâne à l’aide de ciment dentaire.
REMARQUE : De petites quantités de peroxyde d’hydrogène peuvent être appliquées pour augmenter la porosité du crâne et améliorer l’adhérence du ciment dentaire. - Après avoir identifié le muscle VL, implantez l’électrode épimysiale fabriquée sur mesure implantée dans l’alignement des fibres musculaires à l’aide d’un monofilament non résorbable 4-0. Fermez l’incision à l’aide de pinces à plaie ou en suturant.
- Après la fermeture, retirez l’animal de l’anesthésie et logez-le individuellement dans une cage propre et sèche. Laissez le rat récupérer sur un coussin chauffant et surveillez sa température et sa fréquence respiratoire toutes les 15 minutes jusqu’à ce que l’animal soit ambulatoire. Traitez la douleur post-chirurgicale en administrant un analgésique approuvé dans les jours suivant l’instrumentation.
REMARQUE : le rat doit être logé individuellement jusqu’à ce qu’il soit complètement rétabli. - Après une période de 14 jours, effectuez des tests d’électrodes in vivo pour évaluer la validité de l’électrode épimysiale fabriquée sur mesure pour capturer les altérations physiologiques de l’activité musculaire. Placez le rat instrumenté sur un tapis roulant pour rongeurs et exposez-le au hasard à des conditions de marche en montée et en descente qui provoquent une augmentation ou une réduction de la signalisation EMG VL (inclinaison de 16°, déclin de 16° à 16 mètres/minute). Recueillir des données longitudinales (p. ex., 14 jours et 56 jours après l’instrumentation) pour assurer la fiabilité au fil du temps.
REMARQUE : Des évaluations de 14 et 56 jours ont été sélectionnées, car une période de 14 jours permet une récupération chirurgicale complète et celle de 56 jours dépasse notre calendrier expérimental. Nous encourageons les autres à tester les performances et la fiabilité des électrodes en utilisant un délai qui reproduit leur calendrier expérimental avant utilisation. La vitesse (16 m/min) et les conditions de marche (inclinaison de 16°, descente de 16°) ont été sélectionnées pour correspondre aux conditions établies d’augmentation et de diminution de l’excitation VL dans ce modèle10. - Modifier les paramètres d’acquisition en fonction des besoins expérimentaux. Capturez la signalisation EMG pendant la marche à une fréquence de 2 000 Hz à l’aide de la plate-forme d’acquisition de données et synchronisez-la avec un système de capture de mouvement.
REMARQUE : Si vous utilisez un appareil d’acquisition différent, collectez l’EMG et la capture de mouvement conformément aux instructions du fabricant et pour répondre aux besoins expérimentaux. - Extrayez 25 s de données de marche de chaque condition de marche et exportez-les vers un script Python personnalisé pour un traitement et une analyse plus approfondis du signal. Ajustez la ligne de base (zéro), rectifiez et lissez à l’aide d’un algorithme de racine carrée moyenne avec une largeur de bac de 50 ms. Appliquez un algorithme de détection de pics pour sélectionner les pics RMS-EMG à utiliser pour les analyses de données ultérieures.
REMARQUE : Nous avons brièvement décrit les méthodes de prétraitement et d’analyse des données EMG, car cette étape varie considérablement en raison des langages de programmation et des logiciels et matériels d’acquisition EMG. Nous encourageons les auteurs à consulter les ressources suivantes pour plus d’informations 3,11,12,13.
4. Tests de biocompatibilité
- Après la fin des prélèvements EMG longitudinaux (ou à un moment choisi), euthanasier le rat à l’aide de méthodes appropriées et approuvées (p. ex., asphyxie au CO2 suivie d’une thoracotomie bilatérale).
- Après l’euthanasie, extrayez les muscles bilatéraux du VL en créant une incision sur les membres postérieurs antérolatéraux droit et gauche. Congeler rapidement dans de l’azote liquide et conserver à -80 °C.
REMARQUE : Prenez soin de maintenir l’électrode en position sur le muscle instrumenté (par exemple, le VL droit) pendant l’extraction. Vous pouvez également marquer la région de la sous-électrode ou extraire uniquement le muscle de la région de la sous-électrode. Cela ne s’applique pas au muscle controlatéral/contrôle. - À l’aide d’un cryostat, vous découperez en série des sections transversales musculaires (7 μm) dans la région située directement sous l’interface électrode-fasciale (électrode). Coupez des sections du ventre musculaire du VL controlatéral pour servir de contrôle. Voir Kumar et al. pour plus de détails sur la cryosection14.
- Coloration à l’hématoxyline et à l’éosine (H&E) ; voir Wang et al. pour plus de détails sur la coloration H&E sur les coupes transversales des muscles squelettiques15.
- Examinez les sections colorées (instrumentées et témoins) à l’aide d’un microscope optique à un grossissement de 20x. Analyser les changements histologiques sans tenir compte de l’origine des échantillons. Évaluer la santé des tissus à l’aide des caractéristiques pathologiques suivantes : infiltration de cellules immunitaires, accumulation myonucléaire interne, fibrogenèse et fragmentation du sarcolemme.
5. Analyses statistiques suggérées
- Pour évaluer les performances de l’électrode épimyisale fabriquée sur mesure par rapport à la norme de l’industrie, importez les données ex vivo dans un ensemble de statistiques sélectionné. Appliquez les tests statistiques suivants aux données ex vivo recueillies à partir des électrodes fabriquées sur mesure et conformes aux normes de l’industrie (par exemple, 8 000 échantillons représentatifs des formes d’onde sinusoïdales, triangulaires et carrées). Fixez le niveau alpha a priori à p ≤ 0,05.
- Pour tester le niveau d’accord du signal entre les électrodes, utilisez les corrélations intraclasses (ICC) et les diagrammes de Bland-Altman. Calculez les estimations ICC et leurs intervalles de confiance à 95 % à l’aide d’un modèle à effets aléatoires à 2 facteurs à évaluation unique (k = 2), à accord absolu.
- Pour tester le degré de covariation de l’enregistrement des formes d’onde au fil du temps, également connu sous le nom de synchronie temporelle, effectuez une corrélation de Pearson sur des valeurs collectées avec les électrodes fabriquées sur mesure et standard de l’industrie.
- Comparez l’impédance moyenne de l’électrode pour les deux surfaces de contact (mesurée à 1 kHz) à partir d’électrodes fabriquées sur mesure sélectionnées (par exemple, 10 électrodes) à l’impédance de l’électrode standard de l’industrie.
REMARQUE : Les valeurs d’impédance de l’électrode varient en fonction du cas d’utilisation et des matériaux utilisés lors de la fabrication de l’électrode.
- Pour évaluer la qualité des enregistrements in vivo , importez les données collectées lors de la marche sur tapis roulant dans un ensemble de statistiques sélectionné.
- Pour évaluer la validité de l’électrode fabriquée sur mesure lors d’essais in vivo (où la démarche du rat a été perturbée par la marche en montée et en descente pour induire des altérations physiologiques de l’activité musculaire), effectuez le test t de Welch pour comparer les valeurs maximales moyennes dans des conditions de marche en montée et en descente.
REMARQUE : Les lecteurs sont encouragés à effectuer des tests et des analyses supplémentaires (par exemple, des évaluations du rapport signal/bruit (SNR) ; voir Concepts fondamentaux de Delysys dans l’acquisition de signaux EMG) qui ne sont pas présentés ici par souci de concision16. - Pour évaluer la fiabilité de la signalisation de l’électrode dans le temps, évaluez les données longitudinales recueillies dans des conditions constantes (marche en niveau à 16 m/min à 14 et 56 jours d’intervalle après l’implantation) via des tests t appariés.
- Pour évaluer la validité de l’électrode fabriquée sur mesure lors d’essais in vivo (où la démarche du rat a été perturbée par la marche en montée et en descente pour induire des altérations physiologiques de l’activité musculaire), effectuez le test t de Welch pour comparer les valeurs maximales moyennes dans des conditions de marche en montée et en descente.
Access restricted. Please log in or start a trial to view this content.
Résultats
Performance ex vivo
Les ICC ont révélé des niveaux élevés de concordance entre les électrodes fabriquées sur mesure et les électrodes standard de l’industrie pour toutes les formes d’onde (sinus [ICC = 0,993], carré [ICC = 0,995], triangle [ICC = 0,958] ; p < 0,001). Les graphiques de Bland-Altman ont également révélé un degré élevé d’accord des signaux entre les électrodes. Les diagrammes fades d’Altman et les corrélations de Pearso...
Access restricted. Please log in or start a trial to view this content.
Discussion
Notre objectif était de rationaliser le processus de fabrication de l’EMG, en permettant une adoption et une mise en œuvre plus larges de conceptions d’électrodes épimysiales, favorisant ainsi l’accessibilité et faisant progresser la recherche neuromusculaire. À cette fin, nous présentons un guide convivial pour l’approvisionnement, la fabrication et le test d’électrodes épimysiales à faible coût en interne. Dans l’espoir de soutenir d’autres groupes de recherche...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Les auteurs déclarent qu’ils n’ont pas d’intérêts financiers concurrents connus ou de relations personnelles qui auraient pu sembler influencer les travaux rapportés dans cet article.
Remerciements
Ce travail a été soutenu par la subvention R01AR081235 de l’Institut national de l’arthrite et des maladies musculo-squelettiques et cutanées (à L. K. Lepley). Les auteurs remercient les personnes suivantes pour leur contribution à la fabrication et aux tests de notre électrode biocompatible : Joel Pingel, Grant Gueller, Akhil Ramesh, Joe Letner, Jacky Tian et Ross Brancati.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| Electrode Materials | |||
| Quantity & price per electrode | |||
| Contact surface | Prince and Izant PT90/IR10 1.25 mm x 5 mm foil | Catalog #1040055 | 2 per electrode $7.50 per foil $15.00 per electrode |
| PFA coated stainless-steel electrode lead wire | A-M Systems Multi-Stranded PFA-Coated Stainless Steel Wire 50.8 µm strand diameter | Catalog #793500 | Dependent on desired lead length (e.g., 9 inch lead wires x2) $128 per 25 ft spool $5.12 per foot $0.42 per inch (x18) $7.68 per electrode |
| Folding jig | 3D printed (see .gcode file) | NA | NA |
| Sealant for electrode body | Nusil Med-1137 liquid silicone | Catalog #MED-1137 | 1 gram $344.66 per 2 oz. (59.15 mL) $5.83 per electrode |
| Silicone base | Implantech Alliedsil Silicone Sheeting-Reinforced, Long Term Implantable (8” x 6”) .007 thick | Catalog #701-07 | 10mm x 5mm sheet $225.00 per 8 x 6 inch $0.36 per electrode (10 mm x 5 mm) |
| Thinner for sealant mixture | Toluene 99.5% ACS Reagent 500mL or Xylene ACS 99.5% | Catalog #179418-500 ML | 0.75 mL $25.53 per 500 mL $0.38 per electrode |
| Template for perforating silicone base | Cutting jig – 3D printed (see CAD file) | NA | NA |
| Custom-fabricated electrode: $29.25 | |||
| Industry standard electrode (EP105 EMG Patch Electrode, 2 contacts, single-sided, 7mm x 4mm, MicroProbe for Life Science): $305.00 | |||
| Additional Fabrication Materials | |||
| Quantity & price per electrode | |||
| 3D printing software | Solidworks (Solidworks, 2022) | ||
| Micro-Tig welder | Micro-Tig Welder (CD1000SPM, Single Pulse Research and Light Production Resistance Spot Welder, Sunstone) | SKU 301010 | $3,500 |
| Ultrasonic bath | Ultrasonic bath (CPX Series Ultrasonic Bath, Fisherbrand). | 15-337-403 | NA |
| Ex Vivo Testing Materials | |||
| Quantity & price per electrode | |||
| Data acquisition platform and software | DigitalLynx 4sX Base Cheetah version 6.0 (Neuralynx Inc.) | NA | EMG acquisition hardware and software |
| Electrode interface board (EIB) | EIB, EIB16-QC, Neuralynx Inc. | 31-0603-0007 | NA |
| Signal generator | 5 MHz Function Generator, B&K Precision | 4005DDS220V | $387.46 |
| Potentiostat | PGSTAT1 potentiostat (EcoChemie, Utrecht, Netherlands) | NA | NA |
| Stainless steel screw | Fine Science Tools | 19010-00 | $98 |
| Ex Vivo Testing Materials | |||
| Quantity & price per electrode | |||
| Rodent treadmill | Exer 3/6 Open Treadmill, Columbus Instruments | NA | NA |
| Dental cement | Excel Formula® Pourable Dental Material, St. George Technology Inc. | #24211 | $125.60 |
| Light microscope | Keyence BZ-X800, Keyence Corporation, Osaka, Japan | NA | NA |
| Motion capture system | Optitrack Color Camera, Optitrack, NaturalPoint Inc. | NA | NA |
| Peak detection algorithm | “SciPy.signal.find_peaks - SciPy v1.8.1 Manual”, 2022 | NA | NA |
| Python software | Python Software Foundation. Python Language Reference, version 3.9. Available at http://www.python.org | NA | NA |
| Rat | HsdBlu: LE, Envigo | 140 | NA |
| Statistical sotware | GraphPad Prism version 10.0.0 (GraphPad Software, Boston, Massachusetts USA) | NA | NA |
Références
- Grandjean, P. A., Mortimer, J. T. Recruitment properties of monopolar and bipolar epimysial electrodes. Ann. Biomed. Eng. 14 (1), 53-66 (1986).
- Memberg, W. D., Stage, T. G., Kirsch, R. F. A fully implanted intramuscular bipolar myoelectric signal recording electrode. Neuromodulation J. Int. Neuromodulation Soc. 17 (8), discussion 799 794-799 (2014).
- Loeb, G. E., Gans, C. Electromyography for Experimentalists. , University of Chicago Press. Chicago, IL. (1986).
- Boehler, C., Carli, S., Fadiga, L., Stieglitz, T., Asplund, M. Tutorial: guidelines for standardized performance tests for electrodes intended for neural interfaces and bioelectronics. Nat. Protoc. 15 (11), 3557-3578 (2020).
- Patel, P. R., et al. Insertion of linear 8.4 µm diameter 16 channel carbon fiber electrode arrays for single unit recordings. J. Neural Eng. 12 (4), 046009(2015).
- Richie, J. M., et al. Open-source toolkit: benchtop carbon fiber microelectrode array for nerve recording. J. Vis. Exp. (176), e63099(2021).
- Impedance measurement of bipolar stimulation electrodes immersed in medium. Sarolic, A., Skalic, I., Deftu, A., Sapunar, D. 2018 EMF-Med 1st World Conf. Biomed. Appl. Electromagn. Fields EMF-Med, , 1-2 (2018).
- Pritchett-Corning, K. R., Mulder, G. B., Luo, Y., White, W. J. Principles of rodent surgery for the New Surgeon. J. Vis. Exp.: JoVE. (47), e2586(2011).
- Zealear, D., Li, Y., Huang, S. An implantable system for chronic in vivo electromyography. J. Vis. Exp. JoVE. (158), e60345(2020).
- Butterfield, T. A., Leonard, T. R., Herzog, W. Differential serial sarcomere number adaptations in knee extensor muscles of rats is contraction type dependent. J. Appl. Physiol. Bethesda Md 1985. 99 (4), 1352-1358 (2005).
- Farago, E., MacIsaac, D., Suk, M., Chan, A. D. C. A review of techniques for surface electromyography signal quality analysis. IEEE Rev. Biomed. Eng. 16, 472-486 (2023).
- Raez, M. B. I., Hussain, M. S., Mohd-Yasin, F. Techniques of EMG signal analysis: detection, processing, classification and applications. Biol. Proced. Online. 8, 11-35 (2006).
- Tankisi, H., et al. Standards of instrumentation of EMG. Clin. Neurophysiol. 131 (1), 243-258 (2020).
- Kumar, A., Accorsi, A., Younghwa, R., Mahasweta, G. Do's and don'ts in the preparation of muscle cryosections for histological analysis. J. Vis. Exp. JoVE. (99), e52793(2015).
- Wang, C., Yue, F., Kuang, S. Muscle histology characterization using H&E staining and muscle fiber type classification using immunofluorescence staining. Bio-Protoc. 7 (10), e2279(2017).
- Kreifeldt, J. G. Signal versus noise characteristics of filtered EMG used as a control source. IEEE Trans. Biomed. Eng. BME-18 (1), 16-22 (1971).
- Farina, D., Yoshida, K., Stieglitz, T., Koch, K. P. Multichannel thin-film electrode for intramuscular electromyographic recordings. J. Appl. Physiol. 104 (3), 821-827 (2008).
- Muceli, S., et al. Decoding motor neuron activity from epimysial thin-film electrode recordings following targeted muscle reinnervation. J. Neural Eng. 16 (1), 016010(2018).
- Guo, L., Guvanasen, G., Tuthill, C., Nichols, T., Deweerth, S. Characterization of a Stretchable Multielectrode Array for Epimysial Recording. , 694(2011).
- Zwarts, M. J., Stegeman, D. F. Multichannel surface EMG: basic aspects and clinical utility. Muscle Nerve. 28 (1), 1-17 (2003).
- Fabrication and test of robust spherical epimysial electrodes for lower limb stimulation. Aalb. Den. Koch, K. P., Leinenbach, C., Stieglitz, T. IFESS 5th Conf, , (2000).
- Uhlir, J. P., Triolo, R. J., Davis, J. A., Bieri, C. Performance of epimysial stimulating electrodes in the lower extremities of individuals with spinal cord injury. IEEE Trans. Neural Syst. Rehabil. Eng. 12 (2), 279-287 (2004).
- Deer, T. R., et al. The appropriate use of neurostimulation: new and evolving neurostimulation therapies and applicable treatment for chronic pain and selected disease states. Neuromodulation Technol. Neural Interface. 17 (6), 599-615 (2014).
- Ortiz-Catalan, M., Brånemark, R., Håkansson, B., Delbeke, J. On the viability of implantable electrodes for the natural control of artificial limbs: Review and discussion. Biomed. Eng. OnLine. 11, 33(2012).
- Sando, I. C., et al. Regenerative peripheral nerve interface for prostheses control: electrode comparison. J. Reconstr. Microsurg. 32 (3), 194-199 (2016).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon