Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
IRM pulmonaire hyperpolarisée 129Xe et spectroscopie chez des souris ventilées mécaniquement
Dans cet article
Résumé
L’IRM au xénon hyperpolarisé peut quantifier la microstructure pulmonaire régionale (dimensions de l’espace aérien) et la physiologie (ventilation et échange gazeux) dans la recherche translationnelle et les soins cliniques. Bien que difficile, il peut fournir des informations pulmonaires comparables dans les études précliniques. Ce protocole décrit l’infrastructure et les procédures nécessaires pour effectuer une IRM pulmonaire au xénon de routine chez la souris.
Résumé
Le xénon-129 hyperpolarisé (HP) (129Xe) est un agent de contraste d’imagerie par résonance magnétique (IRM) inhalé doté de propriétés spectrales et physiques uniques qui peuvent être exploitées pour quantifier la physiologie pulmonaire, y compris la ventilation, la diffusion restreinte (taille de l’espace alvéolaire-aérien) et les échanges gazeux. Chez l’homme, il a été utilisé pour évaluer la gravité et la progression de la maladie dans une variété de troubles pulmonaires et est approuvé pour une utilisation clinique aux États-Unis et au Royaume-Uni. Au-delà de ses applications cliniques, la capacité de l’IRM 129Xe à évaluer de manière non invasive la physiopathologie pulmonaire et à fournir des informations spatialement résolues est précieuse pour la recherche préclinique. Parmi les modèles animaux, les souris sont les plus largement utilisées en raison de l’accessibilité des modèles de maladies génétiquement modifiées. Ici, l’IRM 129Xe est prometteuse en tant que technique peu invasive, sans rayonnement et sensible pour surveiller longitudinalement la progression de la maladie pulmonaire et la réponse au traitement (par exemple, dans la découverte de médicaments). Cette technique peut s’étendre aux applications précliniques en incorporant un appareil respiratoire libre déclenché par IRM ou un ventilateur mécanique pour délivrer du gaz. Nous décrivons ici les étapes et fournissons des listes de contrôle pour assurer une collecte et une analyse robustes des données, y compris la création d’un fantôme de gaz xénon thermiquement polarisé pour le contrôle de la qualité, l’optimisation de la polarisation, la manipulation des animaux (sédation, intubation, ventilation et soins pour les souris) et les protocoles de ventilation, de diffusion restreinte et d’échange de gaz. Bien que l’IRM préclinique 129Xe puisse être appliquée à divers modèles animaux (par exemple, rats, porcs, moutons), ce protocole se concentre sur les souris en raison des défis posés par leur petite anatomie, qui sont contrebalancés par leur prix abordable et la disponibilité de nombreux modèles de maladies.
Introduction
Alors que les troubles pulmonaires restent les principales causes de morbidité et de mortalité dans lemonde1, la dernière décennie a vu des améliorations spectaculaires des résultats pour les patients. Ces améliorations s’expliquent en partie par deux facteurs. Tout d’abord, les essais cliniques de phase III privilégient désormais les modifications de la fonction pulmonaire comme critères d’évaluation plutôt que la mortalité, accélérant ainsi les essais de médicaments 2,3,4,5. Deuxièmement, les progrès réalisés dans les modèles animaux améliorés ont permis de mieux comprendre les mécanismes de la maladie et ont contribué au développement de thérapies 6,7. Les modèles murins sont souvent privilégiés pour la recherche translationnelle car ils offrent des parallèles physiologiques avec les humains, un prix abordable et un développement rapide de la maladie. Le génie génétique a élargi la gamme et la qualité des modèles disponibles, l’International Mouse Strain Resource comptant désormais plus de 32 000 souches de souris8, contre seulement 4 218 souches de rats (Rat Genome Database9). Ces modèles ont ouvert de nouvelles voies pour l’étude des facteurs mécanistes et des réponses thérapeutiques pour une gamme de maladies pulmonaires, notamment la bronchopneumopathie chronique obstructive (BPCO)10, la fibrose kystique (FK)11, la fibrose pulmonaire12,13, l’hypertension pulmonaire14,15 et l’asthme16.
Malheureusement, la recherche pulmonaire sur les souris est limitée par les techniques disponibles pour quantifier le fardeau de la maladie. Les études reposent souvent sur des procédures terminales qui 1) fournissent des informations sur l’ensemble du poumon (tests biochimiques) ou des informations localisées (histologie) et 2) exigent des plans transversaux et des échantillons de grande taille. Ainsi, ils ne saisissent ni la dynamique spatiale ni temporelle de la maladie. En revanche, l’imagerie tridimensionnelle non invasive permet d’évaluer la structure, les processus moléculaires et la fonction des poumons au fil du temps.
La structure pulmonaire (p. ex., anomalies des voies respiratoires et fibrose interstitielle) peut être visualisée à l’aide d’une IRM à écho ultra-court (UTE) et d’une microtomodensitométrie (μCT) à haute résolution. Des informations fonctionnelles et mécanistes (par exemple, la ventilation, la perfusion, le métabolisme tumoral et les processus inflammatoires) peuvent être obtenues à l’aide d’agents de contraste exogènes (par exemple, la TDM améliorée au xénon et l’UTE enrichie en oxygène) et d’approches de médecine nucléaire ionisante (c’est-à-dire la tomographie par émission de positons [TEP] et la tomographie par émission monophotonique [SPECT]). Cependant, l’imagerie fonctionnelle est difficile en raison du contraste modeste par rapport au bruit (en particulier pour l’UTE amélioré par l’oxygène aux intensités de champ magnétique élevées utilisées pour l’IRM préclinique, où T1 est allongé) disponible sans utiliser de modalités ionisantes avec des niveaux de rayonnement supérieurs à la normale. Bien que l’imagerie avec ces modalités soit bien tolérée dans les modèles animaux utilisant des doses conventionnelles, les radiations cumulatives peuvent fausser les résultats des études sur l’immunologie, l’inflammation et le cancer du poumon17. Cependant, l’imagerie par résonance magnétique (IRM) au xénon-129 hyperpolarisé (HP) (129Xe) fournit des informations structurelles et fonctionnelles peu invasives, non irradiantes et très sensibles. Bien que cette technique ait été utilisée dans la recherche préclinique pour caractériser des affections telles que l’emphysème18,19, la fibrose20, le cancer du poumon21, la BPCO22 et les lésions pulmonaires radio-induites23 à un ou plusieurs moments, elle reste sous-utilisée dans le cadre préclinique.
Pour permettre l’IRM 129Xe préclinique de routine, plusieurs conditions préalables sont requises, notamment le soutien réglementaire institutionnel, un dispositif d’hyperpolarisation, une bobine de radiofréquence (RF) 129Xe et un scanner multinucléaire. Bien que les applications avancées 24,25,26,27,28,29,30,31,32,33 nécessitent une programmation d’impulsions spécifique au fournisseur qui n’entre pas dans le champ d’application de ce protocole, les applications de base peuvent être réalisées avec de modestes modifications logicielles. Par conséquent, nous nous concentrons sur le contrôle de la qualité, la manipulation de l’aimantation, la collecte de données et les procédures de manipulation des animaux, y compris la ventilation mécanique, qui sont uniques à l’IRM préclinique 129Xe (Figure 1).
À ce jour, l’imagerie du 129Xe chez les petits animaux a utilisé trois approches d’administration de gaz sans danger pour l’IRM, chacune présentant des avantages et des inconvénients : respiration libre, entraînement par piston et chute de pression. La respiration libre permet une inhalation spontanée sans risque de blessure par intubation ou trachéotomie, mais consomme beaucoup plus de gaz HP et peut introduire des artefacts de mouvement34,35. Les appareils commerciaux à pistons sont auto-calibrés et faciles à utiliser prêts à l’emploi, mais peuvent être d’un coût prohibitif36. L’approche basée sur la chute de pression utilisée ici est bien décrite dans la littérature, modulaire, personnalisable et exécutée par le code open source 37,38,39,40. De plus, il est rentable, totalisant généralement moins de 10 000 $ et quelques semaines de temps de construction dédié. Le ventilateur à chute de pression délivre du 129Xe à partir d’un sac de dose à l’intérieur d’un bidon pressurisé tout en surveillant la pression des voies respiratoires d’une souris intubée.
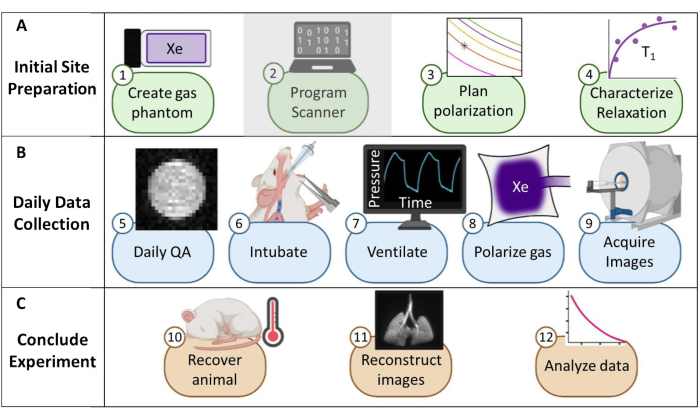
Figure 1 : Vue d’ensemble du protocole de collecte systématique de l’imagerie par résonance magnétique (IRM) au xénon-129 (129Xe) chez la souris. (A) Étapes de la configuration initiale. (Remarque : la programmation du scanner est unique à chaque fournisseur et n’est pas décrite dans ce protocole). (B) Étapes de collecte quotidienne des données d’assurance qualité (AQ) et des données sur les animaux. (C) Étapes pour la conclusion réussie de l’expérience et l’analyse des données. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Ici, nous recueillons et analysons les trois classes courantes de données d’IRM 129Xe : la ventilation, l’imagerie pondérée en diffusion (taille de l’espace aérien alvéolaire) et les échanges gazeux. Les images de ventilation montrent la distribution du gaz 129Xe inhalé. Les régions des poumons où le débit d’air est réduit apparaissent sombres sur les images de gaz HP, et la pathologie est quantifiée par le volume de ventilation défectueuse. Chez l’homme, le pourcentage de défauts de ventilation (VDP) a montré une forte répétabilité41,42 et une sensibilité élevée à l’obstruction pulmonaire dans des maladies telles que la BPCO 43,44,45 et l’asthme 46,47.
La diffusion restreinte des 129atomes de Xe dans l’espace aérien peut être mesurée via le coefficient de diffusion apparent (ADC) et sert de substitut pour la taille de l’espace aérien. L’ADC est calculé en acquérant une image de référence (b0) sans pondération de diffusion et une ou plusieurs images acquises en présence d’une pondération de diffusion induite par un gradient bipolaire (bN). Un ADC élevé reflète une augmentation de la taille de l’espace aérien due au vieillissement ou au remodelage emphysémateux18,48. De plus, l’utilisation de plusieurs images de valeur b (≥4) permet de calculer des informations morphométriques plus détaillées (par exemple, l’ordonnée à l’origine linéaire moyenne)49,50.
Les échanges gazeux peuvent être caractérisés en raison de 1) la solubilité du 129Xe dans le tissu de la membrane capillaire, le plasma et les globules rouges (globules rouges) et 2) le décalage chimique de >200 ppm du 129Xe lorsqu’il est dissous dans ces compartiments. Les données spectroscopiques et d’imagerie donnent un aperçu des maladies cardiopulmonaires (p. ex., hypertension pulmonaire et insuffisance cardiaque gauche 51,52,53). Alors que de nombreuses espèces (humains, canidés et rats) présentent des pics spectraux uniques provenant de chaque compartiment, les souris n’ont pas de signal RBC unique en raison des différences dans les interactions entre les sites de liaison de l’hémoglobine et du xénon. Au lieu de cela, tous les composants dissous sont combinés en un seul signal chez la souris54. Cependant, il est possible d’observer une résonance distincte des globules rouges chez les souris transgéniques exprimant de l’hémoglobine humaine, comme celles utilisées dans les modèles de drépanocytose54. Dans l’ensemble, la spectroscopie et l’imagerie du Xe 129dissous fournissent des informations uniques sur la physiopathologie cardiopulmonaire chez la souris55,56.
Avant d’essayer ce protocole, il est nécessaire de comprendre les informations de base sur l’IRM, la ventilation mécanique et les techniques de manipulation des souris requises pour les études sur les souris. Avant d’entreprendre des études sur des animaux, toutes les procédures doivent être approuvées par le comité local de protection et d’utilisation des animaux (IACUC)57. Étant donné que le moment magnétique total disponible dans le poumon de la souris est intrinsèquement faible (c’est-à-dire un volume courant de ~250 μL), la taille du voxel doit être 1000 fois plus petite que chez l’homme pour obtenir une résolution anatomiquement équivalente. La fréquence respiratoire murine est également extrêmement rapide (>100 respirations/minute). En tant que telles, les procédures d’apnée unique généralement utilisées pour l’imagerie humaine ne sont pas réalisables. Au lieu de cela, seules quelques excitations RF peuvent être appliquées dans chaque respiration, de sorte que 129images Xe doivent être encodées sur des dizaines à des centaines de respirations. La programmation par impulsions peut être nécessaire pour permettre le déclenchement externe des acquisitions et pour boucler correctement les coupes, les codages de phase et/ou les images pondérées en diffusion tout en équilibrant le rapport signal/bruit (SNR), la résolution et la durée de balayage. Ici, le ventilateur émet une impulsion logique transistor-transistor (TTL) une fois par respiration pour déclencher l’acquisition de données (Figure 2).
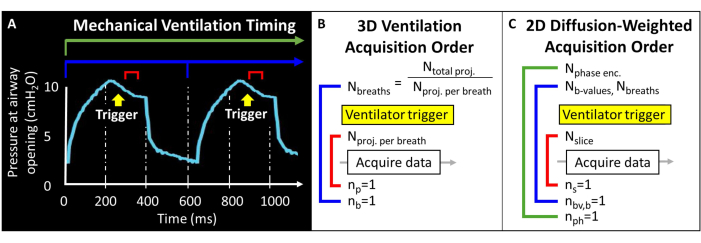
Figure 2 : Ventilation mécanique représentative et synchronisation de l’acquisition des données. (A) La ventilation contrôlée par l’utilisateur peut déclencher l’acquisition de données à la fin de l’inspiration, pendant l’apnée ou à la fin de l’expiration. (B) Pour cette séquence de ventilation radiale 3D, l’utilisateur définit le nombre total de projections acquises et le nombre de projections par respiration. (C) Pour une image sélective en tranches et pondérée en diffusion 2D, l’utilisateur définit l’ordre des tranches, les images de valeur b et les codages de phase. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Pour permettre une ventilation fiable et une distribution de 129Xe, des procédures de sédation et d’intubation robustes sont nécessaires. Pour chaque étude, les effets en aval de chaque anesthésique doivent être pris en compte, y compris les modifications de la ventilation minute, de la fréquence cardiaque (FC) et de la pression artérielle 58,59,60,61,62,63,64,65,66. Bien qu’une variété de sédatifs aient été utilisés pour l’IRM préclinique du gaz HP, nous utilisons un mélange de kétamine, de xylazine et d’acépromazine, en raison de sa disponibilité, de sa rentabilité, de sa fiabilité et de sa durée67,68. Une fois sous sédation, les animaux doivent être intubés pour une ventilation mécanique efficace. L’intubation des souris est difficile en raison de la petite taille de leur anatomie, et il est donc important de s’entraîner minutieusement à cette technique. Nous encourageons les chercheurs à examiner les protocoles vidéo publiés69,70. Étant donné que la plupart des canules d’intubation commerciales contiennent de l’acier inoxydable, nous introduisons une technique pour fabriquer des canules en forme de coin sans métal (c’est-à-dire compatibles avec l’IRM et les gaz HP) qui peuvent être personnalisées pour correspondre au diamètre des voies respiratoires afin de créer un joint étanche à l’air avec la paroi trachéale de la souris.
Étant donné que 129images Xe sont collectées sur de nombreuses respirations, les réglages du ventilateur sont essentiels. Les stratégies de ventilation protectrice doivent être soigneusement envisagées pour prévenir les lésions pulmonaires 71,72,73,74. En particulier, l’utilisation d’un faible volume courant (TV), d’une pression expiratoire positive modérée (PEP) et de manœuvres de recrutement alvéolaire (RM) réduit le risque de lésions pulmonaires induites par la ventilation chez les patients humains et les modèles animaux 75,76,77,78,79,80,81. Ici, nous recommandons une technique simple qui est compatible avec la ventilation mécanique 129Xe de perte de charge qui est protectrice et fournit une image 129Xe SNR suffisante. Plus précisément, nous appliquons la PEP en ajoutant une valve PEP commerciale à la conduite d’expiration du ventilateur. Pour effectuer des MR, la conduite d’expiration doit être fermée de manière à ce que l’animal reçoive plusieurs inspirations sans expiration jusqu’à ce qu’une pression et une durée cibles soient atteintes.
Tout au long de l’étude, nous fournissons des paramètres de ventilation généraux, mais il est conseillé de consulter la littérature pour atteindre des objectifs d’étude spécifiques82,83. En plus de surveiller la pression inspiratoire maximale pendant la ventilation mécanique, il est important de surveiller la température de l’animal, ce qui peut être fait à l’aide de méthodes standard de surveillance de la température chez la souris. Bien qu’elle ne soit pas nécessaire pour l’imagerie, la surveillance de la fréquence cardiaque par électrocardiogramme (ECG) peut être avantageuse ; L’ECG peut indiquer si un animal se réveille d’une sédation, s’il est en surdose ou s’il est en détresse, ce qui permet au chercheur d’intervenir.
Le protocole que nous décrivons est conçu pour collecter 129données de ventilation radiale Xe3D 61, des données pondérées en diffusion GRE2D 76 et des données d’échange de gaz de spectroscopie d’acquisition d’impulsions dynamiques. Ce protocole vise à combler le fossé entre la recherche préclinique dans de petits modèles animaux et le potentiel de l’IRM 129Xe pour faire progresser notre compréhension des troubles pulmonaires.
Access restricted. Please log in or start a trial to view this content.
Protocole
Toutes les méthodes décrites ici ont été approuvées par le Comité institutionnel de soin et d’utilisation des animaux (IACUC) du centre médical de l’hôpital pour enfants de Cincinnati.
1. Préparation initiale du site
- Créez et testez un fantôme de gaz 129Xe polarisé thermiquement (Figure 3).
- Procurez-vous un récipient en verre borosilicaté (~60 ml), une vanne à piston avec un joint torique d’étanchéité frontale et une tige en verre borosilicate broyée, tous évalués jusqu’à 150 psig. Assurez-vous qu’il n’y a pas de pièces magnétiques. Fixez un raccord à compression sur la tige en verre. Serrez pour obtenir un joint étanche au gaz.
- Connectez le récipient à une pompe à vide et à un réservoir d’oxygène conformément à la figure 3A. Récipient à vide à une pression absolue inférieure à 100 mTorr.
- Remplissez le récipient d’oxygène à la pression de 1,5 atm pour réduire le 129Xe T1 de > 30 min à ~2 s (à 7 T d’intensité de champ magnétique ; Pour un scanner de 9,4 T, utilisez de l’oxygène de 1,6 atm). Sceller le récipient.
REMARQUE : Pour des intensités de champ plus élevées, une pression partielle d’oxygène un peu plus élevée sera nécessaire pour atteindre T1≤ 2 s84. - Remplissez un réservoir imperméable aux gaz avec 400 mL de xénon enrichi en isotopie (85 % 129Xe).
REMARQUE : L’abondance naturelle du xénon (26 % 129Xe) peut également être utilisée, mais la réduction du signal devra être augmentée pour atténuer la réduction de ~3 fois du SNR. - Connectez le récipient au réservoir de 129Xe. Tube sous vide à une pression absolue inférieure à 100 mTorr.
- Remplissez un liquide de paillasse N2 Dewar à bouche ouverte à ~90 %. Immerger le fond du récipient (~5 cm) dans de l’azote liquide pour condenser l’O2 et créer un vide (figure 3B). Une fois immergé, ouvrez la vanne pour permettre à 129Xe du réservoir de s’écouler dans le récipient (Figure 3C).
- Scellez la soupape du piston en tirant lentement sur la tige jusqu’à ce que le trou d’entrée du piston soit tiré au-delà du joint torique. Immédiatement après que le trou ait dépassé le joint torique, serrez à la main pour sceller le récipient. Retirez le récipient de l’azote liquide et laissez-le décongeler.
REMARQUE : Une fois décongelé, le récipient se pressurisera à ~4,5 atm (2 atm O2 + 2,5 atm 129Xe). - Protégez la verrerie (p. ex., insérez le récipient dans un contenant rembourré en polychlorure de vinyle (PVC), figure 3D).
REMARQUE : S’il est correctement entretenu, le fantôme peut maintenir la pression pendant une décennie ou plus. - Mesurer le T1 du fantôme (p. ex., à l’aide d’une séquence de récupération d’inversion spectroscopique). Confirmez T1 < 2 s pour les scanners 7 T. Suivez le signal et T1 dans le temps pour l’assurance qualité (QA).
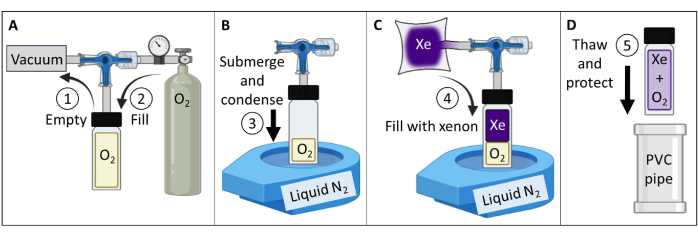
Figure 3 : Création d’un fantôme de gaz 129Xe polarisé thermiquement guidé par le protocole détaillé à l’étape 1.1. Les pressions partielles O2 et 129Xe peuvent être modifiées pour personnaliser le T1 afin d’obtenir des fois 129Xe T1 et une intensité de signal appropriée à une intensité de champ donnéede 84. Veuillez cliquer ici pour voir une version agrandie de cette figure.
- Effectuez l’assurance qualité avec le fantôme de gaz polarisé thermiquement (Tableau 1 et Figure 4).
- Placez la bobine 129Xe à l’isocentre de l’aimant et centrez le fantôme de gaz 129Xe à l’intérieur de la bobine. Dans une seule séquence d’impulsion et d’acquisition (« impulsion unique »), réglez la fréquence de travail pour qu’elle corresponde à la fréquence de gaz approximative de 129Xe dans le fantôme (~83,07 MHz à 7T).
- Centrez les fréquences d’acquisition et d’excitation sur la fréquence 129Xe Larmor, et utilisez cette fréquence pour tous les scans d’étalonnage et de contrôle qualité 129Xe. Voir le tableau 1 pour les paramètres expérimentaux de tous les balayages d’assurance qualité. Vérifiez que le fantôme est centré à l’aide d’un radiophare d’alignement de piste fantôme (Figure 4A).
- Effectuez une expérience de nutation pour calibrer l’angle de retournement : En supposant que le SNR est suffisant, utilisez des impulsions RF simples avec un espacement du temps de répétition (TR) > 5 x T1. Pour chaque acquisition, augmentez progressivement la puissance RF jusqu’à ce que le signal s’annule et commence à s’inverser. La norme utilisée ici est la suivante : nombre d’impulsions = 65 ; TR = 10 s ; durée d’impulsion = 125 μs ; Puissance RF = 1-13,8 W, incrémentée de 0,2 W
- Transformée de Fourier et mise en phase du premier spectre (c’est-à-dire le spectre acquis avec la puissance RF la plus faible). Appliquez la même mise en phase pour tous les spectres. Tracez les spectres réels en fonction de la puissance de l’impulsion RF (Figure 4B).
- La puissance qui produit un pic nul (c’est-à-dire une hauteur de crête minimale) correspond à l’angle de retournement de 180°. Obtenez un angle de retournement de 90° en utilisant la même puissance à la moitié de la longueur d’impulsion nécessaire pour produire l’angle de retournement de 180°. En supposant que le logiciel du scanner le permette, réglez cette puissance de référence de 90° et cette longueur d’impulsion pour la mise à l’échelle ultérieure de l’angle de retournement.
- Utilisez une seule impulsion pour caler en minimisant la largeur totale à la moitié maximum du spectre 129Xe (TR ~ 1 s). Si nécessaire, recentrez la fréquence après le calage. Enregistrez la demi-largeur max.
- Exécutez l’analyse QA 129Xe (Tableau 1 et Figure 4C). Enregistrez les données d’assurance qualité : SNR, signal fantôme moyen et écart-type du bruit.
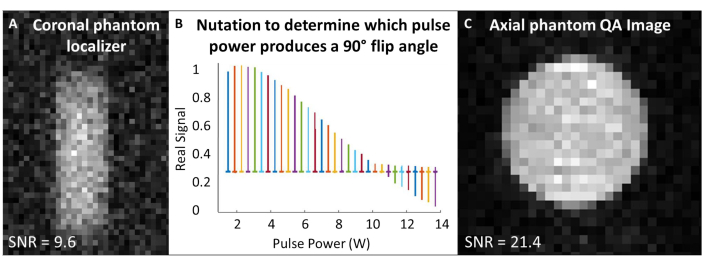
Figure 4 : Assurance qualité pré-balayage. (A) Un localisateur fantôme coronal GRE 2D basse résolution garantit que le fantôme est centré dans l’aimant. (B) Une expérience de nutation pour régler une impulsion de 90° montre un pic nul à l’impulsion de 180°. (C) Après avoir localisé et calibré l’angle de retournement, acquérez une image 2D GRE QA de plus haute résolution. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Nom abrégé du protocole | Description de la séquence | TR (ms) | TE (ms) | Moyennes / Répétitions | Angle de retournement (°) | Taille de la matrice ou Npts | Champ de vision (mm2) | RF BW (kHz) | Épaisseur de la tranche / de la dalle (mm) | Durée de l’analyse |
| Impulsion unique | Acquisition d’impulsions | 1000 | 1 / 1 | 60 | 2048 | 10 | 1 s | |||
| Alignement de piste fantôme | GRE 2D | 200 | 3.7 | 20 / 1 | 48 | 60 × 32 | 120 × 48 | 3 | 60 | 2 min |
| Calibrage de l’angle de retournement | Acquisition d’impulsions | 7000 | 1 / 65 | 20 | 2048 | 5.12 | Durée : 7,5 minutes | |||
| 129Xe QA | GRE 2D | 5000 | 3.3 | 8 / 1 | 90 | 322 | 322 | 3 | 40 | Durée : 21 minutes |
Tableau 1 : Paramètres de séquence d’assurance qualité de l’étalonnage fantôme. TR = temps de répétition, TE = temps d’écho, Npts = nombre de points, FOV = champ de vision, BW = bande passante. Veuillez cliquer ici pour télécharger ce tableau.
- Polarisation plane (Figure 5A, B).
- Sélectionner le volume polarisé 129Xe et le temps d’accumulation : 400 mL en 15 min sont optimaux pour ce protocole (Figure 5) mais peuvent facilement être ajustés pour d’autres applications et équipements.
- En supposant un volume mort connu à l’intérieur de l’hyperpolariseur (p. ex., V vol mort = 80 mL), calculez le débit (FXe en SLM) pour un volume distribué Vsouhaité, une fraction de gaz de 129Xe f et un temps d’accumulation tselon :
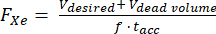 (1)
(1)
REMARQUE : Bien que des temps de production plus longs permettent généralement d’obtenir une polarisation plus élevée, ils peuvent ne pas être pratiques pour l’imagerie in vivo. Utilisez un modèle approprié pour l’hyperpolariseur 85,86,87,88 afin de déterminer un débit qui équilibrera le temps de production et la polarisation. Ici, le modèle de J. W. Plummer et al.89 (figure 5A) a été utilisé. Cela s’applique aux polariseurs à flux continu et ne s’applique pas aux hyperpolariseurs à flux arrêté90. - Polarisez le gaz en fonction de ces paramètres, mesurez la polarisation avec un appareil commercial ou de construction amateur et comparez-la à la polarisation prédite pour l’assurance qualité.
- Mesurez la perte de polarisation pendant le transport. Si la polarisation diminue suffisamment (par exemple, >10 %), construisez une mallette de transport magnétique pour protéger la polarisation pendant le transport. Voir le Fichier supplémentaire 1 : Gestion de la polarisation pendant le transport et la Figure supplémentaire 1.
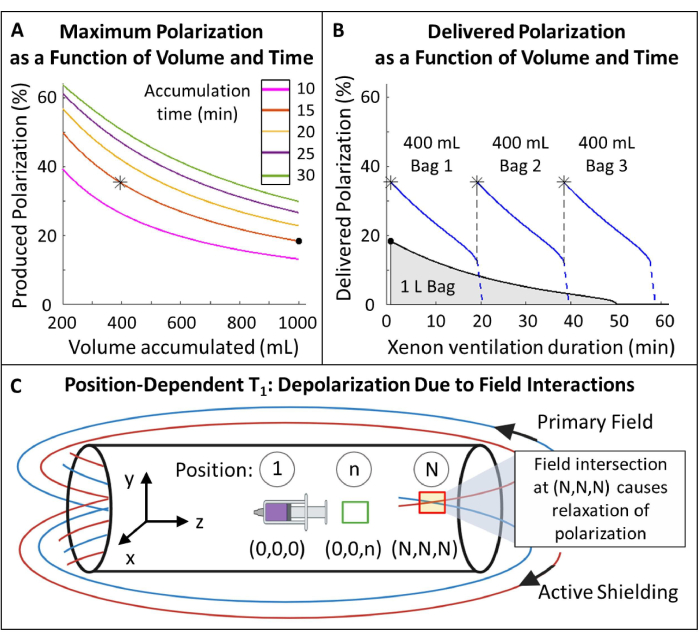
Figure 5 : Gestion de la polarisation. (A) La polarisation et le volume produit sont fonction du temps d’accumulation et du débit. Un sac de gaz de 400 ml fournit une polarisation initiale élevée (~35 %) sur 20 min. Bien que l’utilisation de 1 L de gaz puisse sembler attrayante, il aura une polarisation initiale plus faible (~20 %). (B) Après ~15 minutes de ventilation, un lot de 1 litre de HP 129Xe s’épuiserait à <10 % de polarisation tandis que 600 mL de gaz resterait116. Ainsi, l’utilisation de plusieurs sacs de 400 ml de 129Xe maintient une polarisation moyenne plus élevée. C) Les endroits où le champ primaire et le champ de blindage actif se croisent (boîte rouge à la position (N, N, N)) peuvent provoquer un relâchement rapide de HP 129Xe. La caractérisation du champ de franges de l’aimant permet d’identifier les zones de sécurité où les réservoirs de HP 129Xe peuvent être placés sans relâchement rapide (boîte verte à la position (0,0,n)). Veuillez cliquer ici pour voir une version agrandie de cette figure.
Dossier supplémentaire 1 : Gestion de la polarisation pendant le transport. Veuillez cliquer ici pour télécharger ce fichier.
- Mesurez le T1 dépendant de la position de HP 129Xe dans le champ de franges (Figure 5C).
- Créez des points de référence avec des distances et des positions connues par rapport à l’isocentre de l’aimant le long des dimensions X, Y et Z. Étiquetez l’isocentre et étiquetez les autres positions n à N. Le nombre de postes à examiner dépendra de l’espace disponible.
- Hyperpolarisez un petit volume de 129Xe (~250 mL) et transportez-le vers la salle de contrôle de l’IRM. Remplissez une grande seringue (50-100 ml) avec du 129Xe et placez-la à l’isocentre de l’aimant (position 1 sur la figure 5C). Jouez une impulsion d’angle de retournement de ~1° pour mesurer le signal.
- Laissez la seringue en position pendant ~10 min, puis acquérez un autre spectre. Remesurez le signal toutes les 10 minutes jusqu’à ce qu’il ait décroît d’au moins 1 T1 (c’est-à-dire que le signal a décroît à ~1/3 de sa valeur initiale).
- Démarrez une nouvelle expérience T1 avec une nouvelle seringue de 129Xe en répétant l’étape 1.4.2.
- Déplacez la seringue dans une nouvelle position (par exemple, position n sur la figure 5C) et laissez-la là pendant 10 min. Remettez la seringue dans l’isocentre pour acquérir un spectre d’angle de retournement supplémentaire de ~1°.
- Répétez ce processus : déplacez la seringue en position n, attendez 10 min, remettez-la à l’isocentre et remesurez le signal jusqu’à ce qu’il ait diminué d’au moins 1 T1.
- Répétez les étapes 1.4.4 à 1.4.6 pour les positions de référence restantes couvrant les directions X, Y et Z.
- Le signal initial (S0) décroîtra de manière monoexponentielle sur n impulsions RF avec un angle de retournement θ . Ajustez le signal (S) en fonction du temps (t) dans le champ de franges pour calculer le T1 dans chaque position :
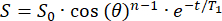 (2)
(2) - Identifier une position avec suffisamment de T1 (>20 min) pour le placement du réservoir 129Xe.
- Créez des canules d’intubation sans métal (Figure 6).
- Procurez-vous deux cathéters veineux à demeure en polytétrafluoroéthylène (PTFE) avec connecteurs Luer. Jetez les aiguilles dans un contenant d’élimination des objets tranchants.
REMARQUE : Pour les souris >25 g, utilisez des cathéters de 18 g et 20 g. Pour les petits animaux, utilisez des cathéters de 20 G et 22 G. - Coupez le connecteur Luer des cathéters. Insérez le plus petit cathéter dans l’extrémité supérieure du plus grand cathéter pour créer une canule plus effilée et plus longue. Coupez la canule composite à ~4,6 cm avec une extrémité biseautée, sans compter la base Luer (Figure 6A, B).
- Coupez l’extrémité la plus large d’une pointe de pipette de 200 μL sur une longueur de ~2,6 cm (Figure 6C).
- Enduire l’intérieur de la pointe de la pipette d’un lubrifiant général pour démoulage de moule. Utilisez une autre pointe de pipette insérée à l’intérieur pour répartir finement le lubrifiant. Remplissez l’embout de la pipette avec de l’époxy de pâte de vulcanisation de silicone acétoxy (Figure 6D, E).
- Branchez la canule avec un fil 22 G s’étendant des deux extrémités. Faites passer le tube de la canule à travers du silicone dans la pointe de la pipette. Étendez le tube de ~7 mm au-delà de l’extrémité de la pointe de la pipette (Figure 6F, G).
- Faites glisser le tube de la canule sur le côté le plus large de la pointe de la pipette à travers un connecteur Luer mâle en plastique, en collant les pièces ensemble avec l’époxy. Tronçonner le tube qui dépasse du connecteur Luer (Figure 6H).
- Attendez que l’époxy sèche (>24 h), puis retirez délicatement la canule d’intubation en silicone du moule de la pointe de la pipette. Retirez le fil de la canule en vous assurant que le tube n’a pas été obstrué (Figure 6I).
- Pour fabriquer une poignée pour une intubation facile, connectez le tube (1/16 » ou 1/8 ») à un connecteur Luer femelle. Lorsque vous êtes prêt pour l’intubation, connectez ce connecteur Luer femelle à la canule d’intubation Luer mâle. Cette pièce peut être facilement détachée après l’intubation (Figure 6J).
- Désinfecter avant chaque utilisation sur les animaux : essuyer l’extérieur de la canule avec de l’alcool à 70 %. Essuyez le fil de 20 g avec du désinfectant, puis faites passer le fil dans la canule pour désinfecter l’intérieur et éviter tout blocage.
- Procurez-vous deux cathéters veineux à demeure en polytétrafluoroéthylène (PTFE) avec connecteurs Luer. Jetez les aiguilles dans un contenant d’élimination des objets tranchants.
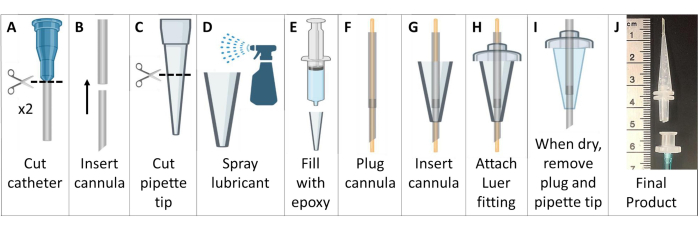
Figure 6 : Création de canules d’intubation de souris compatibles avec l’IRM et le HP 129Xe Ces canules sont constituées de cathéters veineux, d’embouts de pipette et d’un scellant au silicone, comme décrit à l’étape 1.5. Veuillez cliquer ici pour voir une version agrandie de cette figure.
2. Collecte quotidienne des données
REMARQUE : Voir le Fichier supplémentaire 2 : Liste de contrôle de l’assurance qualité pour l’examen préclinique.
Dossier supplémentaire 2 : Liste de contrôle de l’assurance qualité pour l’examen préclinique. Veuillez cliquer ici pour télécharger ce fichier.
- Contrôle quotidien complet de la qualité du scanner et configuration du ventilateur (Figure 4).
- Avec les fantômes, exécutez les protocoles d’assurance qualité sur le scanner (voir le Tableau 1 pour les paramètres de balayage de l’assurance qualité et l’étape 1.2 pour les étapes quotidiennes de contrôle de la qualité).
- Calibrer le ventilateur selon la méthode de J. Nouls et al.38. Voir le Fichier supplémentaire 3 : Étalonnage du ventilateur, la Figure supplémentaire 2 et la Figure supplémentaire 3.
- Réglez les paramètres du ventilateur pour l’imagerie à la fin de l’inspiration (Tableau 2). Placez le lit d’animal sur le support du scanner et le module de survie (c’est-à-dire les pièces mécaniques du ventilateur) sur la table à côté du scanner.
- Activez le système de chauffage des animaux spécifique au site. Réglez un appareil de chauffage à 35,5 - 40 °C, allumez la circulation de l’air et placez le tuyau d’air à moins de ~5" de l’endroit où la tête de l’animal reposera pour préchauffer l’alésage du scanner.
| Réglage de la ventilation | Recommandation pour l’IRM HP 129Xe | Notes |
| Volume courant (TV) | 8 à 10 ml/kg de poids corporel idéal | Télévision modérée ; un faible taux de production de la télévision nécessite un débit plus élevé, ce qui peut provoquer des artefacts de mouvement dans les images |
| Pression expiratoire positive en fin d’expiration (PEP) | 2–6 cmH2O | |
| Fréquence respiratoire (BR) | 80 à 120 br/min | |
| Manœuvres de recrutement (MR) | ~35 cmH2O pendant 6 s toutes les 5 min | |
| Durée de la ventilation ; Position | < 6 h ; Couchée | Couché sur le dos pour mieux voir les mouvements de la poitrine |
| Fraction d’oxygène inspiré (FIO2) | 0.3–0.5 | Prévenir l’hypoxie chez les souris anesthésiées |
| Rapport inspiratoire/expiratoire (I :E) | 1:2–1:4 | |
| Inspiratoire à la durée totale du cycle | 0.2–0.4 | |
| Ventilation minute | ≥0,57 mL·g-1·min-1 | |
| Nos normes : | ||
| BR = 80 br/min, durée de l’inspiration = 200 ms, FIO2 = 0,3 | ||
| Imagerie à la fin de l’inspiration : apnée = 200 ms, délai de déclenchement = 200 ms après le début de l’inspiration | ||
| Imagerie pendant l’apnée : apnée = 250 ms, délai de déclenchement = 250 ms après le début de l’inspiration | ||
| Imagerie à la fin de l’expiration : apnée = 200 ms, délai de déclenchement = 650 ms après le début de l’inspiration | ||
Tableau 2 : Réglages recommandés du ventilateur pour l’imagerie 129Xe. Les paramètres peuvent être ajustés en fonction d’objectifs d’étude spécifiques et de conditions expérimentales 117,118,119,120,121,122,123,124. Veuillez cliquer ici pour télécharger ce tableau.
Dossier supplémentaire 3 : Étalonnage du ventilateur. Veuillez cliquer ici pour télécharger ce fichier.
- Calmer et intuber l’animal.
- Allumez l’incubateur à 27,7 °C et/ou le coussin chauffant électrique à 37,7 °C. Mesurer et consigner la masse corporelle de l’animal. Calculer la dose de sédatif en fonction de la masse. Voir le tableau 3 pour un schéma posologique typique.
- Injectez le sédatif par voie intrapéritonéale. Notez le moment de l’injection et réglez la minuterie pour la prochaine dose de sédatif.
REMARQUE : Effectuez les étapes restantes de la section 2 (Collecte quotidienne des données) le plus rapidement possible afin de réduire au minimum le temps sous sédation et le risque de surdose. - Appliquez du lubrifiant pour les yeux de l’animal et placez-le dans une cage sur le coussin chauffant ou dans un incubateur pour prévenir l’hypothermie.
- Confirmez que l’animal est complètement sous sédatif en effectuant un test de pincement des orteils 10 à 15 minutes après l’injection de sédatif68. Intuber en suivant les procédures décrites dans Das et al.69.
REMARQUE : L’article de Das et al.69 est accompagné d’une démonstration vidéo complète de la technique. Les étapes sont les suivantes : - Suspendez l’animal en décubitus dorsal par les dents sur une planche inclinée. Utilisez un abaisse-langue pour rongeur pour retirer la langue.
- Pour vous assurer que les cordes vocales sont visibles, fournissez une lumière blanche via un câble à fibre optique à l’intérieur de la canule d’intubation ou une lumière vive placée à l’extérieur de la gorge. Insérez la canule à moins de 5 mm au-delà des cordes vocales.
- Assurez-vous que la canule se trouve dans la trachée, et non dans l’œsophage, en la connectant à un morceau de tube avec une petite goutte d’eau à l’intérieur. Si la gouttelette d’eau se déplace au rythme de la respiration de l’animal, le positionnement est probablement correct.
| Agent | Dose | Route | Durée | Commentaires | |||
| Agents inhalés | |||||||
| L’isoflurane | Induction : 4 % à 5 % Entretien : 1 %– 3 % ou à effet | Inhalé | Pendant l’écoulement continu | • Nécessite l’utilisation d’un vaporisateur calibré | |||
| Agents injectables | |||||||
| Recommandé : Kétamine + xylazine + acépromazine | 90 + 9 + 3 mg/kg | Intrapéritonéale | De 20 à 60 minutes | • Crée une susceptibilité à l’hypothermie | |||
| • Pour des doses répétées, il est recommandé de passer à un mélange de kétamine + xylazine pour éviter un surdosage | |||||||
| • Provoque des secousses à mesure qu’il s’estompe. Pour l’imagerie, respectez strictement le schéma posologique | |||||||
| • Peut provoquer une bradycardie | |||||||
| Kétamine + xylazine | 90 + 9 mg/kg | Intrapéritonéale | De 20 à 40 minutes | • Voir ci-dessus (Kétamine + xylazine + acépromazine) | |||
| Pentobarbital | 50 à 70 mg/kg | Intrapéritonéale | De 20 à 60 minutes | • Diminue la fréquence respiratoire et les mouvements | |||
| • Les dépenses peuvent être prohibitives | |||||||
| • La qualité pharmaceutique peut ne pas être disponible | |||||||
| Avis de non-responsabilité : Il s’agit de directives générales. Consultez un vétérinaire pour plus d’informations avant la mise en œuvre. | |||||||
Tableau 3 : Formulaire d’anesthésiques courants pour les souris. Veuillez cliquer ici pour télécharger ce tableau.
- Aérer l’animal (tableau 2).
- Fixez l’animal au ventilateur à l’aide du connecteur Luer sur la canule d’intubation. Surveiller le mouvement diaphragmatique et la pression inspiratoire maximale (~10-12 cm H2O pour un volume courant de 10 mL/kg de poids corporel). Si la pression ou le mouvement respiratoire est anormal, ajustez soigneusement l’angle du cou et la profondeur de la canule au besoin.
- Assurez-vous que la canule d’intubation est hermétique en effectuant une manœuvre de recrutement : évitez l’expiration (p. ex., avec un doigt, bloquez l’orifice d’expiration) de sorte que l’animal inspire plusieurs fois sans expirer.
REMARQUE : Si la pression des voies respiratoires atteint 35 cmH2O pression inspiratoire de crête sur ~6 s, l’étanchéité des voies respiratoires est suffisamment étanche. Si ce n’est pas le cas, consultez la discussion pour le dépannage. - Laissez l’expiration normale reprendre. Effectuez des manœuvres de recrutement entre les examens et toutes les ~5 minutes lorsqu’il n’y a pas d’examen pour maintenir la compliance pulmonaire et prévenir l’atélectasie. Connectez la valve PEP à la conduite d’expiration. Réglez la PEP sur 4 cmH2O. Regardez la pression inspiratoire maximale augmenter de cette quantité.
- Une fois l’intubation réussie, planifiez et initialisez la production de HP 129Xe autour du calendrier de redose de sédatif pour éviter que l’animal ne se réveille pendant un examen. Surveillez la température corporelle tout au long de l’expérience.
- Acquisition de données : Collectez des images de ventilation.
REMARQUE : Les étapes d’acquisition de données 2.4, 2.5 et 2.6 peuvent être effectuées dans n’importe quel ordre- Réglez le ventilateur conformément au tableau 2 pour l’imagerie à la fin de l’inspiration.
- Chargez les protocoles de configuration suivants : localisateur d’animal à protons, impulsion unique pour centrer la fréquence du gaz dans les poumons de la souris et localiseur d’animal 129Xe. Voir le Tableau 4 pour les paramètres de balayage.
- Positionnez l’animal à l’isocentre et confirmez que la cavité thoracique est au centre du champ de vision avec localisation du proton. Si vous utilisez des bobines à fréquence unique, remplacez la bobine de protons par une bobine RF 129Xe.
- Enregistrez la polarisation Xe 129et transportez-la vers le scanner IRM. Voir le Dossier supplémentaire 4 : Liste de contrôle de l’assurance qualité de la polarisation au xénon.
- Placez un sac de 129Xe dans le bidon du ventilateur et fermez-le. Connectez la cartouche dans l’alignement du ventilateur et laissez la cartouche se pressuriser (3 - 6 psig).
- Amorcer la ventilation mécanique 129Xe. Chaque fois que la ventilation 129Xe est activée, laissez l’animal effectuer ~5 respirations avant de commencer un balayage pour retourner la capacité résiduelle fonctionnelle des poumons.
REMARQUE : Passez au mélange N2 / O2 entre 129balayages Xe pour économiser le gaz hyperpolarisé. - À l’aide d’une seule impulsion, ajustez la fréquence de travail pour qu’elle corresponde à la fréquence de résonance in vivo du gaz 129Xe (~83,07 MHz à 7 T). Copiez la fréquence pour tous les balayages ultérieurs de la phase gazeuse 129Xe. Effectuez la localisation de 129Xe pour confirmer que les poumons sont isocentriques.
- Chargez et exécutez la séquence de ventilation radiale 129Xe. Surveillez la pression inspiratoire maximale.
REMARQUE : Si le gaz 129Xe s’épuise avant la fin du protocole, la pression inspiratoire maximale diminuera rapidement. Un sac de 400 mL de 129Xe peut ventiler une souris de 30 g pendant ~24 min lorsqu’il est ventilé avec 70 % de 129Xe à 80 respirations par minute avec un volume courant de 10 mL/kg de poids corporel idéal. - Une fois le balayage terminé, passez à la ventilation avec lemélange N2/O2 et retirez le sac vide de 129Xe.
- Pour l’imagerie à la fin de l’expiration, modifiez la durée de l’apnée et le délai de déclenchement conformément au tableau 2 et répétez les étapes 2.4.2 à 2.4.9.
- Exportez les données brutes du scanner.
| Nom abrégé du protocole | Description de la séquence | Gâchette | TR (ms) | TE (ms) | Répétitions | Angle de retournement (°) | Taille de la matrice ou Npts | Champ de vision (mm2) | RF BW (kHz) | Épaisseur de la tranche/dalle (mm) | Durée de l’analyse |
| Impulsion unique | Acquisition d’impulsions (phase gazeuse) | Optionnel | 1000 | 1 | 60 | 2048 | 10 | 1 s | |||
| Localisateur d’animaux | GRE 2D | Oui | 50 | 1.7 | 1 | 60 | 642 | 322 | 3 | 25 | Années 60 |
| Ventilation radiale | 3D multi-écho radial | Oui | 20 | Voir la légende | 1 | 30 | 613 | 223 | 32.05 | 30 | Durée : 16 minutes |
| Impulsion unique en phase dissoute | Acquisition d’impulsions (phase dissoute) | Non | 80 | 1 | 90 | 512 | 10.35 | 80 ms | |||
| Spécification dynamique de la phase dissoute. | Acquisition d’impulsions (phase dissoute) | Non | 50 | 1000 | 90 | 512 | 10.5 | Années 50 | |||
| Pondéré en diffusion | GRE 2D | Oui | 12.2 | 8.1 | 4 | 45 | 642 | 322 | 3 | 1.5 | Durée : 18 minutes |
Tableau 4 : Paramètres de séquence in vivo . La séquence de ventilation radiale multi-échos 3D décrite précédemment39 permet d’acquérir des images à 6 temps d’écho. Les résultats sont présentés pour la première image d’écho (TE = 1,12 ms, figure 7). Veuillez cliquer ici pour télécharger ce tableau.
Fichier supplémentaire 4 : Liste de contrôle de l’assurance qualité de la polarisation au xénon. Veuillez cliquer ici pour télécharger ce fichier.
- Acquisition de données : Exécution de la spectroscopie dynamique en phase dissoute.
- Réglez le ventilateur conformément au tableau 2 pour l’imagerie pendant l’apnée. Réglez le BR sur 100 respirations/min. Préparez-vous à un nouveau sac de 129Xe comme aux étapes 2.4.2 à 2.4.5.
- Amorcer la ventilation mécanique 129Xe. Chargez et exécutez une seule impulsion pour ajuster la fréquence de travail en fonction de la fréquence dissoute (~83,084 MHz à 7 T). Copiez la fréquence de travail dans la spectroscopie dynamique en phase dissoute.
REMARQUE : Il s’agira d’un pic unique chez les souris avec une hémoglobine54 de type sauvage. - Chargez et exécutez la séquence de spectroscopie dynamique centrée sur la fréquence dissoute dans les poumons des animaux. Une fois le balayage terminé, passez à la ventilation avec lemélange N2/O2 et retirez le sac vide de 129Xe. Exportez les données brutes du scanner.
- Acquisition de données : Collectez des images pondérées en fonction de la diffusion.
- Réglez le ventilateur conformément au tableau 2 pour l’imagerie pendant l’apnée. Préparez-vous à un nouveau sac de 129Xe comme aux étapes 2.4.2 à 2.4.7.
- Chargez et exécutez la séquence pondérée en diffusion. Une fois le balayage terminé, passez à la ventilation avec lemélange N2/O2 et retirez le sac vide de 129Xe. Exportez les données brutes du scanner.
3. Conclusion de l’expérience
- Récupérer l’animal.
- Tirez la canule d’intubation tout droit hors de la bouche de l’animal. Si l’animal ne commence pas immédiatement à respirer spontanément, administrez de légères compressions thoraciques. Si possible, administrez un léger flux d’oxygène de qualité médicale près du visage de l’animal pour favoriser la récupération de la sédation.
- Une fois que l’animal respire régulièrement par lui-même et s’il a été sous sédation pendant >2 h, administrez 0,5 à 1 mL de solution saline normale par voie sous-cutanée pour prévenir la déshydratation.
- Remettez l’animal seul dans une cage. Placez la cage dans un incubateur ou sur un coussin chauffant.
REMARQUE : Les animaux sous sédation sont vulnérables au cannibalisme et ne peuvent pas être placés dans une cage avec leurs compagnons de cage jusqu’à ce qu’ils soient complètement rétablis (c.-à-d. qu’ils se déplacent de manière indépendante). Les animaux sous sédation ne peuvent pas réguler leur température corporelle. Utilisez le dos de la main pour sentir la température de l’animal toutes les quelques minutes. - Surveillez de près l’animal jusqu’à ce que son réflexe de redressement soit de retour (c.-à-d. qu’il peut passer indépendamment d’une position couchée à une position couchée).
- Retirez l’animal du support thermique une fois qu’il peut se déplacer indépendamment. Remettez l’animal dans une cage avec ses compagnons de cage.
REMARQUE : si l’animal n’a pas de compagnon de cage, il est plus sensible à l’hypothermie induite par la sédation. Fournissez à l’animal une litière supplémentaire et, si possible, laissez-le dans un incubateur pendant la nuit. - Notez le poids de l’animal une fois par semaine pendant 2 semaines pour surveiller sa santé.
REMARQUE : Si l’animal a subi une blessure à la bouche ou à l’œsophage lors de l’intubation, il peut cesser de manger. Si l’animal perd >20 % de son poids corporel initial, consultez un vétérinaire au sujet de l’euthanasie.
- Analysez les images de ventilation (Figure 7).
- Chargez des données brutes dans une plate-forme de programmation. Téléchargez le cadre de reconstruction open-source pour les images non cartésiennes91.
- Reconstruisez les images selon les instructions du cadre open source. Normaliser le premier point sur chaque projection radiale39.
- Segmentez le parenchyme pulmonaire dans les images, y compris les voxels avec un signal 129Xe faible ou nul. N’incluez pas les grandes voies respiratoires. Segmentez le bruit de fond dans l’image, à l’exclusion des poumons, des voies respiratoires et des artefacts d’imagerie.
REMARQUE : L’image du localisateur de protons peut aider à déterminer les limites parenchymateuses. - Calculez le SNR à l’aide de la formule :
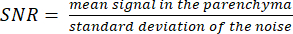 (3)
(3) - Quantifier la ventilation défectueuse.
REMARQUE : Diverses méthodes ont été proposées pour quantifier la ventilation déficiente dans des modèles de petits animaux. Les méthodes d’analyse restent un domaine de recherche ouvert, mais les approches faciles à mettre en œuvre comprennent : (i) la segmentation manuelle semi-quantitative92, (ii) l’approche histogramme utilisant le signal de la trachée pour normaliser le signal parenchymateux47, et (iii) la segmentation du volume pulmonaire total (TLV) et la définition d’un seuil de signal (par exemple, <60 % de la moyenne pulmonaire totale) pour diviser les poumons en volume défectueux et volume pulmonaire ventilé (VV). Quantifier VDP93,94 en fonction de :
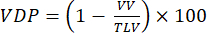 (4)
(4)
- Analysez la spectroscopie dynamique en phase dissoute (Figure 8).
- Chargez des données brutes dans une plate-forme de programmation. Effectuez une transformée de Fourier rapide et phasez les spectres (une mise en phase manuelle simultanée des spectres d’ordre zéro est suffisante pour cette application).
- Calculez les données standard de résonance magnétique nucléaire (RMN)95,96 : SNR, demi-max pleine largeur, aire intégrée, décalage chimique et phase des deux pics.
- À partir des données de magnitude, divisez l’amplitude du signal du spectre dissous par celle du spectre des gaz pour chaque répétition afin de déterminer le rapport dissous/gaz au fil du temps.
- Analysez les images pondérées en fonction de la diffusion (Figure 9).
- Chargez des données brutes dans une plate-forme de programmation. Segmentez le parenchyme pulmonaire de l’image b0 comme à l’étape 3.2.3. Calculez le SNR pour chaque image de valeur b.
- Calculez le rapport valeur/bruit du signal, SVNR0, en divisant le signal dans chaque voxel de l’image b0 par l’écart-type du bruit de l’image. Excluez les voxels avec SVNR0 < 2,5 fois le bruit de l’image97.
REMARQUE : Le SVNR0 est une métrique de voxel individuel, tandis que le SNR parenchymateux est une métrique de l’ensemble du poumon. - Calculer l’ADC en ajustant la décroissance du signal sur les valeurs b (bi) conformément à l’équation 598,99 :
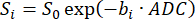 (5)
(5)
Access restricted. Please log in or start a trial to view this content.
Résultats
Ventilation Images
Si les procédures de préparation des animaux et de ventilation sont correctement mises en œuvre, l’imagerie radiale 3D peut capturer avec succès les modèles de ventilation lorsque l’acquisition des données est effectuée à l’inspiration ou à l’expiration (Figure 7). Bien que ces images soient recueillies sur de nombreuses respirations, la méthode décrite ici est similaire à la...
Access restricted. Please log in or start a trial to view this content.
Discussion
L’IRM hyperpolarisée 129Xe est en train de devenir une technique sophistiquée et puissante pour étudier la microstructure et la fonction pulmonaires dans des modèles de petits animaux. Ce protocole a pour but de guider la préparation initiale du site et de décrire les procédures expérimentales nécessaires pour quantifier la ventilation, la diffusion et l’échange gazeux dans les poumons de souris avec HP 129Xe. Les principales conditions préalables aux...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Peter Niedbalski est consultant pour Polarean Imaging, Plc.
Remerciements
Les auteurs expriment leur sincère gratitude à Jerry Dalke pour avoir été un phare dans la construction de ventilateurs. Nous tenons à remercier Carter McMaster pour le brassage du gaz HP 129Xe. Nous tenons également à remercier le Dr Matthew Willmering et le Dr Juan Parra-Robles pour leurs discussions scientifiques stimulantes. Figurines créées avec BioRender.com. Ce travail a été financé par les National Institutes of Health (subventions n° : NHLBI R01HL143011, R01HL151588)
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| 1 mL syringe | fisher scientific | Catalog No.14-955-464 | https://www.fishersci.com/shop/products/sterile-syringes-single-use-12/14955464 |
| 10 mL graduated cylinder | Cole-Parmer | UX-34502-69 | https://www.coleparmer.com/i/cole-parmer-essentials-graduated-cylinder-glass-hexagonal-base-10-ml-2-pk/3450269?PubID=UX&persist=true&ip=no& gad_source=1&gclid=CjwKCAi A6KWvBhAREiwAFPZM7h3do -ssjascARuVviKd7V7kC5ztdIB6 _70DnMr-K3qk9RKeJ7-IrhoCeT 0QAvD_BwE |
| 18 G - veinous PFTE catheters (nonsterile) | Terumo Surflo | SROX1832CA | https://www.shopmedvet.com/product/iv-catheter-18-x-1-25inch?r=GSS17&p=GSS17&utm_source= google&utm_medium=google_ shopping&gad_source=1&gclid= CjwKCAiA0bWvBhBjEiwAtEsoW 4oTvZkAgWQCda6ocVtQlulVrG 2536FNbu5soMVSFN8xK_g1Uh pXIRoCGwoQAvD_BwE |
| 20 G - veinous PFTE catheters (nonsterile) | Terumo Surflo | SROX2051CA | https://www.shopmedvet.com/product/iv-catheter-20-x-2inch?r=GSS17&p=GSS17&utm_source =google&utm_medium=google_ shopping&gad_source=1&gclid= CjwKCAiA0bWvBhBjEiwAtEsoW 87ggCkgToD_XF_UgpQBTpmN dgSNfCml6TkDKlW8k27Dq_daR itPuhoCnBQQAvD_BwE |
| 22 G - veinous PFTE catheters (nonsterile) | Terumo Surflo | SROX2225CA | https://www.shopmedvet.com/product/iv-catheter-22-x-1inch?r=GSS17&p=GSS17&utm_source= google&utm_medium=google_ shopping&gad_source=1&gclid =CjwKCAiA0bWvBhBjEiwAtEso W9IM6mpee6m7e-lBfR8dZhSN KYbMUs7qgEU4gYCRTW_rJAs W_lGkthoCm30QAvD_BwE |
| 400 mL tedlar bags | Jensen Inert Products | GST-001S-3507TJC | NA |
| 60 mL syringe | fisher scientific | Catalog No.14-955-461 | https://www.fishersci.com/shop/products/sterile-syringes-single-use-12/14955461 |
| 70% alcohol | Cole-Parmer | UX-80024-34 | https://www.coleparmer.com/i/labchem-isopropyl-alcohol-70-v-v-500-ml/8002434?PubID=UX&persist=true&ip= no&gad_source=1&gclid=CjwKC AiA6KWvBhAREiwAFPZM7gGh p8g7MBHBBKadaRCAwfEMgV gna5fhYRsuXIuqoqOiToCC4fem nhoCGMEQAvD_BwE |
| Dewar for liquid nitrogen | Terra Universal | 4LDB | https://www.laboratory-equipment.com/tw-4ldb-liquid-nitrogen-dewar-ic-biomedical.html?srsltid=AfmBOooxwMtOA1Z2TweR P8V5Iy5EvYT3alZuzoiY 3UF3Ib9RgFnDxVTfWP0 |
| Eye lubricant | Refresh | REFRESH P.M. | https://www.refreshbrand.com/Products/refresh-pm |
| Fiber optic light | AmScope | HL250-AY | https://amscope.com/products/hl250-ay?tw_source=google &tw_adid=&tw_campaign= 16705014684&gad_source= 1&gclid=CjwKCAiA6KWvBhA REiwAFPZM7p-DpyvHJaGxR pAD1385hzGf1oPdKHHLFDR Sp8yrtxry11SNJeJnKxoCtAoQ AvD_BwE |
| Gaussmeter | Apex Magnets | GMHT201 | https://www.apexmagnets.com/magnets/accessories/ht-digital-gaussmeter-with-peak-hold-can-display-gauss-or-tesla |
| Glass vessel (phantom) | Ace Glass | 8648-24 | https://aceglass.com/results.php?t=8648-24&t=8648-24 |
| Heating pad | Office Depot | 9206211 | Pure Enrichment PureRelief Express Designer Series Heating Pad 12 x 15 Palm Aqua - Office Depot |
| Hyperpolarizer | Polarean | 9820 | https://polarean.com/xenon-mri-platform/ |
| Intubation board | Hallowell EMC | 000A3467 | https://hallowell.com/product/rodent-tilting-workstand/ |
| Intubation supplies | Parts list published elsewhere | NA | https://app.jove.com/t/50318/a-simple-method-of-mouse-lung-intubation |
| Isotopically enriched xenon cylinder | Linde Isotopes | XE-129(1%)N2(10%)HE CGMP 302SZ | NA |
| Liquid nitrogen | Linde | NI LC160-22 | https://www.lindedirect.com/store/product-detail/nitrogen_n2_nitrogen_liquid _lc160_22_psi_ni_lc160_22 /ni-lc160-22?cat_id=shop&node=b89 |
| Male slip luer | Cole-Parmer | UX-21943-27 | https://www.coleparmer.com/i/diba-omnifit-t-series-solvent-waste-cap-adapter-polypropylene-male-luer-slip-x-1-16-id-hose-barb-5-pk/2194327 |
| Manometer | Grainger | 3T294 | https://www.grainger.com/product/3T294?gucid=N:N:PS: Paid:GGL:CSM-2295:4P7A1P: 20501231&gad_source=1&gclid =CjwKCAiAi6uvBhADEiwAWiyR dltxrPJmmcm0bFiYLuPrB25HV QFdEfKMBqvgJBNdQUs3DZ7b TLr8CRoCanAQAvD_BwE& gclsrc=aw.ds |
| Minivent ventilator | harvard apparatus | 73-0044 | https://www.harvardapparatus.com/minivent-ventilator-for-mice-single-animal-volume-controlled-ventilators.html |
| Mouse ear puncher | fisher scientific | 13-812-201 | https://www.fishersci.com/shop/products/fisherbrand-animal-ear-tag-punch/13812201 |
| Mouse tongue depressor | Medical Tools | VRI-617 | https://medical-tools.com/shop/rodent-tongue-depressor.html |
| Mouse weight scale | Cole-Parmer | UX-11712-12 | https://www.coleparmer.com/i/adam-equipment-cqt2000-core-portable-balance-2000g-x-1g-220-v/1171212?PubID=UX&persist=true&ip=no&gad _source=1&gclid=CjwKCAiA6K WvBhAREiwAFPZM7iYnAG5Ilc Z5DZWrdJ6wcLDZSCSfNJHOH m2PQOpyyWe0TjFa75R3tBoCjB sQAvD_BwE |
| MRI scanner | Bruker | 7T Biospec horizontal system | https://www.bruker.com/de/products-and-solutions/preclinical-imaging/mri/biospec.html |
| Multimeter | Home Depot | 1007898529 | https://www.homedepot.com/p/Klein-Tools-600-Volt-Digital-Multi-Meter-Manual-Ranging-MM325/320822947 |
| Natural abundance xenon | Linde Isotopes | UN 2036 | NA |
| Needle | fisher scientific | 305194 | https://www.fishersci.com/shop/products/bd-general-use-precisionglide-hypodermic-needles-20/148266C?keyword=true |
| Needle safe syringe holder | fisher scientific | NC2703873 | https://www.fishersci.com/shop/products/ndlsafe-ii-syr-uncap-deca/NC2703873#?keyword=needlesafe |
| Nitrogen cylinder | Linde | NI M-K | https://www.lindedirect.com/store/product-detail/nitrogen_n2_nitrogen_nf_k/ni-m-k?cat_id=shop&node=b89 |
| Oxygen cylinder | Linde | OX M-K | https://www.lindedirect.com/store/product-detail/oxygen_o2_oxygen_usp_k/ox-m-k?cat_id=shop&node=b90 |
| Oxygen sensor | Apogee instruments | MO-200 | https://www.apogeeinstruments.com/mo-200-oxygen-sensor-with-handheld-meter/ |
| Oxygen sensor inline flowhead | Apogee instruments | AO-002 | https://www.apogeeinstruments.com/ao-002-oxygen-meter-sensor-flow-through-head/ |
| PEEP valve | Hallowell EMC | 000A6556A | https://hallowell.com/product/adjustable-peep-valve-with-exhaust-port-range-5-20cm-disposable/ |
| Pipette tips | fisher scientific | Catalog No.02-707-108 | Fisherbrand Stack-Rack Space-Saver Tips: 101-1000 L Standard; Blue; Volume: | Fisher Scientific |
| Plunger valve | Ace glass | 8648-20 | https://www.aceglass.com/results.php?t=8648 |
| Preclinical coil | Doty scientific | custom built | https://dotynmr.com/products/bmax-xy-low-e/ |
| Pressure regulators | Cole-Parmer | UX-98202-11 | https://www.coleparmer.com/i/cole-parmer-single-stage-regulator-1500-scfh-capacity-346-cga-fitting/9820211?PubID=UX&persist=true&ip=no& gad_source=1&gclid=CjwKCAi A6KWvBhAREiwAFPZM7pruR xCAiaj52nA_8Y1nveQZRsD6B f0QO65o2DKFYqRoz0PopSkX QxoCxqcQAvD_BwE |
| Pressure-drop ventilator | Parts list published elsewhere | NA | https://sites.duke.edu/driehuyslab/resources/ |
| PVC pipe for phantom | Home Depot | 193682 | https://www.homedepot.com/p/IPEX-1-2-in-x-10-ft-White-PVC-SCH-40-Potable-Pressure-Water-Pipe-30-05010HD/319692959 |
| SAI animal heating system | SAII | Model 1030 | https://i4sa.com/product/model-1030-monitoring-gating-system/ |
| Saline | Farris Laboratories Inc. | 0409488820-1 | https://www.farrislabs.com/products/bacteriostatic-sodium-chloride-0-9-30ml-bottle?variant=42807174824167¤cy =USD&utm_medium=product_ sync&utm_source=google&utm_ content=sag_organic&utm_ campaign=sag_organic&utm_ campaign=gs-2021-09-24&utm _source=google&utm_medium =smart_campaign&gad_source =1&gclid=CjwKCAiA6KWvBh AREiwAFPZM7oS3-hFDETO_2f6OWOoKyBMb WuDuWqYxdWRYUWEkY M2Py73VfGzVtRoC2FQQAvD_BwE |
| Sharps container | fisher scientific | 22-730-455 | https://www.fishersci.com/shop/products/sharps-container-47/p-7250579#?keyword=needle%20safe |
| Silicone epoxy | Grainger | 3KMY7 | https://www.grainger.com/product/3KMY7?gucid=N:N:PS:Paid:GGL:CSM- 2295:4P7A1P:20501231&gad_ source=1&gclid=CjwKCAiA6KW vBhAREiwAFPZM7voahkm8tda t1Euql1A8DFhC6AZVJ0wXzCE PfE6iUzrIJXV-Hl8o4xoCQLYQA vD_BwE&gclsrc=aw.ds |
| Silicone mold release lubricant | Grainger | 19MW95 | https://www.grainger.com/product/CRC-Mold-Release-Agent-16-oz-19MW95 |
| Spirometer | ADInstruments | FE141 | https://www.adinstruments.com/products/spirometer |
| Spirometer - mouse flowhead | ADInstruments | MLT1L | https://www.adinstruments.com/products/respiratory-flow-heads |
| Tubing - 1/4 OD | Clippard | URH1-0402-CLT-050 | https://www.clippard.com/part/URH1-0402-CLT-050 |
| Tubing - 1/8 OD | Clippard | URH1-0804-CLT-050 | https://www.clippard.com/part/URH1-0402-CLT-050 |
| Vacuum pump | Cole-Parmer | UX-60062-11 | https://www.coleparmer.com/i/environmental-express-diaphragm-pump-high-volume-120v/6006211?PubID=UX&persist=true&ip=no&gad _source=1&gclid=CjwKCAiA6K WvBhAREiwAFPZM7uFGwmW pRelHNFgZVvJJV09vDUVyfyG HoKeZTiFNIiVTe-05IpJJPxoCO PoQAvD_BwE |
| Wire - 18 gauge | Digikey | 2328-18H240-ND | https://www.digikey.com/en/products/detail/remington-industries/18H240/15202027?s=N4 IgjCBcoOwBxVAYygMwIYBsDOB TANCAPZQDa4YATPAGwgC6h ADgC5QgDKLATgJYB2AcxAB fQmAAMAFkqIQKSBhwFiZEA GZNATi0SGzNpE48BwsSErqw 6uQqV5CJSOQCsMF%2Bq11 GIVuy58QqLmss4gALbogvy4L AAEAO683LgMIkA |
| Xenon polarization measurement station | Polarean | NA | https://polarean.com/xenon-mri-platform/ |
Références
- World Health Organization. Global health estimates 2020: Deaths by cause, age, sex, by country and by region, 2000-2019. World Health Organization. , Geneva. (2020).
- Middleton, P. G., et al. Elexacaftor-Tezacaftor-Ivacaftor for cystic fibrosis with a single Phe508del allele. N Engl J Med. 381 (19), 1809-1819 (2019).
- Taylor-Cousar, J. L., et al. Tezacaftor-Ivacaftor in patients with cystic fibrosis homozygous for Phe508del. N Engl J Med. 377 (21), 2013-2023 (2017).
- Richeldi, L., et al. Efficacy and safety of nintedanib in idiopathic pulmonary fibrosis. N Engl J Med. 370 (22), 2071-2082 (2014).
- King, T. E., et al. A phase 3 trial of pirfenidone in patients with idiopathic pulmonary fibrosis. N Engl J Med. 370 (22), 2083-2092 (2014).
- Yong, K. S. M., Her, Z., Chen, Q. Humanized mice as unique tools for human-specific studies. Arch Immunol Ther Exp (Warsz. 66 (4), 245-266 (2018).
- Li, H., Auwerx, J. Mouse systems genetics as a prelude to precision medicine. Trends Genet. 36 (4), 259-272 (2020).
- Eppig, J. T., Motenko, H., Richardson, J. E., Richards-Smith, B., Smith, C. L. The International Mouse Strain Resource (IMSR): cataloging worldwide mouse and ES cell line resources. Mamm Genome. 26 (9-10), 448-455 (2015).
- Vedi, M., et al. 2022 updates to the rat genome database: A Findable, Accessible, Interoperable, and Reusable (FAIR) resource. Genetics. 224 (1), 042(2023).
- Ghorani, V., Boskabady, M. H., Khazdair, M. R., Kianmeher, M. Experimental animal models for COPD: a methodological review. Tob Induc Dis. 15, 25(2017).
- Semaniakou, A., Croll, R. P., Chappe, V. Animal models in the pathophysiology of cystic fibrosis. Front Pharmacol. 9, 1475(2018).
- Moore, B. B., et al. Animal models of fibrotic lung disease. Am J Respir Cell Mol Biol. 49 (2), 167-179 (2013).
- Jenkins, R. G., et al. An official American thoracic society workshop report: Use of animal models for the preclinical assessment of potential therapies for pulmonary fibrosis. Am J Respir Cell Mol Biol. 56 (5), 667-679 (2017).
- Gomez-Arroyo, J., et al. A brief overview of mouse models of pulmonary arterial hypertension: problems and prospects. Am J Physiol Lung Cell Mol Physiol. 302 (10), L977-L991 (2012).
- Dignam, J. P., Scott, T. E., Kemp-Harper, B. K., Hobbs, A. J. Animal models of pulmonary hypertension: Getting to the heart of the problem. Br J Pharmacol. 179 (5), 811-837 (2022).
- Woodrow, J. S., Sheats, M. K., Cooper, B., Bayless, R. Asthma: The use of animal models and their translational utility. Cells. 12 (7), 1091(2023).
- Van de Velde, G., et al. Longitudinal in vivo microcomputed tomography of mouse lungs: No evidence for radiotoxicity. Am J Physiol Lung Cell Mol Physiol. 309 (3), L271-L279 (2015).
- Mata, J. F., et al. Evaluation of emphysema severity and progression in a rabbit model: comparison of hyperpolarized 3He and 129Xe diffusion MRI with lung morphometry. J Appl Physiol (1985). 102 (1985), 1273-1280 (2007).
- Boudreau, M., Xu, X., Santyr, G. E. Measurement of 129Xe gas apparent diffusion coefficient anisotropy in an elastase-instilled rat model of emphysema. Magn Reson Med. 69 (1), 211-220 (2013).
- Cleveland, Z. I., et al. 3D MRI of impaired hyperpolarized 129Xe uptake in a rat model of pulmonary fibrosis. NMR Biomed. 27 (12), 1502-1514 (2014).
- Kimura, A., et al. Inflammation during lung cancer progression and ethyl pyruvate treatment observed by pulmonary functional hyperpolarized 129Xe MRI in mice. Contrast Media Mol Imaging. 2021, 9918702(2021).
- Kimura, A., et al. Treatment response of ethyl pyruvate in a mouse model of chronic obstructive pulmonary disease studied by hyperpolarized 129Xe MRI. Magn Reson Med. 78 (2), 721-729 (2017).
- Ouriadov, A., et al. Early stage radiation-induced lung injury detected using hyperpolarized 129Xe Morphometry: Proof-of-concept demonstration in a rat model. Magn Reson Med. 75 (6), 2421-2431 (2016).
- Willmering, M. M., et al. Improved pulmonary 129Xe ventilation imaging via 3D-spiral UTE MRI. Magn Reson Med. 84 (1), 312-320 (2020).
- Kaushik, S. S., et al. Single-breath clinical imaging of hyperpolarized 129Xe in the airspaces, barrier, and red blood cells using an interleaved 3D radial 1-point Dixon acquisition. Magn Reson Med. 75 (4), 1434-1443 (2016).
- Zanette, B., Munidasa, S., Friedlander, Y., Ratjen, F., Santyr, G. A 3D stack-of-spirals approach for rapid hyperpolarized 129Xe ventilation mapping in pediatric cystic fibrosis lung disease. Magn Reson Med. 89 (3), 1083-1091 (2023).
- Zanette, B., Stirrat, E., Jelveh, S., Hope, A., Santyr, G. Physiological gas exchange mapping of hyperpolarized 129Xe using spiral-IDEAL and MOXE in a model of regional radiation-induced lung injury. Med Phys. 45 (2), 803-816 (2018).
- Collier, G. J., et al. Dissolved 129Xe lung MRI with four-echo 3D radial spectroscopic imaging: Quantification of regional gas transfer in idiopathic pulmonary fibrosis. Magn Reson Med. 85 (5), 2622-2633 (2021).
- Qing, K., et al. Assessment of lung function in asthma and COPD using hyperpolarized 129Xe chemical shift saturation recovery spectroscopy and dissolved-phase MRI. NMR Biomed. 27 (12), 1490-1501 (2014).
- Ruppert, K., Brookeman, J. R., Hagspiel, K. D., Mugler, J. P. Probing lung physiology with xenon polarization transfer contrast (XTC). Magn Reson Med. 44 (3), 349-357 (2000).
- Kern, A. L., et al. Investigating short-time diffusion of hyperpolarized 129Xe in lung air spaces and tissue: A feasibility study in chronic obstructive pulmonary disease patients. Magn Reson Med. 84 (4), 2133-2146 (2020).
- Amzajerdian, F., et al. Simultaneous quantification of hyperpolarized xenon-129 ventilation and gas exchange with multi-breath xenon-polarization transfer contrast (XTC) MRI. Magn Reson Med. 90 (6), 2334-2347 (2023).
- Perron, S., et al. Application of a 2D frequency encoding sectoral approach to hyperpolarized 129Xe MRI at low field. J Magn Reson. 336, 107159(2022).
- Loza, L. A., et al. Quantification of ventilation and gas uptake in free-breathing mice with hyperpolarized 129Xe MRI. IEEE Trans Med Imaging. 38 (9), 2081-2091 (2019).
- Imai, H., et al. Regional fractional ventilation mapping in spontaneously breathing mice using hyperpolarized 129Xe MRI. NMR Biomed. 28 (1), 24-29 (2015).
- Friedlander, Y., et al. Effect of inhaled oxygen concentration on 129Xe chemical shift of red blood cells in rat lungs. Magn Reson Med. 86 (3), 1187-1193 (2021).
- Virgincar, R. S., et al. A portable ventilator with integrated physiologic monitoring for hyperpolarized 129Xe MRI in rodents. J Magn Reson. 295, 63-71 (2018).
- Nouls, J., Fanarjian, M., Hedlund, L., Driehuys, B. A constant-volume ventilator and gas recapture system for hyperpolarized gas MRI of mouse and rat lungs. Concepts Magn Reson Part B Magn Reson Eng. 39B (2), 78-88 (2011).
- Niedbalski, P. J., et al. Preclinical hyperpolarized 129Xe MRI: ventilation and T2* mapping in mouse lungs at 7 T using multi-echo flyback UTE. NMR Biomed. 33 (7), e4302(2020).
- Akinyi, T. G. An Affordable Open-Source Small Animal MR and Hyperpolarized Gas Compatible Ventilator: Feasibility in Preclinical Imaging. , University of Cincinnati. Master's thesis (2017).
- Smith, L. J., et al. The assessment of short and long term changes in lung function in CF using 129Xe MRI. Eur Respir J. 6, 2000441(2020).
- Svenningsen, S., et al. Reproducibility of hyperpolarized 129Xe MRI ventilation defect percent in severe asthma to evaluate clinical trial feasibility. Acad Radiol. 28 (6), 817-826 (2021).
- Kirby, M., et al. Hyperpolarized 3He and 129Xe MR imaging in healthy volunteers and patients with chronic obstructive pulmonary disease. Radiology. 265 (2), 600-610 (2012).
- Virgincar, R. S., et al. Quantitative analysis of hyperpolarized 129Xe ventilation imaging in healthy volunteers and subjects with chronic obstructive pulmonary disease. NMR Biomed. 26 (4), 424-435 (2013).
- Ebner, L., et al. Multireader determination of clinically significant obstruction using hyperpolarized 129Xe-ventilation MRI. AJR Am J Roentgenol. 212 (4), 758-765 (2019).
- Driehuys, B., et al. 3He MRI in mouse models of asthma. Magn Reson Med. 58 (5), 893-900 (2007).
- Mistry, N. N., Thomas, A., Kaushik, S. S., Johnson, G. A., Driehuys, B. Quantitative analysis of hyperpolarized 3He ventilation changes in mice challenged with methacholine. Magn Reson Med. 63 (3), 658-666 (2010).
- Costa, M., et al. Noninvasive assessment of in vivo mouse lung microstructural changes due to aging and PEEP. Am J Respir Crit Care Med. 207, A4713(2023).
- Sukstanskii, A. L., Yablonskiy, D. A. Lung morphometry with hyperpolarized 129Xe: theoretical background. Magn Reson Med. 67 (3), 856-866 (2012).
- Chan, H. F., Stewart, N. J., Norquay, G., Collier, G. J., Wild, J. M. 3D diffusion-weighted 129Xe MRI for whole lung morphometry. Magn Reson Med. 79 (6), 2986-2995 (2018).
- Bier, E. A., et al. Noninvasive diagnosis of pulmonary hypertension with hyperpolarised 129Xe magnetic resonance imaging and spectroscopy. ERJ Open Res. 8 (2), 00035(2022).
- Bier, E. A., et al. A protocol for quantifying cardiogenic oscillations in dynamic 129Xe gas exchange spectroscopy: The effects of idiopathic pulmonary fibrosis. NMR Biomed. 32 (1), e4029(2019).
- Wang, Z., et al. Diverse cardiopulmonary diseases are associated with distinct xenon magnetic resonance imaging signatures. Eur Respir J. 54 (6), 1900831(2019).
- Freeman, M. S., Cleveland, Z. I., Qi, Y., Driehuys, B. Enabling hyperpolarized 129Xe MR spectroscopy and imaging of pulmonary gas transfer to the red blood cells in transgenic mice expressing human hemoglobin. Magn Reson Med. 70 (5), 1192-1199 (2013).
- Iguchi, S., et al. Direct imaging of hyperpolarized 129Xe alveolar gas uptake in a mouse model of emphysema. Magn Reson Med. 70 (1), 207-215 (2013).
- Imai, H., et al. Noninvasive detection of pulmonary tissue destruction in a mouse model of emphysema using hyperpolarized 129Xe MRS under spontaneous respiration. Magn Reson Med. 64 (4), 929-938 (2010).
- Silk, S. B., Hampton, L. L., Brown, P. A. What investigators need to know about the use of animals. ILAR J. 54 (3), 324-328 (2014).
- Cereda, M., et al. Mild loss of lung aeration augments stretch in healthy lung regions. J Appl Physiol. 120 (1985), 444-454 (2016).
- Constantinides, C., Murphy, K. Molecular and integrative physiological effects of isoflurane anesthesia: The paradigm of cardiovascular studies in rodents using magnetic resonance imaging. Front Cardiovasc Med. 3, 23(2016).
- Irwin, M. R., Curay, C. M., Choi, S., Kiyatkin, E. A. Basic physiological effects of ketamine-xylazine mixture as a general anesthetic preparation for rodent surgeries. Brain Res. 1804, 148251(2023).
- Roth, D. M., Swaney, J. S., Dalton, N. D., Gilpin, E. A., John Ross, J. Impact of anesthesia on cardiac function during echocardiography in mice. Am J Physiol Heart Circ Physiol. 282 (6), H2134-H2140 (2002).
- Massey, C. A., Richerson, G. B. Isoflurane, ketamine-xylazine, and urethane markedly alter breathing even at subtherapeutic doses. J Neurophysiol. 118 (4), 2389-2401 (2017).
- Janssen, B. J. A., et al. Effects of anesthetics on systemic hemodynamics in mice. Am J Physiol Heart Circ Physiol. 287 (4), H1618-H1624 (2004).
- Lenzarini, F., Di Lascio, N., Stea, F., Kusmic, C., Faita, F. Time course of isoflurane-induced vasodilation: A Doppler ultrasound study of the left coronary artery in mice. Ultrasound Med Biol. 42 (4), 999-1009 (2016).
- Mondonedo, J. R., et al. Volatile anesthetics and the treatment of severe bronchospasm: A concept of targeted delivery. Drug Discov Today Dis Models. 15, 43-50 (2015).
- Nolan, J. P. Anaesthesia and Neuromuscular Block. Clinical Pharmacology. , Churchill Livingstone. 295-310 (2012).
- Arras, M., Autenried, P., Rettich, A., Spaeni, D., Rülicke, T. Optimization of intraperitoneal injection anesthesia in mice: drugs, dosages, adverse effects, and anesthesia depth. Comp Med. 51 (5), 443-456 (2001).
- Navarro, K. L., et al. Mouse anesthesia: The art and science. ILAR J. 62 (1-2), 238-273 (2021).
- Das, S., MacDonald, K., Chang, H. Y., Mitzner, W. A simple method of mouse lung intubation. J Vis Exp. (73), e50318(2013).
- Thomas, J. L., et al. Endotracheal intubation in mice via direct laryngoscopy using an otoscope. J Vis Exp. (86), e50269(2014).
- Slutsky, A. S., Ranieri, V. M. Ventilator-induced lung injury. N Engl J Med. 369 (22), 2126-2136 (2013).
- Matute-Bello, G., et al. An official American thoracic society workshop report: features and measurements of experimental acute lung injury in animals. Am J Respir Cell Mol Biol. 44 (5), 725-738 (2011).
- Kulkarni, H. S., et al. Update on the features and measurements of experimental acute lung injury in animals: An official American thoracic society workshop report. Am J Respir Cell Mol Biol. 66 (2), e1-e14 (2022).
- Tsuchida, S., et al. Atelectasis causes alveolar injury in nonatelectatic lung regions. Am J Respir Crit Care Med. 174 (3), 279-289 (2006).
- Fan, E., et al. An official American thoracic society/European society of intensive care medicine/society of critical care medicine clinical practice guideline: Mechanical ventilation in adult patients with acute respiratory distress syndrome. Am J Respir Crit Care Med. 195 (9), 1253-1263 (2017).
- Santos, R. S., Silva, P. L., Pelosi, P., Rocco, P. R. Recruitment maneuvers in acute respiratory distress syndrome: The safe way is the best way. World J Crit Care Med. 4 (4), 278-286 (2015).
- Mekontso Dessap, A., et al. Conflicting physiological and genomic cardiopulmonary effects of recruitment maneuvers in murine acute lung injury. Am J Respir Cell Mol Biol. 46 (4), 541-550 (2012).
- García-Fernández, J., et al. Recruitment manoeuvres in anaesthesia: How many more excuses are there not to use them. Rev Esp Anestesiol Reanim (Engl Ed). 65 (4), 209-217 (2018).
- Allen, G. B., Suratt, B. T., Rinaldi, L., Petty, J. M., Bates, J. H. Choosing the frequency of deep inflation in mice: balancing recruitment against ventilator-induced lung injury. Am J Physiol Lung Cell Mol Physiol. 291 (4), L710-L717 (2006).
- da Silva, A. C. L., et al. Sigh maneuver protects healthy lungs during mechanical ventilation in adult Wistar rats. Exp Biol Med. 245 (15), 1404-1413 (2020).
- Riva, D. R., et al. Recruitment maneuver: RAMP versus CPAP pressure profile in a model of acute lung injury. Respir Physiol Neurobiol. 169 (1), 62-68 (2009).
- Schwarte, L. A., Zuurbier, C. J., Ince, C. Mechanical ventilation of mice. Basic Res Cardiol. 95 (6), 510-520 (2000).
- Joelsson, J. P., Ingthorsson, S., Kricker, J., Gudjonsson, T., Karason, S. Ventilator-induced lung-injury in mouse models: Is there a trap. Lab Anim Res. 37 (1), 30(2021).
- Jameson, C. J., Jameson, A. K., Hwang, J. K. Nuclear spin relaxation by intermolecular magnetic dipole coupling in the gas phase. 129Xe in oxygen. J Chem Phys. 89 (7), 4074-4081 (1988).
- Kelley, M., Branca, R. T. Theoretical models of spin-exchange optical pumping: Revisited and reconciled. J Appl Phys. 129 (15), 1-16 (2021).
- Norquay, G., Leung, G., Stewart, N. J., Wolber, J., Wild, J. M. 129Xe chemical shift in human blood and pulmonary blood oxygenation measurement in humans using hyperpolarized 129Xe NMR. Magn Reson Med. 77 (4), 1399-1408 (2017).
- Norquay, G., Collier, G. J., Rao, M., Stewart, N. J., Wild, J. M. 129Xe-Rb spin-exchange optical pumping with high photon efficiency. Phys Rev Lett. 121 (15), 153201(2018).
- Ball, J. E., Wild, J. M., Norquay, G. Investigating Rubidium density and temperature distributions in a high-throughput 129Xe-Rb spin-exchange optical pumping polarizer. Molecules. 28 (1), 11(2022).
- Plummer, J. W., et al. A semi-empirical model to optimize continuous-flow hyperpolarized 129Xe production under practical cryogenic-accumulation conditions. J Magn Reson. 320, 106845(2020).
- Nikolaou, P., et al. Near-unity nuclear polarization with an open-source 129Xe hyperpolarizer for NMR and MRI. Proc Natl Acad Sci U S A. 110 (35), 14150-14155 (2013).
- Robertson, S. H., et al. Optimizing 3D noncartesian gridding reconstruction for hyperpolarized 129Xe MRI-focus on preclinical applications. Concepts Magn Reson Part A Bridg Educ Res. 44 (4), 190-202 (2015).
- Thomas, A. C., et al. A robust protocol for regional evaluation of methacholine challenge in mouse models of allergic asthma using hyperpolarized 3He MRI. NMR Biomed. 22 (5), 502-515 (2009).
- Niedbalski, P. J., et al. Protocols for multi-site trials using hyperpolarized 129Xe MRI for imaging of ventilation, alveolar-airspace size, and gas exchange: A position paper from the 129Xe MRI clinical trials consortium. Magn Reson Med. 86 (6), 2966-2986 (2021).
- Woodhouse, N., et al. Combined helium-3/proton magnetic resonance imaging measurement of ventilated lung volumes in smokers compared to never-smokers. J Magn Reson Imaging. 21 (4), 365-369 (2005).
- Brown, R. W., Cheng, Y. C. N., Haacke, E. M., Thompson, M. R., Venkatesan, R. Magnetic Resonance Imaging: Physical Principles and Sequence Design. , Wiley. (2014).
- Levitt, M. H. Spin Dynamics: Basics of Nuclear Magnetic Resonance. , Wiley. (2013).
- Salerno, M., et al. Emphysema: hyperpolarized helium 3 diffusion MR imaging of the lungs compared with spirometric indexes—initial experience. Radiology. 222 (1), 252-260 (2002).
- Niedbalski, P. J., et al. Validating in vivo hyperpolarized 129Xe diffusion MRI and diffusion morphometry in the mouse lung. Magn Reson Med. 85 (4), 2160-2173 (2021).
- Bdaiwi, A. S., et al. Improving hyperpolarized 129Xe ADC mapping in pediatric and adult lungs with uncertainty propagation. NMR Biomed. 35 (3), e4639(2022).
- Ruppert, K., Brookeman, J. R., Hagspiel, K. D., Driehuys, B., Mugler, J. P. NMR of hyperpolarized 129Xe in the canine chest: spectral dynamics during a breath-hold. NMR Biomed. 13 (4), 220-228 (2000).
- Driehuys, B., et al. Imaging alveolar-capillary gas transfer using hyperpolarized 129Xe MRI. Proc Natl Acad Sci U S A. 103 (48), 18278-18283 (2006).
- Nakamura, K., et al. 129Xe spectra from the heads of rats with and without ligation of the external carotid and pterygopalatine arteries. Magn Reson Med. 53 (3), 528-534 (2005).
- Kershaw, J., et al. Confirming the existence of five peaks in 129Xe rat head spectra. Magn Reson Med. 57 (4), 791-797 (2007).
- Chen, R. Y., et al. Tissue-blood partition coefficient for xenon: temperature and hematocrit dependence. J Appl Physiol. 49 (2), 178-183 (1980).
- Möller, H. E., et al. Magnetic resonance angiography with hyperpolarized 129Xe dissolved in a lipid emulsion. Magn Reson Med. 41 (5), 1058-1064 (1999).
- Norquay, G., et al. Relaxation and exchange dynamics of hyperpolarized 129Xe in human blood. Magn Reson Med. 74 (2), 303-311 (2015).
- Zhang, L., et al. Absolute thermometry of human brown adipose tissue by magnetic resonance with laser polarized 129Xe. Commun Med. 3 (1), 147(2023).
- Barshishat-Kupper, M., et al. Protein oxidation in the lungs of C57BL/6J mice following X-irradiation. Proteomes. 3 (3), 249-265 (2015).
- Olsson, L. E., et al. Measurement of MR signal and T2* in lung to characterize a tight skin mouse model of emphysema using single-point imaging. J Magn Reson Imaging. 25 (3), 488-494 (2007).
- Crowle, A. J. Delayed hypersensitivity in mice. J Allergy. 30 (2), 151-164 (1959).
- Guo, J., Cao, X., Cleveland, Z. I., Woods, J. C. Murine pulmonary imaging at 7T: T2* and T1 anisotropic UTE. Magn Reson Med. 79 (4), 2254-2264 (2018).
- Sonobe, T., et al. Imaging of the closed-chest mouse pulmonary circulation using synchrotron radiation microangiography. J Appl Physiol. 111 (1), 75-80 (2011).
- Wang, W., et al. Imaging lung microstructure in mice with hyperpolarized 3He diffusion MRI. Magn Reson Med. 65 (3), 620-626 (2011).
- Ouriadov, A. V., et al. Application of a stretched-exponential model for morphometric analysis of accelerated diffusion-weighted 129Xe MRI of the rat lung. Magn Reson Mater Phy. 34 (1), 73-84 (2021).
- O'Halloran, R. L., Holmes, J. H., Altes, T. A., Salerno, M., Fain, S. B. The effects of SNR on ADC measurements in diffusion-weighted hyperpolarized He-3 MRI. J Magn Reson. 185 (1), 42-49 (2007).
- Moller, H. E., Cleveland, Z. I., Driehuys, B. Relaxation of hyperpolarized 129Xe in a deflating polymer bag. J Magn Reson. 212 (1), 109-115 (2011).
- Reiss, L. K., Kowallik, A., Uhlig, S. Recurrent recruitment manoeuvres improve lung mechanics and minimize lung injury during mechanical ventilation of healthy mice. PLoS One. 6 (9), e24527(2011).
- Cagle, L. A., et al. Effects of positive end-expiratory pressure and recruitment maneuvers in a ventilator-induced injury mouse model. PLoS One. 12 (11), e0187419(2017).
- Cannizzaro, V., et al. Lung volume recruitment maneuvers and respiratory system mechanics in mechanically ventilated mice. Respir Physiol Neurobiol. 169 (3), 243-251 (2009).
- Hohlbaum, K., et al. Impact of repeated anesthesia with ketamine and xylazine on the well-being of C57BL/6JRj mice. PLoS One. 13 (9), e0203559(2018).
- Blevins, C. E., Celeste, N. A., Marx, J. O. Effects of oxygen supplementation on injectable and inhalant anesthesia in C57BL/6 mice. J Am Assoc Lab Anim Sci. 60 (3), 289-297 (2021).
- Cannizzaro, V., et al. Impact of supplemental oxygen in mechanically ventilated adult and infant mice. Respir Physiol Neurobiol. 165 (1), 61-66 (2009).
- Sembroski, E., Sanghavi, D. K., Bhardwaj, A. Inverse Ratio Ventilation. StatPearls Publishing. , Treasure Island, FL. (2023).
- Boros, S. J. Variations in inspiratory:expiratory ratio and airway pressure wave form during mechanical ventilation: the significance of mean airway pressure. J Pediatr. 94 (1), 114-117 (1979).
- Zheng, W., Cleveland, Z. I., Moller, H. E., Driehuys, B. Gradient-induced longitudinal relaxation of hyperpolarized noble gases in the fringe fields of superconducting magnets used for magnetic resonance. J Magn Reson. 208 (2), 284-290 (2011).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon