Method Article
Surveillance de l’activité d’une répétition riche en leucine contenant 8 canaux (LRRC8/VRAC) à l’aide du transfert d’énergie de résonance de Förster à émission sensibilisée (SE-FRET)
Dans cet article
Résumé
L’électrophysiologie est la référence pour l’étude de l’activité des canaux ioniques. Cependant, il existe de nombreuses approches alternatives, y compris les méthodes optiques. Ici, nous décrivons une méthode pour surveiller l’activité de la répétition riche en leucine contenant des canaux anioniques formés à 8 canaux (LRRC8) à l’aide d’une méthode basée sur le transfert d’énergie de résonance de Förster (FRET) inter-sous-unités.
Résumé
Les membres de la famille des protéines LRRC8 forment des canaux ioniques et osmolytiques hétéromériques qui jouent un rôle dans de nombreux processus physiologiques. En tant que canaux anioniques régulés en volume (VRAC)/canaux de rectification vers l’extérieur sensibles au volume (VSOR), ils sont activés lors du gonflement des cellules osmotiques et médient l’extrusion du chlorure et des osmolytes organiques, entraînant l’efflux d’eau et donc le rétrécissement cellulaire. Au-delà de leur rôle dans la régulation du volume osmotique, les VRAC ont été impliqués dans des processus cellulaires tels que la différenciation, la migration et l’apoptose. Grâce à leur effet sur le potentiel membranaire et à leur transport de diverses molécules de signalisation, les canaux LRRC8 (LRRC8) jouent un rôle dans la communication neurone-glie, la sécrétion d’insuline et la réponse immunitaire. Le mécanisme d’activation est resté insaisissable. Les canaux LRRC8, comme les autres canaux ioniques, sont généralement étudiés à l’aide de méthodes électrophysiologiques. Ici, nous décrivons une méthode pour détecter l’activation du canal LRRC8 en mesurant le transfert d’énergie de résonance de Förster à émission sensibilisée intra-complexe (SE-FRET) entre des protéines fluorescentes fusionnées aux domaines de répétition C-terminaux riches en leucine des sous-unités LRRC8. Cette méthode offre la possibilité d’étudier l’activation des canaux in situ sans échange de l’environnement cytosolique et lors de processus tels que la différenciation cellulaire et l’apoptose.
Introduction
Des canaux ioniques composés d’hétéromères de protéines de la famille LRRC8 (LRRC8) riches en leucine sont présents dans les cellules des vertébrés, participant à un large éventail de fonctions physiologiques 1,2. Ces canaux LRRC8, d’abord identifiés comme canaux anioniques régulés en volume (VRAC) ou canaux de rectification vers l’extérieur sensibles au volume (VSOR), jouent un rôle crucial dans la diminution du volume régulateur cellulaire 3,4. Ils facilitent l’expulsion des ions chlorure et des osmolytes organiques, qui est suivie d’un efflux d’eau en réponse au gonflement osmotique. Au-delà de leur rôle dans la réponse au stress osmotique, leur rôle dans la régulation du volume cellulaire a été lié à la prolifération et à la migration cellulaires, à l’apoptose, à la spermiogenèse et à l’intégrité épithéliale 5,6,7. Il a été démontré que l’altération du potentiel membranaire lors de l’activation de LRRC8/VRAC contribue à la différenciation des myotubes8 et à la sécrétion d’insuline par les cellules β pancréatiques 9,10,11. De plus, les canaux LRRC8 conduisent une variété d’osmolytes organiques tels que les molécules de signalisation purinergiques ATP et cGAMP ou l’acide aminé excitateur glutamate, plaçant ces canaux dans la communication cellule-cellule dans le système immunitaire ou l’interaction glia-neurone 12,13,14,15,16,17,18,19,20,21 et 22. Même les xénobiotiques, tels que le colorant fluorescéine, l’antibiotique blasticidine S ou le médicament anticancéreux cisplatine, sont conduits par les canaux LRRC8 23,24,25.
Il existe de nombreux rapports sur la transduction du signal conduisant à l’activation de LRRC8/VRAC 26,27,28. Cependant, le mécanisme reste incertain, et la littérature présente un large éventail de mécanismes potentiels qui pourraient dépendre du processus physiologique spécifique. Il s’agit notamment des modifications de l’intensité des ions cytosoliques, de l’interaction avec le cytosquelette, de la composition membranaire, des protéines G, de l’état redox et des cascades de phosphorylation 2,27,29,30,31.
Les canaux LRRC8/VRAC contiennent LRRC8A en tant que sous-unitéessentielle 3,4 qui doit s’hétéromériser avec au moins un de ses paralogues LRRC8B-E pour former des canaux physiologiquement fonctionnels 4,14,32. La composition des sous-unités détermine les propriétés biophysiques du canal, telles que l’inactivation dépendante de la rectification et de la dépolarisation 4,29,32,33,34, la spécificité du substrat 15,17,20,21,24,35 et certaines voies d’activation 36,37. Les structures de cryo-microscopie électronique (cryo-EM) montrent que les homomères LRRC8A, ainsi que les hétéromères, s’assemblent en hexamères 38,39,40, tandis que les chimères LRRC8A/LRRC8C qui forment des canaux fonctionnels sont des heptamers41. La partie N-terminale de toutes les protéines LRRC8 comprend quatre hélices transmembranaires, et la partie C-terminale contient un domaine avec des répétitions riches en leucine (LRRD). Les structures complexes LRRC8 disponibles fournissent la preuve que les LRRD, qui s’étendent dans le cytosol 3,4,23, peuvent subir des réarrangements conformationnels lors de la régulation des canaux 34,42,43. Cette notion est corroborée par la découverte que la fusion C-terminale des protéines fluorescentes entraîne l’activité du canalbasal 14 et que la liaison des nanocorps aux domaines peut moduler l’activité du canal44. De plus, des altérations conformationnelles des extrémités C ont été mises en évidence par un transfert d’énergie par résonance de Förster (FRET) intra-complexe45.
La méthode la plus courante pour étudier l’activité des canaux ioniques est les mesures électrophysiologiques46, qui ont été largement appliquées dans l’étude des VRAC avant leur identification moléculaire47. Cependant, il existe plusieurs autres moyens de surveiller indirectement l’activité de la VRAC, notamment la mesure de ses substrats conduits -ions halogénures ou osmolytes organiques- ou son effet sur le volume cellulaire48. En fait, l’identification des protéines LRRC8 comme VRAC reposait sur un test basé sur l’extinction d’une protéine fluorescente sensible aux halogénures49 par l’iodure pénétrant dans la cellule par les VRACSactivés 3,4. Une autre méthode de surveillance de l’activité des canaux LRRC8/VRAC utilise le mouvement des domaines cytosoliques qui peuvent être observés, comme dans d’autres canaux ioniques 50,51,52,53, par des modifications de FRET45. À cette fin, les protéines fluorescentes qui servent de paires FRET, telles que la protéine fluorescente cyan (CFP)/mCerulean3 comme donneuse et la protéine fluorescente jaune (YFP)/mVenus comme accepteur, ont été fusionnées aux extrémités C des protéines LRRC8 (Figure 1). La FRET intra-complexe entre les sous-unités LRRC8 a été mise en évidence par des expériences de photoblanchiment par accepteur45. En évitant la méthode destructrice de photoblanchiment, les changements de FRET au fil du temps ont été surveillés par FRET À ÉMISSION SENSIBILISÉE (SE-FRET), où l’émission sensibilisée de l’accepteur lors de l’excitation du donneur en raison du chevauchement du spectre d’émission du donneur avec le spectre d’excitation de l’accepteur est mesurée. L’application de l’hypotonicité extracellulaire, un stimulus pour l’activation de LRRC8/VRAC, a entraîné une réduction réversible de l’intensité SE-FRET45. Il est important de noter que les mesures simultanées du patch-clamp sur cellules entières et la surveillance FRET pendant le traitement hypotonique ont montré que cette réduction de FRET reflétait effectivement l’activation de LRRC8/VRAC45. Cette méthode, qui évite de perturber la membrane plasmique ou d’altérer l’environnement intracellulaire par une solution de pipette, offre une alternative pour surveiller l’activité LRRC8/VRAC. Il est particulièrement utile dans les contextes physiologiques où le maintien du cytosol natif est crucial, la résolution subcellulaire est nécessaire ou l’observation prolongée de l’activité des canaux est requise.
Ici, nous présentons un protocole pour étudier LRRC8/VRAC avec une telle lecture basée sur FRET. Le protocole décrit comment manipuler et transfecter les cellules, acquérir des échantillons et des images de contrôle, analyser les données et calculer les valeurs FRET D’ÉMISSION SENSIBILISÉE (SE-FRET).
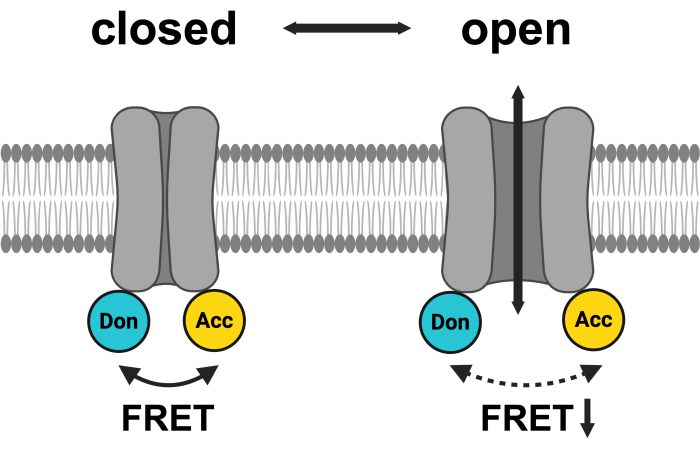
Figure 1 : Schéma du système de paires FRET LRRC8. mCerulean3 est représenté en cyan et mVenus est représenté en jaune. Après l’ouverture du VRAC, la distance (et/ou l’orientation spatiale) entre les fluorophores change, ce qui entraîne une réduction du transfert d’énergie entre le donneur (Don) et l’accepteur (Acc) et, par conséquent, une diminution du FRET observé. Créé avec BioRender.com. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Protocole
1. Préparation du tampon et des réactifs
- Préparez des tampons moyens et isotoniques, hypotoniques et hypertoniques et mesurez l’osmolarité des tampons avec un osmomètre pour vous assurer que l’osmolarité (Osm) se situe dans la plage attendue avec seulement un écart acceptable.
- Milieu de culture cellulaire : Préparez le milieu Eagle modifié (DMEM) de Dulbecco complété par 10 % de sérum de veau fœtal (FBS) et 1 % de pénicilline/streptomycine
- Tampon d’imagerie isotonique (~340 mOsm) : Préparez le tampon d’imagerie isotonique en mélangeant 150 mM de NaCl, 6 mM de KCl, 1 mM de MgCl2, 1,5 mM de CaCl2, 10 mM de D(+)-glucose et 10 mM d’acide 4-(2-hydroxy éthyl)-1-pipérazine éthane sulfonique (HEPES).
- Tampon d’imagerie hypotonique (~250 mOsm) : Préparez le tampon d’imagerie hypotonique en mélangeant 105 mM de NaCl, 6 mM de KCl, 1 mM de MgCl2, 1,5 mM de CaCl2, 10 mM de D(+)-Glucose et 10 mM d’HEPES.
- Tampon d’imagerie hypertonique (~500 mOsm) : Préparez le tampon d’imagerie hypertonique en mélangeant 160 mM de D(-)-Mannitol, 150 mM de NaCl, 6 mM de KCl, 1 mM de MgCl2, 1,5 mM de CaCl2, 10 mM de D(+)-Glucose et 10 mM d’HEPES.
REMARQUE : Les tampons peuvent être complétés par des médicaments spécifiques en fonction de ce qui sera étudié.
2. Croissance des cellules adhérentes sur des plats à fond de verre
- Préparez au moins une boîte pour la transfection uniquement avec la protéine d’intérêt (POI) fusionnée au fluorophore donneur ou accepteur et au moins une boîte pour la transfection avec la paire donneuse-accepteuse (tableau 1 et figure 2). Utilisez des plats à fond en verre pour permettre la microscopie à fluorescence. Selon le type de cellule, prétraitez la surface par un nettoyage spécial ou enduisez-la de polylysine.
REMARQUE : Ici, le donneur de FRET mCerulean3 (mCer)54 et l’accepteur de FRET mVenus (mVen)55 sont utilisés comme paire FRET, mais d’autres combinaisons de fluorophores sont également applicables. L’échantillon exprimant le POI fusionné au donneur ou à l’accepteur seul est utilisé pour déterminer les facteurs de correction β et γ (Tableau 1) nécessaires pour corriger le saignement du donneur dans le canal accepteur et l’excitation croisée de l’accepteur par la longueur d’onde d’excitation du donneur (Figure 2Ac, Bf). - La veille de la transfection, ensemencez 1 x 10cellules 5 HeLa dans 2 mL de milieu de culture cellulaire sur des boîtes de 35 mm avec un fond en verre adapté à la microscopie à fluorescence. Cultivez des cellules pendant la nuit à 37 °C et 5 % deCO2 dans une atmosphère de culture cellulaire dans un incubateur de culture cellulaire.
REMARQUE : Les volumes de réactifs peuvent être adaptés à la surface d’autres boîtes de culture cellulaire/flacons de taille différente. Le nombre de cellules peut être adapté à une densité adaptée à différentes lignées cellulaires et approches expérimentales.- Aspirer le surnageant de culture cellulaire à partir de la monocouche de cellules adhérentes cultivées sur des flacons de culture cellulaire T75 à l’aide d’une pompe à vide.
- Lavez les cellules en ajoutant 10 ml de solution saline tamponnée au phosphate de Dulbecco (DPBS) dans le ballon de culture cellulaire et en aspirant ensuite la solution à l’aide d’une pompe à vide.
- Couvrez complètement les cellules avec 1 ml de Trypsine-EDTA à 0,05 % et incubez les cellules pendant 2 min à 37 °C et 5 % deCO2 dans une atmosphère de culture cellulaire dans un incubateur de culture cellulaire.
- Ajouter 9 mL de milieu de culture cellulaire et suspendre les cellules par pipetage.
- Transférez la suspension cellulaire dans un tube de 15 mL et centrifugez à 700 x g pendant 3 min à température ambiante (RT).
- Aspirez le surnageant à l’aide d’une pompe à vide et remettez en suspension la pastille de cellule dans 10 mL de milieu de culture cellulaire.
- Mélangez des volumes égaux de suspension cellulaire et de bleu de trypan à 0,4 % dans un tube et ajoutez 10 μL à une lame de comptage. Placez la glissière dans le compteur de cellules automatisé et commencez à compter à l’aide du programme approprié pour le comptage des cellules.
- Pour calculer le volume de suspension cellulaire nécessaire pour chaque parabole, divisez le nombre de cellules nécessaires par boîte (1 x 105) par le nombre de cellules par millilitre obtenu à partir du compteur de cellules.
- Préparez une suspension cellulaire dans un tube approprié contenant le nombre de cellules nécessaires par boîte dans le volume nécessaire par boîte (2 ml) plus la quantité pour une boîte supplémentaire.
- Mélanger la suspension cellulaire au moins 20 fois en renversant le tube et pipeter 2 mL de la suspension cellulaire dans chaque boîte.
- Pour assurer une distribution cellulaire plus uniforme, laissez les plats pendant 30 min à RT avant de les placer dans l’incubateur de culture cellulaire.
3. Transfection cellulaire
REMARQUE : Ici, FuGENE a été utilisé comme réactif de transfection. D’autres réactifs et méthodes de transfection sont également applicables. Les rapports optimaux entre l’ADN plasmidique (ADNp) et les réactifs de transfection et le temps d’expression optimal pour chaque POI et modèle cellulaire doivent être évalués empiriquement. Ici, 2 μg d’ADNp total par boîte de 35 mm ont été utilisés. Les constructions donneuse et accepteuse FRET ont été utilisées dans un rapport de 1:1, et le rapport ADNp/réactif de transfection était de 1:4 (tableau 1).
- Avant la transfection, remplacer le surnageant de culture cellulaire par 2 mL de milieu frais préchauffé.
- Diluer l’ADNp dans un milieu essentiel Opti-Minimal (MEM) avec un volume final de 100 μL (= solution d’ADNp).
- Diluer le réactif de transfection dans Opti-MEM avec un volume final de 100 μL (= solution de réactif).
REMARQUE : Pour une transfection plus uniforme, préparez un mélange maître pour l’ADNp et la solution de réactif. - Mélangez bien l’ADNp et la solution réactive.
- Ajouter la solution d’ADNp dans la solution réactive (= solution de transfection).
- Mélangez bien la solution de transfection.
- Incuber la solution de transfection pendant 15 min à RT.
- Ajouter la solution de transfection goutte à goutte en spirale dans le plat.
- Mélangez en déplaçant le plat 5 fois horizontalement et verticalement sur la surface du banc.
- Cultivez des cellules pendant la nuit à 37 °C et 5 % deCO2 dans une atmosphère de culture cellulaire dans un incubateur de culture cellulaire.
| Condition | Construction(s) | Échantillon | Utilisé pour |
| 1 | LRRC8A-mCéruléen | Construction du donneur uniquement | Déterminer le facteur de correction β |
| 2 | LRRC8E-mVénus | Construction de l’accepteur uniquement | Déterminer le facteur de correction γ |
| 3 | LRRC8A-mCéruléen et LRRC8E-mVénus | Paire de frettes | Quantification SE-FRET |
Tableau 1 : Exemple de conditions nécessaires pour qu’une expérience SE-FRET typique mesure l’activité LRRC8/VRAC d’un canal composé de la sous-unité LRRC8A fusionnée au donneur (mCerulean3) et de la sous-unité LRRC8E fusionnée à l’accepteur (mVenus) fluorophore.
4. Acquisition d’images pour la détermination du facteur de correction
REMARQUE : Il y a une fuite de l’émission du donneur dans l’émission détectée de l’accepteur pendant FRET. De plus, il y a excitation croisée du fluorophore accepteur par la longueur d’onde d’excitation du donneur. Ces processus doivent être compensés lors du calcul du SE-FRET. À cette fin, des facteurs de correction sont déterminés dans les cellules exprimant uniquement le donneur ou l’accepteur FRET 24 h après la transfection. Ici, l’imagerie a été réalisée sur un imageur Leica THUNDER équipé d’une lampe Leica LED8, du cube de filtre CYR71010, d’un objectif HC PL APO 63x/1.40 OIL, d’un filtre passe-long pour 460/80 et 553/70 et d’un appareil photo Leica DFC9000GTC. Les expériences ont été réalisées sans contrôle environnemental mais en présence d’HEPES dans les tampons d’imagerie pour stabiliser le pH. Pour l’observation/les mesures à long terme, il est conseillé d’utiliser un système de contrôle de l’environnement. Pour l’analyse, SE-FRET est calculé à partir des images brutes capturées. Cela peut se faire simultanément pendant l’acquisition ou après. Ici, le logiciel Leica LAS X avec le plugin SE-FRET a été utilisé pour simplifier la procédure expérimentale concernant le calcul des facteurs de correction et la visualisation des changements de valeur SE-FRET en temps réel pendant l’acquisition d’images. Pour la post-acquisition, les facteurs de correction et le SE-FRET peuvent être déterminés avec d’autres progiciels (par exemple, FIJI) après l’acquisition des données brutes selon le protocole fourni ci-dessous.
- Avant l’acquisition d’images de cellules transfectées uniques pour calculer les facteurs de correction, utilisez un échantillon exprimant la paire FRET pour configurer le réglage de microscopie pour tous les canaux (excitation du donneur/émission du donneur DD, DA donneur/accepteur et accepteur/accepteur AA ; voir le Tableau 1 et la Figure 2C et la Figure 3A).
REMARQUE : Pour les mesures SE-FRET avec des sous-unités VRAC marquées mCerulean3 et mVenus transfectées comme décrit ci-dessus, les paramètres suivants ont été utilisés : binning de pixels 8x8, temps d’exposition de 100 ms et intensité de la lampe LED de 10 %. - Prélever l’échantillon exprimant uniquement la construction donneuse (figure 2A), aspirer le milieu de culture cellulaire et laver les cellules trois fois avec 2 mL de tampon isotonique.
- Ajouter 3 mL de tampon isotonique et placer l’échantillon sur la platine du microscope.
- Trouvez un champ de vision (FOV) avec au moins une cellule exprimant la construction du donneur.
- Imagez toutes les voies (DD, DA et AA voir le Tableau 2 et la Figure 2A).
- Dessinez une région d’intérêt (ROI) autour de la ou des cellules et mesurez l’intensité moyenne de DA (= IDA ; Figure 2Ac) et DD (= IDD ; Figure 2Aa).
- Pour la soustraction de l’arrière-plan, dessinez un retour d’intérêt dans les canaux DA et DD où seul le signal de fond se trouve et mesurez l’intensité moyenne (IBDA et IBDD).
- Soustrayez l’intensité moyenne de la ROI d’arrière-plan de l’intensité moyenne mesurée dans la ROI de la cellule du canal correspondant (
 et
et 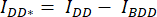 ).
). - Répétez les étapes 4.2 à 4.5 avec l’échantillon exprimant uniquement la construction de l’accepteur (Figure 2B).
- Dessinez un retour d’intérêt autour de la ou des cellules et mesurez l’intensité moyenne de DA (= IDA ; Graphique 2Bf) et AA (= IAA ; Figure 2Be).
- Pour la soustraction de l’arrière-plan, dessinez une ROI dans les canaux DA et AA où seul le signal de fond se trouve et mesurez les intensités moyennes (IBDA et IBAA).
- Soustrayez l’intensité moyenne de la ROI d’arrière-plan de l’intensité moyenne mesurée dans la ROI de la cellule du canal correspondant (
 et
et 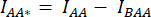 ).
). - Utilisez les valeurs déterminées pour IDA*, IDD* et IAA* pour calculer les facteurs
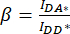 de correction et
de correction et 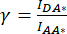 ,
,
Le facteur de correction β est utilisé pour compenser le débordement de l’émission du donneur dans le canal DA. Le facteur de correction γ est utilisé pour compenser l’excitation croisée du fluorophore accepteur par la longueur d’onde d’excitation du donneur dans le canal DA.
| Excitation de | Émission de | Nom de la chaîne | Ligne LED | Cube de filtre | Filtre passe-long |
| Donneur | Donneur | DD | 440 milles marins | CYR71010 | 460/80 NM |
| Donneur | Accepteur | DA | 440 milles marins | CYR71010 | 535/70 milles marins |
| Accepteur | Accepteur | AA | 510 milles marins | CYR71010 | 535/70 milles marins |
Tableau 2 : Résumé des canaux requis pour les expériences SE-FRET.
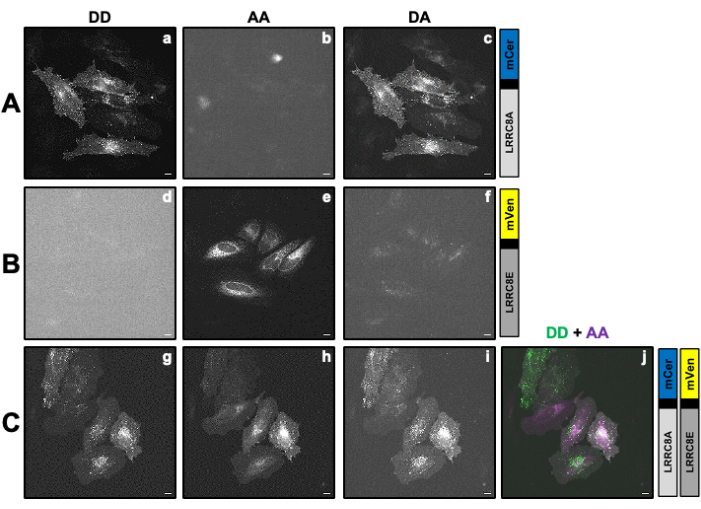
Figure 2 : Images de fluorescence représentatives d’échantillons utilisées pour calculer les facteurs de correction β et γ nécessaires pour déterminer l’activité VRAC d’un canal composé de la sous-unité LRRC8A fusionnée au donneur mCerulean3 (mCer) et de la sous-unité LRRC8E fusionnée au fluorophore accepteur mVenus (mVen) par mesures SE-FRET. (A,B) Détection du canal DD donneur/donneur, accepteur/accepteur AA et donneur/accepteur DA dans les cellules HeLa exprimant uniquement le donneur (A) LRRC8A-mCer ou l’accepteur (B) LRRC8E-mVen. (C) Détection des canaux DD, AA et DA dans les cellules HeLa co-transfectées avec la paire donneuse-accepteuse LRRC8A-mCer et LRRC8E-mVen. Les panneaux a-i montrent des images prises dans le canal de détection du donneur (excitation du donneur et détection du signal du donneur ; DD; a, d et g), le canal de détection de l’accepteur (excitation de l’accepteur et détection du signal de l’accepteur ; AA; b, e et h) et le canal de détection du signal FRET (excitation du donneur et détection du signal accepteur ; DA; c, f et i). Le panneau j est la superposition des panneaux g et h. Le canal DD est affiché en vert et le canal AA en magenta. Barre d’échelle = 10 μm. Veuillez cliquer ici pour voir une version plus grande de cette figure.
5. Imagerie en accéléré pour la quantification SE-FRET
- Prélever l’échantillon exprimant la construction donneuse et accepteuse (tableau 1, figure 2C et figure 3A), aspirer un milieu de culture cellulaire et laver les cellules trois fois avec 2 mL de tampon isotonique 24 h après la transfection.
- Ajouter 3 mL de tampon isotonique et placer l’échantillon sur la platine de microscopie.
- Pour une aspiration ultérieure du tampon isotonique, fixez et ajustez une canule de tuyau de sorte que l’extrémité de la canule atteigne le fond de la boîte.
- Pour ajouter des tampons, fixez et ajustez les tubes de sorte que le tampon entraîné par l’écoulement par gravité puisse tomber dans le bol.
REMARQUE : Ici, un système de perfusion par gravité contrôlé par soupape avec quatre soupapes magnétiques pour contrôler le débit tampon a été utilisé, mais d’autres méthodes sont également applicables. - Trouvez un champ de vision avec au moins une cellule exprimant simultanément la construction donneuse et accepteur.
- Mettez en place une expérience en accéléré pour les canaux DD, DA et AA avec un intervalle de 10 s et une durée pour couvrir toutes les conditions de la séquence de stimulation, par exemple, 12 cycles de base suivis de 15 cycles par condition (Figure 3).
REMARQUE : L’intervalle et le nombre de cycles peuvent être adoptés en fonction des besoins expérimentaux, mais doivent toujours inclure une mesure de référence pour la normalisation afin une meilleure visualisation et comparaison des données. - Après la mesure de base, laver l’échantillon dans le tampon pour la première condition.
- Aspirez le tampon isotonique via la canule du tuyau, en appliquant un vide avec une seringue.
- Ajouter 3 mL de tampon de la condition suivante par écoulement par gravité.
- Aspirez le tampon et ajoutez à nouveau 3 ml du même tampon.
- Répétez l’étape 5.7.3 une fois de plus.
- Après avoir mesuré la première condition, laver l’échantillon dans la mémoire tampon pour la condition suivante (étapes 5.7.1 à 5.7.4).
- Répétez les étapes 5.5 à 5.8 jusqu’à ce que toutes les conditions soient capturées.
- Pour la quantification SE-FRET, dessinez un ROI autour de la ou des cellules et mesurez l’intensité moyenne dans le canal DD = (IDD), DA (IDA) et AA (IAA) pour toutes les images (points temporels) de la série chronologique (Figure 3A, B).
- Pour la soustraction de l’arrière-plan du signal FRET, dessinez un retour d’intérêt dans le canal DA où seul le signal de fond se trouve et mesurez l’intensité moyenne (IBDA).
- Soustrayez l’intensité moyenne de la valeur d’arrière-plan de l’intensité moyenne mesurée dans la zone d’intérêt de la cellule du canal DA (
 ).
). - Utilisez les valeurs déterminées pour calculer les valeurs moyennes SE-FRET pour chaque retour sur investissement et tous les points temporels
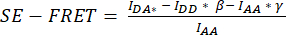 .
. - Pour une meilleure comparabilité des différentes conditions et une meilleure visualisation des valeurs SE-FRET, utilisez la moyenne des valeurs de référence de chaque retour sur investissement pour normaliser tous les points temporels du retour sur investissement correspondant.
- Tracez les valeurs SE-FRET normalisées au fil du temps (Figure 3B).
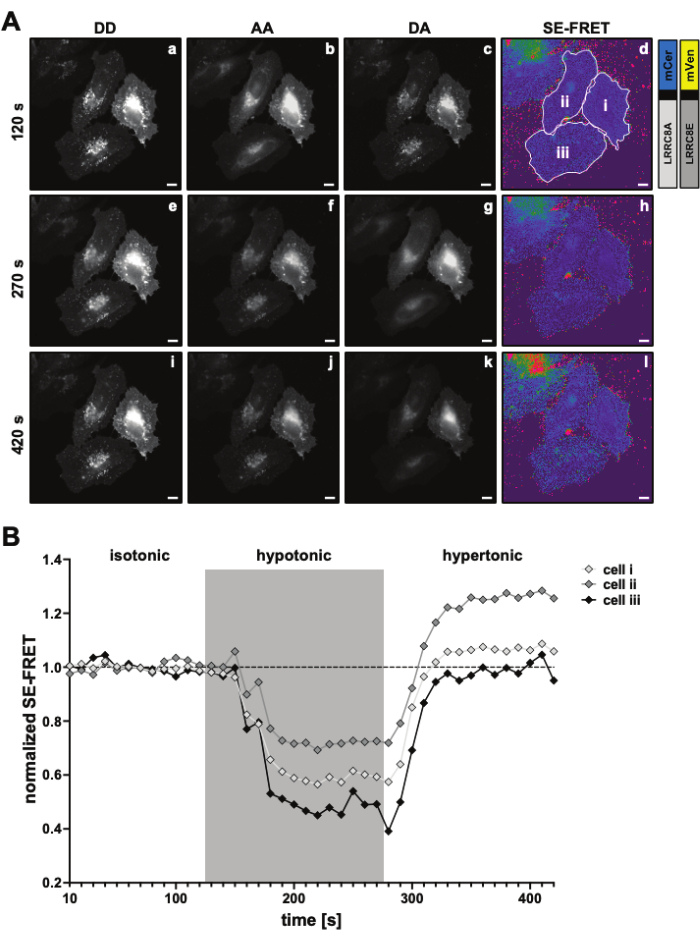
Figure 3 : Images représentatives de fluorescence et quantification SE-FRET. (A) Images représentatives de fluorescence et SE-FRET apparent du premier point temporel d’une expérience de tours de temps pour mesurer l’activité VRAC par SE-FRET d’un canal composé de sous-unités LRRC8A et LRRC8E en fonction de la tonicité. Barre d’échelle = 10 μm. Les mêmes cellules sont illustrées à la figure 2C. Les panneaux a-i montrent la détection des canaux DD, AA et DA et le SE-FRET apparent calculé. Les contours blancs représentent les zones d’intérêt (cellules i-iii dans le panneau d) utilisées pour mesurer les intensités moyennes du signal en DD, AA et DA et l’image SE-FRET apparente. (B) Quantification des valeurs SE-FRET dans le temps. La séquence de conditions était de 12 cycles de tampon d’imagerie isotonique (ligne de base) suivis de 15 cycles de tampon d’imagerie hypotonique et de 15 cycles de tampon d’imagerie hypertonique. La valeur moyenne brute SE-FRET de chaque ROI (cellules i-iii) et point temporel a été normalisée à la moyenne de la valeur de base (isotonique) pour le ROI correspondant. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Résultats
Avec cette méthode basée sur FRET, l’activité LRRC8/VRAC peut être surveillée pendant la stimulation osmotique, et la réduction de SE-FRET est corrélée avec le degré d’hypotonicité extracellulaire45. Des résultats représentatifs de l’activation du canal induite par l’hypotonicité sont également présentés ici (Figure 3 et Figure 4). De plus, l’activation de LRRC8/VRAC par différents stimuli isosmotiques, tels que la manipulation de la signalisation du diacylglycérol45 ou lors de l’activation des myocytes56, peut être observée.
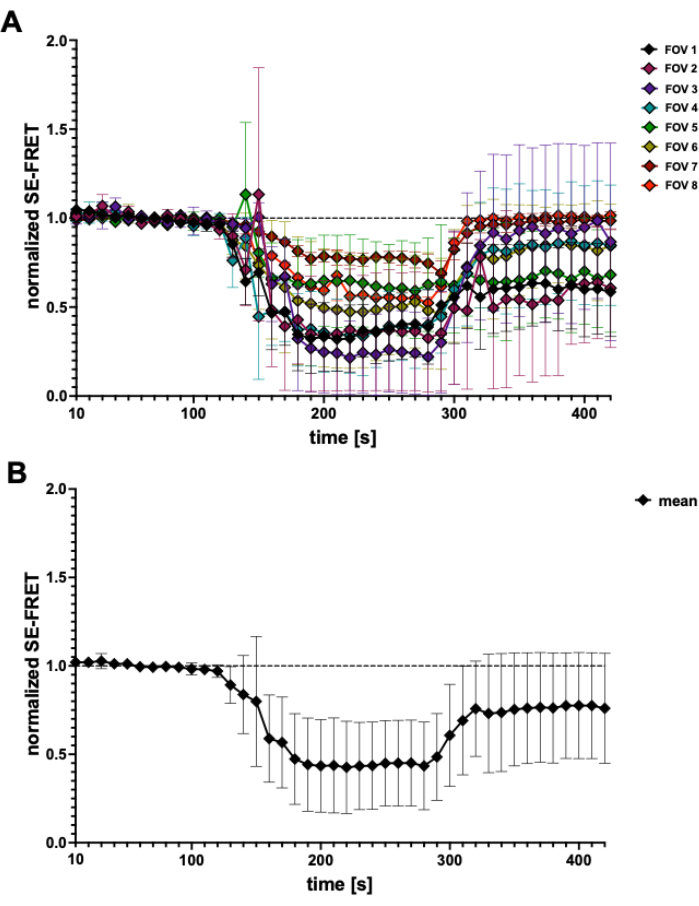
Figure 4 : Traces SE-FRET. (A) Traces SE-FRET apparentes provenant de 5 expériences indépendantes. Les données représentent la moyenne ± ET de N = 2 à N = 7 cellules par champ de vision (FOV). (B) Moyenne ± ET de toutes les cellules (N = 31 cellules). Veuillez cliquer ici pour voir une version agrandie de cette figure.
Comme les canaux LRRC8/VRAC sont également impliqués dans la diminution du volume apoptotique24,57, l’observation de l’activité des canaux lors de l’induction de l’apoptose serait une autre application de la méthode décrite ici. En conséquence, le protocole de surveillance de SE-FRET dans les cellules HeLa exprimant LRRC8A-mCerulean3 et LRRC8E-mVenus a été mis en œuvre lors de l’application de médicaments induisant l’apoptose médiés par les récepteurs de mort. Il a été démontré que le facteur de nécrose tumorale (TNF)-α et le cycloheximide (CHX) évoquent des courants VRAC en quelques minutes58. Après l’ajout de 2 ng/mL de TNF-α et de 1 μg/mL de CHX dans un tampon isotonique, on a observé une diminution robuste du SE-FRET (figure 5). En remplaçant le tampon par un milieu hypertonique, même s’il contenait du TNF-α et du CHX, les valeurs SE-FRET se sont rétablies près de la ligne de base (Figure 5A), ce qui correspond à une diminution des courants VRAC dans une solution de bain hypertonique pendant le traitement avec le ligandFas 58 induisant l’apoptose. Le traitement des cellules avec du DMSO, le solvant pour le TNF-α et le CHX, n’a pas entraîné de réduction du SE-FRET. TNF-α + CHX n’a pas affecté le SE-FRET du CFP-18aa-YFP, une construction en tandem EYFP et ECFP comme contrôle FRET59, démontrant la spécificité pour LRRC8/VRAC (Figure 5B).
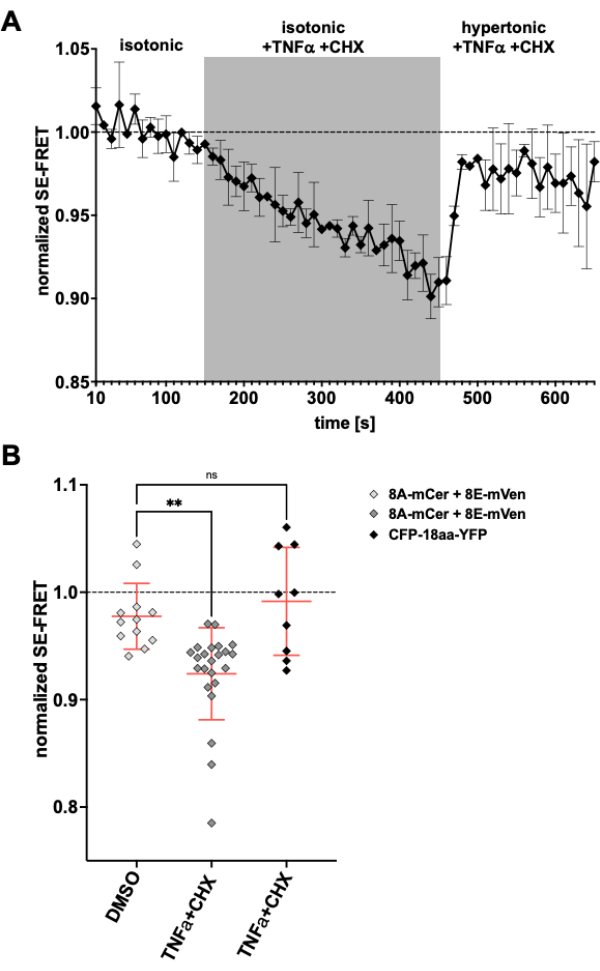
Figure 5 : Activation isosmotique de VRAC par apoptose médiée par le récepteur de mort. (A) Valeurs SE-FRET normalisées des cellules HeLa exprimant LRRC8A-mCer/LRRC8E-mVen (n = 8 plats, 23 cellules) au fil du temps. Après 15 cycles dans un tampon d’imagerie isotonique (ligne de base), la solution de bain a été remplacée par un tampon isotonique complété par 2 ng/mL de TNF-α et 1 μg/mL de cycloheximide (CHX) pendant 30 cycles, suivis de 20 cycles de tampon d’imagerie hypertonique avec TNF-α et CHX. La valeur moyenne brute SE-FRET de chaque retour sur investissement et point temporel a été normalisée à la moyenne de la valeur de base (isotonique) pour le retour sur investissement respectif. (B) Quantification des valeurs SE-FRET normalisées des cellules HeLa exprimant LRRC8A/E comme dans A avec une solution isotonique contenant du DMSO comme véhicule de contrôle pour CHX (n = 5 boîtes, 12 cellules) ou un tampon isotonique contenant des inducteurs d’apoptose comme dans A (n = 8 boîtes, 23 cellules), ou des cellules HeLa exprimant CFP-18aa-YFP avec des inducteurs d’apoptose (n = 3 boîtes, 9 cellules). Les données représentent la moyenne des 10 derniers points temporels dans la mémoire tampon respective des cellules individuelles (symboles) et la moyenne de toutes les cellules ± SD ; ** p < ANOVA unidirectionnelle ordinaire de 0,01 suivie du test post-hoc de comparaison multiple de Tukey. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
La microscopie FRET est une technique bien établie et largement utilisée pour étudier l’interaction entre les protéines. Par conséquent, les méthodes basées sur le FRET peuvent être appliquées dans de nombreux laboratoires d’expertise variable. Les réarrangements conformationnels au cours du gate ont été surveillés pour une large gamme de canaux ioniques à l’aide de tests basés sur le FRET (pour des exemples, voir les références 34,50,51,52,53,60,61,62,63,64,65,66,67), dans certains cas associée à l’électrophysiologie en fluorométrie patch-clamp 68,69,70,71. La FRET peut être utilisée pour étudier les relations structure-fonction de ces canaux ioniques ou pour surveiller leur activité indépendamment du transport des ions. La méthode présentée ici peut présenter des avantages évidents par rapport à l’électrophysiologie car elle permet de surveiller l’activité des canaux LRRC8/VRAC in situ.
Les étapes critiques du protocole comprennent le placage des cellules pour atteindre une confluence optimale pour la transfection et l’imagerie, ce qui facilite idéalement la distinction cellulaire pour une analyse ultérieure. Une co-transfection efficace des différentes sous-unités est cruciale pour une localisation subcellulaire correcte ; par exemple, un excès de la sous-unité non-LRRC8A entraînera une meilleure localisation du réticulum endoplasmique (RE)4. Par conséquent, il peut être nécessaire d’ajuster les rapports plasmidiques. Selon le système, les paires FRET nouvellement générées doivent être vérifiées, par exemple par blanchiment de l’accepteur. Le binning et le temps d’exposition doivent être équilibrés l’un par rapport à l’autre pour permettre une résolution temporelle et spatiale optimale de la question de recherche. Le binning permet des temps d’exposition plus courts et réduit donc le blanchiment potentiel du capteur FRET tout en diminuant la résolution spatiale. Par conséquent, si le dispositif expérimental exige, par exemple, une discrimination subcellulaire de l’activité LRRC8/VRAC, le binning doit être évité. La question de recherche détermine également le nombre et l’intervalle de cycles dans une série time-lapse. L’intervalle n’est pertinent que si la cinétique des changements FRET (et donc l’activation/inactivation de LRRC8/VRAC) est nécessaire ; Sinon, de simples enregistrements « avant-après » peuvent également être effectués. La durée de l’expérience dépend du processus physiologique. Idéalement, l’activité LRRC8/VRAC sur les stimuli devrait être surveillée jusqu’à ce que SE-FRET se soit stabilisé. Ces facteurs peuvent être déterminés dans des expériences pilotes. Les facteurs de correction pour calculer le signal SE-FRET réel doivent être déterminés pour toutes les conditions. Des facteurs de correction mal déterminés peuvent conduire à une surestimation ou à une sous-estimation des intensités SE-FRET. Enfin, après avoir établi une base de référence stable, l’intervalle de temps entre les images doit être suffisamment court pour capturer le processus physiologique d’intérêt.
La méthode comporte certaines limites. L’une d’entre elles est que les changements d’intensité des FRET inter-LRRC8, tout en reflétant les mouvements des LRRD, ne correspondent pas nécessairement au transport d’ions ou d’osmolytes à travers le pore. Cela ressort clairement des changements FRET observés avec les homomères LRRC8A45 malgré leurs courants minimaux 4,32,72. Les bloqueurs de pores des canaux LRRC8/VRAC peuvent ne pas affecter le signal FRET, ce qui rend cette méthode inadaptée à la recherche de modulateurs de canaux spécifiques. De plus, les niveaux d’expression des protéines LRRC8 surexprimées pourraient affecter les processus physiologiques observés, d’autant plus que les protéines LRRC8 marquées en C-terminal présentent une activité basale14.
Un aspect qui peut être considéré comme une limitation ou un avantage selon la question de recherche particulière est que dans cette méthode, seules les sous-unités LRRC8 exprimées de manière ectopique sont mesurées de manière sélective. Ainsi, les niveaux de fond de protéines endogènes interfèrent à peine avec les mesures. D’autre part, les protéines surexprimées peuvent ne pas se comporter comme les canaux endogènes LRRC8 avec une composition de sous-unités et une stœchiométrie potentiellement différentes. Par exemple, divers stimuli tels que l’oxydation peuvent avoir des effets modulateurs opposés sur des canaux LRRC836 composés différemment. En modifiant les rapports entre les sous-unités co-exprimées, leur stœchiométrie et leur conductance ionique globale peuvent être ajustées14,73, mais leur composition native, avec probablement souvent plus de deux paralogues au sein d’un complexe21, n’est pas claire et peut varier entre les types de cellules 74,75,76. De plus, il a été démontré que la fusion des protéines fluorescentes avec les C-terminus cytosoliques des protéines LRRC8 augmente l’activité basale des canaux LRRC8/VRAC dans les ovocytes de xénope 14, probablement parce que les grandes étiquettes modulent la conformation des LRRD, ce qui peut régir l’ouverture des canaux 14,44,45. Par conséquent, la taille des protéines fluorescentes, l’agent de liaison et leur orientation peuvent non seulement affecter l’efficacité du FRET, mais également l’activité du canal. Cependant, il est important de noter que les canaux VRAC des protéines LRRC8 fusionnés avec des protéines fluorescentes sont restés sensibles à la stimulation hypotonique14, ce qui a permis leur utilisation en tant que capteurs FRET45.
Les avantages de cette méthode non invasive pour surveiller l’activité des canaux LRRC8/VRAC par microscopie optique par rapport aux autres méthodes comprennent : (i) Elle permet d’observer LRRC8/VRAC à l’intérieur de cellules ou de compartiments généralement inaccessibles pour l’électrophysiologie. Cela inclut les organites intracellulaires sur lesquels les complexes LRRC8 peuvent être trouvés ou ciblés sur45, 77, 78. (ii) La composition cytosolique reste inaltérée par la méthode, alors que lors des mesures patch-clamp de cellules entières, le cytosol est largement remplacé par une solution de pipette, ce qui peut affecter les voies de signalisation comme observé avec l’activation LRRC8/VRAC induite par le phorbol-12-myristate-13-acétate (PMA)45. (iii) Il offre la possibilité d’observer l’activation de LRRC8/VRAC avec une résolution subcellulaire, comme la distinction de l’activité aux bords d’attaque et de fuite pendant la migration cellulaire, où -limité aux espaces confinés- VRAC a été impliqué79,80. (iv) Il permet une surveillance continue de l’activité LRRC8/VRAC au cours de processus physiologiques étendus tels que la différenciation des myocytes56.
Bien que cette méthode présente des limites et des défis, elle est prometteuse pour une exploration plus approfondie, y compris des applications potentielles dans des modèles animaux. En combinaison avec d’autres méthodes pour étudier cette famille de canaux ioniques et osmolytiques, ce test basé sur FRET pourrait contribuer de manière significative à démêler les mécanismes d’activation et à explorer les diverses fonctions physiologiques des canaux LRRC8 dans leurs environnements natifs.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à divulguer.
Remerciements
Nous remercions C.F. Kaminski pour le don aimable du plasmide codant pour la construction CFP-18aa-YFP, A. Klemmer pour l’assistance technique, et tous les membres actuels et anciens du laboratoire Stauber qui ont contribué au développement de cette méthode.
matériels
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin-EDTA | gibco | 25300-054 | |
| Camera DFC9000GTC | Leica | 11547007 | |
| CFP-18aa-YFP | N/A | N/A | Elder et al. 2009 PMCID: PMC2706461; Gift from C.F. Kaminski (University of Cambridge, UK) |
| Cycloheximide (CHX) | Sigma-Aldrich | 66-81-9 | |
| D(-)-Mannitol | Carl Roth | 4175.1 | |
| D(+)-Glucose | Carl Roth | HN06.1 | |
| DMEM (Dulbeccos Modified Eagle Medium) | PAN-Biotech | P04-03590 | |
| DPBS (Dulbecco's Phosphate Buffer Saline) | PAN-Biotech | P04-36500 | |
| Emission filter wheel (460/80, 535/70, 590/50, 642/80, 100%) | Leica | 11525480 | |
| FBS (Fetal Bovine Serum) | PAN-Biotech | P30-3302 | |
| Filter cube CYR71010 | Leica | 11525416 | |
| FuGENE | Promega | E2691 | |
| Glas Bottom Culture Dishes 35 mm | MatTek | P35G-0-10-C | |
| HeLa cells | Leibniz Forschungsinstitut DSMZ | ACC 57 | Mammalian cervix carcinoma/ Obtained from Leibniz Forschungsinstitut DSMZ |
| HEPES | Carl Roth | 9105.4 | |
| ibidi µ-Disch 35 mm | ibidi | 81156 | |
| KCl (Potassium chloride) | Carl Roth | 6781.1 | |
| LAS X FRET Wizard | Leica | 11640862 | |
| Light source LED8 | Leica | 11504256 | |
| LRRC8A-mCerulean3 | N/A | N/A | König et al. 2019 |
| LRRC8E-mVenus | N/A | N/A | König et al. 2019 |
| Luna-II Automated Cell Counter | logos biosystems | L40002 | |
| Luna-II Cell Counter Slides | logos biosystems | L12001 | |
| MgCl2 (Magnesium chloride) | Carl Roth | KK36.1 | |
| Microscope THUNDER Imager live cell | Leica | 11525681 | |
| NaCl (Sodium chloride) | Carl Roth | 9263 | |
| Objective HC PL APO 63x/1.40 OIL | Leica | 11506349 | |
| Opti-Minimal Essential Medium (MEM) | gibco | 11058 | |
| Osmometer OM807 | Vogel | V04807 | |
| Penicillin Streptomycin (Pen Step) | gibco | 15070-063 | |
| Trypan blue solution (0,4%) | Sigma | T8154 | |
| Tumor necrosis factor (TNF)-a | Sigma-Aldrich | 94948-59-1 | |
| Valve Controlled Gravity Perfusion System | ALA Scientific Instruments | VC3-4xG |
Références
- Jentsch, T. J. VRACs and other ion channels and transporters in the regulation of cell volume and beyond. Nat Rev Mol Cell Biol. 17 (5), 293-307 (2016).
- Chen, L., et al. More than just a pressure relief valve: physiological roles of volume-regulated LRRC8 anion channels. Biol Chem. 400 (11), 1481-1496 (2019).
- Qiu, Z., et al. SWELL1, a plasma membrane protein, is an essential component of volume-regulated anion channel. Cell. 157 (2), 447-458 (2014).
- Voss, F. K., et al. Identification of LRRC8 heteromers as an essential component of the volume-regulated anion channel VRAC. Science. 344 (6184), 634-638 (2014).
- Hoffmann, E. K., Schettino, T., Marshall, W. S. The role of volume-sensitive ion transport systems in regulation of epithelial transport. Comp Biochem Physiol A Mol Integr Physiol. 148 (1), 29-43 (2007).
- López-Cayuqueo, K. I., et al. Renal deletion of LRRC8/VRAC channels induces proximal tubulopathy. J Am Soc Nephrol. 33 (8), 1528-1545 (2022).
- Lück, J. C., Puchkov, D., Ullrich, F., Jentsch, T. J. LRRC8/VRAC anion channels are required for late stages of spermatid development in mice. J Biol Chem. 293 (30), 11796-11808 (2018).
- Chen, L., Becker, T. M., Koch, U., Stauber, T. The LRRC8/VRAC anion channel facilitates myogenic differentiation of murine myoblasts by promoting membrane hyperpolarization. J Biol Chem. 294 (39), 14279-14288 (2019).
- Best, L., Brown, P. D., Sener, A., Malaisse, W. J. Electrical activity in pancreatic islet cells: The VRAC hypothesis. Islets. 2 (2), 59-64 (2010).
- Kang, C., et al. SWELL1 is a glucose sensor regulating beta-cell excitability and systemic glycaemia. Nat Commun. 9 (1), 367 (2018).
- Stuhlmann, T., Planells-Cases, R., Jentsch, T. J. LRRC8/VRAC anion channels enhance beta-cell glucose sensing and insulin secretion. Nat Commun. 9 (1), 1974 (2018).
- Hisadome, K., et al. Volume-regulated anion channels serve as an auto/paracrine nucleotide release pathway in aortic endothelial cells. J Gen Physiol. 119 (6), 511-520 (2002).
- Burow, P., Klapperstück, M., Markwardt, F. Activation of ATP secretion via volume-regulated anion channels by sphingosine-1-phosphate in RAW macrophages. Pflügers Arch. 467 (6), 1215-1226 (2015).
- Gaitán-Peñas, H., et al. Investigation of LRRC8-mediated volume-regulated anion currents in Xenopus oocytes. Biophys J. 111 (7), 1429-1443 (2016).
- Lahey, L. J., et al. LRRC8A:C/E heteromeric channels are ubiquitous transporters of cGAMP. Mol Cell. 80 (4), 578-591 (2020).
- Chen, X., et al. Regulation of anion channel LRRC8 volume-regulated anion channels in transport of 2'3'-cyclic GMP-AMP and cisplatin under steady state and inflammation. J Immunol. 206 (9), 2061-2074 (2021).
- Zhou, C., et al. Transfer of cGAMP into bystander cells via LRRC8 volume-regulated anion channels augments STING-mediated interferon responses and anti-viral immunity. Immunity. 52 (5), 767-781 (2020).
- Feustel, P. J., Jin, Y., Kimelberg, H. K. Volume-regulated anion channels are the predominant contributors to release of excitatory amino acids in the ischemic cortical penumbra. Stroke. 35 (5), 1164-1168 (2004).
- Mongin, A. A. Volume-regulated anion channel--a frenemy within the brain. Pflügers Arch. 468 (3), 421-441 (2016).
- Schober, A. L., Wilson, C. S., Mongin, A. A. Molecular composition and heterogeneity of the LRRC8-containing swelling-activated osmolyte channels in primary rat astrocytes. J Physiol. 595 (22), 6939-6951 (2017).
- Lutter, D., Ullrich, F., Lueck, J. C., Kempa, S., Jentsch, T. J. Selective transport of neurotransmitters and modulators by distinct volume-regulated LRRC8 anion channels. J Cell Sci. 130 (6), 1122-1133 (2017).
- Yang, J., et al. Glutamate-releasing SWELL1 channel in astrocytes modulates synaptic transmission and promotes brain damage in stroke. Neuron. 102 (4), 813-827 (2019).
- Lee, C. C., Freinkman, E., Sabatini, D. M., Ploegh, H. L. The protein synthesis inhibitor blasticidin s enters mammalian cells via leucine-rich repeat-containing protein 8D. J Biol Chem. 289 (24), 17124-17131 (2014).
- Planells-Cases, R., et al. Subunit composition of VRAC channels determines substrate specificity and cellular resistance to Pt-based anticancer drugs. EMBO J. 34 (24), 2993-3008 (2015).
- Model, M. A., Nia, F. H., Zook, E., Hollembeak, J. E., Stauber, T. Uptake of fluorescein upon osmotic cell swelling is dependent on the volume-regulated anion channel VRAC/LRRC8. Paracelsus Proc Exp Med. 1 (1), 3-14 (2022).
- Stauber, T. The volume-regulated anion channel is formed by LRRC8 heteromers - molecular identification and roles in membrane transport and physiology. Biol Chem. 396 (9-10), 975-990 (2015).
- Bertelli, S., et al. Mechanisms of activation of LRRC8 volume regulated anion channels. Cell Physiol Biochem. 55 (S1), 41-56 (2021).
- Liu, T., Li, Y., Wang, D., Stauber, T., Zhao, J. Trends in volume-regulated anion channel (VRAC) research: visualization and bibliometric analysis from 2014 to 2022. Front Pharmacol. 14, 1234885 (2023).
- Strange, K., Yamada, T., Denton, J. S. A 30-year journey from volume-regulated anion currents to molecular structure of the LRRC8 channel. J Gen Physiol. 151 (2), 100-117 (2019).
- Osei-Owusu, J., Yang, J., Vitery, M. D. C., Qiu, Z. Molecular biology and physiology of volume-regulated anion channel (VRAC). Curr Top Membr. 81, 177-203 (2018).
- Friard, J., Laurain, A., Rubera, I., Duranton, C. LRRC8/VRAC channels and the redox balance: A complex Relationship. Cell Physiol Biochem. 55 (S1), 106-118 (2021).
- Syeda, R., et al. LRRC8 proteins form volume-regulated anion channels that sense ionic strength. Cell. 164 (3), 499-511 (2016).
- Ullrich, F., Reincke, S. M., Voss, F. K., Stauber, T., Jentsch, T. J. Inactivation and anion selectivity of volume-regulated anion channels (VRACs) depend on C-terminal residues of the first extracellular loop. J Biol Chem. 291 (33), 17040-17048 (2016).
- König, B., Stauber, T. Biophysics and structure-function relationships of LRRC8-formed volume-regulated anion channels. Biophys J. 116 (7), 1185-1193 (2019).
- Concepcion, A. R., et al. The volume-regulated anion channel LRRC8C suppresses T cell function by regulating cyclic dinucleotide transport and STING-p53 signaling. Nat Immunol. 23 (2), 287-302 (2022).
- Gradogna, A., Gavazzo, P., Boccaccio, A., Pusch, M. Subunit-dependent oxidative stress sensitivity of LRRC8 volume-regulated anion channels. J Physiol. 595 (21), 6719-6733 (2017).
- Bertelli, S., Zuccolini, P., Gavazzo, P., Pusch, M. Molecular determinants underlying volume-regulated anion channel subunit-dependent oxidation sensitivity. J Physiol. 600 (17), 3965-3982 (2022).
- Deneka, D., Sawicka, M., Lam, A. K. M., Paulino, C., Dutzler, R. Structure of a volume-regulated anion channel of the LRRC8 family. Nature. 558 (7709), 254-259 (2018).
- Kasuya, G., et al. Cryo-EM structures of the human volume-regulated anion channel LRRC8. Nat Struct Mol Biol. 25 (9), 797-804 (2018).
- Kefauver, J. M., et al. Structure of the human volume regulated anion channel. Elife. 7, e38461 (2018).
- Takahashi, H., Yamada, T., Denton, J. S., Strange, K., Karakas, E. Cryo-EM structures of an LRRC8 chimera with native functional properties reveal heptameric assembly. Elife. 12, e82431 (2023).
- Sawicka, M., Dutzler, R. Regulators of cell volume: The structural and functional properties of anion channels of the LRRC8 family. Curr Opin Struct Biol. 74, 102382 (2022).
- Kasuya, G., Nureki, O. Recent advances in the structural biology of the volume-regulated anion channel LRRC8. Front Pharmacol. 13, 896532 (2022).
- Deneka, D., et al. Allosteric modulation of LRRC8 channels by targeting their cytoplasmic domains. Nat Commun. 12 (1), 5435 (2021).
- König, B., Hao, Y., Schwartz, S., Plested, A. J., Stauber, T. A FRET sensor of C-terminal movement reveals VRAC activation by plasma membrane DAG signaling rather than ionic strength. Elife. 8, e45421 (2019).
- Hille, B. . Ion Channels of Excitable Membranes. 3rd edn. , (2001).
- Pedersen, S. F., Okada, Y., Nilius, B. Biophysics and physiology of the volume-regulated anion channel (VRAC)/volume-sensitive outwardly rectifying anion channel (VSOR). Pflügers Arch. 468 (3), 371-383 (2016).
- Kolobkova, Y., Pervaiz, S., Stauber, T. The expanding toolbox to study the LRRC8-formed volume-regulated anion channel VRAC. Curr Top Membr. 88, 119-163 (2021).
- Galietta, L. J., Haggie, P. M., Verkman, A. S. Green fluorescent protein-based halide indicators with improved chloride and iodide affinities. FEBS Lett. 499 (3), 220-224 (2001).
- Bykova, E. A., Zhang, X. D., Chen, T. Y., Zheng, J. Large movement in the C terminus of CLC-0 chloride channel during slow gating. Nat Struct Mol Biol. 13 (12), 1115-1119 (2006).
- Zheng, J., Zagotta, W. N. Gating rearrangements in cyclic nucleotide-gated channels revealed by patch-clamp fluorometry. Neuron. 28 (2), 369-374 (2000).
- Miranda, P., et al. State-dependent FRET reports calcium- and voltage-dependent gating-ring motions in BK channels. Proc Natl Acad Sci U S A. 110 (13), 5217-5222 (2013).
- Zachariassen, L. G., et al. Structural rearrangement of the intracellular domains during AMPA receptor activation. Proc Natl Acad Sci U S A. 113 (27), E3950-E3959 (2016).
- Markwardt, M. L., et al. An improved cerulean fluorescent protein with enhanced brightness and reduced reversible photoswitching. PLoS One. 6 (3), e17896 (2011).
- Nagai, T., et al. A variant of yellow fluorescent protein with fast and efficient maturation for cell-biological applications. Nat Biotechnol. 20 (1), 87-90 (2002).
- Chen, L., König, B., Stauber, T. LRRC8 channel activation and reduction in cytosolic chloride concentration during early differentiation of C2C12 myoblasts. Biochem Biophys Res Commun. 532, 482-488 (2020).
- Maeno, E., Ishizaki, Y., Kanaseki, T., Hazama, A., Okada, Y. Normotonic cell shrinkage because of disordered volume regulation is an early prerequisite to apoptosis. Proc Natl Acad Sci U S A. 97 (17), 9487-9492 (2000).
- Shimizu, T., Numata, T., Okada, Y. A role of reactive oxygen species in apoptotic activation of volume-sensitive Cl- channel. Proc Natl Acad Sci U S A. 101 (17), 6770-6773 (2004).
- Elder, A. D., et al. A quantitative protocol for dynamic measurements of protein interactions by Förster resonance energy transfer-sensitized fluorescence emission. Journal of the Royal Society Interface. 6, S59-S81 (2009).
- Glauner, K. S., Mannuzzu, L. M., Gandhi, C. S., Isacoff, E. Y. Spectroscopic mapping of voltage sensor movement in the Shaker potassium channel. Nature. 402 (6763), 813-817 (1999).
- Dai, G., Aman, T. K., DiMaio, F., Zagotta, W. N. The HCN channel voltage sensor undergoes a large downward motion during hyperpolarization. Nat Struct Mol Biol. 26 (8), 686-694 (2019).
- Renart, M. L., et al. Conformational plasticity in the KcsA potassium channel pore helix revealed by homo-FRET studies. Sci Rep. 9 (1), 6215 (2019).
- Wang, S., et al. Potassium channel selectivity filter dynamics revealed by single-molecule FRET. Nat Chem Biol. 15 (4), 377-383 (2019).
- Harley, C. A., et al. Conformation-sensitive antibody reveals an altered cytosolic PAS/CNBh assembly during hERG channel gating. Proc Natl Acad Sci U S A. 118 (44), e2108796118 (2021).
- Han, S., et al. Structural dynamics determine voltage and pH gating in human voltage-gated proton channel. Elife. 11, e73093 (2022).
- Cullinan, M. M., Klipp, R. C., Camenisch, A., Bankston, J. R. Dynamic landscape of the intracellular termini of acid-sensing ion channel 1a. Elife. 12, e90755 (2023).
- Kim, J., Won, J., Chung, D. K., Lee, H. H. FRET analysis of the temperature-induced structural changes in human TRPV3. Sci Rep. 13 (1), 10108 (2023).
- Zheng, J., Zagotta, W. N. Patch-clamp fluorometry recording of conformational rearrangements of ion channels. Sci STKE. (176), PL7 (2003).
- Kusch, J., Zifarelli, G. Patch-clamp fluorometry: electrophysiology meets fluorescence. Biophys J. 106 (6), 1250-1257 (2014).
- Cowgill, J., Chanda, B. The contribution of voltage clamp fluorometry to the understanding of channel and transporter mechanisms. J Gen Physiol. 151 (10), 1163-1172 (2019).
- Bhat, S., Blunck, R. Characterising ion channel structure and dynamics using fluorescence spectroscopy techniques. Biochem Soc Trans. 50 (5), 1427-1445 (2022).
- Yamada, T., Figueroa, E. E., Denton, J. S., Strange, K. LRRC8A homohexameric channels poorly recapitulate VRAC regulation and pharmacology. Am J Physiol Cell Physiol. 320 (3), C293-C303 (2021).
- Yamada, T., Wondergem, R., Morrison, R., Yin, V. P., Strange, K. Leucine-rich repeat containing protein LRRC8A is essential for swelling-activated Cl- currents and embryonic development in zebrafish. Physiol Rep. 4 (19), e12940 (2016).
- Pervaiz, S., Kopp, A., von Kleist, L., Stauber, T. Absolute protein amounts and relative abundance of volume-regulated anion channel (VRAC) LRRC8 subunits in cells and tissues revealed by quantitative immunoblotting. Int J Mol Sci. 20 (23), 5879 (2019).
- Kern, D. M., et al. Structural basis for assembly and lipid-mediated gating of LRRC8A:C volume-regulated anion channels. Nat Struct Mol Biol. 30 (6), 841-852 (2023).
- Rutz, S., Deneka, D., Dittmann, A., Sawicka, M., Dutzler, R. Structure of a volume-regulated heteromeric LRRC8A/C channel. Nat Struct Mol Biol. 30 (1), 52-61 (2023).
- Li, P., et al. LRRC8 family proteins within lysosomes regulate cellular osmoregulation and enhance cell survival to multiple physiological stresses. Proc Natl Acad Sci U S A. 117 (46), 29155-29165 (2020).
- Kashyap, P., et al. An optogenetic method for the controlled release of single molecules. Nat Methods. 21 (4), 666-672 (2024).
- Liu, T., Stauber, T. The volume-regulated anion channel LRRC8/VRAC is dispensable for cell proliferation and migration. Int J Mol Sci. 20 (11), e2663 (2019).
- Zhang, Y., et al. Polarized NHE1 and SWELL1 regulate migration direction, efficiency and metastasis. Nat Commun. 13 (1), 6128 (2022).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon