Method Article
Caractérisation du transfert d’électrons extracellulaire médié dans les bactéries lactiques à l’aide d’un système bioélectrochimique à trois électrodes et deux chambres
Dans cet article
Résumé
Nous présentons ici un protocole pour caractériser le transfert d’électrons extracellulaires (EET) médié chez les bactéries lactiques à l’aide d’un système bioélectrochimique à trois électrodes et deux chambres. Nous illustrons cette méthode avec Lactiplantibacillus plantarum et le médiateur redox 1,4-dihydroxy-2-naphtoïque et fournissons une description détaillée des techniques électrochimiques utilisées pour évaluer l’EET médié.
Résumé
De nombreuses bactéries effectuent un transfert d’électrons extracellulaire (EET), par lequel des électrons sont transférés de la cellule à un accepteur d’électrons terminal extracellulaire. Cet accepteur d’électrons peut être une électrode et les électrons peuvent être délivrés indirectement via une molécule médiatrice redox active. Ici, nous présentons un protocole pour étudier l’EET médiée chez Lactiplantibacillus plantarum, une bactérie probiotique d’acide lactique largement utilisée dans l’industrie alimentaire, en utilisant un système bioélectrochimique. Nous détaillons comment assembler un système bioélectrochimique à trois électrodes et deux chambres et fournissons des conseils sur la caractérisation de l’EET en présence d’un médiateur soluble à l’aide de techniques de chronoampérométrie et de voltampérométrie cyclique. Nous utilisons des données représentatives d’expériences EET médiées par l’acide 1,4-dihydroxy-2-naphtoïque (DHNA) avec L. plantarum pour démontrer l’analyse et l’interprétation des données. Les techniques décrites dans ce protocole peuvent ouvrir de nouvelles opportunités pour l’électro-fermentation et la bioélectrocatalyse. Des applications récentes de cette technique électrochimique avec L. plantarum ont démontré une accélération du flux métabolique vers la production de produits finaux de fermentation, qui sont des composants aromatiques essentiels dans la fermentation des aliments. En tant que tel, ce système a le potentiel d’être développé davantage pour modifier les arômes dans la production alimentaire ou produire des produits chimiques de valeur.
Introduction
Les systèmes bioélectrochimiques interfacent les microbes avec les électrodes, ce qui permet d’étudier les mécanismes de transfert d’électrons extracellulaires (EET) et de fournir des approches renouvelables de la bioélectrocatalyse 1,2,3. Les microbes qui effectuent naturellement l’EET sont connus sous le nom d’exoélectrogènes, qui transfèrent des électrons dérivés du métabolisme à des accepteurs d’électrons terminaux extracellulaires, par exemple, des (hydr)oxydes de fer et des électrodes1. Caractérisées pour la première fois chez Geobacter et les espèces 4,5 de Shewanella, les voies EET ont depuis été identifiées chez de nombreuses bactéries. Ces exoélectrogènes jouent un rôle central dans plusieurs technologies électrochimiques microbiennes, telles que la production d’énergie électrique à partir de flux de déchets, la fixation duCO2 et la production de produits chimiques précieux par électrosynthèse 1,6,7,8,9,10,11,12.
L’un de ces exoélectrogènes est Lactiplantibacillus plantarum, une bactérie d’acide lactique à Gram positif13. L. plantarum est une bactérie nomade probiotique qui réside dans un large éventail d’environnements, y compris les intestins des humains et d’autres vertébrés, ainsi que dans de nombreux types d’aliments tels que la viande, les céréales, les légumes et les aliments et boissons fermentés 14,15,16,17. Son génome code pour un métabolisme flexible et hétérofermentaire, permettant une adaptation réussie à ces divers environnements. Il est bien étudié, largement utilisé dans les industries de l’alimentation et de la santé, et généralement reconnu comme sûr par la Food and Drug Administration18,19. En tant que tel, L. plantarum a le potentiel de servir de plate-forme utile pour les technologies basées sur l’EET.
Des recherches récentes sur L. plantarum ont permis d’identifier un opéron multigénique codant pour une voie EET complexe caractérisée à l’origine chez Listeria monocytogenes13,20. Chez L. plantarum, les protéines synthétisées à partir de cet opéron facilitent l’EET dans un système bioélectrochimique (BES) lorsqu’elles reçoivent l’acide quinone 1,4-dihydroxy-2-naphtoïque (DHNA) en tant que médiateur électronique13. La première protéine essentielle de cette voie est une NADH-quinone oxydoréductase (Ndh2) liée à la membrane, qui oxyde le NADH et réduit le DHNA. DHNA délivre des électrons directement à une électrode ou indirectement via la protéine accessoire PplA (Figure 1)13,21,22. Des recherches récentes indiquent que L. plantarum peut également utiliser d’autres quinones structurellement similaires au DHNA comme médiateurs électroniques ; cependant, L. plantarum est incapable de produire du DHNA ou ces quinone alternatives, de sorte que les médiateurs doivent être présents de manière exogène dans l’environnement pour que l’EET se produise 13,22,23.
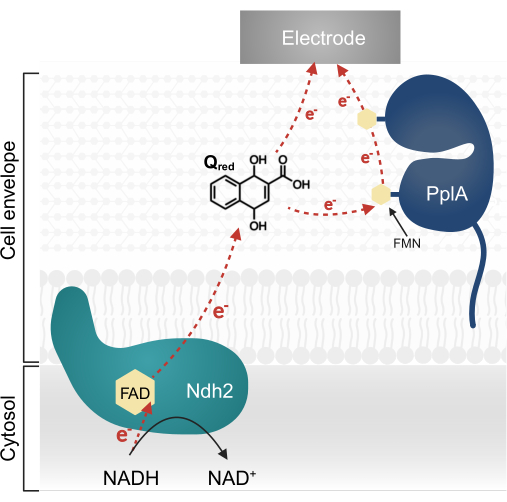
Figure 1 : Flux d’électrons dans Lactiplantibacillus plantarum EET. Ndh2 transmet les électrons du NADH à la quinone DHNA. Les électrons sont acheminés vers l’électrode pour produire du courant, soit directement par la quinone réduite, soit indirectement par l’intermédiaire de la protéine accessoire PplA. Abréviations : FAD = Flavin adénine dinucléotide ; FMN = mononucléotide de flavine ; EET = transfert d’électrons extracellulaires ; NADH = nicotinamide adénine dinucléotide réduit ; Ndh2 = NADH-quinone oxydoréductase ; DHNA = acide 1,4-dihydroxy-2-naphtoïque ; PplA = phospholipase A. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Dans cet article, nous fournissons un protocole complet pour l’utilisation d’une méthode basée sur BES afin de caractériser l’EET médiée par DHNA chez L. plantarum. Un système à trois électrodes et deux chambres confine les bactéries à l’électrode de travail, permettant un contrôle précis du potentiel appliqué aux bactéries tout en empêchant la diaphonie entre l’électrode de travail et la contre-électrode. Nous présentons un protocole complet s’étendant sur 5 jours, qui couvre la préparation pré-expérience, l’assemblage BES, l’analyse EET à l’aide de la chronoampérométrie (CA) et de la voltampérométrie cyclique (CV), et l’analyse d’échantillons post-expérience. Ce protocole peut être appliqué pour démêler les mécanismes des voies EET et pour construire des systèmes d’électrofermentation et d’électrocatalyse.
Protocole
REMARQUE : Les assemblages BES à deux chambres seront appelés « réacteurs » dans le protocole suivant.
1. Préparation des supports
- Préparez le milieu de culture de L. plantarum .
- Préparez les milieux commerciaux MRS (de Man Rogosa Sharpe) comme indiqué et les milieux MRS24 comme décrit dans le tableau 1. Ajustez le pH de l’ARMm à 6,5. Stérilisez les deux milieux à filtre en les passant à travers un filtre de 0,22 μm et stockez-les à 4 °C jusqu’à utilisation.
- Préparez un milieu chimiquement défini avec du mannitol (mCDM)13,25 comme décrit dans le tableau 2, et ajustez le pH à 6,5. Préparez suffisamment de fluide pour remplir la chambre anodique de chaque réacteur avec 110 ml de fluide. Stérilisez par filtre mCDM à travers un filtre de 0,22 μm.
REMARQUE : mCDM doit être préparé frais le jour de l’utilisation prévue. Les solutions des composants peuvent être préparées à l’avance. Stérilisez toutes les solutions de composants à travers un filtre de 0,22 μm et conservez-les à 4 °C. Lors de la préparation des vitamines Wolfe’s, ajustez le pH à 11 avant de les stériliser et conservez-les dans l’obscurité ou enveloppés dans du papier d’aluminium. Lors de la préparation des minéraux de Wolfe, ajustez le pH à 8 après avoir ajouté de l’acide nitrilotriacétique (NTA). Ensuite, ajoutez les composants restants, stérilisez et conservez dans l’obscurité ou enveloppé dans du papier d’aluminium.
- Préparez 1x PBS et autoclave pour stériliser. Conserver à 4 °C pour une utilisation dans ce protocole.
- Préparez le milieu commercial M9 comme indiqué (tableau 3) et l’autoclave pour stériliser. Préparez suffisamment de milieu pour remplir la chambre cathodique de chaque réacteur avec 110 ml. Conserver à température ambiante.
2. Jour 1 : Montage du réacteur BES et premièreculture deL. plantarum
REMARQUE : Reportez-vous à la figure 2 pour un schéma d’un réacteur BES et un schéma détaillant les pièces d’assemblage indiquées dans le protocole.
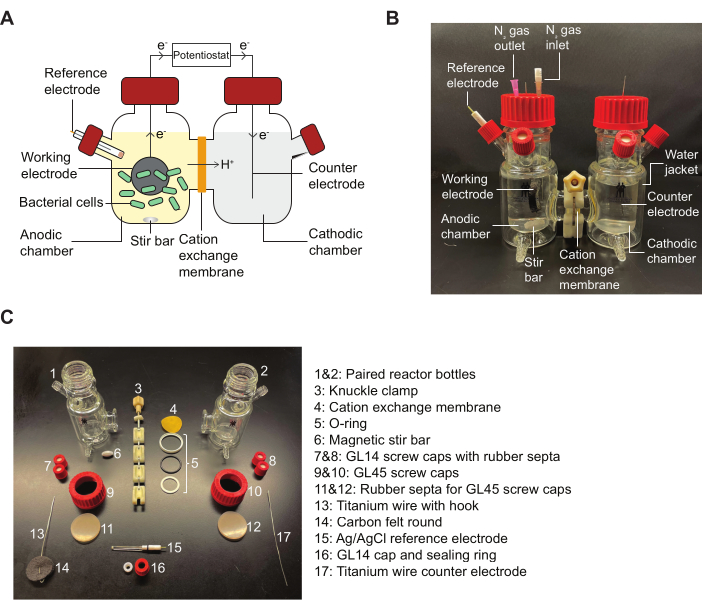
Figure 2 : Composants du BES et schéma d’assemblage. (A) Schéma d’un réacteur BES à deux chambres. Les bactéries (vert) dans la chambre anodique transfèrent des électrons à une électrode de travail (cercle noir) en présence d’un médiateur de quinone. Les électrons circulent dans le circuit jusqu’à la chambre cathodique, ce qui permet à un potentiostat de prendre des mesures de courant entre l’anode et la cathode. (B) Une image montrant un réacteur BES entièrement assemblé, y compris N2 aiguilles d’entrée et de sortie dans la chambre anodique. (C) Une image représentant toutes les pièces d’un réacteur démonté. Abréviation : BES = système bioélectrochimique. Veuillez cliquer ici pour voir une version agrandie de cette figure.
- Assembler et stériliser les réacteurs.
- Préparez les électrodes de travail et de contre-électrode. Poncez les fils de titane prédécoupés de 1,0 mm de diamètre pour les électrodes de travail et de contre-électrode avec du papier de verre en oxyde d’aluminium jusqu’à ce qu’ils soient uniformément brillants. À l’aide d’une pince, pliez une extrémité de chaque fil d’électrode en un petit crochet. Glissez un rond en feutre decarbone de 16 cm 2 sur chaque fil d’électrode fonctionnel, en tissant le fil dans et hors du rond en feutre de carbone une fois et en tirant le rond le long du fil jusqu’à ce qu’il soit fixé sur le crochet. Fixez les électrodes de travail et de contre-électrode dans les capuchons GL45 en perçant le septum en caoutchouc avec le fil et en le tirant sur quelques centimètres.
- Pour assembler des réacteurs appariés, assemblez d’abord le joint torique et placez une membrane échangeuse de cations prédécoupée qui a été pré-trempée dans l’eau dans le joint torique assemblé. Placez le joint torique avec la membrane entre les grandes ouvertures inférieures de deux bouteilles de réacteur appariées. Fixez les bouteilles et le joint torique du réacteur avec la membrane à l’aide d’une pince d’articulation pour serrer à la main. Déposez une barre d’agitation magnétique dans chaque chambre anodique, puis fermez toutes les petites ouvertures en haut de chaque bouteille avec des bouchons GL14 équipés de septa en caoutchouc.
REMARQUE : Ne serrez pas trop les pinces d’articulation ou les bouchons car cela pourrait entraîner des fissures ou des ruptures dans les bouteilles. - Remplissez chaque bouteille du réacteur avec 110 mL d’eau désionisée (DI), puis fermez chaque bouteille avec le bouchon GL45 approprié muni d’une électrode. Insérez les capuchons équipés d’une électrode de travail ronde en feutre de carbone en appuyant doucement sur le haut du rond en feutre pour que le rond reste sur le crochet.
REMARQUE : Le feutre de carbone frais est hydrophobe et repousse l’eau dans le réacteur lors de l’assemblage initial. L’autoclave fera en sorte que le feutre de carbone devienne suffisamment hydrophile pour l’expérimentation. - Rassemblez les capuchons d’électrode GL14 équipés de bagues d’étanchéité en silicone.
- Desserrez doucement tous les capuchons GL45 avant l’autoclavage. Réacteurs remplis d’eau de l’autoclave et capuchons d’électrodes pour stériliser. Après l’autoclavage, laissez les réacteurs refroidir à température ambiante.
- Culture L. plantarum NCIMB8826. Dans des conditions stériles, grattez quelques bactéries du haut d’un stock de glycérol et inocuculez-les dans 3 mL de milieu MRS commercial. Cultivez la culture pendant la nuit à 37 °C sans secouer.
REMARQUE : L. plantarum n’utilise pas l’oxygène comme accepteur d’électrons terminal ; Par conséquent, il n’est pas nécessaire d’oxygéner le milieu en l’agitant26. Cependant, les conditions d’élevage varieront si d’autres microbes sont utilisés.
3. Jour 2 : Préparation des électrodes de référence, préparation des réacteurs pour le démarrage de l’expérience et sous-culture de L. plantarum
- Préparez les électrodes de référence Ag/AgCl.
REMARQUE : Ces étapes décrivent la préparation des électrodes de référence Ag/AgCl indiquées dans le Tableau des matériaux. Les utilisateurs doivent suivre les instructions du fabricant s’ils utilisent une électrode de référence différente.- Démontez les électrodes de référence Ag/AgCl et poncez les fils. Retirez doucement l’électrode de son boîtier en verre et effleurez le boîtier en verre pour vider l’ancienne solution de KCl. Poncez doucement les fils d’électrode avec du papier de verre en oxyde d’aluminium jusqu’à ce qu’ils soient uniformément brillants pour éliminer les matériaux oxydés.
- Rassemblez tous les fils d’électrode de référence poncés dans un petit bécher avec une petite barre d’agitation et remplissez le bécher avec de l’eau de Javel à 100 % jusqu’à ce que les fils soient complètement immergés. Chlorure les fils en les laissant blanchir sur une plate-forme d’agitation pendant 30 minutes jusqu’à ce que les électrodes deviennent gris foncé. Après le blanchiment, rincez abondamment les fils des électrodes avec de l’eau DI.
- Pour remonter une électrode de référence, utilisez une seringue pour remplir entièrement le boîtier en verre avec une solution de KCl 3 M saturée de chlorure d’argent, en tapotant doucement le côté pour déloger les bulles d’air. À l’aide de la même seringue, remplissez le capuchon du fil de l’électrode avec une solution de KCl, puis insérez le fil dans le boîtier. Placez le bas du boîtier en verre contre une serviette en papier sur le dessus de la paillasse, insérez l’électrode dans le boîtier en verre, puis appuyez fermement sur le capuchon pour fermer l’électrode. Conservez les électrodes de référence dans un bécher peu profond rempli de solution de KCl jusqu’à ce que vous en ayez besoin et répétez l’opération avec toutes les électrodes de référence restantes.
- Utilisez un multimètre numérique pour mesurer la tension des électrodes de référence Ag/AgCl faites maison.
- Immergez les extrémités des électrodes de référence Ag/AgCl (estimées à 197 mV par rapport à l’électrode d’hydrogène standard, SHE) dans un bécher rempli de 3 M de KCl. Connectez solidement le multimètre à une électrode de calomel saturée achetée dans le commerce (SCE, 241 mV par rapport à SHE) également immergée dans les mêmes électrolytes de KCl.
- Mesurez la différence de potentiel entre chaque électrode de référence et la SCE. Vérifiez que les électrodes de référence diffèrent de la SCE de 44 ± 10 mV. Démontez et remontez toute électrode de référence qui se trouve en dehors de cette plage.
- Scellez le joint à l’endroit où le capuchon rencontre le boîtier en verre avec du parafilm.
- Préparez les réacteurs pour l’expérimentation.
- Dans une enceinte de biosécurité stérile, remplacez l’eau autoclavée dans les réacteurs par le milieu approprié. Versez l’eau autoclave. Remplissez les chambres cathodiques avec 110 ml de milieu M9 autoclave. Remplissez les chambres anodiques avec 110 mL de mCDM fraîchement préparé.
- Installez les électrodes de référence. Retirez un capuchon GL14 de chaque chambre anodique et remplacez-le par un capuchon d’électrode autoclavé (capuchon GL14 avec une bague d’étanchéité en silicone). Vaporisez les électrodes de référence avec de l’éthanol à 70 % pour les stériliser, puis placez une électrode de référence à travers le capuchon de l’électrode dans chaque chambre anodique.
REMARQUE : Assurez-vous que l’électrode de référence n’entre pas en contact direct avec le rond en feutre de carbone. - Avant de retirer les réacteurs de l’enceinte de biosécurité, serrez tous les capuchons et les pinces pour qu’ils soient serrés à la main afin d’éviter les fuites.
- Fixez les réacteurs au système de pompe à eau. Placez chaque réacteur sur la plate-forme de barre d’agitation appropriée. Connectez les embouts des chemises d’eau de chaque réacteur à l’autre à l’aide d’un tube en caoutchouc, en connectant les réacteurs d’extrémité aux tubes d’entrée et de sortie de la pompe à eau.
REMARQUE : Assurez-vous que tous les raccords sont serrés sans fuites, en utilisant des attaches zippées pour fixer le tube si nécessaire. - Remplissez la pompe d’eau et ajoutez 4 à 6 gouttes de conditionneur d’eau. Allumez le système de pompe et réglez la température à 30 °C. Démarrez la pompe et observez le débit d’eau à travers toutes les chemises d’eau du réacteur, en vous assurant qu’il n’y a pas de fuites au niveau des connexions.
- Allumez les plates-formes d’agitation et réglez-les sur une agitation continue à 220 tr/min.
- Fixez les réacteurs aux conduites de gaz de barbotage d’azote. Fixez un filtre à air à une aiguille de 4 pouces de 22 G et insérez l’aiguille à travers le septum supérieur d’une chambre anodique de réacteur dans le média pour servir d’entrée d’azote. Insérez une autre aiguille de 1 pouce et 18 G dans le septum supérieur de la chambre anodique pour servir de sortie d’azote. Connectez les conduites de gaz d’une source d’azote au filtre à air et ouvrez la vanne pour permettre au gaz de bouillonner doucement à travers le réacteur. S’assurer que l’azote bouillonne dans toutes les chambres anodiques en continu tout au long de l’expérience pour maintenir des conditions anaérobies.
REMARQUE : Assurez-vous que l’aiguille d’entrée est éloignée du rond en feutre de carbone. Le jet de bulles ne doit entrer en contact ni avec le feutre de carbone ni avec les électrodes de référence. - Fixez les bioréacteurs aux fils des potentiostats. Connectez les fils de l’électrode de travail, du compteur et de l’alligator de référence du potentiostat à leurs électrodes correspondantes.
REMARQUE : Utilisez un multimètre pour vérifier la résistance entre le collecteur de fil/courant et les électrodes afin d’assurer des connexions électriques correctes et de minimiser les erreurs de mesure potentielles.
- Entrez les paramètres du potentiostat pour la pré-exécution.
REMARQUE : Les paramètres techniques critiques sont indiqués ci-dessous. Voir le Tableau 4 pour une liste complète des paramètres logiciels pour chaque technique.- Allumez le potentiostat et initialisez le logiciel EC-lab sur l’ordinateur. Connectez le potentiostat à l’ordinateur en cliquant sur le bouton du symbole du potentiostat dans le panneau supérieur gauche sous Périphériques. Une fois connecté, le nom de l’appareil apparaîtra avec un cercle vert dans la zone de texte ci-dessous.
- Synchronisez tous les canaux connectés aux bioréacteurs en un seul groupe en cliquant sur l’onglet Modifier , puis en sélectionnant Synchroniser. Cliquez sur les cases de numéro de canal appropriées | ok.
- Ajoutez la technique de tension en circuit ouvert (OCV) au potentiostat en cliquant sur le bouton + dans le panneau Paramètres de gauche. Dans la boîte bleue des paramètres ; réglez-le pour mesurer le potentiel de l’électrode de travail (EWE) par rapport à l’électrode de référence (RE), en enregistrantle temps dans l’intervalle d t toutes les 36 s pendant un total de 3 h.
- Ensuite, ajoutez la technique de voltampérométrie cyclique (CV) au potentiostat. Réglez le potentiel initial del’WE à l’Ei de 0 V en fonction de l’ENR avec un taux de balayage de 2 mV/s. Balayage vers un potentiel de sommet (E1) de 0,4 V par rapport à RE, inversion vers un potentiel de sommet (E2) de -0,7 V par rapport à RE. Répétez le balayage pour un total de deux balayages.
REMARQUE : Dans les systèmes électrochimiques microbiens, l’inoculation microbienne et la formation de biofilms induisent des capacités élevées par rapport aux matériaux métalliques ou aux molécules inorganiques. Lors du balayage voltampérométrique cyclique, le potentiel varie et un courant de charge agit comme un arrière-plan. Pour obtenir un rapport signal/bruit élevé, des taux de balayage plus faibles sont nécessaires, bien que cela augmente la durée du balayage. Étant donné que nous balayons deux cycles couvrant une large fenêtre électrochimique de 1,1 V, une vitesse de balayage de 2 mV/s entraîne un demi-cycle pouvant durer jusqu’à 9,1 min. Par conséquent, deux cycles durent au total 36,4 min. Réduire davantage la vitesse de balayage prendrait beaucoup de temps. - Ajouter la technique de chronoampérométrie (CA). Appliquer un potentiel constant EWE de 0,2 V en fonction de RE pendant un temps de t = 200 h, en enregistrantle temps par intervalles d t toutes les 25 à 40 s. Ajustez l’intervalle de temps en fonction du logiciel potentiostat pour obtenir le niveau de détail souhaité.
REMARQUE : Le potentiel médian du DHNA est d’environ -0,093 V par rapport à Ag/AgCl ; ainsi, un potentiel appliqué de 0,2 V par rapport à RE à l’électrode de travail est suffisant pour permettre le transfert d’électrons du DHNA à l’électrode. - Après avoir saisi tous les paramètres, commencez la course en appuyant sur le triangle de départ vert. Enregistrez le fichier comme vous le souhaitez comme indiqué par le logiciel, puis cliquez sur Enregistrer. Le logiciel commencera la technique 1, « OCV ». Observez les traces OCV pendant quelques minutes pour vous assurer que tous les réacteurs sont lus positivement et rapprochés avec un signal stable. Laissez l’expérience s’exécuter pendant la nuit pour terminer l’OCV et le CV initial (voir la figure supplémentaire S1 pour le CV de contrôle des supports) et laissez l’AC s’exécuter jusqu’à ce qu’il soit stabilisé.
- Dans des conditions stériles, sous-cultiver la culture MRS de L. plantarum 1:200 dans 50 mL de mMRS. Faites pousser les cellules pendant la nuit à 37 °C sans secouer.
REMARQUE : Une culture de nuit de 50 mL produit généralement plus qu’assez de cellules pour six réacteurs, en supposant une DOfinale de 600 de 0,2 dans le réacteur. Ajustez les volumes de culture en conséquence pour les expériences plus grandes ou plus petites.
4. Jour 3 : Injection de cellules et de DHNA/DMSO
- Lavez les cellules et injectez-les dans les réacteurs.
- Retirer la culture de L. plantarum de l’incubateur le matin. Dans des conditions stériles, transférez la culture dans un tube conique de 50 mL et placez la culture sur de la glace.
- Laver les cellules 2x dans du PBS stérile et froid 1x. Pour ce faire, centrifugez la culture à 4 000 × g pendant 5 min dans une centrifugeuse à 4 °C pour granuler les cellules. Dans des conditions stériles, remettre doucement mais complètement les cellules en suspension dans 50 mL de PBS, puis centrifuger à nouveau comme précédemment ; Répétez l’opération pour un deuxième lavage. Après la dernière centrifugeuse, remettre en suspension les cellules dans du PBS froid à OD600 = 11.
- Dans des conditions stériles, chargez 2 mL de cellules remises en suspension dans une seringue de 3 mL munie d’une aiguille pour chaque réacteur.
- À la station du réacteur, décapsulez une seringue cellulaire et insérez l’aiguille dans le haut d’une chambre anodique du réacteur. N’appuyez pas sur le piston de la seringue à ce moment-là ; Répétez l’opération pour tous les réacteurs. Une fois que toutes les seringues sont en place, appuyez sur les pistons pour injecter les cellules dans les réacteurs et enregistrez le temps d’injection à partir de la trace CA. Ce volume de cellules produit une DO600 finale de 0,2 dans les réacteurs. Jetez toutes les seringues dans des boîtes et les aiguilles pour objets dangereux biologiques dans le contenant désigné pour les objets dangereux biologiques. Laisser le courant se stabiliser à plat sur la piste CA pendant 2 à 4 h.
REMARQUE : Lors de l’injection, des fluctuations de courant peuvent être observées sur la trace CA. Après 2 à 4 heures, ces fluctuations se stabiliseront jusqu’à un courant stable (variation de courant de <2 μA au cours d’une heure), après quoi le DHNA peut être injecté.
- Mesurer le pH initial et injecter du DHNA.
- Préparez une solution DHNA. Dans un tube de 1,5 mL, préparer 500 μL d’une solution de DHNA à 20 mg/mL en dissolvant du DHNA en poudre dans du DMSO à 100 %. Remplissez 3 seringues à insuline avec 110 μL de solution de DHNA et 3 seringues à insuline avec 110 μL de DMSO uniquement.
REMARQUE : Bien que le DHNA soit légèrement soluble dans l’eau, le DMSO est un meilleur solvant pour les stocks de DHNA à cette concentration. Le solvant du médiateur peut varier si d’autres médiateurs sont utilisés. - À la station de réacteur BES, étiqueter les réacteurs expérimentaux comme + DHNA et les réacteurs de contrôle de solvant comme - DHNA. Débouchez une seringue DHNA et insérez-la dans le haut de chaque chambre anodique désignée par + DHNA. Insérez une seringue contenant uniquement du DMSO dans chaque chambre anodique désignée par le DHNA. N’appuyez pas sur les pistons de la seringue à ce moment-là.
- Prenez des échantillons de points temporels de 0 h pour l’analyse des échantillons. À l’aide d’une seringue de 3 mL munie d’une aiguille de 2 pouces et 21 G, prélever un échantillon de milieu de 2 mL dans chaque chambre anodique à travers le septum à petit capuchon inutilisé et transférer les échantillons sur une plaque à 24 puits profonds pour prendre des mesures de pH pour le point temporel de 0 h (point d’injection DHNA). Si vous le souhaitez, prélever 1 mL de média usé de chaque chambre anodique et filtrer à travers un filtre de 0,2 μm dans des tubes étiquetés propres pour quantifier les métabolites à l’aide de la CLHP ou d’autres dosages. Stockez les échantillons de milieux usagés à -80 °C.
- Appuyez sur les pistons de toutes les seringues DHNA et DMSO pour injecter dans les réacteurs. Enregistrez l’heure d’injection à partir de la trace CA. Jetez toutes les seringues et aiguilles de manière appropriée.
- Mesurer et consigner les échantillons de pH 0 h pour chaque réacteur.
- Préparez une solution DHNA. Dans un tube de 1,5 mL, préparer 500 μL d’une solution de DHNA à 20 mg/mL en dissolvant du DHNA en poudre dans du DMSO à 100 %. Remplissez 3 seringues à insuline avec 110 μL de solution de DHNA et 3 seringues à insuline avec 110 μL de DMSO uniquement.
5. Jour 4 : Achèvement de l’expérience et prélèvement des échantillons
- Effectuer une analyse électrochimique 24 h après l’injection de DHNA et prélever les échantillons finaux.
- Terminez l’exécution de l’AC 24 h après l’injection de DHNA.
- Prélever des échantillons de points temporels de 24 h pour l’analyse des échantillons conformément à l’étape 4.2.3.
- Exécutez à nouveau CV pendant le point de temps de 24 h selon les paramètres décrits à l’étape 3.3.4.
- Mesurer et consigner le pH des échantillons prélevés sur 24 h dans chaque réacteur.
- Démontez et nettoyez les réacteurs.
- Éteignez le potentiostat. Ensuite, débranchez les fils de travail, de compteur et de référence de chaque réacteur. Essuyez toute humidité des pinces crocodiles en plomb potentiostat.
- Coupez le flux d’azote gazeux. Débranchez les fils de gaz, puis retirez les aiguilles d’entrée et de sortie. Jetez toutes les aiguilles de manière appropriée dans un contenant pour objets tranchants.
- Éteignez la pompe à eau. Débranchez les tubes d’entrée et de sortie de la pompe et laissez l’eau s’écouler dans un seau. Lors du débranchement, maintenez les extrémités du tube au-dessus de la conduite d’eau dans la pompe pour éviter que l’eau ne siphonne sur le sol. Un par un, débranchez chaque réacteur de la tuyauterie de la chemise d’eau, en travaillant du réacteur de sortie finale au réacteur d’entrée initial.
- Videz tous les fluides des réacteurs dans un grand conteneur à risque biologique. Suivez les méthodes normales de blanchiment des cultures pour l’élimination.
- Une fois vidé, démontez et nettoyez toutes les pièces du réacteur. Jetez les membranes échangeuses de cations et les ronds de feutre de carbone dans les déchets biologiques dangereux. Nettoyez les électrodes de référence et les fils de titane avec de l’éthanol à 70 % et stockez les électrodes de référence nettoyées dans un bécher peu profond rempli d’eau. Nettoyez délicatement les bouteilles, les bouchons, les joints toriques et les pinces du réacteur à l’eau tiède avec un détergent de laboratoire, rincez abondamment à l’eau DI et séchez toutes les pièces à l’air libre avant de les ranger.
6. Jour 5 : Analyse électrochimique
REMARQUE : Vous trouverez ci-dessous une description générale du traçage des données pour ce protocole. Des descriptions plus détaillées concernant l’analyse et l’interprétation des données seront fournies dans la section Résultats représentatifs.
- Pour l’analyse CA : Définissez le moment de l’injection de DHNA comme point de temps 0 h. Tracer la moyenne et l’écart-type de la densité de courant mesurée (j en μA/cm2) toutes les 36 s pour toutes les répétitions à partir du point temporel 0 h en fonction du temps (h). Calculez la densité de courant en fonction de la surface de l’électrode de travail (16 cm2).
- Pour l’analyse CV : Tracez une trace CV représentative pour chaque condition expérimentale (milieu uniquement, DMSO ou DHNA) représentant la densité de courant (j en μA/cm2) en fonction du potentiel de l’électrode de travail (EWE en V). Tracez le deuxième cycle de l’exécution du CV sélectionné.
Résultats
Analyse chronoampérométrique
L’EET de L. plantarum peut être observé à l’aide des données de chronoampérométrie (CA) illustrées à la figure 3, dans lesquelles la trace de densité de courant visualise le transfert d’électrons de L. plantarum à l’électrode de travail. Nous avons surveillé la densité de courant (j) en fonction du temps tout en maintenant un potentiel constant de +200 mV en fonction de Ag/AgCl pendant 24 h. Lors de l’injection de 20 μg/mL de DHNA dans la solution d’électrolyte d’agitation, un pic d’oxydation abiotique du DHNA a été observé, suivi d’une augmentation rapide de la densité du courant biotique culminant à 132,0 ± 2,47 μA/cm2 à environ 8 h dans le temps. À l’inverse, l’injection de DMSO a entraîné une densité de courant négligeable. Ces résultats soulignent l’importance de la DHNA en tant que médiateur nécessaire et efficace pour faciliter le transfert d’électrons entre L. plantarum et l’électrode. Les utilisateurs peuvent ajuster la sortie de courant en ajustant la concentration de DHNA dans le BES. Des recherches antérieures indiquent également que L. plantarum réagit au DHNA de manière dose-dépendante dans une large gamme de concentrations de DHNA, produisant un courant significatif en présence de concentrations de DHNA aussi faibles que 0,01 μg/mL13,22.
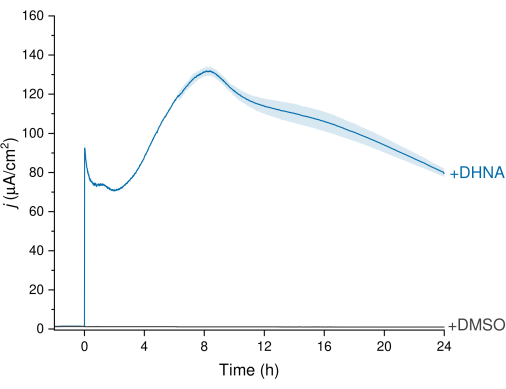
Figure 3 : Analyse chronoampérométrique de Lactiplantibacillus plantarum EET médiée par DHNA. Le DHNA (20 μg/mL) ou le DMSO a été injecté dans les électrolytes mCDM (pH ~ 6,5) avec un temps d’injection identifié comme t = 0. J représente la densité de courant en fonction de la surface de l’électrode de travail. Les expériences ont été menées à 200 mV versus Ag/AgCl avec une électrode en feutre de carbone (16 cm2) et en agitant. Les valeurs sont tracées sous forme de ± sd moyennes obtenues dans des réacteurs BES triples. Abréviations : EET = transfert d’électrons extracellulaires ; DHNA = acide 1,4-dihydroxy-2-naphtoïque ; DMSO = sulfoxyde de diméthyle ; mCDM = Milieu chimiquement défini avec mannitol. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Analyse voltampérométrique cyclique
Pour évaluer davantage l’EET médiée par la DHNA chez L. plantarum, nous avons effectué une voltampérométrie cyclique 24 h après l’injection de DHNA. Ici, nous montrons des traces CV pour trois conditions : L. plantarum avec 20 μg/mL DE DHNA, L. plantarum avec DMSO et milieu avec 20 μg/mL de DHNA. Comme le montre la figure 4A, la présence de 20 μg/mL de DHNA dans les réacteurs contenant L. plantarum a entraîné une augmentation distincte du courant oxydatif à 50 mV qui ne s’est pas produite en présence de DMSO seul. Ces données confirment que l’ajout du médiateur redox DHNA est nécessaire pour faciliter le transfert d’électrons entre L. plantarum et l’anode. Bien que nous ayons observé divers pics redox plus petits dans la trace L. plantarum + DMSO, ces pics étaient similaires à la trace de contrôle du milieu et sont probablement attribués à des composants redox actifs dans mCDM (figure supplémentaire S1). Dans la figure 4B, nous avons comparé les traces de DHNA dans des conditions biotiques (L. plantarum + DHNA) par rapport aux traces de DHNA dans des conditions abiotiques (Milieu + DHNA). Alors que les deux traces présentaient un pic oxydatif distinct de DHNA autour de 50 mV, nous avons observé une augmentation soutenue du courant au-delà de 50 mV uniquement dans des conditions biotiques. Le pic catalytique a atteint une densité de courant de 129 μA/cm2 à 300 mV, ce qui représente une augmentation de 256 % par rapport à la trace abiotique. Ce profil CV de renouvellement est caractéristique de l’EET27 microbien, indiquant une ré-réduction du DHNA par les cellules de L. plantarum en présence d’une source d’électrons (mannitol) après oxydation du DHNA à l’anode. De plus, la trace abiotique a présenté de nouveaux pics oxydatifs autour de -240 mV et -180 mV. Des recherches antérieures indiquent que l’apparition de ces pics pourrait être due à la dégradation du DHNA en ACNQ (2-amino-3-carboxy-1,4-naphtoquinone)21,28. Nous n’avons pas observé ces pics dans la trace biotique, ce qui indique que l’interaction des cellules de L. plantarum avec le DHNA peut stabiliser le DHNA et empêcher la dégradation. Il convient de noter que le tracé sur 24 h pour les milieux contenant 20 μg/mL de DHNA a été effectué séparément selon ce protocole sans ajout de cellules.
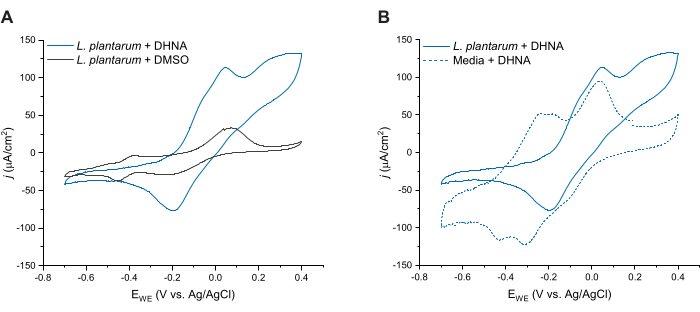
Figure 4 : Traces de voltampérométrie cyclique représentatives. Toutes les expériences CV ont été réalisées en mCDM en utilisant du feutre de carbone (16 cm2) comme électrode de travail à une vitesse de balayage de 2 mV/s tout en agitant la solution. (A) Traces CV pour Lactiplantibacillus plantarum avec DHNA (20 μg/mL) ou DMSO à t = 24 h. (B) Traces CV de 20 μg/mL de DHNA chez L. plantarum (conditions biotiques) ou mCDM uniquement (conditions abiotiques) à t = 24 h. Abréviations : CV = voltampérométrie cyclique ; mCDM = Milieu chimiquement défini avec mannitol ; DHNA = acide 1,4-dihydroxy-2-naphtoïque ; DMSO = diméthylsulfoxyde de méthyle. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Analyse du pH
L’activité de l’EET chez L. plantarum a entraîné une baisse notable du pH sur 24 h. Comme le montre la figure 5, le pH moyen de l’échantillon de L. plantarum exposé au DHNA a chuté à 3,33 ± 0,01 (p = 6,85 × 10-6, n = 3), tandis que le pH moyen de l’échantillon de L. plantarum exposé au DMSO a chuté à 6,50 ± 0,06 (p = 0,0409, n = 3). Comme le montrent des recherches antérieures, cette baisse est attribuée à une augmentation du métabolisme fermentaire qui se produit lorsque L. plantarum effectue l’EET13. L. plantarum métabolise normalement le mannitol par glycolyse et par les voies fermentatives, qui produisent de l’acétate, du lactate et de l’éthanol comme produits de fin de fermentation et génèrent de l’ATP par phosphorylation au niveau du substrat29. Dans les conditions EET, le flux métabolique par la fermentation augmente, augmentant ainsi la production de produits de fin de fermentation dans le milieu BES13. Ce changement métabolique fait chuter plus rapidement le pH du média dans les réacteurs avec DHNA par rapport aux réacteurs de contrôle DMSO.
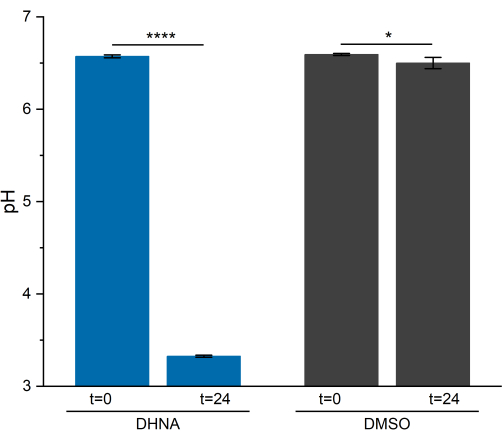
Figure 5 : Analyse du pH du système bioélectrochimique de Lactiplantibacillus plantarum. Les échantillons ont été prélevés à t = 0 et t = 24 h pendant la chronoampérométrie. Les valeurs sont tracées sous forme de ± sd moyennes obtenues dans des réacteurs BES triples. La signification a été déterminée par un test t unilatéral. DHNA : Valeur P = 6,85 × 10-6. DMSO : Valeur P = 0,0409. Abréviations : DHNA = acide 1,4-dihydroxy-2-naphtoïque ; DMSO = diméthylsulfoxyde de méthyle. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Tableau 1 : Ingrédients pour la préparation des milieux MRMm24. Veuillez cliquer ici pour télécharger ce tableau.
Tableau 2 : Ingrédients pour la préparation des milieux mCDM. Ce tableau est tiré de Tejedor-Sanz et al.13 et d’Aumiller et al.25. Veuillez cliquer ici pour télécharger ce tableau.
Tableau 3 : Ingrédients pour la préparation du milieu M9. Veuillez cliquer ici pour télécharger ce tableau.
Tableau 4 : Réglages des paramètres EC-Lab pour les techniques OCV, CA et CV. Abréviations : OCV = tension en circuit ouvert ; CA = chronoampérométrie ; CV = voltampérométrie cyclique. Veuillez cliquer ici pour télécharger ce tableau.
Figure supplémentaire S1 : Traces représentatives de voltampérométrie cyclique de Lactiplantibacillus plantarum avec DMSO et mCDM seuls. Traces CV pour L. plantarum avec DMSO à t = 24 h et mCDM seul à t = 0 h. Toutes les expériences CV ont été réalisées en utilisant du feutre de carbone (16 cm2) comme électrode de travail à une vitesse de balayage de 2 mV/s pendant que la solution était agitée. Abréviations : CV = voltampérométrie cyclique ; mCDM = Milieu chimiquement défini avec mannitol ; DHNA = acide 1,4-dihydroxy-2-naphtoïque ; DMSO = diméthylsulfoxyde de méthyle. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
En utilisant le système bioélectrochimique à trois électrodes et deux chambres décrit ici, nous avons montré la mesure de la génération de courant à partir de l’EET médiée par DHNA chez L. plantarum. Ces expériences BES génèrent des données de haute qualité ; cependant, les BES sont sensibles. Ainsi, le succès du protocole dépend de la précision de l’utilisateur, en particulier dans l’assemblage du réacteur et des électrodes de référence, le positionnement des aiguilles et des électrodes dans la chambre anodique et le remplacement de la membrane échangeuse de cations. Il est essentiel d’assembler les réacteurs avec soin, en veillant à ce qu’il n’y ait pas de fuite d’eau ou de fluide pendant l’autoclave ou l’expérimentation. Les fuites d’eau peuvent être résolues en s’assurant que les membranes échangeuses de cations sont coupées pour s’adapter précisément au joint torique et en serrant la pince d’articulation pour serrer à la main. Il est également essentiel d’immerger complètement le feutre rond de carbone dans l’eau lors de l’autoclave pour lui permettre de devenir hydrophile pour l’expérimentation. Nous recommandons aux nouveaux utilisateurs de laisser reposer les réacteurs nouvellement assemblés remplis d’eau pendant 2 h avant l’autoclavage, en vérifiant les signes de fuites lentes sous les jonctions principales des bouteilles. De plus, le fait d’assurer un ensemble d’électrodes de référence approprié garantit une réplication cohérente des données entre les réacteurs. Si la fritte de téflon à l’intérieur du boîtier en verre se décolore, se fissure ou sèche, cela peut entraîner une résistance élevée de l’électrode de référence. Les utilisateurs peuvent remplacer le boîtier en verre pour restaurer les performances de l’électrode de référence.
L’orientation correcte de toutes les aiguilles et électrodes à l’intérieur de la chambre anodique pendant l’expérimentation est essentielle au succès de l’expérience. L’électrode de référence ne doit pas entrer en contact direct avec une partie de l’électrode de travail en feutre de carbone. Les utilisateurs peuvent ajuster la position du feutre de carbone en tournant doucement le fil de titane de l’électrode de travail depuis le dessus du réacteur. De plus, le placement de l’aiguille pour le barbotage à l’azote ne doit pas entrer en contact direct avec les électrodes à l’intérieur de la chambre ou les connexions électrodes/potentiostats au-dessus de la chambre. Le flux d’azote doit être ajusté pour ne pas s’écouler dans l’une ou l’autre des électrodes. Enfin, les utilisateurs doivent s’assurer que la barre d’agitation n’entre pas en contact avec l’électrode de travail en positionnant l’électrode de travail à 1-2 cm au-dessus de la barre d’agitation. Si un signal erratique est observé dans l’OCV, cela peut généralement être résolu en veillant à ce que les électrodes et le flux d’azote soient correctement placés dans le réacteur, et en vérifiant que les connexions entre les fils des potentiostats et les électrodes du réacteur sont correctes et sûres. Enfin, notre expérience montre que les médiateurs d’électrons comme le DHNA peuvent être retenus à l’intérieur de la membrane échangeuse de cations et provoquer un courant de fond élevé s’ils sont réutilisés trop de fois. Nous recommandons de remplacer la membrane échangeuse de cations après deux à trois utilisations, en particulier lors de l’étude de l’EET médié, afin de garantir des résultats expérimentaux fiables.
Contrairement à l’EET direct, où la fixation microbienne directe à l’électrode facilite le transfert d’électrons, l’EET médié nécessite une diffusion constante des navettes d’électrons à travers la membrane de la cellule et l’électrode, ce qui permet d’obtenir les paramètres BES uniques décrits ici. Tout d’abord, nous avons choisi un BES à double chambre plutôt qu’un homologue à chambre unique dans notre protocole pour séparer les réactions anodiques et cathodiques avec une membrane échangeuse de cations. Cette séparation empêche les médiateurs d’électrons à diffusion libre (DHNA) et les microbes d’interagir avec la cathode, ce qui garantit que l’EET microbienne est la principale source d’électrons pour réduire les médiateurs d’électrons et l’anode. La séparation permet également un contrôle précis de paramètres tels que la concentration/distribution du médiateur et le potentiel lié à l’anode. De plus, nous avons choisi le feutre de carbone comme matériau d’anode parmi d’autres options telles que les tiges de graphite, les électrodes métalliques, le carbone vitreux ou l’oxyde d’indium et d’étain (ITO). En effet, la structure poreuse 3D du feutre de carbone offre une surface beaucoup plus grande que ces électrodes30, ce qui permet une utilisation efficace des médiateurs, même à des concentrations élevées. Nos réglages BES à trois électrodes et à deux chambres fournissent une lecture fiable et reproductible de l’EET médié, même sur une surveillance à long terme ; Cependant, ce processus est relativement faible. Ce protocole convient à la compréhension à l’échelle du banc d’essai des mécanismes EET ou à la mise à l’essai de prototypes d’applications EET. Les chercheurs peuvent envisager d’autres architectures BES31,32 portables ou imprimées, des réseaux de semi-conducteurs à oxyde métallique complémentaire (CMOS)33 ou des BES34 à l’échelle supérieure.
Dans ce protocole, nous fournissons des instructions détaillées pour les techniques électrochimiques les plus couramment utilisées : la chronoampérométrie (CA) et la voltampérométrie cyclique (CV). Il convient de noter que d’autres techniques électrochimiques, telles que la spectroscopie d’impédance électrochimique (EIS) et la voltampérométrie à impulsions différentielles (DPV), peuvent fournir des informations plus approfondies sur le BES en analysant la résistance au transfert de charge et la capacité à double couche 35,36,37. Bien que ce protocole BES permette des mesures EET, il peut également être essentiel de compléter les données électrochimiques par des mesures de l’activité métabolique et de la biomasse cellulaire pour une analyse complète. Des microbes comme L. plantarum engagent l’EET comme l’un des puits d’électrons, aux côtés d’autres sous-produits de fermentation tels que le lactate et l’éthanol. De plus, il convient de noter que la croissance de la biomasse cellulaire sert également de puits d’électrons13. Par conséquent, la quantification des donneurs d’électrons consommés (par exemple, le mannitol), l’évaluation de la croissance de la biomasse cellulaire et la surveillance des sous-produits de fermentation offrent des informations plus approfondies sur l’efficacité et les ramifications physiologiques de l’EET. Les métabolites cellulaires sont généralement quantifiés à l’aide de la chromatographie et des tests enzymatiques, tandis que la viabilité et la croissance cellulaires sont évaluées en comptant les unités formant des colonies et en mesurant la densité optique des milieux épuisés à 600 nm, respectivement13. Il est également important de noter que les mesures EET sont sensibles aux petites perturbations dans des conditions expérimentales. Cela inclut, mais sans s’y limiter, le pH, la température, la vitesse d’agitation et le taux de barbotage de l’azote gazeux38. Par conséquent, la normalisation des niveaux d’EET mesurés par des mesures bioanalytiques agit comme un contrôle interne, facilitant une évaluation cohérente entre les expériences menées à des jours différents.
En combinant des techniques électrochimiques avec d’autres mesures bioanalytiques, l’EET médiée crée de nouvelles opportunités pour l’électro-fermentation et la bioélectrocatalyse. L’utilisation conventionnelle d’électrocatalyseurs organiques, inorganiques ou enzymatiques pose des défis en raison de leur coût élevé et sont sujets à la dégradation. Alternativement, l’utilisation de microbes comme électrocatalyseurs vivants offre une solution moins coûteuse et plus évolutive en raison des capacités d’auto-réparation et d’auto-réplication des microbes39. L. plantarum, généralement reconnu comme une bactérie lactique sûre, est un châssis particulièrement intrigant. En utilisant des configurations électrochimiques identiques décrites dans ce protocole, nous avons précédemment montré que L. plantarum peut fermenter le jus de chou frisé dans des conditions EET et accélérer le flux métabolique vers la production de plus de produits finaux de fermentation tels que le lactate, l’acétate et le succinate13 ; Ces acides organiques sont des composés aromatiques essentiels dans la fermentation des aliments. Cela implique que, en utilisant des techniques électrochimiques, l’EET médiée chez L. plantarum peut être potentiellement détournée pour manipuler le flux métabolique, modifier les arômes des aliments ou produire des produits chimiques précieux. Il convient de noter que les techniques électrochimiques présentées dans ce protocole peuvent non seulement être appliquées à L. plantarum, mais peuvent également être appliquées de manière générique à d’autres microbes natifs ou modifiés qui effectuent l’EET40,41 médié. Différents médiateurs d’électrons, tels que la flavine, le ferrocène, le rouge neutre, le ferricyanure, le lawsone et la ménadione, peuvent être sélectionnés en fonction du mécanisme de transfert d’électrons du microbe spécifique utilisé22,42. De plus, le protocole BES établi dans ce travail peut être étendu aux exoélectrogènes qui effectuent des EET sans médiateur, comme démontré précédemment avec les espèces Shewanella et Geobacter 43,44. Un milieu de croissance optimisé doit être utilisé pour soutenir l’activité cellulaire du microbe particulier afin de faciliter sa performance EET. Ce protocole affine les paramètres de l’EET médié par DHNA chez L. plantarum, mais des modifications sont attendues lorsqu’un médiateur microbien et électronique différent est appliqué.
Déclarations de divulgation
Les auteurs n’ont pas d’intérêts concurrents à déclarer.
Remerciements
Nous remercions les membres du laboratoire Ajo-Franklin pour leurs discussions approfondies sur l’assemblage, la maintenance, les étapes critiques et le dépannage du BES. La recherche a été parrainée par le Bureau de recherche de l’Armée et a été réalisée sous le numéro de subvention W911NF-22-1-0239 (à C. M. A-F, soutenant R. A.) et par l’Institut de prévention et de recherche sur le cancer du Texas, subvention # RR190063 (à C. M. A-F, soutenant R. C., S. L. et B. B. K.). La figure 1 a été créée avec BioRender.com.
matériels
| Name | Company | Catalog Number | Comments |
| 1,4-Dihydroxy-2-naphthoic acid (DHNA) | Sigma-Aldrich | 281255-25G | |
| 1.0 mm diameter titanium wire | Thermo Fisher Scientific | 045485.BY | Cut to size for working and counter electrodes |
| 120-C Aluminum Oxide Sheets 9" x 11" | Johnson Abrasives | 10108-15 | |
| 3 mL plastic syringes | Thermo Fisher Scientific | 14955457 | |
| 3M KCl solution saturated with silver chloride | Millipore Sigma | 60137-250ML | |
| 6.35-mm-thick carbon felt | Thermo Fisher Scientific | 043200.RF | Cut into 16 cm2 rounds |
| Ag/AgCl reference electrode | CH Instruments | CH111 | |
| Air-Tite Premium Hypodermic Needles | Thermo Fisher Scientific | 14-817-102 | |
| AlK(SO)4 * 12H2O | Sigma-Aldrich | 237086-100G | |
| Ammonium citrate tribasic | Millipore Sigma | A1332 | |
| Avanti J-15R Centrifuge | Beckman Coulter | B99517 | |
| BD Precision Glide Needle, 18 G x 1 inch | Thermo Fisher Scientific | 14-826-5G | |
| BD Precision Glide Needle, 21 G x 2 inch | Thermo Fisher Scientific | 14-821-13N | |
| Bel-Art SP Scienceware Cleanware Aqua-Clear Water Condtioner | Thermo Fisher Scientific | 23-278339 | |
| Biotin | Millipore Sigma | B4639 | |
| CaCl2 | Millipore Sigma | C4901 | |
| Calcium D-(+)-pantothenate | Millipore Sigma | 1087009 | |
| Casamino acids | Millipore Sigma | 2240-OP | |
| cation exchange membrane | Membranes International | CMI-7000 | Cut into rounds fit to the BES O-ring |
| CoCl2 * 6H2O | Millipore Sigma | C8661 | |
| CuSO4 * 5H2O | Millipore Sigma | C8027 | |
| Cysteine-HCl * H2O | Millipore Sigma | 30129 | |
| DMSO | Millipore Sigma | 5439001000 | |
| DS-11+ Spectrophotometer | Denovix | N/A | |
| EC-Lab Software | BioLogic | N/A | |
| ECO E 4 S heating circulator | Lauda-Brinkmann | Cat. No. 115 V; 60 Hz : L001191 | |
| FeSO4 * 7H2O | Millipore Sigma | 215422 | |
| Folic acid | Millipore Sigma | F8758 | |
| H3BO3 | Millipore Sigma | B6768 | |
| Insulin syringes with BD Micro-Fine IV Needle | Thermo Fisher Scientific | 14-829-1A | |
| Lactiplantibacillus plantarum NCIMB8826 | N/A | N/A | Reference: Tejedor-Sanz et al., 2022 |
| Lactobacillus MRS Broth | HiMedia | M369 | |
| M9 Broth | Milliport Sigma | 63011 | |
| Magnesium sulfate anhydrous | Millipore Sigma | 208094 | |
| Manganese sulfate monohydrate | Millipore Sigma | 221287 | |
| mannitol | Millipore Sigma | M1902-1KG | |
| Mettler Toledo FiveEasy Benchtop pH Meter | Hogentogler | F20-KIT | |
| MgCl2 * 6H2O | Millipore Sigma | M9272 | |
| MgSO4 * 7H2O | Millipore Sigma | M2773 | |
| Millex - GV 0.22 µm PVDF Membrane Filter Unit | Millipore Sigma | SLGV004SL | |
| MnCl2 * 4H2O | Millipore Sigma | 203734 | |
| MnSO4 * H2O | Millipore Sigma | 221287 | |
| MOPS | Millipore Sigma | M1442 | |
| N2 gas | Airgas | NI UHP300 | Filter before use |
| Na2MoO4 * 2H2O | Millipore Sigma | 331058 | |
| Na2SO4 | Millipore Sigma | 238597 | |
| NaCl | Millipore Sigma | S9888 | |
| NH4Cl | Millipore Sigma | A9434 | |
| Nicotinic acid | Millipore Sigma | N-0761 | |
| Nitrilotriacetic acid (NTA) | Millipore Sigma | 72560 | |
| p-Aminobenzoic acid | Millipore Sigma | P9879 | |
| Phosphate buffered saline, 10x solution | Thermo Fisher Scientific | BP399-1 | |
| Potassium phosphate dibasic | Millipore Sigma | P8281 | |
| potentiostat | BioLogic | VMP-300 | |
| Protease peptone #3 | Bacto | 211693 | |
| Pyridoxine HCl | Millipore Sigma | P6280 | |
| Riboflavin | Millipore Sigma | 555682 | |
| RO10 magnetic stir bar platform | IKA | 3691000 | |
| Sodium acetate trihydrate | Millipore Sigma | 935700 | |
| Stir bar, egg-shaped | Thermo Fisher Scientific | 14-512-121 | Place in anodic chamber of BES |
| Thiamine HCl | Millipore Sigma | V-014 | |
| Thioctic acid (α-Lipoic acid) | Millipore Sigma | T-1395 | |
| Tryptophan | Millipore Sigma | 9136 | |
| Tween80 | Millipore Sigma | P4780 | |
| Vitamin B12 | Millipore Sigma | V6629 | |
| Jacketed MCF set, 100 ml, NW25, 2 x GL14 port | Adams & Chittenden Scientific Glass | NA | Customized |
| Yeast extract | Millipore Sigma | Y1625 | |
| ZnSO4 * 7H2O | Millipore Sigma | Z0251 |
Références
- TerAvest, M. A., Ajo-Franklin, C. M. Transforming exoelectrogens for biotechnology using synthetic biology. Biotechnol Bioeng. 113 (4), 687-697 (2016).
- Chen, H., Dong, F., Minteer, S. D. The progress and outlook of bioelectrocatalysis for the production of chemicals, fuels and materials. Nat Catal. 3 (3), 225-244 (2020).
- Chen, H., et al. Fundamentals, applications, and future directions of bioelectrocatalysis. Chem Rev. 120 (23), 12903-12993 (2020).
- Lovley, D. R., Phillips, E. J. P. Novel mode of microbial energy metabolism: organic carbon oxidation coupled to dissimilatory reduction of iron or manganese. Appl Environ Microbiol. 54 (6), 1472-1480 (1988).
- Myers, C. R., Nealson, K. H. Bacterial manganese reduction and growth with manganese oxide as the sole electron acceptor. Science. 240 (4857), 1319-1321 (1988).
- Koch, C., Harnisch, F. Is there a specific ecological niche for electroactive Microorganisms. ChemElectroChem. 3 (9), 1282-1295 (2016).
- Zhao, J., et al. Microbial extracellular electron transfer and strategies for engineering electroactive microorganisms. Biotechnol Adv. 53, 107682 (2021).
- Zhang, J., Li, F., Liu, D., Liu, Q., Song, H. Engineering extracellular electron transfer pathways of electroactive microorganisms by synthetic biology for energy and chemicals production. Chem Soc Rev. 53 (3), 1375-1446 (2024).
- Logan, B. E. Exoelectrogenic bacteria that power microbial fuel cells. Nat Rev Microbiol. 7 (5), 375-381 (2009).
- Logan, B. E., Rabaey, K. Conversion of wastes into bioelectricity and chemicals by using microbial electrochemical technologies. Science. 337 (6095), 686-690 (2012).
- Gu, L., Xiao, X., Yup Lee, S., Lai, B., Solem, C. Superior anodic electro-fermentation by enhancing capacity for extracellular electron transfer. Bioresour Technol. 389, 129813 (2023).
- Boucher, D. G., et al. Bioelectrocatalytic synthesis: concepts and applications. Angew Chem Int Ed. 62 (46), e202307780 (2023).
- Tejedor-Sanz, S., et al. Extracellular electron transfer increases fermentation in lactic acid bacteria via a hybrid metabolism. eLife. 11, e70684 (2022).
- Martino, M. E., et al. Nomadic lifestyle of Lactobacillus plantarum revealed by comparative genomics of 54 strains isolated from different habitats. Environ Microbiol. 18 (12), 4974-4989 (2016).
- Fidanza, M., Panigrahi, P., Kollmann, T. R. Lactiplantibacillus plantarum-nomad and ideal probiotic. Front Microbiol. 12, 712236 (2021).
- Duar, R. M., et al. Lifestyles in transition: evolution and natural history of the genus Lactobacillus. FEMS Microbiol Rev. 41 (Suppl_1), S27-S48 (2017).
- Kaushik, J. K., et al. Functional and probiotic attributes of an indigenous isolate of Lactobacillus plantarum. PLOS ONE. 4 (12), e8099 (2009).
- Seddik, H. A., et al. Lactobacillus plantarum and its probiotic and food potentialities. Probiotics Antimicrob Proteins. 9 (2), 111-122 (2017).
- Siezen, R. J., et al. Phenotypic and genomic diversity of Lactobacillus plantarum strains isolated from various environmental niches. Environ Microbiol. 12 (3), 758-773 (2010).
- Light, S. H., et al. A flavin-based extracellular electron transfer mechanism in diverse Gram-positive bacteria. Nature. 562 (7725), 140-144 (2018).
- Tolar, J. G., Li, S., Ajo-Franklin, C. M. The differing roles of flavins and quinones in extracellular electron transfer in Lactiplantibacillus plantarum. Appl Environ Microbiol. 89 (1), e0131322 (2023).
- Li, S., De Groote Tavares, C., Tolar, J. G., Ajo-Franklin, C. M. Selective bioelectronic sensing of pharmacologically relevant quinones using extracellular electron transfer in Lactiplantibacillus plantarum. Biosens Bioelectron. 243, 115762 (2024).
- Blackburn, B., Alba, R., Hatch, A., Ajo-Franklin, C. M., Mevers, E. Understanding the Chemical Properties that Drive Extracellular Electron Shuttles. ChemRxiv. , (2024).
- De Man, J. C., Rogosa, M., Sharpe, M. E. A medium for the cultivation of Lactobacilli. J Appl Bacteriol. 23 (1), 130-135 (1960).
- Aumiller, K., et al. A chemically-defined growth medium to support Lactobacillus-Acetobacter sp. community analysis. PLOS ONE. 18 (10), e0292585 (2023).
- Brooijmans, R. J. W., de Vos, W. M., Hugenholtz, J. Lactobacillus plantarum WCFS1 electron transport chains. Appl Environ Microbiol. 75 (11), 3580-3585 (2009).
- LaBelle, E., Bond, D. R. Cyclic voltammetry for the study of microbial electron transfer at electrodes. Bio-electrochemical systems: from extracellular electron transfer to biotechnological application. , (2009).
- Mevers, E., et al. An elusive electron shuttle from a facultative anaerobe. eLife. 8, e48054 (2019).
- Dirar, H., Collins, E. B. End-products, Fermentation balances and molar growth yields of homofermentative Lactobacilli. Microbiology. 73 (2), 233-238 (1972).
- Huong Le, T. X., Bechelany, M., Cretin, M. Carbon felt based-electrodes for energy and environmental applications: A review. Carbon. 122, 564-591 (2017).
- Zhou, A. Y., Baruch, M., Ajo-Franklin, C. M., Maharbiz, M. M. A portable bioelectronic sensing system (BESSY) for environmental deployment incorporating differential microbial sensing in miniaturized reactors. PLOS ONE. 12 (9), e0184994 (2017).
- Benjamin, S. R., de Lima, F., Nascimento, V. A. d. o., de Andrade, G. M., Oriá, R. B. Advancement in paper-based electrochemical biosensing and emerging diagnostic methods. Biosensors. 13 (7), 689 (2023).
- Kumashi, S. R., et al. A CMOS multi-modal electrochemical and impedance cellular sensing array for massively paralleled exoelectrogen screening. IEEE Trans Biomed Circuits Syst. 15 (2), 221-234 (2021).
- Jadhav, D. A., et al. Scale-up of the bioelectrochemical system: Strategic perspectives and normalization of performance indices. Bioresour Technol. 363, 127935 (2022).
- Kim, J., Cestellos-Blanco, S., Shen, Y., Cai, R., Yang, P. Enhancing biohybrid CO2 to multicarbon reduction via adapted whole-cell catalysts. Nano Lett. 22 (13), 5503-5509 (2022).
- He, Z., Mansfeld, F. Exploring the use of electrochemical impedance spectroscopy (EIS) in microbial fuel cell studies. Energy Environ Sci. 2 (2), 215-219 (2009).
- Okamoto, A., Hashimoto, K., Nealson, K. H., Nakamura, R. Rate enhancement of bacterial extracellular electron transport involves bound flavin semiquinones. Proc Natl Acad Sci U S A. 110 (19), 7856-7861 (2013).
- Zhang, X., Li, X., Zhao, X., Li, Y. Factors affecting the efficiency of a bioelectrochemical system: a review. RSC Adv. 9 (34), 19748-19761 (2019).
- Kornienko, N., Zhang, J. Z., Sakimoto, K. K., Yang, P., Reisner, E. Interfacing nature's catalytic machinery with synthetic materials for semi-artificial photosynthesis. Nat Nanotechnol. 13 (10), 890-899 (2018).
- Glasser, N. R., Saunders, S. H., Newman, D. K. The colorful world of extracellular electron shuttles. Annu Rev Microbiol. 71 (1), 731-751 (2017).
- Gemünde, A., Lai, B., Pause, L., Krömer, J., Holtmann, D. Redox mediators in microbial electrochemical systems. ChemElectroChem. 9 (13), e202200216 (2022).
- Kundu, B. B., et al. Extracellular respiration is a latent energy metabolism in Escherichia coli. bioRxiv. , (2024).
- O'Brien, J. P., Malvankar, N. S. A simple and low-cost procedure for growing Geobacter sulfurreducens cell cultures and biofilms in bioelectrochemical systems. Curr Protoc Microbiol. 43 (1), A.4K.1-A.4K.27 (2016).
- Su, L., Fukushima, T., Ajo-Franklin, C. M. A hybrid cyt c maturation system enhances the bioelectrical performance of engineered Escherichia coli by improving the rate-limiting step. Biosens Bioelectron. 165, 112312 (2020).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon