Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Méthode pour la culture d'embryons de poulet Early ex vivo (Nouvelle Culture)
Dans cet article
Résumé
Cette vidéo montre la nouvelle culture, une méthode par laquelle les embryons de poulet sont cultivées en dehors de l'œuf jusqu'à 24 heures. Cette méthode permet d'étudier le développement précoce (ligne primitive à 14 soms.), Une période correspondant à E7-9 chez la souris. Les applications de cette technique comprennent l'électroporation, l'hybridation in situ et immunohistochimie.
Résumé
L'embryon de poulet est un outil précieux dans l'étude du développement embryonnaire précoce. Sa transparence, l'accessibilité et la facilité de manipulation, en font un outil idéal pour étudier la formation et la structuration du cerveau, du tube neural, somite et primordia cœur. Applications de la culture d'embryons de poulets comprennent l'électroporation de constructions d'ADN ou d'ARN afin d'analyser la fonction des gènes, des greffes de perles du facteur de croissance revêtement tels que FGF et BMP, ainsi que monter toute l'hybridation in situ et immunohistochimie. Cette vidéo montre les différentes étapes de la culture d'embryon de poulet; d'abord, l'embryon est explanté dans une solution saline. Ensuite, l'embryon est centrée sur un anneau de verre. Les membranes entourant l'embryon sont levées le long des murs de l'anneau. L'anneau est ensuite placé dans une boîte de culture contenant un pool d'albumine. La boîte de culture est scellé et placé dans une chambre humide, où l'embryon est cultivé pendant au moins 24 heures. Enfin, l'embryon est retiré de l'anneau, fixées et traitées pour d'autres applications. Un guide de dépannage est également présentée.
Protocole
Partie 1: Banc de mettre en place
- Une chambre humide est préparé en plaçant Kimwipe / ddH 2 O dans la chambre de plastique.
- Un tube Falcon de recueillir l'albumine, de la vaisselle pour la culture, des bagues, verre de montre et l'élimination des déchets sont placés sur le banc.
- Plat en pyrex est rempli avec une solution saline 1,4 l (voir note [a]).
Partie 2: l'embryon est explanté dans une solution saline
- Les œufs sont retirés de l'incubateur après 16 heures (stade 4). L'œuf est opene en tapant la coquille avec une pince. Shell morceaux sont enlevés.
- L'albumine fine est recueillie dans le tube Falcon. L'albumine épaisse est retiré avec une pince.
- L'embryon est placé dans une boîte en plastique à l'intérieur du plat saline. L'albumine reste est enlevé avec une pince.
Partie 3: l'embryon est centrée sur l'anneau
- Le sac vitellin est incliné avec une pince afin que les embryons tournée vers le haut.
- Le sac vitellin est coupé au niveau de l'équateur ou en dessous.
- En utilisant une pince fine, la membrane vitelline est rapidement épluchés. La membrane vitelline est orienté de sorte que son côté granulaire (non brillant) tournée vers le haut.
- En utilisant une pince fine, la membrane vitelline est placée sur le verre de montre.
- En utilisant une pince fine, un anneau de verre est appliquée sur le dessus de la membrane vitelline et l'embryon est centré.
- La membrane vitelline est levé autour des bords de l'anneau de verre. L'ensemble est retiré de l'antenne saline.
Partie 4: La culture est mis en place sous le microscope
- La membrane vitelline est levé sur l'anneau de verre à l'aide de pinces fines au microscope.
- En utilisant une pipette Pasteur, la saline est retirée à partir du bord extérieur de l'anneau.
- Avec des ciseaux fins, l'excès de membrane vitelline est enlevée à partir du bord interne de l'anneau de verre. Il est pris soin de ne pas percer la membrane avec pipette ou une pince.
- L'embryon est légèrement rincés avec du sérum physiologique pour enlever les membranes des cellules en vrac et le jaune.
- 200 ul saline est ajoutée au bord externe de l'anneau (ce qui facilitera un transfert ultérieur).
- L'ensemble est recouvert d'un plat de plastique inversé.
Partie 5: La culture est transférée à l'incubateur
- Une boîte de culture Falcon est étiqueté.
- 2.5ml d'albumine mince est ajouté au bas de l'antenne Falcon.
- 200 ul d'albumine mince est ajouté à l'arête intérieure du couvercle du plat Falcon.
- Le plat inversé est retiré de l'assemblée.
- En utilisant une pince fine, l'anneau de verre est glissé le long du bord du verre de montre, et transféré à l'antenne Falcon.
- Tous les salines restante est retirée de la surface intérieure de l'anneau.
- Le plat est couvert Falcon avec couvercle et scellé.
- L'ensemble est placé dans une chambre humide, puis dans l'incubateur.
- Les embryons sont cultivés pendant au moins 24 heures à 38 ° C.
Partie 6: culture suivants, l'embryon est fixe, la culture est transférée à l'incubateur
- Un plat de fixation est remplie de PBS glacé (ou DEPC PBS si des embryons doivent être traitées pour l'hybridation in situ).
- La culture est retiré de l'incubateur et immédiatement placé sur la glace. La boîte de culture est immédiatement remplie de PBS glacé / DEPC PBS.
- L'embryon se détache de la membrane vitelline. L'embryon est transféré dans le plat de fixation, en utilisant l'extrémité émoussée d'une pipette Pasteur.
- L'embryon est coincé à l'aide des extrémités franches pinces fines. Le PBS couvrant le plat de fixation est retiré. Fixateur est ajouté (voir note [b]).
- Selon l'application, l'embryon est fixe pendant 6-8 heures à 4 ° C (cryostat), O / N à 4 ° C (en situs), ou 1 h à température ambiante pour montage immunohistochimie ensemble.
- Le fixateur est enlevé et remplacé par PBS glacé / DEPC PBS.
- Pour les applications en aval telles que l'hybridation in situ ou la coloration immantibody: le système nerveux et le cœur sont perforés à l'aide d'une aiguille extrémité émoussée microcapillaire ou un couteau de microdissection, ce qui permettra d'éviter le piégeage de la sonde / anticorps dans les étapes ultérieures.
Notes: [a] Saline est composé de: la solution A (pour 1 l): 121,0 g de NaCl, 15,5 g de KCl, 10,4 g de CaCl 2 .2 H 2 O, 12,7 g de MgCl 2 .6 H 2 O; solution B (pour 1 l) : 2,4 g de Na 2 HPO 4 .2 H 2 O, 0,2 g de NaH 2 PO 4 .2 H 2 O; Autoclave; Avant utilisation, mélanger 120 ml A avec 2700 ml H 2 O; Ajouter 180 ml B. Mélanger [1]; [b] fixateur est préparé juste avant utilisation (4% dans du PBS ou PFA DEPC PBS dans situs).
Partie 7: Résultats Représentant
Avant de la culture, l'embryon est au stade ligne primitive (HH4). A la fin de la période de la culture, l'embryon a développé au HH10 (longueur 2-3 mm) et est visible dans le centre de la boîte de culture. Il est possible d'étiqueter un groupe de cellules fluorescentes avec carbocyanine DiIjuste avant la culture (0h) et suivre leurs mouvements pendant toute la période de culture. Dans ce cas, les cellules ci-dessous le nœud de Hensen (HN) ont été marqués avec DII. Ces cellules sont indiquées pour contribuer à développer progressivement somites (SOM) et notochorde (n). 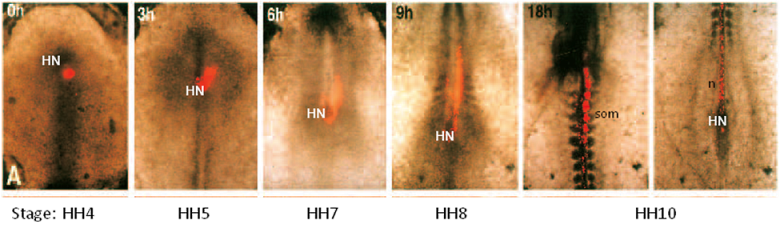
Partie 8: Dépannage
| Problème | Cause | Remède |
|---|---|---|
| Embryon reste avec du jaune au lieu de venir hors avec membrane (étape 2) | Mauvaise qualité des œufs | Demande fraîchement produite oeufs; oeufs magasin à 13 ° C dès réception. Incuber les œufs le même jour que la date d'arrivée. |
| Glisser membrane vitelline loin de placement horloger de verre suivants de l'anneau (étape 3) | Restes d'albumine | Dans l'étape 2, assurez-vous que tous albumine est éliminé par l'éloignant de la membrane avec une pince inclinée |
| Embryon est inaccessible: se trouve sous la membrane (étape 4) | Mauvais côté de la membrane est à la hausse | À l'étape 3, assurez-vous du côté de la membrane contenant des granulés jaunes est orientée vers le haut. Le brillant, côté poli doit faire face vers le bas. |
| Embryon immergé dans la culture suivante salins / albumine (étape 6) | Trou dans la membrane; Saline / albumine laissé intérieur de l'anneau avant de la culture | Dans l'étape 5, assurez-vous que tous albumine / saline est retiré de l'intérieur de l'anneau; l'étape 4, assurez-vous que vous n'avez pas de membrane percer avec une pince (l'utilisation de pinces à bouts francs) |
| Embryon désintégré la culture suivante | L'infection bactérienne | Stériliser tous les outils et ouvrages en verre; l'utilisation d'antibiotiques / antimycotiques |
Discussion
La méthode de culture New 2 peut être utilisé pour une large variété d'applications, allant de greffes du facteur de croissance contenant des billes 3, de monter toute hybridation in situ et immunohistochimie toute monture 4. Culture sur une période de 24 heures permet la surveillance continue du développement embryonnaire dans des applications comme laps de temps le mouvement des cellules d'analyse 5 ou de surveillance de la GFP contenant des constructions électr...
Remerciements
Ce travail a été soutenu par la Fondation Margaret M. Alkek au RHF.
matériels
| Name | Company | Catalog Number | Comments | |
| Eggs | Animal | Charles River Laboratories | Premium Fertile | |
| Stereomicroscope | Microscope | Leica Microsystems | MZ9.5 or similar | |
| Marsh Automatic Incubator | Tool | Lyon | RX | |
| Hybridization Incubator | Tool | Robbins Scientific, SciGene | M1000 | |
| Pyrex dish (2) | Tool | |||
| Watchmaker’s glass 50mm | Tool | VWR international | 66112-060 | |
| Glass rings | Tool | Physical Plant facility | cut 4 mm thick sections of glass tubing (27 mm outer diam, 25 mm inner diam). Do not fine polish. | |
| Curved Forceps (1) | Surgery | Electron Microscopy Sciences | 72991-4C | |
| Forceps (2) | Surgery | Fine Science Tools | 11002-13 | blunt ended using sharpening Stone and 100ul mineral oil |
| Sharpening Stone Dan’s Black Arkansas | Surgery | Electron Microscopy Sciences | 62082-00 | |
| Fine scissors | Surgery | Fine Science Tools | 14161-10 | |
| Plastic dishes | Tool | Falcon BD | 353001 | |
| Rubber Bulb | Tool | Electron Microscopy Sciences | 70980 | |
| Pasteur Capillary Pipette | Tool | Electron Microscopy Sciences | 70950-12 | round edge under flame |
| Microcapillary tube | Surgery | Sigma-Aldrich | P1049-1PAK | Pull using vertical micropipette puller; blunt end with fine forceps |
| Microdissecting knife | Surgery | Fine Science Tools | 10056-12 | Use to puncture cavities prior to in situ hybridization |
| Minuten pins 0.2mm diam | Surgery | Fine Science Tools | 26002-20 | |
| Sylgard 184 Silicon Elastomer Curing Agent and Base | Reagent | Dow Corning | 0001986475 | Mix 1 part Curing Agent, 9 parts Base; set O/N at 37C |
| Diethylpyrocarbonate (depc) | Reagent | Acros Organics | 10025025 | Add 1ml depc to 1l PBS; shake; autoclave |
Références
- Pannett, P. A., Compton, C. A. The cultivation of tissues in saline. Lancet. 206, 381-384 (1924).
- New, D. T. A new technique for the cultivation of the chick embryo in vitro. J. Embryol. Exp. Morph. 3, 326-331 (1955).
- Alvarez, I. S., Araujo, M., Nieto, M. A. Neural induction in whole chick embryo cultures by FGF. Dev. Biol. 199, 42-54 (1998).
- Psychoyos, D., Stern, C. D. Restoration of the organizer after radical ablation of Hensen's node and the anterior primitive streak in the chick embryo. Development. 122, 3263-3273 (1996).
- Psychoyos, D., Stern, C. D. Fates and migratory routes of primitive streak cells in the chick embryo. Development. 122, 1523-1534 (1996).
- Voiculescu, O., Papanayotou, C., Stern, C. D. Spatially and temporally controlled electroporation of early chick embryos. Nature Protoc. 3, 419-426 (2008).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon