Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Une technique de recueil de série du liquide céphalorachidien de la grande citerne de souris
Dans cet article
Résumé
Modèles de souris transgéniques (Tg) de AD offrent une excellente occasion d'examiner comment et pourquoi les niveaux de Aß ou de tau dans le LCR changements que la maladie progresse chez les patients humains. Ici, nous démontrons une technique raffinée cisterna magna perforation pour l'échantillonnage CSF de série de la souris.
Résumé
La maladie d'Alzheimer (MA) est une maladie neurodégénérative progressive qui est pathologiquement caractérisée par un dépôt extracellulaire de β-amyloïde de peptide (Aß) et l'accumulation intraneuronale de protéines tau hyperphosphorylée. Parce que le liquide céphalorachidien (LCR) est en contact direct avec l'espace extracellulaire du cerveau, il fournit un reflet des changements biochimiques dans le cerveau en réponse à des processus pathologiques. LCR de patients atteints de MA montre une baisse dans les 42 acides aminés sous forme de Aß (Aß42), et augmente au total tau et hyperphosphorylée tau, bien que les mécanismes responsables de ces changements ne sont pas encore entièrement compris. Modèles de souris transgéniques (Tg) de AD offrent une excellente occasion d'examiner comment et pourquoi les niveaux de Aß ou de tau dans le LCR changements que la maladie progresse. Ici, nous démontrons une technique raffinée cisterna magna perforation pour l'échantillonnage de LCR chez des souris. Cette technique d'échantillonnage très doux permet série LCR d'être obtenu à partir de la même souris à 2-3 mois d'intervalle ce qui minimise considérablement l'effet de confusion entre la souris variabilité des niveaux de Aß ou tau, ce qui permet de détecter de subtiles altérations dans le temps. En combinaison avec Aß et la protéine tau ELISA, cette technique sera utile pour des études visant à étudier la relation entre les niveaux de CSF Aß42 et tau, et leur métabolisme dans le cerveau de souris modèles AD. Des études chez des souris Tg pourrait fournir une validation importante que le potentiel de Aßi LCR ou les niveaux de tau d'être utilisés comme marqueurs biologiques pour la surveillance progression de la maladie, et de surveiller les effets des interventions thérapeutiques. Comme les souris peuvent être sacrifiés et les cerveaux peuvent être examinés pour des changements biochimiques ou histologiques, les mécanismes sous-jacents aux changements CSF peut être mieux évaluée. Ces données sont susceptibles d'être instructive pour l'interprétation des changements humains LCR AD.
Protocole
Tirer sur le tube capillaire en verre
- Le tube capillaire en verre est acheté à La Inc Sutter Instrument (verre borosilicate, le B100-75-10).
- Tirez les tubes capillaires sur une Sutter P-87 Flaming micropipette extracteur, avec l'indice de chaleur fixé à 300 et l'indice de pression fixé à 330.
- Coupez le bout du tube capillaire en verre avec des ciseaux, de sorte que la pointe conique a un diamètre intérieur de 0,5 mm environ.
Technique de la ponction Cisterna magna pour LCR
Les échantillons de LCR sont tirés de la grande citerne (figure 1) en utilisant une méthode qui a déjà été publiée 1. 
Figure 1
1. Les souris sont anesthésiés par la kétamine (100mg/kg) et de xylazine (10mg/kg), administrée par voie intrapéritonéale. Pendant le temps de l'induction anesthésique, les souris sont conservés dans un incubateur à 37 o C.
2. La peau de la nuque est rasée, et la souris est alors placée sur l'instrument sujettes stéréotaxique avec contact direct d'un coussin chauffant. Une sonde de température rectale est inséré dans le rectum afin que la chaleur produite par le coussin chauffant est ajustée en réponse aux changements de température du corps. La tête est fixée avec les adaptateurs tête. Le site chirurgical est frottée avec de l'iode povidone 10%, suivie par l'éthanol 7 0% (répéter 3 fois), et une incision sagittale de la peau est faite inférieure à l'occiput.
3. Sous le microscope de dissection, le tissu sous-cutané et les muscles (m. biventer cervicis et m. rectus capitis dorsalis majeur) sont séparées par dissection avec une pince. Une paire de microretractors est utilisé pour maintenir les muscles de l'autre.
4. La souris est fixée de telle sorte que la tête forme un angle de près de 135 o avec le corps.
5. Sous le microscope de dissection, la dure-mère de la grande citerne apparaît comme un triangle étincelant et clair inverse par lequel le bulbe rachidien et un vaisseau sanguin majeur (artère spinalis dorsalis), et l'espace LCR sont visibles (figure 2). 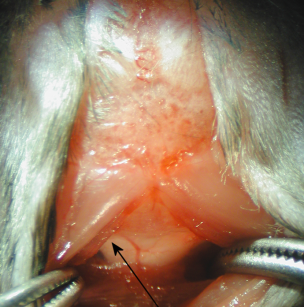
Figure 2
6. La dure-mère est effacée à sec avec un coton-tige stérile. Pénétrer le tube capillaire dans le Citerna magna travers la dure-mère, latéral à la spinalis artère dorsale (figure 2). Suite à un changement notable dans la résistance à l'insertion du tube capillaire, la LCR se jette dans le tube capillaire.
7. Retirer délicatement le tube capillaire, et le connecter à une seringue de 3 ml à travers un tuyau de polyéthylène qui a un diamètre interne de 1 mm. Injectez la LCR dans un tube pré-marqués 0,5 ml Eppendorf, et de geler le tube immédiatement sur glace sèche et ensuite le transférer dans un congélateur à -80 ° C.
8. Après le prélèvement du LCR, les muscles sont ré-alignés, et la peau est suturée (4-0, Ethicon, Johnson & Johnson). Environ 1 ml de NaCl 0,9% d'injection sous-cutanée pour éviter la déshydratation. La souris est maintenu à l'incubateur de maintenir la température du corps jusqu'à ce qu'il récupère, le poids de la souris est surveillé 1 jour et 1 semaine après la chirurgie.
Résultats et discussion
Nous avons décrit un protocole très fiable pour l'échantillonnage de série de LCR chez des souris sans contamination du plasma détectable.
1. Toute la procédure prend généralement 10 min par la souris (y compris l'anesthésie). Le volume de LCR obtenus dépend du souches de souris. Dans le PS / APP doubles souris Tg, nous avons utilisé 2, le volume moyen est d'environ 5 pl (3 à 7 pi), tandis que le P301L (JNPL3) souris 3 donnent un rendement d'environ 10 ul ul-15. Pour l'échantillonnage de série, un maximum de 7-8 ul ne peut être sans risque pris à chaque fois à un intervalle de 2-3 mois.
2. Pendant la chirurgie, il est important de positionner la tête et le corps de la souris correctement sur le cadre stéréotaxique de telle sorte que la dure-mère de grande citerne peut être exposé suffisamment. Eviter soigneusement les vaisseaux sanguins lors de la pénétration de la dure-mère avec le tube capillaire pour éviter la contamination à partir des protéines du plasma, qui peuvent être suivis dans l'échantillon de LCR par immunoblot pour ApoB 4.
3. Minimiser les dommages tissulaires lors de chaque opération est importante, car conglutination tissus peut augmenter la difficulté par un saignement de prédisposition pour l'échantillonnage suivant.
4. La température du corps doit être bien entretenu pendant la chirurgie, car l'hypothermie causée par l'anesthésie peut affecter de manière significative les niveaux de tau phosphorylée dans le cerveau très rapidement 5.
5. L'Ab protocole ELISA et des anticorps que nous avons utilisés ont été décrits en détail dans Refolo et al. 6. Deux ul de LCR de la souris PS / APP donnera des résultats satisfaisants lorsque dilué 1:50-1:60. Pour le test ELISA de tau, 4-5 LCR pi de P301L (JNPL3) souris sera suffisante pour laDétection du total des tau, ou tau phosphore ylated au thréonine 231 (kits sont achetés auprès de Bio-Source).
6. Cette technique peut être appliquée à d'autres modèles de souris de maladies neurologiques, dont un petit volume de LCR est satisfaisante pour les dosages souhaités.
Discussion
Nous avons décrit un protocole très fiable pour l'échantillonnage de série de LCR chez des souris sans contamination du plasma détectable.
1. Toute la procédure prend généralement 10 min par la souris (y compris l'anesthésie). Le volume de LCR obtenus dépend du souches de souris. Dans le PS / APP doubles souris Tg, nous used2, le volume moyen est d'environ 5 pl (3 à 7 pi), tandis que le P301L (JNPL3) souris 3 donnent un rendement d'environ 10 ul ul-15. Pour l'échantillonnage de série, un maximum de 7...
Remerciements
Notre travail est soutenu par des subventions du NIH et de NS048447 AG017216to KD. Li Liu tiens à remercier le Dr Heikki Tanila (Université de Kuopio, Kuopio, Finlande) pour sa supervision et du soutien lors du développement du protocole original.
Références
- Liu, L., et al. Longitudinal observation on CSF Abeta42 levels in young to middle-aged amyloid precursor protein/presenilin-1 doubly transgenic mice. Neurobiol Dis. 17, 516 (2004).
- Holcomb, L., et al. Accelerated Alzheimer-type phenotype in transgenic mice carrying both mutant amyloid precursor protein and presenilin 1 transgenes. Nat Med. 4, 97 (1998).
- Lewis, J., et al. Neurofibrillary tangles, amyotrophy and progressive motor disturbance in mice expressing mutant (P301L) tau protein. Nat Genet. 25, 402 (2000).
- DeMattos, R. B., et al. Plaque-associated disruption of CSF and plasma amyloid-beta (Abeta) equilibrium in a mouse model of Alzheimer's disease. J Neurochem. 81, 229 (2002).
- Planel, E., et al. Anesthesia leads to tau hyperphosphorylation through inhibition of phosphatase activity by hypothermia. J Neurosci. 27, 3090 (2007).
- Refolo, L. M., et al. A cholesterol-lowering drug reduces beta-amyloid pathology in a transgenic mouse model of Alzheimer's disease. Neurobiol Dis. 8, 890 (2001).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon