Tri cellulaire magnétique (MACS) : isolement des lymphocytes T thymiques
Source: Meunier Sylvain1,2,3, Perchet Thibaut1,2,3, Sophie Novault4, Rachel Golub1,2,3
1 Unité de lymphopoiesis, Département d'immunologie, Institut Pasteur, Paris, France
2 INSERM U1223, Paris, France
3 Université Paris Diderot, Sorbonne Paris Cité, Cellule Pasteur, Paris, France
4 Flow Cytometry Platfrom, Cytometry and Biomarkers UtechS, Center for Translational Science, Institut Pasteur, Paris, France
La défense contre les agents pathogènes dépend de la surveillance par le système immunitaire. Ce système est complexe et comprend de nombreux types de cellules, chacune ayant des fonctions spécifiques. Cette composition complexe permet des réponses immunitaires à une grande diversité d'agents pathogènes et de blessures. L'immunité adaptative permet des réponses spécifiques contre des agents pathogènes spécifiques. La majorité des cellules responsables de ce type d'immunité sont les lymphocytes (cellules B et lymphocytes T). Habituellement, les cellules B réagissent aux infections extracellulaires (comme les infections bactériennes), et les lymphocytes T réagissent aux infections intracellulaires (comme les infections virales). Les différents types de cellules dans les populations de lymphocytes peuvent être caractérisés par la combinaison de protéines de surface cellulaire qu'ils expriment et / ou par un panneau de cytokines sécrétées.
Le tri magnétique permet l'enrichissement des populations cellulaires ciblées à l'aide de propriétés magnétiques et l'expression d'une ou plusieurs protéines de surface cellulaire (1, 2). Cette technique se compose de trois étapes. Tout d'abord, les cellules sont incubées avec des perles magnétiques qui sont couplées avec un ou plusieurs anticorps monoclonaux spécifiques. Les cellules qui expriment les protéines de surface qui se lient à ces anticorps se fixent aux perles magnétiques. Ensuite, les populations cellulaires ciblées sont capturées avec un aimant. Pour finir, les cellules ciblées sont élifiées de l'aimant. À la fin, deux produits de tri sont obtenus, l'un contenant des cellules non étiquetées et l'autre contenant les cellules cibles couplées avec les perles magnétiques. Les colonnes peuvent être utilisées pour améliorer l'efficacité du tri magnétique. Dans la colonne, un élément non magnétique allonge le chemin de la cellule à travers la colonne. Par conséquent, le flux cellulaire est ralenti, facilitant la capture cellulaire par l'aimant.
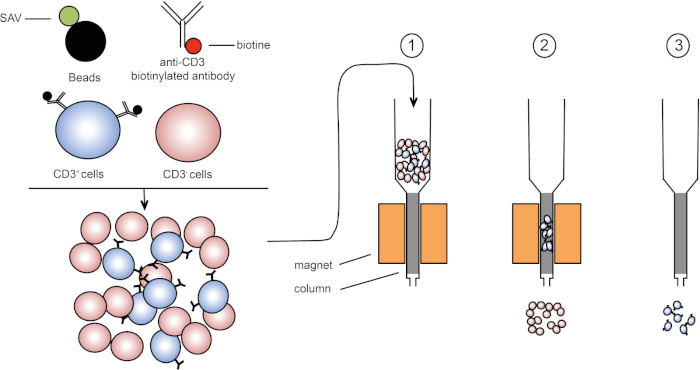
Figure 1 : Représentation schématique de la séparation magnétique. Les leucocytes thymiques sont tachés d'anticorps biotinylated anti-CD3. Après le lavage, les perles couplées de streptavidin (SAV) fixent spécifiquement la biotine sur des anticorps anti-CD3. (1) Les cellules sont transférées dans une colonne. (2) L'aimant ne retient pas les cellules non étiquetées, tandis que les cellules CD3-positives restent dans la colonne. Enfin, la colonne est séparée de l'aimant et (3) les cellules CD3-positives sont élucées dans le milieu. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
Il existe deux types de tri magnétique (3). Dans le tri positif, les cellules d'intérêt sont capturées avec les perles magnétiques. Dans le tri négatif, les cellules indésirables sont enlevées en capturant avec les perles magnétiques portant les anticorps appropriés. Cette technique MACS permet un bon enrichissement des cellules ciblées et améliore le pourcentage de cellules récupérées de 1-20% à 60-98% dans un organe. Après le tri, il est nécessaire de vérifier la pureté et le tri des cellules par différentes méthodes (par exemple, cytométrie du débit). La technique MACS est idéale pour enrichir une population cible pour d'autres expériences telles que la culture cellulaire ou l'analyse du cycle cellulaire.
Dans cet exercice de laboratoire, nous démontrons comment isoler les leucocytes thymiques et par la suite enrichir les cellules thymiques CD3-positives du mélange en utilisant la technique de tri de cellules magnétiques.
1. Préparation
- Avant de commencer, enfilez des gants de laboratoire et des vêtements de protection appropriés.
- Laver tous les outils de dissection, d'abord avec un détergent, puis avec 70% d'éthanol, puis les sécher avec un essuie-tout propre.
- Préparer 200 ml de solution de sel équilibrée de Hank (HBSS) contenant 2 % de sérum fœtal de veau (FCS).
2. Dissection
- Épingler une souris euthanasiée sur une plaque de disse
Dans ce protocole, des cellules CD3-positives ont été enrichies des leucocytes thymiques utilisant le tri de cellules magnétiques (figure 1). Avant l'enrichissement des cellules magnétiques, les cellules CD3-positives représentaient 53,6 % du total des cellules thymiques (figure 2, panneaux supérieurs). Après l'enrichissement des cellules magnétiques, le pourcentage de cellules CD3-positives a augmenté à 95% (figure 2, panneaux inférieurs). Ainsi, MACS est une technique simple,...
La technologie de séparation magnétique est une méthode courante pour trier facilement et rapidement une population de cellules cibles. En utilisant des anticorps spécifiques aux lymphocytes T et des perles magnétiques, nous avons enrichi la fréquence des lymphocytes T dans notre échantillon. Le taux de pureté à la fin de l'expérience dépend du pourcentage de cellules cibles dans la suspension cellulaire initiale. Les cellules obtenues après le tri des cellules magnétiques peuvent être utilisées à diverse...
- Owen, C. S. and Sykes, N. L. Magnetic labeling and cell sorting. Journal of Immunological Methods. 73 (1), 41-48 (1984).
- Miltenyi, S., Müller, W., Weichel, W. and Radbruch, A. High gradient magnetic cell separation with MACS. Cytometry. 11 (2), 231-238 (1990).
- Plouffe, B. D., Murthy, S. K. and Lewis, L. H. Fundamentals and application of magnetic particles in cell isolation and enrichment: a review. Reports on Progress in Physics. 78 (1), (2014).
Passer à...
Vidéos de cette collection:

Now Playing
Tri cellulaire magnétique (MACS) : isolement des lymphocytes T thymiques
Immunology
22.2K Vues

Cytométrie en flux et tri cellulaire activé par fluorescence (FACS) : isolement des lymphocytes B spléniques
Immunology
91.5K Vues

Tests ELISA : Indirect, en sandwich et par compétition
Immunology
233.3K Vues

Test ELISPOT : Détection des splénocytes sécrétants l'IFNgamma
Immunology
27.8K Vues

Immunohistochimie et immunocytochimie : Imagerie tissulaire par microscopie optique
Immunology
77.3K Vues

Génération d'anticorps monoclonaux à l'aide d'hybridomes
Immunology
42.7K Vues

Microscopie à fluorescence : coloration par immunofluorescence des sections de tissus inclus en paraffine
Immunology
52.7K Vues

Microscopie confocale à fluorescence : une technique pour localiser les protéines dans les fibroblastes de souris
Immunology
42.4K Vues

Techniques basées sur l'immunoprécipitation : purification des protéines endogènes à l'aide de billes d'agarose
Immunology
86.8K Vues

Analyse du cycle cellulaire : utilisation de la coloration CFSE et de la cytométrie de flux pour évaluer la prolifération des lymphocytes T CD4 et CD8 après stimulation
Immunology
23.7K Vues

Transfert adoptif de cellules : introduction de splénocytes d'une souris donneuse vers une souris hôte et évaluation du taux de succès au FACS
Immunology
21.6K Vues

Test de mort cellulaire : libération du chromium pour mesurer la cytotoxicité
Immunology
151.1K Vues