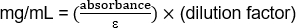Génération d'anticorps monoclonaux à l'aide d'hybridomes
Source : Frances V. Sjaastad1,2, Whitney Swanson2,3, et Thomas S. Griffith1,2,3,4
1 Microbiologie, immunologie et programme d'études supérieures en biologie du cancer, Université du Minnesota, Minneapolis, MN 55455
2 Center for Immunology, Université du Minnesota, Minneapolis, MN 55455
3 Département d'urologie, Université du Minnesota, Minneapolis, MN 55455
4 Centre du cancer maçonnique, Université du Minnesota, Minneapolis, MN 55455
Les anticorps polyclonales sont définis comme une collection d'anticorps dirigés contre différents déterminants antigéniques d'un antigène ou de plusieurs antigènes (1). Bien que les anticorps polyclonales soient de puissants outils pour identifier les molécules biologiques, il existe une limitation importante : ils sont incapables de faire la distinction entre les antigènes qui partagent des déterminants antigéniques. Par exemple, lorsque l'albumine de sérum bovin est utilisée pour immuniser un animal, les cellules B avec une surface différente Ig répondront à différents déterminants antigéniques sur l'albumine de sérum bovin. Le résultat est un mélange d'anticorps dans l'antisérum. Parce que l'albumine de sérum bovin partage quelques épitopes avec l'albumine de sérum humain dans les régions évolutivement conservées de la protéine, cet antisérum anti-bovin d'albumine de sérum de sérum réagira également avec l'albumine humaine de sérum. Par conséquent, cet antisérum ne sera pas utile pour distinguer entre les albumines de sérum bovine s'il y a des sérides.
Plusieurs approches ont été adoptées pour surmonter la question de la spécificité de l'antisera polyclonal. L'un est en absorbant les anticorps indésirables en passant l'antisérum à travers une colonne de chromatographie d'antigènes immobilisés (2). Cette méthode est fastidieuse et souvent incapable d'enlever complètement les anticorps indésirables. Une autre approche consiste à isoler les cellules B productrices d'anticorps individuelles et à les étendre en culture. Cependant, comme la plupart des cellules normales non transformées, les cellules B ne survivent pas dans la culture à long terme.
Pour surmonter l'incapacité des cellules B à survivre en culture, une approche consiste à préparer un hybridome de cellules myélome-B. En 1847, Henry Bence-Jones a découvert que les patients atteints de myélome multiple, une tumeur lymphoïde, ont produit une grande quantité d'anticorps (3). Les cellules B dans ces patients sont devenues malignes et se développent incontrôlables. Étant donné que les cellules B malignes sont dérivées d'un seul clone, elles sont identiques et ne produisent qu'un seul type d'anticorps(c.-à-d.un anticorps monoclonal, ou mAb). Cependant, la plupart de ces cellules de myélome produisent des anticorps de spécificités inconnues. En 1975, en fusionnant une cellule de myélome en cellule B, Cesar Milstein et Georges Kohler ont réussi à produire un hybridoma qui peut être cultivé indéfiniment in vitro et produit un nombre illimité d'anticorps monoclonaux de spécificité antigénique connue (4). La raison d'être de leur approche est de combiner les propriétés immortelles de la cellule myélome et les propriétés productrices d'anticorps de la cellule B. Leur technique a révolutionné la production d'anticorps et fournit un puissant moyen d'identification et de purification des molécules biologiques à l'aide d'anticorps monoclonaux.
En général, la préparation d'un anticorps monoclonal nécessite plusieurs mois. La procédure générale comprend les étapes suivantes :
- Vaccination et dépistage du dispositif d'anticorps
- Fusion de cellules B productrices d'anticorps et de cellules myélomes
- Croissance sélective de l'hybridoma
- Dépistage des hybridomas pour la production de l'anticorps monoclonal souhaité
- Le clonage en limitant la dilution - un processus par lequel les cellules sont diluées à une concentration pour permettre statistiquement d'ajouter moins de 1 cellule aux puits d'une plaque de 96 puits. Certains puits se retrouveront avec 0 cellules et certains auront 1 cellule. Les puits avec ensedus avec 1 cellule finiront par se développer dans une population monoclonale de cellules.
- Croissance de l'hybridome et préparation des anticorps monoclonaux
Ce protocole se concentre sur la dernière étape - la croissance de l'hybridome et la préparation de l'anticorps monoclonal. L'anticorps est purifié du supernatant de culture par la précipitation de sulfate d'ammonium (souvent appelée salage) - une méthode couramment utilisée pour enlever des protéines d'une solution. Les protéines en solution forment des liaisons d'hydrogène, ainsi que d'autres interactions hydrophiles, avec l'eau à travers leurs groupes polaires et ioniques exposés. Lorsque des concentrations de petits ions très chargés (comme l'ammonium ou le sulfate) sont ajoutées, ces groupes rivalisent avec les protéines pour se lier à l'eau. Cela élimine les molécules d'eau de la protéine et diminue sa solubilité, ce qui entraîne des précipitations de la protéine.
Note: La technique de culture des cellules stériles doit être maintenue lors de la manipulation des cellules hybridome et des milieuis de manière stérile (p. ex., dans un cabinet de biosécurité) jusqu'aux étapes de purification des anticorps.
1. Dégeler les cellules hybrides congelées
- Incuber le flacon contenant les cellules d'hybridome congelées dans un bain d'eau à 37 oC jusqu'à ce qu'il soit juste décongelé (environ 2 minutes).
- Ajouter l
En utilisant ce protocole, nous avons obtenu les résultats suivants avec plusieurs hybridomas différents:
Hybridoma: RB6-BC5 (rat anti-souris Ly6C/Ly6G (Gr1) IgG2b, mAb)
OD280 - 1.103
(1.103/1.43) (20) 15,42 mg/mL
Hybridoma: GK1.5 (rat anti-souris CD4 IgG2b, mAb)
OD280 - 0,485
(0.485/1.43) (20) 6,78 mg/mL
La procédure décrite ci-dessus est un moyen simple et direct de purifier les anticorps monoclonaux de la culture hybridome supernatant. Il est important de se rappeler, cependant, que le sulfate d'ammonium précipitera d'autres protéines qui peuvent être dans le supernatant de culture. Par conséquent, les concentrations d'anticorps déterminées à partir des mesures d'absorption sont des estimations. L'utilisateur peut souhaiter évaluer la pureté de l'échantillon dialysé en exécutant une petite quantité sur u...
- Lipman NS, Jackson LR, Trudel LJ, Weis-Garcia F. Monoclonal versus polyclonal antibodies: distinguishing characteristics, applications, and information resources. ILAR Journal, 46 (3), 258-268 (2005).
- Arora S, Ayyar BV, O'Kennedy R. Affinity chromatography for antibody purification Methods Mol Biol. 1129, 497-516 (2014).
- Henry BJ. On a new substance occurring in the urine of a patient with mollities ossium. Philosophical Transactions of the Royal Society of London. 138, 55-62 (1848).
- Köhler G and Milstein C. Continuous cultures of fused cells secreting antibody of predefined specificity". Nature. 256, 495-497 (1975).
Passer à...
Vidéos de cette collection:

Now Playing
Génération d'anticorps monoclonaux à l'aide d'hybridomes
Immunology
42.7K Vues

Cytométrie en flux et tri cellulaire activé par fluorescence (FACS) : isolement des lymphocytes B spléniques
Immunology
91.5K Vues

Tri cellulaire magnétique (MACS) : isolement des lymphocytes T thymiques
Immunology
22.2K Vues

Tests ELISA : Indirect, en sandwich et par compétition
Immunology
233.3K Vues

Test ELISPOT : Détection des splénocytes sécrétants l'IFNgamma
Immunology
27.8K Vues

Immunohistochimie et immunocytochimie : Imagerie tissulaire par microscopie optique
Immunology
77.3K Vues

Microscopie à fluorescence : coloration par immunofluorescence des sections de tissus inclus en paraffine
Immunology
52.7K Vues

Microscopie confocale à fluorescence : une technique pour localiser les protéines dans les fibroblastes de souris
Immunology
42.4K Vues

Techniques basées sur l'immunoprécipitation : purification des protéines endogènes à l'aide de billes d'agarose
Immunology
86.8K Vues

Analyse du cycle cellulaire : utilisation de la coloration CFSE et de la cytométrie de flux pour évaluer la prolifération des lymphocytes T CD4 et CD8 après stimulation
Immunology
23.7K Vues

Transfert adoptif de cellules : introduction de splénocytes d'une souris donneuse vers une souris hôte et évaluation du taux de succès au FACS
Immunology
21.6K Vues

Test de mort cellulaire : libération du chromium pour mesurer la cytotoxicité
Immunology
151.1K Vues