A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
כימות אוטומטי של הקרינה סינפטית
In This Article
Summary
שפע של קולטני הנוירוטרנסמיטר אשכולות על סינפסות מאוד משפיע כוח סינפטי. שיטה זו מכמת קולטני הנוירוטרנסמיטר fluorescently שכותרתו בשלושה ממדים עם רזולוציה אחת סינפסה ב ג elegans, המאפשר מאות סינפסות להתאפיין במהירות ללא עיוותים הציג תחזית Z-המטוס בתוך מדגם אחד.
Abstract
עוצמת הסינפסה מתייחס משרעת של תגובות postsynaptic לאירועים presynaptic שחרור הנוירוטרנסמיטר, ויש לו השפעה משמעותית על התפקוד הכללי במעגל העצבי. עוצמת הסינפסה תלויה באופן קריטי שפע של קולטני הנוירוטרנסמיטר אשכולות באתרים הסינפטיים על קרום postsynaptic. רמות הקולטן מבוססים מבחינה התפתחותית, והוא יכול להשתנות על ידי הקולטן סחר בין בריכות קרקע מקומי, subsynaptic, ו תאיים, המייצגים מנגנונים חשובים של פלסטיות סינפטית neuromodulation ו. שיטות מחמירות לכמת synaptically-מקומי הקולטן שפע הנוירוטרנסמיטר חיוניים ללמוד פיתוח הפלסטיות הסינפטית ו. מיקרוסקופ פלואורסצנטי היא גישה אופטימלית, כי היא שומרת מידע מרחבי, להבדיל מ - סינפטי לא סינפטיים בריכות, ומפלה בין אוכלוסיות מקומיות הקולטן לסוגים שונים של סינפסות. אורגניזם גנטי מודל Caenorhabditis eleganזה מתאים במיוחד עבור אלה מחקרים בשל גודל קטן הפשטות היחסית של מערכת העצבים שלו, השקיפות שלו, ואת הזמינות של טכניקות גנטיות רבות עוצמה, ומאפשר בחינה של סינפסות דובר בבעלי חיים שלמים.
כאן אנו מציגים שיטה לכימות fluorescently שכותרתו קולטני הנוירוטרנסמיטר סינפטיים ב C. elegans. תכונת המפתח שלה הוא זיהוי וניתוח אוטומטי של סינפסות בודדות בשלושה ממדים רב המטוס confocal פלט קבצים מיקרוסקופ, מיקום tabulating, נפח, עוצמת הקרינה, וכן הקרינה הכוללת של כל סינפסה. גישה זו יש שני יתרונות עיקריים על פני ניתוח ידני של Z-המטוס תחזיות של נתונים confocal. ראשית, כי כל מטוס של סט נתונים confocal כלול, הנתונים לא הולכים לאיבוד דרך הקרנת Z-המטוס, המבוססת בדרך כלל על ממוצעים בעוצמה פיקסל או מקסימה. הזיהוי השני, של סינפסות היא אוטומטית, אבל יכול להיבדק על ידי לשעברperimenter עם התקדמות ניתוח נתונים, המאפשר מיצוי מהיר ומדויק של נתונים מתוך מספר רב של סינפסות. מאות עד אלפי סינפסות לפי המדגם יכול בקלות לקבל, ייצור ערכות נתונים גדולות, על מנת למקסם את כוח סטטיסטי. שיקולים להכנת ג elegans לניתוח, ולבצע הדמיה confocal כדי למזער את השונות בין בעלי חיים בתוך קבוצות הטיפול הם דנו גם. למרות שפותחה לנתח ג קולטנים elegans postsynaptic, שיטה זו היא בדרך כלל שימושית עבור כל סוג של חלבון synaptically, מקומית, או למעשה, כל אות הקרינה, כי הוא מקומי לאשכולות נפרדים, puncta או האברונים.
ההליך מתבצע בשלושה שלבים: 1) הכנת דוגמאות, 2) הדמיה confocal, ו 3) ניתוח התמונה. שלבים 1 ו -2 הן ספציפיות ג elegans, ואילו בשלב 3 הוא בדרך כלל החל על כל אות הקרינה punctate ב micrographs confocal.
Protocol
1. הכנת תולעים הדמיה
קטע זה של פרוטוקול מבוסס על פורסם C. טכניקות elegans תרבות 1,2, ו מתואר באיור 1.
- לגדל תולעים על צלחות peptone גבוהה NGM אגר (10 ס"מ) עם זרע NA22 א ' החיידק אשריכיה קולי עד כמעט גוועה ברעב. אם immunostaining, 1 צלחת יהיה אמין לייצר תולעים מספיק לאדם 1 כתם, תוך הפסדים בחשבון לאורך הדרך, וכן את אמות המידה המחמירות נהגו לבחור תולעים עבור דימות (ראה חלק 2).
- תולעים קציר ידי שפיכת מ"ל כמה DDH 2 0 לצלחת, מסתחררים לרגע, לשפוך נוזל לתוך צינור מ"ל 15 חרוטי (חוזר במידת הצורך להעביר את רוב התולעים אל הצינור). גלולה בצנטריפוגה קליני 3 דק ', ג'1000x. לשטוף גלולה 1-3x עם DDH 2 O עד supernatant ברור להסיר חיידקים שיורית. להשתמש ב 'העברה בטפי להחדרת נוזלים פוליפרופילן להסיר supernatants, כמו תולעים מקל זכוכית(למן שלב זה הוא קריטי כדי לצמצם את זמן בין הצעדים כדי למנוע הפסדים הכדאיות ביצה).
- לאחר הכביסה האחרון, resuspend תולעת גלולה בפתרון hypochlorite 5 מ"ל בסיסי כדי lyse תולעים וביצים שחרור. לטלטל בעדינות, ולבחון צינורות תחת מיקרוסקופ לנתח על אחת לדקה. כאשר כ - 50% של תולעים זה lysed (הם יופיעו כפופות שבר פתוח), לסיים תמוגה ידי מילוי צינור למעלה עם מאגר ביצה, מספר פעמים היפוך, ו pelleting במשך 3 דקות, גרם 1000x. זמן תמוגה לא יעלה על 5 דקות.
- הסר supernatant עם העברת פיפטה, ולשטוף גלולה 3x עם מאגר ביצה.
- להפריד ביצים מן ההריסות, צפים להם על כרית של סוכרוז 30% ב DDH 2 O: לאחר שטיפת הסופי משלב 1.4, להסיר בזהירות גלולה supernatant ו resuspend ב 5 מ"ל DDH 2 0. הוסף 5 מ"ל סוכרוז סטרילית 60% ב DDH 2 O, ומערבבים היטב. ספין בצנטריפוגה קליני 6 דק ', ג'1000x. הביצים יאספו את המניסקוס (הם האיש עכירות), בעוד הלכלוך גלולה.
- בעזרת פיפטה העברת פלסטיק, למצוץ את הביצים בהיקף מינימלי להעביר צלחות אגר unseeded NGM. ביצים כל דבקות בצד של הצינור ניתן לשטוף בעדינות והועברו גם כן. אחד 10 ס"מ unseeded צלחת לכל זן ניתחו מספיק.
- דגירה צלחות unseeded עם הביצים לילה (~ 16 שעות) ב 20 מעלות ג לפרוק את הצלחת על השעות הראשונות כדי לייבש אותו על ידי השארת את המכסה מעט לסירוגין במשך כמה שעות, אך הקפד לכסות לילה.
- לאחר הבקיעה, להעביר את הזחלים L1 לצינור קוני 15 מ"ל בסל S (Basal להוסיף לצלחת מ"ל S כמה, מערבולת, שופכים לתוך הצינור). גלולה בצנטריפוגה קליני (3 דק ', ג'1000x), resuspend בהיקף מינימלי של Basal S, והעברה NGM 10 ס"מ צלחות אגר שנזרעו עם NA22 חיידקים. השתמש 2 צלחות כאן כל צלחת המקורי משלב 1.1. דגירה עד תולעים מגיעים לגיל הרצוי.
- לפקח על תרבויות פעם או פעמיים ביום. אם הם נמצאים בסכנה OF רעב, להעביר NA22 צלחות חדשות. עבור wild-type תולעים N2, רעב מקדים להקמת הקו או גל של תולעים שזז על צלחת כמו בעלי חיים נודדים בהמוניהם מן המזון מדולדל אזורי. ברגע זה צורות, האוכל יהיה מדולדל לחלוטין בתוך מספר שעות.
- תולעים זה מוכן כעת immunostaining או הדמיה חיה. תיקון ו מכתים תולעים ההשעיה הוא אופטימלי, כי מספר רב של תולעים שלמים ניתן הדמיה בקלות. נהלים צביעה המבוססות על פיני ו Ruvkun פרוטוקול 3-6 עדיף להקפיא לפיצוח הליכים בשל מספר רב של תולעים יש צורך הדמיה.
2. Confocal הדמיה
- הר תולעים בשקופיות עבור הדמיה confocal. התאם את צפיפות התולעים כדי כמה מאות לכל microliter. לעשות בלוק agarose 2% ב-S הבסיס מוקף בטבעת דקה של וזלין כדי למנוע אידוי במהלך ההדמיה (מיושם באמצעות מזרק 3 מ"ל מצויד במחט 25 ניתוק מד). טפטפתמיקרוליטר של כמה ההשעיה תולעת על גבי תלוש כיסוי (שימוש בהרדמה אם תולעים חיות הדמיה), ולהפחית את הפנקס agarose על פתק את המכסה, להפיץ את התולעים באופן שווה על פני משטח.
- בחר תולעים עבור דימות. בחר שם תולעים הסינפסות של עניין מכוונים לכיוון העדשה אובייקטיבי, עם עקירה הרדיאלי של לא יותר מ ± 45 ° (כאשר 0 ° אומר מכוונת ישירות לכיוון המטרה). לבצע הערכה במהירות (כמה שניות), כדי למנוע photobleaching. בקנה מידה של התרבויות הראשוניות הוא מותאם על מנת להבטיח מספיק תולעים יספק קריטריונים אלה גיאומטריות.
- השלם את ההדמיה confocal של הדגימה. דגימות שטוח יחסית, כי אפשר להכיל בתוך כ 14 חלקים עבים 0.4 מיקרומטר לייצר את התוצאות הטובות ביותר. מהירות גבוהה, תמונות ברזולוציה נמוכה (512 x 512 פיקסלים) מספיקים איסוף נתונים מהיר ומדויק. הימנע להרוות את גלאי עם עוצמות אות מוגזמות, כמו זה יגרום הערכה נמוכה מדי של הקרינהאותות.
3. זיהוי וניתוח אוטומטי של אשכולות סינפטיים אישיות
- פתח רב TIF פלט קבצים באמצעות מיקרוסקופ confocal Volocity 4.0 (ומעלה) תוכנה (PerkinElmer).
- היבול משם אזורים של התמונה, כי אינם מכילים את המבנה של עניין (Image -> פוקוס מורחב -> אזור בחר עניין באמצעות הכלי "Freehand ההחזר על ההשקעה" -> פעולות -> חתוך הבחירה; 2A איור). , הערה פוקוס מורחב מייצרת השלכה Z-המטוס על מסך המחשב כדי לסייע בניתוח שלך, אבל לא משפיע על הנתונים המשמשים כבסיס, אותו הדבר נכון גם עבור התאמות הבהירות והניגודיות, במידת הצורך).
- מדוד את אורך האזור נותחו באמצעות כלי הקו. אורך הקו יהיה מחושב נוסף בטבלת הנתונים (איור 2 ב).
- זיהוי עצמים באמצעות 'אובייקטים לפי עוצמה "המסנן (מצב מדידות). ציון סף כזה אשכולות סינפטיים הםמודגש ולא סינפטית הרקע לא (איור 2 ג). הכללת סמן הסינפטי עצמאית שכותרתו עם צבע אחר יכול לעזור לזהות באופן חד משמעי סינפסות. סינפסות אופייניים נעים בין כמה מאות ל ווקסלים ספורות. הגדרת הסף פעם אחת באמצעות מדגם הבקרה, ולהשתמש בו עבור כל דגימות הבאות. Thresholding כל דגימה בנפרד אינו מתקבל על הדעת משום שהוא מציג את הפוטנציאל הטיה הניסוי. אובייקטים נבחרים נספר באופן אוטומטי (איור 2 ד).
- סדר ולייצא את הנתונים. לחסל את האובייקטים של 2 או פחות ווקסלים, שכן אלה הם בדרך כלל כתמים ברקע. אלה ניתן למנוע על ידי סינון נוספות, או במהלך ניתוח שלאחר מכן. כדי להקל על הזרם הוצאתם מחדש, למיין את קובץ הנתונים של "גודל האובייקט" אז הם קבוצה כל רצון יחד. לייצא את הנתונים בפורמט CSV, אשר ניתן לפתוח על ידי Microsoft Excel או בתוכניות גיליון אלקטרוני אחרות. כל תמונה יוצרת, בהיעדר.
- אם Volocity רכהכלי אינו זמין, שיטות חלופיות לניתוח Z-המטוס תחזיות של נתונים confocal עשוי להיות מנוצל (נ"צ למשל. 7, או ניתוח הוראות שימוש ImageJ), אם כי 3 מימדי מידע הולך לאיבוד (ראה דיון).
4. נציג תוצאות
שיטת כימות הציג אמור להיות מסוגל להבחין בין אוכלוסיות מצרר של בהירות שונה כרכים שונים. תמונות מייצגות ונתונים כמותיים המתאימים המוצגים באיור 3 להפגין דוגמאות של בידול על בסיס פרמטרים אלה. ככלל התוצאות צריך לעקוב אחרי מה בולט לעין. במקרה של הקולטן UNC-49 GABA immunostaining כבל עצב הגחון של C. elegans, כל בעלי החיים בדרך כלל נראה דומה מאוד בגודל בגרות, וסך ערכי הקרינה סינפטיים עבור קבוצה של חמש תולעים (מנורמל לאורך של חוט העצב ניתח) הראה שגיאת התקן ערכים של כ -10% של ממוצע 4. מוטציה גנטית טיפולים ניסיוניים אחרים (כגון: חשיפה לתרופה) עשוי לשנות לא רק את עוצמת הקול ערכי העוצמה הפצות בתדירות של אשכולות סינפטיים, אבל אולי ההתפתחות בזמן הקורס בתיאום של התולעים, המוביל שונות גבוהה יותר. עם זאת תוצאות כמותיות תמיד צריך לשקף מה יכול להיות מוערך באופן חזותי ואם לא, בדיקת התמונות והחפצים שזוהו על ידי Volocity תגלה היכן אירעה השגיאה ולהציע פעולה מתקנת כגון thresholding מחדש או הסרה של אובייקטים artefactual.

באיור 1. הכנת סינכרוני ג elegans תרבויות. תרבויות סינכרוני מתקבלים בהליך זה משום ג elegans מעצרים פיתוח בשלב הזחל L1 בהיעדר מזון, ממשיכה להתנהל, כאשר האוכל הוא הציג.
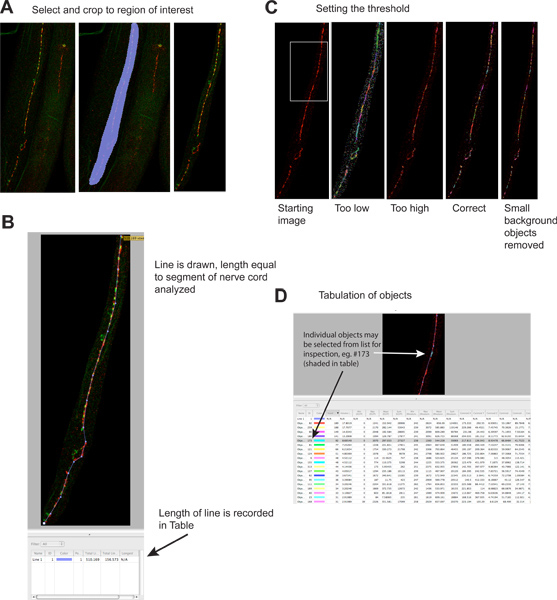
איור 2. לכמת את puncta הסינפטי.
- אזורים זרים של התמונה נחתכות כדי להפחית את גודל הקובץ ולהגדיל הספציפיות. לוח יד שמאל מראה מתחיל התמונה, באמצע הפאנל מראה האזור שנבחר, לוח הזכות מראה התמונה לאחר החיתוך. האות האדום הוא UNC-49 immunofluorescence GABA רצפטור, אות ירוק synaptobrevin-GFP (סמן presynaptic) הביע בנוירונים גאבא presynaptic 4. לחץ כאן כדי להציג דמות גדולה .
- קו מצויר אורך קטע העצב בחוט להיות מנותח, ואת אורכו נרשם באופן אוטומטי בטבלת התוצאות. מידע זה דרוש כדי לנרמל את הנתונים סינפטיים בשל אורכו של חוט העצב analyzable, אשר יכול להשתנות פי כמה וכמה אם תולעים להיות מקוטעת במשך מכתים.www.jove.com/files/ftp_upload/4090/4090fig2blarge.jpg "target =" _blank "> לחץ כאן כדי להציג דמות גדולה.
- סף מוחל לזהות אשכולות סינפטיים בודדים. הלוח השמאלי מציג את התמונה לפני thresholding, דוגמאות של רמות thresholding שונים מוצגים לוחות נפרדים (אות ירוק מושמט). כל אובייקט מזוהה מתואר על התמונה של אזור צבעוני. הערה התכתבות בין אשכולות סינפטיים שנרשמה חזותית בלוח השמאלי ביותר לבין אזורים צבעוניים על לוח העכבר הימני ביותר. לחץ כאן כדי להציג דמות גדולה .
- כל אובייקט מזוהה מופיע בנפרד בטבלת התוצאות. אובייקטים בודדים ניתן לבחור, ואת מודגשים על התמונה לבדיקה אם תרצה בכך. הערה טבלה המכילה מידע על אדום ("rhodamine ') וירוק (" EGFP') ערוצים: ערוץ מידע ירוק מטעה פוטנציאל מאז היו אובייקטיםזיהו מבוסס אך ורק על פלואורסצנטי אדום. ניתוח זה יכול להתבצע גם על תמונות צבע יחיד. לחץ כאן כדי להציג דמות גדולה .
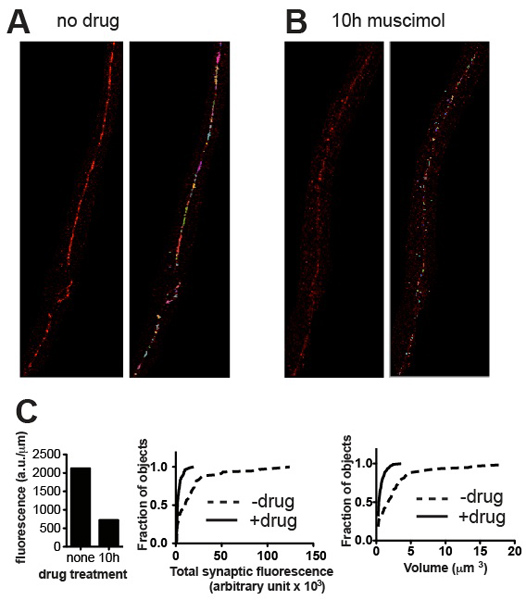
איור 3. נציג תוצאות. Micrographs נציג של wild-type C. elegans מוכתמים של UNC-49 עבור קולטני GABA לפני () ואחרי הטיפול (ב ') עם muscimol, אגוניסט קולטן GABA שגורם קולטנים להיות downregulated לאחר חשיפה ארוכה. לוחות להראות תמונות שנחתכו לפני (משמאל) ואחרי thresholding (מימין) הסרת כתמים רקע קטנים. (ג) מגרשים של פרמטרים כמותיים סינפטיים עבור דגימות המוצגים (א) ו - (ב): הקרינה הכוללת מנורמל לאורך העצב בחוט (משמאל) היסטוגרמות ההסתברות המצטברת של תוכן סינפסה הפרט הקרינה (באמצע) ואת עוצמת הסינפסה (RighT), הוכחת ירידה משמעותית סטטיסטית בתוכן נפח הסינפטי ו הנגרם על ידי חשיפה אגוניסט (n = 60 סינפסות עבור מטופלים, N = 115 סינפסות עבור muscimol שטופלו, p <0.001, קולמוגורוב סמירנוב, מבחן http://www.physics.csbsju .edu / סטטיסטיקות / KS-test.html ).
Discussion
השיטה המוצגת כאן נועדה לחלץ כמותיים רב פרמטרים הנתונים על אוכלוסיות גדולות של סינפסות ב C. elegans, תוך מיקסום עקביות בתוך קבוצות הטיפול. שלוש תכונות לתרום יעדים אלה. ראשית, immunostaining מבוצע על אוכלוסיות תולעת סינכרוני על מנת להבטיח כי כל בעלי החיים הם בני אותו גיל. שלב ?...
Disclosures
אין ניגוד עניינים הצהיר.
Acknowledgements
המחברים מודים א בנהם לסיוע בפיתוח של פרוטוקול. עבודה זו מומנה על ידי NIH מענק NS06747 אל באב
Materials
| Name | Company | Catalog Number | Comments | ||||||
| שם של התוכנה | חברה | הערות (לא חובה) | |||||||
| Volocity v4.0 ומעלה | PerkinElmer / Improvision | בדיקת הדמיה הליבה המקומי מתקן גישה לתוכנה זו. תוכנות הדגמה זמין בכתובת האינטרנט PerkinElmer. שיטה זו מחייבת רק את מודול לכמת את Volocity. | |||||||
| טבלה 2. חומרים כימיים ספציפיים וציוד. | |||||||||
| |||||||||
| טבלה 1. פתרונות. |
References
- Christensen, M. A primary culture system for functional analysis of C. elegans neurons and muscle cells. Neuron. 33, 503-514 (2002).
- Lewis, J. A., Fleming, J. T. Basic culture methods. Methods Cell Biol. 48, 3-29 (1995).
- Bettinger, J. C., Lee, K., Rougvie, A. E. Stage-specific accumulation of the terminal differentiation factor LIN-29 during Caenorhabditis elegans development. Development. 122, 2517-2527 (1996).
- Davis, K. M. Regulated lysosomal trafficking as a mechanism for regulating GABAA receptor abundance at synapses in Caenorhabditis elegans. Mol. Cell Neurosci. 44, 307-317 (2010).
- Finney, M., Ruvkun, G. The unc-86 gene product couples cell lineage and cell identity in C. elegans. Cell. 63, 895-905 (1990).
- Rowland, A. M. Presynaptic terminals independently regulate synaptic clustering and autophagy of GABAA receptors in Caenorhabditis elegans. J. Neurosci. 26, 1711-1720 (2006).
- Burbea, M. Ubiquitin and AP180 regulate the abundance of GLR-1 glutamate receptors at postsynaptic elements in C. elegans. Neuron. 35, 107-120 (2002).
- Miesenbock, G., De Angelis, D. A., Rothman, J. E. Visualizing secretion and synaptic transmission with pH-sensitive green fluorescent proteins. Nature. 394, 192-195 (1998).
- Oda, S., Tomioka, M., Iino, Y. Neuronal plasticity regulated by the insulin-like signaling pathway underlies salt chemotaxis learning in Caenorhabditis elegans. J. Neurophysiol. 106, 301-308 (2011).
- Sankaranarayanan, S. The use of pHluorins for optical measurements of presynaptic activity. Biophys. J. 79, 2199-2208 (2000).
- McDonald, N. A. Generation and functional characterization of fluorescent, N-terminally tagged CB1 receptor chimeras for live-cell imaging. Mol. Cell Neurosci. 35, 237-248 (2007).
- Shakiryanova, D. Synaptic neuropeptide release induced by octopamine without Ca2+ entry into the nerve terminal. Proc. Natl. Acad. Sci. U. S. A. 108, 4477-4481 (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved