Method Article
בחיי עיר ובחינת המתאם של צפיפות התאים ואת פליטת אור של חיידקים זוהרים
In This Article
Summary
חיידקים זוהרים לווסת ייצור אור באמצעות מגוון רחב של מנגנונים, כגון חישת צפיפות. שיטה חדשנית זו מאפשרת החקירה ב באתרו של ביולומינסנציה הקורלציה של פליטת אור לדחיסות התא. מייצרים אור מלאכותי Escherichia coli מערכת מאפשרת אפיון lux operons, לאקס חלבונים והגומלין שלהם.
Abstract
יש מספר ניכר של חיידקים שמסוגל לפלוט אור. כולם חולקים האשכול גנטי זהה, כלומר אופרון לאקס . למרות הדמיון הזה, חיידקים אלו מראים קיצוניים מאפיינים כמו התנהגות גדילה, האינטנסיביות של פליטת אור או ויסות ביולומינסנציה. השיטה המוצגת כאן היא assay פיתח המשלב הקלטה של צמיחת תאים ועוצמת פליטת אור זוהרים לאורך זמן ניצול קורא צלחת. הצמיחה וכתוצאה מכך ואת פליטת אור מאפיינים יכולים להיות מקושרים לתכונות חשובות של המתח חיידקי המתאימים, כגון חישת רגולציה. הטיפוח של מגוון רחב של חיידקים זוהרים דורש מדיום מסוים (למשל, מים ים מלאכותי בינוני), שהוגדרו טמפרטורות. קל לטפל, תקן-מחקר שאינם מייצרים אור החיידק Escherichia coli (e. coli), מצד שני, יכול להיות מעובדות בזול בכמויות גבוהות בקנה מידה מעבדה. ניצול e. coli על ידי החדרת של פלסמיד המכיל את כל לאקס אופרון יכולים לפשט את תנאי הניסוי, בנוסף ונפתח אפשרויות רבות עבור יישומים עתידיים. הביטוי של כל הגנים לאקס ניצול זן בביטוי e. coli הושגה על ידי בניית פלסמיד ביטוי דרך גיבסון שיבוט והוספה של ארבעה קטעים המכיל שבעה גנים לאקס , שלוש צלעות הגנים של אופרון לאקס-צלעות לתוך וקטור pET28a. E. coli המבוסס על ביטוי גנים לאקס המושרה ונשלט באמצעות תוספת איזופרופיל-β-D-thiogalactopyranosid (IPTG) וכתוצאה מכך ביולומנאסן e. coli תאים. היתרונות של מערכת זו הם כדי למנוע חישת מגבלות רגולציה ויצירות בינוני מורכבים יחד עם תנאי הגידול לא סטנדרטיות, כגון שהוגדרו טמפרטורות. מערכת זו מאפשרת ניתוח של לאקס גנים והגומלין שלהם, על ידי הכללת הגן בהתאמה מ אופרון לאקס , או אפילו תוספת של הרומן גנים, מחליפים את הגנים luxAB של זן חיידקי אחד במשנהו, או ניתוח מתחמי חלבון, כגון luxCDE.
Introduction
פליטת האור על ידי אורגניזמים (ביולומינסנציה) הוא תהליך מרתק נמצאו חיידקים, פטריות, חרקים, נמטודות, דגים ופירות דיונונים1. פליטת אור זוהרים מגיח לתגובה chemiluminescent שבו אנרגיה כימית (חלקית) הופכת אנרגיית האור ("אור קר"). בחיידקים זוהרים, מזרז לוציפראז אנזים heterodimeric את monooxygenation של שרשרת ארוכה, aldehydes אליפטיות, כגון tetradecanal, כדי חומצות התואם את בליווי פליטת אור עם מקסימום-490 nm2, 3.
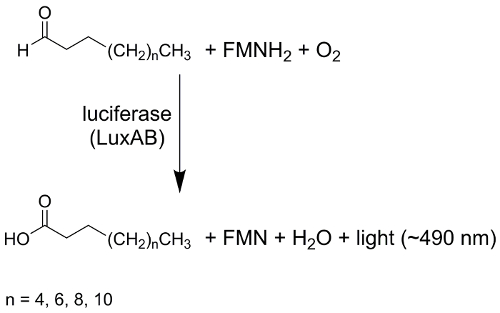
איור 1 : תגובה כללית בסכמה לוציפראז חיידקי. חיידקי לוציפראז (LuxAB) מזרז את monooxygenation של שרשרת ארוכה aldehydes (CH3(CH2)nצ'ו) על-ידי ניצול מופחתת פלווין mononucleotide (FMNH2), חמצן מולקולרי (O2), מניב את המוצרים זמן שרשרת חומצות (CH3(CH2)nCOOH), פלווין mononucleotide (FMN), מים (H2O), את פליטת האור מרוכז 490 nm. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
האנרגיה שפורסמו במהלך חמצון זה גורם של עירור FMN-4a-הידרוקסיד, אשר משמש האור emitting luciferin4. החלבונים המעורבים ביולומינסנציה חיידקים, כלומר LuxCDABEG, מקודדות על ידי אופרון לאקס , מאוד נשמרים על זני חיידקים שונים2,5. הגנים luxA ו- luxB קידוד עבור לוציפראז heterodimeric; מוצרי גן של luxC של luxD, של לוקס הם מרכיבים של רדוקטאז חומצת שומן מורכבות; luxG מקודד עבור רדוקטאז פלווין6. מספר של ביולומנאסן Photobacteria (e.g.,Photobacterium mandapamensis 27561) נושאים את הגן נוספים luxF . דווח כי LuxF הוא חלבון homodimeric המאגד פלווין יוצא דופן נגזרת 6-(3'-(R)-myristyl)-FMN (myrFMN)7,8,9,10,11 ,12. גנים נוספים זוהו שהיו אחראים הריבופלאווין סינתזה (למשל, ribEBH), יתר על כן הרגולטורי הגנים דווח, כי תפקיד בוויסות חישה quorum של ביולומינסנציה, במיוחד עבור ויבריו פישרי ויבריו harveyi6,13. למרות סדר מאוד שנשמרת ג'ין, חיידקים זוהרים להראות וריאציות גבוהה במאפיינים כמו התנהגות גדילה, האינטנסיביות של פליטת אור, או ויסות ביולומינסנציה2,5,14 .
מספר זנים או פלסמידים המכיל חלקי או שלם lux operons ידועים, ניצול ביולומינסנציה כמערכות הכתב. יישומים שונים כגון קביעת מקדם פעילות, ניטור של חיידקי מציג בסביבת או דוגמאות מזון, ביולומינסנציה תהודה אנרגיה העברה (ברט), ויוו הדמיה של זיהומים היצורים האיקריוטים. pyrosequencing וכדומה היו הוקמה15,16,17. מעניין, שלושת תכוף כתב ביולומנאסן מערכות נגזרות של גחלילית בצפון אמריקה (Photinus pyralis) את הפתוגן המעית של נמטודות (Photorhabdus luminescens), אמנון ותמר ים (Renilla reniformis). אף אחד מערכות אלה ממקור חיידקי, אך השימוש לאקס גנים operons ממוצא חיידקי הוא צובר יותר עניין של מחקר יישומי16. היישום פחות בשפע של ביולומינסנציה חלבונים ממקורות חיידקי בעיקר עקב יציבות נמוכה יותר, תוחלת החיים של חיידקים נגזר חלבונים זורח, אשר יכול להיות קשור שלהם בתי גידול ימיים. חיידקים זוהרים של בתי גידול ימיים אינן cultivable תחת תנאי מעבדה סטנדרטיים. חיידקים אלו דורשות תקשורת צמיחה ספציפיים, תנאים, כגון טמפרטורות נמוכות ובינוניות צמיחה/דגירה מים ים מלאכותי (למשל, 28 ° C).
כדי לפשט את ההשוואה של לאקס אופרון מאפיינים או יחיד לאקס גנים של מגוון זני חיידקים שונים מייצרים אור, שיטה לתקנן את הביטוי אופרון לאקס וניתוח הוא תנאי הכרחי. לפיכך, הופיע הרעיון של שילוב של אופרון כל לאקס-צלעות החיידק תקן-מחקר Escherichia coli (e. coli). לענין זה, גיבסון הרכבה הוכיחה להיות כלי שימושי כדי לשלב מספר קטעים ליניארי, חופפים וקטור ביטוי אחד ללא צורך אתרי הגבלה ספציפית. שיטה זו מתאימה גם כשאתה מוסיף DNA גדולים מדי (e.g.,P. mandapamensis 27561 luxCDABFEG-ribEBH; ~ 9 kb אופרון גודל) הגברה באמצעות PCR. אופרון לאקס ניתן להפריד קטעים חופפים מרובים ולאחר מכן הניתנים להרכבה לתוך פלסמיד ביטוי אחד ונבדקה סוף סוף הרצף הרכבה המוצר יכול להיהפך ישירות לתוך המתאים e. coli מערכת עבור תשואה גבוהה חלבון ביטוי18,19,20. בנוסף קל לטפל e. coli המבוסס על ביטוי גנים לאקס , שיטה פשוטה המשלב הקלטה של צמיחת תאים, פליטת אור זוהרים נשארו שתוקם. השיטה המתוארת כאן מאפשר מדידה ב באתרו של צפיפות התאים והן פליטת אור של חיידקים זוהרים.
הניתוח של גנים לאקס לאקס אופרון וסדר. רגולציה של חיידקים שונים מייצרים אור עם, מצד אחד, מייצרים אור מלאכותי e. coli מערכת המכילה את אופרון כל לאקס-צלעות של פ mandapamensis יד 27561, מצד שני, וזמינותו קורא צלחת פיתח המשלב את ההקלטה בבאתרו של צפיפות התאים, פליטת אור, עוזר כדי לקבל מידע נוסף אודות חיידקי לאקס המערכות השונות. השוואה של luciferases ואנזימים הקשורים ואפיון היסוד הזה עלול להוביל חלופות למערכות כתב כבר הוקמה עם יציבות משופרת ופעילות.
Protocol
1. עיצוב, הכנה, ומביע לאקס אופרון ב- Escherichia coli
הערה: ראה טבלה של חומרים למידע על קיטים מסחריים להשתמש בסעיף זה.
- לצורך העברת את אופרון לאקס לתוך החיידק לבחור וקטור מחמד סטנדרטי עם הגבלה מתאימה לאתרים של עמידות לאנטיביוטיקה ג'ין עניין (למשל, pET28a; NcoI, XhoI, kanamycin).
- עיצוב השברים, חופפים תחל להרכבה גיבסון, המבוססת על רצף הדנ א של Photobacterium mandapamensis 27561 (GenBank: DQ988878.2).
- להגדיר תגובה PCR סטנדרטי עם תחל את תוכנן, ה-DNA גנומי מבודד של Photobacterium mandapamensis 27561 כתבנית (ראה חומר משלים תחל ותנאים).
הערה: בידוד של דנ א גנומי של המתח חיידקי המתאימים מגבירה יעילות ה-PCR. - לטהר המוצר PCR דרך ספין עמודות טיהור.
- ביצוע של עיכול הגבלה של וקטור pET28a מבודדים עם NcoI ו XhoI ב 37 מעלות צלזיוס למשך 45 דקות.
- לטהר את הווקטור ליניארית, שברי PCR ויה agarose ג'ל אלקטרופורזה וטיהור ספין עמודות עוקבות.
- לקבוע את ריכוז הדנ א של כל שבר, הווקטור ליניארית, לחשב הכמויות של האופטימלית עבור ההרכבה על פי פרוטוקול20,21.
הערה: היעילות של הרכבה תלוי פרגמנט הגודל והמספר, חייב להיות מותאם על פי היצרן פרוטוקול20,21. - לאחר שילוב כל שברי המאגר בצינור PCR, דגירה התערובת ההרכבה במכונה PCR ב 50 מעלות לשעה.
- להפוך את המוצר וקטור שהורכב על פי פרוטוקולים סטנדרטיים טרנספורמציה עבור פלסמיד חיידקי e. coli הסתדרותי המתאים e. coli מערכת לשכפול פלסמיד תשואה גבוהה (למשל, e. coli TOP10 או XL-1).
- לבחור מושבות מן הצלחת השינוי פס על לוחיות הרישוי עבור בידוד של דנ א.
- לבודד דנ א פלסמיד לפי פרוטוקולים סטנדרטיים.
- כדי לוודא הרכבה נכונה של פלסמיד כולל כל חלקי, תחילה לבצע מושבה PCR על פי פרוטוקולים סטנדרטיים באמצעות תחל ספציפיים עבור כל קטע התאספו.
- בנוסף המושבה PCR ו agarose הבאים בג'ל, להכין כל כיווני ההרכבה המבודד עבור רצפי DNA לוודא הרכבה נכונה של רצפי דנ א נכונה.
- להפוך את פלסמיד מאומת על פי פרוטוקולים סטנדרטיים טרנספורמציה עבור פלסמיד חיידקי e. coli הסתדרותי המתאים e. coli מערכת לייצור חלבון תשואה גבוהה (e.g.,E-קולי BL21).
הערה: להמשיך ישירות עם ביטוי בפרוטוקול להלן. לאחסון ארוך יותר, מומלץ הכנת מלאי גליצרול.
2. הביטוי של זנים ששונה e. coli
- להכין תרבות לילה (שוב) לביטוי על ידי חיסון של אמצעי אחסון המתאים של מדיום ליברות (למשל, 100 מ ל) עם המניה גליצרול בעבר מוכן של התאים e. coli BL21 הפך את פלסמיד שהורכב או ישירות צלחת טרנספורמציה. להוסיף 100 µL של kanamycin (50 מ"ג/מ"ל; גן עמידות לאנטיביוטיקה של pET28a), דגירה. סרטן שעומדים של 37 ° C ו 120 סל ד ב שייקר אינקובטור בן לילה.
- לחסן התרבות הביטוי העיקרי (למשל, 800 מיליליטר בינוני ליברות) עם 8 מ ל סרטן שעומדים ולהוסיף µL 800 של kanamycin (50 מ"ג/מ"ל).
- דגירה התרבות המרכזית ב 37 ° C ו 120 סל ד ב שייקר אינקובטור עד צפיפות התא מגיע עם יתר600 של 0.6 - 0.8 (כ- 2.5 שעות).
- לצמצם את הטמפרטורה הדגירה 28 ° C.
- זירוז ביטוי חלבונים על-ידי הוספת IPTG ריכוז סופי של 0.1 מ מ.
הערה: מבחנים אמפיריים הראו כי ההפחתה של הטמפרטורה 28 ° C נתן עוצמת האור הגבוה ביותר. - להתבונן תאים עד שהם מתחילים זוהר (כ ג 1).
הערה: בהתאם למטרת הביטוי, התאים גדלים עד למחרת, נקצרים מכן, או התאים יכולים להיות כל הזמן רועד כל עוד הם דולקים (מקסימום 48 שעות). קציר את התאים ואת טיהור של כל החלבונים יכול להיעשות על-פי נהלי.
3. הבעה של זני חיידקים זוהרים
הערה: זני חיידקים זוהרים לדרוש צמיחה ספציפיים בינוני/מלאכותי ים מים בינונית עבור גידול והפקה אור.
- להכין בינוני מים ים מלאכותי, מורכב משני הרכיבים בינוני מוכן בנפרד.
הערה: הכנת המדיום מים ים מלאכותי הותאמה מן הפרוטוקול המקורי22. הסיכומים שלהלן מיועדות בינוני נוזלי 1 ליטר או 1 ליטר אגר בינוני.- ים מלאכותי מים בינוני, שוקלים המלחים הבאים: 28.13 g NaCl, 0.77 גרם אשלגן כלורי, 1.60 g CaCl2 · 2H2O. 4.80 g MgCl2 · 6-אייץ '-2O, 0.11 g NaHCO3ו- 3.50 g MgSO4 · 7 שעות2O.
- להוסיף 1 ליטר של מים מזוקקים, לפזר את כל הרכיבים.
- LB בינוני, שוקלים את המרכיבים הבאים: תמצית שמרים 10 גרם, 10 גרם peptone, ועבור לוחות אגר אגר 20 גרם נוספים.
- להוסיף 250 מ של מי ברז, להמיס רכיבים.
- אוטוקלב שניהם מוכן מדיה בנפרד ב 121 מעלות צלזיוס למשך 20 דקות.
- עבור לוחות אגר, לשלב 250 מ ל LB בינוני עם 750 מ של מדיום מים ים מלאכותי ישירות לאחר autoclaving והכן צלחות.
- בינוני נוזלי, לשלב 250 מ ל LB בינוני עם 750 מ של מדיום מים ים מלאכותי ישירות לאחר autoclaving, או התקררה.
הערה: המדיום מים ים מלאכותי עשוי לקבל עכורים דרך משקעים מלח.
- צובעות את זני חיידקים זוהרים על צלחות בינוני אגר מים ים מלאכותי, דגירה בין לילה ב 24-30 º C.
הערה: זמן האחסנה של זני חיידקים מושגת בדרך כלל באמצעות הקפאת גליצרול מניות של התרבות חיידקי. זנים צריך תמיד להיות רץ בעירום על פלטות אגר קודם כדי להבטיח תנאי התחלה אחיד עבור כל זנים, לפני השימוש עבור תרבויות נוזלי, עקב שלב פיגור בצמיחה לאחר מפשיר. - הכן של סרטן שעומדים על ידי מזריקים 100 מ ל ים מלאכותי מים בינונית עם מושבה בודדת מהצלחת. דגירה על. סרטן שעומדים ב 24-30 מעלות צלזיוס ו 120 סל ד ב שייקר אינקובטור בן לילה.
- לחסן 800 מיליליטר ים מלאכותי מים בינונית עם 8 מ של עוד.
- דגירה של תאים חיידקיים ב 24-30 מעלות צלזיוס ו 120 סל ד ב שייקר אינקובטור.
הערה: הפרופיל עוצמת האור של חיידקים זוהרים משתנה בחום עם הטמפרטורה. בהתאם מנגנוני הרגולציה של הפקת אור המתח חיידקי בהתאמה, פליטת אור עשוי להתחיל לאחר כ- 1-6 h. - להתבונן תרבית תאים חיידקיים עד שהם מתחילים זוהר (כ ג 1-6).
הערה: בהתאם למטרת הביטוי, התאים גדלים עד למחרת, נקצרים מכן, או התאים יכולים להיות כל הזמן רועד כל עוד הם דולקים. קציר את התאים ואת טיהור של כל החלבונים יכול להיעשות על-פי נהלי.
4. in Vivo פעילות וזמינותו של זני חיידקים זוהרים וללחצים ששונה e. coli
הערה: זמן האחסון של זנים הוא בדרך כלל acieved באמצעות הקפאת גליצרול מניות של התרבות חיידקי. זנים צריך תמיד להיות רץ בעירום על פלטות אגר קודם כדי להבטיח תנאי התחלה אחיד עבור כל זנים, לפני השימוש עבור תרבויות נוזלי, עקב שלב פיגור בצמיחה לאחר מפשיר.
- פס המתח חיידקים זוהרים הרצוי או ששונה e. coli מסננים על צלחת אגר, דגירה-28 מעלות צלזיוס למשך הלילה.
הערה: הטמפרטורה הדגירה יכולה להשתנות זן זן ויש לו להערכה מדעית. כדי להיות היכולת להשוות בין זני חיידקים זוהרים, ששונה e. coli זנים, תנאי הגידול צריך להיות זהה. - לחסן 3 מ"ל של מדיום עם המתח בהתאמה עם מושבה בודדת מתוך צלחת אגר, דגירה התאים-28 ° C ו- 180 סל ד ב שייקר אינקובטור עבור 1-2 h.
- למדוד צפיפות תא 1:10 דילול של התרבות נוזלי-650 ננומטר. לחשב את יחס נפח לתרבות 1 מ"ל עם יתר650 של 0.05.
הערה: וזמינותו קורא צלחת הבאים יקבעו את צפיפות התאים-650 nm כדי למנוע הפרעה על ידי פליטת אור של הזנים. - Pipette הנפח מחושב של תרבות, בינוני לתוך צלחת עם קירות שחור 24-ובכן עם קרקעית זכוכית. עבור ששונה e. coli זן, להוסיף 1 µL של kanamycin (עמידות לאנטיביוטיקה של וקטור pET28a) µL 1 של IPTG (אינדוקציה של ביטוי גנים) הדגימות. במקום מכסה על הלוח כדי למנוע התאיידות במהלך המדידות.
הערה: כדי להבטיח כי וקטור pET28a המכיל את אופרון כל לאקס לא ללכת לאיבוד על ידי התרבות e. coli , kanamycin להתווסף כל מדגם e. coli ב הבארות צלחת ולהבטיח את הפקת האור e. coli התאים ניתן למדוד, בביטוי הגן חייב להיגרם על ידי IPTG. כדי למנוע הפרעה crosstalk ומדידה, עם קירות שחור צלחות היטב עם רצפת הזכוכית, מכסה שקוף הראו התוצאות הטובות ביותר. למרות זאת, יכול להיות שנצפו crosstalk ויש עמדות טוב להיבחר בקפידה. - להתחיל את המדידה קורא צלחת.
הערה: פרוטוקול קורא צלחת מבוסס על תסריט שפותחה במיוחד עבור זה assay (ראה חומר משלים) המשלבת שתי מדידות, ספיגת ביולומינסנציה. נקודות נתונים נאספים כל 10 דקות ברעידות קבוע בין המדידות על טמפרטורה קבועה של 28 מעלות צלזיוס.
תוצאות
ג'ין מסדר אופרון לאקס - luxCDABFEG - מאוד כולו על זנים שונים2,5,14. על עיצוב האתר של פלסמיד, המידע רצף נלקח המתח חיידקים זוהרים Photobacterium mandapamensis 27561 סדר ג'ין היה כל הזמן אותו דבר ו, גם, נחשבו רצפים noncoding בין גנים יחיד. מבט סכמטי של האסטרטגיה שיבוט יישומית גיבסון מתוארת באיור2. ארבעה קטעים סה כ, luxCDAB, luxF, luxEG, ribEBH, עם זוג בסיסים 20-40 חפיפה רצפים נוצרו. לאחר ביצוע כל השלבים מתוך מכלול גיבסון20, רצפי DNA אישר הרכבה נכונה של פלסמיד, כולל כל חלקי. המפה וקטור של pET28a מוצר ההרכבה הסופית המכיל את אופרון לאקס-צלעות מתואר באיור3. יתרון משמעותי של וקטור שונה pET28a הזה הוא הניצול של סטנדרטית תנאי הגידול של e. coli ומבוקר אינדוקציה עם IPTG.
כדי למדוד את פליטת אור של חיידקים זוהרים, צפיפות תא בהתאמה, פותחה שיטה קורא המבוסס על צלחת. השיטה עבור הקורא צלחת נוצר שילוב של קבצי script של מדידה אחת עבור עוצמת ותא צפיפות נמוכה. קובץ script זה הרומן מופעלת מדידת OD650 ומוגדר עוצמת האור בכל 10 דקות עבור משתמש מסגרת זמן, חייב להיות מותאם לזמן הדור של החיידקים המשמשים לניתוח המתאימים (למשל, 10 h). מידת הצפיפות האופטית בוצעה ב 650 nm כדי למנוע הפרעה פליטת אור. מהווה הוכחה של המושג, כדי להבטיח הבריאות והתנהגות נכונה צמיחה של התאים e. coli , בוצעו מדידות הפניה. איור 4 ההשוואה של e. coli BL21 תאים, e. coli BL21 תאים המכילים וקטור pET28a ריק ו- e. coli BL21 תאים המכילים את הווקטור pET28a עם אופרון לאקס-צלעות הוספה מוצגים. לזן של האחרון, אין IPTG נוספה כדי לנתח את פליטת אור בשל leakiness של האמרגן T7. כל שלוש מדידות הפניה להראות עקומת גדילה sigmoidal עם שלושה שלבי גידול (לג, מעריכי, נייח-שלב). רק e. coli BL21 התאים המכילים את הווקטור pET28a עם לאקס-צלעות אופרון הוספה ההתחלה פולטים אור, אך בניגוד המדידות בו ביטוי הנגרמת על ידי תוספת של IPTG ואור נפלטת לאחר 30 דקות, התאים הלא-induced רק מתחילים לזרוח לאחר כ 5 שעות ולהראות של פליטת אור נמוכה יותר (ca. 4-fold) בהשוואה למערכת המושרה.
איור 5 נותן השוואה של עקומות גדילה ועוצמות אור של אופרון לאקס הביע ב e. coli ו המתח חיידקים זוהרים mandapamensis פ 27561, ליברות מדיום או מדיום מים ים מלאכותי, באמצעות הרומן הוקמה ב באתרו בשיטה. כדי להשוות בין חיידקים אלה, המדידות בוצעו בטמפרטורת דגירה של 28 מעלות צלזיוס. הזה יורדת הטמפרטורה קצב הגידול ששונה e. coli זן LB בינוני כמו גם ים מלאכותי מים בינונית, אך טמפרטורות נמוכות יותר זני חיידקים זוהרים מכריעים תלות טמפרטורה זו מוצגת ב איור 5א, כפי mandapamensis פ 27561 מציגה את צפיפות התאים הרבה יותר גבוה מ- e. coli. יתר על כן, בעוד עבור זנים e. coli , בינוני LB מאפשר הדור של צפיפויות תא גבוה יותר, עבור זני חיידקים מייצרים אור טבעי, מלאכותי ים מים בינונית הוא מועדף וחיוני לתהליך הביולומינציה. תא מוקלטות הצפיפויות לתאם עם עוצמות אור בהתאמה, כמוצג באיור 5ב'. ראוי לציין, זוהרים e. coli בתאי להישג דומה אור פליטה maxima במדיום מים לים בינוני, כמו גם מלאכותית שתי ליברות, למרות עוצמות הגבוהים ביותר נרשמו בנקודות זמן שונות. בניגוד התבוננות זו, mandapamensis פ 27561 קיימא עם שיעורי צמיחה גבוהה מופחתת LB בינוני, אבל התאים חיידקי פולט אור כל (איור 5B). במדיום מים ים מלאכותי, פ mandapamensis 27561 מראה מקסימום של פליטת אור-בסביבות 1 x 10 ספירות4 לשניה, הוא כמעט גורם של 200 נמוך מ e. coli. איור 5 C מייצג יחסית יחידות אור איפה ביולומינסנציה מנורמל מאת OD. תוצאות אלו לאשר כי לא רק הייתה החדרת פלסמיד המכיל את אופרון לאקס לתוך החיידק מוצלחת ופונקציונליים, אלא גם כי זה שונה e. coli זן היא אלטרנטיבה חוקית עם פליטת אור גבוהה יותר התשואות ללא המגבלה של חיידקי ביולומינסנציה של מרינה חיידקים, כגון מי-ים המורכבים טמפרטורות נמוכות ובינוניות.
בנוסף, בוצעה מדידה ארוכת טווח e. coli מבוסס לאקס-צלעות גנים מעל 24 שעות כדי לנתח את תוחלת החיים של פליטת אור (איור 6). פליטת אור נמשכה 19.5 h, הרבה יותר זמן מאשר זני חיידקים (למשל, פ mandapamensis 27561) שבו ירידה הדרגתית נצפתה וכתוצאה מכך פליטת אור נמוך מאוד לאחר 10 h.
כדי להמחיש את המגבלות של וזמינותו מפותחת, איור 7 מראה את תוצאות המדידה של שלושת זני חיידקים זוהרים, כלומר S1 Photobacterium mandapamensis , Photobacterium mandapamensis TH1 ו ויבריו harveyi 14126. על המתח הראשון (S1), השיטה עובד טוב מאוד ומראה של עוצמת ביולומינסנציה מקסימלי של כמעט 2 x 106. עבור השני שני זנים (TH1 ו 14126), לא ניתן לקבוע את עוצמת האור מקסימלי כיוון עוצמת האור שנוצר על ידי שני חרג ממגבלת זיהוי של הגדרות מכשיר משומש. הערך רווח שהוגדרו עבור שיטת מפותחת (סקריפט) עבור שני זנים אלה נקבע גבוה מדי. למרות זאת, ניתן להשוות את התחלתה של פעילות ביולומינסנציה אחד עם השני. Mandapamensis פ TH1 ו- S1 mandapamensis פ להתחיל זוהר ואחרי כ 1 h ערך650 OD של 0.1 - 0.2, בהתאמה. לעומת זאת, נ' harveyi 14126 מתחיל לפלוט אור לאחר כ- 5.5 h-ערך650 OD של 1.0. תחילת שנצפה פליטת אור מלווה גידול מעריכי OD, כמו גם ביולומינסנציה. ידוע כי ביולומינסנציה של harveyi (פ') 14126 ביסוד חישת בתקנה, ולכן ספציפי תא צפיפות המאפשר הפעלת אופרון לאקס , אשר יכול להיות שנצפו בבירור איור 713. תוצאה זו ממחישה כי עם הרומן זה בחיי עיר צלחת קורא assay שאפשר בקלות להשוות חיידקים זוהרים ולהגדיר גם בערך מנגנון רגולטורי זנים אלה על-ידי קביעת אם חישת תקנה ניתן נצפתה או לא.
איור 8 מראה דוגמה של תרבות ביטוי של e. coli BL21 כדוריות מסתירים את פלסמיד pET28a מורכבים המכילים את אופרון לאקס לאחר אינדוקציה עם IPTG. לאחר כ אחד h לאחר אינדוקציה, להתחיל התאים e. coli זוהר בצבע כחול-ירוק. איור 8 א הצגת ביטוי e. coli תרבות צולם באור, איור 8ב' נותן התרבות אותו בחושך. איור 8 C מתארת צלחת אגר ים מלאכותי בינוני מים עם S1 mandapamensis פ זוהרים בחושך האופייניות ביותר של כחול-ירוק צבע זהה לתהליך הביולומינציה חיידקי.
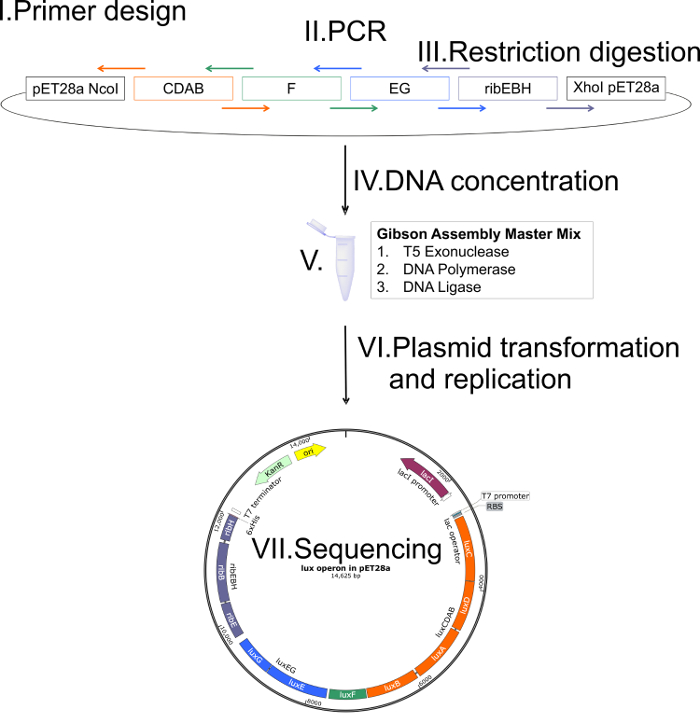
איור 2 : ייצוג סכמטי של גיבסון שהוחלו שיבוט אסטרטגיה. שלב (I): Overlapping תחל (חיצים צבעוניים; ca. זוג בסיסים 20-40 חופפים) מתוכננות. תחל חופפים מכילים רצפי מחזק המורכב של אזור 5' ו 3' בהתאמה של קטע אחד ובאזור המתאימים 3' ו 5' מקטע הסמוך. שלב (II): השברים מעוצב להרכבה נוצרים באמצעות תגובות PCR סטנדרטי. שלב (III): וקטור למטרה זו לליניארית מאת עיכול הגבלה (למשל, NcoI, XhoI). שלב (IV): ה-DNA ריכוזי כל שברי הווקטור ליניארית צריך להיות נחוש להתאים את הריכוז המתאים להרכבה גיבסון (על פי הפרוטוקול של היצרן). שלב (V): כל שברי הווקטור ליניארית עם ריכוזים DNA ממוטבת משולבים עם גיבסון הרכבה מאסטר המיקס (T5 אקסונוקלאז, ה-DNA פולימראז ו DNA ליגאז) ואת מודגרת ב 50 מעלות צלזיוס במשך ה 1 שלב (VI): המוצר הרכבה עובר טרנספורמציה על פי פרוטוקולים סטנדרטיים לתוך המתאים e. coli זן לשכפול פלסמיד תשואה גבוהה (למשל, e. coli TOP10 או XL-1). שלב (VII): כדי לוודא הרכבה נכונה של פלסמיד, רצפי DNA של פלסמיד שהורכב חייב להתבצע. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
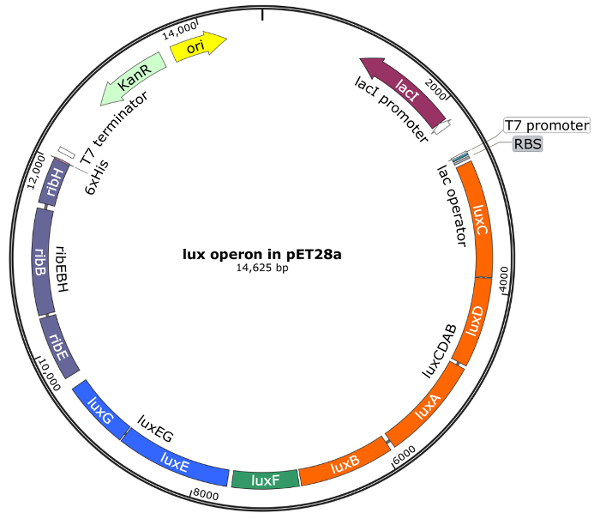
איור 3 : מפה וקטורית של pET28a המכילה את אופרון לאקס-צלעות . אופרון לאקס-צלעות של mandapamensis פ 27561 נוסף באתר שיבוט מרובים של pET28a לפי הסדר הגן המקורי (luxCDABFEG-ribEBH). אתרים הגבלת שימוש עבור שכפול הם NcoI ו- XhoI. שברי משמש להרכבת גיבסון אופרון הם luxCDAB ב orange, luxF בצבע ירוק, luxEG כחול ribEBH בלוונדר; הגנים בתוך קטע מוצגים כמו קופסת נפרדים. רצפים noncoding בין כל גן אופרון כלולים האסטרטגיה שיבוט יישומית. הגודל הסופי פלסמיד של pET28a המכילה את אופרון כל לאקס-צלעות הוא 14,625 בסיסי זוגות. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

איור 4 : השוואה של עקומות גדילה בעוצמות אור של הפניה זנים. OD-650 ננומטר, עוצמת ביולומינסנציה ב סעיפים לשניה נמדדו כל 10 דקות מעל 10 h ב- 28 מעלות צלזיוס. כל המדידות הן ערכי אכזרי של משכפל ביולוגי שלושה עם ארבעה טכני משכפל כל. קווי שגיאה מייצגים סטיות תקן. E. coli BL21 תאים (ריבועים אפורים), e. coli BL21 תאים המכילים pET28a ריק של וקטור (עיגולים אפורים), ו e. coli BL21 תאים המכילים את הווקטור pET28a עם הוספת אופרון לאקס-צלעות (יהלום שחור) נותחו כדי להבטיח צמיחה נכונה התנהגות של התאים שלנו e. coli . אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
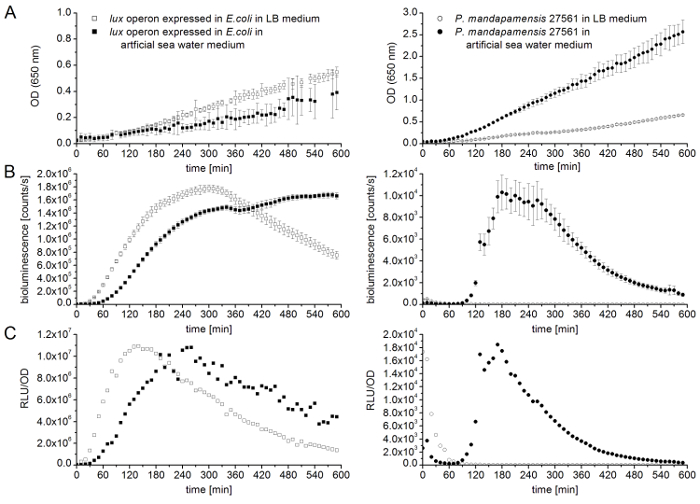
איור 5 : השוואה של עקומות גדילה ועוצמות אור של אופרון לאקס הביע ב e. coli (ריבועים) ו mandapamensis פ 27561 (מעגלים) בינוני ליברות (סמלים פתוחה) או בינוני מים ים מלאכותי (מלא סמלים). כל המדידות הן ערכי אכזרי של משכפל ביולוגי שלושה עם ארבעה טכני משכפל כל. קווי שגיאה מייצגים סטיות תקן. כל הניסויים בוצעו בטמפרטורת דגירה של 28 מעלות צלזיוס. (א) אופטי מדידות צפיפות (OD)-650 nm בוצעו כל 10 דקות 10 ה e. coli לאקס אופרון ביטוי (החלונית הימנית) היא לעומת mandapamensis פ 27561 (לוח נכון) ליברות בינוני, מלאכותיים ים מים בינוני. תא צפיפויות נקבעים ב 650 nm כדי למנוע ביולומינסנציה-הפרעה. (B) מדידה של עוצמת האור (ביולומינסנציה [ספירות/s]) בוצע בכל 10 דקות עבור 10 ה e. coli לאקס אופרון ביטוי (החלונית הימנית) בהשוואה mandapamensis פ 27561 (לוח נכון) ב- LB הים בינונית, מלאכותיים מים בינונית. (ג) אור היחסי בין עוצמות (RLU/OD) אופרון לאקס הביע ב e. coli (החלונית הימנית) ו mandapamensis פ 27561 (לוח נכון) נקבעים על-ידי נרמול ביולומינסנציה לדחיסות התא. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
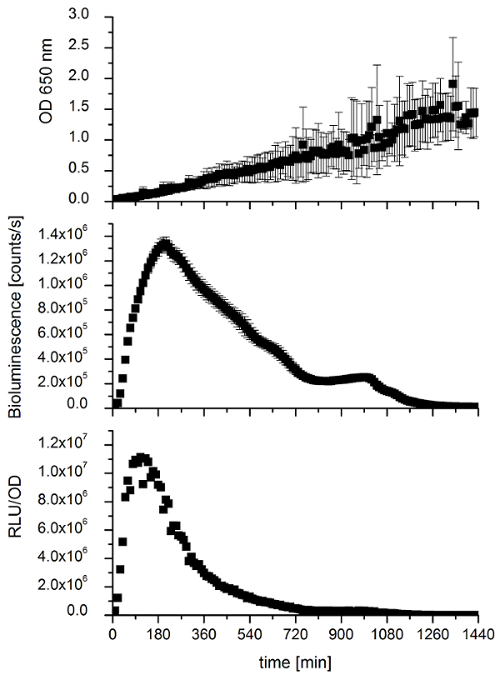
איור 6 : השוואה של עקומות גדילה ועוצמות אור של e. coli המבוסס על ביטוי גנים לאקס עבור ה 24 OD-650 ננומטר, עוצמת ביולומינסנציה ב סעיפים לשניה נמדדו כל 10 דקות מעל 24 שעות ב 28 º C. כל המדידות הן ערכי אכזרי של משכפל ביולוגי שלושה עם ארבעה טכני משכפל כל. קווי שגיאה מייצגים סטיות תקן. בנוסף, יחסית קלה עוצמות (RLU/OD) שבו ביולומינסנציה מנורמל על ידי צפיפות תא מיוצגים. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
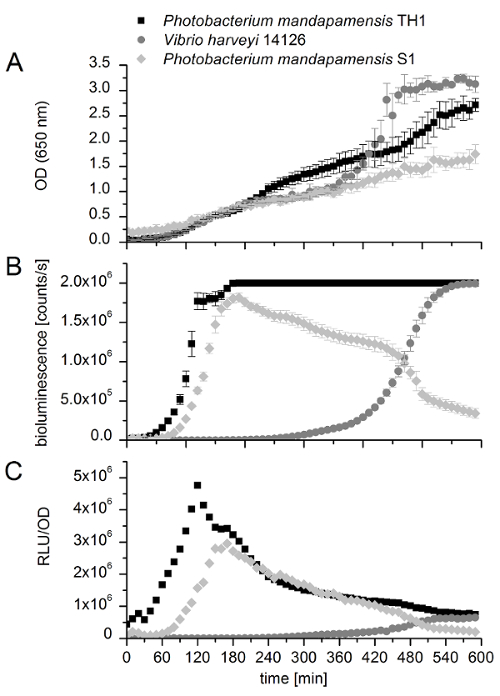
איור 7 : השוואה של חיידקים זוהרים כדי להעריך את פוטנציאל חישת תקנה. פליטת אור וצפיפות תא נמדדים כל 10 דקות עבור 10 h ומייצגות ערכים אכזרי של משכפל ביולוגי שלושה עם ארבעה טכני משכפל כל. קווי שגיאה מייצגים סטיות תקן. מדידות של TH1 Photobacterium mandapamensis (שחור משבצות), ויבריו harveyi 14126 (עיגולים אפורים) ו- S1 Photobacterium mandapamensis (אפור יהלומים), לעומת אחד את השני; (א) מתארת את צפיפות אופטית (OD)-650 nm, (B) האור בעוצמה (ביולומינסנציה [ספירות/s]), ו (ג) עוצמות האור היחסי (RLU/OD). אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
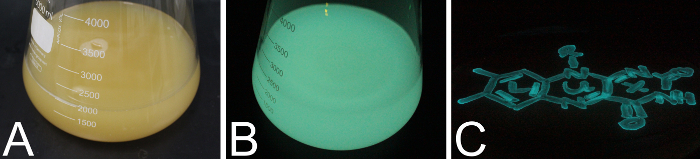
איור 8 : ביולומינסנציה מדיה נוזלי וכן על פלטות אגר. (א) הבקבוק 5 L 2 L LB בינונית מחוסן עם תאים BL21 e. coli לבטא את פלסמיד אופרון lux pET28a צולם באור. (B) באותה התרבות כמו (א) צולם בחושך. תמונות A ו- B נלקחו כ 2 h לאחר אינדוקציה של הביטוי. (ג) ים מלאכותי המים אגר בינוני צלחת עם תרבות מרוחים של S1 mandapamensis פ מצולם בחושך. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
Discussion
הקמת פלסמיד ביטוי המכיל ארבעה קטעים להלחין את אופרון כל לאקס-צלעות של mandapamensis פ 27561 הושגה באמצעות גיבסון שיבוט. ביטוי גנים זה e. coli מבוסס לאקס מאפשר לתאים e. coli פולטים אור. הימנעות חישת רגולציה, תנאי הגידול לא סטנדרטיים הם יתרונות משמעותי של מערכת זו.
יתרונות השימוש אסטרטגיה שיבוט גיבסון הם הרכבה קלה של שברי DNA ליניארי מרובים, גמישות גבוהה, אין צורך הגבלה ספציפית אתרי18,19,20. שיטה זו מאפשרת לשנות בקלות את אופרון לאקס , למעט גנים יחיד או אשכולות גנים או החדרת גנים חדשים או החלפת גנים מהמאמץ אחד עם השני. תנאי הכרחי ליישום של שיטה זו הוא הזמינות של רצף גנטי אופרון בהתאמה lux . רק עבור מספר קטן של חיידקים זוהרים הוא רצף הדנ א מלאה של אופרון בהתאמה לאקס מוכרות ו/או זמינות. רבים של רצפי אלה הם מפוצלים כי מופקות באמצעות רובה רצף. במקרה של ובדוקים mandapamensis פ 27561 רצף הדנ א מלאה של אופרון לאקס הוא ידוע וזמין ממסד הנתונים של ג'ין NCBI (GenBank: DQ988878.2).
צעד קריטי בפרוטוקול של האסיפה גיבסון הוא חישוב ריכוז ה-DNA של השברים יחיד. בפרוטוקול הרכבה של היצרן הומלץ להשתמש 0.2 - 0.5 pmols, הנפח הכולל של 20 µL 4-6 קטעים20,21. במקרה שלנו, איפה luxCDABFEG-ribEBH מורכב מ 4 חלקים, ריכוזים של נפחים היו 0.1 pmol 45 µL, בהתאמה, בהתאם התשואה של מוצרי ה-PCR. מצד אחד, הריכוז היה צריך להיות מופחת, מצד שני, אמצעי האחסון היה צריך להיות מוגברת. ובכל זאת, מכלול עבדו היטב, רצפי DNA אישר את הכניסה הנכון על הניסיון הראשון. ממצא זה אישר גיבסון הרכבה כשיטה המתאימה ועמיד לחקירה שלנו, אשר יכול בקלות להיות שונה18,19,20.
צלחת שהוקם קורא וזמינותו הוא קל לטפל בשיטה. הוא מאפשר ניתוח ראשוני פשוטה של חדש (un-) ידוע זני חיידקים זוהרים ונותן כבר רמז ראשון על מנגנון רגולטורי אור הייצור (למשל, לג בהפריה חוץ גופית-צפיפות התאים נמוך). בנוסף, בקלות ניתן להעריך תנאי הגידול בשילוב עם ייצור אור פשוט על ידי שינוי מדיום הגידול או טמפרטורה.
המדידות עם הקורא צלחת בוצעו ב 28 ° C. הסיבה להגדרה זו יוצאת דופן היא הרגישות לטמפרטורה של זני חיידקים זוהרים, איפה טמפרטורות מעל 30 מעלות צלזיוס להוביל פחות או אפילו אין צמיחה ו/או פליטת אור. שימו לב, כי הקורא צלחת הוא מסוגל לשמור טמפרטורה מוגדרים לאורך זמן עם המגבלה של חסר הפעיל מערכת הקירור. לכן, טמפרטורת הסביבה של חייב להיות מתחת הטמפרטורה של המדידה.
מהווה הוכחה של המושג, ההשוואה של הבונה e. coli עם המתח זוהרים mandapamensis פ (איור 5) מצד אחד ומדידות הפניה (איור 4) לעומת בוצעו ואשר האמינות של המערכת שזה עתה הוקם. בנוסף, מדידה ארוכת טווח הבטיח את תוחלת החיים של פליטת אור (איור 6). אבל צריך לשקול כי יתר הערכים אינם אמינים מעל צפיפות אופטית מסוימים, בהתאם המאפיינים של המכשיר בשימוש מדידה (כ 15 h במקרה הנוכחי) שבו יהיה צורך של דילול המתאים עבור מדידה ב טווח ליניארי של הגלאי. אלה סטיות גבוהה יתר הערכים לבצע מדידות זמן אלה לא אמין. לכן, מדידות קצרות כגון 10 h מומלץ שימוש את הגדרת הניסוי דיווחו כאן.
איור7 ניתן לראות מגבלות של צלחת הוקמה קורא וזמינותו. הקושי הוא למצוא הגדרה מתאימה של המדידה. 'להרוויח ערך' מכווננת את הרגישות של הצינור מכפיל צילום (PMT). הוא ההגברה של האות ב- PMT, כלומר גורם רווח גבוה יותר יגדיל את האות. אם רווח ערך נמוך מדי, האות לרעש יחס הופך גדול יותר בעוצמות אור של "נמוך" חיידקים זוהרים זוהר שאי אפשר למדוד כל (אותות יותר קרובה לאפס, הנתונים לא מוצג). האתגר ב assay זוהרים הוא להגדיר את הרווח אז תוצאות המדידה עבור כל זני חיידקים להישאר בטווח של המכשיר. בנוסף, טווח מדידה עבור הפריה חוץ גופית תלוי זמן מרווח זמן המדידה (למשל, מקסימום 2,000,000 1 s).
הרווח הוגדר 2800, היה נבדק מדעית, שבחרת עבור הקורא צלחת ספציפיים השתמשו להקמתה של שיטה זו. ההגדרה בשימוש רווח מאפשרת ההקלטה של האור הנפלט המרבי על ידי ביולומנאסן מערכת e. coli , פ mandapamensis 27561 ו mandapamensis פ S1 ללא גלישה, אבל עבור זנים mandapamensis פ TH1 ו- (פ') harveyi 14126 הרווח היה גבוה מדי. לכן, אלה זנים השנייה חורגת מהמגבלה של זיהוי, לא ניתן למדוד את עוצמת האור ממש מקסימלי. מגבלה טכנית זו עלולה למנוע את ההשוואה של חיידקים זוהרים, המציגות וריאציות גבוהה בפליטת אור מקסימלית, למרות תנאי הגידול וצפיפות התא יכול להיות דומה.
מיצוב של זנים חיידקי שנותחה בתוך הלוחות טוב בשימוש יש לעבור הערכה מדעית. למרות הצלחות טוב שחור עם תחתית זכוכית שימשו, נצפתה crosstalk בין הדגימות. עוצמת האור של זנים מסוימים הוא כל כך גבוה, כי כל הבארות הסמוכים יראה שווא חיוביים פליטת אור (למשל, ריק). לכן, חשוב למדוד שני זנים שונים בנפרד או עם הפרדה מרחבית מסוים אחד לשני.
ישנם כבר רבים ששינה זני החיידק הידוע המכילים חלקים אופרון לאקס , הם בעיקר מוכוונת יישומים15,16,17. בשיטות המתוארות כאן, מכוון מחקר בסיסי, לדוגמה את האפשרות לנתח כל הגן לאקס בנפרד. למרות המחקר של ביולומינסנציה יש היסטוריה ארוכה, יש עדיין הרבה שאלות פתוחות. למעט או החדרת גנים מ אופרון לאקס , מחליפים את הגנים luxAB עם גנים של עוד מאמץ או ניתוח חלבון מכלולי מוטבע בתוך קל לטפל e. coli המערכת והיישומים נוספת של צלחת הקורא assay, יתכן ניתן להשיג מידע נוסף על תהליכים רגולטוריים, הפונקציות של גנים lux .
Disclosures
המחברים אין לחשוף.
Acknowledgements
אנחנו רוצים להודות ולדיסלאו Maier (BMG Labtech GmbH) בשל תמיכתו בהקמת בתסריט כתוב עצמית עבור הקורא צלחת. עבודה זו נתמכה על ידי האוסטרים "Fonds zur Förderung der wissenschaftlichen Forschung" (FWF) כדי PM (P24189) ואת התוכנית PhD "DK מולקולרית אנזימולוגיה" (W901) עד בערב.
Materials
| Name | Company | Catalog Number | Comments |
| NEBuilder High-Fidelity DNA Assembly Cloning Kit | New England Biolabs Inc. | E2621S | for 10 rxn dx.doi.org/10.17504/protocols.io.cwaxad |
| Phusion Polymerase | Thermo Scientific | F530S | |
| Q5 High Fidelity DNA Polymerase | New England Biolabs Inc. | M0491S | |
| GeneJet Genomic DNA Purififcation Kit | Thermo Scientific | K0721 | for 50 rxn |
| Restriction enzymes and buffer (NcoI, XhoI) | New England Biolabs Inc. | R3193S/R0146S | |
| Wizard SV Gel and PCR Clean-Up kit | Promega | A9282 | for 250 rxn |
| Monarch DNA Gel Extraction Kit | New England Biolabs Inc. | #T1020S | for 50 rxn |
| GeneJet Plasmid Miniprep Kit | Thermo Scientific | K0503 | for 250 rxn |
| GoTaq G2 DNA Polymerase | Promega | M7841 | |
| 24-well black sensoplate with glass bottom | Greiner Bio One | 662892 | |
| FLUOStar Omega plate reader | BMG Labtech | ||
| OPTIMA/Mars Analysis Software | BMG Labtech | Version 2.20 | |
| Microsoft Excel 2010 | Microsoft | ||
| Multitron Standard Incubator Shaker | Infors AG |
References
- Widder, E. A. Bioluminescence in the Ocean: Origins of Biological Chemical, and Ecological Diversity. Science. 328 (5979), 704-708 (2010).
- Dunlap, P. Bioluminescence, Microbial. Encycl Microbiol. , 45-61 (2009).
- Ulitzur, S., Hastings, J. W. Evidence for tetradecanal as the natural aldehyde in bacterial bioluminescence. Proc Natl Acad Sci USA. 76 (1), 265-267 (1979).
- Kurfürst, M., Ghisla, S., Hastings, J. W. Characterization and postulated structure of the primary emitter in the bacterial luciferase reaction. Proc Natl Acad Sci USA. 81, 2990-2994 (1984).
- Dunlap, P. Biochemistry and genetics of bacterial bioluminescence. Biolumin Fundam Appl Biotechnol. 1, 37-64 (2014).
- Meighen, E. A. Bacterial Bioluminescence: Organization, regulation, and application of the lux genes. FASEB J. 7, 1016-1022 (1993).
- Moore, S. A., James, M. N. G., O'Kane, D. J., Lee, J. Crystallization of Photobacterium leiognathi non-fluorescent flavoprotein with limited sequence identity to bacterial luciferase. J Mol Biol. 224, 523-526 (1992).
- Moore, S. A., James, M. N. G., O'Kane, D. J., Lee, J. Crystal structure of a flavoprotein related to the subunits of bacterial luciferase. EMBO J. 12 (5), 1767-1774 (1993).
- Moore, S. A., James, M. N. G. Common structural features of the luxF protein and the subunits of bacterial luciferase: Evidence for a (βα)8 fold in luciferase. Protein Sci. 3, 1914-1926 (1994).
- Moore, S. A., James, M. N. G. Structural refinement of the non-fluorescent flavoprotein from Photobacterium leiognathi at 1.60 Å resolution. J Mol Biol. 249, 195-214 (1995).
- Kita, A., Kasai, S., Miyata, M., Miki, K. Structure of flavoprotein FP390 from a luminescent bacterium Photobacterium phosphoreum refined at 2.7 Å resolution. Acta Crystallogr Sect D Biol Crystallogr. 52 (1), 77-86 (1996).
- Bergner, T., et al. Structural and biochemical properties of LuxF from Photobacterium leiognathi. Biochim Biophys Acta - Proteins Proteomics. 1854 (10), 1466-1475 (2015).
- Defoirdt, T., Boon, N., Sorgeloos, P., Verstraete, W., Bossier, P. Quorum sensing and quorum quenching in Vibrio harveyi: Lessons learned from in vivo work. ISME J. 2 (1), 19-26 (2008).
- Meighen, E. Genetics of bacterial bioluminescence. Annu Rev Genet. 28, 117-139 (1994).
- Kelkar, M., De, A. Bioluminescence based in vivo screening technologies. Curr Opin Pharmacol. 12 (5), 592-600 (2012).
- Waidmann, M. S., Bleichrodt, F. S., Laslo, T., Riedel, C. U. Bacterial luciferase reporters: The Swiss army knife of molecular biology. Bioeng Bugs. 2 (1), 8-16 (2011).
- Wilson, T., Hastings, J. W. . Bioluminescence living lights, lights for living. , (2013).
- Gibson, D. G., Young, L., Chuang, R. Y., Venter, J. C., Hutchison, C. A., Smith, H. O. Enzymatic assembly of DNA molecules up to several hundred kilobases. Nat Methods. 6 (5), 343-345 (2009).
- Gibson, D. G., Smith, H. O., Hutchison, C. A., Venter, J. C., Merryman, C. Chemical synthesis of the mouse mitochondrial genome. Nat Methods. 7 (11), 901-903 (2010).
- Gibson, D. G. Enzymatic assembly of overlapping DNA fragments. Methods Enzymol. 498, 349-361 (2011).
- . . NEB NEBuilder HiFi DNA Assembly Reaction. , (2015).
- Atlas, R. M. . Handbook of Microbiological Media, Third Edition. , (2004).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved