A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
תפוקה גבוהה מדידה של קרום פלזמה חתימת יעילות בתאים בתרבית
In This Article
Summary
כאן נתאר של תפוקה גבוהה המבוססת על ידי קרינה פלואורסצנטית assay המודד קרום פלזמה חתימת יעילה באמצעות ניתוחים fluorometric, הדמיה בתאים חיים. Assay הזה יכול לשמש לסינון סמים או היעד גנים המווסתים קרום פלזמה חתימת בתאי יונקים.
Abstract
בסביבתם פיזיולוגיים, תאי יונקים נחשפים לעיתים קרובות מושם מכני וביוכימי שתוצאתה נזק קרום פלזמה. בתגובה נזקים אלה, machineries מולקולרית מורכבים במהירות לאטום מחדש קרום פלזמה שחזור תפקידה מכשול ולשמור על הישרדות cell. למרות 60 שנים של מחקר בתחום זה, אנו עדיין חוסר הבנה מעמיקה של התא חתימת מכונות. עם המטרה של זיהוי מרכיבי התא הזה חתימה מחדש של קרום פלזמה של שליטה או תרופות שיכולות לשפר חתימה, פיתחנו assay תפוקה גבוהה המבוססת על ידי קרינה פלואורסצנטית המודד חתימת יעילות בתאים בתרבית של קרום פלזמה תרבותי ב- microplates. כמערכת מודל עבור נזק קרום פלזמה, תאים נחשפים את חיידקי להיוות נקבובית רעלן listeriolysin O (מתוק), המהווה גדול 30-50 ננומטר קוטר proteinaceous נקבוביות ב כולסטרול המכילים הקרומים. השימוש של קורא מבוקרי טמפרטורה microplate רב במצב מאפשר מדידות spectrofluorometric מהיר ורגיש בשילוב עם brightfield קרינה פלואורסצנטית הדמיה מיקרוסקופיה של תאים חיים. ניתוח קינטי של עוצמת קרינה פלואורסצנטית הנפלטת fluorochrome מחייב חומצת גרעין impermeant הממברנה ומשקף את מידת ממברנה ופצעו וחתימה ברמת האוכלוסייה התא, המאפשר החישוב של התא חתימת יעילות . קרינה פלואורסצנטית מיקרוסקופ הדמיה מאפשר ספירת תאים, אשר צורונים אקספרס שימרה פלורסנט של חלבון גרעיני היסטון 2B, בתוך כל טוב של microplate להביא בחשבון וריאציות אפשריות במספר שלהם ומאפשרת בסופו של דבר זיהוי של אוכלוסיות תאים נפרדים. זה וזמינותו תפוקה גבוהה הוא כלי רב עוצמה צפויים להרחיב את ההבנה שלנו של מנגנוני תיקון קרום באמצעות הקרנה עבור גנים המארח או exogenously הוסיף תרכובות את חתימת קרום פלזמה שליטה.
Introduction
בתרבית של תאים כפופים לחץ מכני, osmotic ו ביוכימי, והתוצאה היא האובדן של קרום פלזמה שלמות. ללא חתימה מחדש מהיר ויעיל, תאים פגומים שתכניע במהירות למוות מתוכנת או נמק. מאז שנות השישים, מאמצים כדי להבין את קרום פלזמה חתימת תהליך יש כבר מונעים על-ידי ההשלכות ההרסניות הקשורים בתפקוד שלו. אכן, מחלות כגון חגורת הגפיים-ניוון שרירים, סוכרת או תסמונת Chediak-היגאשי קושרו תיקון קרום פלזמה לקויה עקב מוטציות dysferlin קידוד גנטי, הייצור של מוצרי קצה glycation מתקדם, פגמים lysosomal סחר המתקן CHS1, בהתאמה1,2,3,4,5,6. אולם, נכון להיום, ההבנה שלנו של קרום חתימה הוא עדיין מוגבל7. מחקרים ראשוניים הראו כי קרום חתימה הוא שיזם זרם של חוץ-תאית Ca2 + דרך קרום פלזמה פגום8,9,10. מאז, מספר שאינו-שבחירה Ca2 +-מנגנונים תלויים הוצעו כדי לחתום מחדש תאים. ההשערה תיקון מציעה כי בסמיכות הפצע, שלפוחית תאיים נתיך עם כל קרום פלזמה פגום לפעול כמו תיקון11,12,13,14. מודל נוסף מציעה אקסוציטוזה סידן תלוית הזה של lysosomes לפצע האתר משחרר את האנזים lysosomal חומצה sphingomyelinase, אשר ממירה ספינגומיילין ceramide בעלון החיצוני של קרום פלזמה. השינוי הפתאומי הזה בהרכב השומנים תוצאות מונחה-ceramide אנדוציטוזה מתוך16,15,17באזור הפגוע. לבסוף, המנגנון המוצע השלישית כרוכה תפקיד עבור endosomal המיון מורכבים הנדרשים להעברה (ESCRT) לקדם את היווצרות שלפוחית הפונים כלפי חוץ זה באד של קרום פלזמה18. רק קבוצה מוגבלת של חלבונים זוהה במודלים אלה, מכונות שלהם חייב להיות הובהר עוד יותר.
כאן נתאר וזמינותו של תפוקה גבוהה זה אמצעי קרום פלזמה חתימת יעילות תאים בתרבית של חסיד חשופים לפגיעה מתווכת על-ידי רקומביננטי listeriolysin O (מתוק)19. מתוק להיוות נקבובית רעלן (PFT) מופרש על ידי המחלה תאיים עיצוב גבות ליסטריה monocytogenes20,21,22 , שייך לקבוצת ה-MACPF/CDC (ממברנה התקפה מורכבת, perforin, ו superfamily cytolysin תלויי-כולסטרול). MACPF הם יוצרים נקבובית יונקים החלבונים המעורבים מערכות ההגנה החיסוניות, בעוד CDCs טוקסינים חיידקיים בעיקר המיוצר על ידי פתוגנים גראם חיוביים הגורמות נזק לתאים המארח כדי לקדם אורח חיים החולני שלהם23. CDCs הם מסונתז כמו מונומרים מסיסים במים או הדימרים זה לאגד כולסטרול נוכח קרום פלזמה oligomerize לתוך מתחם prepore subunits עד 50. Prepore מורכב מסדר מחדש ואז להוסיף β-גדילי מעבר ליפידית, ויוצרים נקבובית β-חבית המתפרס על 30-50 ננומטר בקוטר24,25,26,27. נקבוביות גדולות אלה מאפשרות פלקסים של יונים ורכיבים הסלולר קטן בתוך ומחוץ לתא. למרות זאת, מספר מחקרים הציעו כי נקבוביות בגדלים קטנים יותר הם גם יצרו28,29,30. בין CDCs, מתוק מציג מאפיינים ייחודיים, כולל צבירת בלתי הפיך pH טמפרטורה ותלוי, מה שתורם לביצוע ניתוחים תפוקה גבוהה31,32. ניתן להוסיף מתוק המדיום התרבות התא-4 הלעפה תרוטרפמט, טמפרטורה מתירני כדי שלה מחייב תאים, אך לא את היווצרות הנקבובית מורכבים. חניכה של היווצרות נקבובית ואז ניתן לסנכרן באמצעות העלאת הטמפרטורה הלעפה תרוטרפמט 37, ומאפשר פעפוע יעיל של הרעלן מולקולות במישור של הקרום על טופס oligomers וכן את הבנייה מחדש הסתגלותי מעורב נקבובית הדור. לכן, שלאחר הבורר בטמפרטורה, קינטי של נזק לתאים יהיה תלוי הכמות של רעלן קשור קרום פלזמה. חשוב לציין, מתוק מסיסים (מאוגדים קרום פלזמה) במהירות ובאופן בלתי הפיך אגרגטים כאשר הטמפרטורה מגיעה הלעפה תרוטרפמט 37, אשר מקלה על הצורך לשטוף את הרעלן לא מאוגד מולקולות ומגביל את היקף נזק הממברנה לאורך זמן. לבסוף, מכיוון מתוק נקשר כולסטרול, טפסים נקבוביות ממברנות כולסטרול-עשיר, זה וזמינותו היא לבצע מגוון רחב של תאי יונקים. חשוב לזכור כי מתוק משפיע על התא המארח איתות בעיקר דרך היווצרות נקבובית, עם כמה יוצאים מן הכלל בתא נקבובית שאינו תלוי איזה איתות עלולה להתרחש33,34,35,36 ,-37,-38,-39. לכן, זה לא יכול להיות מהכלל הזה מתוק איתות פעילויות עשויה להשפיע על התהליך של תיקון קרום.
זה וזמינותו ישירות מעריך את היקף התא ופצעו על ידי מדידת שיתוף התא impermeant fluorochrome (למשל, יודיד propidium) פסיבי מזין תאים פצועים, הופך מאוד פלורסנט ברגע זה משייך חומצות גרעין . לפיכך, fluorochrome יכול להישמר במדיום התרבות התא לאורך כל הניסוי, ומאפשר ניתוחים בזמן אמת של התא ופצעו. עוצמת קרינה פלואורסצנטית לצבוע חומצת גרעין מחייב יגדל עם ריכוז הרעלן ו, על ריכוז נתון של הרעלן, תגדל עם הזמן עד כל הנקבוביות נוצרות, התאים הם תוקנו או עד רוויה. זרם של חוץ-תאית Ca2 + דרך ממברנה הנקבוביות הוא אירוע קווה נון עבור חתימה מחדש. לכן, יעילות resealing יכול להיות בעקיפין שמעידים השוואת תא ופצעו במדיום תרבות המכיל Ca2 + (תיקון תנאי מתירניות) כדי ופצעו ב Ca2 +-חינם בינוני (תיקון תנאי מגביל). כיוון עוצמת קרינה פלואורסצנטית לצבוע מחייב חומצת גרעין הוא ביחס ישר לריכוז תא היטב לכל, חשוב לתאי הזרע-ריכוז זהה בבארות כל. חשוב גם לספור תאים כל היטב לפני ואחרי וזמינותו כדי להבטיח כי ניתוק התא אינו מתרחש, צפים, מצטברים תאים ניתן להסתיר את קריאות קרינה פלואורסצנטית אשר עלול לסבך את פרשנות הנתונים. לספור תאים, התאים לבטא היסטון גרעיני מותאם לשפות אחרות 2B-GFP (ויזת עבודה H2B-GFP) שימשו זה וזמינותו. מבוקרי טמפרטורה, מצב מרובה, microplate הקוראים לשלב מהירה, תפוקה גבוהה מדידות (באמצעות תבנית 96 או 384-ובכן לוח) של עוצמות קרינה פלואורסצנטית עם מיקרוסקופ הדמיה של תאים חיים ב 37 º C. האחרון יכול לשמש כדי למנות את מספר הטלפון הנייד ולצפות היווצרות בסופו של דבר של אוכלוסיות תאים נפרדים.
בסופו של דבר, וזמינותו זה מספק למשתמשים את היכולת להרחיב את הידע שלהם על המורכבות של מנגנוני תיקון קרום על ידי הקרנה של מולקולות מארח או תרכובות exogenously הוסיף כי עשויות לשלוט ממברנה לתקן. הפרוטוקול הבא מתאר את השלבים ניסיוני כדי למדוד את היעילות resealing של התאים חשופים מתוק ולהעריך את ההשפעות של התרופה נתון או טיפול הסלולר על יעילות חתימה מחדש.
Protocol
1. הכנה
- תא יופיצ
הערה: האדם תאי אפיתל צוואר הרחם, הלה והלה לבטא היסטון 2B-GFP (ויזת עבודה H2B-GFP), שהיו בשימוש פרוטוקול זה, אך assay זו ניתן להתאים בתרבית של תאים אחרים19.- ניתוק תאים חסיד מבקבוק 75 ס מ2 תא תרבות ע י שטיפת התאים עם 2 מ של טריפסין-EDTA 0.25%. החלף את טריפסין בשימוש 2 מ של טריפסין טריים-EDTA 0.25%.
- דגירה התאים ב 37 הלעפה תרוטרפמט במשך 5 דקות עד התאים יש מעוגל, מנותק מן הבקבוק.
- Resuspend התאים 8 מ של מדיום הגידול (DMEM המכיל 10% לא פעיל חום העובר שור סרום 100 פניצילין U/mL, סטרפטומיצין µg/mL 100).
- לקבוע את הריכוז התא באמצעות של hemocytometer ו- µL 10 תא השעיה.
- לדלל התאים מדיום הגידול כדי ריכוז של 2.5 x5 10 תאים/מ.
- יוצקים התליה תא לתוך קערה פיפטה סטרילי ומערבבים ביסודיות את המתלים. באמצעות פיפטה סרולוגית 10 מ.
- באמצעות micropipette של 12-רב-ערוצי וטיפים µL 200, להפיץ הלה תאים (2.5 x4 תאים/100 10 µL/טוב) בשלושה עותקים (או ארבע פעמים) בצלחת שטוחה 96-ובכן, ברור התחתון, שחור פוליסטירן שטופלו תרביות רקמה.
הערה: סידור ציפוי מוצג כדוגמא באיור1. - התרבות התאים במשך 24 שעות ביממה בחממה תרבות תא humidified-37 הלעפה תרוטרפמט ו-5% CO2.
- פתרון מניות הכנה
- להכנת 1 ליטר של מניה 10 x מאגר מ' (משמש להכנת M1 ו- M2) על-ידי הוספת 95 גר' הנקס מאוזנת תמיסת מלח, 0.476 גר' MgCl2 (5 מ מ), ו- g 23.83 של HEPES (100 מ מ) עד 900 מ"ל של מים. להתאים את ה-pH ל 7.4, להעלות את עוצמת הקול 1 ל' מסנן לחטא.
- הכנת 50 מ של 50 x (1.25 מ') מניות של גלוקוז על-ידי הוספת 11.26 גר' D-(+)-גלוקוז לסך של 50 מ ל מים. מסנן לעקר את הפתרון.
- להכין 50 מ של 100 x (120 מ"מ) מניות של סידן על-ידי הוספת 0.666 גר' CaCl2 סך של 50 מ ל מים. מסנן לעקר את הפתרון.
- הכנת 50 מ של 10 x (50 מ מ) מלאי של-אתילן גליקול-bis(2-aminoethylether)-N, N, N', N', חומצה tetraacetic (EGTA) על-ידי הוספת 0.951 גר' EGTA 40 מ ל מים. להגביר את רמת ה-pH 8 באמצעות NaOH כדי להמיס את EGTA, ואז להעלות את עוצמת הקול כדי 50 מ. מסנן לעקר את הפתרון.
- לצלחת יחיד 96-ובכן, להכין 50 מ של 1 בינוני (M1, מכיל Ca2 +), 50 מ של 2 בינוני (M2, Ca2 +-ללא תשלום), ו-15 מיליליטר 2 בינוני בתוספת EGTA, בהתאם:
- עבור M1, הוסף 5 מ של 10 x מאגר M 0.5 מ של 100 x CaCl2, 1 מ"ל של גלוקוז x 50 43.5 מ ל מים.
- עבור M2, הוסף 5 מ של 10 x מאגר מ' ו- 1 מ"ל של גלוקוז 50 x 44 מ ל מים.
- M2/EGTA, להוסיף 1.5 מיליליטר 10 x מאגר מ' ו- 1.5 מיליליטר 10 x EGTA 12 מ של מים.
הערה: כל הפתרונות המכיל propidium יודיד (PI) צריך להיות מוכן ישירות לפני הוספת התאים.
- צלחת הקורא/הדמיה Cytometer הגדרות
הערה: להשתמש בקורא רב במצב צלחת מצויד עם שתי יחידות הזיהוי: של מצלמות-דיגיטליות ו- cytometer של הדמיה. להגביל את החשיפה פלורסצנטיות להימנע photobleaching fluorophores.- לחמם את הקורא צלחת 37 ° C לפני ביצוע וזמינותו.
- כוונן את הפרמטרים עבור וזמינותו קינטי בהתאם בתוך מצב הגדרות :
- לבחור Monochromator, פל (זריחה), קינטית עבור תצורת אופטי, לקרוא מצבי וקרא סוג, בהתאמה.
- תחת הגדרות אורך גל, בחירה של 9 ו 15 ננומטר עירור, פליטה bandpass, בהתאמה. עבור מבחני באמצעות propidium יודיד (PI), מוגדר אורכי הגל עירור, פליטת 617, 535 nm, בהתאמה.
- תחת סוג צלחת, בחר ולס 96 התבנית צלחת, צלחת שנקבע מראש תצורה המתאים צלחת התחתון ברור קיר שחור.
- תחת אזור לקריאה, לסמן את הבארות ינותחו ברחבי קינטי.
- תחת PMT, אופטיקה, מראש את ההבזקים בכל קריאה ל- 6 , סמן את התיבה עבור קריאה מלמטה.
- תחת תזמון, להוסיף 30: 00:00 בתיבת זמן לרוץ הכולל עבור assay קינטי 30 דקות ולאחר הכנס 05: 00:00 עבור מרווח זמן.
הערה: עבור כל פעם הצבע ואת אורך גל אחד, זמן הקריאה של צלחת מלאה 96-ובכן הוא 30 s. - לאשר את ההגדרות שצוינו פרטי הגדרות מימין ובחר אישור. להפעיל לחץ לקריאה ליזום את קינטי.
- הגדר את פרמטרי ההדמיה בהתאם בתוך מצב הגדרות:
- לבחור Minimax, הדמיה, קצה עבור תצורת אופטי, לקרוא מצבי וקרא סוג, בהתאמה.
- תחת אורכי גל, בחר ששודרו אור, ואו שניהם פלורסצנטיות בתיבות המתאימים עירור, פליטה של אורכי הגל של 456/541 nm (GFP), 625/713 nm (PI).
- להשתמש באותן האפשרויות עבור סוג הצלחת ואזור לקריאה כפי שהוגדר בשלבים 1.3.2.3 ו- 1.3.2.4.
- תחת הגדרת אזור טוב, בחר מספר האתרים בתוך באר לדימות.
הערה: 12 אתרי יתאימו לתמונת מלא-. טוב. - תחת הגדרות ייבוא תמונה, בחר את פעמים חשיפה של אור מסור, 541 (GFP), 713 (PI). עבור ה-GFP, תמונה כולו טוב עם מועד החשיפה של ms 20/תמונה. עבור ששודרו אור (TL) ו- PI פלורסצנטיות, רוכשים תמונה אחת של מרכז מכל קידוח עם פעמים חשיפה של ms 8 ו- 20, בהתאמה.
- לאשר את ההגדרות שצוינו ב- מידע ההגדרות מימין ובחר אישור. הפעם הרכישה עבור הדמיה, כל שטח בכל טוב (12 תמונות טוב) של צלחת 96-ובכן, גל אחד היא מינימלית ~ 15 העיתונות לקריאה ליזום הדמיה.
הערה: הזמן רכישה של תמונה בודדת/טוב של צלחת 96-ובכן מחייב פלטה/min ~2.5 מאורך גל אחד. שאר הפרמטרים המתוארים לעיל מקבילים לציוד ספציפי במעבדה שלנו. Spectrofluorometric מידות: מנורה פלאש קסנון הצגת 1.0 קבועה עירור אורכי גל nm (250-850 ננומטר) עם bandpass nm 9 או 15 מתכווננת, גלאי צינור האופטיקה עם > 6 יומן טווח דינמי, פליטה nm 15 או 25 מתכוונן bandpass. הדמיה cytometer: מקור אור תאורה מסוגל אור לבן, 460 nm ו אורכי גל עירור nm 625 עם bandpass nm 20, מסננים פליטה מרוכז בכל 541 nm (108 bandpass ננומטר) ו- 713 nm (123 nm bandpass), בהתאמה, ולא מטרה X 4 מצמידים 1.25 12 סיביות תשלום מצמידים מכשיר מגה-פיקסל.
2. assay
הערה: בזמן וזמינותו, התאים להיות 70-90% confluent. במהלך השלבים לשטוף, המדיום צריך להיות יוסר, חלה על הקיר בצד של הבאר (לא ישירות מעל תאי). לשמור על הטמפרטורה של מתוק ב- < 4 הלעפה תרוטרפמט כדי למנוע צבירת שלה עד שלב 3.1.5.
- להכין מלאי של 30 מיקרומטר PI ב M1 וחיממתי מלאי של 30 מיקרומטר PI ב- M2 מראש ב- 37 הלעפה תרוטרפמט.
- לשטוף בעדינות את התאים בצלחת 1 באמצעות micropipette 12-רב-ערוצי וטיפים µL 200, כדלקמן:
- תנאים תיקון-מתירני, הסר את מדיום הגידול ואת שטיפת שהתאים פעמיים עם µL 200/M1 טוב להתחמם מראש ב- 37 הלעפה תרוטרפמט. החלף את המדיום 100 µL/טוב של M1 חמה המכילה 30 מיקרומטר PI.
- בשביל לתקן תנאים מגבילים, להסיר את מדיום הגידול ולשטוף את התאים פעם אחת עם M2 µL/טוב חם 200 המכילים 5 מ"מ EGTA כדי chelate Ca2 +, ולאחריה שטיפה אחת עם µL 200/M2 היטב. החלף את המדיום עם 100 M2 µL/טוב חמה המכילה 30 מיקרומטר PI.
- לאחר מדיום הגידול שטף והחלפתם בינוני המכיל propidium יודיד, להעביר ישירות לשלב 2.1.3.
- תמונה צלחת 1 תחת אור המשודרת GFP, PI כמפורט תחת 1.3.3 (קינטיק מראש). שלב זה לוקח 15-20 דקות.
- במהלך תקופת 15 דקות בשלב 2.1.3, להכין צלחת 2 באמצעות micropipette 12-רב-ערוצי וטיפים µL 200 כדלקמן:
- מקום 96-ובכן עגול microplate פוליפרופילן התחתון על קרח. להגדיר את הצלחת באמצעות עיצוב ניסיוני המתאים צלחת 1 (איור 1).
- תנאים תיקון-מתירני, להוסיף 100 µL/טוב של M1 כקרח המכיל 60 מיקרומטר PI, ואחריו התוספת של 100 µL/טוב של M1 כקרח המכיל 4 x מתוק או לא עבור הפקד.
- עבור תנאים מגבילים-תיקון, להוסיף 100 µL/טוב של M2 כקרח המכיל 60 מיקרומטר PI, ואחריו התוספת של 100 µL/טוב של M2 כקרח המכיל 4 x מתוק או לא עבור הפקד.
- לאחר הדמיה צלחת 1 (שלב 2.1.3), מיד למקם אותו על קרח, באמצעות נייר אלומיניום כדי להפריד את הצלחת קשר ישיר עם קרח. אפשר צלחת 1 כדי להתקרר למשך 5 דקות.
- באמצעות micropipette של 12-רב-ערוצי וטיפים µL 200, להעביר 100 µL מכל קידוח לתוך צלחת 2 (שלב 2.1.4) לבארות המתאימים בצלחת 1. לפיזור כראוי את הרעלן בתקשורת של צלחת 1, הוספת בעצות שלהלן מניסקוס, להוציא בעדינות את אמצעי אחסון ללא היכרות עם בועות.
הערה: לא פיפטה למעלה ולמטה, כמו זה בשוגג עלול לנתק את התאים. - להשאיר את הצלחת. בשביל 1 דקות נוספות לאפשר את הרעלן לאגד התאים ולהעביר מיד לצלחת 1 לקורא צלחת עבור וזמינותו קינטי באמצעות מצב מצלמות-דיגיטליות (שלב 1.3.2).
- בסוף וזמינותו קינטי, מיד תמונה צלחת 1 (פוסט-קינטי) באמצעות שלב 1.3.3.
3. ניתוח: תא ספירה
- לקבוע את ספירת בהתבסס על גרעיני ידי קרינה פלואורסצנטית באמצעות התוכנה ספירה תא microplate.
- בתוך הגדרות, בחר שאריץ ניתוחולאחר תחת המקטע קטגוריה בתוך הגדרות ניתוח תמונה בחר דיסקרטי אובייקט ניתוח שימוש 541 הגל עבור מציאת חפצים.
- בתוך האפשרות למצוא חפצים, באמצעות את לצייר על תמונות למצוא שיטה, בחר הגרעינים תחת הכרטיסייה הגדרות ולחץ על ' החל'.
- הקש OK ו קריאה ליזום את התא כולל אלגוריתם.
- לחלופין, אם אין כלי כזה זמין, השתמש ניתוח תמונה של תוכנה כגון ImageJ לספור תאים.
- ב- ImageJ, פתח את קובץ התמונה כמו ערימה.
- להמיר את המחסנית 8-bit סולם גוני אפור תמונות על ידי לחיצה על תמונה בשורת התפריטים, לרחף מעל סוג, ובחר 8 סיביות.
- להחסיר את הרקע: לחצו על תמונה בשורת התפריטים, רחף מעל התאםובחר בהירות/חדות. התאם את הערך המינימלי כדי להסיר את רעשי הרקע ולבחור החל.
- סף ליצירת תמונות בינאריות: לחצו על תמונה בשורת התפריטים, רחף מעל התאם, ובחר את הסף. בחר רקע כהה, התאימו את ערכי סף מינימום ומקסימום, ולחץ על החל.
- במקרה של חופפים גרעינים, כלי קו פרשת המים יכול לשמש קטע רב-קוטבי. לחץ על תהליך בתפריט, לרחף מעל בינארי , בחר קו פרשת המים.
הערה: זה יפריד באופן אוטומטי גרעינים מחוברים. - לנתח את התמונות רעולי פנים על-ידי החלת קריטריונים מוגדרים על-ידי המשתמש (גודל, מעגליות) כדי לחדד את הזיהוי של גרעינים או לא לכלול שאריות תאים.
- לחץ על נתח התפריט ולאחר מכן ניתוח חלקיקים. להגדיר את הגודל הרצוי (פיקסל ^ 2) וכן מעגליות (הערך 1 הוא מעגל מושלם) טווחים זה מספיקים לכלול תאים בודדים/גרעינים.
- בתיבה הנפתחת הצג, בחר את הפיכת האפשרות הרצויה, הסימון סכםולאחר לחץ על אישור כדי לקבל ספירת.
4. ניתוח: עקומות קינטי
- להעביר את המידע קינטי בתוכנת reader צלחת תוכנה נתונים אנליטיים.
- עבור כל תנאי הניסוי, ממוצע עוצמות קרינה פלואורסצנטית משכפל על כל timepoint, יחד עם סטיית תקן המתאים ו שגיאת התקן של הממוצע עבור כל תנאי הניסוי.
- עבור כל תנאי הניסוי, לעקוב אחר עקומת קינטי המתאימים: עוצמת PI (ציר y) נגד הזמן (ציר x).
- כדי לחשב את היעילות resealing של מצב נתון טיפול, לחשב את השטח מתחת לעקומה (AUC) של + מתוק ב- M1 (AUC(M1)) ו + מתוק ב- M2 (AUC(M2)). השתמש הגישה הציעו להלן כדי להעריך את היעילות (E) של חתימה:
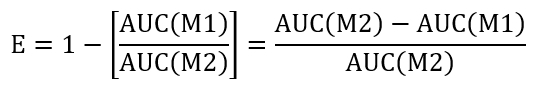
- לבצע השוואה בין טיפול בקרה ובדיקה על-ידי קביעת יחס יעילות (REff) המצוין להלן:
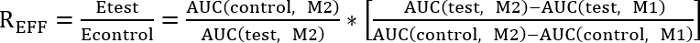
REFF = 1, בדיקת הטיפול אינו משפיע על תיקון
REFF < 1, מבחן טיפול מעכב תיקון
REFF > 1, בדיקת הטיפול משפר את תיקון - לחשב את השטח מתחת לעקומה באמצעות המשוואה הבאה:
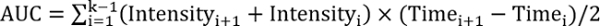 , איפה k המספר הכולל של מעקב.
, איפה k המספר הכולל של מעקב.
תוצאות
תא סופר דיוק: הלה תאים משמשים לעתים קרובות כקו בתרבית של תאים דגם לחקור מנגנוני תיקון קרום. בעת הערכת תיקון קרום ברמת האוכלוסייה תא, חשוב לתאי צלחת-ריכוז זהה בבארות כל לפרשנויות הנתונים המתאימים. זה חשוב גם לוודא ביצוע וזמינותו מספרי הטלפון הנייד שלהם שוות ערך מעבר בארות. ...
Discussion
Assay זו מודדת את היעילות של קרום חתימת ברמת האוכלוסייה תא עם קיבולת תפוקה גבוהה. זה יכול לשמש עבור מרכיבי התא או ספריות סמים העלולה להשפיע על קרום תיקון מסך. וזמינותו שתואר פעם תבנית צלחת 96-ובכן, אבל זה ניתן להתאים 384-ובכן לוחות עבור תפוקה גבוהה יותר. היתרון הזה וזמינותו הוא היכולת שלו לקבל מד?...
Disclosures
המחברים אין לחשוף.
Acknowledgements
אנו להכיר ד ר ג'סי Kwiek (אוניברסיטת אוהיו) באדיבות הרשות לשימוש שלו פלטפורמה רב במצב זיהוי עבור ניסויים מוקדמים. מחקר דיווחו במאמר זה נתמך על ידי המכון הלאומי לאלרגיה ומחלות זיהומיות של מכוני הבריאות הלאומיים תחת פרס מספר RO1AI107250 כדי Seveau סטפני. התוכן הוא אך ורק באחריות המחברים, ואינם מייצגים בהכרח את הנופים הרשמי של מכוני הבריאות הלאומיים.
Materials
| Name | Company | Catalog Number | Comments |
| SpectraMax i3x Multi-Mode Microplate Reader | Molecular Devices | i3x | |
| MiniMax 300 Imaging cytometer | Molecular Devices | 5024062 | |
| TO-PRO-3 | ThermoFisher Scientific | T3605 | |
| Propidium Iodide | ThermoFisher Scientific | P3566 | |
| HeLa | ATCC | CCL2 | |
| HeLa H2B-GFP | Millipore | SCC117 | |
| Trypsin-EDTA 0.25% | ThermoFisher Scientific | 25200056 | |
| 96-well Corning flat bottom black polystyrene tissue culture treated plate | Corning | 3603 | |
| Hanks' balanced Salts | Sigma-Aldrich | H4891 | |
| EGTA | ISC BioExpress | 0732-100G | |
| HEPES | Fisher Scientific | BP310-500 | |
| D-(+)-Glucose, HybriMax | Sigma-Aldrich | G5146-1KG |
References
- Demonbreun, A. R., McNally, E. M. Plasma Membrane Repair in Health and Disease. Current Topics in Membranes. 77, 67-96 (2016).
- Howard, A. C., McNeil, A. K., McNeil, P. L. Promotion of plasma membrane repair by vitamin E. Nature Communications. 2, 597 (2011).
- Howard, A. C., et al. A novel cellular defect in diabetes: membrane repair failure. Diabetes. 60 (11), 3034-3043 (2011).
- Lozano, M. L., et al. Towards the targeted management of Chediak-Higashi syndrome. Orphanet Journal of Rare Diseases. 9, 132 (2014).
- Vainzof, M., et al. Dysferlin protein analysis in limb-girdle muscular dystrophies. Journal of Molecular Neuroscience. 17 (1), 71-80 (2001).
- Huynh, C., et al. Defective lysosomal exocytosis and plasma membrane repair in Chediak-Higashi/beige cells. Proceeding of the National Academy of Sciences of the United States of America. 101 (48), 16795-16800 (2004).
- Cooper, S. T., McNeil, P. L. Membrane Repair: Mechanisms and Pathophysiology. Physiological Reviews. 95 (4), 1205-1240 (2015).
- Steinhardt, R. A., Bi, G., Alderton, J. M. J. M. Cell membrane resealing by a vesicular mechanism similar to neurotransmitter release. Science. 263 (5145), 390-393 (1994).
- De Mello, W. C. Membrane sealing in frog skeletal-muscle fibers. Proceedings of the National Academy of Sciences of the United States of America. 70 (4), 982-984 (1973).
- Fishman, H. M., Tewari, K. P., Stein, P. G. Injury-induced vesiculation and membrane redistribution in squid giant axon. Biochimica et Biophysica Acta. 1023 (3), 421-435 (1990).
- Davenport, N. R., Bement, W. M. Cell repair: Revisiting the patch hypothesis. Communicative & Integrative Biology. 9 (6), 1253643 (2016).
- McNeil, P. L., et al. Patching plasma membrane disruptions with cytoplasmic membrane. Journal of Cell Science. 113 (11), 1891-1902 (2000).
- Terasaki, M., Miyake, K., McNeil, P. L. Large plasma membrane disruptions are rapidly resealed by Ca2+-dependent vesicle-vesicle fusion events. Journal of Cell Biology. 139 (1), 63-74 (1997).
- Bi, G. Q., Alderton, J. M., Steinhardt, R. A. Calcium-regulated exocytosis is required for cell membrane resealing. Journal of Cell Biology. 131 (6 Pt. 2), 1747-1758 (1995).
- Tam, C., et al. Exocytosis of acid sphingomyelinase by wounded cells promotes endocytosis and plasma membrane repair. Journal of Cell Biology. 189 (6), 1027-1038 (2010).
- Rodriguez, A., et al. Lysosomes behave as Ca2+-regulated exocytic vesicles in fibroblasts and epithelial cells. Journal of Cell Biology. 137 (1), 93-104 (1997).
- Reddy, A., Caler, E. V., Andrews, N. W. Plasma membrane repair is mediated by Ca(2+)-regulated exocytosis of lysosomes. Cell. 106 (2), 157-169 (2001).
- Jimenez, A. J., et al. ESCRT machinery is required for plasma membrane repair. Science. 343 (6174), 1247136 (2014).
- Pathak-Sharma, S., et al. High-Throughput Microplate-Based Assay to Monitor Plasma Membrane Wounding and Repair. Frontiers in Cellular and Infection Microbiology. 7, 305 (2017).
- Hamon, M. A., et al. Listeriolysin O: the Swiss army knife of Listeria. Trends in Microbiology. 20 (8), 360-368 (2012).
- Seveau, S. Multifaceted activity of listeriolysin O, the cholesterol-dependent cytolysin of Listeria monocytogenes. Subcellular Biochemistry. 80, 161-195 (2014).
- Osborne, S. E., Brumell, J. H. Listeriolysin O: from bazooka to Swiss army knife. Philosophical Transactions of the Royal Society of London B: Biological Sciences. 372 (1726), (2017).
- Lukoyanova, N., Hoogenboom, B. W., Saibil, H. R. The membrane attack complex, perforin and cholesterol-dependent cytolysin superfamily of pore-forming proteins. Journal of Cell Science. 129 (11), 2125-2133 (2016).
- Tweten, R. K. Cholesterol-dependent cytolysins, a family of versatile pore-forming toxins. Infection and Immunity. 73 (10), 6199-6209 (2005).
- Koster, S., et al. Crystal structure of listeriolysin O reveals molecular details of oligomerization and pore formation. Nature Communications. 5, 3690 (2014).
- Duncan, J. L., Schlegel, R. Effect of streptolysin O on erythrocyte membranes, liposomes, and lipid dispersions. A protein-cholesterol interaction. Journal of Cell Biology. 67 (1), 160-174 (1975).
- Morgan, P. J., et al. Subunit organisation and symmetry of pore-forming, oligomeric pneumolysin. FEBS Letters. 371 (1), 77-80 (1995).
- Leung, C., et al. Stepwise visualization of membrane pore formation by suilysin, a bacterial cholesterol-dependent cytolysin. eLife. 3, (2014).
- Marchioretto, M., et al. What planar lipid membranes tell us about the pore-forming activity of cholesterol-dependent cytolysins. Biophysical Chemistry. 182, 64-70 (2013).
- Palmer, M., et al. Assembly mechanism of the oligomeric streptolysin O pore: the early membrane lesion is lined by a free edge of the lipid membrane and is extended gradually during oligomerization. European Molecular Biology Organization Journal. 17 (6), 1598-1605 (1998).
- Bavdek, A., et al. pH dependence of listeriolysin O aggregation and pore-forming ability. Federation of European Biochemical Society Journal. 279 (1), 126-141 (2012).
- Schuerch, D. W., Wilson-Kubalek, E. M., Tweten, R. K. Molecular basis of listeriolysin O pH dependence. Proceeding of the National Academy of Sciences of the United States of America. 102 (35), 12537-12542 (2005).
- Cassidy, S. K., O'Riordan, M. X. More than a pore: the cellular response to cholesterol-dependent cytolysins. Toxins (Basel). 5 (4), 618-636 (2013).
- Lam, J., et al. Host cell perforation by listeriolysin O (LLO) activates a Ca(2+)-dependent cPKC/Rac1/Arp2/3 signaling pathway that promotes L. monocytogenes internalization independently of membrane resealing. Molecular Biology of the Cell. , (2017).
- Gekara, N. O., Weiss, S. Lipid rafts clustering and signalling by listeriolysin O. Biochemical Society Transactions. 32 (Pt 5), 712-714 (2004).
- Magassa, N., Chandrasekaran, S., Caparon, M. G. Streptococcus pyogenes cytolysin-mediated translocation does not require pore formation by streptolysin O. European Molecular Biology Organization Reports. 11 (5), 400-405 (2010).
- Baba, H., et al. Induction of gamma interferon and nitric oxide by truncated pneumolysin that lacks pore-forming activity. Infection and Immunity. 70 (1), 107-113 (2002).
- Carrero, J. A., Vivanco-Cid, H., Unanue, E. R. Listeriolysin o is strongly immunogenic independently of its cytotoxic activity. Public Library of Science One. 7 (3), e32310 (2012).
- Coconnier, M. H., et al. Listeriolysin O-induced stimulation of mucin exocytosis in polarized intestinal mucin-secreting cells: evidence for toxin recognition of membrane-associated lipids and subsequent toxin internalization through caveolae. Cell Microbiology. 2 (6), 487-504 (2000).
- Suzuki, T., et al. DNA staining for fluorescence and laser confocal microscopy. Journal of Histochemistry and Cytochemistry. 45 (1), 49-53 (1997).
- Bink, K., et al. TO-PRO-3 is an optimal fluorescent dye for nuclear counterstaining in dual-colour FISH on paraffin sections. Histochemistry and Cell Biology. 115 (4), 293-299 (2001).
- Zhang, J. H., Chung, T. D., Oldenburg, K. R. A Simple Statistical Parameter for Use in Evaluation and Validation of High Throughput Screening Assays. Journal of Biomolecular Screening. 4 (2), 67-73 (1999).
- Birmingham, A., et al. Statistical methods for analysis of high-throughput RNA interference screens. Nature Methods. 6 (8), 569-575 (2009).
- Zhang, X. D. A pair of new statistical parameters for quality control in RNA interference high-throughput screening assays. Genomics. 89 (4), 552-561 (2007).
- Zhang, X. D. A new method with flexible and balanced control of false negatives and false positives for hit selection in RNA interference high-throughput screening assays. Journal of Biomolecular Screening. 12 (5), 645-655 (2007).
- Idone, V., et al. Repair of injured plasma membrane by rapid Ca2+-dependent endocytosis. Journal of Cell Biology. 180 (5), 905-914 (2008).
- Davenport, N. R., et al. Membrane dynamics during cellular wound repair. Molecular Biology of the Cell. 27 (14), 2272-2285 (2016).
- Defour, A., Sreetama, S. C., Jaiswal, J. K. Imaging cell membrane injury and subcellular processes involved in repair. Journal of Visualized Experiments. (85), (2014).
- Lee, J. J. A., et al. Cell Membrane Repair Assay Using a Two-photon Laser Microscope. Journal of Visualized Experiments. (131), (2018).
- Weisleder, N., et al. Visualization of MG53-mediated cell membrane repair using in vivo and in vitro systems. Journal of Visualized Experiments. (52), (2011).
- Corrotte, M., et al. Toxin pores endocytosed during plasma membrane repair traffic into the lumen of MVBs for degradation. Traffic. 13 (3), 483-494 (2012).
- Kuismanen, E., Saraste, J. Low temperature-induced transport blocks as tools to manipulate membrane traffic. Methods in Cell Biology. 32, 257-274 (1989).
- Togo, T., et al. The mechanism of facilitated cell membrane resealing. Journal of Cell Science. 112, 719-731 (1999).
- Johnson, S. A., et al. Temperature-dependent phase behavior and protein partitioning in giant plasma membrane vesicles. Biochimica et Biophysica Acta. 1798 (7), 1427-1435 (2010).
- Lam, J. G. T., et al. Host cell perforation by listeriolysin O (LLO) activates a Ca(2+)-dependent cPKC/Rac1/Arp2/3 signaling pathway that promotes Listeria monocytogenes internalization independently of membrane resealing. Molecular Biology of the Cell. 29 (3), 270-284 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved