Method Article
הזרקת תוך-החזה לחקר בוגרים של לב זברדג
In This Article
Summary
שיטה זו מסתמכת על הזרקה של 0.5-3 μL של הפתרון לתוך החזה של דג מבוגר. ההליך מספק ביעילות חלבונים ותרכובות כימיות לתוך הסמיכות של הלב דג זברה מבלי לפגוע האיבר. הגישה מתאימה לבדיקת ההשפעות של גורמי אקסוגני על רקמות שונות של הלב.
Abstract
לב הדגים המבוגר מספק מודל רב עוצמה במחקר התחדשות לב. למרות שהכוח של מערכת זו מבוסס על גישות טרנסגניים, משלוח מהיר של גורמי אקסוגני מספק טכניקה משלימה במחקרים פונקציונליים. כאן, אנו מציגים שיטה הנשענת על מינהל של כמה מיקרוליטר של פתרון לתוך חלל החיוג מבלי לגרום נזק לאוטם שריר הלב. זריקות בתוך החזה (IT) ניתן ביעילות לספק חלבונים ותרכובות כימיות ישירות על פני השטח של הלב. החומר המוזרק מתפזר דרך האפידיום. לתוך רקמות הלב המשמשות כבסיס לעומת זריקות הצפק (IP), היתרון העיקרי של זריקות החזה הפנימי הוא הניהול המרכזי של הגורמים נבדק על איבר היעד. משלוח של מולקולות ישירות לתוך קרום הלב היא אסטרטגיה מתאימה למחקרים של מיזוג לב והתחדשות בוגרים zebrafish.
Introduction
בין בעלי חוליות, בעלי יכולת מופלאה לחדש את ליבם1,2. יכולת זו דווחה בכמה מודלים לפציעה, כלומר כריתת הקודקוד החדרית, הקריופציעה (CI) ו-מעבר גנטי ה, אבלציה3,4,5,6,7. לאחר פציעות פולשנית, הקיר הפגום של החדר הופך בסופו של דבר נרפא על ידי רקמת פיברוטיק, אשר מוחלף בהדרגה על ידי שריר הלב החדש של היום8,9,10,11. התגובה המוקדמת ריפוי הפצע כוללת הפעלה אפילידיום וגיוס של תאים חיסוניים12,13,14,15. במקביל, הופך קרדיוציטים ליד שריר הלב הפצוע להיות מופעל, להבדיל, להתרבות ולהפוך בהדרגה את השטח הפצוע בתוך 30-90 יום16,17,18 , 19. התקדמות משמעותית בפענוח המנגנונים המולקולריים והסלולאריים של התחדשות הלב הושגה בזכות הזמינות של כלים גנטיים, כגון ניתוח מעקב אחר שושלת היוחסין, inducible gene מוגזם, שורות כתבת של רקמה פלואורסצנטית, ו-crispr/Cas9 גנים מוטגנזה20,21.
לאחרונה הקמנו מודל של מיזוג לב ב-דג זברה למבוגרים על ידי כריתת האונה22,23. התניה מגבירה את הביטוי של גנים קרדיקליניים ומרוממת את הכניסה מחדש למחזור התא בלבבות שלמים ומתחדשות. תהליכים אלה משויכים גיוס של תאים חיסוניים ושיפוץ מטריצה22,24. מנגנוני המיזוג מובנים בצורה עלובה, והקמת טכניקות חדשות נדרשת לטפח את תחום המחקר. במיוחד, ניהול אופטימיזציה של חלבונים איתות מופרש או תרכובות כימיות אחרות חיוני כדי לחקור עוד נושא זה.
בהיותו בעלי חיים ימיים, דגי מלחמה יכולים לקלוט באופן טבעי חומרים שונים המומסים במים באמצעות הזימים והעור שלהם. זה מציע אפשרות מסירת סמים לא פולשנית באמצעות טבילה של דגים בפתרונות עם כימיקלים מגוונים, כגון מעכבי פרמקולוגית, הורמונים סטרואידים, טמוקסיפן, BrdU ואנטיביוטיקה. אכן, מחקרים רבים של מעבדות שונות, כולל שלנו25,26,27, ניצלו שיטה זו, אשר יקר במיוחד בתחום של ביולוגיה משובי6, 28. גישה זו היא, עם זאת, לא מתאים המסירה של פפטידים, DNA, RNA, מודולנוס או מולקולות עם חדירות רקמות מוגבלות. במקרים אלה, מסירה יעילה יותר מושגת על ידי מיקרוהזרקה לתוך הגוף, למשל, על ידי החדרת נימי לתוך סינוס ורידי רטרו מסלולית, לתוך הצפק הפנימי או לחלל בתוך הלב הפנימי29,30, . בסדר, 31 כאן, אנו מתארים הליך של הזרקה תוך בית החזה של כמות קטנה של פתרון, כשיטה מתאימה ללמוד התחדשות לב ומיזוג מראש ב-zebrafish מבוגרים.
Protocol
טיפול בבעלי חיים וכל הליכי החיות המתוארים בפרוטוקול הבא אושרו על ידי המשרד הווטרינרי של פריבורג, שוויץ.
1. כלים ופתרונות לזריקות
- משוך הזרקה מותאם בורוסיליקט זכוכית נימים באמצעות פולר מחט על פי איור 1A. החנות נימים שלף בצלחת 9 ס מ פטרי עם מסילות של חימר מידול או דבק.
- באמצעות מספריים נפוצים, חותכים פיסת ספוג (7 ס"מ x 3 ס"מ x 1 ס מ) ולגלף צללית כמו דג במרכזו.
- הכינו מענה קטן של פתרון הזרקה עם החלבונים שנבדקו או תרכובות אחרות. כוונן את הריכוז שלהם בתוך היכולת על ידי דילול החומר ב-1x הנקס מאוזנת תמיסת מלח (HBSS) השלימה עם 10% פנול אדום.
הערה: כאן, הריכוז של החלבון נבדק היה 100 ng/mL. - כדי להכין פתרון מניות של הרדמה באגירה tricaine, לפזר 4 גרם של tricaine ב 980 mL של מים מזוקקים. כוונן את ה-pH ל-7.0-7.4 באמצעות 1 M-HCl-הזינו-pH 9, ומלא את המים עד 1,000 mL. אחסן את הפתרון בחשיכה ב-4 ° c.
- כדי לקבל את ריכוז העבודה של הרדמה, להוסיף 1 על 2 מ ל של פתרון מניות tricaine לתוך 50 mL של מי דגים בגביע.
הערה: את ריכוז העבודה של הרדמה מטריקיין יש להכין טרי לפני השימוש.
2. הכנת תחנת ההזרקה
- הפעל את הstereomicroscope עם האור מלמעלה והתאם את ההגדלה ל-16x.
- משרים את הספוג במים דגים, מניחים אותו על צלחת פטרי בגודל 9 ס מ על במת המיקרוסקופ והתאימו את הפוקוס.
- תחת הstereomicroscope, לחתוך את הקצה של מיקרונימי ב ~ 7 מ"מ מהבסיס באמצעות מספריים iridectomy כפי שמוצג באיור 1A. קוטר הטיפ האידיאלי יהיה ~ 20 μm.
הערה: חיתוך קצה של נימי בדרך אלכסונית הוא אופטימלי עבור הוספות לתוך הרקמה. - הכניסו את המיקרונימים למחזיק המחט של מנגנון המיקרו מזרק.
- באמצעות טיפים microloader, טען פתרון בקרה (למשל, 1x HBSS) כדי להגדיר את הלחץ של הזרקה, כדי להשיג את הזרימה המתאימה בין 0.3 μL/s ו 0.5 μL/s. רוקן את המחט.
- טען את אמצעי האחסון הנבחר של פתרון ההזרקה (לדוגמה, neurotrophic factor [CNTF] המדולל ב-1x HBSS) לקצה הקפילר (איור 1X). . לא אמורה להיות בועת אוויר בקפילר
הערה: הנפח המקסימלי של פתרון ההזרקה תלוי בגודל הדג. עבור אורך סטנדרטי של 2.5 כ 3 ס מ (מרחק מן החוטם אל הדוד מדווש), נפח ההזרקה המקסימלי המונע נפיחות בבית החזה ודימום היה נחוש להיות 5 μL (איור 1F). ניתן להזריק כמויות גדולות יותר לדגים גדולים יותר.
3. הכנת הדגים להזרקה בתוך החזה
- תפוס דג מבוגר (danio rerio) עם רשת ולהעביר אותו לתוך פתרון הרדמה.
- לאחר 1-2 לדקה, כאשר הדג מפסיק לשחות והתנועה של הפועל מופחתת, גע בדגים בכפית פלסטיק כדי לוודא שהוא אינו מגיב לשום קשר.
- העבירו את הדג במהירות ובזהירות עם הכפית לתוך החריץ של הספוג הרטוב, עם הצד הגחוני למעלה. ראש הדג צריך להצביע מידו הדומיננטית של המפעיל.
4. הזרקת מיקרוקרום הלב
- תחת הstereomicroscope, התבונן היטב בתנועת הלב הפועם מתחת לעור הדג. קביעת נקודת הזריקה מעל הלב הפועם ובאמצע המשולש המוגדר על-ידי לוחות הסחוס הגוניים (איור 1D). הכנס את קצה הנימים בזווית של 30-45 מעלות ביחס לציר הגוף (איור 1E). לחדור בעדינות את העור עם קצה המיקרוקפילר לתוך קרום הלב (איור 1C). נקודת כניסה אופטימלית היא קרובה יותר לבטן מאשר לראש.
הערה: אל תכניס את הנימים עמוק מדי לגוף וללב, משום שהגורם לכך הוא פגיעה באיבר. במקרה של ניקוב לב, המחט מתמלאת בדרך כלל בדם. אם זה קורה, להסיר את הנימים ולהוציא את הדג מהניסוי. - ברגע שהמחט נמצאת בתוך קרום הלב, הזרקה מלאה על ידי לחיצה על דוושת הדוושה של מכשיר המיקרו-מזרק.
הערה: להיזהר לא להזריק אוויר לחלל החזה. - לאחר ההזרקה, למשוך בעדינות את הנימים מבית החזה ומיד להעביר את הדג לתוך טנק עם מי מערכת להחלמה.
- נטר את הדג עד. להתאוששות מוחלטת מההרדמה
- לאסוף את הלב בנקודת הזמן הרצויה ולהכין אותו לניתוח נוסף.
הערה: במקרה והדגים לא מחדשים את התנועה של האופרנות בתוך 30 s, הנפשת הדגים מחדש על ידי לחיצת מים לתוך הזימים באמצעות פיפטה פלסטי.
תוצאות
לאחר זריקות החזה הפנימי (IT), את ההשפעות של פתרון האקסוגני ניתן לנתח. למטרה זו, יש לקבל את הדג מורדמים ואת הלבבות שנאספו, קבועים ומעובדים באופן היסטולוגית, על פי הפרוטוקולים שפורסמו בעבר32,33.
כדי לאמת את השיטה, ביצעו לראשונה שני ניסויים באמצעות הזרקת צבע וצבעי פלורסנט. בהתחלה, הורלנו דגים ולאחר המוות. הזריקו 3 מדיו לתוך החזה הלבבות נאספו לאחר 5 דקות, שטף בתמיסת מלח מאגור פוספט (PBS), קבוע 2% פורמאלין, שטף ב-PBS וצילם מתחת למיקרוסקופ. שנית, הזרקנו 3 μL של 1 μg/mL 4 ′, 6-diamidino-2-פניינילידול (DAPI) ב vivo, ותיקן את הלב אחרי 2 h. בשני הצדדים, ניתוח ההרכבה המלאה חשף את התיוג של הלב כולו, כולל החדר, האטריום והריוסוס (איור 2 א, ב). תוצאות אלו מגלות התפשטות יעילה של הפתרון המוזרק על משטח הלב.
פרוטוקול נפוץ לאספקת חומרים אקגניים לתוך הדג המבוגר הוא הזרקת הצפק (IP). כדי להשוות את התאמתו של IT לעומת זריקות IP ללימודי לב, הזרקנו כמות דומה של DAPI באמצעות שתי השיטות ותיקן את ליבם לאחר 5 דקות ו 120 דקות (איור 3A). הלבבות היו מוכתמים ומוכתמים בעזרת phalloidin אלקסה Fluor (AF) 568 כי תוויות F-actin בשריר הלב. תאים DAPI-חיוביים נצפו בלבבות לאחר הזרקת ה-IP בשתי נקודות זמן (איור 3B). לעומת זאת, הזרקת IT הביא לנוכחות של גרעיני DAPI התווית בשריר הלב (איור 3B). תוצאות אלה מדגימות כי הזרקת IT שיפור המסירה של התרכובת ללב, לעומת הזרקת IP.
כדי לבדוק את ההתאמה של שיטה זו עבור לימודי התחדשות לב, אנו לקריוגוף הגוף8, וביצע זריקות IT של 3 μl של 1 μg/ML dapi ו-1 Μg/mL phalloidin AF649 ב 3 ו -7 ימים לאחר ההקפאה (dapi) (איור 4a). ב 1 h לאחר ההזרקה, הלבבות נאספו, קבוע, מנות מוכתמים עם phalloidin AF568 לדמיין את שריר הלב השלם. מצאנו כי גם שריר הלב וגם את הרקמה הפצועה הכילו תאים חיוביים DAPI רבים, המציין חדירה יעילה של הצבע הזה לתוך הלב שלמים ורקמות פיברוטיק (איור 4B). יתר על כן, הוזרק phalloidin AF649 היה גם משולב על ידי הקרדיוציטים של אזור הפגיעה בפרי וכמה מגויס הגידולים של האזור הפצוע. ניסוי זה מגלה כי הסמים יכולים לחצות את האפילידיום ולחדור לתוך השריר הלב הבסיסי.
לאחר בדיקת היעילות של זריקות IT באמצעות צבעים, ניתחנו את ההשפעות של חלבונים מוזרק על הלב. אנו מחומרים ציטוקין, שנקרא CNTF, אשר מיובטים לאחר כריתת האונה24. חקרנו את ההשפעות של CNTF אקסוגני על תהליכים שונים, כלומר התפשטות הקרדיוציט, מטריקס התצהיר מטריצה, גיוס תאים החיסונית וביטוי גנטי הקרדיוקטיבי. מצאנו שכל ההיבטים הביולוגיים האלה הופעלו על ידי הזרקת ה-IT של CNTF, לעומת השליטה החיסונית (איור 5)24. תוצאות אלה מדגימות כי שיטת הזרקת הבית הפנימי מספק אסטרטגיה מתאימה למסירה ממוקדת של חלבונים כדי ללמוד את ההשפעות שלהם על רקמות לב נפרדות במגוון של assays.
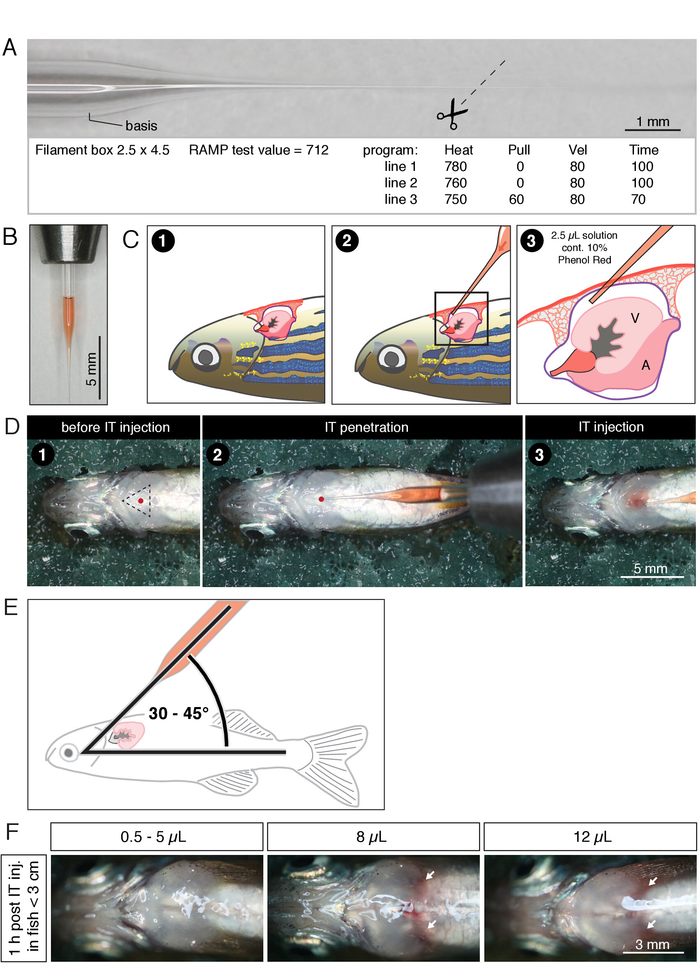
איור 1: הזרקת הפנימי (IT) הזרקה של דג מבוגר. (A) צילום של נימי מיקרוהזרקה משכו עם פילמנט (6 ", 1.0 מ"מ בקוטר) וערכים של תוכנית המחט לשימוש מחטים. (ב) צילום של מיקרועם נימי מיקרו הזרקה עם פילמנט (6 ", 1.0 מ"מ קוטר) מתמלא עם 2.5 μl של פתרון המכיל 10% פנול אדום. הקצה המושך של המחט הוא באורך מקסימאלי של 7 מ"מ. (ג) ייצוג סכמטי של הליך הזרקת ה-IT. (ד) תצלומים של הליך הזרקת ה-IT. דמות זו שונתה מ Bise et al.24. מספרים בחלוניות C ו-D תואמים את אותם שלבים של ההליך: (1) דג ממוקם בצד השני למעלה על ספוג מחולל. אתר הניקוב (נקודה אדומה במשולש) ממוקם במרכז החזה ליד הזימים. (2) חדירת המחט לתוך קרום הלב. . נקודה אדומה מרמזת על חדירה לאתר (3) ההזרקה מנוטרת על ידי התבוננות התפשטות הפתרון האדום בחלל הלב לחייג. (E) הערכה של הזרקה. זווית בין נימי ההזרקה לבין ציר הגוף צריך להיות בין 30 ° ו 45 ° כדי למנוע ניקוב לב. (ו) תצלומים של דג החזה בשעה אחת לאחר הזרקה של כרכים שצוין. חיצים לבנים מצביעים על רקמת הכלים, אשר עשוי להצביע על דימום פנימי. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
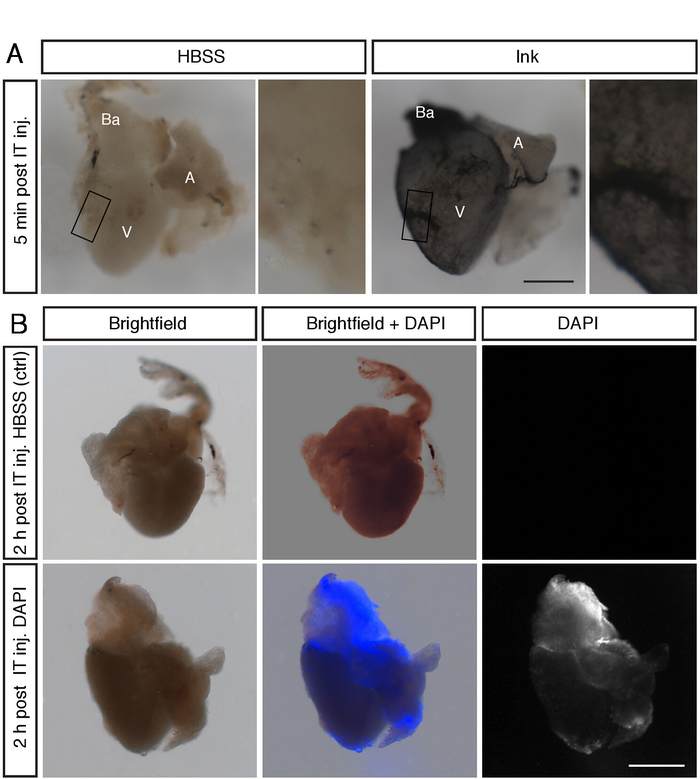
איור 2: הפתרונות המוזרקים מתפשטים כמעט בצורה אחידה על משטח הלב. (A) Stereomicroscope תמונות של לבבות שלמים של דגים נתון הזרקת IT לאחר המוות עם 2.5 ΜL HBSS או 2.5 μl דיו. דיו מוכתם המשטח של החדר (V), אטריום (A) ו בורגול הריוסוס (Ba). סרגל בקנה מידה = 300 μm. (ב) בהיר שדה ותמונות פלורסנט stereomicroscope של לבבות שלמים של דגים נתון זה הזרקה עם HBSS ו 3 μl של 1 μg/ML dapi. הזריחה DAPI מזוהה על חלקי הלב מיד לאחר הזרקה. סרגל קנה מידה = 300 μm. נא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
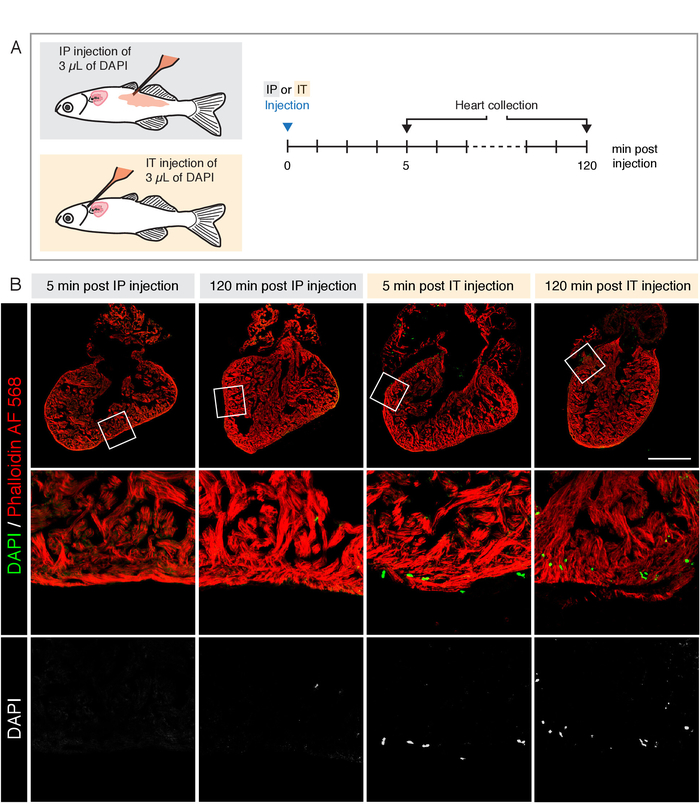
איור 3: השוואה בין שתי שיטות הזרקה להעברת DAPI ללב. (א) ערכה של התכנון הניסיוני. זריקות הצפק (IP) ו התוך התוך (IT) בוצעו עם כמות זהה של 1 μg/mL DAPI (3 μL). לבבות נאספו ב 5 ו 120 דקות לאחר ההזרקה. (ב) מיקרוסקופיה מיקרוסקופית תמונות של קטעי לב ויטראז ' פלורסנט (אדום) שתוויות השריר בשפע. DAPI מוזרק היה דמיינו בערוץ המתאים המוצג בירוק. לאחר הזרקת IP, DAPI אינו מזוהה בלב בכל רגע. לאחר הזרקת IT, התאים החיוביים DAPI נמצאים החדר לאחר שתי נקודות הזמן. סרגל קנה מידה = 500 μm. נא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
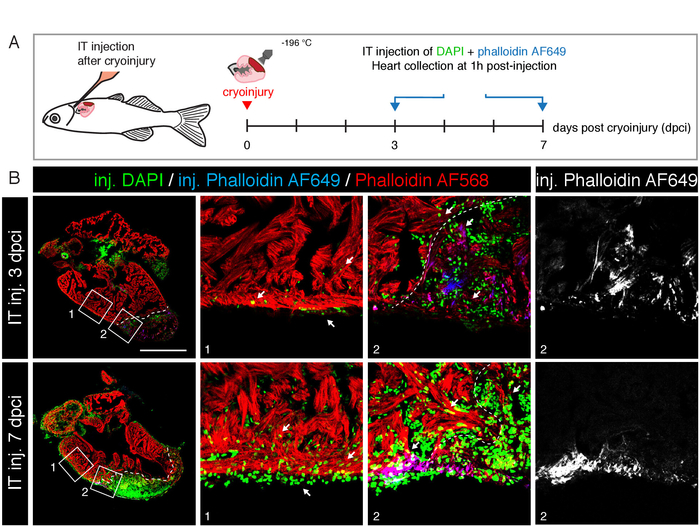
איור 4: הזרקה ללמוד התחדשות לב. (א) ערכה של התכנון הניסיוני. ב 3 ו 7 ימים לאחר מקריופיל, שילוב של DAPI ו phalloidin AF649 היה זה-הוזרק (3 μL של 1 μg/mL). לבבות נאספו 1 שעה לאחר הזרקת IT, קבוע, מנות ומוכתם עם phalloidin AF568 (אדום). (ב) מיקרוסקופיה בתמונות של קטעי לב אורכי ב 3 ו -7 dpci. מוזרק DAPI (ירוק) ו phalloidin AF649 (כחול) התווית תאים של האזור הנפגע (מופרד על ידי קו מקווקו לבן) ואת שריר הלב השלם (כתמים אדומים). חיצים לבנים מצביעים על התפלגות DAPI (ירוק) באמצעות שריר השריר קומפקטי ומלא שלמות והאפילודיום. סרגל קנה מידה = 500 μm. נא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
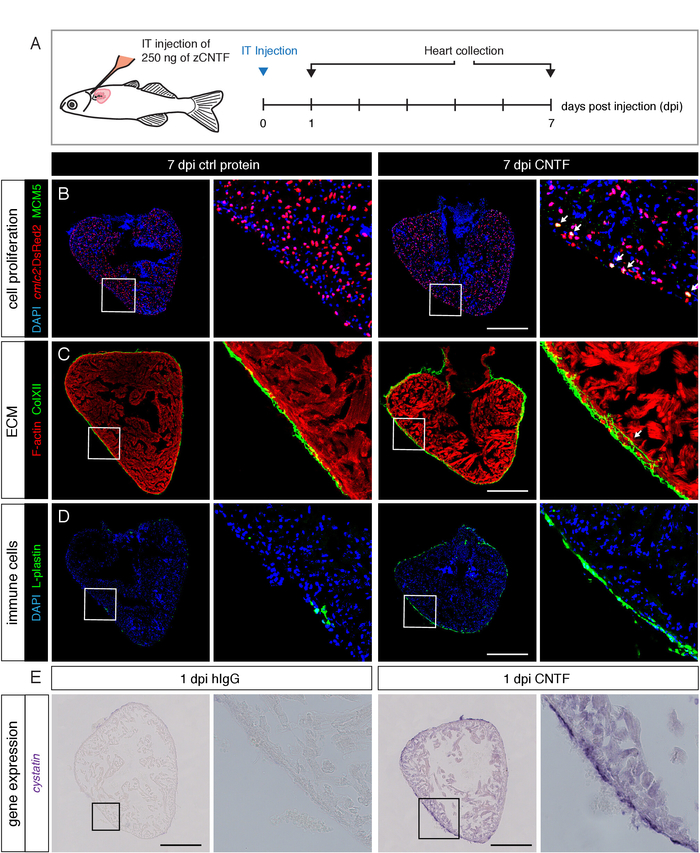
איור 5: אקסוגני IT-מוזרק CNTF מעוררת מספר תהליכים ביולוגיים בלב. (א) ערכה של התכנון הניסיוני. ראשית, 2.5 μl של פתרון המכיל 250 ng של דג דג זברה או בקרת חיסוני (higg) הוזרק לתוך קרום הלב של הדגים הטרנסגניים המבטא DsRed2 גרעינית בקרדיומנציטים. לבבות נאספו ב 7 ו 1 ימים לאחר ההזרקה (dpi) ונותחו על ידי מערכת חיסונית היברידיזציה באתרו, בהתאמה. (B-D) תמונות מיקרוסקופית הקונקמיות של קטעי שליטה ולבבות מוזרקים מבוססי CNTF. (ב) מכתים כנגד סמן מחזור התא, תחזוקה של מיני כרומוזום רכיב מורכב 5 (MCM5; ירוק), חושף מספר גבוה יותר של מתרבים הקרדיוציטים בתגובה CNTF אקסוגניים. סרגל בקנה מידה = 500 μm. (C) חיסוני כנגד הקולגן xii מראה מוגברת התצהיר של קולגן xii בשריר הלב לאחר הזרקת CNTF. ב שליטה לב, קולגן XII הוא מוגבל האפיארדיום34. סרגל בקנה מידה = 500 μm. (ד) החיסון נגד סמן תא החיסונית, L-plastin, מזהה גיוס משופר של תאים חיסוניים בדגים CNTF מוזרק. סרגל בקנה מידה = 500 μm. (E) בהיר מיקרוסקופ תמונות של סעיפים הצלב החדרית לאחר היברידיזציה באתרו באמצעות בדיקה mrna אנטי הגיון נגד cystatin, גורם הקרדיוקטיבי, מציג upregulation הטרנס של הגן הזה בלב של דג CNTF מוזרק. סרגל קנה מידה = 500 μm. דמות זו שונתה מ Bise et al.24. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Discussion
כאן, אנו מתארים שיטה לאספקת תרכובות אקסוגני וחלבונים לתוך חלל לחיוג קרום הלב כדי ללמוד את ההשפעות שלהם על הלב zebrafish מבוגרים. ההליך מבוסס על הזרקה תוך-בית החזה, אשר גורמת להעברת נפח קטן של פתרון בקרבת האיבר. טכניקה זו פותחה ותוארה ללימודי מיזוג והתחדשות לב.
הצעד הקריטי בהליך זה הוא חדירה של נימי הזכוכית לחלל החזה. שלב זה תלוי בשלושה פרמטרים שהם: קשיחות וחדות של טיפ נימי, זווית החדירה, ואת אתר הניקוב. כדי לייעל את החדירה דרך העור, החלק הנמשך של הנימים לא צריך להיות ארוך מדי, כמו מחטים כאלה גמישים מדי ולהתכופף במגע עם העור. כדי למנוע זאת, קשיחות יכול להיות מותאם על ידי הפחתת גודל הקצה עם המספריים iridectomy. למרות זווית החדירה יכול להשתנות בין 30 ° ו 45 °, זה יכול להיות מותאם קשיחות של הקצה. בהחלט, טיפ דק יחדור את העור טוב יותר עם זווית צרה יותר.
כדי לייעל את חדירת המחט, אתר הכניסה צריך להיות מיד מעל הלב הפועם. הסיכון לניקוב לב הוא בדרך כלל נמוך בין 5% ל -8%. החדרת המחט האחורי ללב מגבירה את הסיכון לניקוב לב, כפי שנראה על ידי דימום מוגבר. במקרים כאלה, יש להסיר את החיות מן הניסויים.
מקור אחר של צרות במהלך הזרקת ה-IT מתרחשת ברמת נימי. ואכן, הקפילר יכול להישבר כאשר כוחות צדדיים מופעל עליו. כדי למנוע זאת, המחט חייב לנוע לאורך ציר הזריקה בדרך ישרה. לעיתים, ניתן לחסום את הקפילר על ידי שאריות רקמות המונעות מהנוזל לזרום. ניתן לחסום את המחט באמצעות הסגת הקצה בעדינות בזמן הזרקת. אם זה לא משפר את הזרימה, אנו ממליצים למשוך לחלוטין את המחט מתוך החזה ולהחליף את המחט.
נגעים יכולים להיגרם על ידי מחט מוכנס עמוק מדי קרום הלב. כדי למנוע נגעים בכיס הלב, אין להוסיף את המחט יותר מדי (1-2 מ"מ) לתוך החזה. כמה דליפות נצפו כאשר נפח ההזרקה היה גדול מ 8 μL.
בדגי השדג, ההרכב המדויק של נוזל החיוג לקרום הלב אינו ידוע. עם זאת, הנפח של החלל לחייג הלב מוערך על ~ 10 μL31. בהינתן כי הנפח של החדר המבוגר דג זברה הוא כ 1-2 מ"מ3, אנו מניחים כי החלל לחייג הלב בהתאם יש נפח זעיר, אשר יש לשקול לפני זריקות. ממחקרים ראשוניים שלנו, קבענו כי הטווח האופטימלי של נפח הוזרק הוא בין 0.5 ו 3 μL עבור דגים מדידת 2.5-2.8 ס מ (מרחק מהחוטם אל הדוד מדווש). אמצעי אחסון זה ניתן להתאמה בהתאם לגודל הדג. הזרקה של עד 5 μL לא לגרום לפגיעה בדגים בגודל זה. עם זאת, אמצעי אחסון מ-8 μL היו מספיקים כדי לגרום לדימום בולטות ופנימי כפי שמוצג באיור 1F. בהתבסס על נתונים אלה, אנו מעריכים כי כמות של פתרון גדול יותר מ 3 μL עלול לגרום ללחץ פיסי ופיזיולוגי על האיבר. מגבלה זו מסיק את הצורך לבחור ריכוז גבוה יותר של מולקולות במקום להגדיל את כמות הפתרון המוזרק.
גורם חשוב נוסף הוא המאפיין האוסמוטי של הפתרון המוזרק, שאמור להיות בטווח הפיזיולוגי. אכן, כדי למנוע סיכון של מתח אוסמוטי, אנו ממליצים על HBSS כמו בינוני הזרקה.
ב zebrafish, השיטות הנפוצות המשמשות להעברת הסמים הם באמצעות טיפול במים והזרקת הצפק הפנימי30,35. למרות שתי טכניקות אלה מתאימים יישומים רבים, זריקות IT לספק יתרונות ניסיוניים וכלכליים, על ידי הפחתת הסיכונים של תופעות לוואי מערכתית לא רצויות וצמצום השימוש של מולקולות יקרות, בהתאמה. שיטה זו יכולה להיות מתאימה למסירה של טממוקסיפן כדי להפעיל את מערכת הטרנסגניים של ERT2 המשמש לניתוח שושלת היוחסין של התא, והמדריך שונה RNAs למחקרים פונקציונליים במחקר התחדשות.
שיטת הזרקת IT ב דג זברה תוארה קודם לכן31,36. בדוחות אלה, זריקות תוך-החזה בוצעו עם מחט אינסולין, בדקירה מהצד הקדמי. לעומת זאת, הפרוטוקול שלנו מציג אסטרטגיה חלופית עם נימי הזכוכית הנמשכים מכיוון הכיוון האחורי. באופן ספציפי, הגישה שלנו לוקח בחשבון את האנטומיה של קרום הלב של הדג כדי למטב את הזריקה עם סיכון מופחת של ניקוב לב. יתר על כן, במהלך ההליך, הדג אינו מוחזק על ידי מלקחיים מתכתיים, אלא על ידי ספוג לח ורך, שהיא שיטה מתאימה יותר כדי למנוע פציעה חיצונית של הדג. כך, השיטה המוצגת עשוי להיות מתאים יותר למחקרים של הומאוסטזיס לב, טרום התניה והתחדשות ב zebrafish מבוגרים.
זריקות IT כבר הוקמו אורגניזמים מודל היונקים. אכן, שיטה זו הוחל גם ניסויים עם חזירים ומחקרים קליניים בבני אדם37,38. בעכברים, העברת הזרקת שריר הלב מונחה על ידי האולטרה סאונד שימשו לאתגר את הלב שלהם39. בתוך מאמר זה אנו מציעים פרוטוקול מפורט כדי להקל על השימוש הזרקת ה-IT עבור דג zebrafish. זה יהיה יקר במיוחד לתחום, על מנת להשלים גישות גנטיות בהומאוסטזיס הלב, מיזוג מראש ומחקר התחדשות.
Disclosures
. למחברים אין מה לגלות
Acknowledgements
אנו מודים ל-V. צימרמן לקבלת סיוע טכני מעולה ולטיפול בדגים, ד. König (אוניברסיטת פריבורג) לקריאה קריטית של כתב היד, ד. קרסלר (אוניברסיטת פריבורג) לקבלת עזרה עם סינתזה של חלבון zCNTF, פ. רוג'ירו (מכון הבריאות) הפוננל דה ליון) למתן נוגדן ColXII, ו פ. מרטין (אוניברסיטת בריסטול) עבור נוגדן ל-plastin. אנו מודים למרכז ההדמיה ולפלטפורמת הפרוטאומניקס באוניברסיטת פריבורג. עבודה זו נתמכת על ידי הקרן הלאומית למדע השוויצרי, הענק מספר 310030_179213, ועל ידי הSchweizerische הרצפלד (קרן הלב השוויצרית).
Materials
| Name | Company | Catalog Number | Comments |
| Hanks Balanced Salt Solution | Gibco by Life technology | 14065-056 | |
| Iridectomy scissor | Roboz Surgical Instruments Co | RS-5602 | |
| Macroscope (binocular) | M400 | with Apozoom | |
| Micro-injector femtojet | Eppendorf | 5247 0034 77 | |
| Microloaders femtotips | Eppendorf | 5242 956.003 | |
| Micropipette glass needles type C | WPI | TW100F-6 | thin-wall capillary |
| Micropipette puller model P-87 | Flaming/Brown | 20081016 | filament box 2.5 mm x 4.5 mm |
| Sponge | any | any | dim. carved sponge 7cm x 3 cm x 1 cm |
| Tricaine (Anestethic) | Sigma | E10521 | |
| Dyes and Antibodies | Company | Catalog Number | Comments |
| anti-Chicken Cy5 | Jackson ImmunoResearch Laboratories | Concentration: 1/500 | |
| anti-Guinea pig Cy5 | Jackson ImmunoResearch Laboratories | Concentration: 1/500 | |
| anti-Rabbit Cy5 | Jackson ImmunoResearch Laboratories | Concentration: 1/500 | |
| Chicken l-plastin | gift from P. Martin, Bristol | Concentration: 1/1,000 | |
| DAPI | Sigma | 10236276001 | Concentration: 1/2,000 (1µg/ml); 1/100 IT injected |
| Guinea pig anti-ColXII | gift from Florence Ruggerio, Lyon | Concentration: 1/500 | |
| Phalloidin-Atto-565 (F-actin) | Sigma | 94072 | Concentration: 1/500 |
| Phalloidin-Atto-647 (F-actin) | Sigma | 95906 | Concentration: 1/50 IT injected |
| Rabbit anti-MCM5 | gift from Soojin Ryu, Heidelberg | Concentration: 1/500 | |
| Stamping Ink 4K | Pelikan | 1 4k 351 197 | Concentration: 1/1 |
| ISH probe primers | |||
| Cystatin | gene number: ENSDARG00000074425 fw primer: GATTCACTGTCGGGTTTGGG Rev primer: ATTGGGTCCATGGTGACCTC |
References
- Tzahor, E., Poss, K. D. Cardiac regeneration strategies: Staying young at heart. Science. 356 (6342), 1035-1039 (2017).
- Iismaa, S. E., et al. Comparative regenerative mechanisms across different mammalian tissues. npj Regenerative Medicine. 3 (1), (2018).
- Xiang, M. S. W., Kikuchi, K. Endogenous Mechanisms of Cardiac Regeneration. Int Rev Cell Mol Biol. 326, 67-131 (2016).
- González-Rosa, J. M., Burns, C. E., Burns, C. G. Zebrafish heart regeneration: 15 years of discoveries. Regeneration. 4 (3), 105-123 (2017).
- Jazwinska, A., Sallin, P. Regeneration versus scarring in vertebrate appendages and heart. The Journal of Pathology. 238 (2), 233-246 (2016).
- Sehring, I. M., Jahn, C., Weidinger, G. Zebrafish fin and heart: what's special about regeneration?. Current Opinion in Genetics & Development. 40, 48-56 (2016).
- Rubin, N., Harrison, M. R., Krainock, M., Kim, R., Lien, C. L. Recent advancements in understanding endogenous heart regeneration-insights from adult zebrafish and neonatal mice. Seminars in Cell and Developmental Biology. 58, 34-40 (2016).
- Chablais, F., Veit, J., Rainer, G., Jazwinska, A. The zebrafish heart regenerates after cryoinjury-induced myocardial infarction. BMC Developmental Biology. 11, 21 (2011).
- Schnabel, K., Wu, C. C., Kurth, T., Weidinger, G. Regeneration of cryoinjury induced necrotic heart lesions in zebrafish is associated with epicardial activation and cardiomyocyte proliferation. PLoS One. 6 (4), e18503 (2011).
- Gonzalez-Rosa, J. M., Martin, V., Peralta, M., Torres, M., Mercader, N. Extensive scar formation and regression during heart regeneration after cryoinjury in zebrafish. Development. 138 (9), 1663-1674 (2011).
- Poss, K. D., Wilson, L. G., Keating, M. T. Heart regeneration in zebrafish. Science. 298 (5601), 2188-2190 (2002).
- Cao, J., Poss, K. D. The epicardium as a hub for heart regeneration. Nature Reviews Cardiology. 15 (10), 631-647 (2018).
- Andres-Delgado, L., Mercader, N. Interplay between cardiac function and heart development. Biochim Biophys Acta. 1863, 1707-1716 (2016).
- Richardson, R. J. Parallels between vertebrate cardiac and cutaneous wound healing and regeneration. npj Regenerative Medicine. 3, 21 (2018).
- Lai, S. -. L., Marín-Juez, R., Stainier, D. Y. R. Immune responses in cardiac repair and regeneration: a comparative point of view. Cellular and Molecular Life Sciences. , (2018).
- Kikuchi, K., et al. Primary contribution to zebrafish heart regeneration by gata4(+) cardiomyocytes. Nature. 464 (7288), 601-605 (2010).
- Jopling, C., et al. Zebrafish heart regeneration occurs by cardiomyocyte dedifferentiation and proliferation. Nature. 464 (7288), 606-609 (2010).
- Pfefferli, C., Jaźwińska, A. The careg element reveals a common regulation of regeneration in the zebrafish myocardium and fin. Nature Communications. 8, 15151 (2017).
- Sánchez-Iranzo, H., et al. Tbx5a lineage tracing shows cardiomyocyte plasticity during zebrafish heart regeneration. Nature Communications. 9 (1), (2018).
- Wang, J., Poss, K. D. Methodologies for Inducing Cardiac Injury and Assaying Regeneration in Adult Zebrafish. Methods In Molecular Medicine. 1451, 225-235 (2016).
- Gut, P., Reischauer, S., Stainier, D. Y. R., Arnaout, R. Little Fish, Big Data: Zebrafish as a Model for Cardiovascular and Metabolic Disease. Physiological Reviews. 97 (3), 889-938 (2017).
- de Preux Charles, A. S., Bise, T., Baier, F., Marro, J., Jazwinska, A. Distinct effects of inflammation on preconditioning and regeneration of the adult zebrafish heart. Open Biology. 6 (7), (2016).
- de Preux Charles, A. S., Bise, T., Baier, F., Sallin, P., Jazwinska, A. Preconditioning boosts regenerative programmes in the adult zebrafish heart. Open Biology. 6 (7), (2016).
- Bise, T., de Preux Charles, A. S., Jazwinska, A. Ciliary neurotrophic factor stimulates cardioprotection and the proliferative activity in the zebrafish adult heart. npj Regenerative Medicine. 4, (2019).
- Thorimbert, V., Konig, D., Marro, J., Ruggiero, F., Jazwinska, A. Bone morphogenetic protein signaling promotes morphogenesis of blood vessels, wound epidermis, and actinotrichia during fin regeneration in zebrafish. The FASEB Journal. 29 (10), 4299-4312 (2015).
- König, D., Page, L., Chassot, B., Jaźwińska, A. Dynamics of actinotrichia regeneration in the adult zebrafish fin. Developmental Biology. 433 (2), 416-432 (2018).
- Sallin, P., Jaźwińska, A. Acute stress is detrimental to heart regeneration in zebrafish. Open Biology. 6 (3), 160012 (2016).
- Mokalled, M. H., Poss, K. D. A Regeneration Toolkit. Developmental Cell. 47 (3), 267-280 (2018).
- Pugach, E. K., Li, P., White, R., Zon, L. Retro-orbital Injection in Adult Zebrafish. Journal of Visualized Experiments. (34), e1645 (2009).
- Kinkel, M. D., Eames, S. C., Philipson, L. H., Prince, V. E. Intraperitoneal Injection into Adult Zebrafish. Journal of Visualized Experiments. (42), (2010).
- Xiao, C., et al. Nanoparticle-mediated siRNA Gene-silencing in Adult Zebrafish Heart. Journal of Visualized Experiments. (137), (2018).
- Chablais, F., Jazwinska, A. Induction of myocardial infarction in adult zebrafish using cryoinjury. Journal of Visualized Experiments. (62), (2012).
- Gonzalez-Rosa, J. M., Mercader, N. Cryoinjury as a myocardial infarction model for the study of cardiac regeneration in the zebrafish. Nature Protocols. 7 (4), 782-788 (2012).
- Marro, J., Pfefferli, C., de Preux Charles, A. S., Bise, T., Jazwinska, A. Collagen XII Contributes to Epicardial and Connective Tissues in the Zebrafish Heart during Ontogenesis and Regeneration. PLoS One. 11 (10), e0165497 (2016).
- Ma, X., Ding, Y., Wang, Y., Xu, X. A Doxorubicin-induced Cardiomyopathy Model in Adult Zebrafish. Journal of Visualized Experiments. (136), (2018).
- Diao, J., et al. PEG-PLA nanoparticles facilitate siRNA knockdown in adult zebrafish heart. Developmental Biology. 406 (2), 196-202 (2015).
- Lloyd, L. C., Etheridge, J. R. The pathological and serological response induced in pigs by parenteral inoculation of Mycoplasma hyopneumoniae. Journal of Comparative Pathology. 91 (1), 77-83 (1981).
- Zhou, A., Guo, L., Tang, L. Effect of an intrathoracic injection of sodium hyaluronic acid on the prevention of pleural thickening in excess fluid of tuberculous thoracic cavity. Clinical and Experimental Pharmacology and Physiology. 30 (3), 203-205 (2003).
- Prendiville, T. W., et al. Ultrasound-guided Transthoracic Intramyocardial Injection in Mice. Journal of Visualized Experiments. (90), (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved