Method Article
זיהום חוזר בדרכי השתן של Escherichia coli שנגרם על ידי גרדנרלה וגינליס חשיפה לשלפוחית השתן בעכברים
In This Article
Summary
מודל עכברי של חיסון אורופתוגני E. coli (UPEC) טרנס-urethral כדי ליצור מאגרי שלפוחית שתן תוך-תאיים סמויים וחשיפה שלפוחית השתן לאחר מכן ל - G. vaginalis כדי לגרום ל- UPEC UTI חוזר ונשנה מודגם. כמו כן הודגמו ספירה של חיידקים, ציטולוגיה של שתן, וקיבוע ועיבוד שלפוחית השתן באתרם לסריקת מיקרוסקופיית אלקטרונים.
Abstract
דלקות חוזרות ונשנות בדרכי השתן (rUTI) הנגרמות על ידי Escherichia coli (UPEC) אורופתוגנית הן שכיחות ויקרות. מאמרים קודמים המתארים מודלים של UTI בעכברים זכרים ונקבות המחישו את ההליכים לחיסון חיידקים ולספירתם בשתן וברקמות. במהלך זיהום ראשוני בשלפוחית השתן בעכברי C57BL/6, UPEC מקימה מאגרים סמויים בתוך תאי אפיתל של שלפוחית השתן שנמשכים לאחר פינוי של חיידקי UPEC. מודל זה מתבסס על מחקרים אלה כדי לבחון rUTI הנגרם על ידי הופעתה של UPEC מתוך מאגרי שלפוחית שתן סמויים. החיידק האורוגניטלי Gardnerella vaginalis משמש כטריגר של rUTI במודל זה מכיוון שהוא נמצא לעתים קרובות בדרכי האורגניטל של נשים, במיוחד בהקשר של דיסביוזיס נרתיקי שנקשר עם UTI. בנוסף, מתוארת גם שיטה לקיבוע שלפוחית השתן באתרה ולאחריה ניתוח מיקרוסקופיית אלקטרונים סורקת (SEM) של רקמת שלפוחית השתן, עם יישום פוטנציאלי למחקרים אחרים המערבים את שלפוחית השתן.
Introduction
זיהומים בדרכי השתן (UTI) מטילים נטל בריאותי משמעותי ברחבי העולם, ומשפיעים על איכות חייהם של מיליוני אנשים מדי שנה, במיוחד נשיםבנות 1. Escherichia coli אורופתוגני (UPEC) הם הגורם השכיח ביותר ל- UTI1. חולים רבים (כ-20-30%) המפתחים UTI יחוו UTI חוזר (rUTI) תוך 6 חודשים למרות אישור בתיווךאנטיביוטי של הזיהום הראשוני 2. למרבה הצער, עד 5% מהנשים לפני גיל המעבר סובלות מ-3 rUTI או יותר בכל שנה 3,4. אפיזודות עוקבות של rUTI יכולות להיגרם על ידי התמדה של אותו זן UPEC ממקרה המדד 5,6,7,8. נתונים מדגימות אנושיות וממודלים של עכברים מצביעים על כך ש-rUTI באותו זן יכול להיגרם על-ידי UPEC השוכנת בתוך מאגרים שקטים בשלפוחית השתן. בבני אדם, UPEC זוהו בתאי אפיתל ובביופסיות של שלפוחית השתן של חולים עם UTI 9,10,11,12,13. מחקרים בעכברי C57BL/6 הראו כי זנים מסוימים של UPEC יכולים להקים מאגרים תוך-תאיים תוך-תאיים בשלפוחית השתן, כפי שזוהו על ידי מיקרוסקופיה פלואורסצנטית ועל ידי הומוגניזציה ותרבית של רקמת שלפוחית השתן, שנשמרים במשך חודשים לאחר רזולוציה של בקטריוריה 14,15,16. טיפול בשלפוחית השתן עם חומרים הגורמים לפילינג של אפיתל שלפוחית השתן (urothelium), למשל פרוטאמין סולפט17 או chitosan18, לגרום להופעת UPEC ממאגרים לגרום rUTI. נתונים אלה מצביעים על כך שבנשים המחזיקות במאגרי UPEC של שלפוחית השתן כתוצאה מזיהום קודם, חשיפות לשלפוחית השתן שמובילות לפילינג אורותליאלי עלולות לגרום ל-rUTI.
ישנן עדויות הולכות וגוברות לכך שהמיקרוביוטה הנרתיקית תורמת לזיהום בדרכי השתן19,20. Gardnerella vaginalis הוא חבר שכיח הן במיקרוביוטה הנרתיקית והן במיקרוביוטה של השתן 21,22,23,24,25,26,27,28,29. בנרתיק, נוכחות של רמות גבוהות של G. vaginalis קשורה עם דיסביוזה מיקרוביאלית המכונה נרתיק חיידקי (BV), אשר משפיע על ~ 30% מהנשים 30,31,32. נשים עם BV נמצאות בסיכון גבוה יותר לחוות UTI בהשוואה לנשים עם קהילה נרתיקית הנשלטת על ידי לקטובצילוס 33,34,35,36,37. במודלים של עכברים, G. vaginalis גורם לפילינג אפיתל הן בנרתיק38 והן בשלפוחית השתן39. בעכברים C57BL/6 המחזיקים במאגרי שלפוחית השתן של UPEC, שתי חשיפות רצופות של שלפוחית השתן ל-G. vaginalis - אך לא ל-PBS - גורמות לעלייה מחודשת של UPEC ממאגרים כדי לגרום ל-UPEC rUTI. הופעתה מעידה על הופעתם של טיטרים של UPEC בשתן מעכברים שפתרו בעבר את חיידקי UPEC וירידה לאחר מכן בטיטרים הומוגנטיים של שלפוחית השתן של UPEC בהקרבה בהשוואה לחיות בקרה שנחשפו ל-PBS39. באופן מעניין, אין התיישבות מתמשכת על ידי G. vaginalis בשלפוחית השתן. ברוב המכריע של המקרים, שתי חשיפות קצרות, שלכל אחת מהן פחות מ-12 (h) של G. vaginalis בר קיימא בשתן, מספיקות כדי לעורר פילינג אורותליאלי ולקדם rUTI.
פרוטוקול זה מתאר מודל עכברי של rUTI הנגרם על ידי UPEC השוכן במאגרי שלפוחית השתן התוך תאיים, תוך שימוש בחיסון שלפוחית השתן G. vaginalis כדי לגרום להישנות המחלה. ההתקדמות שהושגה על ידי מודל זה היא כי G. vaginalis הוא טריגר ביולוגי רלוונטי מבחינה קלינית של rUTI בהשוואה לחומרים כימיים בשימוש בעבר. יתר על כן, ההישרדות קצרת הימים יחסית של G. vaginalis בדרכי השתן של העכבר מאפשרת לבחון את ההשפעה של חשיפות מיקרוביאליות חולפות על האורותליום, כפי שעלול להתרחש לאחר פעילות מינית. בנוסף להתוויית מודל rUTI, פרוטוקול זה מתאר גם שיטות לציטולוגיה של השתן ולקיבוע והדמיה של שלפוחית השתן באתרה של האורותליום על ידי סריקת מיקרוסקופיית אלקטרונים (SEM).
פרוטוקול זה של UPEC UTI חוזר המושרה על ידי G. vaginalis משתמש בזן UPEC UTI89 הנושא קלטת עמידות לקנאמיצין (UTI89kanR)40. לא כל הזנים של UPEC שנבדקו הצליחו ליצור קהילות חיידקים תוך תאיות במהלך שלב ההדבקה החריפה בעכברים41 ועדיין לא ידוע אם לכל הזנים של UPEC יש את היכולת ליצור מאגרים תוך תאיים סמויים. יש לאשר את היווצרות המאגר לפני השימוש בזנים אחרים של UPEC במודל. פרוטוקול זה משתמש בבידוד G. vaginalis עמיד לסטרפטומיצין ספונטני, JCP8151BSmR38. אינדוקציה של rUTI על ידי JCP8151BSmR דורשת שני חיסונים רציפים של G. vaginalis , בהינתן 12 שעות או 7 ימים (d) בהפרששל 39. האם זנים אחרים של G. vaginalis גורמים לפילינג ו/או ל-UPEC rUTI עדיין יש לקבוע באמצעות מודל זה. חיוני להשתמש בזני UPEC ו-G. vaginalis עם עמידות ידועה לאנטיביוטיקה (כגון קנאמיצין או ספקטינומיצין עבור UPEC וסטרפטומיצין עבור G. vaginalis) מכיוון שניתן להוסיף אנטיביוטיקה לצלחות אגר כדי למנוע צמיחה של מיקרוביוטה של עכברים אנדוגניים שעלולים להפריע אחרת לספירת יחידות יוצרות מושבה (CFU) לניטור זיהום. זה חשוב במיוחד עבור גידול דגימות שתן, כי שתן של עכברים מכיל לעתים קרובות חיידקים אחרים שיכולים לגדול יתר על המידה על צלחות תרבית ללא אנטיביוטיקה. מקורם של חיידקים אנדוגניים אלה בשתן של עכברים אינו ידוע, אך ככל הנראה משקף חיידקים פריאוריתרליים ואורוגניטליים שנלקחו במהלך איסוף השתן.
G. vaginalis הוא חיידק אנאירובי פקולטטיבי, ולכן פרוטוקול זה מתאר גידול G. vaginalis JCP8151BSmR בתא אנאירובי. אם תא אנאירובי אינו זמין, ניתן להשתמש בשיטות אחרות לשמירה על תנאי גדילה אנאירוביים (כגון שקית GasPak במיכל אטום). לחלופין, זנים מסוימים של G. vaginalis (כולל JCP8151BSmR) יגדלו בחממת תרביות רקמה סטנדרטית (5% CO2). בדיוק כפי ששימוש בזני G. vaginalis שאינם JCP8151BSmR דורש בדיקה כדי לוודא שהחיידקים מתנהגים באופן דומה במודל זה, שינוי תנאי הגדילה דורש קביעה אמפירית של משכי זמן אידיאליים לתרבית (על צלחות ובנוזל) וצפיפות אופטית (OD)600 שווה ערך להשגת ריכוזי אינוקולום בני קיימא רצויים. יתר על כן, לא ידוע אם תנאי גדילה משפיעים על הפתוביולוגיה של G. vaginalis.
לבסוף, כאשר שוקלים אם להשתמש במודל זה, החוקרים צריכים להיות מודעים לכך שהוא יכול לדרוש מספר גדול יותר של בעלי חיים לכל קבוצה מאשר מודלים טיפוסיים של עכברי UTI. זאת, בין היתר, משום שאינדוקציה של rUTI דורשת מהעכברים לפתור את הבקטריוריה של UPEC הנגרמת על ידי הזיהום הראשוני של שלפוחית השתן. לפיכך, כל עכבר שאינו מצליח לנקות בקטריוריה (פנוטיפ המעיד בדרך כלל על זיהום כליות מתמשך) אינו נכלל בשלב rUTI של הפרוטוקול. מספר העכברים הדרושים להפעלת מחקרים אלה מושפע גם משיעור הופעת UPEC "ספונטנית" בשתן (12-14% בממוצע). לבסוף, לזני עכברים שונים יש נטיות שונות לפתח בקטריוריה כרונית לעומת היווצרות מאגרים תוך-תאיים42,43. אם משתמשים בזני עכברים שאינם C57BL/6 במודל זה, יש לוודא כי בעלי החיים מפתחים מאגרים תוך תאיים של UPEC.
Protocol
הוועדה המוסדית לטיפול ושימוש בבעלי חיים באוניברסיטת וושינגטון (IACUC) אישרה את כל הזיהומים והנהלים בעכברים כחלק ממספר הפרוטוקול 20170081, שתוקפו פג ב-06/09/2020, וב-20-0031, שתוקפו פג ב-18/03/2023. הטיפול הכולל בבעלי החיים עלה בקנה אחד עם המדריך לטיפול בחיות מעבדה ושימוש בהן ממועצת המחקר הלאומית ומדריך המשאבים לטיפול בבעלי חיים של USDA. הליכי המתת חסד עולים בקנה אחד עם הנחיות AVMA להמתת חסד של בעלי חיים: מהדורת 2020.

איור 1. סכמות של מודל העכבר. ציר הזמן מודגש כדי לשקף את השלבים או ההליכים של המודל המתוארים בפרוטוקול. שלב 1 (כתום): הקמת מאגרי UPEC תוך תאיים. עכברים מחוסנים באופן טרנס-וורתרלי ב-UPEC ודגימות שתן נאספות ומנוטרות לפינוי בקטריוריה. רק עכברים המנקה בקטריוריה ממשיכים לשלבים הבאים. שלב 2 (ירוק): חשיפה לשלפוחית השתן ל- G. vaginalis. עכברים מחוסנים באופן טרנס-וורתרלי עם G. vaginalis פעמיים. משך הזמן בין שתי החשיפות הרצופות הוא 12 שעות (לוח עליון) או שבוע (wk; פאנל תחתון), בהתאם לניתוח הרצוי במורד הזרם. שלב 3 (צהוב): UPEC rUTI. השתן נאסף מדי יום לאחר חשיפה ל-G. vaginalis ומנוטר עבור חיידקי UPEC. בנוסף, ניתן לאסוף את שלפוחית השתן והכליות בנקודת הקצה הניסיונית כדי למדוד את טיטר רקמות UPEC. במודל החשיפה למשך 1 שבועות, הופעתו של UPEC כתוצאה ממאגרים תוך-תאיים הנגרמת על-ידי G. vaginalis וההתרחקות שלאחר מכן מדרכי השתן משתקפים גם הם בירידה ברקמות שלפוחית השתן של UPEC (בהשוואה לעכברים שנחשפו ל-PBS, ראו איור 3D). ירידה זו בטיטרים של שלפוחית השתן לא ניכרה במודל החשיפה של 12 שעות, ככל הנראה משום שנדרש זמן רב יותר להופעת מאגר מספיק ולפינוי כדי להתרחש כדי להפחית באופן משמעותי את טיטר הרקמות. הליך A: ציטולוגיה של שתן מבוצעת בדרך כלל 1 dpi (או אפילו מוקדם יותר) במהלך שלב 1 כדי לבחון זיהום UPEC חריף ובמהלך שלב 3 כדי להעריך את תכולת PMN בשתן, אשר מתואמת עם הופעת UPEC. ניתן לנתח דגימות שתן שנאספו בנקודות זמן אחרות באופן דומה. הליך B: מיקרוסקופ אלקטרונים לסריקת שלפוחית השתן (SEM) לבחינת פילינג אורותל מתבצע בדרך כלל במודל של 12 שעות ב-3 שעות לאחר החשיפה השנייה ל-G. vaginalis (15 שעות לאחר מתן החשיפה הראשונה בזמן 0). ניתן גם להעריך נקודות זמן אחרות, כגון 6-24 שעות לאחר חיסון UPEC כפי שמוצג בשלב 1. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
1. להקים מאגרים תוך תאיים תוך-תאיים של UPEC בעכברים
- הכן קטטרים במתן שתן (עיין ב- 44,45,46,47 לסרטונים של שלב זה).
- חוט 30 מחטי מד עם אורך של צינורות PE10 המשתרעים מבסיס המחט למספר מ"מ מעבר לקצה המחט. הקפידו לא לנקב את הצינורות עם קצה המחט. לחלופין, יש להשתמש בצינוריות תוך ורידיות בילדים46.
- מניחים צנתרים מוכנים בצלחת פטרי ומעקרים עם אור UV למשך 30 דקות לפחות. החליפו את מכסה כלי הפטרי והקפידו על אחסון עד הצורך.
- הכן את האינוקולום של UPEC (יום -3 עד 0)
- יום -3: Streak UTI89kanR מ -80 מעלות צלזיוס מלאי מקפיא על צלחת אגר Luria-Bertani (LB). צלחת דגירה ב 37 °C (84 °F) למשך 18-24 שעות.
הערה: אין צורך להוסיף קנאמיצין למדיית הגידול של האינוקולום מכיוון שההתנגדות לקנאמיצין משולבת ביציבות ב- UTI89kanR. - יום -2: חסן 20 מ"ל של ציר LB בבקבוק סטרילי של 125 מ"ל עם מושבה אחת של UTI89kanR. אין להשתמש בבקבוקון קטן יותר מכיוון ששיטת תרבית זו חשובה כדי לגרום לביטוי של פילוס מסוג UPEC מסוג 1 הנחוץ להידבקות שלפוחית השתן.
- דגירה סטטית (ללא רעידות) בטמפרטורה של 37 מעלות צלזיוס למשך 18-24 שעות. אין להוסיף אנטיביוטיקה למדיום הגדילה. השתמשו רק במושבות טריות על צלחות LB (בנות 18-24 שעות) כדי להתחיל תרביות נוזליות.
- יום -1: תת-תרבות UTI89kanR על ידי הסרת 20 μL של תרבית (מערבולת בעדינות את הבקבוקון כדי להחיות חיידקים מיושבים) והוספת 20 מ"ל של ציר LB טרי בבקבוק סטרילי של 125 מ"ל. אינקובציה כמו בשלב 2, למעט משך חברה של 18 שעות. אין להוסיף אנטיביוטיקה למדיום הגדילה.
- יום 0: מעבירים תרבית שלמה לצינור של 50 מ"ל ומסובבים ב-3200 × גרם בצנטריפוגה שולחנית למשך 10 דקות כדי לכדור חיידקים. שאפו לסופרנטנט והחזירו את כדור החיידקים ב-10 מ"ל של PBS.
- הוסף 100 μL של תרחיף החיידקים המרוכז משלב 4 עד 900 μL של PBS בקובטה וקבע את הצפיפות האופטית ב- 600 ננומטר (OD600) באמצעות ספקטרופוטומטר שהתרוקן באמצעות PBS. הכפל את ערך הספקטרופוטומטר ב- 10 (כדי להסביר את הדילול) כדי לקבוע את OD600 של ההשעיה (מתלה OD).
- כדי להשיג את ריכוז האינוקולום הרצוי של 1 x 107 CFU ב-50 μL, לדלל (או לרכז) את תרחיףה-kanR UTI89 באמצעות המשוואה הבאה, שבהאינוקולום OD הרצוי הוא 0.35 (הערך עשוי להשתנות עבור זנים אחרים של UPEC) ו-Y הוא נפח האינוקולום הנדרש (100 μL לעכבר כדי לאפשר תוספת לסילוק בועות ומילוי הצנתרים):
X mL xמתלה OD = Y mL x ODאינוקולום
לדוגמה, אם ערךההשעיה של OD הוא 4.7 ו- 5 מ"ל של אינוקולום נדרשים:
X mL × 4.7 = 5 × 0.35
X = (5 × 0.35) / 4.7
X = 0.372 מ"ל
לכן, הוסף 372 μL של תרחיף חיידקים כדי ליצור 5 מ"ל (נפח סופי) - השתמש בפיפטה רב-ערוצית כדי ליצור דילולים סדרתיים של 1:10 של האינוקולום החוצה ל-10-6 ב-PBS סטרילי בצלחת של 96 בארות. זהה חמישה שכפולים של 10 μL של כל 6 הדילולים על צלחת LB ו- LB+kan, אפשר לכתמים להתייבש, ודגירה בטמפרטורה של 37 מעלות צלזיוס במהלך הלילה. צלחת ה-LB ללא אנטיביוטיקה משמשת כדי להבטיח שהאינוקולום לא היה מזוהם על ידי אורגניזם אחר (מה שיופיע כמורפולוגיה נוספת של המושבה שאינה קיימת על צלחת הבחירה האנטיביוטית של קאן). שני סוגי הלוחות אמורים להניב את אותה תוצאה.
הערה: יש לאפשר לצלחות להתייבש על הספסל במשך יום לפני השימוש, כך שהן יספגו את הנוזל המצופה ללא כתמים מתלכדים. - ספרו את המספר הכולל של המושבות בכל נקודות הדילול עם מושבות הניתנות להבחנה והשתמשו בערך כדי לחשב את מינון האינוקולום בפועל המשמש בכל ניסוי. אל תסתמך רק על ערכי OD600 .
- יום -3: Streak UTI89kanR מ -80 מעלות צלזיוס מלאי מקפיא על צלחת אגר Luria-Bertani (LB). צלחת דגירה ב 37 °C (84 °F) למשך 18-24 שעות.
- חסן UTI89kanR לתוך שלפוחית השתן של נקבות עכברים מורדמות (יום 0)
הערה: הקלטות וידאו של הליך זה פורסמו בעבר44,46. עיין במאמרים אלה לקבלת תיאור מעמיק יותר. ראה סעיף 5 של פרוטוקול זה לקבלת פרטים נוספים על צנתור עכבר.- הרדמה עכברים באמצעות שאיפת איזופלורן על פי שיטות שאושרו על ידי IACUC.
- בזמן שהם ממתינים לעכברים שירדימו, מלאו את מזרק השחפת באינוקולום UTI89kanR ולאחר מכן הצמידו קטטר מוכן. לדכא את הבוכנה כדי לרוקן אוויר מהקטטר, ואז לייבש את הצנתר לתוך חומר סיכה כירורגי סטרילי.
- מקם את העכבר על גבו ואישר את ההרדמה על ידי לחיצה חזקה על משטח כף הרגל של העכבר והתבוננות בהיעדר רפלקס או תגובה. אתרו את שלפוחית השתן (מרגישה כמו אפונה בבטן התחתונה) בין המצחים של כל יד. להביע שתן על ידי הזזת אצבעות אחד כלפי השני כדי להפעיל לחץ סחיטה עדין על שלפוחית השתן.
- החדירו את הצנתר דרך שופכת העכבר לתוך שלפוחית השתן והעבירו באיטיות 50 μL של אינוקולום.
- המתן מספר שניות ולאחר מכן הסר בעדינות את הצנתר על ידי משיכה ישר החוצה. מחזירים את העכבר לכלוב שלו ומנטרים עד שהוא מתאושש מהרדמה.
- חזור על שלבים 1.3.1 - 1.3.5 עם עכברים נוספים, תוך שינוי הצנתר בין כלוב (5 עכברים). אם רוצים, ניתן להשתמש באותו הליך כדי לחסן קבוצת ביקורת של עכברים עם PBS, למשל כדי להראות זן נוסף של G. vaginalis מעורר rUTI (מעל רמת הספונטנית/רקע).
2. ניטור פינוי של חיידקי UPEC (ימים 1 עד 28)
הערה: וידאו של הליך איסוף השתן פורסם בעבר44.
- לאסוף שתן (מינימום 10 μL) מכל העכברים על ידי מישוש שלפוחית השתן כמתואר44 ב 1 d לאחר זיהום ושבועית עבור 4 שבועות (7, 14, 21 ו 28 d לאחר ההדבקה). שתן צריך להיות תרבית בתוך כמה שעות של איסוף על מנת לפקח על זיהום UPEC. יש לאחסן שתן בטמפרטורה של 4 מעלות צלזיוס עד למצופה. שתן יכול לשמש גם לציטולוגיה (ראה סעיף 4). מדי פעם אם שלפוחית השתן מודלקת מאוד, לא ניתן להשיג 10 μL של שתן; במקרה זה ניתן להוסיף PBS עד 10 μL, אך יש להתאים את ציוני הטיטר והציטולוגיה של חיידקי השתן בהתאם (למשל, אם נאספים רק 5 μL שתן ו-5 μL PBS מתווסף, הכפל את הטיטרים והציונים ב-2).
- עם פיפטה רב ערוצית, בצע דילולים סדרתיים של 1:10 עד 10-6 ב- PBS סטרילי בצלחת של 96 בארות. השתמש בפיפטה רב-ערוצית P10 כדי לזהות 10 μL של כל 6 הדילולים מעמודה 1 בכיוון אנכי בקצה השמאלי של לוחית LB המכילה את סמן הבחירה האנטיביוטי הרלוונטי. השליכו טיפים.
- חזור על הציפוי עם הדוגמאות הנותרות (עמודה 2, ואז עמודה 3 וכו '). צלחת אחת יכולה להכיל 5 דוגמאות זו לצד זו. זה מייצר צלחת עם מטריצה של 5 × 6 ספוטים, עם דילולים הולכים וגדלים מלמעלה למטה ומספרי דגימה הולכים וגדלים משמאל לימין (איור 2A).
- אפשרו לכתמים להתייבש על הספסל, ולאחר מכן דגירה בטמפרטורה של 37 מעלות צלזיוס למשך הלילה. למחרת, ספרו את מספר המושבות במקום הכי פחות מדולל שבו המושבות נבדלות זו מזו (איור 2B) והשתמשו במספר זה כדי לחשב CFU/mL:
# של מושבות בכתם שתן יחיד × גורם דילול × 100 = CFU /mL שתן - תרשים UTI89kanR שתן titers באמצעות תוכנת גרפים (איור 2C). זהה עכברים שאין להם UTI89kanR הניתן לזיהוי בשתן ב-28 ד' (כ-65-80% מעכברי C57BL/6). לעכברים אלה יש מאגרים תוך-תאיים שקטים והם משמשים בשלב הניסוי הבא לבחינת אינדוקציה של UTI חוזר. אלה עם חיידקים בשתן ב 28 d אינם נכללים בשלבים הבאים.
3. חשיפות שלפוחית השתן ל-G. vaginalis
- הקצאת עכברים לקבוצות חשיפה (יום 29). המטרה העיקרית של שלב זה היא להימנע מכך שכל העכברים עם בקטריוריה ממושכת יותר יהיו יחד באותה קבוצת חשיפה, שכן לא ידוע אם זה משפיע על הסבירות של rUTI.
- באמצעות נתוני CFU בשתן (איור 2D), סווגו את העכברים על סמך נקודת הזמן שבה UTI89kanR bacteriuria כבר לא היה ניתן לזיהוי (איור 2E).
- להפוך את העכברים באופן אקראי מכל קטגוריה לקבוצות החיסון של G. vaginalis או PBS; למשל, חצי מהעכברים שהתפנו לפני יום 7 מקבלים G. vaginalis ומחציתם יקבלו PBS; מחצית מהעכברים שפינו בין הימים 8 ל-14 יקבלו G. vaginalis ומחציתם יקבלו PBS וכו' (כמו באיור 2E).
- הכן G. vaginalis inoculum (כל השלבים מבוצעים בתא אנאירובי)
הערה: זמני הדגירה האידיאליים של תרבית משתנים בין זנים שונים של G. vaginalis, כאשר זנים מסוימים נכנסים לשלב הנייח ואפילו מתחילים למות מהר יותר מאחרים. זה חשוב במיוחד בהתחשב בכך שהרג G. vaginalis (JCP8151B) לא הצליח להפעיל rUTI39. לפיכך, זמני הדגירה צריכים להיקבע באופן אמפירי עבור זן נתון לפני ביצוע ניסויים בעכברים. לא ידוע אם זנים אחרים/כל הזנים של G. vaginalis יפעילו את אותן ההשפעות במודל זה.- זן Streak G. vaginalis מ-80 מעלות צלזיוס ציר מקפיא על צלחת NYCIII (ללא אנטיביוטיקה). צלחת דגירה ב 37 מעלות צלזיוס באופן אנאירובי במשך 24 שעות.
- בתא האנאירובי, לחסן 5 מ"ל של מדיה NYCIII אנאירובית עם לולאה של 1 μL של תאים (מושבה אחת אינה מספיקה) מלוח NYCIII ולדגום תרבית באופן סטטי ב 37 °C בתנאים אנאירוביים במשך 18 שעות. אין לכלול אנטיביוטיקה במדיום הגידול.
- קבע את ה- OD600 של התרבית באמצעות ספקטרופוטומטר.
- צנטריפוגה נפח מוגדר (X) של תרבות ב 9600 × g במשך דקה אחת ולשאוף את התקשורת. חשב את הנפח (Y) של PBS כדי להשעות מחדש את הכדור כדי להשיג את האינוקולום OD הרצוי כדי להשיג 108 CFU ב- 50 μL באמצעות המשוואה הבאה:
X mL ×תרבות OD = Y mL × ODinoculum לפתור עבור Y
Y = (X ml ×תרבות OD) / ODאינוקולום
הערה:אינוקולום OD עבור JCP8151BSmR הוא 5 אך יש לקבוע זאת באופן אמפירי עבור זנים אחרים של G. vaginalis . לדוגמה, אם מסתובבים 3 מ"ל של תרבית נוזלית לילה JCP8151BSmR עםתרבית OD = 2.0: Y = (3 מ"ל × 2.0) / 5.0; ולכן גלולה resuspend ב 1.2 mL PBS - מחזירים את גלולת החיידקים ב- PBS לריכוז הרצוי. דיללו באופן סדרתי וצלחו את האינוקולום (כפי שתואר בפרוטוקול ציפוי CFU לעיל) כדי לקבוע את מינון האינוקולום בפועל ששימש בכל ניסוי. אל תסתמך רק על ערכי OD.
- צנטריפוגה נפח מוגדר (X) של תרבות ב 9600 × g במשך דקה אחת ולשאוף את התקשורת. חשב את הנפח (Y) של PBS כדי להשעות מחדש את הכדור כדי להשיג את האינוקולום OD הרצוי כדי להשיג 108 CFU ב- 50 μL באמצעות המשוואה הבאה:
- ביום 29-31 לאחר חיסון UPEC, חסן עכברים מורדמים עם G. vaginalis או PBS כמתואר בשלב 1.3 לעיל. קבוצת ביקורת של PBS היא חיונית, שכן פעולת הצנתור של שלפוחית השתן עלולה לגרום לנזק ולפילינג אורותליאלי שיכולים לעורר מידה מסוימת של התחדשות מאגר UPEC. לפיכך, עכברים מחוסנים ב-PBS משמשים כבקרה שאליה משווים עכברים מחוסנים ב-G. vaginalis.
הערה: הקביעה הסופית של UPEC bacteriuria ב-28 d דורשת דגירה לילית של צלחת ה-CFU. לכן, המוקדם ביותר שניתן לבצע שלב זה הוא 29 ימים לאחר החיסון הראשוני של UPEC. במידת הצורך, החשיפה יכולה להינתן כבר ביום ה-31. החוקרים צריכים להיות עקביים בין הניסויים. - חזור על הכנת האינוקולום כדי לתת חיסון נוסף של G. vaginalis (או בקרת PBS) בנקודת הזמן הרצויה, כגון 12 שעות או 1 שבועות לאחר החיסון הראשון. חשיפה שנייה נחוצה מכיוון שחיסון יחיד עם G. vaginalis אינו גורם להופעת UPEC משמעותית39.
4. ניטור UTI חוזר של UPEC
- אספו שתן מעכברים בנקודות הזמן הרצויות לאחר כל חיסון של G. vaginalis (מומלץ 1, 2 ו-3 d לאחר החיסון).
- דילול סדרתי וצלחת שתן על צלחות סלקטיביות (למשל, LB+kanamycin) כדי לקבוע UTI89kanR CFU/mL. אם רוצים, ניתן גם לצפות דילולים בשתן על צלחות סלקטיביות (למשל, NYCIII + סטרפטומיצין של 1 מ"ג/מ"ל) כדי לקבוע G. vaginalis CFU/mL. עם זאת, G. vaginalis JCP8151BSmR נוקה מהשתן של רוב העכברים על ידי 12 שעות 39. לכן, נקודות זמן מוקדמות יותר יהיו נחוצות כדי לזהות את G. vaginalis ברוב העכברים.
- בנקודת הקצה הניסויית (למשל, 3 ד' לאחר החיסון השני של G. vaginalis), להקריב את העכברים על פי שיטות מאושרות (למשל, נקע צוואר הרחם בהרדמה איזופלורנית או שאיפת CO2) ולאסוף שלפוחית שתן וכליות לספירת CFU, כפי שתואר קודם לכן 44,46.
5. ציטולוגיה של השתן
הערה: ניתן לבצע הליך זה בכל נקודת זמן שבה רצויה הדמיה של התאים ו/או החיידקים הנמצאים בשתן. כפי שמצוין באיור 1, ציטולוגיה של שתן מבוצעת בדרך כלל ב-1 dpi (או אפילו מוקדם יותר) במהלך שלב 1 כדי לבחון זיהום UPEC חריף ובמהלך שלב 3 כדי להעריך את הנוכחות של תאים פולימורפונוקליאריים (PMN) בשתן המציגים הופעת UPEC.
- הוסף 10 μL של שתן ל 90 μL של PBS בקלטת cytofunnel עם מסנן מחובר ושקופית. (השיטה הפשוטה ביותר היא להשתמש בשארית הדילולים של 1:10 מהצלחת בת 96 הבאר המשמשת לעיגול שתן; ניתן להשתמש בדגימות אלה עד 24 שעות לאחר גידול השתן אם הן מאוחסנות בטמפרטורה של 4 מעלות צלזיוס). מניחים קלטות בציטו-צנטריפוגה ומסובבים ב-600-800 x גרם למשך 6 דקות עם תאוצה גבוהה.
- הסירו את המגלשות ואפשרו לייבוש למשך הלילה. למחרת, כתם עם ערכת צביעה המטולוגית (למשל, של רייט, גימסה, כולל מקבע) על פי פרוטוקול היצרן.
- נתח את השקופיות על ידי מיקרוסקופיית אור לנוכחות של PMNs ותאי אפיתל. אם תרצה בכך, ניתן יהיה להבקיע אותם באמצעות מדד ניקוד איכותי המבוסס על השפע של כל סוג תא הקיים בכל שדה ראייה בעל עוצמה גבוהה (לדוגמה, 0=אף אחד, 1=מעטים, 2=בינוני, 3=חזק). ודא שהאדם המנתח את השקופיות עיוור לקבוצות הניסוי כדי למזער את ההטיה הפוטנציאלית.
6. הדמיה של שלפוחיות על ידי סריקת מיקרוסקופיית אלקטרונים
הערה: הליך זה יכול להתבצע בכל נקודת זמן שבה ההדמיה של האורותל רצויה. כפי שמצוין באיור 1 (קופסאות סגולות), אינטראקציות UPEC-urothelial מוצגות בצורה הטובה ביותר בין 6 שעות ל-24 שעות לאחר חיסון UPEC במהלך שלב היווצרות המאגר, ופילינג אורותליאלי המופעל על-ידי G. vaginalis מוצג בצורה הטובה ביותר בין 3 שעות ל-12 שעות לאחר החשיפה השנייה ל-G. vaginalis .
- קיבוע שלפוחית השתן באתרו
- יש להכין את הקיבוע מיד לפני קציר שלפוחית השתן על ידי הוספת גלוטראלדהיד (2.5% סופי) ופרפורמלדהיד (2% סופי) ב-0.15 מ' חיץ נתרן קקודילט עם 2 מ"מ של CaCl2 ב-pH 7.4. השתמשו ב-paraformaldehyde וב-glutaraldehyde מאמפולות זכוכית שנפתחו לאחרונה, מכיוון ששני המקבעים מתחמצנים עם הזמן במיכלים שנפתחו.
אזהרה: גלוטארלדהיד הוא רעיל, מגרה נשימה וקורוזיבי; paraformaldehyde הוא דליק, מסרטן, מגרה ורעלן רבייה; נתרן קקודילאט הוא רעיל ומסרטן. - כדי לייצר 50 מ"ל של תמיסה מקבעת, הוסיפו 6.25 מ"ל של 16% פרפורמלדהיד, 2 מ"ל של 50% גלוטארלדהיד, ו-16.75 מ"ל של מים אולטרה-פורים ל-25 מ"ל של תמיסת 0.3 מ' של נתרן קקודילאט ב-pH 7.4 עם 4 mM CaCl2.
- מחממים את הקיבוע המוכן ל-37 מעלות צלזיוס לפני מתן לשלפוחית השתן.
- ממלאים את מזרק ההחלקה של שחפת במזרק מקבע ומצמידים קטטר לקצה, משופע מול סימוני מזרק מנוגדים. חותכים את הצינורות העודפים 1-2 מ"מ מקצה המחט, נזהרים שלא לחשוף את קצה המחט. הזיזו את המזרק כדי להסיר בועות ולדחוף את הבוכנה לאוויר ריק ולמלא את הצנתר בקיבוע מעל צינור מיקרו-צנטריפוג' כדי לאסוף כל מקבע לסילוק נכון.
- להרדים ולהקריב את העכבר בשיטה מאושרת (למשל, פריקה של צוואר הרחם בהרדמה). הניחו את העכבר על משטח הניתוח כשהרגליים מאובטחות (עם גומיות או סיכות). פתח את אזור האגן של העכבר עם מלקחיים וזוג מספריים כירורגיים כדי לחשוף את שלפוחית השתן. יש לדחוף בזהירות הצידה את השומן הסמוך אך להשאיר את שלפוחית השתן במקומה.
- החזיקו את המזרק עם היד הדומיננטית כשהמחט מצביעה כלפי מטה וסימני המחט והמזרקים פונים הרחק מכם. טובלים את קצה הצנתר בחומר סיכה סטרילי.
- מקם את קצה הצנתר בפתח השופכה, והרחיק את קנה המזרק כשהוא ממוקם בזווית של 30-45° מעל גוף העכבר.
- הפעילו לחץ כלפי מטה בתנועה קטנה מאוד עם כיוון השעון עם הקצה והכניסו בעדינות את הצנתר לשופכה. כאשר קצה הצנתר נכנס לשופכה, צירו את המזרק לכיוון זנב העכבר תוך המשך החלקת הצנתר לתוך השופכה עד שקנה המזרק מקביל למשטח העבודה. כל מוט מחט הצנתר (לא כולל הבסיס) אמור להיכנס לעכבר, ולמקם את קצה הצנתר בתוך לומן שלפוחית השתן.
- לאט לאט לספק 50-80 μL של קיבוע, מה שגורם לשלפוחית השתן להתנפח כמו בלון. השאירו את הצנתר במקומו והרימו מעט את המזרק, תוך הטיית הקצה כלפי מעלה.
- עם היד השנייה, פותחים המוסטאט ומחליקים אחד מתחת למחט הצנתר בצומת של השופכה. סוגרים חלקית את ההמוסטאט עד שהוא פשוט יוצר מגע עם המחט.
- מחליקים בעדינות את מחט הצנתר אל מחוץ לשלפוחית השתן ובמקביל מהדקים ונועלים את ההמוטט לחלוטין כדי למנוע אובדן של הקיבוע.
- אחזה את ההמוטט כך שיהיה מקביל למשטח העבודה כאשר שלפוחית השתן מונחת על גביו. הרימו בעדינות ובזהירות את החתך מתחת להמוסטט (הצד הנגדי של שלפוחית השתן) כדי להסיר את שלפוחית השתן כאשר ההמוסטאט עדיין מחובר.
- מניחים את שלפוחית השתן ומחברים את המוסטאט לתוך צינור פלקון המכיל מקבע מחומם. יש לוודא כי שלפוחית השתן שקועה במלואה בנוזל ולא נלחצת אל דפנות הצינור. אינקובציה בטמפרטורה של 4 מעלות צלזיוס למשך 24 שעות.
- יש להכין את הקיבוע מיד לפני קציר שלפוחית השתן על ידי הוספת גלוטראלדהיד (2.5% סופי) ופרפורמלדהיד (2% סופי) ב-0.15 מ' חיץ נתרן קקודילט עם 2 מ"מ של CaCl2 ב-pH 7.4. השתמשו ב-paraformaldehyde וב-glutaraldehyde מאמפולות זכוכית שנפתחו לאחרונה, מכיוון ששני המקבעים מתחמצנים עם הזמן במיכלים שנפתחו.
- עיבוד והדמיה של שלפוחית השתן באמצעות מיקרוסקופיית אלקטרונים סורקת (SEM)
- חותכים את שלפוחית השתן בחוזקה עם סכין גילוח דו-צדדית מנוקה, ועושים חתך שני משיק להמוסטאט כדי לשחרר את שלפוחית השתן. התוצאה היא 2 "כוסות" של חצי שלפוחית השתן. אם קיימים רפידות שומן שנותרו בחלק החיצוני של שלפוחית השתן, הסירו אותן בעדינות.
- יש לשטוף את חצאי שלפוחית השתן שלוש פעמים (10 דקות כל אחד) במאגר נתרן קקודילט (0.15 מ', עמ' 7.4).
- הכתימו את הרקמה ב-1% אוסמיום טטרוקסיד ב-0.15 מ' של חיץ קקודילט למשך שעה אחת בטמפרטורת החדר. אוסמיום רגיש לאור; לכן, בצע שלב זה עם כלי ההכתמה עטוף בנייר כסף כדי לשמור על סביבה חשוכה.
אזהרה: אוסמיום טטרוקסיד הוא רעיל וקורוזיבי לעור. עשו את הצעד הזה במכסה האדים עם כפפות. - יש לשטוף את חצאי שלפוחית השתן שלוש פעמים (10 דקות כל אחד) במים אולטרה-פוריים. במהלך שלבים אלה, שמן מאוסמי ניתן לראות מתישהו על פני המים. לשאוף או לפתות את זה כדי למנוע זיהום במהלך שלבי הייבוש.
- לייבש רקמות על ידי שקיעה בסדרת אתנול מדורגת (50, 70, 90, 100 ו-100%) במשך 10 דקות כל אחת.
- מייבשים את הרקמה הקבועה באמצעות מייבש נקודה קריטית המבצע 12 החלפות CO2 במהירות האיטית ביותר. הגדר את כל ההגדרות הנוספות לאיטיות, למעט שלב האוורור המוגדר למהיר.
- חתכו כל שלפוחית שתן חצי שוב עם סכין גילוח דו-צדדי נקי כדי ליצור 4 חתיכות בסך הכל כדי להפחית את העקמומיות של הדגימה לציפוי יעיל יותר, להקלה על ההדמיה ב-SEM ולחשוף רקמה שאולי הסתלסלה במהלך הייבוש.
- הדביקו את חתיכות שלפוחית השתן ללשונית דבק פחמן מוליכה על גבי תיל אלומיניום וצבעו כמות קטנה של דבק כסף סביב המגע התחתון עם קיסם קיסם, תוך הקפדה על מניעת דבק עודף מלהתפתל על פני השטח הפנימיים של שלפוחית השתן.
- השתמשו במעיל פיזור ואקום גבוה כדי לפזר את הסטאבים של הדגימה ב-6 ננומטר של אירידיום. אם הדגימות ממשיכות להיטען, יש לוודא שהנתיב המוליך נצבע אל פני השטח בצבע כסף וציפוי עם 4 ננומטר נוספים של אירידיום.
- דמיינו את הדגימות במיקרוסקופ אלקטרונים סורק. בעוד שהתנאים עשויים להשתנות בהתאם למיקרוסקופ שבו נעשה שימוש, מתח מואץ של 3 KeV עם זרם קרן של 200 pA ומרחק עבודה של 12-13 מ"מ עבד היטב על צייס מרלין FE-SEM בעת שימוש בגלאי האלקטרונים אברהרט-ת'ורנלי (SE2).
תוצאות
לאחר החיסון, ניתן לזהות טיטרים של UPEC בשתן (איור 2B). כישלון לצלוח דגימות שתן במדיה סלקטיבית המכילה קנאמיצין יגרום ככל הנראה לצמיחת יתר של מיקרוביוטה של עכברים אנדוגניים המזהמת את השתן. רמת הבקטריוריה של UPEC תהיה ככל הנראה גבוהה ביום הראשון ועשויה לעלות במהלך השבוע הראשון לפני שתרד בנקודות זמן מאוחרות יותר (איור 2C). לכ-65-80% מהעכברים לא יהיה UPEC הניתן לזיהוי בשתן ב-28 dpi (איור 2C, עיגול ירוק). ניתן להשתמש בעכברים אלה בשלבים הבאים של המודל. עכברים שנותרו בקטריוריים (איור 2C, אליפסה אדומה) צריכים להיות מסולקים מהניסוי.
שתי חשיפות עוקבות של G. vaginalis בהינתן 12 שעות (איור 3A) או 1 שבועות זה מזה (איור 3B) גורמות להופעת UPEC ממאגרים תוך תאיים ולגרום לבקטריוריה חוזרת. הן רמת הבקטריוריה של UPEC (בדיקת מאן-וויטני) והן חלק העכברים המציגים UPEC rUTI (הבדיקה המדויקת של פישר) גבוהים משמעותית בעכברים שנחשפו ל-G. vaginalis בהשוואה לקבוצת הביקורת של PBS. ניתוח ציטולוגיה של שתן מזהה PMNs בשתן מעכברים שנחשפו ל-G. vaginalis שהפגינו הופעת UPEC (איור 3C). במודל עם שתי חשיפות שניתנו בהפרש של 1 שבועות זו מזו, טיטרים של UPEC ברקמת שלפוחית השתן נמוכים יותר בעכברים שנחשפו ל-G. vaginalis בהשוואה ל-PBS (איור 3D), ככל הנראה בשל הופעת UPEC ממאגרים ופינוי לאחר מכן.
הדמיה של רקמת שלפוחית השתן הקבועה באתרה על ידי SEM חושפת תאי מטריה שטחיים גדולים של השתן המצפים את פני השטח של שלפוחית השתן בעכברי בקרה שנחשפו רק ל-PBS (איור 4A). פילינג אורותליאלי מעיד על אובדן של תאי מטריה שטחיים, החושפים תאי אפיתל מעבר קטנים יותר בעכברים שנחשפו ל-G. vaginalis (איור 4B). בשלב מוקדם לאחר חיסון UPEC במהלך הקמת מאגרים תוך-תאיים, UPEC נראה על האורותליום וננעץ מתוך תאים מקלפים (איור 4C).
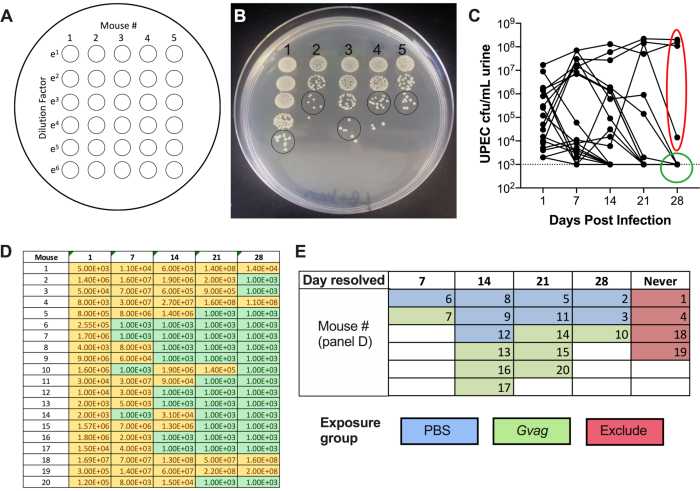
איור 2. ניטור טיטרים של UPEC בשתן במהלך שלב 1 (היווצרות מאגר). (A) שרטוט של יחידות יוצרות מושבה (CFU) ציפוי. (B) תמונה מייצגת של טיטרים של UPEC בשתן על LB+kanamycin. עיגולים שחורים מצביעים על כתמי דגימת שתן שיש לספור כדי לחשב CFU/mL. (C) קורס זמן של חיידקי UPEC בעכברי C57BL/6. כל שורה מייצגת עכבר בודד, תוך התחקות אחר טיטר השתן של UPEC לאורך זמן. קו מקווקו מציין את גבול הזיהוי (1000 CFU/mL). אליפסה אדומה מצביעה על ארבעה עכברים (מתוך 20) שלא הצליחו לפתור את חיידקי UPEC ולכן לא ישמשו למודל ה-RUTI המושרה על ידי G. vaginalis. לעומת זאת, עיגול ירוק מציין עכברים שפתרו את בקטריוריה של UPEC והמשיכו לשלבים הבאים. (D) טבלת נתונים המשמשים ליצירת גרף בלוח C. CFU צהוב וניתן לזיהוי; ירוק, ללא CFU. (E) אקראיות של עכברים לקבוצות חשיפה בהתבסס על נקודת הזמן שבה UPEC CFU כבר לא זוהו בשתן ("היום נפתר"). מספרי העכבר בעמודה השמאלית של לוח D הם אותם מספרי עכבר שניתנו בחלונית E. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
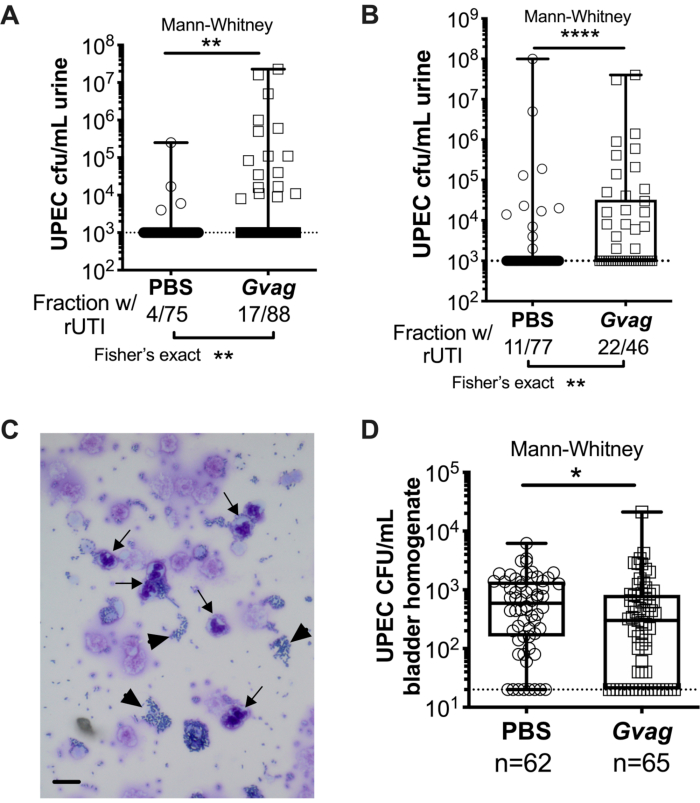
איור 3. G. vaginalis מפעילה UPEC rUTI. UPEC titers בשתן בעקבות שתי חשיפות רצופות של דרכי השתן ל-PBS (עיגולים) או ל-G. vaginalis (Gvag; ריבועים) בהפרש של 12 שעות (A) או 1 שבועות (B). כל סמל מייצג עכבר בודד. ה-CFU/mL UPEC הגבוה ביותר שזוהה מכל עכבר בין 1-3 ד' לאחר החשיפה השנייה מתוארים. עכברים ללא בקטריוריה הניתנת לזיהוי מתווים בגבול הגילוי (קו מקווקו). (C) ניתוח ציטולוגי של שתן המציג תאים UPEC (ראשי חץ) ותאי פולימורפונוקליאר (PMN) (חצים). סרגל קנה מידה = 20 מיקרומטר. (D) טיטרים של UPEC ברקמות שלפוחית השתן נאספו ב-3 ד' לאחר שתי חשיפות רצופות לדרכי השתן בהפרש של 1 שבועות זו מזו. כל סמל מייצג עכבר אחר ואפסים משורטטים בגבול הזיהוי (קו מקווקו). ב-A, B ו <- D, הקופסאות נמצאות ברבעון הראשון והשלישי עם החציון המסומן והשפם ממיני עד למקסימום. ** עמ' < 0.01; עמ' < 0.0001. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
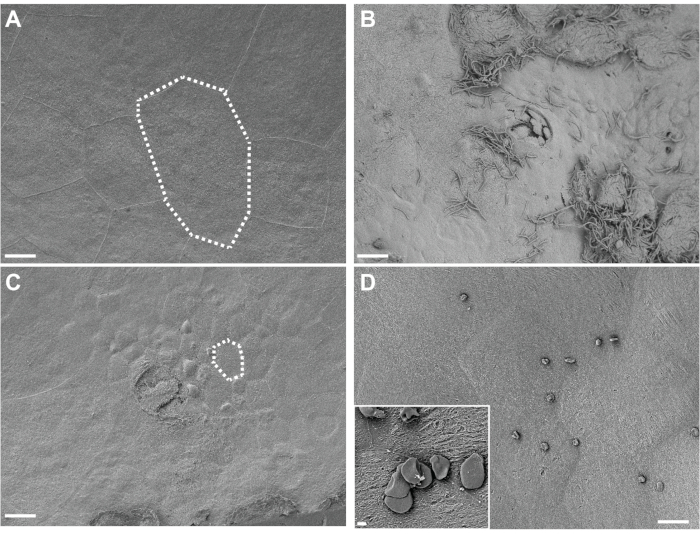
תרשים 4. ניתוח SEM של שלפוחית השתן קבועה באתרה. שלפוחית השתן נאספה מעכברים 3 שעות לאחר שתי חשיפות (בהפרש של 12 שעות זו מזו) ל-PBS (A) או ל-G. vaginalis (C). קווים מנוקדים ממחישים תא אפיתל שתן יחיד, שהוא קטן יותר בשלפוחית השתן החשופה ל-G. vaginalis מכיוון שהתאים השטחיים הגדולים התרחקו וחשפו את אפיתל המעבר הבסיסי. (B) שלפוחית השתן נאספה 6 שעות לאחר החיסון הראשוני עם UPEC, במהלך שלב 1 של המודל, והראה פילינג אורותליאלי ו-UPEC חוץ-תאי. (D) דוגמה לטיפות שומן בלתי מסיסות הקיימות על פני השטח של שלפוחית השתן. סרגלי קנה מידה הם 20 מיקרומטר בתמונות הראשיות ו-2 מיקרומטר בכניסה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
Discussion
הצעד הקריטי הראשון במודל זה לזיהוי עכברים שלא ניקו את חיידקי UPEC במהלך שלב ה-UTI הראשוני. עכברים אלה חייבים להיות מוסרים מהניסוי מכיוון שאחרת הם היו מבלבלים את שיעורי הבקטריוריה של UPEC לאחר חשיפת G. vaginalis. לאחר החיסון הראשוני של UPEC, יש לאסוף את השתן מדי שבוע כדי לעקוב אחר פינוי החיידקים. כ-65-80% מעכברי C57BL/6 ינקו זיהום ב-UTI89kanR תוך 4 שבועות. לזני עכברים גזעיים אחרים יש נטיות שונות לפינוי UPEC42,43 ולהיווצרות מאגרים ולכן ייתכן שאינם מתאימים למודל זה. הנקודה הקריטית השנייה היא שמחקרים אמפיריים קבעו כי שני חיסונים רציפים של G. vaginalis (בהפרש של 12 שעות או 1 שבועות זה מזה) נחוצים כדי לגרום להופעת מאגר משמעותית מעל הופעת הרקע הספונטנית המתרחשת בעכברי בקרה החשופים רק ל- PBS. פרקי זמן אחרים בין שתי החשיפות הרצופות לא נבדקו, אך הם עשויים להניב תוצאות דומות. חשוב לציין כי הפחתה בשלפוחית השתן של UPEC נצפתה רק במודל שבו ניתנו חשיפות ל-G. vaginalis בהפרש של 1שבועות זה מזה 39. בעוד שניתן לתת יותר משתי חשיפות, עדויות אמפיריות מצביעות על כך שצנתור חוזר ונשנה לבדו מגביר את הופעתה, מה שעלול לבלבל את פרשנות התוצאות או לדרוש ממספר גדול יותר של בעלי חיים להבחין בהבדלים בין קבוצות חשיפה ובקרה. לבסוף, לשיטת קיבוע שלפוחית השתן in situ יש מספר שלבים קריטיים. נדרשת מיומנות מסוימת כדי להבטיח שהקיבוע יישאר בתוך שלפוחית השתן המהודקת. שלפוחית שתן מנופחת תהיה קשה יותר לדמיון על ידי SEM. זה גם חיוני להיות עדין מאוד בעת חיסון מקבע לתוך שלפוחית השתן, כמו גירוד urothelium עם קטטר המכיל מקבע יכול לגרום פילינג urothelial ללא תלות במה שמופעל על ידי G. vaginalis. כל הריכוזים המוזכרים בקוקטייל המקבע הם ריכוזים סופיים. יחסים לא נאותים של אלה עלולים לגרום לתיקון ונפיחות או התכווצות לא מספיקים של התאים. יש לחמם את המקבעים לטמפרטורות פיזיולוגיות כדי למנוע הלם טמפרטורה בתאים וברקמות. ההתחממות מספקת גם שיפור קל בקצב הדיפוזיה של מקבעים באמצעות ממברנות פלזמה. בעוד שלעתים קרובות ניתן להשמיט את צביעת אוסמיום עבור דגימות שהוכנו לניתוח SEM, זהו שלב חיוני בפרוטוקול זה כדי לייצב את השומנים ולמנוע פיצוח של קרומי התאים במהלך ייבוש נקודה קריטית.
ניתן לשנות פרוטוקול זה כדי לבדוק זנים אחרים של UPEC ו/או G. vaginalis על יכולתם ליצור מאגרים ולהפעיל את הופעתם, בהתאמה. ניתן להוסיף גם גורמים ניסיוניים אחרים, כגון חשיפה לחיידקים נרתיקיים אחרים (למשל, לקטובצילוס קריספאטוס PVAS100) או G. vaginalis מומת בחום, שאף אחד מהם לא מדגים פתולוגיה במודל זה39. כאשר בוחרים זני חיידקים אחרים לבדיקה, חשוב להדגים צמיחה עקבית כך שניתן יהיה להשתמש בריכוז אינוקולום סטנדרטי בכל הניסויים. הצמיחה של JCP8151BSmR עברה אופטימיזציה בתא אנאירובי. סביר להניח שניתן יהיה לטפח את הזן הזה במערכת GasPak אנאירובית, אך הדבר ידרוש אופטימיזציה כדי להבטיח צמיחה חזקה של חיידקים. לבסוף, ייתכן שניתן יהיה לשנות את העיתוי של שלבים מסוימים במודל. לדוגמה, ניתן לאסוף שתן בנקודות זמן מוקדמות יותר במהלך שלב היווצרות מאגר UPEC כדי לעקוב אחר תגובות CFU או מארח. השפעה שלילית של איסוף דגימות שתן בנקודות זמן מוקדמות (3, 6, 12 hpi) על התקדמות הזיהום או הקמת מאגרים לא נצפתה במודל זה. דווח כי הופעתם של מאגרי UPEC מתרחשת לאחר שתי מנות JCP8151BSmR שניתנו 12 שעות או 1 שבועות, אך מרווחי זמן אחרים טרם נבדקו. כמו כן, ייתכן שניתן יהיה לקצר את משך הזמן הכולל של המודל על ידי הפחתת שלב היווצרות מאגר UPEC לשבועיים (במקום 4 שבועות), מכיוון שרבים מהעכברים מפנים בקטריוריה בשלב זה. מחקרים קודמים שבחנו את הופעת UPEC בעקבות חשיפה לשלפוחית השתן לפילינגים כימיים השתמשו בהיווצרות מאגר UPEC של 1 או 2 שבועות שלב17,18. עם זאת, הפחתת משך הזמן לפינוי בקטריוריה של UPEC עלולה לבוא במחיר של דרישה לסילוק בעלי חיים נוספים מהניסוי. לבסוף, ניתוח SEM של שלפוחית השתן יכול להתבצע בנקודות זמן נוספות כדי לבחון את משך ההשפעה של G. vaginalis על האורותליום.
לגבי פתרון בעיות, ישנם כמה שיקולים חשובים במיוחד לגבי ניתוח SEM שלפוחית השתן. בהתאם לרקע העכבר שבו נעשה שימוש וכמות הדלקת הקיימת, חלק משלפוחית השתן תציג קירות דקים מאוד. שלפוחית השתן הזו נוטה להתכרבל יותר במהלך ייבוש נקודתי קריטי, ועלולה לגרום לצורה דמוית קליפת פרה. אם זה קורה, השיטה הטובה ביותר היא לחתוך את שלפוחית השתן בצורת פגז לשניים לאורך הממשק המכורבל ולאחר מכן בפעם השנייה כדי להסיר את עיקר הרקמה התלויה. חיתוך עובד בצורה הטובה ביותר עם סכין גילוח דו-קצוות מצופה PTFE. עודף שומן יכול לפעמים להתייבש במהלך שלבי צביעת האוסמיום. זה יכול לגרום לטיפות שומן לא מסיסות לא מסיסות שעלולות שלא להישטף במהלך שלבי השטיפה וההתייבשות ויכולות להתיישב על פני השטח של שלפוחית השתן במהלך הייבוש הבא. טיפות אלה יכולות להופיע ככדורים קטנים או כמבנים דמויי דיסק הפזורים על פני הדגימה (איור 4D). ניתן למתן זאת על ידי הבטחה שכמה שיותר רקמת שומן תוסר מסביב לשלפוחית השתן. ניתן להחליף פלטינה בציפוי אירידיום, אך יש לשמור על עוביים למינימום כדי להפחית את מיסוך הפרטים המבניים העדינים. מומלץ מאוד להשתמש בשלב מסתובב במהלך הציפוי.
מגבלה אחת של מודל זה היא שהוא דורש מספר רב של עכברים. רק 65-80% מעכברי C57BL/6 יפנו את חיידקי ה-UPEC שלהם ויתאימו לחיסון G. vaginalis או PBS הבאים (ראו איור 2C). כדי להשיג 10-12 עכברים לכל קבוצה (G. vaginalis inoculation לעומת PBS), כ-30 עכברים צריכים להיות נגועים בתחילה ב-UPEC. יתר על כן, סביר להניח שנדרשים ניסויים מרובים כדי להשיג את השכפולים הביולוגיים הדרושים כדי לזהות מובהקות סטטיסטית. כאשר החשיפות ניתנו בהפרש של 1 שבועות זו מזו, הופעת UPEC התרחשה ב-14% מהעכברים שנחשפו ל-PBS (איור 3B). לפיכך, זיהוי עלייה משמעותית ב-UPEC rUTI בעכברים שנחשפו ל-G. vaginalis ביחס לבקרות PBS (המופעלות ב-0.8; alpha=0.05 [חד-צדדיות]) דורשות בדיקה מצטברת של לפחות 40 עכברים עבור כל קבוצת חשיפה. שיקול נוסף הוא שניסויים אלה יקרים ועתירי עבודה. עכברים חייבים להיות במעקב שבועי לצורך אישור UPEC ומסלול הזמן הניסיוני הוא 4-5 שבועות, תלוי אם G. vaginalis ניתן פעמיים במסגרת זמן של 12 שעות או פעמיים בהפרש של 1 שבועות זה מזה. SEM הוא עתיר עבודה ועשוי להיות יקר, בהתאם לזמינות המיקרוסקופים ולחובי השירות. הכנת שלפוחית השתן כולה ל- SEM מספקת חומר רב לניתוח אך החיסרון הוא שניתוח כל שלפוחית שתן יכול לגזול זמן רב. לפיכך, סביר להניח כי רק מספר מוגבל של שלפוחית שתן ניתן לנתח על ידי SEM בהשוואה למספרים גבוהים יותר של בעלי חיים המשמשים שתן ורקמות titers. בנוסף, קבלת תמונות באיכות גבוהה של המשטחים המעוקלים של "כוסות" שלפוחית השתן דורשת מיומנות בשל צללים שיכולים לעכב את הראות. למרות SEM שלפוחית השתן הוא כלי שימושי להדמיה של פילינג אורותליאלי, שיטה זו היא איכותית במידה רבה. מכיוון שהדגימה קבועה בצורה עגולה, ובשל השימוש בגלוטרלדהיד בקיבוע, לא ניתן לבצע הקרנה של חיידקים המבטאים פלואורסצנטית באמצעות מיקרוסקופיית אור. חיסון וצבעים כימיים אינם עולים בקנה אחד עם תהליך זה בשל השימוש בגלוטראלדהיד שיחצה את רוב האנטיגנים והאוסמיום ואשר יסתיר את אתרי האנטיגן ויכהה את הרקמה. עם זאת, טכניקת SEM שימושית עבור פרמטרים שניתן להעריך באופן כמותי ללא שימוש בבדיקות נוספות, כגון גודל התא48,49.
מודל זה מציע מספר יתרונות מעבר לשיטות שתוארו קודם לכן. זה מאפשר בדיקה של מנגנונים של UPEC rUTI הנגרמים על ידי הופעה ממאגרי שלפוחית השתן, בניגוד להחדרה מחדש לשלפוחית השתן ממקור חיצוני. מודלים אחרים של rUTI עקב הופעתם ממאגרי שלפוחית השתן משתמשים בחומרים כימיים (פרוטמין סולפט או צ'יטוזן) כדי לגרום לפילינג אורותליאלי17,18, אשר לא יהיה טריגרים של rUTI אצל נשים. G. vaginalis הוא חיידק אורוגניטלי נפוץ שהתגלה בשתן שנאסף ישירות משלפוחית השתן באמצעות צנתור או שאיפה סופרפובית אצל חלק מהנשים23,26. עובדה זו, יחד עם הקשר הידוע בין BV (שבו G. vaginalis גדל יתר על המידה בנרתיק) לבין UTI, מצביעה על כך ש- G. vaginalis הוא טריגר סביר מבחינה קלינית של rUTI. לבסוף, שיטת קיבוע שלפוחית השתן באתרה משמרת את מבנה העל של שלפוחית השתן ומגבילה את הנזק, ומבטיחה ששכבות שלפוחית השתן אינן נפרדות זו מזו. שיטות קודמות להדמיה של האורותליום גורמות באופן מסורתי למשתמש לקצור, לחתוך, למתוח ולהצמיד את שלפוחית השתן למגש דיסקציה לפני שהוא מטביע את שלפוחית השתן המתוחה באופן אספטי48. שיטה זו מביאה לדגימה שטוחה מאוד אך אינה מבטיחה מתיחה אחידה או טבעית של הרקמה ועלולה לגרום לאזורים שנמתחים מעל ומתחת (וכתוצאה מכך רקמה מקומטת מאוד) ועלולה לגרום להפרדת שכבת שלפוחית השתן. בנוסף, מניפולציות פיזיות אלה של שלפוחית השתן כדי למתוח ולהצמיד את הרקמה עלולות לגרום לנזק, כולל פילינג אורותליאלי. שיטה נוספת היא להטביע שלפוחיות שלמות בקיבוע לפני ההטבעה בפרפין ולרכוש חלקים דקים עם מיקרוטום. מקטעים דקים לא יסולאו בפז לניסויים אימונוהיסטוכימיה לבחינת חיידקים ולוקליזציה של חלבון מארח, אך חתך דק אינו מאפשר הדמיה של משטח האורותל. שיטת SEM זו מאפשרת לבחון את פני השטח של שלפוחית השתן כולה בבת אחת.
כפי שתואר, יישומים עתידיים של מודל זה כוללים בדיקת זנים אחרים של UPEC כדי לקבוע אם הם יוצרים מאגרים תוך תאיים ובדיקת זנים אחרים של G. vaginalis כדי להעריך אם הם מעוררים פילינג והופעת UPEC לגרום ל-rUTI. זני עכברים אחרים מעבר לעכברי C57BL/6 עשויים גם הם להיבדק, אם כי עכברים עם נטייה גבוהה לפתח דלקת שלפוחית השתן כרונית (כגון עכברים על רקע C3H) אינם מומלצים, מכיוון שיהיה צורך להוציא יותר מדי עכברים מהניסוי. יתרון נוסף של עכברי C57BL/6 הוא שזני נוקאאוט גנטיים רבים זמינים באופן מסחרי. זנים כאלה מספקים הזדמנות לחקור את הגורמים המארחים המעורבים ביצירת מאגרים ו/או הופעתם.
Disclosures
המחברים מצהירים כי אין להם ניגודי עניינים הקשורים למחקר זה.
Acknowledgements
המחברים מודים ללין פוסטר על הסיוע הטכני בניסויי זיהום, לג'יימס פיצפטריק במרכז להדמיית תאים באוניברסיטת וושינגטון (WUCCI) על הגישה ל-SEM, לסקוט הולטגרן על זן UTI89kanR UPEC, ולדיוויד הונסטאד על קריאה ביקורתית של כתב היד.
עבודה זו נתמכה על ידי הקרן הלאומית למדע (מלגת מחקר לתארים מתקדמים ל- VPO#DGE - 1143954), על ידי המרכז לחקר מחלות זיהומיות של נשים בבית הספר לרפואה של אוניברסיטת וושינגטון (פרס מחקר פיילוט ל- NMG), על ידי איגוד הלב האמריקאי: #12POST12050583 (NMG) ו- #14POST20020011 (NMG), ועל ידי המכונים הלאומיים לבריאות, NIAID: R01 AI114635 (ALL) ו- NIDDK: R21 DK092586 (ALL), P50 DK064540-11 (SJH, פרויקט II PI:ALL) ו-K01 DK110225-01A1 (NMG). חלק מהמחקרים בבעלי חיים בוצעו במתקן הנתמך על ידי מענק NCRR C06 RR015502. המרכז להדמיה תאית של אוניברסיטת וושינגטון (WUCCI; שם בוצע SEM) ו-MSJ נתמכו על ידי בית הספר לרפואה של אוניברסיטת וושינגטון, מכון תגלית הילדים של אוניברסיטת וושינגטון ובית החולים לילדים סנט לואיס (CDI-CORE-2015-505), הקרן לבית החולים היהודי בארנס (3770) והמכון הלאומי להפרעות נוירולוגיות ושבץ מוחי (NS086741). למממנים לא היה כל תפקיד בתכנון המחקר, באיסוף וניתוח הנתונים, בהחלטה על פרסום או בהכנת כתב היד.
Materials
| Name | Company | Catalog Number | Comments |
| 30G x 1/2 needles | BD | 305106 | for catheters |
| 5 1/2" straight forcep hemostat | McKesson | 487377 | in situ bladder fixation |
| ACE 600 Sputter coater | Leica | SEM sample processing | |
| aluminum SEM stub | Ted Pella | 16111 | SEM sample processing |
| Calcium chloride | EMS | 12340 | in situ bladder fixation |
| conductive carbon adhesive tab | Ted Pella | 16084-1 | SEM sample processing |
| Conductive silver paint | Ted Pella | 16034 | SEM sample processing |
| CPD 300 Critical Point Drier | Leica | SEM sample processing | |
| Cytofunnel metal clip | Simport | M964B | cytospun urinalysis |
| Ethanol | EMS | 15050 | SEM sample processing |
| Glucose | Sigma | G7528 | for NYCIII G. vaginalis growth media |
| glutaraldehyde | EMS | 16320 | in situ bladder fixation |
| Hema 3 staining kit | Fisher | 23123869 | cytospun urinalysis |
| HEPES | Cellgro | 25-060-Cl | for NYCIII G. vaginalis growth media |
| iridium | Ted Pella | 91120 | SEM sample processing |
| isofluorane | mouse anaesthesia | ||
| kanamycin | Gibco | 11815024 | add to UPEC LB selective plates (50 ug/mL) |
| Luria-Bertani agar | BD | DF0445174 | UPEC growth plates |
| Luria-Bertani broth | BD | DF0446173 | UPEC growth media |
| Merlin FE-SEM | Zeiss | scanning electron microscope | |
| Milli-Q Water Purifier | Millipore | IQ-7000 | SEM sample processing |
| NaCl | Sigma | S3014 | for NYCIII G. vaginalis growth media |
| Olympus Vanox AHBT3 microscope | Olympus | cytospun urinalysis | |
| osmium tetroxide | EMS | 19170 | SEM sample processing |
| paraformaldehyde | EMS | 15710 | in situ bladder fixation |
| polyethylene tubing | Intramedic | 427401 | for catheters |
| Proteose Peptone #3 | Fisher | DF-122-17-4 | for NYCIII G. vaginalis growth media |
| PTFE coated double edge razor blade | EMS | 72000 | cutting bladders for SEM |
| Shandon Cytocentrifuge | Thermo Scientific | A78300002 | cytospun urinalysis |
| Shandon cytofunnel filter | Simport | M965FWDV | cytospun urinalysis |
| Shandon Double cytofunnel | Simport | M964-1D | cytospun urinalysis |
| Shandon double cytoslides (coated) | Thermo Scientific | 5991055 | cytospun urinalysis |
| sodium cacodylate trihydrate | EMS | 12310 | in situ bladder fixation |
| spectrophotometer | BioChrom | 80-3000-45 | measuring bacterial OD600 |
| streptomycin | Gibco | 11860038 | add to G. vaginalis NYCIII selective plates (1 mg/mL) |
| tuberculin slip tip syringe | BD | 309659 | for catheters |
| Yeast Extract | Fisher | DF0127-17-9 | for NYCIII G. vaginalis growth media |
References
- Foxman, B. Urinary tract infection syndromes: occurrence, recurrence, bacteriology, risk factors, and disease burden. Infectious Disease Clinics of North America. 28 (1), 1-13 (2014).
- Foxman, B. Recurring urinary tract infection: incidence and risk factors. American Journal of Public Health. 80 (3), 331-333 (1990).
- Foxman, B. Epidemiology of urinary tract infections: incidence, morbidity, and economic costs. American Journal of Medicine. 113, 5-13 (2002).
- Foxman, B. The epidemiology of urinary tract infection. Nature Reviews Urology. 7 (12), 653-660 (2010).
- Ikaheimo, R., et al. Recurrence of urinary tract infection in a primary care setting: analysis of a 1-year follow-up of 179 women. Clinical Infectious Diseases. 22 (1), 91-99 (1996).
- Russo, T. A., Stapleton, A., Wenderoth, S., Hooton, T. M., Stamm, W. E. Chromosomal restriction fragment length polymorphism analysis of Escherichia coli strains causing recurrent urinary tract infections in young women. Journal of Infectious Diseases. 172 (2), 440-445 (1995).
- Luo, Y., et al. Similarity and divergence of phylogenies, antimicrobial susceptibilities, and virulence factor profiles of Escherichia coli isolates causing recurrent urinary tract infections that persist or result from reinfection. Journal of Clinical Microbiology. 50 (12), 4002-4007 (2012).
- Schreiber, H. L. t., et al. Bacterial virulence phenotypes of Escherichia coli and host susceptibility determine risk for urinary tract infections. Science Translational Medicine. 9 (382), (2017).
- Rosen, D. A., Hooton, T. M., Stamm, W. E., Humphrey, P. A., Hultgren, S. J. Detection of intracellular bacterial communities in human urinary tract infection. PLoS Med. 4 (12), 329 (2007).
- Elliott, T. S., Reed, L., Slack, R. C., Bishop, M. C. Bacteriology and ultrastructure of the bladder in patients with urinary tract infections. Journal of Infection. 11 (3), 191-199 (1985).
- Robino, L., et al. Detection of intracellular bacterial communities in a child with Escherichia coli recurrent urinary tract infections. Pathogens and Disease. 68 (3), 78-81 (2013).
- Robino, L., et al. Intracellular bacteria in the pathogenesis of Escherichia coli urinary tract infection in children. Clinical Infectious Diseases. 59 (11), 158-164 (2014).
- De Nisco, N. J., et al. Direct Detection of Tissue-Resident Bacteria and Chronic Inflammation in the Bladder Wall of Postmenopausal Women with Recurrent Urinary Tract Infection. Journal of Molecular Biology. 431 (21), 4368-4379 (2019).
- Mulvey, M. A., Schilling, J. D., Hultgren, S. J. Establishment of a persistent Escherichia coli reservoir during the acute phase of a bladder infection. Infection and Immunity. 69 (7), 4572-4579 (2001).
- Kerrn, M. B., Struve, C., Blom, J., Frimodt-Moller, N., Krogfelt, K. A. Intracellular persistence of Escherichia coli in urinary bladders from mecillinam-treated mice. Journal of Antimicrobial Chemotherapy. 55 (3), 383-386 (2005).
- Eto, D. S., Sundsbak, J. L., Mulvey, M. A. Actin-gated intracellular growth and resurgence of uropathogenic Escherichia coli. Cellular Microbiology. 8 (4), 704-717 (2006).
- Mysorekar, I. U., Hultgren, S. J. Mechanisms of uropathogenic Escherichia coli persistence and eradication from the urinary tract. Proceedings of the National Academy of Sciences of the United States of America. 103 (38), 14170-14175 (2006).
- Blango, M. G., Ott, E. M., Erman, A., Veranic, P., Mulvey, M. A. Forced resurgence and targeting of intracellular uropathogenic Escherichia coli reservoirs. PLoS One. 9 (3), 93327 (2014).
- Gilbert, N. M., Lewis, A. L. Covert pathogenesis: Transient exposures to microbes as triggers of disease. PLoS Pathogens. 15 (3), 1007586 (2019).
- Lewis, A. L., Gilbert, N. M. Roles of the vagina and the vaginal microbiota in urinary tract infection: evidence from clinical correlations and experimental models. GMS Infectious Diseases. 8, (2020).
- Janulaitiene, M., et al. Prevalence and distribution of Gardnerella vaginalis subgroups in women with and without bacterial vaginosis. BMC Infectious Diseases. 17 (1), 394 (2017).
- Fredricks, D. N. Molecular methods to describe the spectrum and dynamics of the vaginal microbiota. Anaerobe. 17 (4), 191-195 (2011).
- Hilt, E. E., et al. Urine is not sterile: use of enhanced urine culture techniques to detect resident bacterial flora in the adult female bladder. Journal of Clinical Microbiology. 52 (3), 871-876 (2014).
- Klein, S., et al. Significant increase in cultivation of Gardnerella vaginalis, Alloscardovia omnicolens, Actinotignum schaalii, and Actinomyces spp. in urine samples with total laboratory automation. European Journal of Clinical Microbiology Infect Dis. 37 (7), 1305-1311 (2018).
- Pearce, M. M., et al. The female urinary microbiome in urgency urinary incontinence. American Journal of Obstetrics and Gynecology. 213 (3), 341 (2015).
- Pearce, M. M., et al. The female urinary microbiome: a comparison of women with and without urgency urinary incontinence. mBio. 5 (4), 01283 (2014).
- Gottschick, C., et al. The urinary microbiota of men and women and its changes in women during bacterial vaginosis and antibiotic treatment. Microbiome. 5 (1), 99 (2017).
- Malki, K., et al. Genomes of Gardnerella Strains Reveal an Abundance of Prophages within the Bladder Microbiome. PLoS One. 11 (11), 0166757 (2016).
- Kramer, H., et al. Diversity of the midstream urine microbiome in adults with chronic kidney disease. International Urology and Nephrology. 50 (6), 1123-1130 (2018).
- Allsworth, J. E., Peipert, J. F. Prevalence of bacterial vaginosis: 2001-2004 National Health and Nutrition Examination Survey data. Obstetrics & Gynecology. 109 (1), 114-120 (2007).
- Ravel, J., et al. Vaginal microbiome of reproductive-age women. Proceedings of the National Academy of Sciences of the United States of America. 108, 4680-4687 (2011).
- Hillier, S. L. Diagnostic microbiology of bacterial vaginosis. American Journal of Obstetrics and Gynecology. 169 (2), 455-459 (1993).
- Amatya, R., Bhattarai, S., Mandal, P. K., Tuladhar, H., Karki, B. M. Urinary tract infection in vaginitis: a condition often overlooked. Nepal Medical College Journal. 15 (1), 65-67 (2013).
- Harmanli, O. H., Cheng, G. Y., Nyirjesy, P., Chatwani, A., Gaughan, J. P. Urinary tract infections in women with bacterial vaginosis. Obstetrics & Gynecology. 95 (5), 710-712 (2000).
- Sharami, S. H., Afrakhteh, M., Shakiba, M. Urinary tract infections in pregnant women with bacterial vaginosis. Journal of Obstetrics and Gynaecology. 27 (3), 252-254 (2007).
- Hillebrand, L., Harmanli, O. H., Whiteman, V., Khandelwal, M. Urinary tract infections in pregnant women with bacterial vaginosis. American Journal of Obstetrics and Gynecology. 186 (5), 916-917 (2002).
- Sumati, A. H., Saritha, N. K. Association of urinary tract infection in women with bacterial vaginosis. Journal of Global Infectious Diseases. 1 (2), 151-152 (2009).
- Gilbert, N. M., Lewis, W. G., Lewis, A. L. Clinical features of bacterial vaginosis in a murine model of vaginal infection with Gardnerella vaginalis. PLoS One. 8 (3), 59539 (2013).
- Gilbert, N. M., O'Brien, V. P., Lewis, A. L. Transient microbiota exposures activate dormant Escherichia coli infection in the bladder and drive severe outcomes of recurrent disease. PLoS Pathogens. 13 (3), 1006238 (2017).
- Wright, K. J., Seed, P. C., Hultgren, S. J. Uropathogenic Escherichia coli flagella aid in efficient urinary tract colonization. Infection and Immunity. 73 (11), 7657-7668 (2005).
- Garofalo, C. K., et al. Escherichia coli from urine of female patients with urinary tract infections is competent for intracellular bacterial community formation. Infection and Immunity. 75 (1), 52-60 (2007).
- Hannan, T. J., Mysorekar, I. U., Hung, C. S., Isaacson-Schmid, M. L., Hultgren, S. J. Early severe inflammatory responses to uropathogenic E. coli predispose to chronic and recurrent urinary tract infection. PLoS Pathogens. 6 (8), 1001042 (2010).
- Hopkins, W. J., Gendron-Fitzpatrick, A., Balish, E., Uehling, D. T. Time course and host responses to Escherichia coli urinary tract infection in genetically distinct mouse strains. Infection and Immunity. 66 (6), 2798-2802 (1998).
- Conover, M. S., Flores-Mireles, A. L., Hibbing, M. E., Dodson, K., Hultgren, S. J. Establishment and Characterization of UTI and CAUTI in a Mouse Model. Journal of Visualized Experiments. (100), e52892 (2015).
- Hannan, T. J., Hunstad, D. A. A Murine Model for Escherichia coli Urinary Tract Infection. Methods in Molecular Biology. 1333, 159-175 (2016).
- Zychlinsky Scharff, A., Albert, M. L., Ingersoll, M. A. Urinary Tract Infection in a Small Animal Model: Transurethral Catheterization of Male and Female Mice. Journal of Visualized Experiments. (130), e54432 (2017).
- Thai, K. H., Thathireddy, A., Hsieh, M. H. Transurethral induction of mouse urinary tract infection. Journal of Visualized Experiments. (42), e2070 (2010).
- O'Brien, V. P., et al. A mucosal imprint left by prior Escherichia coli bladder infection sensitizes to recurrent disease. Nature Microbiology. 2, 16196 (2016).
- O'Brien, V. P., Dorsey, D. A., Hannan, T. J., Hultgren, S. J. Host restriction of Escherichia coli recurrent urinary tract infection occurs in a bacterial strain-specific manner. PLoS Pathogens. 14 (12), 1007457 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved