תחזוקה והערכה של סוגי רקמות ותאים שונים של העין באמצעות מערכת חדשנית של Pumpless Fluidics
In This Article
Summary
ניתוח בזמן אמת של רקמות חיות מניב נתונים פונקציונליים ומכניסטיים חשובים. מאמר זה מתאר את הפרוטוקולים והמשתנים הקריטיים כדי להבטיח ייצור מדויק וניתן לשחזור של נתונים על ידי מערכת זרימה רב-ערוצית חדשנית ונטולת משאבות, השומרת ומעריכה מגוון רחב של מודלים של רקמות ותאיים.
Abstract
מודלים רבים במבחנה המשמשים לחקר תפקוד רקמות וביולוגיה של התא דורשים זרימה של מדיה כדי לספק חמצון הולם ותנאי תא אופטימליים הדרושים לשמירה על תפקוד וכדאיות. לשם כך, פיתחנו מערכת תרביות זרימה רב-ערוצית כדי לשמור על רקמות ותאים בתרבית ולהעריך ברציפות תפקוד וכדאיות על ידי חיישנים בתוך השורה ו/או אוסף של שברי זרימה. המערכת משלבת חישה אופטית רציפה בת 8 ערוצים של קצב צריכת חמצן עם קולט שברים מובנה כדי למדוד בו זמנית את קצב הייצור של מטבוליטים והפרשת הורמונים. למרות שהוא מסוגל לתחזק ולהעריך מגוון רחב של מודלים של רקמות ותאיים, כולל איונים, שרירים והיפותלמוס, כאן אנו מתארים את עקרונות הפעולה שלו ואת ההכנות/פרוטוקולים ניסיוניים שבהם השתמשנו כדי לחקור ויסות ביואנרגטי של רשתית עכבר מבודדת, אפיתל פיגמנט רשתית עכבר (RPE)-choroid-sclera, ותאי RPE אנושיים בתרבית. חידושים בתכנון המערכת, כגון זרימת נוזל ללא משאבה, הפיקו פעולה פשוטה מאוד של מערכת זרימה רב ערוצית. מוצגים סרטונים ותמונות הממחישים כיצד להרכיב, להכין את המכשיר לניסוי ולטעון את המודלים השונים של רקמות/תאים לתוך תאי הפריפיוזיה. בנוסף, מתוארים ונדונים קווים מנחים לבחירת תנאים לניסויים ספציפיים לפרוטוקול ולרקמות, כולל קביעת יחס קצב זרימה לרקמה נכון לקבלת תנאי תרבית עקביים ויציבים וקביעות מדויקות של קצב הצריכה והייצור. השילוב של תחזוקת רקמות אופטימלית והערכה בזמן אמת של פרמטרים מרובים מניב מערכי נתונים אינפורמטיביים ביותר שיהיו שימושיים מאוד למחקר בפיזיולוגיה של העין ולגילוי תרופות לטיפול בראייה לקויה.
Introduction
למערכות פריפיוז'ן יש היסטוריה ארוכה במדעי החיים. בפרט, לחקר תפקוד ההפרשה על ידי איונים, הם שימשו לאפיון הקינטיקה של הפרשת אינסולין בתגובה להפרשה1. בנוסף לאיסוף שברי זרימה לבדיקה עוקבת של הורמונים ומטבוליטים, שולבו חיישנים בזמן אמת, בעיקר לזיהוי צריכת חמצן 2,3,4. מאמצים נרחבים להבין טוב יותר מנגנונים המתווכים מחלות של העין הוגבלו על ידי מחסור בשיטות רלוונטיות מבחינה פיזיולוגית להערכת ויסות מטבולי וחוסר ויסות של המרכיבים המבודדים השונים של העין, כולל הרשתית, אפיתל פיגמנט הרשתית (RPE)-choroid-sclera ותאי RPE בתרבית. מערכות סטטיות המיועדות לתאים בתרבית הותאמו לרקמה5, אך רקמה דורשת זרימה לצורך חמצון הולם. מערכות זרימה הצליחו למדוד באופן מדויק ומשכפל תגובות בזמן אמת בקצב צריכת החמצן (OCR) על ידי הרשתית ו- RPE-choroid-sclera, והרקמות נשארות יציבות מטבולית במשך יותר מ -8 שעות ומאפשרות פרוטוקולים אינפורמטיביים ביותר הכוללים תרכובות בדיקה מרובות 4,6,7,8,9 . עם זאת, הפעלת מערכות פלואידיקה דרשה באופן היסטורי מנגנון מותאם אישית וצוות טכני מיומן במתודולוגיות לא סטנדרטיות. מערכות כאלה לא אומצו כמתודולוגיה סטנדרטית ברוב המעבדות. BaroFuse היא מערכת פלואידיקה חדשה שפותחה ואינה מסתמכת על משאבות, אלא על לחץ גז כדי להניע זרימה דרך תעלות מרובות ותאי רקמות מרובים (איור 1). כל ערוץ מנוטר ברציפות עבור זיהוי תווים אופטי (OCR), והזרימה החוצה נאספת באמצעות אספן שברים מבוסס צלחת לבדיקה עוקבת של תוכן. חשוב לציין, תאי פריפיוז'ן הרקמה עבור המכשיר מתוכננים להכיל רקמות בגיאומטריות ובגדלים שונים.
לב המכשיר הוא מערכת הפלואידיקה, שבה הזרימה מועברת ממאגר אטום בלחץ דרך צינורות בקוטר פנימי קטן (ID) (התורמים את התנגדות הזרימה המשמעותית ביותר במעגל הנוזל) אל תאי רקמת הזכוכית המאחסנים את הרקמה. הלחץ למודול מאגר המדיה (MRM) מסופק על ידי וסתי לחץ נמוך ולחץ גבוה המחוברים לבלון גז המכיל תערובת גזים (בדרך כלל 21% O 2, 5% CO 2, איזון N2), והמאגר אטום מלמעלה על ידי מודול תא הפריפיוז'ן (PCM) המחזיק את מכלולי תאי הרקמה (TCAs). קצב הזרימה נשלט על ידי אורך ומזהה צינורות ההתנגדות והגדרת הלחץ של וסת לחץ נמוך. צינורות זרימה המחוברים לחלק העליון של תאי הרקמה מעבירים נוזל לכלי קיבול פסולת (שנשקל ברציפות לקביעה אוטומטית של קצב זרימה) או לבארות של צלחת בת 96 בארות הנשלטות על ידי קולט השברים. מערכת זיהוי O 2 מודדת את אורך החיים של צבע רגיש O2 הצבוע בחלק הפנימי של כל אחד מתאי רקמת הזכוכית במורד הזרם של הרקמה. מידע זה משמש לאחר מכן לחישוב רציף של זיהוי תווים אופטי (OCR). כל מערכת הפלואידיקה שוכנת במתחם מבוקר טמפרטורה ומיכל הגז, קולט השברים והמחשב הם המרכיבים העיקריים של המכשיר (איור 2A). לבסוף, תוכנה המפעילה את המכשיר משמשת לבקרה על פעולתו (כולל הכנה ותזמון של תרכובות בדיקה מוזרקות, מערכת מדידת זרימה ותזמון אספן שברים), כמו גם עיבוד וגרפים של נתוני OCR ומדידות משלימות אחרות.
במאמר זה אנו מתארים את הפרוטוקולים לשימוש במערכת הפלואידיקה כדי לשבור ולהעריך OCR וקצב ייצור לקטט (LPR) עבור רכיבים מבודדים שונים של העין. LPR הוא פרמטר המשקף קצב גליקוליטי המשלים מאוד את OCR, שבו הצמד מהווה את שני הענפים העיקריים של ייצור אנרגיה מפחמימות בתא10. מכיוון שהכנת הרקמה והטענתה לתאי הרקמה נלמדת בצורה הטובה ביותר על ידי צפייה בהליך, הסרטון יסייע להמחיש כמה מהשלבים הקריטיים המבוצעים במהלך ההתקנה והתפעול שאינם מועברים בקלות על ידי טקסט בלבד.
תיאור הפרוטוקול מחולק ל-8 חלקים המתאימים לשלבים שונים של הניסוי (איור 2B): 1. הכנה טרום-ניסויית; 2. הכנה/שיווי משקל של הפריפוסט; 3. הגדרת מכשיר; 4. שיווי משקל רקמות; 5. פרוטוקול ניסיוני; 6. שבירת מכשירים; 7. עיבוד נתונים; ו-8. בדיקות של שברים יוצאים.
Protocol
כל ההליכים לקצירת רקמות מחולדות ועכברים אושרו על ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים באוניברסיטת וושינגטון.
1. הכנה טרום ניסויית
הערה: המשימות הבאות הושלמו לפחות יום לפני הניסוי.
- תכנון פרוטוקול הניסוי
- הקצאת מיקום הרקמה בתעלות: בחרו רקמה או מודל תא שימוקמו ב-3 מתוך 4 התעלות בכל צד של ה-MRM. תא רקמה אחד בכל צד מופעל ללא רקמה שתשמש לתיקון קו בסיס.
- סדרו את הדגימות באמצעות אחד משני העיצובים האופייניים - פרוטוקולי תרכובת בדיקה שונים בכל צד (למשל, ערוצים בצד אחד של MRM מקבלים תרכובות בדיקה בעוד התעלות בצד השני פועלות כבקרה); אותו פרוטוקול הזרקת תרכובת בדיקה בשני צידי ה-MRM, אך רקמות שונות או מודל רקמות שונה לעומת בקרה משני צדי ה-MRM.
- בחירת קצב הזרימה וכמות הרקמה למדידה אופטימלית של זיהוי תווים אופטי (OCR): התאם את קצב הזרימה עד לשינוי ביחס אורך החיים כפול 100 הוא בערך 3.
הערה: כמויות אופייניות של רקמה וקצבי זרימה תואמים מוצגים בטבלה 1 עבור רכיבי העין, כאשר המכשיר מתפקד בצורה הטובה ביותר בקצבי זרימה בין 6-80 מיקרוליטר/דקה/ערוץ. - חישוב נפח המדיה/מאגר הנדרש: חשב את נפח המדיה שיש להוסיף לכל תוספת MRM בתחילת הניסוי כ-
נפחMRM = 30 מ"ל + משך פרוטוקול (במינימום) x קצב זרימה (במ"ל/דקה) x 4 ערוצים (Eq.1)
לדוגמה, ב-0.01 מ"ל/דקה,MRM בנפח התחלתי של 60 מ"ל יאפשר פרוטוקול של 12.5 שעות (שבו 30 מ"ל יתרוקן, בעוד 30 מ"ל יישארו), בעוד שב-0.04 מ"ל/דקה,MRM בנפח התחלתי של 90 מ"ל יאפשר פרוטוקול של 6 שעות (עם 30 מ"ל שנותרו). - פרוטוקול הזרקת תרכובות בדיקה: בחר תרכובות בדיקה להערכה, את הריכוז שיש לבדוק (בדרך כלל נבחר להניב תגובה כמעט מקסימלית או כתלות בריכוז) ואת משך החשיפה. שקול מסיסות והמציא מלאי בממס הרצוי כגון מים, DMSO או אתנול.
- בחר את תזמון הזריקות והזריקות הבאות כך שהתגובה תגיע למצב יציב לפני הוספת סוכן עוקב. בעת חזרה על פרוטוקולים, התאם את תזמון הזריקות כך שניתן יהיה לבצע ממוצע של קורסים מרובים.
הערה: התרכובות המשמשות כאן הן מבדיקת מאמץ מיטוכונדריאלית (מיטו) קודמת 11 והן אוליגומיצין והן קרבוניל ציאניד 4-(trifluoromethoxy)פנילהידראזון (FCCP) דורשים DMSO הן בתמיסות המלאי, כמו גם בפריפוזאט הסופי. - זמני דגימה יוצאים: בחר את מרווחי איסוף השברים הרצויים (בין 1-60 דקות לדגימה), שבהם נבחרים קצבי דגימה מהירים יותר לשינויים מהירים, ומרווחי זמן ארוכים יותר נבחרים כאשר מתקרבים למצב יציב. השתמש בנפחי בארות מתאימים (0.3 עד 1.5 מ"ל) כדי למנוע גלישה במהלך מרווח הדגימה (בחר נפחים הגדולים מקצב הזרימה x מרווח הזמן).
הערה: זמני הדגימה ישתנו בהתאם לבחירת הפרוטוקול, אך עבור בדיקת מאמץ מיטו, השתמשנו בדרך כלל במרווחים של 5 דקות במהלך קו הבסיס ובמרווחים של 15 דקות במהלך הזריקות (-15, -10, -5, 0, 15, 30, 45, 60, 75, 90, 105, כאשר כל פעם הוא תחילת מרווח הדגימה). - הזן את הערכים שנבחרו עבור תרכובות בדיקה ואיסוף שברים המתוארים לעיל בממשק המשתמש (UI), היוצר ייצוגים גרפיים של מידע זה. ייצוא והפצה של קבצים להערכה קבוצתית ולדיונים (תרשים משלים 1).
- הגדר את האביזרים והחלקים המתכלים
- הגדר את החומרים המסופקים והארוזים מראש על ידי היצרן הכוללים: TCAs (חבילה של 8), מכלולי צינורות זרימה (חבילה של 8 צינורות), צינורות הזרקת תרכובת בדיקה (2), מלקחיים, מהדקי צינורות (3), MRM, תוספות MRM (2), מוטות ערבוב (2) ומכלול צינורות טיהור (מונח בארון בטיחות ביולוגי).
- אין לעשות שימוש חוזר בחלקים חד פעמיים הבאים במגע עם נוזלים, שכן הדבר יוביל לעלייה בכישלון הניסוי. עשו שימוש חוזר במלקחיים ובוחשים על ידי ניקוי ואוטוקלאבינג שלהם בין ניסויים.
2. הכנה ושיווי משקל של פריפוזט (זמן: 30 דקות לא כולל זמן הדגירה)
- הכינו את המדיה או את חיץ קרבס-רינגר ביקרבונט (KRB) יום קודם לכן בהתבסס על חישובים ממשוואה 1, בדרך כלל 200 מ"ל, ולאחר מכן דגרו לילה באינקובטור CO2 של 39°C/5% בצלוחיות תרבית רקמה T225 עם לא יותר מ-90 מ"ל בכל בקבוק.
- אם אתם משתמשים ב-KRB או במדיה שהוכנה מסחרית (מחוממים לטמפרטורת החדר), הכינו את הפריפוזאט בבוקר הניסוי והניחו באינקובטור 5% CO2 למשך שעה אחת לפחות. הכינו את כל הפתרונות באופן אספטי.
הערה: כל הנוזלים והחלקים של מערכת הפלואידיקה הבאים במגע עם נוזל הם סטריליים בתחילת הניסוי. עם זאת, הרכבה של המערכת וטעינה של הרקמה מבוצעת פתוחה לאוויר.
3. שיווי משקל טמפרטורה וגז מומס להגדרת המכשיר (זמן: 75 דקות)
- חיבור מכלולי צינורות ל-MRM
- הניחו את ה-MRM וחבילת הפלואידיקה על הספסל שליד המכשיר. ודא שמהדקי הצינור (3), מוטות הערבוב (2) והמלקחיים כבר נמצאים על מגש הכלים.
- הניחו תוסף MRM שאינו בשימוש עם מוט ערבוב בכל צד של ה-MRM (ראו איור 3).
- חברו את ה-TCAs ליציאות הזרקה בשני קצוות ה-MRM כך שקצה הצינורית ימוקם ישירות מעל מוט הערבוב. ודא שהארוך מבין שני מכלולי ההזרקה של תרכובת הבדיקה נמצא בגב ה-MRM.
- לאחר מכן, חברו את קו הזנת זרימת הגז ואת מכלול צינורות הטיהור ליציאות הפנויות האחוריות והקדמיות, בהתאמה (ראו איור 4A).
- הצבת מכלולי MRM/צינורות במארז
- הכניסו את ה-MRM (כשמכלולי הצינוריות מחוברים) לתנור החימום MRM (איור 4B).
- מקמו את ארבעת מכלולי הצינורות בחריצי הקירות שבבסיס המתחם (שניים מכל צד) כך שיבלטו אל החלק החיצוני של המתחם לאחר הצבת המתחם האמצעי.
- אבטח את ה-MRM בין המהדקים על-ידי הידוק שני הגלגלים במעמד הגלאי.
- הזינו את מכלול ההזרקה הארוך יותר של תרכובת הבדיקה הבולט מגב המארז דרך שני מדריכי הצינור בצד המארז, כך שפתח הצינורות פונה קדימה (איור 4C).
- הדקו כל אחד ממכלולי ההזרקה הסגורים של תרכובת הבדיקה.
- הרכבת המארז והפעלת בקרי הטמפרטורה
- העבר את מפצל החשמל המספק חשמל לכל המכשירים החשמליים בתוך המארז למצב מופעל. המאוורר במעמד הגלאי יופעל ובקר הטמפרטורה MRM אמור להידלק ולהציג ערך מוגדר של 38°C (איור 5).
- הפעל את הבוחשנים ל-70 סל"ד באמצעות ממשק המשתמש כדי לוודא שמוטות הערבוב מסתובבים בצורה חלקה. לאחר שנצפתה ערבוב מתאים, כבו את הבוחשנים.
- הניחו את החלק האמצעי של המארז על גבי הבסיס.
- חבר את הכבל בחלק האמצעי של המארז לכבל מקופסת החשמל כדי לחבר חשמל למתג הידית של בקר טמפרטורת הסביבה ולספק חשמל למחמם טמפרטורת הסביבה.
- הניחו את המכסה על המארז והתצוגה של בקר הטמפרטורה העליון (בקר טמפרטורת הסביבה) תידלק ותקרא 36°C. הפעילו טיימר למשך 30 דקות, הזמן שלוקח למחמם MRM להגיע לטמפרטורת הנקודה שנקבעה.
- הכנסת TCAs לתוך PCM
- השתמש בכלי החדרת TCA כדי להכניס כל אחד מ- 8 TCAs לתוך חורי ה- PCM על ידי לחיצה חזקה על המתאם עם פני כלי ההחדרה עד שהחלק העליון של שרוול הצינור הכרוך סביב תא הרקמה נוגע במשטח המקיף את החורים ב- PCM.
- הכנס לחלוטין TCA אחד לפני הכנסת הבא. הניחו את ה-PCM המורכב חלקית בצד ליד סד ה-PCM ו-6 ברגים.
הערה: הכנסה לא מלאה של TCA תמנע מחלל הראש להגיע לנקודת הגדרת הלחץ והפריפוזט לא יזרום.
- מילוי שתי התוספות ב-MRM בפריפוזאט מאוזן מראש
- כדי לעשות זאת, 30 דקות לאחר שהמארז הורכב וה-MRM הגיע לטמפרטורה, העבירו את הפריפוזט המאוזן מראש לתוספת MRM שחוממה מראש על ידי פיזור עדין של הנוזל במורד הצדדים באמצעות פיפטה של 50 מ"ל.
הערה: צעדים אלה, כמו גם אלה בסעיף 3.6, צריכים להתבצע באופן מיידי כדי למנוע מעבר של גז בין perifusate ב- MRM לבין האטמוספירה.
- כדי לעשות זאת, 30 דקות לאחר שהמארז הורכב וה-MRM הגיע לטמפרטורה, העבירו את הפריפוזט המאוזן מראש לתוספת MRM שחוממה מראש על ידי פיזור עדין של הנוזל במורד הצדדים באמצעות פיפטה של 50 מ"ל.
- הרכבת MRM/PCM ליצירת אטם אטום לגזים ומיקום גלאי O2
- הניחו את ה-PCM על ה-MRM על ידי הכנסת צינורות ההתנגדות של ה-TCAs הנובעים מתחתית ה-PCM לתוך תוספות ה-MRM, 4 בכל צד של מחיצת ה-MRM. כיוון ה- PCM כך שתאי הרקמה יוכלו לנוח כנגד גלאי O2 ברגע שהוא ממוקם.
- אבטחו את ה-PCM ואת סד התמיכה ב-PCM בעזרת 6 הברגים באמצעות המברג החשמלי.
- אבטחו את ה-TCAs בתוך סנפירי התמיכה של ה-PCM באמצעות הרצועה האלסטית המסופקת על-ידי מתיחתם סביב הסנפירים של ה-PCM ברמת אטמי הגומי (איור 6).
- מקם את גלאי O2 על מעמד הגלאי כך שפניו יישענו על הסנפירים של ה- PCM. בדקו שזוגות ה-LED/photodetector מסתדרים עם הצבע הרגיש ל-O2 בחדרי הרקמות. במידת הצורך, כוונן את קווי העזר הרוחביים של גלאי O 2 לאחר שחרור ברגי הסט בצד מחזיק גלאי O2.
- הניחו את המכסה על גבי המארז.
- איזון הגז בחלל הראש ב-MRM עם הפריפוזט
- כאשר שסתום הלחץ הגבוה מאובטח וסגור במלואו, פתח את שסתום מיכל הגז על ידי סיבוב שסתום הצילינדר על גבי המיכל נגד כיוון השעון.
- התאם את וסת הלחץ הגבוה ללחץ של 10 psi באמצעות הידית על הרגולטור.
- לחצו על MRM על-ידי הגדרת וסת הלחץ הנמוך ל-1.0 psi (איור 7A).
- שחררו את צינור הטיהור (איור 7B) כדי לאפשר לגז מהמכל להחליף את האוויר בחלל הראש של MRM (מזרקי תרכובת הבדיקה נשארים מהודקים) למשך 15 דקות. אשרו את זרימת הגז על ידי השקעת קצה צינור הטיהור לתוך מים כדי לצפות בבעבוע.
- לאחר אישור הזרימה, הפעל את גלאי O2 כמתואר להלן בסעיף 3.8.
- לאחר 15 דקות, הפעל את המערבל במהירות 70 סל"ד והשאר את הריצה להמשך הניסוי. לאחר 15 דקות נוספות, הדקו את מכלול צינורות הטיהור (איור 7C).
- להוריד את הלחץ על וסת הלחץ הנמוך ללחץ ההפעלה המשיג את קצב זרימת הנוזל הרצוי (כפי שצוין על ידי חבילת הניסוי - בדרך כלל בין כ 0.5-0.7 psi). אם קצב הזרימה הוא מעל 20 μL/min, הגדר זמנית את הלחץ ל- 0.3 psi כדי לאפשר זמן לטעון את הרקמה מבלי שהתאים יעלו על גדותיהם. זה לא הכרחי אם הרקמה נטענת בתוך 15 דקות של מהדק להיות ממוקם.
הערה: אין לתת למאגר לזרום במורד החלק החיצוני של תא הרקמה, מכיוון שהנוזל יכול להפריע לחישת O2 .
- הפעלת גלאי O2
- הפעל את תוכנת גלאי O2 במחשב הנייד על ידי לחיצה על הסמל שכותרתו גלאי חמצן.
- לאחר פתיחת התוכנית (איור משלים 2), ודא שיציאת COM נכונה נבחרה. במידת הצורך, ניתן לזהות את יציאת ה- COM על-ידי ניתוק וחיבור גלאי O2 מהמחשב כך שמספר היציאה יוצג. אם יציאת ה- COM מנותקת בזמן שהיישום פועל, יש לסגור את היישום ולפתוח אותו מחדש לפני השימוש.
- לחץ על התחל ולאחר מכן על הקלט (ושמור את הנתונים בתיקיית הגיבוי). לאחר מכן, לחץ על גרף.
- שנה את הערך הממוצע בפינה השמאלית התחתונה של גרף החיים ל- 5 (המורה לתוכנית לחשב ממוצע נע עם 5 נקודות רצופות). לאחר שחלפה דקה ונקודת הנתונים הראשונה מוצגת במסך הגרפים, לחץ על קנה מידה אוטומטי.
4. העמסת רקמות ותקופת שיווי משקל (זמן: 90 דקות)
- מיקום השברים בתאי הרקמה
- הסירו את המכסה ואת החלקים האמצעיים של המארז.
- לאחר שהפריפוזט בתאי הרקמה עלה מעל החלק העליון של הפריט, דחפו את הפריט, עם רמז הפריט, על ידי הקשה קלה על החלק העליון של הפריט, כדי להסיר בועות אוויר שנוצרו מתחת או בתוך הפריט.
- מיקום frits על 0.25 אינץ 'מעל החלק התחתון של תא הרקמה.
- העמסת רקמות לתוך תאי הרקמה
- ברגע שרמת המדיה היא 0.5 אינץ 'מלמעלה, טען את הרקמה לחדר.
- טעינת רשתית או RPE-choroid-sclera: Harvest Retina או RPE-choroid-sclera כמתואר ב-6. כדי לטעון את הרקמה, השתמש במלקחיים נקודתיים עדינים כדי למקם בעדינות את הרקמה בכל חדר, תוך זהירות לא לקפל את הרקמה, תוך שימוש במגבון רקמה כדי למנוע מנוזלים מתא הרקמה לטפטף על חיישן O2 . שימו לב לרקמה שוקעת לכיוון ולתוך הפריט.
הערה: בין זמן קצירת הרקמה לבין העמסת הרקמה לתוך החדרים, ודא כי טראומה לרקמה נמנעת על ידי לא להשאיר את הרקמה בחיץ / מדיה מבוסס ביקרבונט מחוץ לאינקובטור במשך יותר מ -10 דקות ולוודא שהרקמה שטופה מספיק חוצץ/מדיה (לפחות 1 מ"ל / 10 מ"ג רקמה) כדי לשמור על הרקמה מלהפוך להיפוקסית ולמנוע חשיפה לאוויר. - טעינת תאי RPE על ממברנות טרנסוול: הכן תאי RPE כמתואר לעיל 12 ובקובץ משלים 1. תאי מעבר המשתמשים ב-0.25% טריפסין-EDTA וזרעים על פוליאתילן טרפתלט, מסננים חרוטים במסלול (תוספות תרבית תאים, גודל נקבוביות 0.4 מ"מ) בגודל מינימלי של 2.0 x 105 תאים לסמ"מ2. ביום הניסוי, חתכו את הקרומים לשלוש רצועות ברוחב שווה והעמיסו עם מלקחיים לתוך תאי הרקמה (ראו איור 8A).
- חיבור מכלולי צינורות הזרימה לתאי רקמה
- הסר את מכלולי צינורות הזרימה מהאריזה והנח את מפריד צינורות הזרימה על שפת החלק האמצעי של המארז כך שמתאמי צינורות הזרימה יהיו בחלק הפנימי של המארז (איור 8B,C).
- היזהרו לא ללחוץ חזק מדי על ה-TCAs (אחרת הם ישתחררו מה-MRM), חברו את מתאמי צינורות הזרימה לחלק העליון של תאי הרקמה TCAs (איור 8D). החלף את מרכז המארז וחבר מחדש את כבל בקרת טמפרטורת הסביבה.
- לפני החלפת מכסה המארז, ודא שהרכיבים של מערכת הפלואידיקה בתוך המארז, כולל גלאי O2 , PCM, תאי רקמות, צינורות יציאה, MRM ומחמם, ממוקמים כולם כראוי כפי שמוצג באיור 8E.
- החלף את מכסה המארז. הזינו את שמונת צינורות הזרימה החוצה דרך זרוע המדריך של אספן השברים.
- הפעלת אספן השברים
- ודא שקולט השברים ממורכז ביחס לקיר הימני של המארז ולמחזיק צינור היציאה: התמיכה השמאלית של בסיס אספן השברים צריכה להישען על קצה דופן התחום.
- במחשב הנייד, לחץ על קיצור הדרך של ממשק המשתמש ודף המידע הניסיוני ייפתח (איור משלים 3 למעלה).
- מלא את המידע בתיבות המתאימות בדף המידע של הניסוי (ניתן לעשות זאת לפני תחילת הניסוי) ולאחר מכן לחץ על הדף Flow &; Fraction Collector בחלק העליון (איור משלים 3 למטה).
- הגדרת פרמטרים למדידת קצב זרימה אוטומטית
- בחר את זמן השילוב הרצוי בתפריט הנפתח של זמן רכישת הדגימה באמצע העליון המאזן בין הדיוק הרצוי (שהוא פרופורציונלי לזמן השילוב) לבין הרזולוציה הזמנית.
- אם לא ייאספו שברי זרימה בניסוי, לחץ על התחל ועבור לסעיף 4.7. אם ייאספו שברים יוצאים, בצע שלבים בסעיף 4.6.
- איסוף שברים של זרימה יוצאת
- בתוכנת ממשק המשתמש, בדוק את אסוף שברים? בדף פרטי הניסוי או בדף אספן זרימה ושברים. לאחר מכן לחץ על הגדרות FC מחשוב לחצן.
- כאשר החלון החדש נפתח, מלא את זמן ההזרקה הראשונה בפרוטוקול (מוגדר כזמן = 0) ואת קצב הזרימה לערוץ, וכן את מרווחי הזמן עבור כל דגימה. לאחר מכן, לחץ על מחשוב.
- לאחר אימות מרווחי הזמן של האוסף, לחץ על צור והתחל.
- מדידת קצבי זרימה עבור ערוצים בודדים (אופציונלי)
- אם יש למדוד את קצבי הזרימה של תעלות בודדות (שבתנאים רגילים משתנים באחוזים ספורים בלבד), שקלו שמונה צינורות מיקרוצנטריפוגות (או פחות), ורשמו את משקלם.
- הגדר את מחזיק הצינור המכיל את צינורות המיקרוצנטריפוגות שנשקלו מראש על עגלת הצלחת. לחץ על מדידת קצב זרימה באופן ידני במקטע כלי עזר אחרים.
- בחרו את משך המדידה ולאחר מכן לחצו על ' צור תבנית'. סגור את החלון ולחץ על התחל. קולט השברים יאסוף נוזלים מצינורות הזרימה למשך המדידה ואז הזרוע תחזור למקומה הביתי.
- שקול את צינורות המיקרופוגה לאחר האיסוף והשתמש בהפרש המשקל חלקי משך המדידה כדי לחשב את קצב הזרימה (כאשר 1 מ"ג = 1 מיקרוליטר).
- ייצוב קו בסיס
- לאחר שהרקמה ו/או התאים הועמסו לתוך תאי הרקמה, אפשרו למערכת להתאזן למשך 90 דקות כדי לקבוע קו בסיס שטוח של צריכת O2 , ואז ניתן להזריק את תרכובת הבדיקה הראשונה (הנחשבת לזמן = 0).
- 30 דקות לפני הזריקה הראשונה, הזן את ממוצע הערך האחרון של 3 FR לערוץ בדף ההזרקה להכנת זריקות מורכבות בדיקה.
5. פרוטוקול ניסוי (זמן: 2-6 שעות)
הערה: לאחר ייצוב קו הבסיס בעיצומו, המשימות הבאות הן הזרקת תרכובות הבדיקה והחלפת לוחות על אוסף השברים אם ייעשה שימוש ביותר מאחד.
- הכנת תרכובת הבדיקה להזרקה
- הזן את שמות התרכובות, הריכוזים הרצויים (תמיסות סופיות ותמיסות מלאי) וזמני ההזרקה של תרכובות הבדיקה לטבלה בממשק המשתמש בדף הזרקה. אשרו את המידע המוצג בתוכנית, כולל נפחים ב-MRM שנותרו בזמן ההזרקות וכמה תמיסת מלאי להזריק כדי להשיג את הריכוזים הרצויים (איור משלים 4).
- כדי לחשב כמה היקף ומלאי דרושים להזרקה, מלא את התיבות הלבנות של טבלת ההזרקה ולחץ על מחשוב. באמצעות הערכים המחושבים, יש לדלל את תמיסת תרכובת הבדיקה עם פריפוזט לפני ההזרקה, כך שהנפח המוזרק הוא 5% מהנפח ב-MRM לאחר ההזרקה.
- הכינו כל תרכובת בדיקה על ידי ערבוב תמיסת הציר והפריפוסט. יש לטעון את המזרקים לפחות 10 דקות לפני זמן ההזרקה ולשמור באינקובטורCO2 (נשמר בטמפרטורות שבין 37-40 מעלות צלזיוס) עד מוכנים להזרקה.
- הזרקת תרכובות בדיקה
- חברו את המזרק המכיל את תרכובת הבדיקה לקווי ההזרקה (איור 9A). שחררו את הצינורית בעלת הדפנות הרכות המובילות לקו ההזרקה והזריקו באיטיות תרכובות בדיקה (איור 9B) בקצב של כ-3 מ"ל/דקה. הדקו מחדש את הצינורית על קו ההזרקה ולאחר מכן הסירו את המזרק (איור 9C); חזור על הפעולה עבור הצד השני של ה-MRM.
- לאחר הזרקת כל תרכובת בדיקה, הכינו כל תרכובת בדיקה עוקבת להזרקה בהתאם לדף הזרקת ממשק המשתמש.
- קביעת אות זרימה O2 עבור כל ערוץ
- בסוף כל ניסוי, הזריקו את מעכב הנשימה KCN (3 מילימול) כדי לקבוע את אות אורך החיים של הזרימה עבור כל ערוץ המשמש לתיקון השונות במשך חיי החיישן הבסיסי ובצריכה הלא מיטוכונדריאלית של חמצן.
6. סיום הניסוי ופירוק המערכת (זמן: 30 דקות)
- שמירת נתוני חמצן
- לחץ על להציל כפתור בפינה השמאלית העליונה של חלון הגרפים בתוכנת גלאי החמצן; תן שם לקובץ ואחסן אותו בתיקיה שבה הקובץ יישמר. לחץ על תפסיק הקלטה כפתור בחלון הראשי כדי לשמור את קובץ הגיבוי.
- שמירת קובץ המידע הניסיוני של ממשק המשתמש
- לחץ על לחצן שמור פרופיל בפינה השמאלית העליונה של הדף הכללי של ממשק המשתמש; תן שם לקובץ ואחסן אותו בתיקיה שבה הקובץ יישמר. בדף שבר וזרימה של ממשק המשתמש, לחץ על התפריט הנפתח כלים ולאחר מכן על שמור. שמור את השם שנוצר או בחר שם אחר ואחסן את הקובץ במקום הרצוי. במידת הצורך, ישנם קבצי גיבוי שניתן לגשת אליהם ולשמור אותם.
- פירוק הכלי
- מכיוון ש-KCN הוא נדיף, יש להיפטר ממכלולי פלואידים במכסה מנוע; יש לשפוך מדיה ממגש האשפה MRM ו-FC למיכל אשפה, לשטוף היטב את תוספות ה-MRM ולערבב היטב במים. יש לשפוך את תכולת מכל הפסולת (המכיל KCN) לתוך מיכל פסולת כימית מסומן לסילוק לאחר מכן על ידי בטיחות כימית. לפני הניסוי הבא, נקו היטב את מוטות הערבוב והמלקחיים.
7. עיבוד נתונים (זמן: 15-45 דקות)
- פתחו את יישום מעבד הנתונים במחשב Mac או PC. בחר את קובץ הנתונים .csv שנוצר על-ידי ניסוי. אם פרוטוקול ניסוי זה דומה לניסוי שניתח בעבר, בחר בקובץ הגדרות זה ולחץ על השלב הבא. אחרת, פשוט לחץ על השלב הבא כדי להתחיל להזין את הגדרות הניסוי.
- מלא את ההגדרות השונות של הניסוי. בקביעת נקודת זמן הייחוס, בחר את נקודת הזמן ישירות לפני כניסת KCN לתוקף וערכי משך החיים פחתו. בחר נקודה זו באמצעות מחוון או על-ידי הקלדת ערך השעה בתיבה.
- לחץ על חשב כדי ליצור גרפים של זיהוי תווים אופטי (OCR) בהתאם למשוואה 2:
OCR = ([O 2]in- [O 2]out) x FR = (217 nmol/mL - [O 2]out) x FR/בסיס רקמות (Eq. 2)
כאשר ריכוז O 2 ב-KRB כאשר הוא נמצא בשיווי משקל עם 21% O2 ב-37°C הוא 217 ננומול/מ"ל, FR הוא קצב הזרימה (במ"ל/דקה), בסיס הרקמה הוא כמות הרקמה המוטענת לתוך התא (כלומר, מספר הרשתיות, תאי RPE-choroid-sclera או RPE). - שמרו את התרשימים כקובצי .pdf בלחיצה על הלחצן ' יצא תרשים' . צור תרשים של זיהוי תווים אופטי (OCR) כערכים מוחלטים, או כשבריר מערך מצב יציב על-ידי סימון התיבות התואמות לתרכובת הבדיקה שתוגדר ל- 1 בעמוד הגדרות העריכה.
8. בדיקות של שברים outflow
- אם לא ניתן לבדוק דגימות מיד לאחר הניסוי, הניחו את הלוחות בטמפרטורה של 4 מעלות צלזיוס אם נבדקו למחרת, או הוקפאו אם אוחסנו זמן רב יותר. אם הצלחות קפואות, אז להפשיר דגימות ב 4 ° C (כך הדגימות להישאר קר).
- לאחר ביצוע הבדיקות על שברי הזרימה שנבחרו, עמודות הנתונים (אחת לכל ערוץ) מוזנות לקובץ .csv עם זמן (במינימום) בעמודה השמאלית ביותר, וריכוז בימין (ב- nmol/mL או ng/mL); קישור בתוכנית עיבוד הנתונים בעת לחיצה מעלה תבנית.
- העלה קובץ זה למעבד הנתונים כדי לחשב ולהתוות את הנתונים.
תוצאות
כדי להמחיש את הרזולוציה של הנתונים שנוצרו מרכיבים מבודדים של העין, OCR ו- LPR נמדדו עם שלושה סוגי רקמות (רשתית, RPE-choroid-sclera, ותאי RPE) בעקבות פרוטוקול נפוץ (מבחן מאמץ מיטוכונדריאלי10; איור 10, איור 11 ואיור 12). כמות הרקמה המשמשת עבור כל רקמה מוצגת בטבלה 1. הנתונים עובדו וטופלו בגרפים באמצעות חבילת התוכנה שפותחה עבור מערכת פלואידיקה. הכנת הרשתית ו-RPE-choroid-sclera היא פשוטה יחסית ואורכת פחות מ-20 דקות לכל סוג רקמה. OCR היה קבוע בזמן שהוזרקו תרכובות הבדיקה, מה שמצביע על בריאות ותפקוד יציבים של הרקמה ותומך בתוקף השיטה (איור 10). לאחר שאומתו עבור כל סוג רקמה, לא מצאנו צורך להריץ בקרות שבהן לא מוזרקות תרכובות בדיקה לכל ניסוי. בהתאם לנתונים שהתקבלו באמצעות שיטות פריפיוז'ן קונבנציונליות יותר 6,8,13, OCR ירידה בתגובה לאוליגומיצין ועלייה ב- OCR בתגובה ל- FCCP. שינויים ב-LPR היו בכיוון ההפוך מאלה שנצפו עבור OCR: אוליגומיצין הגביר את LPR, אשר לאחר מכן ירד (אך רק מעט) בתגובה ל-FCCP (איור 11). כדי להשוות את המובהקות הסטטיסטית של ההשפעה של כל תרכובת בדיקה רציפה, בוצעו בדיקות t (אשר מחושבות באופן אוטומטי על ידי התוכנה המצורפת למכשיר). מכיוון שמטרת המאמר הייתה לתאר כיצד לבצע את השיטה, מספר ההעתקים שנשאו לא תמיד היה גבוה מספיק כדי לייצר מובהקות סטטיסטית. עם זאת, באופן כללי, כאשר מספר העותקים המשוכפלים היה 3 או יותר, ההשפעות של FCCP ואוליגומיצין הן על OCR והן על LPR היו משמעותיות.
תאי RPE לא נותחו בעבר עם מערכות זרימה, אך הגיבו באופן דומה לתאי RPE-choroid-sclera (בהתאם לדעה שחלק גדול של OCR נובע מתאי RPE; איור 11). דוגמאות אלה מדגישות את יכולתה של המערכת לשמור על כדאיות הרקמה כפי שהיא משתקפת ביציבות של OCR בתעלות הבקרה, ואת יחס האות לרעש הגבוה עבור שינויים ב-OCR בסדר גודל המושרה על ידי אוליגומיצין ו-FCCP, שהיה יותר מ-100 ל-1. בנוסף, ניתן להשתמש במבדקים של שברי זרימה כדי לתאם את קצב הקליטה או הייצור של מגוון רחב של תרכובות המתחלפות עם הנוזל החוץ תאי המשלימות את OCR (במקרה זה, LPR). תכונות אלה של המכשיר אפשרו כימות מדויק של הבדלים אופייניים בתגובות הרקמה בין סוגי רקמות שבוצעו במקביל. OCR על ידי RPE-choroid-sclera ותאי RPE רגישים באופן עקבי יותר לאוליגומיצין מאשר רשתית (איור 11 ואיור 12), אם כי עבור RPE-choroid-sclera משך החשיפה ל-FCCP לא היה ארוך מספיק כדי להגיע למצב יציב. נקודה שיש לקחת בחשבון התעוררה בעת שימוש ב- DMSO כממס. בריכוזים גבוהים יותר, (0.2%) DMSO השפיע באופן חולף על OCR על ידי הרשתית (ככל הנראה משקף השפעה של שינוי בלחץ האוסמוטי שנגרם על ידי השפעת DMSO על חדירות הממברנה).
בהתבסס על ההנחה ש-KCN מעכב לחלוטין את הנשימה על ידי פעולתו הישירה על ציטוכרום c אוקסידאז, OCR בסוף החשיפה ל-KCN מוגדר ל-0 וכל ערכי ה-OCR מחושבים על בסיס השינוי ביחס לערך KCN. OCR יכול להתרחש ללא תלות בשרשרת הנשימה ובציטוכרום c אוקסידאז. עם זאת, גודל התרומה הזו ל-OCR הכולל הוא בדרך כלל לא יותר מאחוזים בודדים (הנתונים לא מוצגים) ומשך הזמן הממושך שבו הרקמה נחשפת ל-KCN מבטיח שמצעים של אוקסידאזים שאינם חלק משרשרת הובלת האלקטרונים הידלדלו.
ניתוח סטטיסטי
ניסויים בודדים הוצגו כפי שמצוין באיורים, אך עם ערוצים מרובים שהיו ממוצעים. הנתונים הוצגו בגרפים כממוצע ± שגיאת התקן (SE; מחושב כ-SD/√n).
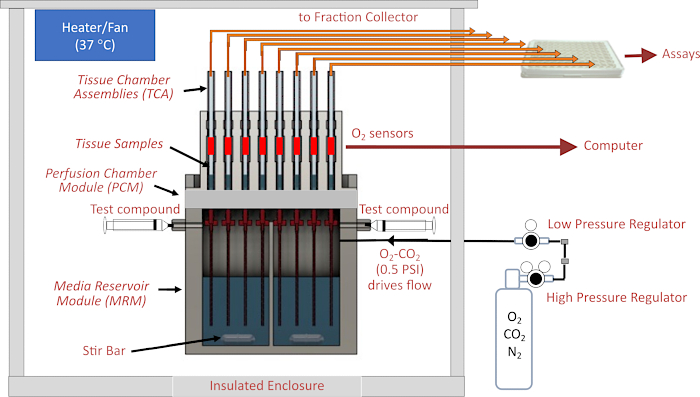
איור 1. סכמטי של מערכת הפלואידיקה/הערכה. המרכיבים העיקריים כוללים את המארז, רכיבי בקרת טמפרטורה, מערכות פלואידיקה ותאי רקמות, ויסות לחץ הגז בחלל הראש מעל פריפוזאט, ניטור אספן שברים / קצב זרימה, וגלאי O2 . קיצורים: MRM = מודול מאגר מדיה, PCM = מודול תא היתוך, TCA = מכלולי תאי רקמות. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 2. (A) תמונה של המרכיבים העיקריים של המכשיר. המרכיבים העיקריים כוללים מיכל גז (וסתי לחץ), מארז, אספן שברים ומחשב. (B) תרשים זרימה ניסיוני המציג את קטגוריות השלבים העיקריות ואת הזמן שנדרש להשלמתן. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 3. מבט על MRM. ה-MRM מוצג עם תוספת MRM (משמאל) ומוטות ערבוב (מימין) הממוקמים בתחתית תוספות ה-MRM (ממוקמות בכל צד של מחיצת MRM). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 4. הרכבת צינורות וטיהור מכלול צינורות ב- MRM. (A) בדיקת מכלול צינורות הזרקה מורכבים ומכלול צינורות טיהור המחוברים ליציאות ב-MRM. (ב-ג) מכלול ההזרקה של תרכובת הבדיקה ומכלול צינורות הטיהור (B) ממוקמים בחריץ בחזית המארז (C). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 5. הפעלת בקר הטמפרטורה MRM. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 6. תאי רקמות ומיכל גז. מיקום גלאי O2 על מעמד הגלאי (התומך גם ב-MRM וב-PCM), ומיקום הרצועה סביב הסנפירים של ה-PCM המסייעים לאבטח את תאי הרקמה במקומם. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 7. (A) וסתי לחץ גבוה ונמוך במיכל הגז. (ב-ג) צינור טיהור. צינור הטיהור מאפשר למרווח הראש ב-MRM להתנקות מהאוויר ולהתמלא בגז ממיכל האספקה. תמונות המציגות צינור טיהור פתוח (B) וצינור טיהור סגור (C). מכלול ההזרקה של תרכובת הבדיקה נשאר סגור לאורך תהליך הטיהור. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 8. תא הרקמה ומערך היציאה. (A) מידות קרום הטרנסוול לאחר חתיכתו לשלוש רצועות ברוחב שווה. (B) תמיכה בזרימה מרובת צינורות. (C) תמיכה מרובת צינורות המוציאה החוצה הממוקמת על שפת המארז עם מתאמי הצינור ליד תאי הרקמה. (D) תמונה של מכלולי צינורות זרימה המחוברים לתאי הרקמה. (ה) תצלום אוויר של המתחם ללא מכסה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 9. הזרקת תרכובת ב-MRM. הזרקת תרכובת בדיקה דרך פתח ההזרקה לתוך MRM באמצעות מזרק 5 מ"ל. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
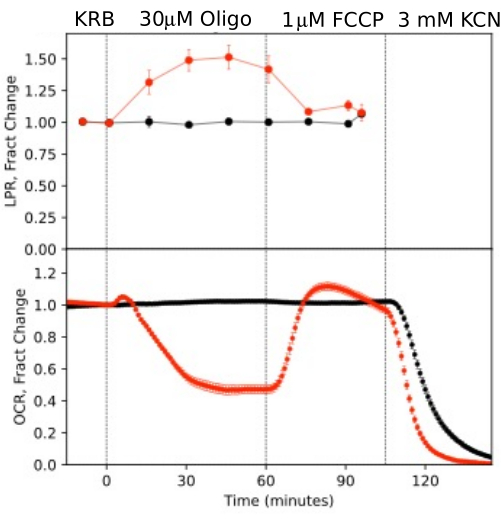
איור 10. עקומות OCR ו-LPR בתגובה לתרכובות בדיקה. OCR ו- LPR על ידי רשתית מבודדת מעכברים (רשתית אחת / ערוץ) בתגובה לנוכחות או היעדר (בקרה) של תרכובות בדיקה כפי שצוין. כל עקומה היא הממוצע של 6 עותקים משוכפלים מניסוי יחיד (קווי שגיאה הם SE; ערכי p מחושבים על ידי ביצוע מבחני t זוגיים המשווים ערכי מצב יציב עבור כל סוכן בדיקה לזה של סוכן הבדיקה הקודם). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
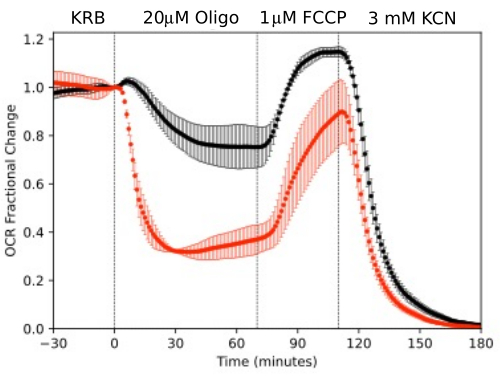
איור 11. עקומות זיהוי תווים אופטי (OCR). OCR על ידי RPE-choroid-sclera ורשתית שבודדה מעכברים (רשתית אחת או 2 RPE-choroid-sclera/channel) שנמדדו במקביל בתגובה לתרכובות הבדיקה כפי שצוין. נתונים הם הממוצע של עותקים משוכפלים מניסוי יחיד (n = 2 ו- 4 עבור RPE-choroid-sclera ורשתית בהתאמה; ערכי p מחושבים על ידי ביצוע בדיקות t זוגיות המשווה ערכי מצב יציב עבור כל סוכן בדיקה לזה של סוכן הבדיקה הקודם). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
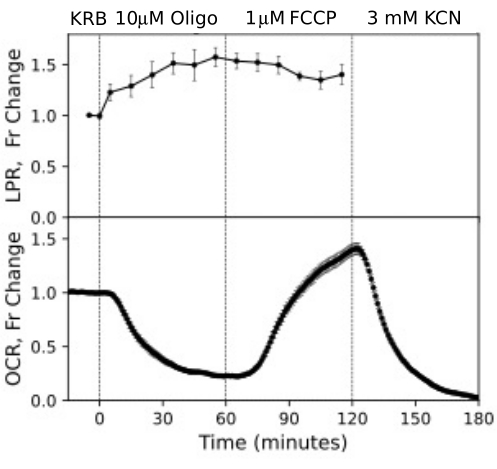
איור 12. עקומות OCR ו-LPR מתאי RPE. OCR ו- LPR מתאי RPE המחוברים לממברנות טרנסוול שנחתכו לרצועות והועמסו לתאי הפריפוזיה. נתונים הם הממוצע של עותקים משוכפלים מניסוי יחיד (n = 3, עם 1.5 ממברנות לערוץ (360,000 תאים לערוץ); ערכי p מחושבים על ידי ביצוע בדיקות t זוגיות המשווה ערכי מצב יציב עבור כל סוכן בדיקה לזה של סוכן הבדיקה הקודם). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
| רקמה/תא | סכום/ערוץ | קצב זרימה: מ"ל/דקה |
| רשתית (עכבר) | 1 | 0.025 |
| RPE-choroid-sclera (עכבר) | 2 | 0.02 |
| תאי RPE על ממברנות Transwell | 360,000 תאים (4 x 1/3 רצועות מסנן) | 0.016 |
טבלה 1. מפרטי הפעלה מומלצים לרקמות שונות.
תרשים משלים 1. ייצוג גרפי של עיצוב ניסיוני. עיתוי והרכב החשיפה לתרכובות בדיקה, ועיתוי איסוף השברים. תוספת ריכוז (Conc Inc) היא השינוי בריכוז שיש ליישם. אנא לחץ כאן כדי להוריד קובץ זה.
תרשים משלים 2. ממשק משתמש בעת ההפעלה. ממשק המשתמש של חלון ההפעלה של תוכנת הזיהוי O 2 המנטרת את ה- O2 בתאי הרקמה המוכנסים ל- PCM. אנא לחץ כאן כדי להוריד קובץ זה.
תרשים משלים 3. ממשק משתמש עבור הגדרות ניסוי. ממשק משתמש להזנת מידע ניסיוני (משמאל) ובחירת מועדים לאיסוף שברי זרימה (מימין). אנא לחץ כאן כדי להוריד קובץ זה.
תרשים משלים 4. ממשק המשתמש של דף ההזרקה. דף הזרקה המחשב את נפחי ההזרקה בהתבסס על ריכוזי תרכובת הבדיקה הרצויה והנפח שנותר ב-MRM. אנא לחץ כאן כדי להוריד קובץ זה.
קובץ משלים 1: שיטות להכנת דגימת רקמות. אנא לחץ כאן כדי להוריד קובץ זה.
Discussion
בשל חשיבותה של הביו-אנרגטיקה בכל היבטי תפקוד התא ותחזוקת מרכיבי העין השונים, קיים צורך קריטי בשיטות לחקר ויסותה. בפרט, הרשתית העצבית ו- RPE תלויים בחילוף החומרים הן לייצור אנרגיה והן לאיתות תוך תאיובין-תאי 14,15,16,17. בגלל יכולת החמצון הגבוהה שלהן, רקמות מבודדות של העין אינן מתוחזקות היטב בתנאים סטטיים18,19 ולכן מחקר של רכיבים מבודדים של העין דורש מערכות זרימה שיכולות גם לשמור וגם להעריך תהליכים מטבוליים. מערכת הפלואידיקה פותחה כדי להפיק נתוני OCR ו-LPR ממגוון רחב של סוגי רקמות, ובמאמר זה הצגנו פרוטוקולים מפורטים שנמצאו כמניבים תוצאות אופטימליות.
הגורם העיקרי להפקת נתונים חזקים באמצעות מערכת הזרימה כולל שיווי משקל מראש של מדיה/חיץ מבוסס CO2 ב-39°C (כדי להבטיח שהפריפוזאט אינו רווי בגז מומס שירד מהגז במהלך הניסוי). בפרט, מדיה או חיץ KRB המאוחסנים ב -4 ° C יהיו רוויים ביחס ל -37 ° C וירדו מהגז במהלך הניסוי אם זמני טרום שיווי משקל אינם מספיקים. בנוסף, אסור שהרקמה המועמסת לתוך תאי הרקמה תעבור טראומה על ידי בידוד לא תקין של רקמה עקב קריעה או הפרדה לא מלאה של רקמה, או על ידי חשיפת רקמה בכמות נמוכה של חיץ מבוסס ביקרבונט לאוויר האטמוספרי למשך זמן רב מדי. בקרת הטמפרטורה, יציבות הזרימה והאמינות של זיהוי O2 הם בעלי שונות מועטה וגורמים אלה אינם תורמים באופן משמעותי לשיעור הכשלים.
למכשיר שמונה תעלות זרימה / תאי רקמה הפועלים בו זמנית המסופקים עם פריפוזט משני מאגרים, ארבעה תאי רקמה לכל מאגר. כדי לקבל את מסלולי הזמן המדויקים ביותר של OCR, עקומות קינטיות מתוקנות על ידי תאים שאינם עמוסים ברקמות. לפיכך, פרוטוקול ניסויי טיפוסי יכלול שתי קבוצות של שלושה תאי רקמה. פרוטוקולים באופן כללי מתחלקים לשתי קטגוריות: האחת היא פרוטוקולי תרכובת הבדיקה השונים בכל צד (למשל תרופה/רכב בצד אחד של MRM, ורק רכב בצד השני); השני הוא אותו פרוטוקול הזרקת תרכובת בדיקה משני צידי ה-MRM, אך מודל רקמות או רקמות שונה בכל צד של ה-MRM. במאמר זה, ההשפעות של אוליגומיצין ו-FCCP על הרשתית הושוו ל-OCR על ידי רקמות שלא נחשפו לתרכובות בדיקה כלשהן, ושתי רקמות הוערכו במקביל תחת אותו פרוטוקול ותנאים לזיהוי התנהגות ספציפית לרקמה. האחרון הודגם במחקר זה על ידי הצגת טווח דינמי מוגבר של קצב חילוף החומרים על ידי RPE-choroid-sclera ביחס לרשתית במקביל באותו ניסוי. דוחות אחרים תיארו מגוון רחב יותר של תכנוני מחקר, כולל מדידת ההשפעות המשתנות של רמות O2 על OCR ו- LPR, ותלות בריכוז של דלקים, תרופות ורעלים20,21. בנוסף, למרות שהגבלנו את הניתוח של שברים החוצה למדידת לקטט וחישוב של LPR, תוכן המידע של ניסוי גדל מאוד אם תרכובות מרובות וסוגים של תרכובות בשברים החוצה נבדקים כגון הורמונים, נוירוטרנסמיטרים, אותות תאיים, מטבוליטים שיכולים לצאת התאים20,22, 23.
ההעמסה של רשתית מבודדת או RPE-choroid-sclera היא פשוטה, ולאחר בידוד רקמות אלה פשוט ממוקמים בחלק העליון של חדרי הרקמה עם מלקחיים ומותר לשקוע למטה אל frit. תאי RPE בתרבית על תוספות מסנן מפתחים קיטוב מתאים וסמנים של בשלות RPE לאחר 4-8 שבועות בתרבית. אין זה ריאלי להסיר את RPE לאנליזה של תאים חיים לאחר חיבורו לקרום הטרנסוול, אם יש לשמור על בשלות וקיטוב RPE24. תא הפריפוזיה יכול להכיל רצועות של קרום הטרנסוול שנחתכות באזמל בזמן שהן שקועות בחיץ ומוחדרות במהירות לתאי הרקמה. למרות שחיתוך רצועות מסנן הוכנס למערכת סטטית24, אין שיטה אחרת להערכת סוגי תאים חשובים אלה. התגובות של תאי RPE היו מהירות ודינמיות יותר מאשר הרשתית או RPE-choroid-sclera, ככל הנראה בשל גישה מיידית של שני ההיבטים האפיקליים והבזאליים של תאי RPE שהוגדרו כשכבה אחת על תוספת הממברנה.
גורם נוסף המבטיח שלנתונים יש את האות הגבוה ביותר לרעש הוא בחירת היחס האופטימלי של הרקמה המוטענת לתאי הפריפיוז'ן ביחס לקצב הזרימה. מעט מדי רקמה ביחס לקצב הזרימה גורמת להפרש של ריכוז O2 מומס בין זרימה לזרימה החוצה שהוא קטן מאוד וקשה למדוד אותו בצורה אמינה. לעומת זאת, אם הזרימה איטית מדי, אז הריכוז של O2 הופך להיות כל כך נמוך כי הרקמה מושפעת היפוקסיה. עם זאת, זרימת נוזל מונעת לחץ גז יכולה להישמר בקצבי זרימה של עד 5 מ"ל / דקה הדורשים רק כמויות קטנות של רקמה למדידות OCR ו- LPR מדויקות. בניסויים המוצגים כאן, נעשה שימוש בכ-20 מ"ל/דקה/תעלה שהתאימו לרשתית אחת, לשני תאי RPE-choroid-scleras, או ל-360,000 תאי RPE. כדי למזער את השפעות המערכת המעכבות ומפזרות את חשיפת הרקמה לתרכובת הבדיקה המוזרקת, מסופקים גדלים מרובים של תאי הרקמה, כך שכמות הרקמה (וקצב הזרימה) מותאמים לגודל המתאים של החדר.
הנתונים מהניתוחים המוצגים במאמר זה יוצגו בשתי דרכים: גודל מוחלט ביחס לקצב, או שינויים חלקיים ביחס למצב יציב או קו בסיס. ההתמקדות הייתה בהמחשה של מדידת תגובות לתרכובות בדיקה. עם זאת, מערכת הפלואידיקה מתאימה היטב להעריך ולהשוות השפעות של טיפול ברקמות לפני ניתוח פריפוזיה כגון שינויים גנטיים. בדיקה אם טיפול שונה משליטה היא חזקה ביותר אם מנותחות השפעות הטיפול על תגובות מנורמלות של תרכובות בדיקה. אם הניתוח דורש סדרי גודל מוחלטים, הכוח הסטטיסטי של ניתוחי הדגימות המטופלות מראש הוא מקסימלי אם הערכתם והבקרות שלהם מתבצעות באותו ניסוי פריפיוז'ן.
למעט הבוחש, כל החלקים הבאים במגע עם נוזל מסופקים על ידי היצרן כחומרים מתכלים ועברו עיקור. אין לעשות שימוש חוזר בחלקים אלה, מכיוון שניסויים יאבדו מדי פעם עקב ניקוי לא שלם ומשטחים מזוהמים. המערכת בתחילת ההתקנה היא סטרילית. עם זאת, התקשורת מתווספת ל- MRM, ורקמות נטענות בתאים בתנאים לא סטריליים. מדדנו OCR במערכת שמורכבת מחלקים סטריליים, אך הניסוי עצמו מתבצע בתנאים לא סטריליים. לוקח בערך 14 שעות לחיידקים להצטבר עד כדי כך שיש OCR מדיד (תוצאות שלא פורסמו). אם משתמשים בפרוטוקולים שהם פחות מ -10 שעות בערך, אז הצטברות של חיידקים וכל ההשפעות הנובעות מהם יהיו זניחים.
חוקרים רבים משתמשים במכשירים שנועדו למדוד OCR תחת דגירה סטטית של שכבה אחת של תאים עם תפוקה גבוהה יחסית25,26. לעומת זאת, מכשיר הפלואידיקה שבדקנו ותיארנו במאמר זה שומר על הרקמה על ידי הבטחת אספקת O2 נאותה, שהיא קריטית למרחקי הדיפוזיה הגדולים יותר הנמצאים בדגימות רקמה. בנוסף, הוא מסוגל לאסוף שברים המאפשר הערכה של פרמטרים מרובים במקביל OCR אשר משפר מאוד את היכולת לחקור את היחסים ביניהם. לבסוף, ניתן לשלוט בריכוזי הגזים המומסים (כגון O 2 ו-CO 2), מה שמגדיל את משך הניסויים עם מדיה וחיץ מבוססי ביקרבונט, מה שמאפשר למשתמש לחקור את ההשפעות של O2. יש לציין, מגבלה עבור שתי המתודולוגיות היא חוסר היכולת לחקור את השטיפה של תרכובות בדיקה, פונקציונליות כי מערכות perifusion אחרים יש 4,27,28. שיקול נוסף בקביעת שיטת הניתוח האופטימלית הוא העובדה שמערכות פלואידיקה משתמשות ביותר מדיה ותרכובות בדיקה מאשר מערכות סטטיות. ההוצאה הנוספת ממוזערת עם מערכות הפלואידיקה הנוכחיות, אם כי בשל שיעורי הזרימה הנמוכים שניתן להשתמש במערכת.
בסך הכל, מתואר תיאור מפורט של הפרוטוקולים לביצוע ניסויים עם מכשיר זרימה/הערכה חדש. נתונים שנוצרו עם רשתית ו- RPE-choroid-sclera חזרו על תוצאות קודמות שהתקבלו עם מערכות שהן הרבה יותר קשות לשימוש (ולא זמינות). כמו כן הוכח כי המערכת יכולה לשמור ולהעריך תאי RPE המחוברים לממברנות טרנסוול, מודל תאי חשוב מאוד שלא נותח בעבר עם מערכות זרימה בשל שבריריות התאים. חלקיו העיקריים של הפרוטוקול מורכבים מזמן התקנה של 75 דקות, ואחריו תקופת שיווי משקל של 90 דקות והפרוטוקול הניסיוני שהופך אותו למתאים לשימוש שגרתי על ידי מעבדות שאינן מתמחות בהפעלת מערכות פלואידיקה. למרות שהתמקדנו במדידת התגובה החריפה של רקמה לבדיקת תרכובות, המערכת מתאימה מאוד להשוואת רקמות ממקורות שונים כגון מודלים של בעלי חיים או מודלים של תאים ששונו גנטית או עברו טיפולים/מצבים ניסיוניים. בנוסף, היקף הבדיקות שניתן לבצע על שברי הזרימה הוא רחב וכולל מטבוליטים, מולקולות איתות תאיות והורמונים / מוליכים עצביים המופרשים וכן אנליזה מרובת רכיבים הנוצרת על ידי ספקטרומטריית מסות על השברים כמו גם על הרקמה.
Disclosures
ל-I.R.S., M.G. ו-K.B יש קשרים פיננסיים עם EnTox Sciences, Inc. (Mercer Island, WA), היצרן/מפיץ של מערכת BaroFuse perifusion המתוארת במחקר זה. כל שאר המחברים מצהירים שאין ניגודי עניינים.
Acknowledgements
מחקר זה מומן על ידי מענקים מהמכונים הלאומיים לבריאות (R01 GM148741 I.R.S.), U01 EY034591, R01 EY034364, קרן BrightFocus, מחקר למניעת עיוורון (J.R.C.) ו- R01 EY006641, R01 EY017863 ו- R21 EY032597 (J.B.H).
Materials
| Name | Company | Catalog Number | Comments |
| BIOLOGICAL SAMPLES | |||
| C57BL/6J mice | Envigo Harlan (Indianapolis, IN) | N/A | |
| REAGENTS | |||
| FCCP | Sigma-Aldrich | C2920L9795 | |
| Glucose | Sigma-Aldrich | G8270G | |
| KCN | Sigma-Aldrich | 60178 | |
| Lactate | MilliporeSigma | L6661 | |
| Oliigomycin A | Sigma-Aldrich | 75351L9795 | |
| CELL CULTURE AND TISSUE HARVESTING | |||
| Beuthanasia-D | Schering-Plough Animal Health Corp., Union, NJ | N/A | |
| Bovine serum albumin | Sigma-Aldrich | A3059 | |
| Euthasol, 390 mg/ml sodium pentobarbital | Virbac | RXEUTHASOL | |
| Fetal bovine serum | Sigma-Aldrich | 12303C | |
| Hank’s Buffered Salt Solution | GIBCO | 14065056 | |
| Krebs Ringer Bicarbonate (KRB) | Thermo Fisher Scientific | J67795L9795 | |
| Matrigel | ThermoFisher | #CB-40230 | |
| Penicillin-streptomycin | ThermoFisher Scientific | 15140122 | |
| ROCKi | Selleck Chemicals | Y-27632 | |
| Trypsin-EDTA | ThermoFisher | #25-200-072 | |
| SUPPLIES | |||
| Gas Cylinders: 21% O2/5% CO2/balance N2 | Praxair Distribution, Inc | N/A | |
| Transwell filters | MilliporeSigma | 3470 | |
| COMMERCIAL ASSAYS | |||
| Amplex Red Glucose/Glucose Oxidase Assay Kit | ThermoFisher | A22189 | |
| Glucose Oxidase from Aerococcus viridans | Invitrogen (Carlsbad, CA) | A22189L9795 | |
| Lactate Oxidase | Sigma-Aldrich | L9795 | |
| EQUIPMENT | |||
| BaroFuse Multi-Channel Perifusion system | EnTox Sciences, Inc (Mercer Island, WA | Model 001-08 | |
| Synergy 4 Fluorometer | BioTek (Winooski, VT) | S4MLFPTA |
References
- Lacy, P. E., Walker, M. M., Fink, C. J. Perifusion of isolated rat islets in vitro: Participation of the microtubular system in the biphasic release of insulin. Diabetes. 21 (10), 987-998 (1972).
- Doliba, N. M., et al. Metabolic and ionic coupling factors in amino acid-stimulated insulin release in pancreatic beta-HC9 cells. American Journal of Physiology. Endocrinology and Metabolism. 292 (6), E1507-E1519 (2007).
- Sweet, I. R., et al. Regulation of ATP/ADP in pancreatic islets. Diabetes. 53 (2), 401-409 (2004).
- Chertov, A. O., et al. Roles of glucose in photoreceptor survival. The Journal of Biological Chemistry. 286 (40), 34700-34711 (2011).
- Kooragayala, K., et al. Quantification of Oxygen Consumption in Retina Ex Vivo Demonstrates Limited Reserve Capacity of Photoreceptor Mitochondria. Investigative Ophthalmology & Visual Science. 56 (13), 8428-8436 (2015).
- Bisbach, C. M., et al. Succinate Can Shuttle Reducing Power from the Hypoxic Retina to the O2-Rich Pigment Epithelium. Cell Reports. 31 (5), 107606 (2020).
- Du, J., et al. Inhibition of mitochondrial pyruvate transport by zaprinast causes massive accumulation of aspartate at the expense of glutamate in the retina. The Journal of Biological Chemistry. 288 (50), 36129-36140 (2013).
- Hass, D. T., et al. Succinate metabolism in the retinal pigment epithelium uncouples respiration from ATP synthesis. Cell Reports. 39 (10), 110917 (2022).
- Kamat, V., et al. Fluidics system for resolving concentration-dependent effects of dissolved gases on tissue metabolism. Elife. 10, e66716 (2021).
- Stryer, L. . Biochemistry. , (1995).
- Gu, X., Ma, Y., Liu, Y., Wan, Q. Measurement of mitochondrial respiration in adherent cells by Seahorse XF96 Cell Mito Stress Test. STAR Protocols. 2 (1), 100245 (2021).
- Engel, A. L., et al. Extracellular matrix dysfunction in Sorsby patient-derived retinal pigment epithelium. Experimental Eye Research. 215, 108899 (2022).
- Zhang, R., et al. Inhibition of Mitochondrial Respiration Impairs Nutrient Consumption and Metabolite Transport in Human Retinal Pigment Epithelium. Journal of Proteome Research. 20 (1), 909-922 (2021).
- Hurley, J. B. Retina Metabolism and Metabolism in the Pigmented Epithelium: A Busy Intersection. Annual Review of Vision Science. 7, 665-692 (2021).
- Xiao, J., et al. Autophagy activation and photoreceptor survival in retinal detachment. Experimental Eye Research. 205, 108492 (2021).
- Okawa, H., Sampath, A. P., Laughlin, S. B., Fain, G. L. ATP consumption by mammalian rod photoreceptors in darkness and in light. Current Biology. 18 (24), 1917-1921 (2008).
- Lakkaraju, A., et al. The cell biology of the retinal pigment epithelium. Progress in Retinal and Eye Research. , 100846 (2020).
- Yu, J., et al. Emerging strategies of engineering retinal organoids and organoid-on-a-chip in modeling intraocular drug delivery: Current progress and future perspectives. Advanced Drug Delivery Reviews. 197, 114842 (2023).
- Arjamaa, O., Nikinmaa, M. Oxygen-dependent diseases in the retina: role of hypoxia-inducible factors. Experimental Eye Research. 83 (3), 473-483 (2006).
- Kamat, V., et al. A Versatile Multi-Channel Fluidics System for the Maintenance and Real-Time Metabolic and Functional Assessment of Tissue or Cells. Cell Reports Methods. In Press. , (2023).
- Neal, A., et al. Quantification of Low-Level Drug Effects Using Real-Time, in vitro Measurement of Oxygen Consumption Rate. Toxicological Sciences. 148 (2), 594-602 (2015).
- Jung, S. R., et al. Reduced cytochrome C is an essential regulator of sustained insulin secretion by pancreatic islets. The Journal of Biological Chemistry. 286 (20), 17422-17434 (2011).
- Rountree, A. M., et al. Control of insulin secretion by cytochrome C and calcium signaling in islets with impaired metabolism. The Journal of Biological Chemistry. 289 (27), 19110-19119 (2014).
- Calton, M. A., Beaulieu, M. O., Benchorin, G., Vollrath, D. Method for measuring extracellular flux from intact polarized epithelial monolayers. Molecular Vision. 24, 425-433 (2018).
- Jarrett, S. G., Rohrer, B., Perron, N. R., Beeson, C., Boulton, M. E. Assessment of mitochondrial damage in retinal cells and tissues using quantitative polymerase chain reaction for mitochondrial DNA damage and extracellular flux assay for mitochondrial respiration activity. Methods in Molecular Biology. 935, 227-243 (2013).
- Perron, N. R., Beeson, C., Rohrer, B. Early alterations in mitochondrial reserve capacity; a means to predict subsequent photoreceptor cell death. Journal of Bioenergetics and Biomembranes. 45 (1-2), 101-109 (2013).
- Cabrera, O., et al. high-throughput assays for evaluation of human pancreatic islet function. Cell Transplantation. 16 (10), 1039-1048 (2008).
- Doliba, N. M., Qin, W., Vinogradov, S. A., Wilson, D. F., Matschinsky, F. M. Palmitic acid acutely inhibits acetylcholine- but not GLP-1-stimulated insulin secretion in mouse pancreatic islets. American Journal of Physiology. Endocrinology and Metabolism. 299 (3), E475-E485 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved