הקמה פשוטה של נישת מח עצם אוסטאוגנית וסקולרית באמצעות הידרוג'לים פוליאתילן גליקול (PEG) יצוקים מראש במיקרו-צלחת הדמיה
In This Article
Summary
מודל במבחנה של נישה וסקולרית של מח העצם נקבע על ידי זריעת תאים מזנכימליים ואנדותל על הידרוג'ל PEG תלת-ממדי יצוק מראש. רשתות האנדותל, רכיבי ECM ופעילות ALP של הנישות משתנים בהתאם לגורם הגדילה בו נעשה שימוש. הפלטפורמה יכולה לשמש למודלים מתקדמים של סרטן.
Abstract
מח העצם ומח העצם הם איברים מאוד וסקולריים ומורכבים מבחינה מבנית, והם אתרים להיווצרות סרטן וגרורות. מודלים במבחנה המשחזרים תפקודים ספציפיים לעצם ולמח העצם, כולל וסקולריזציה, התואמים לבדיקת תרופות הם רצויים מאוד. מודלים כאלה יכולים לגשר על הפער בין מודלים דו-ממדיים (2D) במבחנה פשטניים ולא רלוונטיים מבחינה מבנית לבין מודלים יקרים יותר ומאתגרים מבחינה אתית in vivo . מאמר זה מתאר בדיקת תרבית משותפת תלת-ממדית (תלת-ממדית) הניתנת לשליטה המבוססת על מטריצות פולי(אתילן גליקול) (PEG) מהונדסות, ליצירת גומחות מח-עצם אוסטאוגניות וסקולריות. תכנון מטריצת PEG מאפשר פיתוח תרביות תאים תלת-ממדיות באמצעות שלב פשוט של זריעת תאים שאינו דורש אנקפסולציה, ובכך מאפשר פיתוח מערכות תרבית משותפת מורכבות. יתר על כן, המטריצות שקופות ונוצקות מראש על לוחות הדמיה בעלי תחתית זכוכית של 96 בארות, מה שהופך את המערכת למתאימה למיקרוסקופיה. עבור הבדיקה המתוארת כאן, תאי סטרומה מזנכימליים שמקורם במח עצם אנושי (hBM-MSCs) מתורבתים תחילה עד ליצירת רשת תאים תלת-ממדית מפותחת מספיק. לאחר מכן מתווספים תאי אנדותל של ורידים טבוריים אנושיים המבטאים GFP (HUVECs). התפתחות התרבית מלווה במיקרוסקופ שדה בהיר ופלואורסצנטי. נוכחותה של רשת hBM-MSC תומכת בהיווצרות מבנים דמויי כלי דם שאחרת לא היו נוצרים ונשארים יציבים לפחות 7 ימים. ניתן לכמת בקלות את היקף היווצרות הרשת דמוית כלי הדם. ניתן לכוונן מודל זה לנישה אוסטאוגנית של מח עצם על ידי השלמת מדיום התרבית עם חלבון מורפוגנטי עצם 2 (BMP-2), אשר מקדם את ההתמיינות האוסטאוגנית של hBM-MSCs, כפי שהוערך על ידי פעילות מוגברת של פוספטאז אלקליין (ALP) ביום 4 וביום 7 של תרבית משותפת. מודל תאי זה יכול לשמש כפלטפורמה לגידול תאים סרטניים שונים ולחקור כיצד הם מתקשרים עם נישות כלי דם ספציפיות לעצם ולמח עצם. יתר על כן, הוא מתאים לאוטומציה ולניתוחים בעלי תוכן גבוה, כלומר הוא יאפשר בדיקת תרופות לסרטן בתנאי תרבית הניתנים לשחזור גבוה.
Introduction
עצם ומח עצם הם איברים מורכבים מבחינה מבנית ותפקודית מרכזיים לבריאות האדם. זה בא לידי ביטוי על ידי קיומן של נישות נפרדות המסדירות hematopoiesis ותחזוקת עצם1. כיום מקובל כי במוח עצם בריא, התחזוקה וההרחבה של תאי גזע המטופויטיים ושלדיים, כמו גם צאצאיהם, נשלטים על ידי נישות נפרדות. גומחות אלה מורכבות מסוגי תאים שונים, כולל תאי אוסטאו-שושלת, תאי גזע מזנכימליים, תאי אנדותל ופרי-וסקולריים, תאי עצב וגלייה, אדיפוציטים, אוסטאוקלסטים, מקרופאגים ונויטרופילים2. שלא במפתיע, נישות אלה, הקשורות בעיקר לכלי דם, מעורבות גם בהתפתחות סוגים שונים של לוקמיה3 והן אתר של גרורות לסוגי סרטן שונים4. בשל תפקידיו הספציפיים ביצירת עצם, עיצוב מחדש ותחזוקת עצם (מח), לכלי הדם הקשורים לעצם יש מבנים מיוחדים שונים מכלי הדם הנמצאים במקומות אחרים בגוף 5,6,7. לפיכך, תרופות אנטי אנגיוגניות או מווסתות כלי דם המיושמות באופן מערכתי עשויות להיות השפעות שונות בסביבות מיוחדות אלה8. לכן, רצוי מאוד שמודלים לחקר המנגנונים המולקולריים המעורבים בשמירה על התכונות הפיזיולוגיות של מח העצם ומח העצם, התחדשות מח העצם ומח העצם ותגובות לטיפולים טיפוליים.
תרביות רקמה דו-ממדיות קלאסיות (2D) וחקירות in vivo באמצעות מודלים של בעלי חיים סיפקו תובנה שלא תסולא בפז לגבי תפקידיהם של תאים שונים ושחקנים מולקולריים המעורבים בהתפתחות מח עצםומח עצם 9,10. מודלים המאפשרים ניסויים בתפוקה גבוהה עם תאים אנושיים רלוונטיים יכולים לשפר את הבנתנו כיצד לווסת פרמטרים נבחרים במערכות מורכבות מאוד אלה.
בעשור האחרון נעשה שימוש בעקרונות הנגזרים מהנדסת רקמות כדי ליצור מודלים תלת-ממדיים של רקמות11,12. אלה הסתמכו בעיקר על אנקפסולציה של תאים רלוונטיים לרקמות לביו-חומרים כדי ליצור תרביות מונו-ממדיות או קו-תרביות13. בין הביו-חומרים הנפוצים ביותר הם פיברין 14, קולגן 15 ומטריג'ל16,17, שכולם בעלי תאימות ביולוגית גבוהה ומספקים תנאים מתאימים לגדילה של סוגי תאים רבים. לביו-חומרים אלה יש את היכולת ליצור מודלים במבחנה המשחזרים היבטים מרכזיים של נישות כלי הדם השונות שנמצאות in vivo18. יתר על כן, השימוש בהתקנים מיקרופלואידים ליצירת מודלים של עצמות וכלי דם ומח עצם מחוררים תרם ליצירת מודלים במבחנה בעלי מורכבות גבוהה יותר 19,20,21,22.
הקושי לשלוט בהרכב ולהנדס את התכונות של ביו-חומרים טבעיים נתן השראה לפיתוח אנלוגים סינתטיים שניתן לתכנן באופן רציונלי עם תכונות פיזיקליות, כימיות וביולוגיות צפויות23,24. פיתחנו הידרוג'לים מבוססי פולי (אתילן גליקול) (PEG) סינתטיים לחלוטין (FXIII), אשר מתפקדים עם פפטידים RGD ואתרי מחשוף מטריצה metalloprotease (MMP) כדי להקל על חיבור תאים ושיפוץ25,26. העיצוב המודולרי של ביו-חומרים אלה שימש בהצלחה כדי לייעל את התנאים להיווצרות מודלים תלת-ממדיים של מח עצם ומח עצם27,28.
לבדיקה של מספר גדול יותר של תנאי תרבות שונים וטיפולים חדשים, נדרשים מודלים עם יכולת תפוקה גבוהה יותר. לאחרונה הראינו כי ניתן לשלוט בקישור הצולב FXIII של הידרוג'ל ה- PEG שלנו באמצעות תהליך אלקטרוכימי כך שנוצר שיפוע קשיחות הידרוג'ל מעמיק29. כאשר מוסיפים תאים על גבי הידרוג'לים כאלה, הם נודדים לכיוון הפנים ומתפתחים בהדרגה לרשתות סלולריות תלת-ממדיות מקושרות מאוד30. ביטול הצורך לתמצת תאים לתוך הידרוג'ל, אשר נמצא בדרך כלל עם פיגומים 3D אחרים, לא רק מפשט את התכנון הניסויי, אלא גם מאפשר תוספת רציפה של סוגי תאים שונים בנקודות זמן שונות כדי ליצור מערכות מורכבות של תרבית משותפת. הידרוג'לים אלה זמינים מראש על לוחות הדמיה של 96 בארות עם תחתית זכוכית, ובכך הופכים את הקמת התרביות התלת-ממדיות להשגה באמצעות פרוטוקולי זריעת תאים ידניים ואוטומטיים. השקיפות האופטית של הידרוג'ל PEG הופכת את הפלטפורמה לתואמת למיקרוסקופיה.
כאן, אנו מציגים שיטה פשוטה ליצירה ואפיון של נישות אוסטאוגניות וסקולריות בתוך פלטפורמת plug-and-play סינתטית מוכנה לשימוש. אנו מראים כי ניתן לגרות את התפתחותן של רשתות כלי דם באמצעות גורם גדילה המשמש בדרך כלל לגרימת אוסטאוגנזה במבחנה, חלבון מורפוגנטי עצם-2 (BMP-2), בעוד שניתן למנוע התמיינות אוסטאוגנית על ידי תוספת של גורם גדילה פיברובלסטי 2 (FGF-2)27,31. הרשתות שנוצרו שונות בהשוואה לרשתות מעוררות FGF-2 מבחינת המראה הכללי, כמו גם התפלגות התא וה- ECM. יתר על כן, עקבנו אחר האינדוקציה האוסטאוגנית באמצעות פוספטאז אלקליין כסמן. אנו מדגימים את הביטוי המוגבר של סמן זה לאורך זמן ומשווים את הביטוי לזה ברשתות מגורות FGF-2 בשיטות איכותיות וכמותיות. לבסוף, אנו מדגימים את התאמת הנישות שנוצרו של מודל זה לשני יישומים פוטנציאליים. ראשית, ביצענו בדיקת רגישות לתרופות הוכחת היתכנות על ידי הוספת bevacizumab לנישות מוכנות מראש ומעקב אחר השפלת רשתות כלי הדם בנוכחותו. שנית, הוספנו את סרטן השד MDA-MB-231 ואת תאי אוסטאוסרקומה U2OS לנישות אוסטאוגניות שנוצרו מראש, והראינו כי ניתן להשתמש בגומחות אלה כדי לחקור אינטראקציות בין תאים סרטניים לסביבתם.
Protocol
איור 1 מסכם את סעיפי הפרוטוקול הבאים.
1. הקמת מונוקולטורה סטרומה תלת ממדית
- הכן את השעיית תאי hBM-MSC.
- לגדל hBM-MSCs לרמת מפגש של 70%-90% ב-MEMα בתוספת 10% FBS, 1% פניצילין-סטרפטומיצין ו-5 ננוגרם/מ"ל FGF-2 באינקובטור בטמפרטורה של 37°C ו-5% CO2 באטמוספירה לחה. ניתן להשתמש בתאים עד מעבר 6.
- שטפו את התאים עם PBS ונתקו אותם באמצעות 0.05% טריפסין-EDTA למשך 3-5 דקות ב-37°C. עצור את תהליך הניתוק על ידי שטיפה עם מדיום בסיסי (MEMα בתוספת 10% FBS ו 1% פניצילין-סטרפטומיצין). אסוף את התאים המרחפים בצינור צנטריפוגה חרוטי של 50 מ"ל.
- ספור את התאים באמצעות המטוציטומטר או מונה תאים אוטומטי, וקבע את מספר התאים הכולל בתרחיף.
- משחררים את התאים בצנטריפוגה ב 200 x גרם למשך 5 דקות. בזהירות להסיר את supernatant.
- השהה מחדש את התאים בנפח מתאים של מדיום בסיסי כדי להשיג ריכוז של 1 x 107 תאים / מ"ל של תמיסת מלאי.
- הכינו צינורות צנטריפוגות חרוטיות של 50 מ"ל המכילות את הנפח הנדרש של תווך בסיסי בתוספת גורמי הגידול המתאימים (FGF-2 ו-BMP-2 בריכוזים מוגדרים, למשל, 0 ננוגרם/מ"ל, 25 נ"ג/מ"ל, 50 נ"ג/מ"ל, 100 נ"ג/מ"ל או 200 נ"ג/מ"ל). לכל באר, 200 μL נדרש. אם יש לבצע זריעת תאים באמצעות מטפל אוטומטי בנוזלים, שקול גם את הנפח המת של המכשיר. עבור זריעת תאים ידנית, עודף נפח של 10% מספיק.
- הוסף את hBM-MSCs מתמיסת המניות בדילול של 1:66.67 כדי להשיג ריכוז של 1.5 x 105 תאים/מ"ל.
- מכינים את הצלחת לזריעה.
- הסר את סרט דבק פוליפרופילן המכסה את צלחת הידרוג'ל 96 באר.
- שאפו בזהירות את מאגר האחסון המכסה את ההידרוג'לים. עבור משימה זו, להשתמש מכונת כביסה microplate; עם זאת, טיפול ידני אפשרי.
- בעת שימוש בשואב ידני או פיפטה רב ערוצית, מקם את הקצה כנגד דופן הבאר, ונע באיטיות מטה לכיוון קצה הבאר הפנימית תוך כדי שאיפת החיץ. פעולה זו תמנע פגיעה במשטח ההידרוג'ל.
- בעת שימוש במכונת כביסה אוטומטית לצלחות, הגדר את חרירי השאיפה לפחות 3.8 מ"מ ממוביל הצלחת (זה מתאים ל -0.8 מ"מ מהטבעת הפנימית של צלחת ההידרוג'ל) ולכיוון קצה הבאר. עיין במדריך היצרן לקבלת הוראות מפורטות יותר ולקבלת שרטוטי הצלחת של צלחת הידרוג'ל 96 בארות.
- הוסף 200 μL / באר של תרחיף התא שהוכן בשלב 1.1.7 לאחר ערבוב יסודי כדי להבטיח שהתאים מפוזרים בצורה הומוגנית. במהלך הזריעה, כדי למנוע שקיעה לא אחידה של התאים באזור אחד של המצע, אין להטות את הצלחת. עבור זריעה ידנית, מעת לעת לערבב את השעיית התא (לאחר זריעה שלוש בארות) כדי לשמור על תערובת הומוגנית. לזריעה אוטומטית, יש לערבב עם צינור סרולוגי מיד לפני הניפוק על מנת להוציא נפחים המכילים מספר שווה של תאים.
- שמרו על התרביות בטמפרטורה של 37°C ו-5% CO2 באווירה לחה.
- עקוב אחר התפתחות התרביות על ידי מיקרוסקופ שדה בהיר עם מטרה פי 5 לפי הצורך. רכשו תמונות ייחוס כ-30 דקות לאחר הזריעה כדי להעריך את מספר התאים שנוספו.
2. ביסוס תרבית תאי סטרומה-אנדותל תלת-ממדית
- הכן את השעיית התא GFP-HUVEC.
- הכינו צלוחיות לתרבית HUVEC על ידי ציפוי בתמיסה המורכבת מ-150 מיקרוגרם/מ"ל קולגן זנב-חולדה I בחומצה אצטית 0.02 M למשך 30 דקות ב-37°C. יש לשטוף פעם אחת עם PBS לפני השימוש.
- הגדל את GFP-HUVECs לרמת מפגש של 80%-100% ב- EGM-2 בתוספת 10% FBS באינקובטור ב- 37 ° C ו- 5% CO2 באטמוספירה לחה. ניתן להשתמש בתאים עד מעבר 7.
- שטפו את התאים עם PBS ונתקו אותם באמצעות 0.05% טריפסין-EDTA למשך 2-3 דקות ב-37°C. עצור את תהליך הניתוק על ידי שטיפה עם מדיום בסיסי (MEMα בתוספת 10% FBS ו 1% פניצילין-סטרפטומיצין). אסוף את התאים המרחפים בצינור צנטריפוגה חרוטי של 50 מ"ל.
- ספור את התאים באמצעות המטוציטומטר או מונה תאים אוטומטי, וקבע את המספר הכולל של התאים הקיימים בתרחיף.
- משחררים את התאים בצנטריפוגה ב 200 x גרם למשך 5 דקות. בזהירות להסיר את supernatant.
- השהה מחדש את התאים בנפח מתאים של מדיום בסיסי כדי להשיג ריכוז של 1 x 107 תאים / מ"ל של תמיסת מלאי.
- הכינו צינורות צנטריפוגות חרוטיות של 50 מ"ל המכילות את הנפח הנדרש של תווך בסיסי בתוספת גורמי הגדילה המתאימים (FGF-2 ו-BMP-2 בריכוזים מוגדרים, למשל, 0 ננוגרם/מ"ל, 25 נ"ג/מ"ל, 50 נ"ג/מ"ל, 100 נ"ג/מ"ל או 200 נ"ג/מ"ל) כמתואר עבור hBM-MSCs בשלב 1.1.6.
- הוסף את GFP-HUVECs מתמיסת המניות בדילול של 1:66.67 כדי להשיג ריכוז של 1.5 x 105 תאים/מ"ל, כמתואר עבור hBM-MSCs בשלב 1.1.7.
- שאפו את התווך מהצלחת המכילה את המונוקולטורה הסטרומלית, כמתואר להסרת החיץ בשלב 1.2.2.
- הוסף 200 μL/well של מתלה תאי GFP-HUVEC שהוכן בשלב 2.1.8 כמתואר עבור תוספת hBM-MSC בשלב 1.3.
- יש לדגור על 37°C ו-5%CO2 באטמוספירה לחה. שנה את המדיום כל 3-4 ימים.
- עקוב אחר התפתחות התרבית על ידי מיקרוסקופ שדה בהיר ופלואורסצנטי באמצעות מטרה פי 5 לפי הצורך. לשמור על התרבויות עד היום הרביעי או היום השביעי של התרבות המשותפת לאפיונים מוקדמים או בינוניים, בהתאמה, או לפי הצורך.
3. הליך אפיון 1: כימות היווצרות רשת תאי אנדותל
- בנקודות הזמן הרצויות, רכשו את אות ה-GFP מה-GFP-HUVECs באמצעות מיקרוסקופ פלואורסצנטי תוך שימוש בהגדרות המתאימות לכימות (כלומר, המיקוד הטוב ביותר, ניגודיות גבוהה והגדלה נמוכה [למשל, פי 5] עבור שדות ראייה גדולים יותר).
- עבד מראש באופן שווה את כל התמונות שנרכשו באותו יום (למשל, באמצעות פיג'י32) כדי לשפר עוד יותר את הניגודיות. שים לב שהאות GFP עשוי להיות עמום יותר עם זמן התרבות; לכן, תמונות שנרכשו בימים שונים עשויות להזדקק לעיבוד שונה.
- אם אתם משתמשים בפיג'י או ב-ImageJ, פתחו את כל תמונות ערוץ GFP מאותה נקודת זמן, ופתחו את התפריט ' בהירות וניגודיות' . בחרו תמונה המייצגת תנאי ביניים (לא האות העמום ביותר ולא הבהיר ביותר), וכווננו אוטומטית את הניגודיות באמצעות בחירה באפשרות ' אוטומטי'. בחרו ' הגדר' ובדקו את ' הפץ לכל התמונות הפתוחות האחרות'.
- הערך חזותית אם הטווח שנבחר אוטומטית מתאים לכל התמונות של נקודת הזמן הנוכחית, והתאם מחדש והפץ מחדש באופן ידני לכל התמונות לפי הצורך.
- שמור את התמונות המותאמות כקבצי TIF וחזור על שלבים 3.2.1 ו- 3.2.2 עבור נקודות הזמן האחרות שנרכשו.
- החל מסנן טשטוש חציוני (לדוגמה, רדיוס 3 לתמונות ברזולוציה של 2048x2048) על כל התמונות כדי למנוע זיהוי לכלוכים במורד הזרם, ובכך להקל על זיהוי מדויק ברשת. הקטינו את הגודל באמצעות כריכה (2x2) ושמרו את כל התמונות שעובדו מראש כקובצי RGB TIF צבעוניים בגווני אפור בתיקייה לצורך כימות. ניתן לבצע שלבים אלה באופן ידני או במצב אצווה באמצעות פקודות מאקרו שהמחברים ישתפו לפי בקשה.
- נתח את כל התמונות בתיקייה שנוצרה בשלבים 3.1-3.3 באמצעות מצב תהליך אצווה במנתח אנגיוגנזה עבור ImageJ33. שים לב שבהתאם לגודל התמונות ולזיכרון העבודה הזמין, פעולה זו עשויה להימשך מספר דקות לכל תמונה.
- אמת את תוצאות הכימות על ידי בחינת שכבות-העל של המבנים המוכרים והתמונות המקוריות. אם האלגוריתם מזהה מבנים מלאכותיים, שבהם ניתן לראות רק תאים מעטים או כלל לא ניתן לראות בתמונה המקורית, התאם את פרמטרי העיבוד מראש, ונתח מחדש את התמונות המקוריות, או החריג אזורים בעייתיים כאלה ו/או שכפל תמונות מהניתוח.
- לנרמל את הערכים המתקבלים לאזור של 1 מ"מ 2 על ידי הכפלת הערכים של כל מדגם על ידי היחס בין האזור מנותח ל 1 מ"מ2. שלב זה הוא בעל חשיבות מיוחדת אם נעשה שימוש בתמונות בגדלים שונים.
- חלצו מהניתוח פרמטרים שונים של הרשת, כגון אורך הרשת הכולל, מספר הצמתים, מספר המקטעים, מספר המקטעים המבודדים, מרווח ההסתעפות וגודל הרשת הממוצע, והשתמשו בהם כדי לאפיין את רשת האנדותל בנקודות זמן שונות ובתנאי תרבית שונים.
4. הליך אפיון 2: הערכת תצהיר ECM
- בנקודות זמן הסיום הרצויות, להעריך תצהיר ECM באמצעות immunofluorescence. הוסף נוגדנים ראשוניים כנגד מולקולות ECM שונות ב- 100 μL של מדיום התרבית במהלך 6 השעות האחרונות של התרבית או לאחר קיבוע, כמתואר להלן.
- שטפו את התרביות פעם אחת עם 200 μL/well של PBS למשך 5 דקות ב-RT, וקבעו אותן עם 100 μL/well של 4% paraformaldehyde מתחת למכסה אדים כימי למשך 30 דקות ב-RT. שימו לב שמומלץ לתקן את כל הבארות של הצלחת בו זמנית, מכיוון שהתרבויות שמסביב עלולות להיפגע במהלך שלב זה. שטפו את התרביות הקבועות עם 200 μL/well של PBS ב-RT שלוש פעמים למשך 5 דקות בכל פעם, ואחסנו ב-4°C ב-200 μL/well של PBS, או המשיכו מיד לשלב הבא.
- לפני הדגירה עם נוגדנים ראשוניים נגד מולקולות ECM לאחר קיבוע, לדגור על התרביות הקבועות עם 200 μL / באר של 1% BSA ב- PBS כתמיסת חסימה למשך 30 דקות ב- RT.
- שאפו את תמיסת החסימה, ודגרו עם 100 μL/well של תמיסת הנוגדנים הראשונית ב-1% BSA ב-PBS למשך הלילה ב-4°C. יש לשטוף עם 200 מיקרוליטר/באר של PBS שלוש פעמים למשך 5 דקות, לפחות 3 שעות ו-5 דקות, בהתאמה, ב-RT.
הערה: שלב השטיפה הארוך נדרש לדיפוזיה מלאה של הנוגדן הלא קשור מתוך ההידרוג'ל.
- שאפו את תמיסת החסימה, ודגרו עם 100 μL/well של תמיסת הנוגדנים הראשונית ב-1% BSA ב-PBS למשך הלילה ב-4°C. יש לשטוף עם 200 מיקרוליטר/באר של PBS שלוש פעמים למשך 5 דקות, לפחות 3 שעות ו-5 דקות, בהתאמה, ב-RT.
- כדי להקל על חדירת תמיסת הצביעה המשנית, כולל כתמי נגד תוך תאיים, יש לחדור לתרביות באמצעות 0.3% Triton X-100 ו-1% BSA ב-PBS למשך 30-90 דקות ב-RT, בהתאם לצפיפות התאית של התרביות.
הערה: עבור צביעה מבוססת נוגדנים של מולקולות תוך תאיות, שלב זה צריך להתבצע לפני הדגירה עם הנוגדן העיקרי המתואר בשלב 4.1.2. - הכינו תמיסות צביעה משניות המכילות את הנוגדנים המשניים והכתמים הנגדיים המתאימים לפי הצורך (למשל, כתם גרעיני כגון DAPI וכתם שלד ציטו-שלד כגון פאלואדין-רודמין).
- הכינו חיץ צביעה המורכב מ-0.1% טריטון X-100, 1% BSA ב-PBS וכתמים נגדיים (למשל, 1 מיקרוגרם/מ"ל DAPI ו-1:4,000 פאלואדין-רודמין), והוסיפו את הנוגדנים המשניים המתאימים בדילול המומלץ.
- יש להוסיף 100 מיקרוליטר/באר של תמיסת צביעה משנית, ולדגור למשך הלילה ב-4°C. בדומה להליך לאחר דגירה ראשונית של נוגדנים, יש לשטוף עם 200 μL/well של PBS שלוש פעמים במשך 5 דקות, לפחות 3 שעות ו-5 דקות, בהתאמה, ב-RT.
- לפתרון תלת ממדי של המבנים, רכשו ערימות קונפוקליות המתחילות בתחתית הזכוכית עם מדרגת z של 2.5 מיקרומטר המגיעה לגובה סופי של 500 מיקרומטר, השתמשו במטרה של 10x ובזום דיגיטלי של 0.75x. כדי ליצור שחזור תלת-ממדי של אות GFP ו-F-actin בפיג'י, החזק כל ערוץ בנפרד לפני יצירת קומפוזיט ויצירת השחזור באמצעות Fiji 3D Viewer.
- עבור הדמיה של ECM שהופקד מן immunostainings, לרכוש ערימות קונפוקליות בגובה של 100 מיקרומטר עם z-step של 5 מיקרומטר, מטרה 10x, זום דיגיטלי 1.5x. צור הקרנות בעוצמה מרבית, וכוונן את הבהירות והניגודיות עבור כל ערוץ בנפרד בפיג'י לפני יצירת קומפוזיט.
- בצעו צביעת צבע ישירה של הסביבה החוץ תאית.
- הוסף 200 μL / באר של תמיסת צביעה אדומה Picrosirius לבארות קבועות paraformaldehyde, ולדגור במשך 1 שעה ב RT.
- לאחר מכן, שטפו את הבארות המוכתמות חמש פעמים במים מזוקקים, ולאחר מכן שטפו פעמיים ביום או כל יומיים במשך 3-4 ימים תוך מעקב אחר ניקוי צבע הדגימה. שמרו את הצלחות בטמפרטורה של 4°C במהלך שלבי הכביסה הארוכים (כלומר, כל דבר שעולה על 6 שעות).
- קבל תמונות של הדגימות המוכתמות באמצעות מיקרוסקופ שדה בהיר המצויד במצלמה צבעונית, ושמור על איזון לבן שווה בכל התנאים. כדי לקבל סקירות כלליות של הדגימות, השתמש בהגדלה נמוכה (למשל, פי 2.5) כדי לסרוק את הבאר כולה. אם המיקרוסקופ אינו מגיע עם תוכנה התומכת בתפירה אוטומטית, עשו זאת באופן ידני (למשל, באמצעות Pairwise Stitching בפיג'י34).
הערה: הבארות ששימשו בעבר לאימונופלואורסנציה יכולות לשמש לכך, בתנאי שרכישת התמונה הפלואורסצנטית הושלמה. - בצע את אותם השלבים המתוארים עבור צביעה אדומה של Picrosirius בשלבים 4.2.1-4.2.3 כדי לבצע צביעה אדומה של Alizarin, כביסה והדמיה.
5. הליך אפיון 3: הערכת התמיינות אוסטאוגנית על ידי ניטור פעילות ALP
- בנקודות זמן שונות של תרבית (למשל, יום 4 ויום 7 של תרבית משותפת), יש להעריך כמותית את פעילות ALP באמצעות צביעה של 5-bromo-4-chloro-3-indolyl phosphate (BCIP)/nitro blue tetrazolium (NBT).
- שטפו את התרביות פעם אחת עם 200 מיקרוליטר/באר של PBS לפני הדגירה עם תמיסת מצע BCIP/NBT, אותה יש להכין בהתאם להוראות היצרן. יש לדגור בטמפרטורה של 37°C תוך מעקב תקופתי אחר התפתחות הצבע. ברגע שהצבע מתחיל להתפתח בתנאים לא אוסטאוגניים, יש לשטוף מיד פעם אחת עם 200 μL/well של PBS לפני קיבוע עם 4% פרפורמלדהיד, כמתואר בשלב 4.1.1.
- רכוש תמונות צבעוניות של הדגימות המוכתמות, כמתואר בשלב 4.2.3 עבור צביעה אדומה של Picrosirius.
- בנקודות זמן שונות של תרבית (למשל, יום 4 ויום 7 של תרבית משותפת), כמתו את פעילות ה-ALP בליזטים של התא.
- שטפו את התרביות שלוש פעמים עם 200 מיקרוליטר/באר של PBS לפני הדגירה עם 200 מיקרוליטר/באר של 0.25% טריפסין-EDTA ב-37°C. כל 10 דקות, להתסיס את התרביות על ידי pipeting נמרץ למעלה ולמטה כדי להקל על העיכול, ולפקח על המורפולוגיה של התרבית עם מיקרוסקופ תרבית תאים סטנדרטי.
- לאחר קבלת תרחיף נוזלי חד-תאי ללא מבנים תאיים מוארכים בבארות (בדרך כלל לאחר 20-30 דקות), העבירו את הדגימות לצינורות של 2 מ"ל, הוסיפו 200 מיקרוליטר של מדיום בסיסי MSC כדי לעכב את הטריפסין, וצנטריפוגה ב -500 x גרם למשך 5 דקות כדי להניע את התאים שהוחזרו. דקרו את הסופר-נטנט, והקפיאו את הכדוריות בטמפרטורה של -80°C, או המשיכו ישירות לשלב 5.2.3.
- הפשירו את כדורי התא שהתקבלו בשלב 5.2.2, ודגרו עם 500 מיקרוליטר של חיץ ליזיס המורכב מ-0.56 M 2-Amino-2-methyl-1-propanol, 0.2% Triton X-100, pH 10, למשך 30 דקות על קרח. לאחר מכן, צנטריפוגה ב 16,100 x גרם במשך 10 דקות ב 4 ° C, ולשמור את הדגימות על קרח. לאחר המדידות המתוארות בשלב 5.2.7, יש להקפיא את הדגימות בטמפרטורה של -20°C או -80°C, או להמשיך ישירות בכימות הדנ"א, כמתואר בשלב 5.2.8.
הערה: ניתן להכין מראש את חיץ הליזיס, לסנן סטרילי ולאחסן בטמפרטורה של 4°C. - הכן את מגיב ALP המורכב 20 mM 4-Nitrophenyl פוספט, מלח דיסודיום hexahydrate ו 4 mM MgCl2 במאגר ליזיס.
הערה: עדיף להכין פתרון זה טרי ביום הכימות. - מבלי להפריע לפסולת כדורית, יש לפזר 50 μL של הסופרנאטנט ליזט התא שהוכן בשלב 5.2.3 לתוך בארות של צלחת סטנדרטית, שקופה, תרבית רקמה 96 בארות בכפילויות. הוסף חיץ ליזיס לשתי בארות כפקדים ריקים.
- עם פיפטה רב ערוצית, להוסיף 50 μL / באר של מגיב ALP לבארות מלא בשלב 5.2.5. נערו לזמן קצר את הצלחת ודגרו בטמפרטורה של 37°C למשך 10 דקות כשהיא מוגנת מפני אור. בארות עם פעילות ALP גבוהה יותר ייראו צהובות. עצור את התגובה על ידי הוספת 100 μL / באר של 1 M NaOH באמצעות פיפטה רב ערוצית.
- קרא את הצפיפות האופטית ב- 410 ננומטר באמצעות קורא לוחות. בצע ממוצע של הכפילויות הטכניות והפחת את הממוצע של הפקדים הריקים.
- בצע כימות DNA כדי לנרמל את פעילות ALP שנקבעה בשלבים הקודמים מול מספר התא הכולל. כאן מתוארת שיטה המבוססת על מדידות פלואורסצנטיות, אך כל שיטה אחרת לכימות DNA בליזטים של תאים תואמת את הבדיקה. הכינו את הריאגנטים ואת תקני הדנ"א הנדרשים לכימות DNA באמצעות ערכות מסחריות בהתאם להוראות היצרן.
הערה: מומלץ להשתמש במאגר ליזיס להכנת תקני DNA. - אם הדגימות המשמשות לכימות ALP המתוארות בשלב 5.2.3 הוקפאו, הפשיר אותן, צנטריפוגה ב 16,100 x גרם במשך 2 דקות ב 4 ° C, והניח אותם על קרח. מבלי להפריע לפסולת כדורית, יש לפזר 50 μL של הסופרנאטנט ליזט התא לבארות של צלחת שחורה בת 96 בארות בכפילויות. הקפיאו את הדגימות בטמפרטורה של -20°C או -80°C, וחזרו על כימות ה-ALP וה-DNA במידת הצורך. הוסף את תקני ה- DNA בכפילויות.
- עם פיפטה רב ערוצית, להוסיף 50 μL של חומר מכתים DNA, לדגור, ולקרוא את עוצמת פלואורסצנטיות בהתאם להוראות היצרן. באמצעות ערכי העקומה הסטנדרטיים, קבעו והחילו את ההמרה של ערכי העוצמה הנמדדים לריכוזי הדנ"א.
- נרמל את ערכי ALP שהתקבלו בשלב 5.2.7 על ידי חלוקתם בריכוז ה- DNA המתאים של כל דגימה.
6. יישום 1: ביצוע בדיקות רגישות לסמים
- כאשר רשתות האנדותל מפותחות במלואן (בדרך כלל ביום הרביעי של תרביות תאי סטרומה-אנדותל), מוסיפים תרכובות אנטי-אנגיוגניות, כגון bevacizumab, לתרביות בתרבית טרייה, ובודקים את פעילותן לאורך זמן ובתנאים שונים (למשל, ריכוזים שונים של FGF-2 או BMP-2).
- הכינו מדיום תרבית טרי המכיל את אותם גורמי גדילה ששימשו את התרבויות השונות עד לאותה נקודה.
- הכינו תמיסת בקרה המורכבת מדילול של דריבית הריבית (למשל, עבור bevacizumab: 60 מ"ג/מ"ל α-טרהלוז דיהידרט, 0.4 מ"ג/מ"ל טווין20, 5.8 מ"ג/מ"ל נתרן פוספט, מונובייסיק ומונוהידרט, ו-1.2 מ"ג/מ"ל נתרן פוספט דיבסיסי, נטול מים), ולסנן אותו סטרילי.
- הוסף את דריבית הריבית בריכוז הרצוי (למשל, 10 מיקרוגרם/מ"ל bevacizumab) ונפח שווה של תמיסת הבקרה למדיום התרבית המיועד לתנאי הבדיקה והביקורת, בהתאמה.
- הכינו מדיום תרבית טרי המכיל את אותם גורמי גדילה ששימשו את התרבויות השונות עד לאותה נקודה.
- שאפו את המדיום מהתרבות, והוסיפו 200 מיקרוליטר/באר של המדיום שהוכן טרי בשלב 6.1.1. יש לדגור לזמן המתאים לבדיקת התרכובת (למשל, עבור bevacizumab: יומיים). לעקוב אחר התפתחות התרבית, ולאפיין את רשתות האנדותל כמתואר בסעיף 3. להעריך את היעילות של התרכובת בעיכוב אנגיוגנזה או להבעיר את המבנים שנוצרו מראש באמצעות תמונות GFP ואת הפרמטרים הכמותיים ברשת שחולצו מן הניתוח המתואר בשלב 3.7.
7. יישום 2: הקמת מערכות תרבית משותפת מתקדמות עם סוגי תאים סרטניים שונים
- ביום הרביעי של התרבית המשותפת, כאשר רשתות האנדותל מבוססות ברובן, הוסיפו סוגי תאים אחרים, כגון תאי סרטן MDA-MB-231 או U2OS, לתרביות בתרבית טרייה.
- תייגו את התאים הסרטניים באמצעות צבע חי תואם תאים בהתאם להוראות היצרן על מנת להיות מסוגלים להבדיל אותם מה-HUVECs המסומנים ב-GFP ומ-hBM-MSCs שאינם מסומנים בתרביות המשותפות.
- הכינו תרחיף של תאים סרטניים בריכוז של 1.5 x 104 תאים/מ"ל בתווך תרבית טרי המכיל את אותם גורמי גדילה ששימשו לתרביות בהתאמה עד לאותה נקודה.
- עקוב אחר התפתחות התרבית ולוקליזציה של תאים סרטניים לפי הצורך.
הערה: בהתאם לסוג הסרטן, פעילותו וסביבתו, ייתכן שיחלפו מספר ימים עד שהם יגיעו למבני כלי הדם בתרביות תאי סטרומה-אנדותל (למשל, יומיים עבור MDA-BM-231 ו-U2OS). לכן, יש לתזמן בהתאם את ההדמיה בהילוך מהיר כדי להמחיש את האינטראקציות בין תאים סרטניים-וסקולריים.
תוצאות
תרביות נישה של כלי דם נוצרו על-ידי זריעה רציפה של hBM-MSCs ו-GFP-HUVECs על הידרוג'לים מבוססי PEG יצוקים מראש עם שיפוע קשיחות בתוך לוח הדמיה של 96 בארות (איור 1). התרביות נוטרו לאורך זמן באמצעות מיקרוסקופ אפיפלואורסצנטי חי ואופיינו עוד יותר בנקודות זמן נבחרות. התא החוץ תאי נבדק באמצעות כתמי צבע ישירים וכתמים מבוססי נוגדנים. פעילות ALP כומתה לאחר שליפה ושכיבה של התאים מהגומחות שנוצרו. יתר על כן, אנו מדגימים את התאמתה של פלטפורמה זו לבדיקות רגישות לתרופות אנטי-אנגיוגניות וכבסיס למודלים של תרבית משותפת לסרטן.
תרביות משותפות של hBM-MSCs ו-HUVECs המבטאים GFP הוקמו על ידי זריעת 3 x 104 תאים/באר בהיעדר גורמי גדילה או בנוכחות FGF-2 או BMP-2 ב-50 ננוגרם/מ"ל, כמתואר בפרוטוקול. מנקודת זמן מוקדמת ניתן היה להבחין בהבדלים בין התרביות הן מתמונות השדה הבהיר והן מתמונות פלואורסצנטיות שמראות רק את GFP-HUVECs (איור 2A). על ידי התבוננות באותם אזורים לאורך, ניתן להבחין בהבדלים בהתפתחות התרבויות, כגון התפתחות מהירה יותר בנוכחות FGF-2. באופן כללי, התרביות נראו פחות מפותחות בהיעדר גורם גדילה כלשהו, עם פחות תאים משני הסוגים מתפשטים ונוכחות של אזורים אצלולריים. לעומת זאת, תמונות השדה הבהיר הראו את התרבויות הצפופות ביותר בנוכחות BMP-2. עם זאת, רשתות דמויות כלי דם נוצרו בשני התנאים המכילים גורמי גדילה, והרשתות הנרחבות והמקושרות ביותר נוצרו עם FGF-2. הבדלים נצפים אלה יכולים גם להיות מכומתים באמצעות Angiogenesis Analyzer עבור ImageJ. ואכן, אורך הרשת הכולל היה הגבוה ביותר בנוכחות FGF-2 והנמוך ביותר בהיעדר גורמי צמיחה (איור 2B). מספר הצמתים המציינים נקודות הסתעפות ברשתות היה באותה מגמה כמו האורך הכולל (איור 2C). לעומת זאת, בשני התנאים המכילים גורמי גדילה היו הרבה פחות מקטעים מבודדים, מה שמצביע על קישוריות גבוהה יותר, מאשר המצב ללא גורם גדילה כלשהו (איור 2D). נוסף על כך, הדמיה קונפוקלית תלת-ממדית חשפה חדירה חזקה יותר של תאי אנדותל במונחים של עומק במצב מגורה FGF-2 (איור 2E).
תרביות משותפות של hBM-MSC/GFP-HUVEC נשמרו במשך 7 ימים בנוכחות FGF-2 או BMP-2 לפני שתוקנו והוכתמו עבור רכיבי ECM. כתמים אימונוציטוכימיים ולאחריהם מיקרוסקופ סריקת לייזר קונפוקלי הראו הבדלים בולטים במורפולוגיית התרבית כתלות בסוג תוספת גורם הגדילה (איור 3A). עם FGF-2, התרבית אורגנה במבנים מיקרו-וסקולריים מעובים, שהיו צפופים הן בתאי אנדותל והן בתאי מזנכימאל, בעוד שבנוכחות BMP-2, hBM-MSCs השתרעו על שטח גדול בהרבה, כפי שניתן לראות מהאזורים החיוביים והשליליים הנרחבים יותר של F-אקטין ו-GFP. חלבוני ECM פיברונקטין וקולגן I היו ממוקמים באופן דומה, בעוד שלמינין וקולגן IV היו מרוכזים יותר סביב מבני האנדותל. עם זאת, ריכוז מוגבר זה סביב מבני האנדותל היה הרבה יותר בולט בנוכחות FGF-2 מאשר בנוכחות BMP-2. בנוסף לכתמים מבוססי נוגדנים, בוצעו צביעות צבע ישירות כדי להעריך את המצב הפיברוטי הכולל של ECM (צביעה אדומה Picrosirius; איור 3B), כמו גם התצהיר של Ca על ECM (צביעה אדומה של אליזרין; איור 3C) של הגומחות שנוצרו. הצביעה האדומה של פירוסיריוס הייתה חזקה ונרחבת יותר בגומחות שתורבתו עם BMP-2, והצביעה האדומה של אליזרין המשיכה באותה מגמה.
לאחר מכן, התרבויות אופיינו במונחים של הפוטנציאל האוסטאוגני שלהן על ידי הערכת פעילות ALP כסמן אוסטאוגני מוקדם. ביום ה-4 וביום ה-7 של התרבית המשותפת, התאים הוצאו מהגומחות על ידי עיכול ההידרוג'לים עם טריפסין. כדי לכמת את פעילות ה-ALP, התאים שאוחזרו עברו ליזה ובוצעה בדיקת pNPP. הערכים שהתקבלו נורמלו מול הדנ"א הכולל עבור כל דגימה כדי להסביר הבדלים פוטנציאליים במספר התאים בין תנאים. ואכן, ניתן היה להבחין בהבדלים קטנים בין תכולת הדנ"א של התנאים, והתאים המעטים ביותר נשלפו מהמצב ללא כל גורם גדילה (לא מוצג). פעילות ה-ALP המנורמלת, לעומת זאת, השתנתה מאוד בין התנאים, עם מגמה של פעילות מוגברת עם ריכוזים גבוהים יותר של BMP-2 ורמה של 100 ננוגרם/מ"ל (איור 4A,B). רמות הפעילות הנמוכות ביותר זוהו עבור המצב המכיל 50 ננוגרם/מ"ל FGF-2. בעוד שניתן היה לראות מגמות דומות בשתי נקודות הזמן שהוערכו, כל הערכים עלו באופן משמעותי עם הזמן בתרבות מהיום הרביעי ליום השביעי. בנוסף לבדיקה הכמותית, ניתן היה להמחיש את פעילות ALP באופן איכותי באמצעות צביעת צבע ישירה בהתבסס על המרת מצע BCIP/NBT. כתמים סגולים נרחבים ועזים יותר נצפו בנוכחות BMP-2 בהשוואה ל-FGF-2 (איור 4C).
כדי להדגים שני יישומים פוטנציאליים של הנישות האוסטאוגניות המאופיינות בוצע מחקר הוכחת היתכנות לרגישות לתרופות ותרבויות משותפות לסרטן. עבור בדיקת רגישות לתרופה, bevacizumab או פתרון בקרה המורכב מדלל של נוסחת bevacizumab נוסף למדיום התרבית המכיל BMP-2 טרי. ביום הרביעי, כאשר נוצרו רשתות מבוססות בנוכחות 50 ננוגרם/מ"ל BMP-2, נוסף פתרון הבקרה או המדיום המכיל bevacizumab במהלך שינוי התווך הרגיל, והתרביות נוטרו באמצעות הדמיה פלואורסצנטית. התוספת של bevacizumab של 10 מיקרוגרם/מ"ל הובילה לנסיגה או לאבלציה של הרשת הקודמת, בעוד שמצב הבקרה עדיין כלל רשתות נרחבות יומיים לאחר השינוי הבינוני (איור 5A,B). ניתן לכמת את השינויים האלה גם על-ידי מעקב אחר האורך הכולל של הרשתות באמצעות Angiogenesis Analyzer for ImageJ על תמונות פלואורסצנטיות שנרכשות מדי יום (איור 5C). לחלופין, bevacizumab או כל תרכובת אחרת ניתן להוסיף גם מתחילת התרבות המשותפת כדי להעריך את השפעתם על היווצרות הרשתות. במקרה של bevacizumab, זה עיכב לחלוטין את היווצרות רשתות האנדותל (לא מוצג).
עבור היישום השני, MDA-MB-231 סרטן השד או תאי אוסטאוסרקומה U2OS נוספו ליום 4 תרביות משותפות בצפיפות של 1.5 x 103 תאים / באר בתווך תרבית טרי המכיל 50 ng/mL BMP-2. כדי להבדיל אותם מה-HUVECs המסומנים ב-GFP ומה-hBM-MSCs שאינם מסומנים, תאי הסרטן הודגרו באמצעות CellTrace FarRed ממש לפני הזריעה על הגומחות האוסטאוגניות. התרביות נוטרו במיקרוסקופ פלואורסצנטי; בהתחלה, רוב התאים הסרטניים התמקמו בסמוך לפני השטח של המצע, אך לאחר יומיים, ניתן היה למצוא אותם בסמיכות רבה יותר לשכבות המכילות את תרביות כלי הדם. לפיכך, יום 2 נבחר כנקודת ההתחלה למיקרוסקופ בהילוך מהיר כדי להראות את הדינמיקה של האינטראקציות בין התאים הסרטניים לבין התאים בתוך נישה וסקולרית. באופן מעניין, ניתן היה לראות את תאי MDA-MB-231 מתקרבים למבני אנדותל ומתרחקים מהם, ולכן ייתכן שהם בוחנים או מעצבים מחדש את סביבתם (איור 5D). באמצעות CellTrace FarRed כתווית עבור התאים הסרטניים, GFP כתווית עבור HUVECs, וצביעה נוספת עבור F-actin, ניתן היה להבחין בין כל סוגי התאים באמצעות מיקרוסקופ סריקת לייזר קונפוקלי (איור 5E).
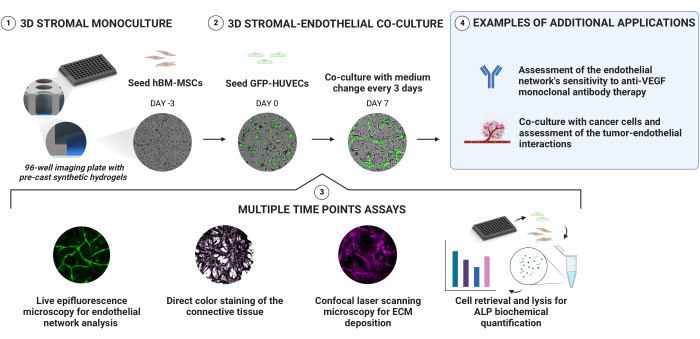
איור 1: גישה פשוטה ליצירה אמינה של נישות אוסטאוגניות וסקולריות. הידרוג'לים סינתטיים יצוקים מראש עם שיפוע קשיחות מעמיק מאפשרים יצירת תרביות תלת ממדיות באמצעות זריעת תאים רציפה ללא צורך באנקפסולציה ישירה. hBM-MSCs מתורבתים מראש במשך 3 ימים לפני הוספת HUVECs המבטאים GFP. התרביות מנוטרות על ידי רכישת אותות שדה בהיר ו-GFP לאורך. בנקודות זמן נבחרות, הגומחות מוערכות עוד יותר עבור תצהיר ECM ומצב אוסטאוגני. פעילות פוספטאז אלקליין מוערכת באמצעות צביעת צבע ישירה ועל ידי שליפת תאים מהגומחות וביצוע בדיקת pNPP על הליזטים של התא. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
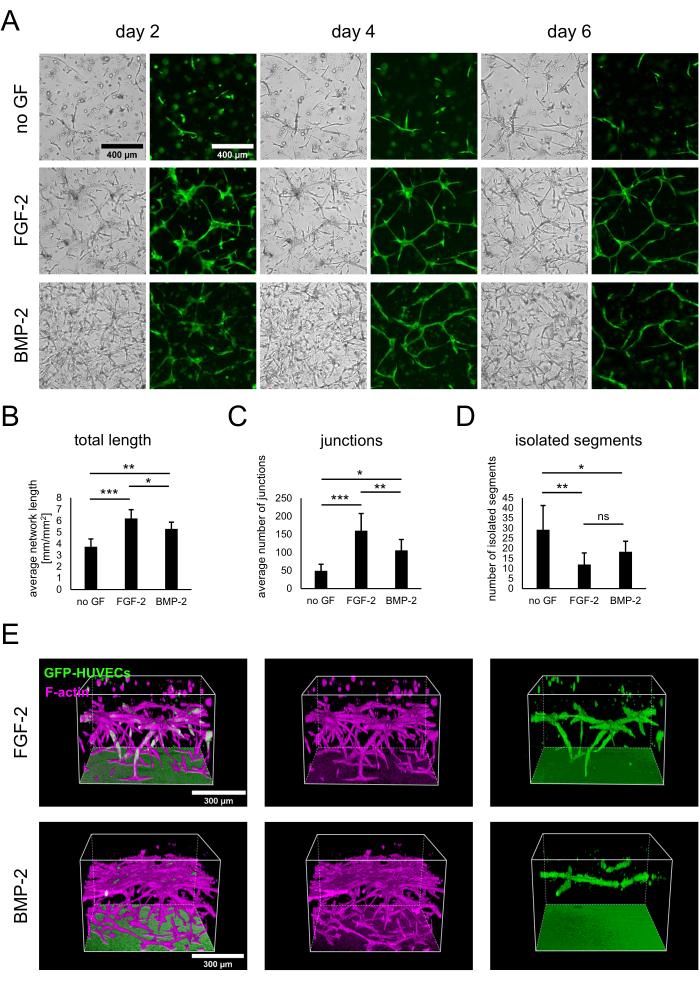
איור 2: גירוי של רשתות דמויות כלי דם עם FGF-2 או BMP-2. (A) תמונות של שדה בהיר ופלואורסצנטיות (GFP) נרכשו ביום 2, ביום 4 וביום 6 של התרבית המשותפת של תאים שגדלו בהיעדר גורמי גדילה או בנוכחות FGF-2 או BMP-2, שניהם ב-50 ננוגרם/מ"ל. סרגל קנה מידה: 400 מיקרומטר. (B-D) פרמטרים מכומתים של רשתות GFP-HUVEC שצולמו ביום 4 של תרבות משותפת, נותחו באמצעות Angiogenesis Analyzer עבור ImageJ. הנתונים מיוצגים כממוצע ± סטיית תקן. הניתוח הסטטיסטי בוצע באמצעות GraphPad Prism 9.5.1. ANOVA חד-כיווני רגיל עם מבחן השוואות מרובות של דנט בוצע עם n ≥ 4; * P < 0.05; ** P < 0.01; P < 0.001. (E) שחזורים תלת-ממדיים שנוצרו מארובות קונפוקליות (גובה כולל: 547.5 מיקרומטר; z-step: 2.5 מיקרומטר) של אותות GFP ו-F-actin עבור התנאים המעוררים FGF-2- (שורה עליונה) ו-BMP-2 (שורה תחתונה). סרגל קנה מידה: 300 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
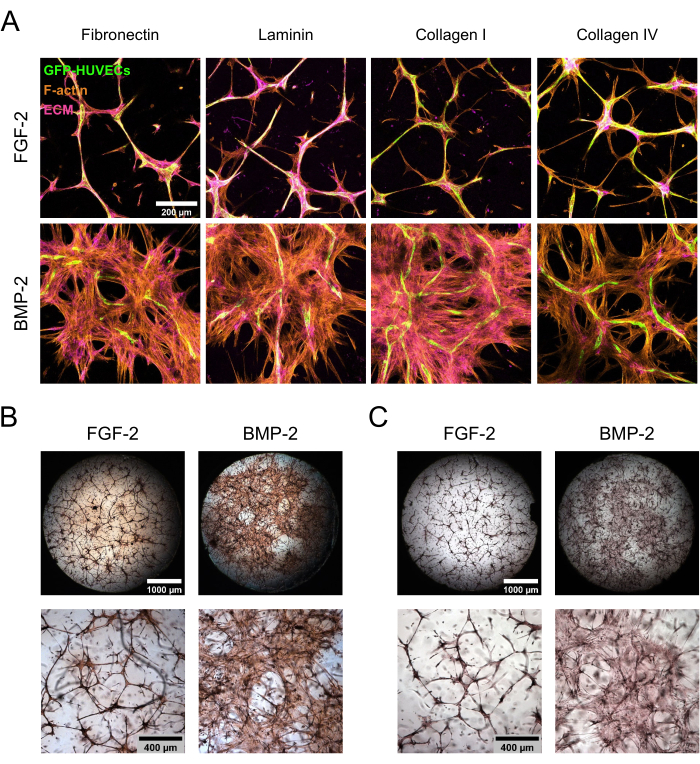
איור 3: אינדוקציה של התפשטות hBM-MSC דה-לוקליזציה ושקיעת ECM על-ידי BMP-2. (א-ג) התרביות השיתופיות בנות 7 הימים שגדלו בנוכחות FGF-2 או BMP-2 היו נתונות (A) לצביעת צבע ישירה או (B,C). (A) התרביות הוכתמו עבור F-actin וחלבוני ECM פיברונקטין (fibronectin), למינין (laminin), קולגן I וקולגן IV. התמונות מתארות את הקרנות העוצמה המרבית של הערימות הקונפוקליות (גובה כולל: 100 מיקרומטר; z-step: 5 מיקרומטר). סרגל קנה מידה: 200 מיקרומטר. (B,C) התרביות הוכתמו באמצעות (B) אדום פיקרוסיריוס ו-(C) אדום אליזרין. השורה העליונה מתארת סקירות תפורות ושלמות של התמונות שנרכשו בהגדלה של פי 2.5 (סרגל קנה מידה: 1,000 מיקרומטר), ואילו השורה התחתונה מתארת שדה ראייה אחד שנרכש בהגדלה של פי 5 (סרגל קנה מידה: 400 מיקרומטר). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
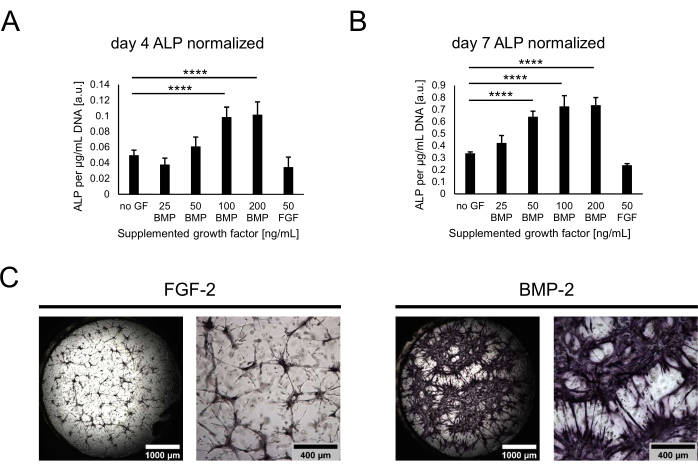
איור 4: הערכה ביוכימית של פעילות ALP הנגרמת על-ידי BMP-2 באמצעות צביעת צבע ישירה. (A,B) פעילות ה-ALP נקבעה בליזטים של תרביות שגדלו בהיעדר גורמי גדילה או בנוכחות BMP-2 בריכוזים שונים או FGF-2 ב-50 ננוגרם/מ"ל במשך (A) 4 ימים או (B) 7 ימים של תרבות משותפת. פעילות ALP מוצגת מנורמלת לתכולת ה- DNA של כל דגימת ליזט. הנתונים מיוצגים כממוצע ± סטיית תקן. הניתוח הסטטיסטי בוצע באמצעות GraphPad Prism 9.5.1. ANOVA חד-כיווני רגיל עם מבחן השוואות מרובות של דנט בוצע עם n = 5; P < 0.0001. (C) צביעת צבע ישירה של פעילות ALP בגומחות הגדלות בנוכחות 50 ננוגרם/מ"ל FGF-2 או BMP-2 למשך 7 ימים של תרבית משותפת. התמונות בצד שמאל מתארות סקירות שלמות תפורות של תמונות שנרכשו בהגדלה של פי 2.5 (סרגל קנה מידה: 1,000 מיקרומטר), ואילו התמונות בצד ימין מתארות שדה ראייה אחד שנרכש בהגדלה של פי 5 (סרגל קנה מידה: 400 מיקרומטר). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
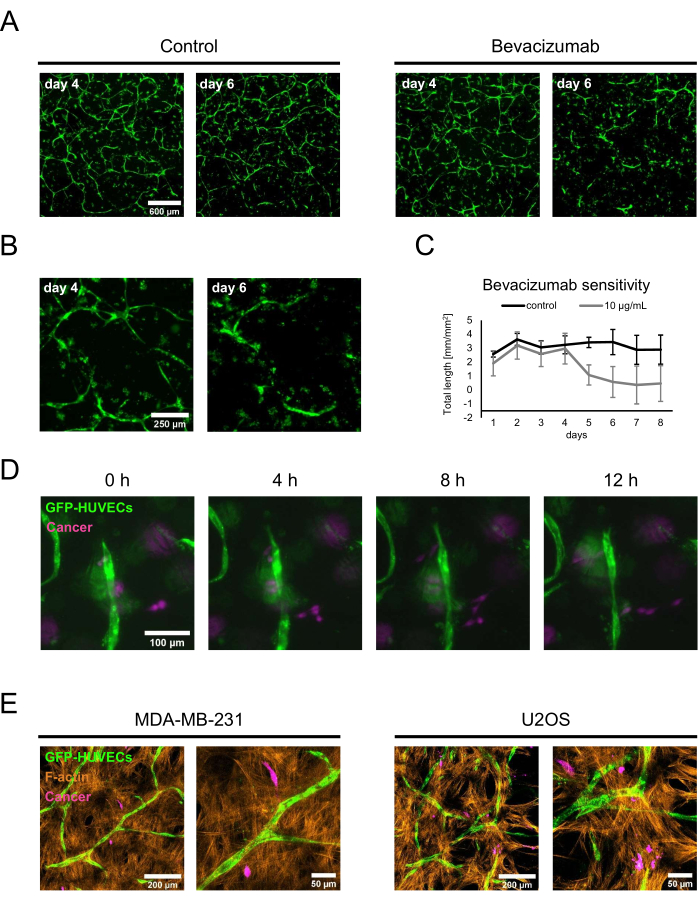
איור 5: שימוש בנישות אוסטאוגניות, וסקולריות במודלים מתקדמים של סרטן. (A) אותות GFP של תרביות שגדלו בנוכחות BMP-2 צולמו ביום 4 של תרבית משותפת לפני שתמיסת בקרה (משמאל) או bevacizumab ב-10 מיקרוגרם/מ"ל (מימין) נוספו במשך יומיים, ולאחר מכן התרבויות צולמו שוב (יום 6 של תרבות משותפת). סרגל קנה מידה: 600 מיקרומטר. (B) תמונות הגדלה גבוהות יותר של התרביות שטופלו ב-bevacizumab מוצגות ב-A. סרגל קנה מידה: 250 מיקרומטר. (C) האורך הכולל של רשתות האנדותל כפי שמוצג ב-A כומתו באמצעות Angiogenesis Analyzer for ImageJ מתמונות שנרכשו מדי יום; n ≥ 3. (D) CellTrace FarRed עם תווית MDA-MB-231 תאי סרטן השד נוספו לתרביות המשותפת של 4 ימים שגודלו בנוכחות BMP-2, ותמונות בהילוך מהיר נרכשו החל מיומיים לאחר הוספת התא הסרטני. סרגל קנה מידה: 100 מיקרומטר. (E) הקרנות בעוצמה מרבית של ערימות קונפוקליות (גובה כולל: 70 מיקרומטר; z-step: 2.4 מיקרומטר) של תרביות משולשות שנוצרו כמתואר ב-D וקבועות ומוכתמות עבור F-actin. משמאל: גומחות המציגות תאי סרטן שד MDA-MB-231; מימין: גומחות הכוללות תאי אוסטאוסרקומה U2OS. פסי קנה מידה לתמונות משמאל: 200 מיקרומטר; פסי קנה מידה לתמונות מימין: 50 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Discussion
במאמר זה אנו מתארים פרוטוקול להקמת מודל במבחנה של גומחות עצם ומח עצם וסקולריות מאוד במטריצה תלת-ממדית מבוססת PEG סינתטית לחלוטין וניתנת לשליטה, שיש לה מגוון יישומים במחקר ביולוגי של מח עצם ומח עצם, הנדסת רקמות וחקר הסרטן. מודל זה מתבסס על הידרוג'ל סינתטי מבוסס PEG המתפקד עם פפטידים RGD ואתרי מחשוף MMP ונוצק עם שיפוע צפיפות מעמיק על לוחות הדמיה 96 בארות תחתית זכוכית30. פלטפורמת plug-and-play זו הוכחה כמאפשרת הקמת רשתות סלולריות תלת-ממדיות מקושרות מאוד ללא צורך לעטוף תאים לתוך ההידרוג'ל. בדומה לפרוטוקול אנקפסולציית התא שתואר קודם לכן, בעבודה זו, אנו מראים את העיצוב מחדש של המצע על ידי ECM28 הטבוע בתא כדי ליצור מיקרו-סביבה ספציפית לסוג התא. לכן, בשיטה זו, ניתן לבצע בקלות בדיקות סינון סמים וניתוחי תוכן גבוה בתנאי תרבית תלת-ממד אורגנוטיפיים הניתנים לשחזור. לוחות 96 הקידוחים בעלי תחתית הזכוכית וההידרוג'לים השקופים אופטית הופכים את הפלטפורמה לתואמת לאוטומציית טיפול בנוזלים ולמיקרוסקופ בתפוקה גבוהה.
הצעד הראשון ביצירת נישת מח עצם וסקולרית אוסטאוגנית הוא תרבית טרום של hBM-MSCs על הידרוג'ל PEG למשך 3 ימים לפחות. במהלך תקופה זו, הם נצמדים להידרוג'ל, חודרים אליו, ומתחילים ליצור מגעים בין תאים ושקיעת ECM. לפני זריעת hBM-MSCs, יש להסיר את מאגר האחסון. מכיוון שההידרוג'ל ממוקם בתוך באר פנימית בתוך הבאר הסטנדרטית של צלחת הדמיה של 96 בארות, בטוח להכניס את קצה השאיפה לאורך דופן הבאר עד שהוא נוגע בטבעת הבאר הפנימית. משאבת ואקום יכולה לשמש לשאיפה אם היא מוגדרת בכוח היניקה הנמוך ביותר האפשרי. לחלופין, ניתן להשתמש במכונת כביסה אוטומטית עם גובה הזרבובית המותאם לפחות ל-0.8 מ"מ מעל טבעת הבאר הפנימית כדי לשאוף את החיץ מצלחת ההידרוג'ל. שימוש באוטומציה לטיפול בנוזלים יכול למזער את הנזק למשטח ההידרוג'ל ולהוביל לשחזור גבוה יותר של התרביות המתקבלות. פגמים קטנים על פני השטח של ההידרוג'ל הופכים גלויים ברגע שהתאים מתיישבים על ההידרוג'ל ומופיעים במישור מיקוד נמוך יותר באזורי הידרוג'ל פגומים. לכן, רכישת תמונות ייחוס ביום 0 משמשת כבקרת איכות טובה להומוגניות זריעת התא ולשלמות פני השטח של הידרוג'ל. בעוד פגמים קטנים בפני השטח של הידרוג'ל אינם מונעים שימוש נוסף בבאר, התאים נוטים להתקבץ על האזורים הפגומים ועשויים לגדול לדפוסים לא מייצגים או להגיע מהר יותר לזכוכית התחתונה, שם הם גדלים לשכבה אחת. יש לציין ממצאים אלה בעת שימוש/הערכה של בארות אלה. שיקולים דומים חלים על כל שינוי בינוני שיבוצע במהלך כל תקופת הבדיקה.
השלב השני של הפרוטוקול כולל תוספת של GFP-HUVECs למונוקולטורה hBM-MSC שנוצרה מראש (יום 0 של תרבות משותפת). ה- ECM שהופקד על ידי hBM-MSC מספק פיגום נהדר לצמיחת תאי אנדותל, אשר בעבודה זו, אפילו בנוכחות מדיום מותנה hBM-MSC, יכול היה ליצור רק צבירי תאים עגולים על ההידרוג'לים (לא מוצגים). עם הזריעה על תרביות hBM-MSC, HUVECs משתלבים ויוצרים מבנים דמויי מיקרו-כלי דומים לאלה שנצפו בתרביות משותפות שנוצרו על ידי אנקפסולציה של תאים27,28. בדרך כלל, רשתות מיקרו-וסקולריות תלת-ממדיות מפותחות היטב נוצרות תוך 4 ימים מהתרבית המשותפת, וניתן לנטר זאת לאורך זמן על ידי שימוש ב-HUVECs המסומנים ב-GFP. מבנים אלה יכולים להישמר לפחות 7 ימים בתרבית, כלומר יש מספיק זמן לעקוב אחר שינויים בארגון רשת כלי הדם בתגובה לטיפולים, כגון עבור הקרנה של תרופות אנטי אנגיוגניות. ניתן לכמת את המרכיבים המורפולוגיים של רשת האנדותל במצב אצווה על ידי פילוח תמונות GFP באמצעות כלים מבוססים, כגון תוסף Angiogenesis Analyzer של ImageJ33, וניתן להשתמש בפרמטרים שלהם כדי להעריך, למשל, יעילות תרופות ופרמקודינמיקה.
יתרון משמעותי אחד של המודל הסלולרי המתואר עבור יישומים פוטנציאליים רבים הוא הפלסטיות שלו. פשוט להשלים את מדיום התרבות עם גורמי צמיחה שונים יכול לשנות את המראה של התרבות המשותפת. לדוגמה, נוכחותו של BMP-2 לאורך תקופת המונו והתרבות המשותפת יוצרת נישה וסקולרית אוסטאוגנית, המראה פעילות ALP מוגברת, שקיעת סידן חוץ-תאית, כמו גם הרכבה ותצהיר ECM. להיפך, בנוכחות FGF-2, הסמנים האוסטאוגניים נעדרים, והתרבית המשותפת יוצרת פחות אסוציאציות תאים רוחביות אך מראה צמיחה בולטת יותר של תאים תלת-ממדיים. העובדה ש-FGF-2 מדכא את פעילות ה-ALP בעוד BMP-2 מדכא פעילות ALP חזקה יותר בהשוואה ללא טיפול בגורם גדילה עולה בקנה אחד עם תצפיות קודמות27. עם זאת, למרות הבדלים גדולים אלה ברכיב הסטרומה hBM-MSC, היקף הרשת המיקרו-וסקולרית היה דומה מאוד עבור שני התנאים שטופלו בגורמי גדילה בעבודה זו. בתרביות הבקרה נוצרו רק כמה רשתות כלי דם קצרות, המייצגות אולי נישה גרועה של מח עצם. זה מצביע על כך שפשוט על ידי שינוי הסוג, הריכוז והתזמון של גורמי הגדילה שנוספו למדיום התרבית, ניתן לייצר מגוון של גומחות מח עצם מוגדרות היטב, כפי שיידרש למחקרים השוואתיים. עם זאת, כדי להבטיח תוצאות הניתנות לשחזור, חשוב לציין כי התקדמות התרבית והמורפולוגיה עשויות להשתנות בהתאם להיסטוריה של התאים בהם נעשה שימוש (למשל, מספר המעבר ושיטת הניתוק המשמשים במהלך תחזוקת תרבית שגרתית), ורצוי לשלוט בגורמים אלה במהלך תכנון הבדיקה.
כאן, כיישום ראשון של מודל זה, אנו מדגימים את הרגישות של רשתות כלי הדם המהונדסות לטיפול עם bevacizumab 10 מיקרוגרם/מ"ל. יש לציין כי חשוב לאשר כי האלגוריתם המשמש יכול לזהות במדויק את רשת האנדותל, כמו חפצים נוצרים לעתים קרובות בתמונות עם רשתות מפותחות גרוע. אם זה המקרה, יש לכוונן את הפרמטרים המשמשים לעיבוד תמונה (לפני ובמהלך הסגמנטציה), לעתים קרובות על בסיס ניסוי וטעייה.
כיישום שני, אנו מציגים מודל תרבית משותפת מתקדם שנוצר על ידי זריעה רציפה של תאים מזנכימליים, אנדותל וסרטן. מודל זה מאפשר לחקור את יחסי הגומלין בין תאים סרטניים, סטרומה וכלי הדם של מח העצם, אשר עשויים להיות גורמים חשובים במהלך גרורות. בנוסף, מודל זה יכול לשמש ליישומי סינון תרופות ובדיקת תרכובות עם מטרות מעבר לאנגיוגנזה.
בתרביות דו-ממדיות, תאים אינם מקבלים אותות מיקרו-סביבתיים פיזיולוגיים, אינם רוכשים מורפולוגיות תאים טבעיות, וכתוצאה מכך מתמיינים באופן שונה בהשוואה לתאים בסביבות תלת-ממדיות טבעיות35. כאשר הם גדלים בהידרוג'לים תלת-ממדיים מהונדסים, התאים מפקידים ECM מובנה בשלב מוקדם, המספק אתרי הידבקות וניתן לשפץ אותם באופן פעיל28,36. כאן, כדי להקים מודל תלת ממדי פשוט ליישומי הקרנה, תאים יוצרי כלי דם נזרעו על פני השטח של הידרוג'לים מהונדסים והורשו להקים רשתות כלי דם בהיעדר זילוח. ההערכות מבוססות הדמיה נערכו על תחזיות דו-ממדיות של תאי אנדותל התורמים למבני כלי הדם. עם זאת, רק תמונות קונפוקליות חשפו את הצמיחה הפחות בולטת של רשתות כלי הדם התלת-ממדיות בדגימות BMP-2 מגורות בהשוואה לדגימות FGF-2 מגורה. זה מצביע על כך שאורך מבני כלי הדם שנוצרו הוערך בחסר, בעוד שהקישוריות שלהם הוערכה יתר על המידה. בנוסף, אינטראקציות בין תאים פריווסקולריים ותאי אנדותל והיווצרות לומן וסקולרי לא נחקרו. היבטים אלה, במיוחד במונחים של תגובות לטיפול תרופתי, ידרשו תשומת לב נוספת. לבסוף, פרוטוקולים מעודנים כדי לבסס תחילה רשתות כלי דם תלת-ממדיות נרחבות ורק לאחר מכן לגרום להתמיינות האוסטאוגנית שלהם יהיו רצויים כדי ליצור מודלים פיזיולוגיים יותר של עצמות ומח עצם.
בסך הכל, המודל המוצג כאן הוא רב-תכליתי ביותר וניתן להתאים אותו בקלות ליישומים ספציפיים. לדוגמה, תאים מזנכימליים ואנדותל ממקורות שונים יכולים לשמש. ידוע כי MSCs מרקמת השומן ו- MSCs של חבל הטבור מבטאים גורמים אנגיוגניים שונים בהשוואה ל- BM-MSCs, וניתן להחליף אותם בקלות כרכיב סטרומה חלופי37. תאי אנדותל שבודדו מנישות מח עצם שכבר הוגדרו יכולים לשמש במקום HUVECs. אפשר גם לבסס את התרבית המשותפת עם תאי מח עצם מזנכימליים ותאי אנדותל שמקורם במטופל עבור יישומי רפואה מותאמת אישית, כפי שהוצע לאחרונה עבור תרביות שרירים משותפות של כלי דם38. בנוסף, העיצוב של צלחת ההידרוג'ל מאפשר ניטור אורכי של התרבית הן באמצעות מיקרוסקופ שדה בהיר והן במיקרוסקופ פלואורסצנטי, ובכך מציע למשתמש את האפשרות לקצר או להאריך את זמן התרבית בהתאם ליישום. לחלופין, ניתן להתאים את צפיפות התאים המשמשת לזריעה בהתאם כדי להאיץ או לעכב את היווצרות הרשת התאית אם נדרשים זמני תצפית קצרים או ארוכים יותר מאלה שבפרוטוקול זה. בכל מקרה, נדרשת זהירות כדי למנוע צמיחת יתר של תאים למבנים דמויי יריעות, מה שעלול להוביל להתכווצות ההידרוג'ל ובסופו של דבר לניתוק התא.
לבסוף, ניתן לבצע מגוון רחב של בדיקות באמצעות מודל זה. בנוסף לאימונופלואורסנציה ולמיקרוסקופיה המבוצעת בתרביות חיות או קבועות, התרביות התלת-ממדיות עשויות להיות מעוכלות אנזימטית, וניתן לאחזר את התאים ולחשוף אותם לכל סוג של בדיקה ביוכימית. כאן, אנו מדגימים את קביעת פעילות ALP וכימות תוכן DNA בליזטים של תאים באמצעות בדיקות קולורימטריות/פלואורומטריות, אך המערכת תואמת לטכניקות רבות אחרות, כולל PCR, RNAseq ופרוטאומיקה. אם הרגישות של הבדיקה הרצויה אינה גבוהה במיוחד, ניתן לאסוף דגימות מיותר מבאר אחת כדי להגדיל את כמות הדגימה הזמינה לבדיקה. אם היישום הרצוי דורש המסת ג'ל מהירה יותר, ניתן ליישם ניעור אורביטלי של הצלחת בשילוב עם נפחים קטנים יותר של תמיסת העיכול כדי להבטיח היווצרות מערבולות בבארות, בהנחה שכל הבארות על הצלחת ישמשו באופן זה (תרבויות חיות רגישות לטיפול קשה כזה). לסיכום, אנו מציגים כאן פרוטוקול אשר, אם משתמשים בו כמתואר, מבטיח את יצירתו של מודל במבחנה המשחזר את ההיבטים העיקריים של נישות כלי דם אוסטאוגניות, אך הוא גם ורסטילי מספיק כדי להיות שונה עבור יישומים מותאמים אישית.
Disclosures
Ectica Technologies AG היא היצרנית של צלחת באר הידרוג'ל 3DProSeed ויש לה אינטרסים מסחריים. בנג'מין ר. סימונה ומרטין ארבר הם בעלי המניות של Ectica Technologies AG.
Acknowledgements
המחברים רוצים להודות לריקרדו אורבנט על הסיוע הטכני עם מכשירי הטיפול בנוזלים ולרודי אודבסי על התמיכה במיקרוסקופ האפיפלואורסצנטי. עבודה זו מומנה על ידי הקרן הלאומית השוויצרית למדע (מספרי מענקים 310030E_202429 ו- 205321_204318) ו- Ectica Technologies AG.
Materials
| Name | Company | Catalog Number | Comments |
| 0.25% Trypsin-EDTA | Gibco | 25200-072 | |
| 2 mL microtubes | Eppendorf | 30120094 | |
| 2-Amino-2-methyl-1-propanol | Sigma | A9199 | |
| 3DProSeed hydrogel well plate | Ectica Technologies | ECT.PS1.001.096 | |
| 4-Nitrophenyl phosphate disodium salt hexahydrate | Sigma | 71768 | |
| Alizarin Red S | Sigma | A5533 | |
| Anti-Collagen IV antibody | Abcam | ab6311 | |
| Anti-Laminin 1+2 antibody | Abcam | ab7463 | |
| Automated plate washer | Agilent Biotek | ELχ50 | |
| Automated washer/dispenser | Agilent Biotek | MULTIFLO FX equipped with a peristaltic pump 5uL cassette | |
| Bevacizumab | Evidentic | ID PS-E07-2019-00119 A009 | |
| BMP-2 | Peprotech | 120-02C | |
| BSA | AppliChem | A1391 | |
| Centrifuge | Eppendorf | 5415 R | To centrifuge 2 mL tubes at 16100 x g during ALP analysis |
| Confocal laser scanning microscope | Leica | Stellaris 5 | |
| Conical 50 mL centrifuge tubes | TPP | 91050 | |
| DAPI | Sigma | D9542 | |
| DyLight 649 Donkey anti-rabbit IgG (minimal x-reactivity) Antibody | Biolegend | 406406 | |
| DyLight 649 Goat anti-mouse IgG (minimal x-reactivity) Antibody | Biolegend | 405312 | |
| EGM-2 | Lonza | CC-3162 | |
| Epifluorescence microscope | Leica | DMI6000B | |
| FBS | Gibco | 10500-064 | |
| FGF-2 | Peprotech | 100-18B | |
| Fibronectin (IST-9) | Santa Cruz | sc-59826 | |
| GFP-HUVECs | PELOBiotech | PB-CAP-0001GFP | |
| hBM-MSCs | - | - | Isolated at University Hospital Basel; Papadimitropoulos A, Piccinini E, Brachat S, et al. Expansion of human mesenchymal stromal cells from fresh bone marrow in a 3D scaffold-based system under direct perfusion. PLoS One. 2014;9(7):e102359 |
| Inverted microscope | Zeiss | 200M | |
| Magnesium chloride | Sigma | M8266 | |
| MDA-MB-231 breast cancer cell line | - | Kindly obtained from J Massagué at the Memorial Sloan-Kettering Cancer Center | |
| MEMα | Gibco | 22571-038 | |
| Multimode imaging reader | Agilent Biotek | Cytation 1 | For automated imaging |
| Multimode imaging reader - fluorescence and absorbance | Agilent Biotek | Cytation 5 | For measuring absorbance and fluorescence intensity duing ALP analysis |
| Paraformaldehyde | Artechemis | US 040 | |
| PBS | Gibco | 10010-015 | |
| Penicillin/Streptomycin | Gibco | 15140-122 | |
| Phalloidin-rhodamine | Invitrogen | R415 | |
| Picro-Sirius Red Solution | Abcam | ab246832 | |
| Quant-iT PicoGreen dsDNA Assay kit | ThermoFisher Scientific | P7589 | |
| Recombinant Anti-Collagen I antibody | Abcam | ab260043 | |
| SIGMAFAST BCIP/NBT | Sigma | B5655-25TAB | |
| Sodium hydroxide | Sigma | 1064981000 | |
| Sodium phosphate dibasic, anhydrous | Sigma | S-0876 | |
| Sodium phosphate monobasic, monohydrate | Merck | 1.06346 | |
| Triton X-100 | Sigma | T8787 | |
| Tween20 | AppliChem | A4974 | |
| U2OS osteosarcoma cell line | - | Kindly obtained from J Snedeker at the Institute for Biomechanics, Zurich | |
| α-trehalose dihydrate | Sigma | 90208 |
References
- Mendez-Ferrer, S., et al. Mesenchymal and haematopoietic stem cells form a unique bone marrow niche. Nature. 466 (7308), 829-834 (2010).
- Calvi, L. M., Link, D. C. Cellular complexity of the bone marrow hematopoietic stem cell niche. Calcified Tissue International. 94 (1), 112-124 (2014).
- Behrmann, L., Wellbrock, J., Fiedler, W. Acute myeloid leukemia and the bone marrow niche-take a closer look. Frontiers in Oncology. 8, 444 (2018).
- Yip, R. K. H., et al. Mammary tumour cells remodel the bone marrow vascular microenvironment to support metastasis. Nature Communications. 12 (1), 6920 (2021).
- Potente, M., Makinen, T. Vascular heterogeneity and specialization in development and disease. Nature Reviews Molecular Cell Biology. 18 (8), 477-494 (2017).
- Augustin, H. G., Koh, G. Y. Organotypic vasculature: From descriptive heterogeneity to functional pathophysiology. Science. 357 (6353), (2017).
- Kusumbe, A. P., Ramasamy, S. K., Adams, R. H. Coupling of angiogenesis and osteogenesis by a specific vessel subtype in bone. Nature. 507 (7492), 323-328 (2014).
- Barillari, G. The anti-angiogenic effects of anti-human immunodeficiency virus drugs. Frontiers in Oncology. 10, 806 (2020).
- Owen, M., Friedenstein, A. J. Stromal stem-cells - Marrow-derived osteogenic precursors. Ciba Foundation Symposia. 136, 42-60 (1988).
- Sacchetti, B., et al. Self-renewing osteoprogenitors in bone marrow sinusoids can organize a hematopoietic microenvironment. Cell. 131 (2), 324-336 (2007).
- Traore, M. A., George, S. C. Tissue engineering the vascular tree. Tissue Engineering. Part B, Reviews. 23 (6), 505-514 (2017).
- Bessy, T., Itkin, T., Passaro, D. Bioengineering the bone marrow vascular niche. Frontiers in Cell and Developmental Biology. 9, 645496 (2021).
- Bray, L. J., et al. A three-dimensional ex vivo tri-culture model mimics cell-cell interactions between acute myeloid leukemia and the vascular niche. Haematologica. 102 (7), 1215-1226 (2017).
- Montano, I., et al. Formation of human capillaries in vitro: The engineering of prevascularized matrices. Tissue Engineering Part A. 16 (1), 269-282 (2010).
- Sun, Z. Y., Kemp, S. S., Lin, P. K., Aguera, K. N., Davis, G. E. Endothelial k-RasV12 expression induces capillary deficiency attributable to marked tube network expansion coupled to reduced pericytes and basement membranes. Arteriosclerosis Thrombosis and Vascular Biology. 42 (2), 205-222 (2022).
- Kleinman, H. K., et al. Basement-membrane complexes with biological-activity. Biochemistry. 25 (2), 312-318 (1986).
- Kubota, Y., Kleinman, H. K., Martin, G. R., Lawley, T. J. Role of laminin and basement-membrane in the morphological-differentiation of human-endothelial cells into capillary-like structures. Journal of Cell Biology. 107 (4), 1589-1598 (1988).
- Davis, G. E., et al. Control of vascular tube morphogenesis and maturation in 3D extracellular matrices by endothelial cells and pericytes. Methods in Molecular Biology. 1066, 17-28 (2013).
- Jeon, J. S., et al. Human 3D vascularized organotypic microfluidic assays to study breast cancer cell extravasation. Proceedings of the National Academy of Sciences of the United States of America. 112 (1), 214-219 (2015).
- Bersini, S., et al. A microfluidic 3D in vitro model for specificity of breast cancer metastasis to bone. Biomaterials. 35 (8), 2454-2461 (2014).
- Wang, X. L., et al. Engineering anastomosis between living capillary networks and endothelial cell-lined microfluidic channels. Lab on a Chip. 16 (2), 282-290 (2016).
- Phan, D. T. T., et al. A vascularized and perfused organ-on-a-chip platform for large-scale drug screening applications. Lab Chip. 17 (3), 511-520 (2017).
- Lutolf, M. P., Hubbell, J. A. Synthetic biomaterials as instructive extracellular microenvironments for morphogenesis in tissue engineering. Nature Biotechnology. 23 (1), 47-55 (2005).
- Kyburz, K. A., Anseth, K. S. Synthetic mimics of the extracellular matrix: How simple is complex enough. Annals of Biomedical Engineering. 43 (3), 489-500 (2015).
- Ehrbar, M., et al. Enzymatic formation of modular cell-instructive fibrin analogs for tissue engineering. Biomaterials. 28 (26), 3856-3866 (2007).
- Ehrbar, M., et al. Biomolecular hydrogels formed and degraded via site-specific enzymatic reactions. Biomacromolecules. 8 (10), 3000-3007 (2007).
- Blache, U., et al. Dual role of mesenchymal stem cells allows for microvascularized bone tissue-like environments in PEG hydrogels. Advanced Healthcare Materials. 5 (4), 489-498 (2016).
- Blache, U., et al. Notch-inducing hydrogels reveal a perivascular switch of mesenchymal stem cell fate. Embo Reports. 19 (8), e45964 (2018).
- Simona, B. R., et al. Density gradients at hydrogel interfaces for enhanced cell penetration. Biomaterials Science. 3 (4), 586-591 (2015).
- Zhang, N., et al. Soft hydrogels featuring in-depth surface density gradients for the simple establishment of 3d tissue models for screening applications. SLAS Discovery. 22 (5), 635-644 (2017).
- Martin, I., Muraglia, A., Campanile, G., Cancedda, R., Quarto, R. Fibroblast growth factor-2 supports ex vivo expansion and maintenance of osteogenic precursors from human bone marrow. Endocrinology. 138 (10), 4456-4462 (1997).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Carpentier, G., Martinelli, M., Courty, J., Cascone, I. Angiogenesis Analyzer for ImageJ. 4th ImageJ User and Developer Conference. , 198-201 (2012).
- Preibisch, S., Saalfeld, S., Tomancak, P. Globally optimal stitching of tiled 3D microscopic image acquisitions. Bioinformatics. 25 (11), 1463-1465 (2009).
- Yamada, K. M., Cukierman, E. Modeling tissue morphogenesis and cancer in 3D. Cell. 130 (4), 601-610 (2007).
- Loebel, C., Mauck, R. L., Burdick, J. A. Local nascent protein deposition and remodelling guide mesenchymal stromal cell mechanosensing and fate in three-dimensional hydrogels. Nature Materials. 18 (8), 883-891 (2019).
- Curtis, M. B., Kelly, N., Hughes, C. C. W., George, S. C. Organotypic stromal cells impact endothelial cell transcriptome in 3D microvessel networks. Scientific Reports. 12 (1), 20434 (2022).
- Wust, R., Terrie, L., Muntefering, T., Ruck, T., Thorrez, L. Efficient co-isolation of microvascular endothelial cells and satellite cell-derived myoblasts from human skeletal muscle. Frontiers in Bioengineering and Biotechnology. 10, 964705 (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved