חיקוי קרום מרתף ננופיברילרי עשוי ממשי עכביש פונקציונלי רקומביננטי בתוספות תרבית רקמה בהתאמה אישית
In This Article
Summary
תוספות תרבית רקמה עם ממברנות פלסטיק הן תקן הזהב במעבדות תרביות תאים כתומכות חדירות לביסוס שכבות תאים ומודלים של רקמות מחסום. במאמר זה אנו מציגים שיטה פשוטה להחלפת קרום הפלסטיק בקרום רלוונטי יותר מבחינה ביולוגית העשוי מחלבון משי עכביש רקומביננטי מתפקד.
Abstract
שכפול מחסומי רקמות הוא קריטי ליצירת מודלים רלוונטיים במבחנה להערכת טיפולים חדשניים. כיום, זה נעשה בדרך כלל באמצעות תוספות תרבית רקמה עם קרום פלסטיק, אשר יוצר צד אפי וצד בסיסי. מלבד התמיכה בתאים, קרומים אלה רחוקים מלחקות את מקבילתם הטבעית, קרום המרתף, שהוא מטריצה ננו-פיברילרית מבוססת חלבון. בעבודה זו, אנו מראים דרך פשוטה לשפר באופן משמעותי את הרלוונטיות הביולוגית של תוספות תרבית הרקמה על ידי החלפת קרום הפלסטיק בקרום העשוי מחלבון משי עכביש רקומביננטי טהור ומתפקד. קרום המשי נוצר באמצעות הרכבה עצמית וייצמד באופן ספונטני לתוספת תרבית רקמה נטולת קרום, שם הוא יכול לספק תמיכה לתאים. ניתן להדפיס תוספות תרבית רקמה בהתאמה אישית באמצעות מדפסת תלת ממד סטנדרטית, בהתאם להוראות המופיעות בפרוטוקול, או לרכוש ולהשתמש במקום זאת בתוספות מסחריות. פרוטוקול זה מראה כיצד מערכת התרבית עם קרומי משי בתוספות מוגדרת, ולאחר מכן, כיצד ניתן ליישם את אותן טכניקות גידול תאים המשמשות עם תוספות מסורתיות וזמינות מסחרית.
Introduction
מודלים במבחנה שיכולים לשכפל מחסומי רקמות זכו לתשומת לב גוברת בשל יישומם בבדיקת טיפולים חדשניים והקלה על ההבנה של מנגנוני מחלה בסיסיים 1,2. כדי לשחזר במדויק את המיקרו-סביבה המקורית, חיוני לשחזר את הפונקציה של קרום המרתף (BM), קומפלקס מטריצה חוץ-תאית (ECM) מיוחד מאוד. BM קיים כמעט בכל רקמה בגוף האדם, שם הוא מספק תמיכה לתאי אנדותל ואפיתל ומפריד אותם מהרקמה הבסיסית 2,3. מעבר למתן תמיכה פיזית, ה- BM גם מווסת ושומר על אותות ביוכימיים בין התאים לרקמות הסובבות אותם. פונקציות חיוניות אלה מחייבות תכנון פיגומים הדומים למבנה, כמו גם את המאפיינים המכניים והפונקציונליים של BM3 הילידי.
אחת הדרכים הנפוצות ביותר לחקות את BM במבחנה כיום היא באמצעות שימוש בתוספות תרבית רקמה זמינות מסחרית (TC-inserts). מדובר למעשה בגלילי פלסטיק בעלי קרום חדיר המחלק את החדר לצדדים אפיים ובזולטרליים 4,5. למרות שהם קלים לשימוש, הממברנות בתוספות מסחריות הן בדרך כלל קשיחות, חרוטות במסילה ועשויות מפולימרים כגון פולי(קרבונט) (PC) ופולי(אתילן טרפתאלט) (PET)3,4,6. הם גמישים מבחינת קוטר, צפיפות נקבוביות וגודל וניתן לצפות אותם כדי לשפר את הידבקות התא אך חסרים את כל התכונות הרלוונטיות האחרות של BM, כגון עובי דומה6, נקבוביות מחוברות, ארכיטקטורה סיבית ומודולוס אלסטי רלוונטי3.
הסטנדרטיזציה של תוספות TC וקלות השימוש בהן נתנו השראה למספר קבוצות, כולל שלנו, להחליף את קרום הפלסטיק במקבילו דמוי in vivo (סקירה בטבלה 1). החומרים המשמשים נעים בין פולימרים כגון Polydimethylsiloxane (PDMS)7, Poly(lactide-co-caprolactone) (PLCL)8, ו polycaprolactone (PCL)4,9,10 לחומרים מבוססי חלבון כגון ג'לטין 2,11,12, קולגן 5,13, משי עכביש רקומביננטי 14,15,16,17. ממברנות מחומרים אלה חוברו בדרכים שונות, הן לתוספות מסחריות שמהן הוצא הממברנה 4,7,8,10,12,13,14,16,18,19,20,21 וכן לתוספות בהתאמה אישית שיוצרו באמצעות הדפסה תלת-ממדית 1,11,15,17,20 או הזרקה 9,22., עם זאת, רובם עדיין רחוקים מלהידמות ל- BM המקורי מבחינת עובי, שם ההעתקים נעים בין מאות11,18 עד כמה מיקרומטרים 5,10,14,21,22. רבים מהם דורשים גם היווצרות מורכבת ו / או שיטות התקשרות ידניות 1,7,13,14,18,19,21, מה שהופך את קנה המידה והשכפול במעבדות אחרות למאתגרים.
במאמר זה אנו מציגים שיטה פשוטה ליצור ולהצמיד קרום משי לתוספות ולהראות כיצד לגדל תאים משני צדי הממברנה. קרומי המשי נוצרים באמצעות הרכבה עצמית של חלבון FN-4RepCT (FN-silk) בממשק נוזל-אוויר של תמיסה עומדת16,17. FN-silk היא גרסה קצרה המיוצרת באופן רקומביננטי של Major Ampullulate Spidroin 1 מבית Euprosthenops australis, עם מוטיב RGD הנגזר מפיברונקטין23. הוכח שהוא מתכנס למטריצות פיברילריות המקדמות הידבקות, גדילה ונדידה של תאים 15,16,17,23,24,25. שיטת החיבור של הממברנה על האינסרט מסתמכת על הדבקה ספונטנית ונמצאה מתאימה לתוספות זמינות מסחריות שמהן הוסר הממברנה16, וכן לתוספות מודפסות בתלת ממד מחומצה פולילקטית (PLA)17 ודנטל LT15. מאמר זה מפרט כיצד שיטה זו משמשת עבור תוספות מודפסות מ LT שיניים. לאחר שקרומי משי FN חוברו לתוספות, הם יכולים, למעשה, להיות מטופלים כמו תוספות תרבית רקמה מסחריות סטנדרטיות. בקיצור, אנו מציגים שיטה פשוטה ליצירת מודלים רלוונטיים יותר במבחנה של מחסומי רקמות על ידי החלפת קרומי פלסטיק בקרום משי FN מבוסס חלבון.
Protocol
הדפסת 1. 3D של תוספות
- הורד את . קובץ עיצוב STL (JoVe_Silk_Insert.stl) מתוך קובץ משלים 1.
- הכן את הקבצים להדפסה על ידי פתיחתם בחבילת התוכנה המוקדשת להמרת . קובץ STL לקובץ הדפסה עבור מדפסת התלת-ממד שבשימוש.
- השתמש בתוכנה הייעודית כדי להוסיף תומכים. המבנה התומך מתוכנן על ידי התוכנה, והכמות הדרושה תהיה תלויה במדפסת ובתוכנה בה נעשה שימוש. כוון את הכנס כך שלא פלטפורמת הבניין ולא התמיכות ייגעו בתחתית.
- הדפס את מספר התוספות הרצוי באמצעות שרף תואם ביולוגית (כגון Dental LT או BioMed) או חוט להט (כגון PLA) המתאים למדפסת התלת-ממד שבשימוש.
הערה: ודא כי החומר יכול לעמוד בתהליך עיקור מתאים כגון autoclaving, הקרנה, או טבילת אתנול. - נתק את התוספות המודפסות מפלטפורמת ההדפסה והסר את המבנה התומך המודפס מהחלק המוגמר.
- אם אתה משתמש במדפסת שרף, עבד את התוספות באמצעות הפרוטוקול הסטנדרטי שסופק על-ידי היצרן.
הערה: העיבוד עשוי להשתנות בהתאם לשרף שבו נעשה שימוש. הפרוטוקול המשמש לשרף המשמש כאן מסופק בקובץ משלים 2. - יש לעקר את התוספות בטכניקה המתאימה לחומר הנבחר.
הערה: ההמלצות הן אוטוקלאבינג, הקרנה או טבילה באתנול 70%, או שילוב שלהם. אם אתה משתמש במדפסת שרף, ייתכן שיהיה צורך בפרוטוקול שטיפה נרחב כדי להשיג תאימות ביולוגית אופטימלית. עיין בפרוטוקול המופיע בקובץ משלים 2 לקבלת המלצה. - יש לוודא שהתוספות יבשות לחלוטין ולאחסן אותן סטריליות עד לשימוש.
2. היווצרות קרומי משי FN
- ממלאים קופסה בקרח יבש ומביאים למקפיא בטמפרטורה של -80°C.
- אספו את בקבוקוני המשי FN מהמקפיא בטמפרטורה של -80°C והניחו אותם בקרח יבש להובלה. הביאו את בקבוקוני המשי FN לארון בטיחות ביולוגי ובצעו שם צעדים נוספים. הניחו את בקבוקוני משי FN במתלה צינורות מיקרוצנטריפוגה כדי להפשיר מבלי לגעת בהם יתר על המידה.
- בזמן שהמשי FN מפשיר, פרקו את צלחת 48 הבארות. לאחר שהמשי FN הפשיר לחלוטין, המשך לשלב הבא תוך 10 דקות, רצוי מוקדם יותר.
- יש לדלל את תמיסת משי FN ב-PBS מצונן או בטמפרטורת החדר לריכוז הרצוי, רצוי 1.8 מ"ג/מ"ל. פיפטה 550 μL של תמיסת משי FN ישירות לתחתית באר ריקה בצלחת 48 בארות. פיפטה פתרון משי FN עד למספר הרצוי של ממברנות הוכנה.
הערה: הימנע מהחדרת בועות אוויר והסר בועות אוויר מיד עם פיפטה. אין להשתמש בבארות בשורה A או F או בטור 1 או 8, וגם לא בבארות סמוכות (ראו סכמה באיור משלים S1). - מניחים את המכסה על צלחת 48 בארות ומניחים אותו בתוך קופסה גדולה וסטרילית כדי לספק סביבה סטרילית במהלך הדגירה.
- הוציאו בזהירות את הקופסה מארון הבטיחות הביולוגי והשאירו אותה בתנאי סביבה במקום ללא הפרעה ללא זרימת אוויר משמעותית למשך הלילה.
3. הדבקת קרומי משי FN לתוספות
- למחרת, הביאו את התוספות הסטריליות לארון הבטיחות הביולוגי.
- הביאו את הקופסה הסטרילית הגדולה המכילה את צלחת 48 הקידוחים עם קרומי המשי FN בחזרה לארון הבטיחות הביולוגי ובצעו שם צעדים נוספים. הרימו בזהירות את צלחת 48 הבארות מהקופסה הסטרילית הגדולה.
- אמת חזותית את היווצרות הממברנה על ידי התבוננות בעננות בבארות ופתח את מכסה צלחת 48 הקידוחים המכילה את הממברנות. הרימו אינסרט אחד באמצעות פינצטה סטרילית והנחו את האינסרט כלפי מטה אל הממברנה עד שהידיות של האינסרט ייגעו בחלק העליון של הבאר כפי שמוצג באיור 1. שמור את החלק התחתון של הכנס מקביל לתחתית הצלחת.
- חזור על שלב 3.3 עד להורדת התוספות לכל הקרומים שנוצרו. מניחים את המכסה על גבי צלחת 48 בארות ולאחר מכן להחזיר את הצלחת לקופסה סטרילית. השאירו את הצלחת ללא הפרעה למשך שעתיים בתנאי סביבה כדי לאפשר לקרומים להיצמד לתוספות.
- מחממים מראש את מדיום הצמיחה או PBS ב 37 °C (77 °F).
- לפרוק צלחת 24 בארות.
- לאחר 2 שעות, להסיר את צלחת 48 באר מן הקופסה ולפתוח את המכסה. בעזרת פינצטה סטרילית, החזיקו אינסרט בידיות שלו והרימו אותו מהצלחת בעלת 48 הקידוחים.
- מיד לאחר ההרמה, מלאו את העלון במדיום תרבית שחומם מראש או PBS. השתמש 100 μL של מדיום תרבית אם ממשיכים עם זריעה בצד הבסיס או 200 μL אם ממשיכים עם זריעה בצד apical . אם רוצים לאחסן את הממברנות לשימוש מאוחר יותר, השתמש במקום זאת ב- 200 μL של PBS.
מחסום: אם הנוזל נשמר מעל הממברנה, ההרמה הייתה מוצלחת. אם נוזל מטפטף על הספסל, הקרום דולף ויש להתעלם ממנו. - מניחים את האינסרט בבאר ריקה של צלחת 24 בארות.
- הרימו את כל התוספות מתוך צלחת 48 הבארות והעבירו אותן לצלחת בעלת 24 הקידוחים. מלאו את הבארות ב-1,000 מיקרוליטר של מצע גידול אם ממשיכים בזריעת תאים או PBS לאחסון תוך שמירה על הצלחת מוטה מעט.
הערה: חשוב שקצה הממברנה יהיה מתחת לרמת הנוזל (איור 2). - אם רוצים לזרוע תאים מיד, המשיכו לחלק 4 או 5, תלוי באיזה צד של הממברנה יש לזרוע את התאים. אם לא, הניחו את המכסה על צלחת 24 הבארות והניחו אותו במקרר (4°C) או באינקובטור של 37°C. אם ממוקם באינקובטור, לחדש את PBS כל יום שני כדי להבטיח כי נפח הדרוש נשמר.
4. זריעת תאים בצד האפי של הממברנה
הערה: אם הממברנות אוחסנו ב-PBS, החלף את PBS במדיום תרבית שחומם מראש כמתואר בסעיף 6.
- קצרו את התאים. הכן את השעיית התא כך שמספר התאים הרצוי לכל ממברנה נמצא ב 20-50 μL של התרחיף. השהה מחדש כדי להשיג את ריכוז התא הרצוי.
- באמצעות פיפטה P100 או P200, לשאוף 20-50 μL של השעיית התא. מכוונים את קצה הפיפטה לכיוון מרכז הממברנה, מרחיקים את קצה הפיפטה 1-2 מ"מ מהמשטח הבינוני של התרבית בתוך האינסרט ולוחצים באיטיות על בוכנת הפיפטה ליצירת טיפה בקצה הקצה. הביאו את הטיפה למגע עם מדיום התרבית שבתוך העלון.
הערה: שמור את פיפטה בניצב למשטח העבודה. - חזור על שלב 4.2 עבור הממברנות הנותרות. השהה מחדש את מלאי התא לאחר זריעת חמישה קרומים כדי להבטיח פיזור תאים הומוגני. הזיזו את הצלחת בתבנית הספרה שמונה כדי להבטיח פיזור תאים טוב יותר על הממברנה.
- תרבית בתנאים סטנדרטיים (37 ° C ו 5% CO2) ולשנות בינוני כל יום שני.
5. זריעת תאים בצד הבסיסי של הממברנה
הערה: אם הממברנות אוחסנו ב-PBS, החלף את PBS ב-100 מיקרוליטר של מצע גידול מחומם מראש ומלא את הבארות ב-1 מ"ל של מדיום גידול מחומם מראש כמתואר בסעיף 6.
- קצרו את התאים והכינו את תרחיף התא כך שמספר התאים הרצוי לכל ממברנה נמצא ב -20 מיקרוליטר של התרחיף. השהה מחדש כדי להשיג את ריכוז התא הרצוי.
- פרקו ופתחו את המכסה של צלחת פטרי. ודאו שגובה צלחת הפטרי מספיק כדי להכיל את התוספות מבלי שתחתוניהן ייגעו במכסה.
- בעזרת פינצטה, מרימים את האינסרט מתוך צלחת 24 הקידוחים, ומשאירים את מדיום התרבית בבארות. בעזרת סט פינצטות בכל יד, הופכים את האינסרט כך שהצד הבסיסי פונה כלפי מעלה, והצד האפי פונה לאזור העבודה. הניחו את התוספת ההפוכה בצלוחית הפטרי כמו באיור 3C. חזור על הפעולה לתוספות הנותרות.
הערה: אין להסיר את מדיום התרבות בצד האפיקאלי. זה ישמור על הקרום רטוב במהלך הדגירה. - השהה מחדש את מלאי התא כדי להבטיח פיזור תאים אחיד בתמיסה, ושאפו 20 μL של תרחיף התא עם פיפטה P100 או P200. מכוונים את קצה הפיפטה לכיוון מרכז הממברנה, מרחיקים את קצה הפיפטה 1-2 מ"מ מהממברנה ולוחצים באיטיות על בוכנת הפיפטה ליצירת טיפה בקצה הקצה. שמור את פיפטה בניצב לפני השטח של הממברנה ולאפשר לטיפה ליפול על הממברנה. חזור על הפעולה עבור הקרומים הנותרים.
הערה: השהה מחדש את מלאי התאים לאחר זריעת חמישה קרומים כדי להבטיח פיזור תאים אחיד. - מניחים את המכסה על צלחת הפטרי, מביאים את צלחת הפטרי ואת צלחת 24 הקידוחים לאינקובטור, ודורים על התוספות עם התאים בתנאים סטנדרטיים (37°C ו-5% CO2) למשך 30 דקות.
- הכניסו את צלחת 24 הקידוחים המכילה מדיום תרבית ואת צלחת הפטרי לארון הבטיחות הביולוגית. פתחו את שני העפעפיים והשתמשו בפינצטה בכל יד, הרימו אינסרט אחד והפכו אותו כך שהצד האפי של הממברנה פונה כעת כלפי מעלה והצד הבסיסי כלפי מטה.
- בעזרת פיפטה P200, מוסיפים 200 μL של מדיום תרבית בתוך העלון. מניחים את האינסרט באחת הבארות הממולאות מראש של צלחת 24 הקידוחים וחוזרים על הפעולה עבור הקרומים הנותרים.
- תרבית בתנאים סטנדרטיים (37 ° C ו 5% CO2) ולשנות בינוני כל יום שני.
6. שינוי בינוני של תרבויות בתנאים שקועים
- הכינו צלחת חדשה בת 24 בארות עם מדיום התרבית הטרייה על ידי הוספת 1,000 מיקרוליטר/באר. בעזרת פינצטה, הרימו תוספת אחת מתוך צלחת 24 הבארות, הטו אותה מעט והסירו את המדיום מהצד האפיקאלי.
- הוסף 200 μL של מדיום תרבית טרי בתוך העלון. מניחים את האינסרט בבאר שמולאת מראש במדיום תרבית טרי. חזור על הפעולה עבור כל הממברנות.
7. שינוי בינוני של תרבויות בתנאי הרכבת האווירית
- בעזרת פינצטה, מרימים את האינסרט ומניחים אותו בבאר ריקה של צלחת בת 24 בארות. חזור על הפעולה במשך ארבעה קרומים נוספים.
- מטים מעט את הצלחת בעלת 24 הבארות ומוסיפים לאט 1,000 מיקרוליטר של מדיום תרבית טרי בתוך כל צלחת היטב. חזור על הפעולה עבור הקרומים הנותרים.
8. מדידת התנגדות חשמלית טרנסאפיתל (TEER)
- הכינו צלחת בת 24 בארות עם 1,000 מיקרוליטר של מדיום תרבית או PBS בתוך הבארות והעבירו את הממברנות לתוכה. ודא שיש 200 μL של התמיסה המתאימה מעל הממברנה.
- בעזרת סט פינצטה, ייצבו היטב את האינסרט בתוך הצלחת על ידי לחיצה עדינה על זרועות ההכנסה. מבלי להסיר את הפינצטה, הכנס את אלקטרודת TEER לבאר ורשום את המדידה.
- הסר את האלקטרודה ולאחר מכן הרם את הפינצטה.
- חזור על שלבים 8.2-8.3 עבור הממברנות הנותרות.
תוצאות
תצלומים מייצגים של התוספות
תצלומים של התוספות לפני ואחרי השחרור מפלטפורמת ההדפסה מוצגים באיור 3A,B. תמונה של תוספת מוגמרת שממנה הוסרה התמיכה מוצגת באיור 3C. התוצאה היא קבוצה של תוספות מודפסות בתלת-ממד, מוכנות לעיקור ולשימוש לאחר מכן.
הרמה וטיפול בקרומי משי FN
סכמה כללית של היווצרות קרום משי FN והרמה ידנית מוצגת באיור 1. התוצאה היא מספר תוספות עם קרום משי FN מחובר. כדי להבטיח את שיעור ההצלחה הגבוה ביותר עם הרמת קרומים שלמים, יש לעקוב במדויק אחר השלבים המתוארים בפרוטוקול. איור 4 מראה תצלומים של קרום כשהוא שלם (A,D) ולאחר קריעה (B,E,F). ניתן להמחיש את הקרע באמצעות מיקרוסקופ שדה בהיר (איור 4E,F) ו/או באמצעות טפטוף של נוזל דרך הממברנה (איור 4B). חשוב להרים ולהוריד את התוספות בניצב לממברנה, כדי לוודא שהקרום נצמד באופן שווה ונמתח מתחת לתוספות. ניתן לראות הידבקות קרום באופן חזותי, כפי שמוצג באיור 4A. אם מורידים את האינסרט לפי ההוראות ורמות הנוזלים נשמרות כפי שמוצג באיור 2, הממברנה נשארת מחוברת לאינסרט לאורך תקופות תרבית ארוכות.
כאן, חיבור הממברנה לעלון מאומת על ידי ביצוע ניסוי חלחול 15,16,17 על ממברנות שהוחזקו בתנאי תרבית תאים סטנדרטיים במשך 9 ימים. בקצרה, כאשר מוסיפים מולקולה פלואורסצנטית על גבי הממברנה ומודדים את האות בתמיסה למטה, פרופיל החדירה של קרומי המשי עוקב אחר זה של תוספת תרבית רקמה זמינה מסחרית (איור 4C), מה שמראה שאין דליפה במשך 36 שעות של חלחול ומציין שהקרום נשאר שלם וגם מחובר לעלון. ניסויים דומים נערכו בעבר עם תאים שנזרעו עלאחד 15 או שני הצדדים של קרום המשי17. עוצמת ההדבקה הודגמה בעבר באמצעות כניסת מאקרו16 ומבחני אינפלציה16,17. במסגרת ניסויי הזחת המאקרו, נעשה שימוש בחרט כדי למתוח את הממברנה, אשר נקרעה בכוח של 1.4 mN, תוך שהיא נשארת מחוברת לאינפרט16.
יש לציין כי אחוזי ההצלחה של הרמת קרומים שלמים קשורים לחומר ולטיפול שלאחר התוספות. בפרוטוקול זה, 95% מהקרומים שהורמו באמצעות תוספות שהודפסו עם השרף שבו נעשה שימוש התאימו לזריעת תאים, בהשוואה ל-74% כאשר נעשה שימוש בשרף דומה במקום. אנו משערים כי ההיצמדות נעזרת באינטראקציות הידרופוביות ובכוחות ואן דר ואלס, ולכן שינוי תכונות החומר משנה את עוצמת ההדבקה. זה נתמך עוד יותר על ידי העובדה כי הממברנות אינן נצמדות היטב לחומרים הידרופיליים (נתונים לא מוצגים).
תוצאות מייצגות של תרבית תאים על קרומי משי FN
תמונות אימונופלואורסצנטיות של קרטינוציטים (HaCaT) בתרבית בצד האפי או הבסיסי של הממברנה מוצגות באיור 5. התאים שהודבקו (איור 5D.i) נצפו מכסים באופן שווה את אזור התרבית ביום 1 בזמן שהם רוכשים את המורפולוגיה הטיפוסית של אבן מרוצפת קרטינוציטים (איור 5A.i-B.i). ביום השלישי, הקרטינוציטים יצרו שכבה קונפלואנטית (איור 5A.ii-B.ii) ויצרו רשת של צמתים הדוקים (איור 5D.ii), מה שמצביע על כך שהם מניחים תפקודי אפיתל פיזיולוגיים. הרמות הגבוהות של כדאיות התא שהושגו במטריצות משי FN 15,17,23,24 הוצגו גם במערך תרבית החדרת קרום המשי המתואר כאן. לאחר 3 ימים בתרבית, קרטינוציטים נשארו בני קיימא מאוד (איור 5C.i-iv). בנוסף, לא נצפה הבדל בפיזור התאים המתים בין המרכז (איור 5C.i-ii) לבין הפריפריה של הממברנה (איור 5C.iii-iv), מה שלא חשף השפעה משמעותית של חומר ההחדרה על הכדאיות של HaCaT. בסך הכל, מערכת תרבית החדרת המשי הציעה כדאיות קרטינוציטים דומה (איור 5i-ii, v-vi) אם לא משופרת (איור 5iii-iv, vii-viii) עם זו של מערכת מסחרית להחדרת קרום PET.
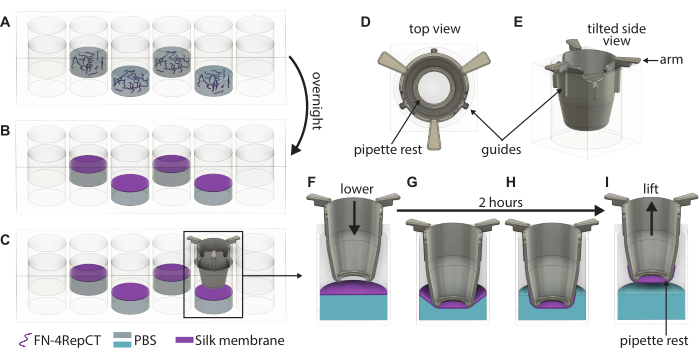
איור 1: איור מפורט של היווצרות והרמה של קרומי משי FN יחידים. (A) מלאו כל באר שנייה (הימנעו מהשורה/עמודה החיצונית) בצלחת בת 48 בארות עם תמיסת חלבון משי FN, כאשר (B) היא מתכנסת בעצמה לקרום בממשק נוזל-אוויר למשך הלילה. (C) תפוס את האינסרט עם זוג פינצטות והורד אותו באיטיות אל הממברנה באמצעות קווי העזר (D,E) שעל העלון המודפס בתלת-ממד כדי לוודא שהאינסרט מונמך בניצב לממברנה. הגדלה של הדבקת קרום המשי מראה חתך רוחב של האינסרט (F) ממש מעל הממברנה ו-(G) כשהוא נוגע בקרום המשי. במהלך תקופת הדגירה של 2 שעות, (H) קרום המשי מתחבר באופן ספונטני לתוספת, ואז (I) משמש להרמת הממברנה מהממשק. קיצורים: FN = פיברונקטין PBS = מלח חוצץ פוספט. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
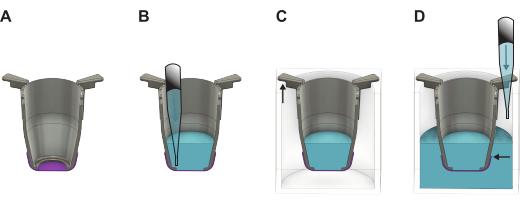
איור 2: איור מפורט המראה כיצד לטפל בקרום משי FN לאחר הרמת אותו מלוח היצירה. (A) התוספת (אפור) עם הממברנה (סגול) מיד לאחר ההרמה. (B) נוזל (כחול) מתווסף בצד האפי של הממברנה, אשר לאחר מכן ממוקם בלוח (C) 24 בארות שבו החלק הארוך יותר של זרועות הכנס תלוי על הקירות, והחלק הקצר יותר שומר על האינסרט ממוקם במרכז הצלחת. (D) מוסיפים נוזל לבאר, ומבטיחים שרמת הנוזל מאוזנת ומעל קצה הממברנה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 3: תצלומים של התוספות שהודפסו בתלת-ממד. (A) התוספות מיד לאחר הוצאתן ממדפסת התלת-ממד, עדיין מחוברות ללוח הבנייה. (B) תוספת אחת לאחר הוצאתה מלוח הבנייה, לפני שבירת התמיכות. (ג) תוספת אחת לאחר הסרת התמיכות. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
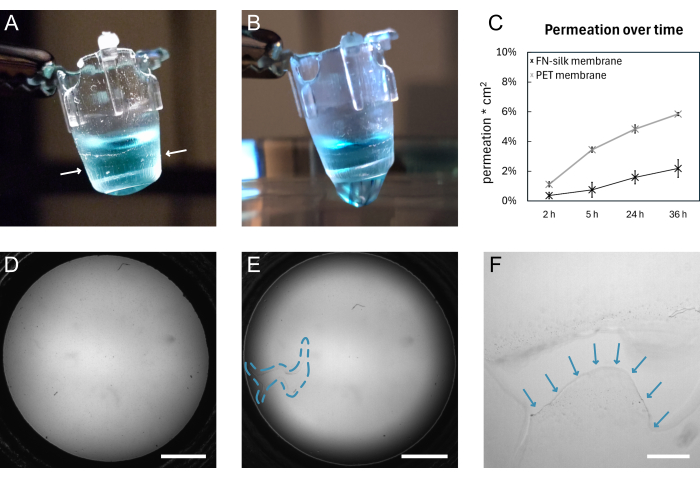
איור 4: קרום משי FN לפני ואחרי שבירה. (A) תצלום של קרום שלם הנושא 200 מיקרוליטר PBS צבוע (כחול) בצד האפיקאלי. קצה הממברנה הכרוך סביב העלון מסומן בחצים לבנים. (B) צילום של אותו קרום לאחר הקריעה. PBS דולף דרך הממברנה. (C) תרשים המראה חלחול של מולקולה פלואורסצנטית של 3 kDa במשך 36 שעות דרך קרום משי או קרום PET זמין מסחרית שנשמר בתנאי תרבית תאים סטנדרטיים במשך 9 ימים. (D) תמונת שדה בהיר של קרום לפני קריעה. (E) תמונת שדה בהיר של אותו קרום לאחר קריעה. האזור הפגום מסומן על-ידי קו המתאר המקווקו הכחול. (F) תצוגה מוגדלת של הקרע המוצג ב-D עם קצה הקרום הקרוע המסומן בחצים כחולים. פסי קנה מידה = 1 מ"מ (D,E), 200 מיקרומטר (F). קיצורים: FN = פיברונקטין PBS = מלח חוצץ פוספט; PET = פולי(אתילן טרפתלט). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
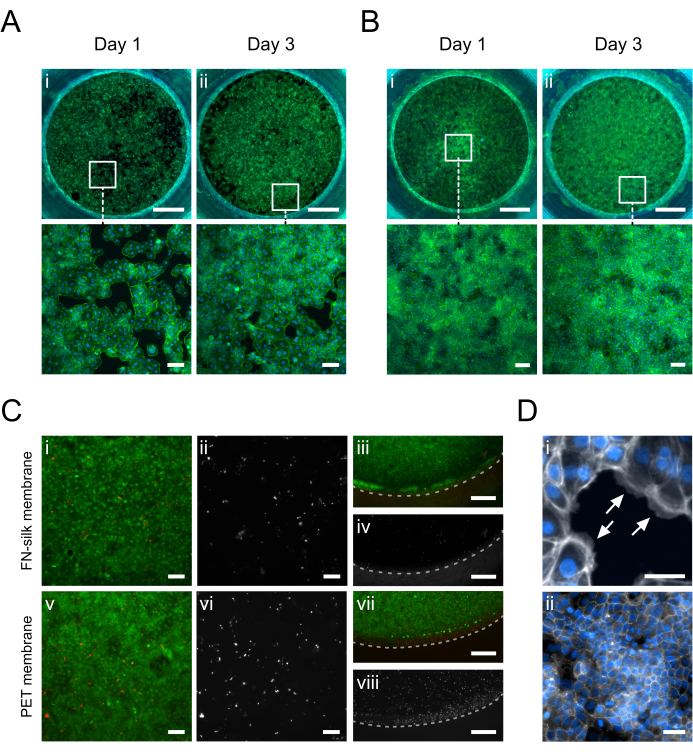
איור 5: קרטינוציטים (HaCaT) שגודלו בתרבית על קרום משי FN. ביום הראשון, קרטינוציטים נצמדו וכיסו באופן שווה את שטח הפנים של הממברנה בצד האפי (A.i) או הבסיסי (B.i) (פאלואדין, ירוק). ביום השלישי, נוצרת חד-שכבה מתמזגת בצד האפי (A.ii) או הבסיסי (B.ii) (פאלואדין, ירוק). (C) הערכת כדאיות התא על קרום המשי (i-iv) בהשוואה לקרום PET מסחרי (v-viii) במרכז (i, ii, v, vi) ובפריפריה (iii, iv, vii, viii) של שכבת התא. תאים חיים מוצגים בירוק (i, iii, v, vii) ותאים מתים באדום (i, iii, v, vii) או לבן (ii, iv, vi, viii). הקו המקווקו מסמן את שלב החדרת הממברנה. (D) זום בפירוט, (i) ציון (חיצים לבנים) היצמדות תאים לקרום (phalloidin, לבן) ו-(ii) רשת צומת הדוקה שנוצרה לאחר 3 ימים בתרבית (ZO-1, לבן). פסי קנה מידה = 1 מ"מ (שורה עליונה: A,B), 100 מיקרומטר (שורה תחתונה: A,B,Ci, ii, v, vi), 500 מיקרומטר (C iii, iv, vii, viii), 50 מיקרומטר (D). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
טבלה 1: סקירה כללית של עבודות קודמות שבהן שולבו ממברנות בתוספות תרבית תאים. קיצורים: PCL = polycaprolactone; PEGDA = פולי (אתילן גליקול) דיאקרילט; PLGA = פולי(חומצה לקטית-קו-גליקולית); PDMS = Polydimethylsiloxane; PC = פוליקרבונט; RSS = חלבון משי עכביש רקומביננטי; PLCL = פולי(לקטיד-קו-קפרולקטון); RHSIF = רקומביננטי דג רפש רפש חלבוני נימה ביניים אנא לחץ כאן להורדת טבלה זו.
טבלה 2: סקירה כללית של עבודות קודמות המסכמות את סוגי התאים השונים שגודלו בתרבית על קרומי משי FN. FN-4repCT (FN-silk) היא גרסה קצרה של משי הדראגליין של Euprosthenops australis, אשר מיוצר באופן רקומביננטי ומתפקד עם מוטיב RGD מפיברונקטין ברמה גנטית. חלבון זה משמש בכל המקרים המסוכמים כאן. אנא לחץ כאן כדי להוריד טבלה זו.
טבלה 3: פתרון בעיות. אנא לחץ כאן כדי להוריד טבלה זו.
קובץ משלים 1: קובץ עיצוב ( .stl) להדפסת תלת מימד של התוספות. אנא לחץ כאן כדי להוריד קובץ זה.
קובץ משלים 2: פרוטוקול להדפסה, לאחר טיפול ועיקור בעת שימוש במדפסת ובשרף המפורטים בטבלת החומרים. אנא לחץ כאן כדי להוריד קובץ זה.
איור משלים S1: סכמטי של התבנית המוצעת לשימוש בעת הנחת תמיסת משי FN בלוח 48 בארות. אנא לחץ כאן כדי להוריד קובץ זה.
Discussion
הפרוטוקול המתואר כאן מתאר דרך פשוטה ליצור תוספות תרבית תאים רלוונטיות ביולוגית. זה מתחיל עם הדפסת התוספות, ואחריו היווצרות וחיבור של ממברנות משי FN, ומסתיים עם מראה כיצד תאים ניתן לזרוע הן בצד האפי והן בצד הבסיסי של הממברנה. יש צעד אחד קריטי באמת בפרוטוקול זה כדי להבטיח הצלחה ארוכת טווח עם תרביות תאים וזה הורדה והרמה של החדרות על הממברנה. ביצוע מוצלח של שלבים אלה יניב מערכת תרבית החדרת קרום משי המסוגלת לעמוד בתרבית תאים בדומה למערכות זמינות מסחריות עם ממברנות סינתטיות. כדי להבטיח זאת, הוטמעו מעקות מנחים בצידי התוספות שתוכננו בהתאמה אישית כדי למנוע את הנמכתם בזווית או הזזתם הצידה בבאר, מה שיוביל להידבקות לא אחידה של הממברנה, ליצירת נקודות תורפה וכתוצאה מכך לדליפה. זה נפוץ כי בעיות קלות להתעורר בעת ביצוע פרוטוקול בפעם הראשונה. כדי לסייע למשתמש החדש לעקוף אותן, אם הוא חווה אותן תוך כדי ביצוע הפרוטוקול שהוצג לעיל, תיארנו בעיות פוטנציאליות ופתרונן בטבלה 3.
הממברנה עצמה הוכחה כמועילה למידול רקמות מחסום שונות (סקירה בטבלה 2); עם זאת, יש לציין כי השרף המשמש להדפסת התוספות כאן לא נבדק בהרחבה על השפעתו על הכדאיות של סוגי תאים אחרים. למרות שלא נתקלנו בבעיות כאלה עד כה, ייתכן שהשרף עלול להשפיע לרעה על הכדאיות והגדילה של כמה תאים רגישים. לכן מומלץ לבצע בדיקת כדאיות דומה לזו המוצגת כאן כדי לוודא את התאמת השרף לכל סוג תא שנעשה בו שימוש. אם חווים ציטוטוקסיות, יש לקבוע פרוטוקול ריפוי ו/או שטיפה יסודי יותר כדי למנוע ממונומרים שלא נרפאו לזלוג החוצה לאורך זמן ולפגוע בתאים. דוגמה לפרוטוקול כזה, ששימש לשרף ששימש להדפסת התוספות בפרוטוקול זה, ניתן למצוא בקובץ משלים 2. פרוטוקול זה שימש בעבר להכנת תוספות לתרבית של אנדותל מוח bEnd.3 על קרומי משי למשך עד 8 ימים15.
היתרון העיקרי של השיטה המוצגת בעבודה זו הוא שהיא מציעה דרך פשוטה להחליף את קרומי הפלסטיק הנוכחיים בתוספות תרבית רקמה, וככזו, לשפר מודלים של תרביות רקמה סטטיות. המגבלה העיקרית היא שהמשתמש זקוק לגישה לציוד הדפסה תלת-ממדית או לרכוש זמן במתקן להדפסת התוספות שלהם. עם זאת, במידת הצורך, ניתן לעקוף זאת על ידי שימוש בתוספות תרבית רקמה מסחריות לאחר הסרת הממברנות שלהם. בנוסף, בעוד קרומי המשי, למעשה, יכולים לשמש כתוספות תרבית רקמה רגילות, הם דקים יותר ובעלי הרכב חלבוני, ולכן רגישים יותר ממקביליהם המסחריים הסינתטיים הנוכחיים. לפיכך, הם דורשים טיפול זהיר יותר על ידי המשתמשים ויש לשמור אותם רטובים כדי לשמור על גמישותם. יש לציין כי הממברנות יכולות לעמוד במתיחה ובאינפלציה16,17, מה שהופך אותן למתאימות, למשל, לחיקוי תנועת נשימה. למרות זאת, סביר להניח שמשתמשים חדשים ישברו חלק מהקרומים בשלבים הראשונים, אך ככל שחוויית הטיפול בקרום שלהם תגדל, שיעור ההצלחה צפוי לעלות. אם נותרו בעיות, על המשתמש לעיין בטבלה 3 לפתרון בעיות.
במהלך העשור האחרון הוצגו מספר חלופות לתוספות הפלסטיק המסחריות (טבלה 1), ובכל פעם שהשוו את ביצועי תרביות התא, הממברנות החדשות והרלוונטיות יותר מבחינה ביולוגית הניבו תוצאות טובות יותר ממקבילותיהן הפלסטיות המסחריות 2,5,6,7,14,22. זה נצפה בעיקר במונחים של תפקוד מחסום משופר 2,5,6,7,14,22, אבל גם בהיווצרות של צמיחת תאים ילידים יותר14 ואינטראקציות מוגברות דרך הממברנה במערכות תרבית משותפת 7 . מגמה זו נצפתה בעבר עבור קרומי משי FN בעת הקמת מודל דופן כלי הדם. במחקר זה, HDMEC ותאי שריר חלק (SMC) גודלו בצדדים מנוגדים של הממברנה. הוכח כי SMCs הפרישו ECM עבה יותר כאשר תרבית משותפת עם HDMEC על קרום משי FN בהשוואה לממברנות PET מסחריות. באופן דומה, HDMEC הקים מחסום הדוק יותר על קרום משי FN17. התוצאות המשופרות של תרביות התאים נובעות ככל הנראה משיפור התקשורת התאית ויותר מתנאי גידול דמויי vivo. קרום המשי FN מתקרב הרבה יותר ל- BM המקורי מבחינת עובי, מבנה ותכונות מכניות. ה-BM המקומי הוא בין 20 ננומטר ל-3 מיקרומטר22 דק, קרומי ה-PET 10 מיקרומטר, וקרומי המשי FN סביב 1 מיקרומטר, ולכן נופלים היטב בטווח הטבעי. המבנה של קרום משי FN הוא גם nanofibrillar16, בדיוק כמו BM22 המקורי, בעוד קרום PET מורכב פלסטיק עם נקבוביות חרוטות מסלול, בדרך כלל בין 0.4 מיקרומטר ל 8 מיקרומטר בקוטר7. קרומי ה-PET הם גם הרבה יותר קשיחים מה-BM, עם מודולוס של יאנג סביב 2 GPa, בהשוואה ל-BM שנע בין kPa ל-MPa, אך בדרך כלל מצוטט סביב 250-500 kPa22. לקרומי המשי FN יש מודולוס צעיר של 115 kPa16, אשר נופל בתנאים המקומיים. כמו כן יש לציין כי ברגע שתאים גדלים על הממברנה, כוחם הופך להיות הגורם הדומיננטי, ולא הממברנה עצמה17 . בסופו של דבר, יש לציין גם כי הפונקציונליות המשולבת של חלבון FN-משי מבטיחה כי התאים נצמדים ישירות לממברנה וככזה, ציפוי לא יהיה צורך. עבור ממברנות PET זה לעתים קרובות סטנדרטי לצפות עם חלבון ECM כדי להבטיח הידבקות תאים תקינה7.
כאשר משווים את קרום משי FN עם גישות אחרות המשמשות להחלפת קרום PET (סקירה בטבלה 1), היתרון העיקרי של השיטה שלנו הוא השימוש בחלבון משי פונקציונלי המיוצר באופן רקומביננטי. זה מבטיח יכולת רבייה ותנאי תרבית מוגדרים בניגוד לחומרים אחרים מבוססי חלבון, שמקורם מן החי כגון קולגן. שימו לב שוב שהתפקוד של החלבון מבטיח שאין צורך בציפויים מכיוון שהתאים נצמדים היטב לממברנות כפי שהוא17. יתר על כן, הייצור של ממברנות מבוססות משי המתוארות כאן מבוסס על הרכבה עצמית ואינו דורש התקנה מורכבת או שימוש בכימיקלים קשים, בניגוד לטכניקות רבות אחרות הנשענות, למשל, על אלקטרוספינינג. ההיצמדות הספונטנית של הממברנה לאינסרט גם מבטלת את הצורך בטיפול ידני הקשור לתוספות בשני חלקים, הדבקה וטבעות הרכבה מסיליקון, ובכך מפשטת את קנה המידה ומאפשרת שחזור קל בכל מעבדה. בנוסף לייצור קל, השיטה שלנו קלה להתאמה לצרכי הניסוי של המשתמש מכיוון שניתן להשתמש בחומרי החדרה שונים וניתן לכוונן את עובי הממברנה על ידי התאמת ריכוז המשי של התמיסה הראשונית16. לבסוף, פרוטוקול זה יכול להניב, למיטב ידיעתנו, את הממברנה העצמאית הדקה והדקה ביותר המחוברת לתוספת תרבית רקמה, ומאפשרת את הדמיון הקרוב ביותר לקרום המרתף המקומי.
פרוטוקול היווצרות וטיפול בקרום המשי המוצג כאן הוא פשוט לשימוש עבור כל מי שרגיל לעבוד עם תוספות תרבית רקמה במעבדה לתרביות תאים. זוהי דרך פשוטה לעבור מממברנות פלסטיק למקבילה דמוית in vivo, המאפשרת יצירת מודלים רלוונטיים יותר של רקמות באמצעות סוגים שונים של תאים (טבלה 2). קרומי המשי יכולים לתמוך בתרבית תאים בצדם האפי או הבסיסי וכן בתרביות משותפות של סוגי תאים שונים באופן דו-צדדי17. המודלים של רקמת המחסום שפותחו על קרומי המשי יכולים לשמש לאותו טווח יישומים כמו תוספות תרבית הרקמה, כולל בדיקות סקר של תרופות ומחקרי חלחול וזיהום. במקרים שבהם ההצלבה בין סוגי תאים שונים מעניינת, הוכח שהם עולים בביצועיהם על תוספות ה-TC בשל תכונותיהם הדומות יותר ל-in vivo 17.
Disclosures
ל.ג. עובדת ומ.ה. מחזיקה במניות של Spiber Technologies AB, החברה המייצרת את חלבון המשי FN.
Acknowledgements
המחברים רוצים להודות ל-Spiber Technologies AB על אספקת חלבון משי העכביש המתפקד הרקומביננטי ול-Eline Freeze על הדפסת חלק גדול מהתוספות המודפסות בתלת-ממד.
Materials
| Name | Company | Catalog Number | Comments |
| CHEMICALS | |||
| Alexa Fluor 488 | Invitrogen; Thermo Fisher Scientific | A-21121 | Goat anti-mouse, Dilution 1:500 |
| Alexa Fluor 488 Phalloidin | Invitrogen; Thermo Fisher Scientific | A12379 | Dilution 1:400 |
| anti-ZO-1 (1A12) antibody | Invitrogen; Thermo Fisher Scientific | 33-9100 | Mouse anti-human, Monoclonal, Dilution 1:200 |
| Dextran, Alexa Fluor 680; 3,000 MW, Anionic | Invitrogen; Thermo Fisher Scientific | D34681 | Diluted 2,5% (w/v) in 200 ul of culture medium |
| DMEM/F-12 | Gibco; Thermo Fisher Scientific | 31330095 | Supplemented with 5% v/v FBS and 1% v/v Penicillin-Streptomycin |
| Ethanol | Solveco | 1326 | 70% (CAS-no 64-17-5) |
| Fetal Bovine Serum, qualified, heat inactivated, United States | Gibco; Thermo Fisher Scientific | 16140071 | |
| FN-silk | Spiber technologies AB | Store at -80 °C | |
| Isopropanol, EMPARTA ACS analytical reagent | Supelco | 1096342511 | ≥99.5% (CAS-no 67-63-0) |
| Live/Dead Viability/Cytotoxicity Kit | Invitrogen; Thermo Fisher Scientific | L3224 | |
| PBS | Swedish Veterinary Agency / Statens veterinärmedicinska anstalt | 992420 | without Ca and Mg, filtered |
| Penicillin-Streptomycin (10,000 U/mL) | Gibco; Thermo Fisher Scientific | 11548876 | |
| MATERIAL | |||
| Dental LT Clear Resin | Denthouse | #DLCL-01 | |
| HaCaT cells | CLS | 300493 | |
| Nunc Cell-Culture Treated Multidishes 24-well | Fisher Scientific | 10604903 | |
| Nunc Cell-Culture Treated Multidishes 48-wel | Fisher Scientific | 10644901 | |
| TC insert, for 24-well plates, PET, transparent | Sarstedt | 83.3932.041 | pore size: 0.4 µm |
| ThinCert Cell Culture Inserts, translusent membrane (PET) | Greiner | 662640 | pore size: 0.4 µm |
| EQUIPMENT | |||
| EVOM meter with chopsticks | World Precision Instruments (WPI) Germany, GMBH | ||
| Form 3B | FormLabs | ||
| Form Wash | FormLabs | ||
| Form Cure | FormLabs | ||
| Isotemp General Purpose Deluxe Water Baths | Fisherbrand | ||
| Inverted fluorescence microscope Eclipse Ti | Nikon | ||
| Inverted fluorescence microscope DMI6000 B | Leica | ||
| Laminar flow hood Ninosafe, class II | Labolutions | ||
| Midi CO2 Incubator, 40 L | Thermo Scientific |
References
- Kumar, P., Kedaria, D., Mahapatra, C., Mohandas, M., Chatterjee, K. A designer cell culture insert with a nanofibrous membrane toward engineering an epithelial tissue model validated by cellular nanomechanics. Nanoscale Adv. 3 (16), 4714-4725 (2021).
- Wang, Y., et al. Ultrathin and handleable nanofibrous net as a novel biomimetic basement membrane material for endothelial barrier formation. Colloids Surf B Biointerfaces. 219, 112775 (2022).
- Jain, P., Rauer, S. B., Möller, M., Singh, S. Mimicking the natural basement membrane for advanced tissue engineering. Biomacromolecules. 23 (8), 3081-3103 (2022).
- Eom, S., Park, S. M., Han, S. J., Kim, J. W., Kim, D. S. One-step fabrication of a tunable nanofibrous well insert via electrolyte-assisted electrospinning. RSC Advances. 7 (61), 38300-38306 (2017).
- Kim, D., Eom, S., Park, S. M., Hong, H., Kim, D. S. A collagen gel-coated, aligned nanofiber membrane for enhanced endothelial barrier function. Sci Rep. 9 (1), 1-11 (2019).
- Ebrahim, N. A., et al. Porous honeycomb film membranes enhance endothelial barrier integrity in human vascular wall bilayer model compared to standard track-etched membranes. J Biomed Mater Res A. 111 (5), 701-713 (2023).
- Zakharova, M., et al. Transwell-integrated 2 µm thick transparent polydimethylsiloxane membranes with controlled pore sizes and distribution to model the blood-brain barrier. Advanced Materials Technologies. 6 (12), 2100138 (2021).
- Park, S., et al. Use of elastic, porous, and ultrathin co-culture membranes to control the endothelial barrier function via cell alignment. Advanced Functional Materials. 31 (9), 2008172 (2021).
- Youn, J., et al. Facile and adhesive-free method for bonding nanofiber membrane onto thermoplastic polystyrene substrate to fabricate 3D cell culture platforms. Materials Today Bio. 20, 100648 (2023).
- Liu, H., et al. Electrohydrodynamic jet-printed ultrathin polycaprolactone scaffolds mimicking Bruch’s membrane for retinal pigment epithelial tissue engineering. Int J Bioprint. 8 (3), 550 (2022).
- Dogan, A. A., Dufva, M. Customized 3D-printed stackable cell culture inserts tailored with bioactive membranes. Sci Rep. 12 (1), 1-12 (2022).
- Rohde, F., Danz, K., Jung, N., Wagner, S., Windbergs, M. Electrospun scaffolds as cell culture substrates for the cultivation of an in vitro blood–brain barrier model using human induced pluripotent stem cells. Pharmaceutics. 14 (6), 1308 (2022).
- Slater, S. C., et al. An in vitro model of the glomerular capillary wall using electrospun collagen nanofibres in a bioartificial composite basement membrane. PLoS ONE. 6 (6), e20802 (2011).
- Harris, T. I., et al. Utilizing recombinant spider silk proteins to develop a synthetic Bruch’s membrane for modeling the retinal pigment epithelium. ACS Biomater Sci Eng. 5 (8), 4023-4036 (2019).
- Hjelm, L. C., Hedhammar, M., Löfblom, J. In blood–brain barrier model based on recombinant spider silk protein nanomembranes for evaluation of transcytosis capability of biomolecules. Biochem Biophys Res Commun. 669, 77-84 (2023).
- Gustafsson, L., et al. Recombinant spider silk forms tough and elastic nanomembranes that are protein-permeable and support cell attachment and growth. Advanced Functional Materials. 30 (40), 2002982 (2020).
- Tasiopoulos, C. P., Gustafsson, L., Van Der Wijngaart, W., Hedhammar, M. Fibrillar nanomembranes of recombinant spider silk protein support cell co-culture in an in vitro blood vessel wall model. ACS Biomater Sci Eng. 7 (7), 3332-3339 (2021).
- Marino, A., Baronio, M., Buratti, U., Mele, E., Ciofani, G. Porous optically transparent cellulose acetate scaffolds for biomimetic blood-brain barrier in vitro models. Front Bioeng Biotechnol. 9, 630063 (2021).
- Schramm, R. A., Koslow, M. H., Nelson, D. A., Larsen, M., Castracane, J. A novel impedance biosensor for measurement of trans-epithelial resistance in cells cultured on nanofiber scaffolds. Biosensors. 7 (3), 35 (2017).
- Qi, D., et al. Establishment of a human iPSC- and nanofiber-based microphysiological blood-brain barrier system. ACS Appl Mater Interfaces. 10 (26), 21825-21835 (2018).
- Rickabaugh, E., Weatherston, D., Harris, T. I., Jones, J. A., Vargis, E. Engineering a biomimetic in vitro model of Bruch’s membrane using hagfish slime intermediate filament proteins. ACS Biomater Sci Eng. 9 (8), 5051-5061 (2023).
- Choi, J. W., Youn, J., Kim, D. S., Park, T. E. Human iPS-derived blood-brain barrier model exhibiting enhanced barrier properties empowered by engineered basement membrane. Biomaterials. 293, 121983 (2023).
- Widhe, M., Shalaly, N. D., Hedhammar, M. A fibronectin mimetic motif improves integrin mediated cell biding to recombinant spider silk matrices. Biomaterials. 74, 256-266 (2016).
- Johansson, U., et al. Assembly of functionalized silk together with cells to obtain proliferative 3D cultures integrated in a network of ECM-like microfibers. Sci Rep. 9 (1), 1-13 (2019).
- Widhe, M., Johansson, U., Hillerdahl, C. O., Hedhammar, M. Recombinant spider silk with cell binding motifs for specific adherence of cells. Biomaterials. 34 (33), 8223-8224 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved