In una reazione di precipitazione, le soluzioni acquose di sali solubili reagiscono per dare un composto ionico insolubile - il precipitato. La reazione si verifica quando ioni caricati in modo opposto in soluzione superano la loro attrazione per l'acqua e si legano l'uno all'altro, formando un precipitato che si separa dalla soluzione. Poiché tali reazioni comportano lo scambio di ioni tra composti ionici in soluzione acquosa, sono anche indicate come doppio spostamento, doppia sostituzione, reazioni di scambio o reazioni di metatesi (greco per "trasporre"). Una reazione di precipitazione è usata come tecnica di analisi per identificare gli ioni metallici in un composto e metodi gravimetrici per determinare la composizione della materia.
La misura in cui una sostanza può essere sciolta in acqua, o qualsiasi solvente, è espressa quantitativamente come la sua solubilità, definita come la concentrazione massima di una sostanza che può essere raggiunta in determinate condizioni. Si dice che le sostanze con solubilità relativamente grandi siano solubili. Una sostanza precipiterà quando le condizioni della soluzione sono tali che la sua concentrazione supera la sua solubilità. Si dice che le sostanze con solubilità relativamente basse siano insolubili, e queste sono le sostanze che precipitano prontamente dalla soluzione.
Ad esempio, la precipitazione si osserva quando si mescolano soluzioni di ioduro di potassio e nitrato di piombo, con conseguente formazione di ioduro di piombo solido:

Questa osservazione è coerente con le linee guida sulla solubilità: l'unico composto insolubile tra tutti gli interessati è lo ioduro di piombo, una delle eccezioni alla solubilità generale dei sali di ioduro.
L'equazione ionica netta che rappresenta questa reazione è:
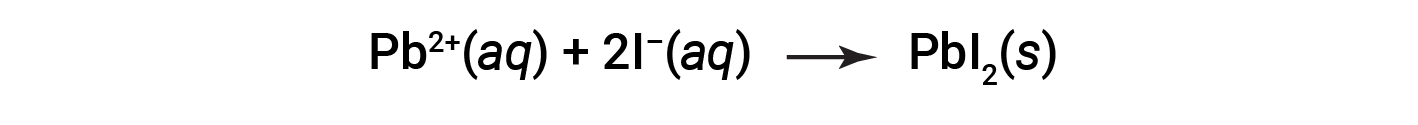
Le linee guida sulla solubilità possono essere utilizzate per prevedere se una reazione di precipitazione si verificherà quando le soluzioni di composti ionici solubili vengono mescolate insieme. È semplicemente necessario identificare tutti gli ioni presenti nella soluzione e quindi considerare se un possibile accoppiamento cation-anione potrebbe provocare un composto insolubile.
Ad esempio, le soluzioni di miscelazione di nitrato d'argento e fluoruro di sodio produrranno unasoluzionecontenente ioni Ag+, NO 3−, Na+e F −. A parte i due composti ionici originariamente presenti nelle soluzioni, AgNO3 e NaF, due composti ionici aggiuntivi possono essere derivati da questa raccolta di ioni: NaNO3 e AgF. Le linee guida sulla solubilità indicano che tutti i sali di nitrato sono solubili, ma che l'AgF è una delle eccezioni alla solubilità generale dei sali di fluoruro. Si prevede quindi che si verifichi una reazione di precipitazione, come descritto dalle seguenti equazioni:


Questo testo è adattato da OpenStax Chemistry 2e, Sezione 4.2: Classificare le reazioni chimiche.
Dal capitolo 4:

Now Playing
4.9 : Reazioni di precipitazione
Quantità chimiche e reazioni acquose
49.7K Visualizzazioni

4.1 : Stechiometria di reazione
Quantità chimiche e reazioni acquose
63.1K Visualizzazioni

4.2 : Reagente limitante
Quantità chimiche e reazioni acquose
56.0K Visualizzazioni

4.3 : Resa di reazione
Quantità chimiche e reazioni acquose
47.1K Visualizzazioni

4.4 : Proprietà generali delle soluzioni
Quantità chimiche e reazioni acquose
29.7K Visualizzazioni

4.5 : Concentrazione e diluizione della soluzione
Quantità chimiche e reazioni acquose
83.1K Visualizzazioni

4.6 : Soluzioni elettrolitiche e non elettrolitiche
Quantità chimiche e reazioni acquose
61.7K Visualizzazioni

4.7 : Solubilità dei composti ionici
Quantità chimiche e reazioni acquose
61.6K Visualizzazioni

4.8 : Reazioni chimiche in soluzioni acquose
Quantità chimiche e reazioni acquose
59.0K Visualizzazioni

4.10 : Reazioni di ossidazione-riduzione
Quantità chimiche e reazioni acquose
63.6K Visualizzazioni

4.11 : Numeri di ossidazione
Quantità chimiche e reazioni acquose
36.2K Visualizzazioni

4.12 : Acidi, basi e reazioni di neutralizzazione
Quantità chimiche e reazioni acquose
54.0K Visualizzazioni

4.13 : Reazioni di Sintesi e di decomposizione
Quantità chimiche e reazioni acquose
31.6K Visualizzazioni