Reazioni di ossidazione-riduzione
L'atmosfera terrestre contiene circa il 20% di ossigeno molecolare, O2, un gas chimicamente reattivo che svolge un ruolo essenziale nel metabolismo degli organismi aerobici e in molti processi ambientali che modellano il mondo. Il termine ossidazione è stato originariamente usato per descrivere reazioni chimiche che coinvolgono O2, ma il suo significato si è evoluto per riferirsi a una classe di reazione ampia e importante nota come reazioni di ossidazione-riduzione (redox).
Alcune reazioni redox comportano il trasferimento di elettroni tra specie reagenti per produrre prodotti ionici, come la reazione tra sodio e cloro per produrre cloruro di sodio:

È utile vedere il processo per quanto riguarda ogni singolo reagente, cioè rappresentare il destino di ogni reagente sotto forma di un'equazione chiamata semireazione:

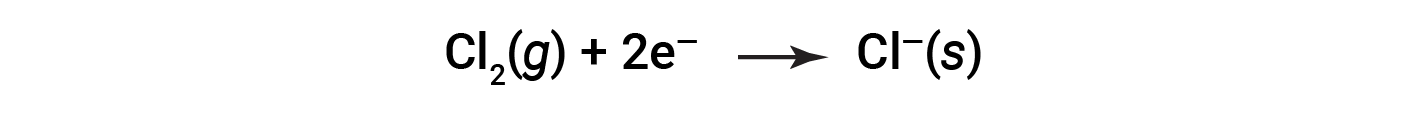
Queste equazioni mostrano che gli atomi di Na perdono elettroni mentre gli atomi di Cl (nella molecola cl2) guadagnano elettroni, i pedici "s" per gli ioni risultanti che significano che sono presenti sotto forma di un composto ionico solido. Per reazioni redox di questo tipo, la perdita e il guadagno degli elettroni definiscono i processi complementari che si verificano:
ossidazione = perdita di elettroni
riduzione = guadagno di elettroni
In questa reazione, il sodio viene ossidato e il cloro subisce una riduzione. Visto da una prospettiva più attiva, il sodio funziona come un agente riducente (riduttore), poiché fornisce elettroni al cloro (o lo riduce). Allo stesso modo, il cloro funziona come un agente ossidante (ossidante), in quanto rimuove efficacemente gli elettroni dal sodio (ossida).
agente riducente = specie ossidata
agente ossidante = specie ridotta
In generale, un agente ossidante ottiene un elettrone dall'agente riducente, e si riduce. La carica di un agente ossidante diventa più negativa. Allo stesso modo, un agente riducente perde un elettrone per l'agente ossidante, e si ossida. L'accusa di un agente riducente diventa più positiva.
Alcuni processi redox, tuttavia, non comportano il trasferimento di elettroni. Si consideri, ad esempio, una reazione simile a quella che produce NaCl:
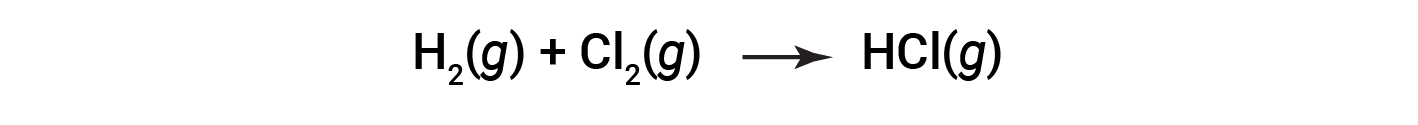
Il prodotto di questa reazione è un composto covalente, quindi il trasferimento di elettroni in senso esplicito non è coinvolto. Per chiarire la somiglianza di questa reazione con la precedente e permettere una definizione inequivocabile delle reazioni redox, è stata definita una proprietà chiamata numero di ossidazione.
Questo testo è adattato da Openstax, Chemistry 2e, Sezione 4.2: Classificare le reazioni chimiche.
Dal capitolo 4:

Now Playing
4.10 : Reazioni di ossidazione-riduzione
Quantità chimiche e reazioni acquose
63.6K Visualizzazioni

4.1 : Stechiometria di reazione
Quantità chimiche e reazioni acquose
63.0K Visualizzazioni

4.2 : Reagente limitante
Quantità chimiche e reazioni acquose
56.0K Visualizzazioni

4.3 : Resa di reazione
Quantità chimiche e reazioni acquose
47.0K Visualizzazioni

4.4 : Proprietà generali delle soluzioni
Quantità chimiche e reazioni acquose
29.7K Visualizzazioni

4.5 : Concentrazione e diluizione della soluzione
Quantità chimiche e reazioni acquose
83.0K Visualizzazioni

4.6 : Soluzioni elettrolitiche e non elettrolitiche
Quantità chimiche e reazioni acquose
61.6K Visualizzazioni

4.7 : Solubilità dei composti ionici
Quantità chimiche e reazioni acquose
61.6K Visualizzazioni

4.8 : Reazioni chimiche in soluzioni acquose
Quantità chimiche e reazioni acquose
59.0K Visualizzazioni

4.9 : Reazioni di precipitazione
Quantità chimiche e reazioni acquose
49.7K Visualizzazioni

4.11 : Numeri di ossidazione
Quantità chimiche e reazioni acquose
36.1K Visualizzazioni

4.12 : Acidi, basi e reazioni di neutralizzazione
Quantità chimiche e reazioni acquose
54.0K Visualizzazioni

4.13 : Reazioni di Sintesi e di decomposizione
Quantità chimiche e reazioni acquose
31.6K Visualizzazioni