Alcuni solidi possono passare direttamente allo stato gassoso, bypassando lo stato liquido, attraverso un processo noto come sublimazione. A temperatura ambiente e pressione standard, un pezzo di ghiaccio secco (CO2solida) sublima, apparendo gradualmente scomparire senza mai formare alcun liquido. Neve e ghiaccio sublimano a temperature inferiori al punto di fusione dell'acqua, un processo lento che può essere accelerato dai venti e dalle ridotte pressioni atmosferiche ad alta quota. Quando lo iodio solido viene riscaldato, si formano i sublimi solidi e un vivido vapore viola. Il rovescio della sublimazione è chiamato deposizione, un processo in cui le sostanze gassose si condensano direttamente allo stato solido, bypassando lo stato liquido. La formazione del gelo è un esempio di deposizione.
Come la vaporizzazione, il processo di sublimazione richiede un apporto di energia per superare le attrazioni intermolecolari. La sublimazione è, quindi, una transizione di fase endotermica. L'entalpia della sublimazione, ΔHsub, è l'energia necessaria per convertire una talpa di una sostanza dal solido allo stato gassoso. Ad esempio, la sublimazione dell'anidride carbonica è rappresentata da:

Allo stesso modo, il cambiamento di entalpia per il processo inverso di deposizione è uguale in grandezza ma opposto nel segno a quello per la sublimazione. Poiché la deposizione comporta la formazione di forze intermolecolari, è una transizione di fase esotermica.

Si consideri in che misura le attrazioni intermolecolari devono essere superate per ottenere una determinata transizione di fase. La conversione di un solido in un liquido richiede che queste attrazioni siano superate solo parzialmente; transizione allo stato gassoso richiede che siano completamente superati. Di conseguenza, l'entalpia di fusione per una sostanza è inferiore alla sua entalpia di vaporizzazione. Questa stessa logica può essere usata per derivare una relazione approssimativa tra gli entalpie di tutti i cambiamenti di fase per una data sostanza. Sebbene non sia una descrizione del tutto accurata, la sublimazione può essere convenientemente modellata come un processo sequenziale in due fasi di fusione seguito dalla vaporizzazione al fine di applicare la legge di Hess. Vista in questo modo, l'entalpia di sublimazione per una sostanza può essere stimata come la somma delle sue entalpie di fusione e vaporizzazione.
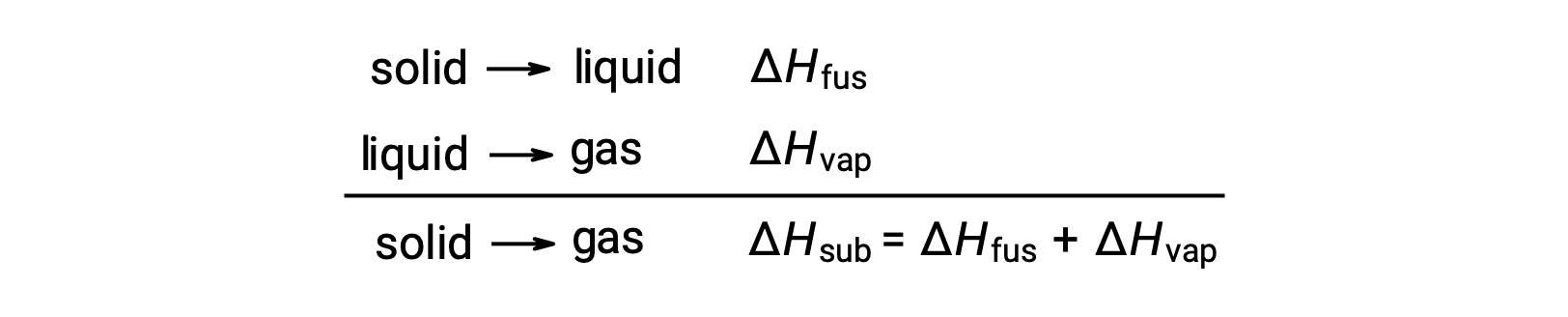
Questo testo è adattato da Openstax, Chemistry 2e, Sezione 10.3: Phase Transitions.
Dal capitolo 11:

Now Playing
11.11 : Transizioni di fase: sublimazione e deposizione
Liquidi, solidi e forze intermolecolari
16.4K Visualizzazioni

11.1 : Confronto molecolare di gas, liquidi e solidi
Liquidi, solidi e forze intermolecolari
39.7K Visualizzazioni

11.2 : Forze intermolecolari vs intramolecolari
Liquidi, solidi e forze intermolecolari
83.5K Visualizzazioni

11.3 : Forze intermolecolari
Liquidi, solidi e forze intermolecolari
54.9K Visualizzazioni

11.4 : Confronto delle forze intermolecolari: punto di fusione, punto di ebollizione e miscibilità
Liquidi, solidi e forze intermolecolari
43.2K Visualizzazioni

11.5 : Tensione superficiale, azione capillare e viscosità
Liquidi, solidi e forze intermolecolari
27.1K Visualizzazioni

11.6 : Transizioni di fase
Liquidi, solidi e forze intermolecolari
18.4K Visualizzazioni

11.7 : Transizioni di fase: vaporizzazione e condensazione
Liquidi, solidi e forze intermolecolari
16.8K Visualizzazioni

11.8 : Pressione del vapore
Liquidi, solidi e forze intermolecolari
33.6K Visualizzazioni

11.9 : Equazione di Clausius-Clapeyron
Liquidi, solidi e forze intermolecolari
54.5K Visualizzazioni

11.10 : Transizioni di fase: fusione e congelamento
Liquidi, solidi e forze intermolecolari
12.1K Visualizzazioni

11.12 : Curve di riscaldamento e raffreddamento
Liquidi, solidi e forze intermolecolari
21.7K Visualizzazioni

11.13 : Diagrammi di fase
Liquidi, solidi e forze intermolecolari
38.1K Visualizzazioni

11.14 : Strutture dei solidi
Liquidi, solidi e forze intermolecolari
13.3K Visualizzazioni

11.15 : Solidi molecolari e ionici
Liquidi, solidi e forze intermolecolari
16.3K Visualizzazioni
See More