Un diagramma di fase combina grafici di pressione rispetto alla temperatura per gli equilibri di transizione di fase liquido-gas, solido-liquido e gas solido di una sostanza. Questi diagrammi indicano gli stati fisici che esistono in specifiche condizioni di pressione e temperatura e forniscono anche la dipendenza dalla pressione delle temperature di transizione di fase (punti di fusione, punti di sublimazione, punti di ebollizione). Le regioni o le aree etichettate come solido, liquido e gas rappresentano singole fasi, mentre linee o curve rappresentano due fasi che coesistono in equilibrio (o punti di cambio fase). Il triplo punto indica le condizioni di pressione e temperatura in cui convivono tutte e tre le fasi. Al contrario, un punto critico indica la temperatura e la pressione al di sopra delle quali esiste una singola fase, le cui proprietà fisiche sono intermedie tra gli stati gassoso e liquido.
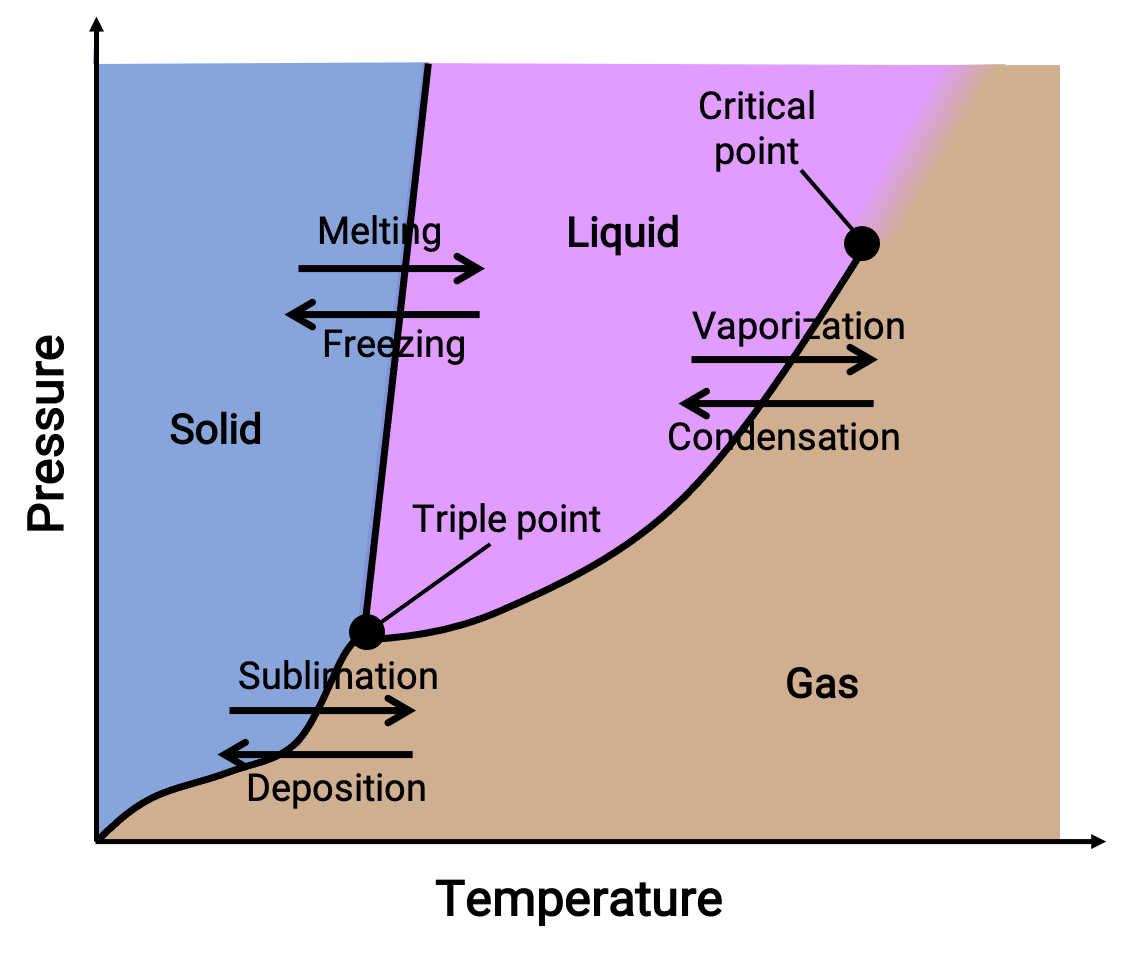
Figura 1. Tipico diagramma di fase.
Un diagramma di fase identifica lo stato fisico di una sostanza in determinate condizioni di pressione e temperatura. Per illustrare l'utilità di questi appezzamenti, si consideri il diagramma di fase dell'acqua, mostrato di seguito.
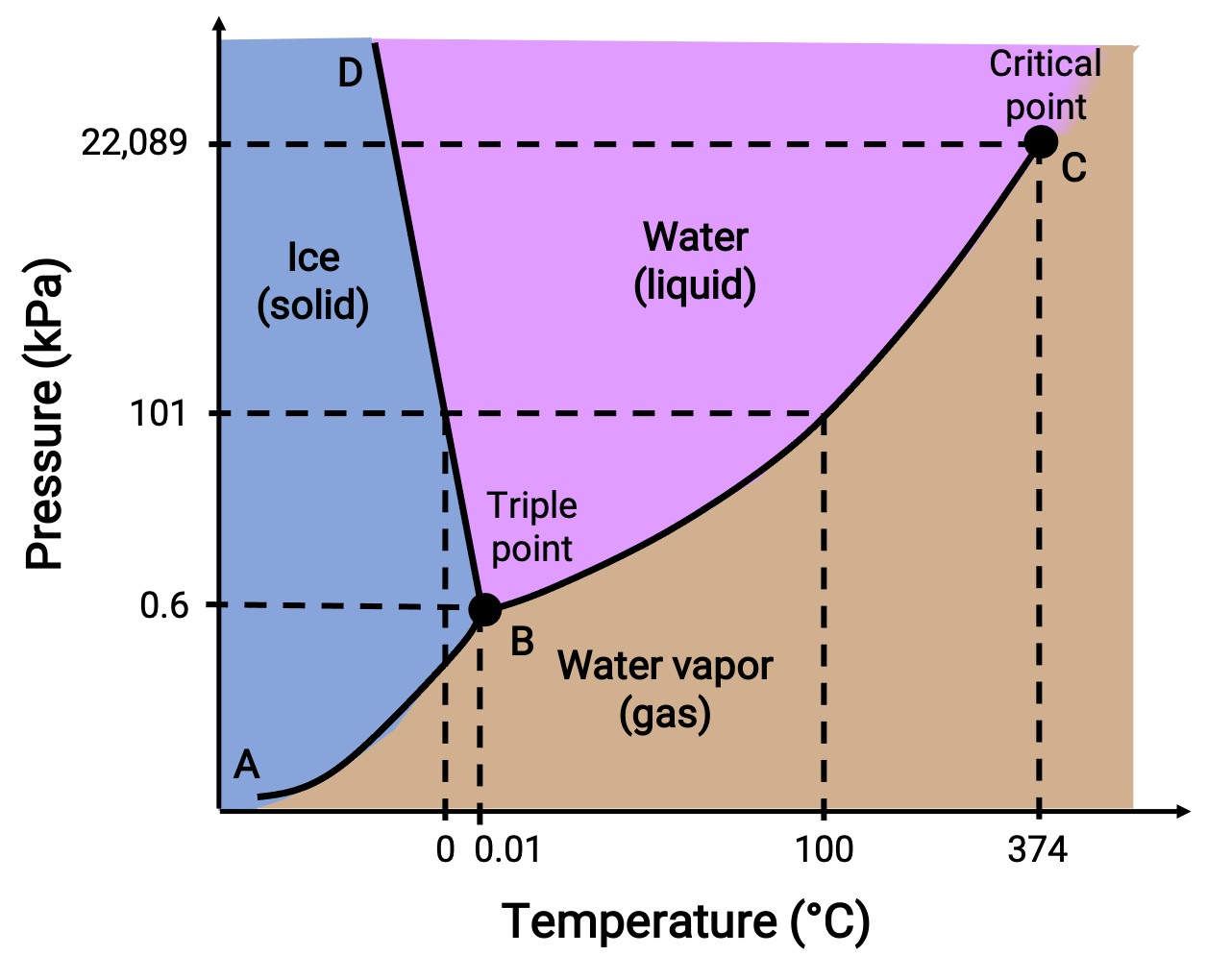
Figura 2. Diagramma di fase dell'acqua.
Una pressione di 50 kPa e una temperatura di −10 °C corrispondono alla regione del diagramma etichettata come "ghiaccio". In queste condizioni, l'acqua esiste solo come solido. Una pressione di 50 kPa e una temperatura di 50 °C corrispondono alla regione in cui l'acqua esiste solo come liquido. A 25 kPa e 200 °C, l'acqua esiste solo allo stato gassoso. La curva BC è la curva liquido-vapore che separa le regioni liquide e gassose del diagramma di fase e fornisce il punto di ebollizione per l'acqua a qualsiasi pressione. Ad esempio, a 1 atm, il punto di ebollizione è di 100 °C. Si noti che la curva liquido-vapore termina ad una temperatura di 374 °C e una pressione di 218 atm, indicando che l'acqua non può esistere come liquido al di sopra di questa temperatura, indipendentemente dalla pressione. Le proprietà fisiche dell'acqua in queste condizioni sono intermedie tra quelle delle sue fasi liquide e gassose. Questo stato unico della materia è chiamato fluido supercritico. La curva a vapore solido etichettata AB, indica le temperature e le pressioni a cui ghiaccio e vapore acqueo sono in equilibrio. Queste coppie di dati temperatura-pressione corrispondono ai punti di sublimazione, o deposizione, per l'acqua.
La curva solido-liquido etichettata BD mostra le temperature e le pressioni a cui ghiaccio e acqua liquida sono in equilibrio, rappresentando i punti di fusione /congelamento per l'acqua. Si noti che questa curva presenta una leggera pendenza negativa, indicando che il punto di fusione per l'acqua diminuisce leggermente all'aumentare della pressione. L'acqua è una sostanza insolita a questo proposito, poiché la maggior parte delle sostanze mostra un aumento del punto di fusione con una pressione crescente. Il punto di intersezione di tutte e tre le curve, etichettato B, è il triplo punto d'acqua, dove tutte e tre le fasi coesistono in equilibrio. A pressioni inferiori al punto triplo, l'acqua non può esistere come liquido, indipendentemente dalla temperatura.
Considera il diagramma di fase per l'anidride carbonica come un altro esempio.
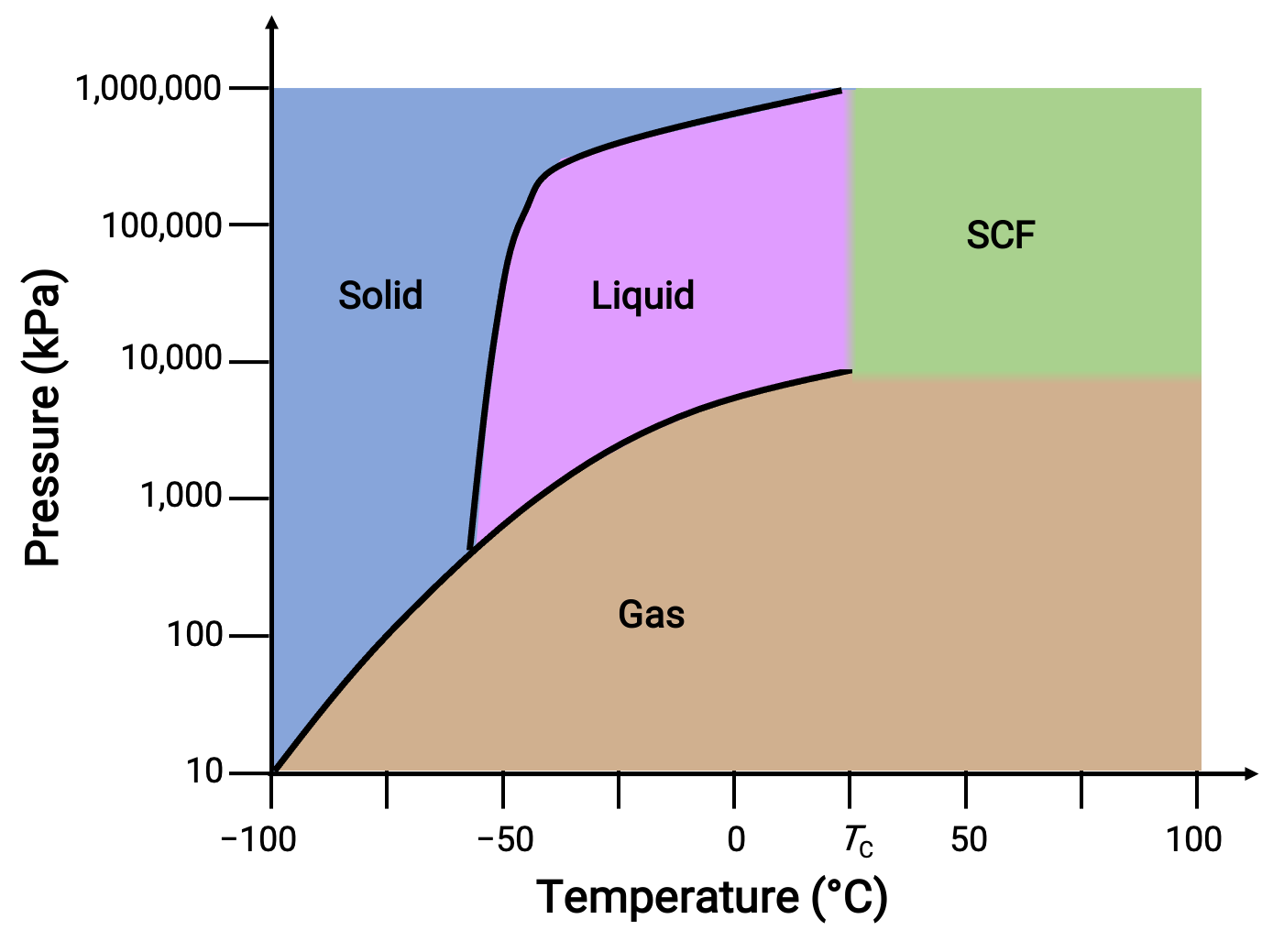
Figura 3. Diagramma di fase dell'anidride carbonica.
La curva solido-liquido mostra una pendenza positiva, indicando che il punto di fusione per CO2 aumenta con la pressione come per la maggior parte delle sostanze. Si noti che il punto triplo è ben al di sopra di 1 atm, indicando che l'anidride carbonica non può esistere come liquido in condizioni di pressione ambiente. Invece, il raffreddamento dell'anidride carbonica gassosa a 1 atm provoca la sua deposizione nello stato solido. Allo stesso modo, l'anidride carbonica solida non si scioglie a 1 atm di pressione, ma sublima per produrre CO2 gassosa. Infine, il punto critico per l'anidride carbonica si osserva a una temperatura e una pressione relativamente modeste rispetto all'acqua.
Questo testo è adattato da Openstax, Chimica 2e, Sezione 10.4: Diagrammi di fase.
Dal capitolo 11:

Now Playing
11.13 : Diagrammi di fase
Liquidi, solidi e forze intermolecolari
38.1K Visualizzazioni

11.1 : Confronto molecolare di gas, liquidi e solidi
Liquidi, solidi e forze intermolecolari
39.7K Visualizzazioni

11.2 : Forze intermolecolari vs intramolecolari
Liquidi, solidi e forze intermolecolari
83.5K Visualizzazioni

11.3 : Forze intermolecolari
Liquidi, solidi e forze intermolecolari
54.9K Visualizzazioni

11.4 : Confronto delle forze intermolecolari: punto di fusione, punto di ebollizione e miscibilità
Liquidi, solidi e forze intermolecolari
43.3K Visualizzazioni

11.5 : Tensione superficiale, azione capillare e viscosità
Liquidi, solidi e forze intermolecolari
27.1K Visualizzazioni

11.6 : Transizioni di fase
Liquidi, solidi e forze intermolecolari
18.4K Visualizzazioni

11.7 : Transizioni di fase: vaporizzazione e condensazione
Liquidi, solidi e forze intermolecolari
16.8K Visualizzazioni

11.8 : Pressione del vapore
Liquidi, solidi e forze intermolecolari
33.7K Visualizzazioni

11.9 : Equazione di Clausius-Clapeyron
Liquidi, solidi e forze intermolecolari
54.6K Visualizzazioni

11.10 : Transizioni di fase: fusione e congelamento
Liquidi, solidi e forze intermolecolari
12.1K Visualizzazioni

11.11 : Transizioni di fase: sublimazione e deposizione
Liquidi, solidi e forze intermolecolari
16.4K Visualizzazioni

11.12 : Curve di riscaldamento e raffreddamento
Liquidi, solidi e forze intermolecolari
21.8K Visualizzazioni

11.14 : Strutture dei solidi
Liquidi, solidi e forze intermolecolari
13.3K Visualizzazioni

11.15 : Solidi molecolari e ionici
Liquidi, solidi e forze intermolecolari
16.3K Visualizzazioni
See More