L'elettrochimica è la scienza coinvolta nell'interconversione delle reazioni elettriche e chimiche. Tali reazioni sono chiamate riduzione-ossidazione, o reazioni redox. Queste importanti reazioni sono definite da cambiamenti negli stati di ossidazione per uno o più elementi reagenti e includono un sottoinsieme di reazioni che coinvolgono il trasferimento di elettroni tra specie reagenti. L'elettrochimica come campo si è evoluta per fornire sufficienti approfondimenti sui principi fondamentali della chimica redox e su più tecnologie che vanno dai processi metallurgici su scala industriale alle batterie robuste e ricaricabili per veicoli elettrici. Poiché le reazioni che coinvolgono il trasferimento di elettroni sono essenziali per lo studio dell'elettrochimica, una breve revisione della chimica redox include quanto segue.
Numeri di ossidazione
Per definizione, una reazione redox comporta un cambiamento nel numero di ossidazione o nello stato di ossidazione per uno o più reagenti. Il numero di ossidazione di un elemento è una valutazione di come l'ambiente elettronico dei suoi atomi differisce rispetto agli atomi dell'elemento puro. Con questa definizione, un atomo in un elemento porta un numero di ossidazione pari a zero. Per un atomo, il numero di ossidazione è uguale alla carica dell'atomo nel composto se il composto fosse ionico. Quindi, la somma dei numeri di ossidazione per tutti gli atomi in una molecola è uguale alla carica della molecola.
Composti ionici
I composti ionici semplici sono gli esempi più semplici di questo formalismo poiché gli elementi hanno numeri di ossidazione uguali alle loro cariche ioniche. Il cloruro di sodio, NaCl, è composto da Na+ zioni e Cl− anioni, con numeri di ossidazione per sodio e cloro rispettivamente +1 e −1. Il fluoruro di calcio, CaF2, è composto da ca2+ cateazioni e F− anioni, con numeri di ossidazione per calcio e fluoro, +2 e −1.
Composti covalenti
I composti covalenti sono più impegnativi nell'uso del formalismo. L'acqua è un composto covalente costituito da due atomi H legati ad un atomo O attraverso legami polari covalenti O−H. Gli elettroni condivisi che fanno un legame O−H sono più fortemente attratti dall'atomo O più elettronegativo. Quindi l'ossigeno acquisisce una carica negativa parziale, rispetto a un atomo O nell'ossigeno elementale. Di conseguenza, gli atomi H in una molecola d'acqua mostrano una carica positiva parziale rispetto agli atomi di idrogeno nel gas idrogeno. La somma delle cariche parziali negative e positive per ogni molecola d'acqua è zero, rendendo neutra la molecola d'acqua.
Se la polarizzazione degli elettroni condivisi all'interno dei legami O−H dell'acqua fosse completa — il risultato sarebbe il completo trasferimento di elettroni da H a O, e l'acqua sarebbe un composto ionico composto da O2− anioni e H+ formazioni. E così, i numeri di ossidazione per ossigeno e idrogeno nell'acqua sono rispettivamente -2 e +1. Applicando questa stessa logica al tetracloruro di carbonio, CCl4, produce numeri di ossidazione di +4 per il carbonio e -1 per il cloro. Nello ione nitrato, NO3−, il numero di ossidazione per l'azoto è +5 e che per l'ossigeno è −2, sommando per uguale alla carica −1 sulla molecola:
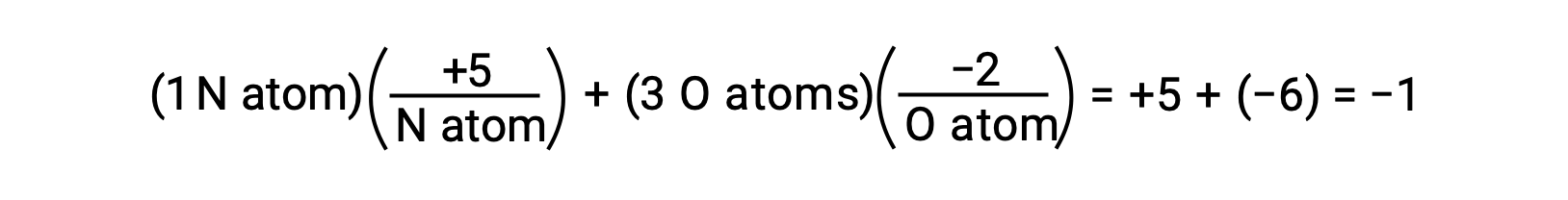
Bilanciamento delle equazioni Redox
L'equazione sbilanciata mostrata di seguito descrive la decomposizione del cloruro di sodio:
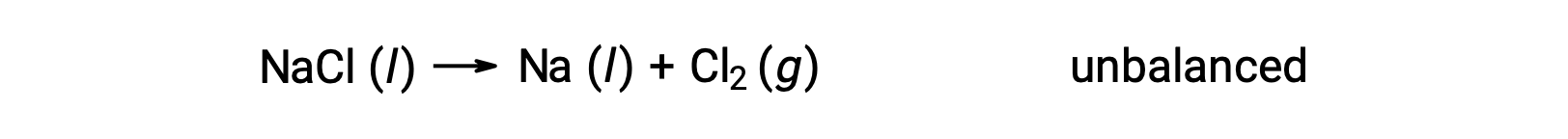
Questa reazione corrisponde al criterio per una reazione redox, poiché il numero di ossidazione per Na diminuisce da +1 a 0 (mediante riduzione)e quello per Cl aumenta da −1 a 0 (subendo ossidazione). Il caso dell'equazione è facilmente bilanciabile aggiungendo il coefficiente stechiometrico di 2 per il NaCl e Na:
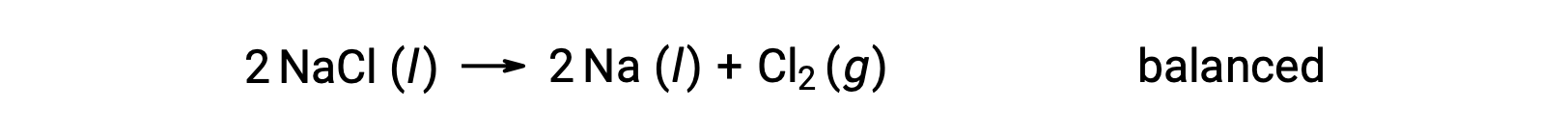
Le reazioni redox che si verificano in soluzioni acquose si incontrano comunemente nell'elettrochimica, e molte coinvolgono l'acqua o i suoi ioni, H+ (aq) e OH− (aq), sia come reagenti che come prodotti.
In questi casi, le equazioni che rappresentano reazioni redox possono essere molto difficili da bilanciare semplicemente mediante ispezione, e l'uso di un approccio sistematico noto come metodo di semireazione è utile. Questo approccio prevede i seguenti passaggi:
- Dividere l'equazione nella sua componente scheletro ossidazione e riduzione semi-reazioni.
- Bilanciare ogni semireazione per tutti gli elementi diversi da O e H.
- Bilanciare ogni semireazione per gli atomi O aggiungendo molecole d'acqua secondo necessità nell'equazione.
- Bilanciare ogni semireazione per gli atomi H aggiungendo protoni come richiesto per l'equazione.
- Infine, bilanciare le cariche sugli elementi aggiungendo elettroni in base alle esigenze.
- Moltiplicare le semireazioni per ogni intero necessario per equalizzare il numero di elettroni persi nella semireazione di ossidazione al numero di elettroni guadagnati nella semireazione di riduzione.
- Aggiungi entrambe le mezze reazioni e semplificalo ulteriormente annullando le specie comuni su entrambi i lati dell'equazione.
- Se la reazione si verifica in un mezzo alcalino, aggiungere oh− ioni all'equazione ottenuta nel passaggio 7 per neutralizzare i protoni (aggiunti in numero uguale a entrambi i lati dell'equazione) e semplificare.
- Controllare l'equazione per assicurarsi che le cariche sugli atomi siano bilanciate.
Questo testo è adattato da Openstax, Chemistry 2e, Chapter 17: Introduction, and Openstax, Chemistry 2e, Section17.2: Review of Redox Chemistry.
