Reazioni chimiche spontanee
Le reazioni spontanee di redox si verificano abbondantemente in natura. La reazione chimica che si verifica in una batteria AA usa e getta che alimenta i nostri telecomandi è uno di questi esempi di reazione redox spontanea. Un altro esempio è l'immersione del filo di rame arrotolato in una soluzione acquosa di nitrato d'argento. La reazione mostra un graduale, visivamente impressionante cambiamento di colore da incolore a blu brillante e la formazione di un precipitato grigio sul filo di rame. In questo esperimento, il rame subisce l'ossidazione per formare ioni cupri, che rende la soluzione blu, mentre gli ioni d'argento sono ridotti a formare un precipitato d'argento sul filo.
La reazione può essere riassunta come segue:
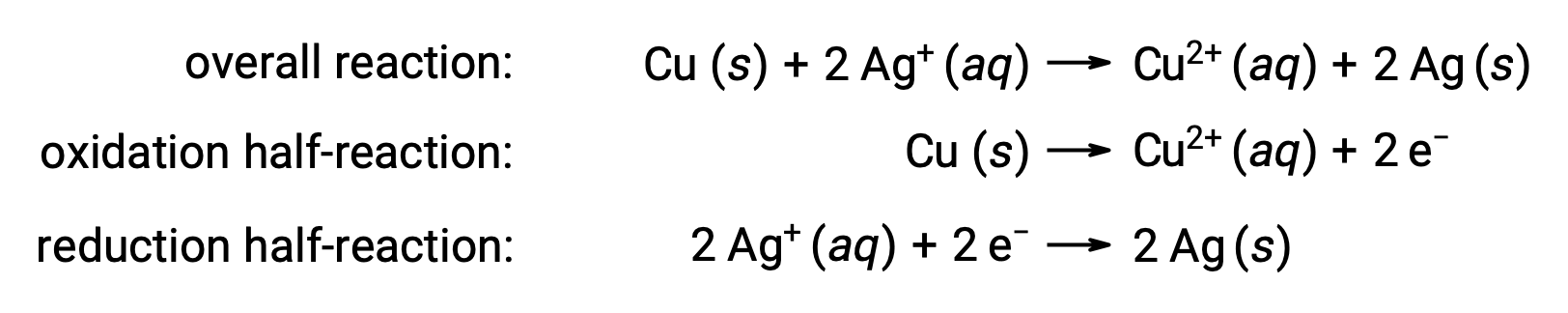
Qui, c'è un trasferimento diretto e spontaneo di elettroni dal filo di rame agli ioni d'argento acquosi.
Celle elettrochimiche e cellule galvaniche
Supponiamo che un dispositivo contenga tutti i reagenti e i prodotti di un sistema redox ma prevenga il contatto fisico tra i reagenti. Pertanto, il trasferimento diretto di elettroni è impedito; avviene invece indirettamente attraverso un circuito esterno che contatta i reagenti separati. Dispositivi di questo tipo sono generalmente indicati come celle elettrochimiche.
Una cella elettrochimica è uno strumento in cui una corrente elettrica è generata da una reazione redox senza contatto diretto tra gli atomi che reagiscono. Le cellule elettrochimiche in cui viene creata una corrente a causa di una reazione spontanea redox sono note come cellule galvaniche o voltaiche (dal nome di Luigi Galvani e Alessandro Volta).
Componenti di una cella galvanica
Una cellula galvanica basata sulla reazione spontanea tra rame e argento(I) è raffigurata nella figura 1. Una tipica cellula galvanica è costituita da due mezze cellule, ognuna contenente una coppia coniugata redox, o coppia, di un singolo reagente. La mezza cella a sinistra contiene la coppia Cu(0)/Cu(II) sotto forma di un foglio di rame solido e una soluzione acquosa di nitrato di rame. La mezza cella destra contiene la coppia Ag(I)/Ag(0) come lamina d'argento massiccio e una soluzione acquosa di nitrato d'argento. Un circuito esterno è collegato a ogni mezza cella nella sua lamina solida, il che significa che la lamina Cu e Ag funzionano come un elettrodo. La reazione avviene all'interfaccia tra ogni miscela di reazione a mezza cella e il rispettivo elettrodo. L'anodo è l'elettrodo in cui si verifica l'ossidazione e porta una carica negativa, mentre il catodo è l'elettrodo in cui si verifica la riduzione e porta una carica positiva.
Le due mezze cellule sono collegate da un ponte di sale, che è un tubo a U rovesciato contenente un gel o una pasta di un elettrolita inerte come cloruro di potassio o nitrato di ammonio. Il ponte di sale aiuta a mantenere separate le miscele di reazione garantendo al contempo il bilanciamento della carica della reazione. La reazione spontanea in questa cellula produce formazioni cu2+ nella mezza cellula anodo e consuma ioni Ag+ nella mezza cellula catodica, risultando in un flusso compensativo di ioni inerti dal ponte di sale che mantiene il bilanciamento della carica. Il ponte di sale fornisce un flusso di ioni inerti, assicurando che la reazione continui neutralizzando l'accumulo di ioni positivi e negativi all'anodo e al catodo. Quindi, l'aumento delle concentrazioni di Cu2+ nella mezza cellula anodo è bilanciato da un afflusso di NO3− dal ponte salato, mentre un flusso di Na+ nella mezza cellula catodica compensa la diminuzione della concentrazione Ag+ .
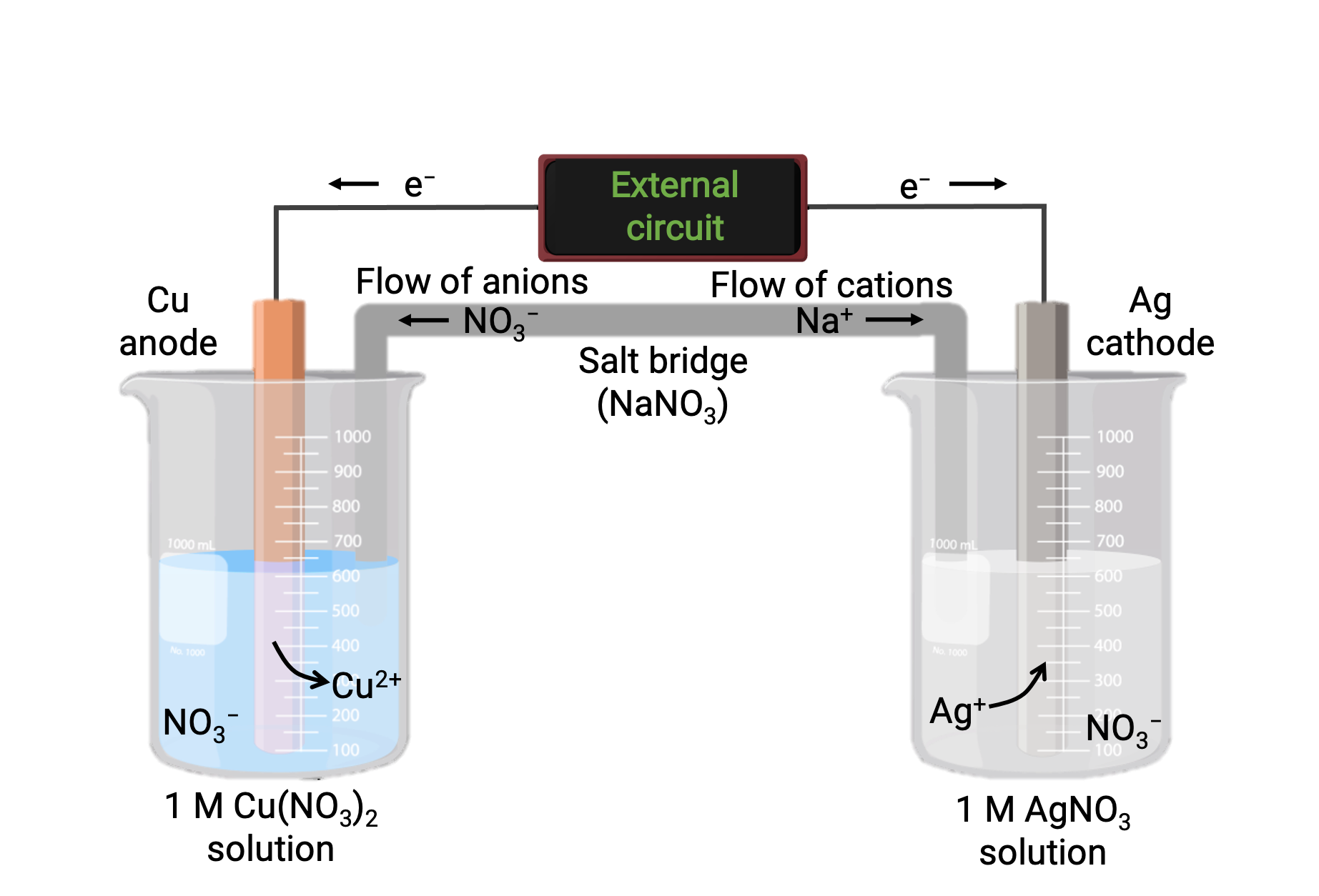
Figura 1: Una cellula galvanica basata sulla reazione spontanea tra ioni rame e argento(I).
Rappresentazione di una cella galvanica mediante schemi cellulari o notazioni cellulari
La cella galvanica è rappresentata simbolicamente usando schemi cellulari o notazioni cellulari.
• Negli schemi delle celle, tutte le interfacce tra le fasi dei componenti sono rappresentate da linee parallele verticali.
• Se nella stessa fase esistono due o più componenti, questi vengono separati nella rappresentazione utilizzando virgole.
• L'anodo è rappresentato a sinistra dello schema e il catodo a destra.
• Una doppia linea verticale indica un ponte di sale o una partizione porosa tra le due mezze reazioni.
• Per convenzione, lo schema inizia con l'anodo e procede da sinistra a destra, identificando le fasi e le interfacce incontrate all'interno della cellula, terminando con il catodo.
Ad esempio, la cella galvanica di cui sopra è costituita da un anodo di rame solido immerso in un nitrato acquoso di rame(II) collegato tramite un ponte di sale a una soluzione acquosa di nitrato d'argento(I) immersa in un catodo d'argento solido. La conversione di questa istruzione in simbolismo seguendo le linee guida precedenti comporta lo schema della cella:
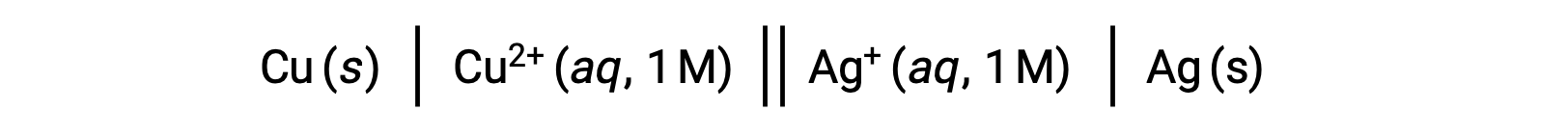
Questo testo è adattato da Openstax, Chemistry 2e,17.2 Galvanic Cells.