Termodinamica di una reazione Redox
La termodinamica è la branca della fisica che si occupa della relazione tra calore e altre forme di energia. In una cella elettrochimica, l'energia chimica viene convertita in energia elettrica.
Quindi, si può prevedere un legame tra il potenziale cellulare, il cambiamento di energia libera e la costante di equilibrio per la reazione. Il potenziale cellulare può anche essere misurato come ossidante o forza riducente, e simili misure di forza acido-base si riflettono nelle costanti di equilibrio.
L'energia libera di Gibbs e la relazione tra la cellula E° e ΔG°
L'energia libera di Gibbs è una quantità utilizzata per calcolare la quantità massima di lavoro reversibile eseguito da un sistema termodinamico mantenuto a temperatura e pressione costanti. È indicato con il simbolo Ge il suo cambiamento è rappresentato come ∆G. Il cambio di energia libera standard di un sistema, ΔG°, è definito come il lavoro massimo eseguito da un sistema, wmax. Per una reazione redox che si verifica all'interno di una cella galvanica in condizioni standard, tutto il lavoro svolto è associato al trasferimento di elettroni dall'agente riducente all'agenteossidante, w elec. Così
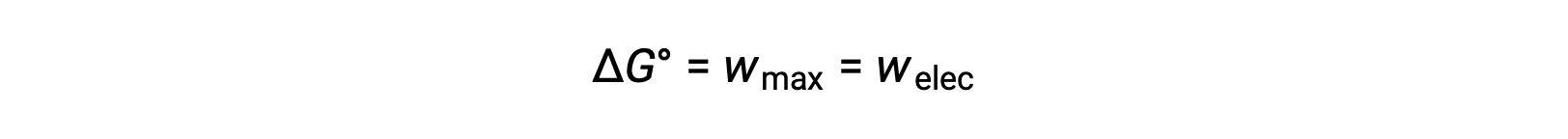
Tuttavia, qualsiasi lavoro associato al trasferimento di elettroni dipende dalla carica trasferita in Coulombs così come dal potenziale cellulare:
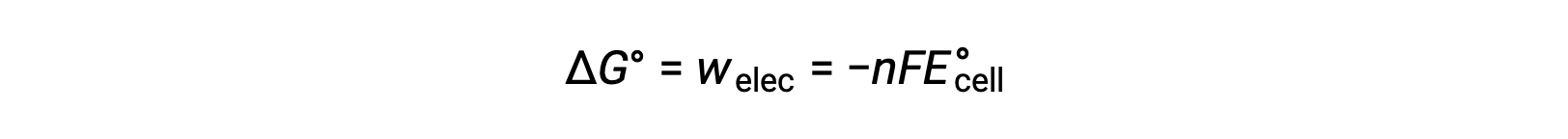
dove n = il numero di talpe di elettroni trasferiti, F è la costante di Faraday, che rappresenta la carica coulombica di 1 talpa di elettroni, e la cellula E°è il potenziale cellulare standard. La relazione tra la cella ΔG° e ΔE°conferma le convenzioni dei segni e i criteri per la spontaneità della reazione. Le reazioni redox spontanee hanno un potenziale positivo e valori negativi di energia libera.
Relazione tra cellula E°e K
Il cambiamento di energia libera standard ΔG° è correlato alla costante di equilibrio K di una reazione redox come segue:
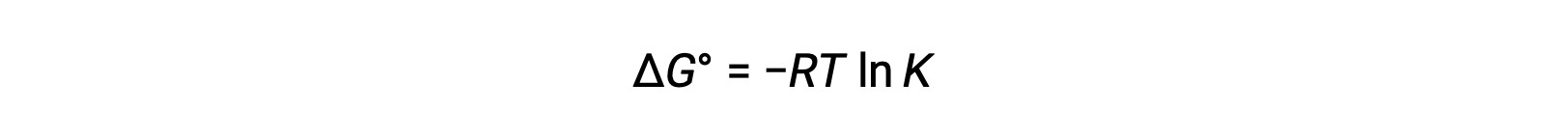
Combinando una relazione precedentemente derivata tra ΔG° e K e l'equazione relativa alla cella ΔG° ed E°si ottiene quanto segue:
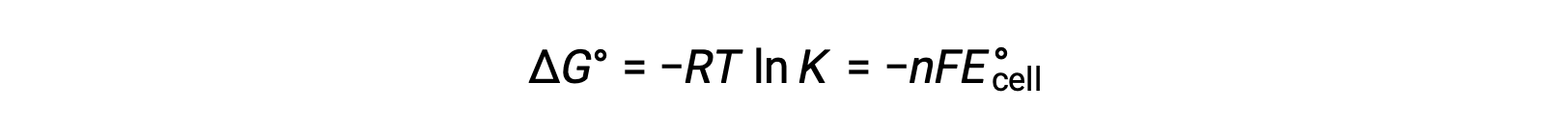
Quindi
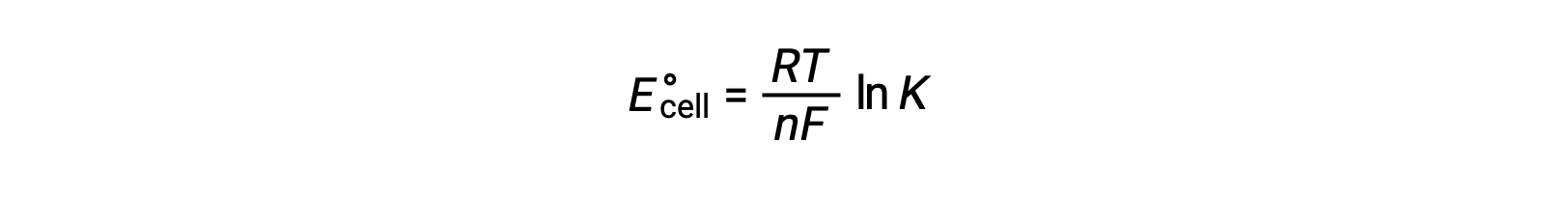
Questa equazione indica che le reazioni redox con grandi o positivi potenziali cellulari standard procederanno verso il completamento, raggiungendo l'equilibrio quando la maggior parte dei reagenti sono stati convertiti in prodotto.
Reazioni o reazioni nonpontanee che procedono in direzioni invertite mostrano potenziali cellulari negativi, valori energetici liberi positivi e una costante di equilibrio inferiore a uno. Una costante di equilibrio di uno e del potenziale cellulare e valori di energia libera pari a zero è associata ad una reazione in equilibrio in condizioni standard.
La relazione tra il potenziale cellulare in condizioni standard e le costanti termodinamiche ΔG° e K può essere spiegata dalla figura riportata di seguito:
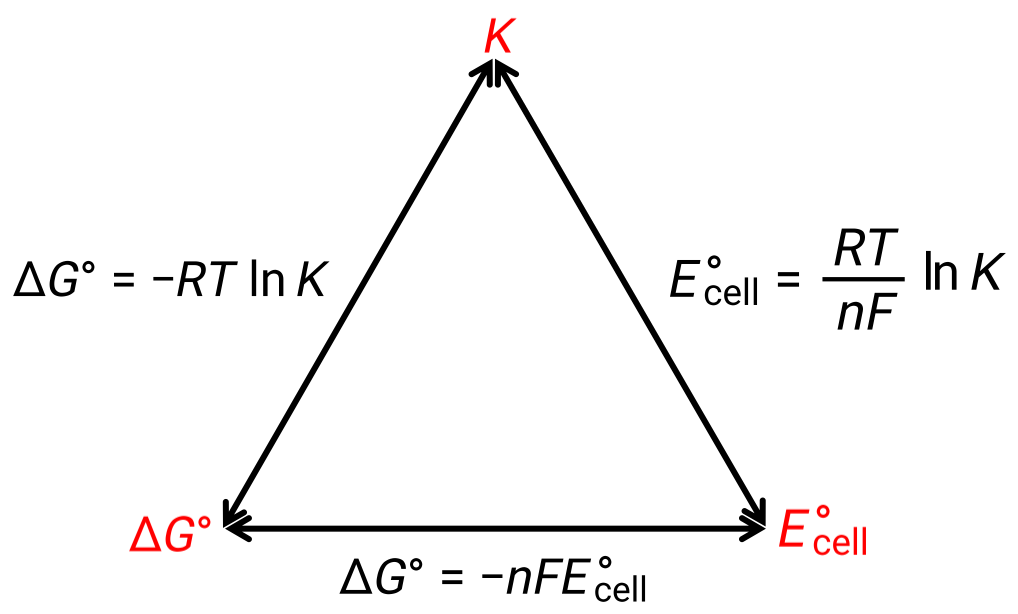
Figura 1: Grafico raffigurante la relazione tra tre importanti proprietà termodinamiche.
Questo testo è adattato da Openstax, Chimica 2e, Sezione 17.4: Potenziale, Energia Libera ed Equilibrio.