Una cella di concentrazione è un tipo di cellula voltaica costruita collegando due mezze cellule quasi identiche, entrambe basate sulla stessa semireazione e usando lo stesso elettrodo, che differiscono solo nella concentrazione di una specie redox. Il potenziale di una cellula di concentrazione, quindi, è determinato solo dalla differenza di concentrazione della particolare specie redox.
Si consideri la seguente cella voltaica:
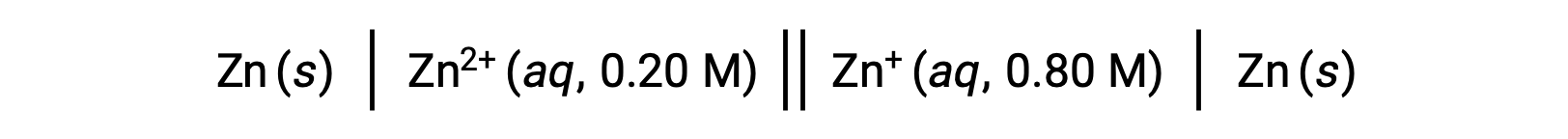
Dalle informazioni fornite, il potenziale cellulare di questa cella di concentrazione può essere calcolato usando l'equazione di Nernst:

Sostituendosi nell'equazione di Nernst,
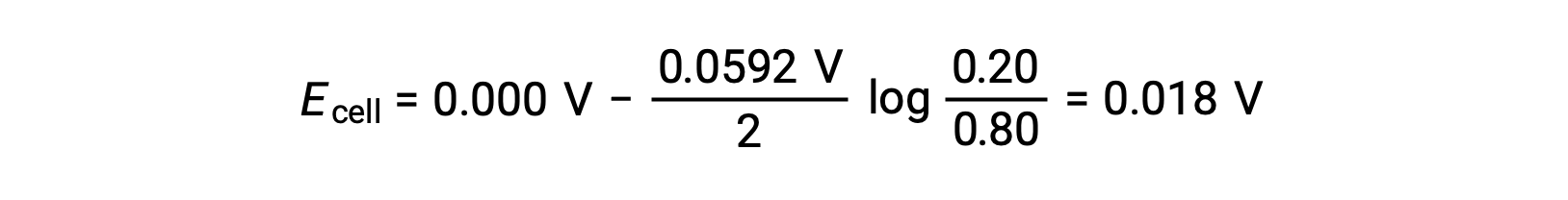
Il valore positivo del potenziale cellulare indica che la reazione cellulare complessiva è spontanea. Questa reazione spontanea si verifica quando la concentrazione di ioni di zinco nel catodo cade (per riduzione allo zinco elementale) mentre quella nell'anodo aumenta (per ossidazione dell'anodo di zinco in ioni di zinco). Una maggiore forza motrice per la riduzione dello zinco è presente nel catodo, dove la concentrazione di ioni Zn2+ è maggiore(Ecatodo > Eanodo).
i misuratori di pH in laboratorio, i canali ionici nelle membrane cellulari nervose e le cellule muscolari cardiache nel corpo umano lavorano sul principio delle cellule di concentrazione.
Questo testo è adattato da Openstax,Chimica 2e, Capitolo 17.4: Potenziale, Energia Libera ed Equilibrio.